Method Article
Ensaio de imagem quantitativa in vitro para fagocitose de células de neuroblastoma morto por iPSC-Macrófagos
Neste Artigo
Resumo
Doenças neurodegenerativas estão associadas a funções de microglia disreguladas. Este artigo descreve um ensaio in vitro de fagocitose de células neuroblastoma por macrófagos iPSC. As leituras quantitativas de microscopia são descritas tanto para imagens de lapso de tempo de células vivas quanto para imagens de alto conteúdo de células fixas.
Resumo
Microglia orquestra respostas neuroimunes em várias doenças neurodegenerativas, incluindo doença de Parkinson e doença de Alzheimer. Microglia limpa neurônios mortos e moribundos através do processo de eferócitose, uma forma especializada de fagocitose. A função fagocitose pode ser interrompida por fatores de risco ambientais ou genéticos que afetam a microglia. Este artigo apresenta um protocolo de microscopia in vitro rápido e simples para o estudo da equecriose microglial em um modelo de microglia (célula-tronco pluripotente) induzida, utilizando uma linha celular neuroblastoma humana (SH-SY5Y) rotulada com um corante sensível ao pH para a carga fagocítica. O procedimento resulta em um alto rendimento de células neuroblastoma mortas, que exibem fosfartidylserina superficial, reconhecida como um sinal de "comer-me" por fagocitos. O ensaio de placa de 96 poços é adequado para imagens de lapso de tempo de células vivas, ou a placa pode ser corrigida com sucesso antes de processamento adicional e quantificada por microscopia de alto conteúdo. A microscopia de alto teor de células fixas permite que o ensaio seja dimensionado para triagem de inibidores de pequenas moléculas ou avaliando a função fagocítica das linhas iPSC da variante genética. Embora este ensaio tenha sido desenvolvido para estudar fagocitose de células de neuroblastoma mortas por macrófagos iPSC, o ensaio pode ser facilmente adaptado para outras cargas relevantes para doenças neurodegenerativas, como sinapstos e mielina, e outros tipos de células fagocíticas.
Introdução
Microglia são macrófagos residentes em tecido cerebral, e suas funções incluem vigilância imunológica, coordenação de respostas inflamatórias a lesões/infecções, remodelação sináptica e fagocitose de células mortas, mielina, agregados de proteínas e patógenos. A fagocitose é o processo pelo qual a microglia reconhece a carga com receptores superficiais e reorganiza seu citoesqueleto para engolir o objeto em um fagosome, que então se funde com lisosomos para degradação da carga. Microglia saudável fagocytose células cerebrais apoptóticas para removê-las antes de se tornarem necrosas1. A fagocitose das células apoptóticas também é conhecida como eferocisose, e requer a exibição de um sinal de fosfatidídeserina "comer-me" pela célulamoribunda 2. Numerosos receptores de microglia se ligam diretamente à fosfatidíserina, incluindo TIM-4, BAI1, Stabilin-2 e TREM2. Receptores TAM microglial (por exemplo, MERTK) e integrinos indiretamente se ligam à fosfatidíserina, utilizando proteínas acessórias GAS6 ou MFG-E8, respectivamente. Outros sinais de "comer-me" podem ser necessários para o reconhecimento de células moribundas, estes incluem alterações na glicoseção ou carga de proteínas superficiais; expressão de proteínas intracelulares ICAM3, calreticulina, anexo-I na superfície celular; LDL oxidado; ou revestimento da célula apoptótica por complemento produzido por microglia C1q1,2.
Doenças neurodegenerativas, incluindo doença de Parkinson, doença de Alzheimer, demência frontotemporal e esclerose lateral amiotrófica têm sido associadas ao comprometimento da função microglia, incluindo o acúmulo de resíduos cerebrais, como células mortas, fragmentos de mielina e agregados proteicos, e respostas inflamatórias exageradas a esses estímulos3. A fagocitose pode ser prejudicada em doenças neurodegenerativas e contribuir para a patologia, devido a uma combinação de envelhecimento, inflamação ou variantes específicas de risco genético4,5. Por outro lado, há também evidências de modelos animais de doenças neurodegenerativas de que a microglia pode inapropriadamente fagocytose neurônios viáveis ou sinapses6,7,8. É provável que o mecanismo seja instigado pela exibição fosfatidylserina de neurites danificados, que é diretamente sentido pelos receptores de fagocitose microglial TREM2 ou GPR56, ou indiretamente sentido pelo complemento solúvel C1q revestimento da membrana enriquecida com fosfartidylserina, levando à fagocitose mediada por CR39,10,11.
Ensaios in vitro da função fagocitose, por exemplo, para avaliar o impacto fenotípico de uma variante de risco genético na microglia, são frequentemente realizados utilizando cargas não fisiológicas, como contas de látex4. Bactérias fluorescentes e zimosãs também são utilizadas, que são fisiológicas, mas não relevantes para doenças neurodegenerativas. Cargas fagocíticas não fisiológicas podem ser usadas para detectar defeitos no maquinário básico do engolamento fagocítico, mas não modelam com precisão o primeiro passo de "reconhecimento" na fagocitose dos neurônios apoptóticos. O tamanho, a forma, a rigidez e o tipo de carga também ditam as vias de sinalização intracelular que são ativadas, levando a diferentes resultados do estado de ativação da microglia. Por exemplo, as bactérias E.coli são pequenas e rígidas, ao contrário das células humanas, e os lipopólises em sua superfície são reconhecidos pelo receptor Toll-like 4 (TLR4) que ativa a fagocitose e as vias de sinalização pró-inflamatórias2,12.
No contexto de estudos de doenças neurodegenerativas, uma carga fagocítica mais relevante teria exibição de fosfatidylserina em membranas plasmáticas de mamíferos, e seria idealmente humana e neuronal, para incluir sinais que a microglia provavelmente encontrará. Para este protocolo de fagocitose, a linha celular neuroblastoma humana SH-SY5Y foi escolhida como um modelo de neurônio fácil de cultivar. A exposição permanente de fosfatidylserina foi artificialmente induzida por paraformaldeído, que já foi mostrado para causar exibição de fosfatidíserina de plaquetas13. Para o modelo microglia foram utilizados macrófagos humanos iPSC-macrófagos, que imitam o perfil ontogenia e transcricional da microglia humana, e são phagocyticamente competentes14,15,16,17. os macrófagos iPSC não são o modelo de microglia mais autêntico disponível, por exemplo, eles não imitam a morfologia da microglia; no entanto, pode-se substituí-lo por um modelo iPSC de monocultura mais autêntico, se desejar, como Haenseler et al.15. Os modelos humanos de iPSC são preferíveis à microglia de roedores primários para estudar a neurodegeneração, devido a preocupações com a sobreposição limitada dos módulos transcricionais de microglia observados nos tecidos da doença neurodegenerativa humana versuscamundongos 18. Os SH-SY5Ys mortos são manchados com um corante sensível ao ácido que fluoresce fracamente no pH neutro e mais fortemente dentro dos fagolicosomos de iPSC-macrófagos após fagocitose. O uso de um corante sensível ao ácido melhora a precisão da detecção de eventos fagocíticos, com versatilidade para diferentes leituras de macrófagos vivos e fixos19. Este protocolo descreve tanto a imagem de lapso de tempo de célula viva da fagocitose, quanto um ensaio de imagem fixo de alto teor de conteúdo para fagocitose, com as mesmas etapas de preparação celular antes da leitura(Figura 1).
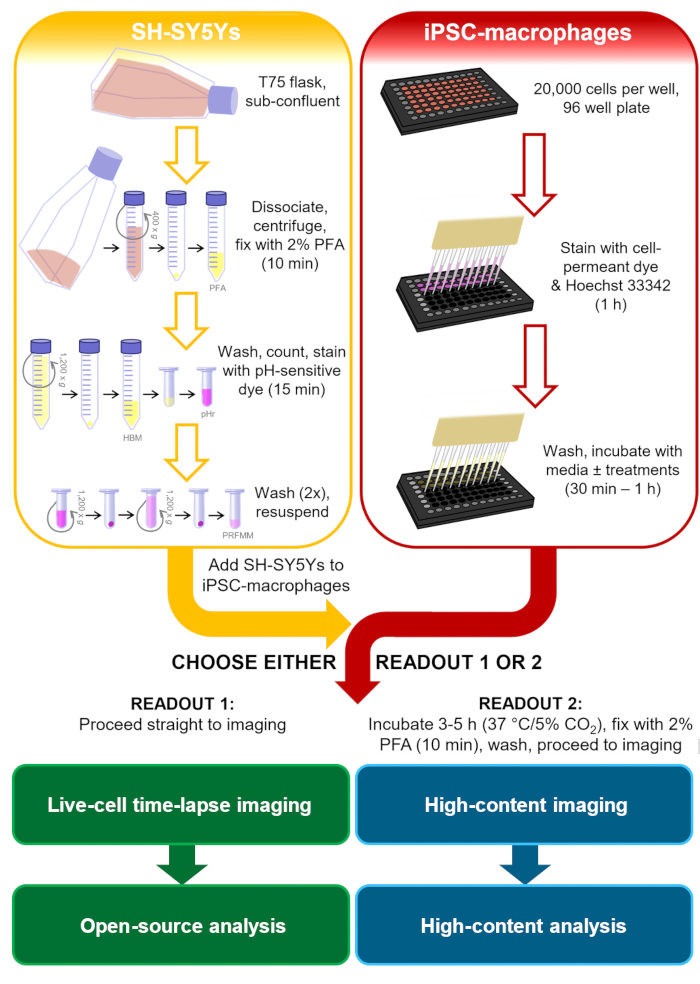
Figura 1: Diagrama esquemático da metodologia. O esboço do ensaio de fagocitose, onde a preparação dos SH-SY5Ys e a coloração dos macrófagos iPSC são realizados em paralelo, e então os SH-SY5Ys são pipetados sobre os macrófagos iPSC. Ou a imagem de lapso de tempo de células vivas é realizada imediatamente, ou as células são incubadas a 37 °C/5% de CO2 para a duração necessária e fixadas antes de realizar microscopia de alto conteúdo. PFA: paraformaldeído, HBM: mídia sem fenol sem fenol, pHr: solução de corante fluorescente vermelho sensível ao pH STP Ester, PRFMM: mídia macrófago sem fenol. Clique aqui para ver uma versão maior desta figura.
Protocolo
O protocolo segue as diretrizes para o uso de linhas celulares iPS humanas derivadas na Universidade de Oxford, Oxford Parkinson's Disease Centre (Comitê de Ética: National Health Service, Health Research Authority, NRES Committee South Central, Berkshire, Reino Unido (REC 10/H0505/71)). Os iPSCs humanos devem ser tratados dentro de um gabinete de segurança classe II para proteger o trabalhador de possíveis agentes aventureiros. As normas locais, nacionais e de segurança da UE devem ser respeitadas. As composições de mídia de cultura celular estão detalhadas na Tabela 1, e todos os materiais estão listados na Tabela suplementar de Materiais.
1. Cultura celular antes do experimento
- IPSCs de cultura em mídia iPSC (Tabela 1) em placas de 6 poços pré-revestidas com uma matriz de membrana de porão qualificada pelo HESC, subconfluente e com um número de passagem baixo.
- Diferencie iPSCs humanos aos precursores do macrófago iPSC: sementes de quatro milhões de iPSC em uma placa de 24 poços de baixa adesão com 2 mL de mídia corporal embrionária(Tabela 1) para incentivar a formação do corpo embrióide e realizar 75% de mudanças de mídia diariamente durante 5-6 dias. Transfira corpos embrionários para frascos T175, aproximadamente 150 corpos embrionários por frasco, contendo 20 mL de mídia de fábrica(Tabela 1). Alimentar semanalmente por adição de 10-20 mL de mídia de fábrica.
NOTA: os precursores do macrófago iPSC emergem no supernanato após aproximadamente 2-3 semanas e são produzidos continuamente por vários meses. Para este experimento, é preferível o uso de células a partir de aproximadamente 6 semanas após a configuração das fábricas de diferenciação. Os macrófagos iPSC colhidos anteriormente podem reter alguma capacidade proliferativa e são menos aderentes, evitando até mesmo semeadura a uma baixa densidade celular. Um limite de idade superior para a capacidade de fagocitose não foi determinado. - Diferencie os precursores do iPSC-macrófago aos macrófagos iPSC: precursores da colheita removendo o volume necessário de supernanato; passá-lo através de um coador de células de 40 μm para remover aglomerados; centrífuga a 400 x g por 5 min para pelotas e resuspend em mídia macrófago(Tabela 1). Seed iPSC-macrófagos a 20.000-30.000 células por poço em uma microplaca tratada com 96 poços de cultura tecidual (TC) com paredes de poço preto e um fundo opticamente claro, em 100 μL de mídia macrófago por poço. Evite os poços de borda e encha-os com PBS; isso é importante para reduzir o efeito da evaporação no ensaio. Diferencie para 6-10 dias por incubação a 37 °C/5% DE CO2.
NOTA: Para este ensaio, utilizou-se a linha iPSC BIONi010-C (ECACC ID: 66540023); no entanto, outra linha iPSC pode ser substituída. - Mantenha sh-SY5Ys para subconfluência em frascos T75 com 20 mL de mídia SH-SY5Y(Tabela 1),passaging a cada 3-4 dias.
| Nome | Mídia base | Aditivo, concentração final |
| mídia iPSC | mTeSR1 | - |
| Mídia corporal embrionária | mTeSR1 | BMP4, 50 ng/mL |
| VEGF, 50 ng/mL | ||
| SCF, 20 ng/mL | ||
| Mídia de fábrica | XVIVO15 | GlutaMAX, 2 mM |
| Penicilina, 100 unidades/mL | ||
| Estreptomicina, 100 μg/mL | ||
| 2-Mercaptoetanol, 50 μM | ||
| IL-3, 25 ng/mL | ||
| M-CSF, 100 ng/mL | ||
| Mídia macrófago | XVIVO15 | GlutaMAX, 2 mM |
| Penicilina, 100 unidades/mL | ||
| Estreptomicina, 100 μg/mL | ||
| M-CSF, 100 ng/mL | ||
| Mídia SH-SY5Y | DMEM/F12 | Soro bovino fetal, 10% |
| Penicilina, 100 unidades/mL | ||
| Estreptomicina, 100 μg/mL |
Tabela 1: Receitas de mídia.
Constituintes da mídia de cultura celular usadas no protocolo. Mais detalhes sobre os componentes de mídia podem ser encontrados na Tabela de Materiais.
2. Preparação de SH-SY5Ys mortos
- Em um gabinete de segurança biológica classe II, dissociar SH-SY5Ys, adicionando 4 mL de um tampão de dissociação celular contendo enzimas de trypsina recombinante e 1,1 mM EDTA (ver Tabela de Materiais),que deve ser removido imediatamente para que menos de 1 mL permaneça como uma película fina que reveste as células. Incubar por 2-3 min a 37 °C/ 5% DE CO2.
- Adicione 10 mL de HBSS ao frasco T75 para enxaguar e pipeta os SH-SY5Ys em um tubo de centrífuga cônica de 15 mL. Centrifugar a 400 x g por 5 min. Aspire o supernasciente e suspenda as células em 2 mL de mídia tamponada com HEPES sem fenol (ver Tabela de Materiais). Certifique-se de resuspensar a pelota cuidadosamente, pipetando com uma pipeta de 100-1.000 μL para quebrar aglomerados antes da fixação.
- Fixar células adicionando 2 mL de 4% de paraformaldeído (concentração final 2%) ao tubo. Incubar por 10 minutos à temperatura ambiente com agitação suave ocasional do tubo.
- Adicione 10 mL de HBSS ao tubo. Centrifugar a 1.200 x g por 7 min e suspender em 2 mL de mídia hepes-tamped sem fenol vermelho.
NOTA: Após o passo 2.4, a preparação fixa-SH-SY5Y pode ser controlada pela qualidade por coloração com anexo V-FITC para mostrar iodeto de fosfatidídrina e propidium acessíveis para medir a permeabilidade celular com uma leitura de citometria de fluxo. Compare a preparação fixa com sh-SY5Ys vivos obtidas a partir da etapa 2.2. Consulte a seção 7 e a Figura Suplementar S1. O armazenamento dos SH-SY5Ys fixos após a etapa 2.4 não é recomendado, pois isso não foi avaliado.
3. Rotulagem de SH-SY5Ys mortos com corante fluorescente vermelho sensível ao pH
- Após a etapa 2.4, conte as células e remova o número total de células necessárias em um tubo de baixa ligação de proteínas de 2 mL. Para cada 1 milhão de SH-SY5Ys, compõem o volume total no tubo de 2 mL para 300-500 μL com mídia hepes-livre de fenol. Aqueça o tubo brevemente em um banho de água de 37 °C.
- Reconstitua o ér de corante fluorescente vermelho sensível ao pH (ver Tabela de Materiais)e adicione 12,5 μg de corante por milhão de SH-SY5Y ao tubo quente de 2 mL de células. Misture suavemente por pipetar. Incubar o tubo em temperatura ambiente por 30 minutos, protegido da luz.
NOTA: A espécie éster STP do corante sensível ao pH reage com aminas primárias e, portanto, o tampão de rotulagem não deve conter aminas livres. Devido à solubilidade potencialmente limitada em tampões aquosos, adicione o corante dissolvido pelo DMSO apenas para aquecer o tampão aquoso, misture imediatamente e examine sinais de precipitado (partículas escuras sob um microscópio de luz). - Adicione 1 mL de HBSS e centrífuga a 1200 x g por 7 min a 4 °C. Descarte o supernatante e lave com HBSS de 2 mL. Repita a centrifugação.
- Descarte o supernasciente e suspenda as células em meios macrófagos livres de fenol (ver Tabela de Materiais),a uma concentração de 200.000-1,2 milhões de células/mL de modo que 50 μL seja de 10.000-60.000 células (i.e., 0,5x-3x mais SH-SY5Ys do que iPSC-macrófagos).
NOTA: O vermelho fenol na mídia aumenta a fluorescência de fundo e, portanto, uma mídia sem fenol não deve ser usada se a imagem de células vivas for realizada. O armazenamento dos SH-SY5Ys manchados por mais de algumas horas não é recomendado, pois isso não foi avaliado. Mantenha sh-SY5Ys manchados no gelo e proteja da luz.
4. Coloração de macrófagos iPSC
- Em um gabinete de segurança biológica, prepare uma solução em meios macrófagos de um profundo corante vermelho-fluorescente, permeante celular, succinimidyl (ver Tabela de Materiais). Adicionar Hoechst 33342 (ver Tabela de Materiais). Aqueça a solução de trabalho a 37 °C em banho-maria.
- Aspire o meio iPSC-macrófago suavemente, tubondo a célula supernante com uma pipeta multicanal em um reservatório estéril. Adicione 70 μL/bem da solução de corante preparada na etapa 4.1 aos macrófagos iPSC, utilizando uma pipeta multicanal. Incubar por 1h a 37 °C/5% DE CO2.
- Prepare tratamentos experimentais em mídia de macrófago sem fenol. Inclua 10 μM cytochalasin D como tratamento de controle negativo. Após a incubação aspira o meio iPSC-macrófago muito suavemente com uma pipeta multicanal, e adicione 100 μL/poço da solução salina tamponada da Hank (HBSS) para lavar. Remova imediatamente o HBSS por tubulação suave e adicione 100 μL de compostos de ± de mídia. Incubar por 10 min-1 h a 37 °C/ 5% CO2.
NOTA: Cytochalasin D é um potente inibidor de actina e bloqueia a fagocitose. Para quaisquer tratamentos experimentais que exijam maior incubação, por exemplo, 24-72 h, realize o tratamento experimental antes da etapa 4.1 usando 100 μL/bem de tratamento em plena mídia macrófago. Siga as etapas 4.1-4.3 de acordo com o protocolo para que a coloração celular seja realizada e, posteriormente, o tratamento seja reaplicado em mídia de macrófago sem fenol para o restante do ensaio de fagocitose.
5. Fagocitose por imagem
Abaixo estão dois métodos diferentes de leitura da fagocitose, escolha a subseção 5.1 ou 5.2.
- Imagens de lapso de tempo de células vivas
- Antes da fagocitose, ligue o microscópio de imagem de lapso de tempo de células vivas (ver Tabela de Materiais),computador, câmara de ambiente e gás CO2. Software de captura de imagens abertas. Verifique se os cubos de luz DAPI, RFP e CY5 estão instalados no microscópio. Clique em time lapse | Incubar | Habilite a Câmara de Meio Ambiente e selecione o aquecimento a 37 °C com gás CO2, também certifique-se de que a umidade seja desle escolhida. Deixe 30 min para que o microscópio aqueça a 37 °C.
- Durante a incubação do composto na etapa 4.3, carregue a placa iPSC-macrófago no microscópio.
- Clique em Imagem | Capturar | Especialista em Embarcações. Selecione Placa de Poço e escolha um tipo de placa de 96 poços.
- Na guia Imagem, ligue o canal de fase e ajuste o foco grosseiro e fino usando os controles deslizantes verticais, para que as células estejam em foco. Ajuste os níveis de iluminação com o controle deslizante horizontal. Clique nos canais DAPI, RFP e CY5 e ajuste os níveis de iluminação para cada canal.
- Na guia Sistema, clique em Calibrar o alinhamento da embarcação e siga as instruções da tela.
- Clique em time lapse | Rotinas | Criar nova rotina. Na primeira tela do Assistente de Lapso de Tempo,nomeie a rotina. Clique em Next. Na segunda tela, selecione o objetivo de 20x, selecione captura monocromática e selecione os canais DAPI, RFP, CY5 e Phase. Não selecione as seguintes opções: Auto Find Sample, Auto fine focus, Z-Stack, Auto lighting. Clique em Next.
- Na próxima tela configure um farol no centro de cada poço, o que permitirá que o microscópio retorne às mesmas coordenadas com as mesmas configurações de iluminação para cada ponto de tempo. As configurações de foco e iluminação para cada farol são independentes. Para definir um farol: arraste o círculo azul para o local no mapa da placa, use o controle deslizante vertical de foco grosseiro e fino e, quando satisfeito, clique em Adicionar Farol. As configurações do farol podem ser atualizadas mais tarde usando o botão Atualizar Selecionado.
- Quando estiver pronto para iniciar o ensaio de fagocitose, remova a placa de ensaio e coloque-a em um armário de segurança biológica. Use uma pipeta multicanal para adicionar 50 μL de SH-SY5Ys por poço, adicionando ao lado de cada poço na borda do líquido.
- Coloque a placa no microscópio e espere aproximadamente 30 minutos para que o câmbio térmico se equilibre.
NOTA: Durante os primeiros 30 minutos em que a placa está no microscópio, a mudança de temperatura da placa de ensaio fará com que o foco mude. Se a placa não for permitida a equilibrar, as imagens capturadas sairão do foco durante o lapso de tempo. - Clique em cada farol e atualize a configuração de foco. Clique em Next. Na próxima tela do Assistente de Lapsode Tempo, selecione o formato de arquivo TIFF,habilite a opção de salvar canais individuaise habilite a opção de criar vídeo para cada farole permita que as opções abaixo Incluam as seguintes informações como marca d'água. Clique em Next.
- Defina o número de cenas para 1. Clique em Next. Defina a duração e os intervalos do lapso de tempo, por exemplo, 3 h e imagem a cada 5 minutos. Não selecione Capturar apenas um quadro. Clique em Next.
- Habilite a câmara ambiente, com temperatura de 37 °C e CO2 (a umidade é opcional para experimentos curtos). Clique em Next duas vezes. Escolha um caminho para salvar os dados. Clique em Next. Clique em Iniciar para iniciar o lapso de tempo.
- Imagem de alto conteúdo de célula fixa
- Use uma pipeta multicanal para adicionar 50 μL dos SH-SY5Ys rotulados por poço, adicionando ao lado de cada poço na borda do líquido. Incubar a 37 °C/ 5% de CO2 para 3-5 h.
- Após a incubação da fagocitose, aspirar suavemente os supernaentes celulares por pipetar com uma pipeta multicanal e descartar. Lave uma vez com 100 μL PBS.
- Fixar a placa por adição de 100 μL de 2% de paraformaldeído, incubar por 15 min a temperatura ambiente.
- Aspirar poços e adicionar 100 μL de PBS. Cubra com selador de placas e papel alumínio; armazenar a 4 °C até que seja necessário.
NOTA: A placa de ensaio pode ser armazenada assim por pelo menos uma semana sem degradação significativa do sinal; o armazenamento mais longo não foi testado. - Ligue o microscópio de imagem de alto conteúdo (ver Tabela de Materiais) e abra o software de captura de imagens. Carregue a placa de ensaio no microscópio clicando no ícone Carregar na parte superior da tela.
- Selecione a guia Configuração. Nos menus suspensos da caixa superior esquerda: selecione o tipo de placa apropriado, selecione a opção de foco automático Dois Picos (Padrão),selecione o objetivo 40x Água, NA1.1,selecione o modo Confocal e selecione binning de 1.
- Lave o objetivo de água de 40x antes de usar, através do menu Configurações.
- Na caixa seleção de canais, use o ícone + para adicionar os canais DAPI, Alexa 647 e Alexa 568. Defina estes para medir em um único plano de 1 μm. Otimize as configurações de tempo e energia para a eficiência de coloração da placa de ensaio.
NOTA: Como diretriz, coloque o DAPI em exposição de 200 ms e 100% de potência, alexa 647 a 1500 ms de exposição e 100% de potência, e Alexa 568 com exposição de 100 ms e 40% de potência. - Certifique-se de que os canais não são medidos simultaneamente clicando em Sequência de Canais para separar os canais.
- Sob | de Navegação Defina layout,selecione os poços de medição e selecione 9-12 campos por poço.
- Durante a configuração, clique em um campo representativo no mapa da placa e verifique cada canal de medição, por sua vez, para garantir que a mancha esteja presente e que as imagens estejam focadas, ajustando o deslocamento do canal.
- Para que os dados sejam carregados em um servidor para análise remota, clique na caixa Empregos Online e no nome de tela relevante; isso permitirá o upload automático dos dados para um servidor após a imagem.
- Salve o protocolo de ensaio clicando no botão Salvar.
- Clique na guia Executar experimento na parte superior e nomeie a placa de experimento e clique em Iniciar.
6. Análise de dados
Abaixo estão dois métodos diferentes de análise de dados, escolha a subseção 6.1 se a subseção 5.1 fosse seguida ou escolhesse a sub seção 6.2 se a subseção 5.2 fosse seguida.
- Análise de imagens de fagocitose obtidas por microscópio de lapso de tempo de células vivas
- Baixe e instale o software de código aberto recomendado (ver Tabela de Materiais). Abra o software.
- Na caixa de módulos de entrada, selecione Imagens.
- Do Windows Explorer,abra a pasta de dados, contendo subpastas chamadas Beacon-1, Beacon-2, etc. Selecione e arraste todas as pastas Beacon para a caixa lista Arquivo.
- Na caixa de módulos De entrada, selecione Metadados. Para Extrato de Metadados?, selecione Sim. No menu suspenso ao lado do Método de Extração de Metadados,escolha extrair nomes de arquivos/pastas. Para a Fonte metadados,escolha o Nome da pasta. Clique na lupa à direita da expressão regular e digite ".*[\.*](? P.*)"na caixa de texto Regex (excluindo as marcas de cotações). Clique em Enviar. Para extrair metadados,escolha todas as imagens. Clique em Atualizar na parte inferior da tela. As imagens serão agora agrupadas por farol.
- Na caixa Módulos de Entrada, selecione Nomes e Tipos. O processo a seguir permitirá que as imagens de cada ponto de tempo sejam atribuídas ao canal de fluorescência correto. Atribua um nome às Regras de Correspondência de Imagens (menu suspenso). Selecione os critérios de regra correspondendo a Todos (menu suspenso) das seguintes regras. Arquivo (menu suspenso), Faz (menu suspenso), contém (menu suspenso), DAPI (caixa de texto). Nome a atribuir a essas imagens DAPI (caixa de texto). Selecione o tipo de imagem Greyscale Image (menu suspenso). Definir faixa de intensidade a partir de Metadados de imagem (menu suspenso).
- Na parte inferior da tela, clique em Adicionar outra imageme repita o passo 6.1.5. Substitua o DAPI por RFP,para que as imagens RFP sejam agrupadas.
- Repita o passo 6.1.6 para as imagens do canal CY5.
- Clique em Atualizar na parte inferior da tela, os arquivos de imagem agora serão listados em três colunas rotuladas DEPI, RFP e CY5.
- Na caixa Módulos de Entrada, selecione Grupos. Para Você quer agrupar suas imagens?, selecione Sim. No menu suspenso para categoria Metadados,escolha Beacon.
- Na caixa Módulos de Análise, clique com o botão direito do mouse no espaço branco para chamar uma lista de todos os módulos.
- Clique em Adicionar | | de processamento de imagens EnhanceOrSuppressFeatures. Escolha o DAPI na primeira caixa de entrada como a imagem de entrada. Nomeie a imagem de saída como "DAPIspeckles". Selecione o tipo de operação Melhorar e apresentar o tipo Speckles,com um tamanho de recurso de 20 pixels. Escolha a opção de velocidade e precisão Rápido/Hexagonal.
- Crie um novo módulo. Adicione | | de processamento de objetos IdentifiqueObjectsprimary. Escolha DAPIspeckles da primeira caixa de entrada como a imagem de entrada. Diga os objetos primários "Núcleos". Inserir o diâmetro típico dos objetos como unidades de 10 a 35 pixels; este parâmetro pode ser otimizado. Escolha a estratégia de limiar Global, o método de limiar RidlerCalvard, o método de suavização Automático, e dê o fator de correção de limiar como 12 com limites inferiores e superiores 0-1. Altere o método para distinguir objetos agrupados para Moldar, mas deixe outros parâmetros em suas configurações padrão.
NOTA: Os núcleos iPSC-macrófago foram aproximadamente segmentados na etapa 6.1.12, seguindo uma etapa de processamento de imagem que reduz o diâmetro e aumenta o contraste dos núcleos. É importante que apenas os núcleos mais brilhantes sejam selecionados, uma vez que os SH-SY5Ys aparecerão como núcleos mais fracos e serão confundidos como macrófagos iPSC de outra forma. Para ajustar a proporção de núcleos selecionados, aumente ou diminua o fator de correção do limiar. Durante a fase de teste, compare a seleção dos núcleos resultantes com uma imagem de fase do farol, onde é fácil distinguir entre iPSC-macrófago e SH-SY5Y usando morfologia celular. - Crie um novo módulo. Adicione | | de processamento de imagens CorrectIlluminationCalcula. Escolha CY5 na primeira caixa de entrada como a imagem de entrada. Nomeie a imagem de saída "IllumCY5". Para Selecionar Como a Iluminação, escolha Plano de Fundo no menu suspenso. Deixe os outros parâmetros em suas configurações padrão.
- Crie um novo módulo. Clique em Adicionar | | de processamento de imagens CorrectIlluminationApply. Escolha CY5 na primeira caixa de entrada como a imagem de entrada. Nomeie a imagem de saída "CorrCY5". Para Selecionar a Iluminação,escolha IllumCY5 no menu suspenso. Para selecionar como a iluminação,escolha Dividir no menu suspenso.
NOTA: O objetivo das etapas 6.1.13-6.1.14 é corrigir a variação na iluminação de fundo das imagens CY5, o que interferiria na segmentação celular correta. - Crie um novo módulo. Clique em Adicionar | | de processamento de objetos IdentificaoscagenscondaryObjects. Escolha CorrCY5 na primeira caixa de entrada como a imagem de entrada. Escolha núcleos como objetos de entrada. Diga os objetos secundários de "Mac". Escolha o método de identificação como Distância - B. Selecione a estratégia de limiar Global, método de limiar RidlerCalvard,o método de suavização Sem suavização, e dê o fator de correção de limiar como 1 com limites inferiores e superiores 0-1. Deixe outros parâmetros em suas configurações padrão.
NOTA: Esta etapa de segmentação celular pode exigir otimização, ajustando o fator de correção de limiar para crescer ou reduzir os limites celulares. A eficiência de segmentação também pode ser melhorada aumentando a força da coloração iPSC-macrófago, ou a iluminação do cubo de luz CY5 durante a imagem. - Crie um novo módulo. Clique em Adicionar | | de processamento de imagens EnhanceOrSuppressFeatures. Escolha RFP na primeira caixa de entrada como a imagem de entrada. Nomeie a imagem de saída como "FilteredRFP". Selecione o tipo de operação Melhorar e apresentar o tipo Speckles,com um tamanho de recurso de 15 pixels. O tamanho do recurso pode ser otimizado. Escolha a opção de velocidade e precisão Rápido/Hexagonal.
- Crie um novo módulo. Clique em Adicionar | | de processamento de objetos IdentifiqueObjectsprimary. Escolha FilteredRFP na primeira caixa suspensa como a imagem de entrada. Nomeie objetos primários "pHr". Insira o diâmetro típico dos objetos como unidades de 5 a 20 pixels. Selecione o Manualde estratégia de limiar e digite um limiar manualmente, por exemplo, 0,005. Altere o método para distinguir objetos agrupados para Moldar, mas deixe os outros parâmetros em suas configurações padrão.
NOTA: Os SH-SY5Ys foram segmentados na etapa 6.1.17, seguindo uma etapa de processamento de imagem que reduz o diâmetro e aumenta o contraste da puncta. É fundamental realizar o limiar manual, uma vez que a intensidade do corante sensível ao pH aumenta ao longo do tempo em partículas fagocitas, e outras estratégias de limiar inflarão artificialmente o número de puncta de corante sensível ao pH nos primeiros pontos de tempo. O limiar manual deve ser ajustado para cada repetição experimental subsequente, utilizando o modo de teste. - Crie um novo módulo. Clique em Adicionar | | de processamento de objetos RelacionasObjects. Selecione os objetos de entrada do pHr do menu suspenso. Selecione os objetos pai de entrada Mac no menu suspenso. Para calcular por pai significa para todas as medidas da criança? Não calcule distâncias entre pais e filhos(Nenhum).
NOTA: O passo 6.1.18 relaciona o sinal de corante sensível ao pH aos macrófagos iPSC, permitindo a medição do número médio de objetos fagocytosed por iPSC-macrófago. - Crie um novo módulo. Clique em Adicionar | Processamento de arquivos | ExportToSpreadsheet. Selecione o delimitador de coluna como Tab e adicione um prefixo para nomes de arquivos para indicar o número do farol. Escolha medições específicas para exportação, conforme indicado abaixo (etapas 6.1.19.1 - 6.1.19.4); deixando outros parâmetros em suas configurações padrão.
- | de imagem Conde | Selecione pHr e Mac
- | de imagem Filename
- | de imagem Grupo
- Mac | crianças | Phr
- Na caixa Saída, clique em Exibir configurações de saída. Crie uma nova pasta na área de trabalho para este experimento e defina isso como a pasta de saída padrão.
- Salve o arquivo do pipeline | Salvarprojeto como....
- Teste e otimize o pipeline em uma imagem representativa clicando no Modo de Teste iniciar no canto inferior esquerdo. O programa seleciona automaticamente a primeira imagem para testes e cada etapa do pipeline pode ser visualizada clicando nos símbolos dos olhos, o que torna a saída visível e, em seguida, clicando em Executar. Para alterar o farol usado para testes, na barra superior do menu clique em Test | Escolha grupo de imagens. Para alterar a imagem (ponto de tempo) dentro de um farol, na barra superior do menu clique em Teste | Escolha conjunto de imagens. Os parâmetros que devem ser otimizados são indicados nas etapas anteriores.
- Quando estiver satisfeito com o pipeline, clique no Modo de Teste de Saída e clique nos símbolos dos olhos abertos para fechá-los. Salve o oleoduto. Clique em Analisar imagens para iniciar a análise completa da imagem.
- Os arquivos de texto gerados podem ser abertos como uma planilha com software de planilha apropriado, e o arquivo rotulado como "Imagem" conterá uma linha para cada ponto de tempo da imagem, com as colunas representando parâmetros.
NOTA: Count_Mac e Count_pHr representam o número de macrófagos iPSC e o número de objetos sensíveis ao pH identificados em uma imagem. Não utilize dados Count_pHr, pois a contagem inclui SH-SY5Ys vagamente fluorescentes que não foram phagocytosed. A coluna Mean_Mac_Children_pHr_Count leva o número médio de objetos pHr phagocytosed por Mac (passo 6.1.18 RelateObjects) para uma imagem individual, ou seja, ponto de tempo individual de um farol. - Organize os dados para que cada farol seja uma coluna separada na planilha, as imagens dispostas como linhas de ordem cronológica, com parâmetros diferentes ocupando diferentes folhas da planilha.
- Multiplique as medidas Mean_Mac_Children_pHr_Count por Count_Mac, para gerar o parâmetro Número de manchas por imagem. Calcule a média Count_Mac para cada farol. Divida o número de pontos por imagem pela média Count_Mac para esse farol, gerando o parâmetro Número de manchas por célula.
NOTA: O passo 6.1.26 corrige quaisquer flutuações errôneas que possam ocorrer na contagem iPSC-macrófago (Count_Mac), normalizando os dados para a contagem média iPSC-macrófago em todos os pontos de tempo de um Farol. - Atribua o tempo desde que a fagocitose começou (em min) a cada linha de imagem.
- Gerar meios e desvio padrão para replicar poços/sinalizadores. Gráfico do número de pontos por célula (eixo y) contra o tempo (x-eixo) para visualizar a taxa de fagocitose.
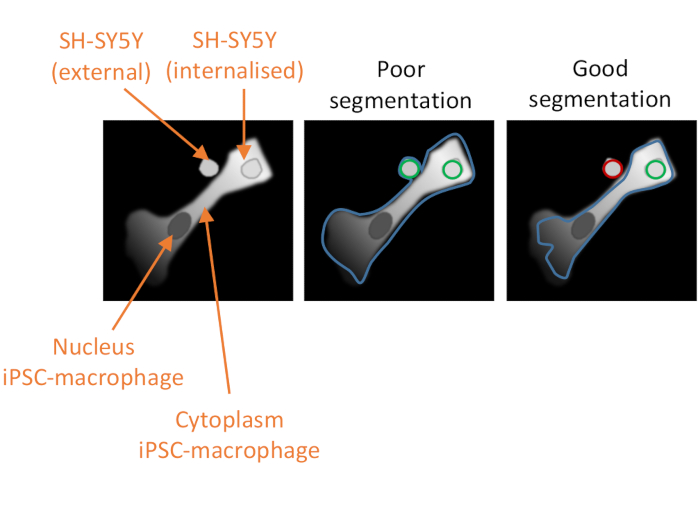
Figura 2: Segmentação celular na análise de fagocitose de alto teor. Ilustração para demonstrar boa versus má segmentação de um iPSC-macrófago próximo a um SH-SY5Y não fagocytosed, com um segundo SH-SY5Y totalmente fagocytosed. Com ambos os tipos de células mostrados em cinza, a borda da célula iPSC-macrófago delineada pela análise do computador é delineada (azul). Sh-SY5Ys que são contados como eventos de fagocitose são delineados verdes ou delineados vermelhos se excluídos da análise. A imagem no meio mostra má segmentação; o iPSC-macrófago tem delineamento sub-ideal que inclui o SH-SY5Y não fagoctosed dentro da borda celular, que será contado como um evento de fagocitose. A imagem à direita mostra boa segmentação devido a parâmetros mais rigorosos que definem a borda célula iPSC-macrófago, o que levou o SH-SY5Y não fagocitado a ser corretamente excluído da análise. Clique aqui para ver uma versão maior desta figura.
- Análise de imagens de fagocitose obtidas com microscópio de alto teor
- Faça login no software de processamento de imagens recomendado (ver Tabela de Materiais).
- Selecione a pasta de nome da tela e a subpas de execução de imagens do menu esquerdo. Clique no ícone Análise de imagem (uma tela com uma lupa). Selecione um bem representativo no layout da placa para configurar o pipeline de análise.
- O primeiro bloco de construção de análise é a imagem de entrada. Deixe as configurações padrão para processamento de pilhas(Planos Individuais) e correção de campo plano(Nenhum). Clique no sinal + no canto superior direito do bloco, para adicionar o próximo bloco de construção e selecione Encontrar Núcleos.
- Em Find Nuclei, defina o canal como DAPI,a população do ROI como Nenhum,o método de segmentação como C. A caixa de método contém um menu suspenso que permite que o parâmetro seja otimizado, com configurações para o limiar comum (ou seja, 0,40) e área (ou seja, >30 μm2). Nomeie a população de saída "Núcleos". Adicione o próximo bloco de construção clicando no símbolo + e selecione Encontrar Citoplasma.
- Em Find Cytoplasm, defina o canal como Alexa 647 e o método como B. A caixa de método contém um menu suspenso que permite que o parâmetro seja otimizado, com configurações para o limiar comum (ou seja, 0,45) e o limiar individual (ou seja, 0,20). Adicione o próximo bloco de construção clicando no símbolo + e selecione Selecionar População.
NOTA: É fundamental otimizar adequadamente a segmentação do citoplasma para que exclua quaisquer SH-SY5Ys adjacentes que não tenham sido phagocytosed, mas não excluam a carga fagocitada (ver Figura 2). - Em População Selecionada, mantenha as configurações padrão, que serão núcleos populacionais,método Filtros Comuns,um carrapato para Remover Objetos fronteiriçose a população de saída chamada "Núcleos Selecionados". Adicione o próximo bloco de construção clicando no símbolo + e selecione Calcular Propriedades de Morfologia.
- Em Calcular Propriedades de Morfologia, defina a população para núcleos selecionados,a região para a célula,o método para padrão. No menu suspenso, certifique-se de que a área e a arredondamento sejam selecionadas (μm2). Nomeie a população de produção "Célula de Morfologia". Adicione o próximo bloco de construção clicando no símbolo + e selecione Selecionar População.
- Em População Selecionada (2), escolha a população Nuclei Selectede o método Filtro por Propriedades. Na caixa de entrega sob filtro F1,selecione Área celular de morfologia [μm2]. Escolha > da caixa de entrega para a direita e digite 160 na caixa à direita disso. Nomeie a população de saída "Núcleos Selecionados 2". Adicione o próximo bloco de construção clicando no símbolo + e selecione Encontrar pontos.
NOTA: Esta etapa exclui quaisquer células segmentadas incorretamente, e quaisquer células mortas de análises posteriores. Pode ser necessário otimizar aumentando ou diminuindo o tamanho do corte. - Em Find Spots, selecione o canal Alexa 568, a população do ROI Núcleos Selecionados 2, a célulada região do ROI , método B, e nomeie a população de saída "Pontos". O método pode ser otimizado, se necessário, utilizando o menu suspenso, com configurações para sensibilidade de detecção (ou seja, 0,20) e sensibilidade de divisão (ou seja, 0,400). Adicione o próximo bloco de construção clicando no símbolo + e selecione Calcular Propriedades de Morfologia.
- Em Calcular Propriedades de Morfologia (2), selecione as manchas populacionais, a mancha daregião e o método Padrão. No menu suspenso, certifique-se de que a área e a arredondamento sejam selecionadas (μm2). Nomeie as propriedades de saída "Ponto de Morfologia". Adicione o próximo bloco de construção clicando no símbolo + e selecione Selecionar População.
- Em População Selecionada (3), selecione as manchas populacionais e o método Filtro por Propriedades. Nas caixas de queda sob filtro F1, selecione Área spot [px2],>, 20. Nas caixas de subsistência em Filter F2, selecione Área spot [px2],<, 2500. Nas caixas de entrega sob filtro F3,selecione Morfologia Spot Roundness, >, 0,6. Nas caixas de queda sob filtro F4, selecione Ponto para Intensidade de Região, >, 2,5. Nomeie a população de saída "Pontos Selecionados". Adicione o próximo bloco de construção clicando no símbolo + e selecione Selecionar População.
NOTA: A seleção automatizada de pontos terá segmentado muitas pequenas partículas fluorescentes que resultam de corpos autofluorescentes dentro dos macrófagos iPSC. Esta etapa visa filtrar corpos autofluorescentes, aplicando cortes rigorosos na área, arredondamento e intensidade das manchas, podendo exigir alguma otimização. - Em População Selecionada (4), selecione a população Núcleos Selecionados 2 e o método Filtro por Propriedades. Nas caixas de queda sob filtro F1, selecione Número de Pontos, >, 0,5. Nomeie a população de saída "Células Positivas Spot". Adicione o próximo bloco de construção clicando no símbolo + e selecione Definir resultados.
- Em Definir resultados,selecione o primeiro método como Lista de Saídas. A configuração padrão é para que o número de objetos seja calculado para cada população. Clique no menu suspenso para Population: Nuclei Selected 2 e certifique-se de que o número de objetos esteja marcado e no menu Suspenso Desegue TODOS OS . Para a população Spot Positive Cell, certifique-se de que o número de objetos esteja marcado. Para as demais populações, não é necessário informar quaisquer parâmetros. Selecione o segundo método como Formula Outpute digite a fórmula (a/b)*100. Escolha como variável A Spot Positive Cell- Number of Objects, e como variável B escolha núcleos selecionados 2- Número de Objetos. Nomeie a saída como "Spot Positive Cells (%)".
- Salve o pipeline: clique no ícone Salvar análises para disco (um disquete com seta para baixo).
- Clique no ícone Análise de lote (um símbolo de funil e engrenagens ao longo da parte superior da tela). A partir das pastas experimentais à esquerda, selecione o arquivo de dados bruto, que deve atualizar o número de medições selecionadas para 1. Na região de opções de análise, clique no menu suspenso para métodoe selecione Análise existente. Clique no ... símbolo ao lado do Arquivo script e procurar o arquivo de análise salvo (sufixo .aas). Em seguida, clique no arqueiro verde ao lado de Iniciar análise. O progresso da análise pode ser monitorado clicando em Job Status (no canto superior direito da tela).
- Uma vez concluída a análise, clique na guia Exportar,escolha a pasta de experimento e selecione uma pasta de destino. Deixe as configurações padrão, que exportam dados, mas não imagens TIFF, e inicie a exportação.
- Abra o arquivo baixado como uma planilha em um software de planilha apropriado. Os poços são dispostos em linhas e os parâmetros em colunas. Selecione os dados em colunas rotuladas De Células Spot Positiva (%), Núcleos Selecionados 2 - Número de Pontos - Média por Poço, e Núcleos Selecionados 2 - Área Total spot - Média por Bem, e copie-os para planilhas novas para cada parâmetro. Calcule a média do parâmetro para replicar poços de cada condição e o gráfico conforme apropriado.
7. Ensaio de controle de qualidade para homogeneidade de SH-SY5Ys fixos
- Colete uma alíquota de SH-SY5Ys ao vivo a partir da etapa 2.2 e resuspensa no buffer de ligação de anexo de um kit para coloração anexa em V-FITC (ver Tabela de Materiais) em uma concentração de aproximadamente 200.000 células por mL.
- Colete uma alíquota de SH-SY5Ys fixos da etapa 2.4 e resuspende em buffer de ligação de anexo a uma concentração de aproximadamente 200.000 células por mL.
- Prepare dois tubos de ensaio com 5 μL de anexo em V-FITC e 5 μL de iodeto de propídio (ver Tabela de Materiais). Adicione 500 μL de SH-SY5Ys vivos a um tubo, e 500 μL de SH-SY5Ys fixos ao outro.
- Prepare três tubos de controle: um com 5 μL de anexo em V-FITC, um com 5 μL de iodeto de propídio e um tubo vazio. Misture uma proporção de 1:1 de SH-SY5Ys vivos e fixos e adicione 500 μL disso a cada tubo de controle.
- Misture os tubos suavemente por pipeta. Incubar em temperatura ambiente por 10 minutos, protegido da luz.
- Meça imediatamente em um citômetro de fluxo (Ex = 488 nm; Em = 530 nm) utilizando detector de sinal FITC (geralmente FL1) para anexo em V-FITC, e o detector de sinal de emissão de ficoerticrina (geralmente FL2) para iodeto de propídio.
- Use qualquer software de análise de citometria de fluxo para exibir gráficos de pontos do sinal FITC vs PI e use uma ferramenta de gating retangular para selecionar a população duplamente negativa. Dentro da população dupla-negativa, exiba FSC vs SSC e use uma ferramenta de gating poligonal para criar um portão de exclusão em torno da população com FSC e SSC muito baixos, que é classificado como detritos e, portanto, excluído de análises posteriores. Exiba os eventos restantes como sinal FITC vs PI e use os controles de um único ajuste e sem manutenção para definir um portão de quadrante para eventos FITC-/PI-, FITC+/PI-, FITC -/PI+e FITC+/PI+.
NOTA: Evite manuseamento áspero, vórtice ou incubações longas com SH-SY5Ys vivos, que poderiam induzir artificialmente a exibição de fosfatidíserina. Prossiga para a citometria de fluxo sem demora. Um resultado desejável é que a proporção de eventos FITC/PI é de <5% nos SH-SY5Ys fixos. Os resultados representativos são mostrados em Figura Suplementar S1.
Resultados
A imagem de lapso de tempo de células vivas foi realizada utilizando-se o protocolo previamente delineado, com macrófagos iPSC-macrófagos do tipo selvagem semeados em 20.000 células por poço. Foram aplicadas diferentes quantidades de SH-SY5Ys (10.000-30.000 por bem como estimadas da contagem celular na etapa 3.1), e o inibidor de fagocitose cytochalasin D foi pré-incubado (1 h) com alguns poços, agindo como um controle para inibir a fagocitose para cada quantidade de SH-SY5Ys. A imagem começou 40 minutos após a adição de SH-SY5Ys e as imagens foram capturadas em intervalos de 5 minutos para as próximas 3 horas (os dados incluem o atraso inicial de 40 min). Um vídeo de lapso de tempo representativo é incluído nos Dados Suplementarese analisados dados quantitativos mostrados na Figura 3. Com a quantidade de 10.000 SH-SY5Ys por poço, o número de partículas fagocitas (manchas) por célula aumentou linearmente com o tempo, e foi inibido em aproximadamente 50% por citochalasina D. A inibição por citochalasina D foi mais fraca do que o previsto, provavelmente causada por insuficientes réplicas técnicas ou biológicas, pois apenas um poço por condição foi imageado com três campos de imagem. Com maiores quantidades de SH-SY5Ys por poço (20.000 e 30.000), a fagocitose apresentou baixa linearidade, provavelmente devido à má segmentação de macrófagos iPSC e SH-SY5Ys em um campo de visão mais lotado.
A imagem de alto teor de células fixas foi realizada utilizando-se o protocolo previamente delineado, com macrófagos iPSC-macrófagos do tipo selvagem a 20.000 células por poço, várias quantidades diferentes de SH-SY5Ys (10.000-80.000 por bem), e a placa de ensaio foi fixa e imageda após 5h. Uma imagem representativa da fagocitose é apresentada na Figura 4A, e os dados analisados mostrados na Figura 4B17. O aumento da quantidade de SH-SY5Ys resultou em um maior número de partículas fagocitas (manchas) por célula; no entanto, uma duplicação da quantidade SH-SY5Y leva apenas a um aumento de 1,5x no número de pontos por célula. Isso indica que os valores testados não são limitadores de taxa à fagocitose. Posteriormente, o ensaio de phagocytose por imagem de alto teor foi validado utilizando vários inibidores da fagocitose(Figura 4C)17. Os inibidores de polimerização de actina citochalasin D e jasplakinolide inibiram significativamente a fagocitose em 91% e 90%, respectivamente, quando pré-incubado por 1h antes da fagocitose. O robusto Z' do ensaio quando a citochalasina D ou jasplakinolide são utilizadas como controles negativos é calculada como 0,7 e 0,8, respectivamente20. O inibidor de acidificação lysososome bafilomicina A1 reduziu significativamente a fagocitose em 31%, quando incubado 1h antes da fagocitose. O efeito mais fraco do inibidor de acidificação lisososome versus inibidores de actina sugere que a detecção da carga internalizada pode não exigir acidificação total do fagosome. A anexação recombinante V foi usada como controle para bloquear especificamente a fosfatidíserina exposta na superfície dos SH-SY5Ys, impedindo que receptores fagocíticos acessem o ligante, um importante sinal de "come-me". A adição de anexação recombinante V reduziu significativamente a fagocitose em 30%, quando adicionada a poços imediatamente antes da adição sh-SY5Y. Sh-SY5Ys fixos foram confirmados para expor fosfatidylserine, usando uma sonda fluorescente anexa V, enquanto sh-SY5Ys vivos foram negativos para coloração anexa em V(Figura 4D).
O receptor de fagocitose microglial TREM2 tem sido anteriormente mostrado importante para a fagocitose dos neurônios apoptóticos21. A mutação R47H do TREM2 é um gene de risco para o início tardio da doença de Alzheimer, e é hipótese para reduzir a ligação de ligante de TREM223. Com o objetivo de avaliar a função fagocítica de R47H TREM2 e TREM2 KO, o ensaio de fagocitose de alto teor de célula fixa foi realizado utilizando linhas isogênicas iPSC-macrófagos com WT/R47H/KO TREM217. Vários comprimentos de duração da fagocitose de 1 a 5 h foram testados, utilizando-se uma adição escalonada de carga fagocítica (40.000 SH-SY5Ys). O sinal resultante aumenta linearmente para 4h, nivelando ligeiramente a 5 h(Figura 5)17. A redução da taxa de fagocitose e da capacidade (% das células positivas spot) ficou evidente no KO TREM2 em comparação com a TMC, enquanto o mutante R47H TREM2 não apresentou fagocitose alterada. O defeito fagocítico nas células KO TREM2 não é fenocópido pela mutação R47H TREM2, aparentemente porque a função TREM2 é suficiente para suportar fagocitose normal.
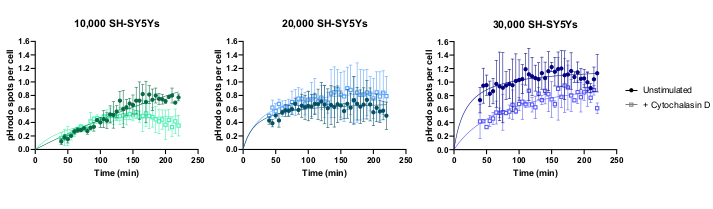
Figura 3: Exemplos de dados para ensaiode fagocitose de lapso de tempo de células vivas. Absorção de SH-SY5Ys mortos por macrófagos iPSC-macrófagos do tipo selvagem BIONi010-C (ECACC ID: 66540023) imagens em intervalos de 5 minutos por 3 h. Os tempos exibidos no gráfico são do início da fagocitose, incluindo os primeiros 40 minutos sem medição. O número médio de pontos por célula de três poços de réplica são plotados. A fagocitose de 10.000 SH-SY5Ys é inibida com 10 μM de citochalasina D com pré-tratamento de 1 h, enquanto maiores quantidades de SH-SY5Ys (20.000 e 30.000) têm quantificação subotimal de fagocitose. Desvio padrão ± médio (SD), N = 1 experimento. Clique aqui para ver uma versão maior desta figura.
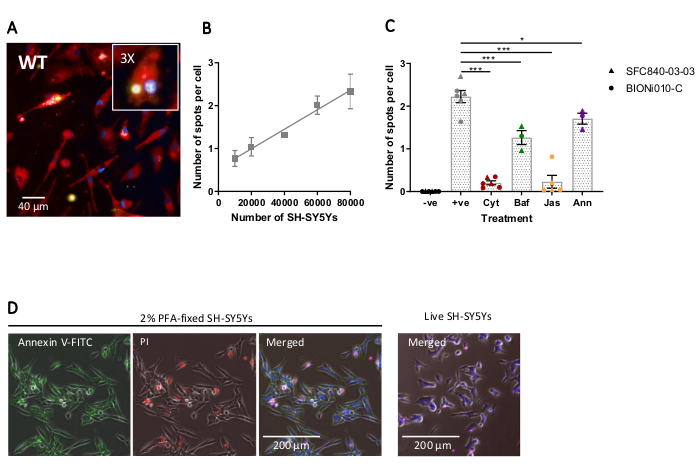
Figura 4: Otimização e validação de ensaio de fagocitose de alto teor de células fixas. (A) Imagem representativa de microscopia de alto teor de alto conteúdo da SH-SY5Ys phagocytos por iPSC-macrófagos do tipo selvagem BIONi010-C (ECACC ID: 66540023). Um ponto de tempo de 3h com 40.000 SH-SY5Ys é mostrado. Os canais de fluorescência são mesclados, com a mancha iPSC-macrófago mostrada como vermelho, núcleos como azul e SH-SY5Ys como amarelo. O painel de entrada é uma seção da imagem ampliada 3x. (B) O número de pontos por célula de SH-SY5Ys mortos phagocytos após 5h, usando diferentes quantidades de adição de carga para macrófagos do tipo selvagem iPSC. Erro padrão ± médio (SEM), para N = 3 colheitas. (C) A fagocitose (3 h) é inibida com 10 μM cytochalasin D (Cyt), 1 μM bafilomycin A1 (Baf), 1 μM jasplakinolide (com 1 h pré-tratamento; Jas), e 13 μg/mL anexo recombinante V (adicionado simultaneamente aos SH-SY5Ys mortos; Ann). os macrófagos iPSC sem sh-SY5Ys adicionados foram usados como um controle negativo (-ve), e o controle positivo (+ve) é iPSC-macrófagos não tratados com SH-SY5Ys adicionados. Os dados foram normalizados para a média para a repetição do experimento. Significa ± SEM, para N = 3-6 colheitas e com duas linhas celulares de tipo selvagem (SFC840-03-03, a caracterização desta linha é descrita em (Fernandes et al.21 e BIONi010-C). ANOVA de 1 via com o teste pós-hoc de Dunnett, comparações com células não tratadas. *p < 0,05, ***p < 0,001. (D) Mancha sh-SY5Ys recém-fixada uniformemente para exibição de fosfatidylserina (anexo V-FITC) e tem permeabilidade celular limitada (iodeto de propídio). Sh-SY5Ys vivos não mancham para anexar V-FITC ou iodeto de propídio, exceto para coloração focal presente nas poucas células mortas na cultura. Os números são reproduzidos com permissão da Alzheimer's Research & Therapy17. Clique aqui para ver uma versão maior desta figura.
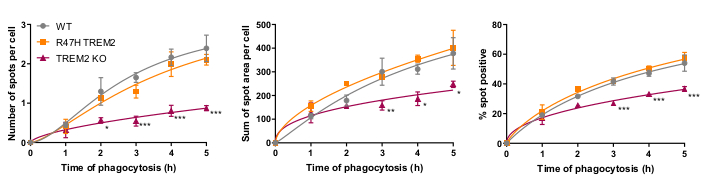
Figura 5: A fagocitose é reduzida em KO TREM2, mas não em R47H TREM2 iPSC-macrófagos. Ensaio de fagocitose de alto teor realizado com 40.000 SH-SY5Ys por poço com adições escalonadas. Os meios foram quantificados para os parâmetros: número de manchas por célula, soma de áreas spot (μm2) por célula e percentual de células contendo partículas fagocitas por campo. Os dados foram normalizados para significar para cada genótipo por experimento. Média ± SEM, para N = 3 colheitas. ANOVA de duas formas repetidas, teste pós-hoc de Dunnett, comparações em pares com o WT para cada vez: *p < 0,05, **p < 0,01, ***p < 0,001. Os números são reproduzidos com permissão da Alzheimer's Research & Therapy17. Clique aqui para ver uma versão maior desta figura.
Figura suplementar S1: Exemplo QC para preparação sh-SY5Ys. Os SH-SY5Ys dissociados foram fixados por 10 minutos com 0% (células vivas), 1% e 2% de paraformaldeído (PFA), depois lavados. As células foram manchadas com anexo V-FITC e iodeto de propidium (PI) e imediatamente medidas por citometria de fluxo. As parcelas de pontos de densidade de cores foram criadas no software de análise de citometria de fluxo, usando os controles de uma única mancha e sem manutenção para colocar um portão do quadrante. Os quadrantes são anotados com a porcentagem de eventos dentro desse quadrante. As células vivas estão principalmente no 4º trimestre, e as células fixas estão principalmente no 2º trimestre. Q1 = anexo V-/PI-, Q2 = anexo V+/PI+, Q3 = anexo V+/PI-, Q4 = anexo V-/PI- (células vivas). Clique aqui para baixar este Arquivo.
Vídeo suplementar: Fagocitose de lapso de tempo de célula viva. Vídeo de lapso de tempo representativo de SH-SY5Ys phagocytos por iPSC-macrófagos do tipo selvagem BIONi010-C (ECACC ID: 66540023). As imagens foram tiradas a cada 5 minutos por 3 h. O vídeo é cortado e roda a 3 quadros por segundo, mostrando as últimas 1,5 h do ensaio. Os SH-SY5Ys manchados de corante sensíveis ao ácido são mostrados em vermelho, intensidade de sinal aumentando com acidificação fagosome. Núcleos celulares manchados com Hoechst 33342 são mostrados em azul. Clique aqui para baixar este vídeo.
Discussão
A microglia tem funções importantes que afetam a iniciação e progressão de doenças neurodegenerativas, incluindo fagocitose de neurônios apoptóticos. A fagocitose microglial prejudicada e a fagocitose inadequada das sinapses têm sido associadas a doenças neurodegenerativas, embora os mecanismos e causalidades subjacentes não sejam bem compreendidos4,23. Este artigo descreve um ensaio de fagocitose para medir a fagocitose de células apoptóticas por macrófagos iPSC, com uma leitura de imagem de lapso de tempo de células vivas ou microscopia de alto conteúdo de células fixas, ou uma combinação de ambos em um único ensaio. Essa versatilidade significa que o ensaio pode ser usado para estudar eventos fagácticos individuais ao longo do tempo em alguns poços ou usado para triagem de alto conteúdo com múltiplas condições ou tratamentos. Uma vez que o ensaio de alto teor é fixado em um único ponto de tempo, várias placas de ensaio podem ser preparadas simultaneamente. O ensaio de alto teor tem utilidade potencial para caracterizar macrófagos/microglia com variantes genéticas associadas à doença ou triagem de inibidores de pequenas moléculas para alterações na fagocitose. O ensaio também pode ser facilmente adaptado para estudar fagocitose de outros modelos de microglia, ou potencialmente astrócitos. O ensaio de fagocitose pode potencialmente ser multiplexado com manchas de imagem de células vivas, por exemplo, mitocôndrias, cálcio ou indicadores ROS, e coloração imunofluorescente pós-fixação para proteínas de interesse pode ser realizada. Em comparação com os ensaios de fagocitose existentes que utilizam células neuronais apoptóticas, as principais vantagens que este protocolo confere é que a preparação da carga fagocítica é relativamente simples e rápida, e resulta em um produto uniforme. Outros ensaios induzem apoptose de neurônios ou SH-SY5Ys com S-nitroso-L-cisteína por 2 h25, ácido okadaico para 3 h22, staurospor para 4-16 h26,27,28,29 ou UV-irradiação para 24 h30, e pode resultar em células em diferentes estágios da apoptose. Além disso, as imagens de células vivas e leituras de imagens de alto conteúdo não foram descritas anteriormente, tanto quanto os autores sabem. A principal limitação do uso da fixação do paraformaldeído para preparar a carga fagocítica é que ela não recapitule totalmente o processo de apoptose, uma vez que a fixação impede que as células separem em corpos apoptóticos, que provavelmente serão fagocitados mais rapidamente devido ao seu tamanho menor. Não se sabe qual efeito a fixação tem sobre a secreção de sinais nucleotídeos de "me encontre" (por exemplo, ATP, UDP) da célula alvo que atraem fagocitos. Semelhante às células apoptóticas, os SH-SY5Ys fixos exibem alguma permeabilidade de membrana ao iodeto propidium. A permeabilidade da membrana está associada à liberação de sinais de "encontre-me"; no entanto, isso não foi estudado nos SH-SY5Ys fixos, e se o nucleotídeo for liberado muito rapidamente, eles serão lavados antes que os SH-SY5Ys sejam adicionados aos macrófagos iPSC.
O primeiro passo crítico no protocolo é a coloração de SH-SY5Ys mortos com um éster STP de um corante fluorescente vermelho sensível ao pH. Este corante reage rapidamente e covalentemente com aminas primárias livres na superfície dos SH-SY5Ys mortos. A duração da coloração não precisa ser otimizada; no entanto, deve-se tomar cuidado com o manuseio do corante antes da rotulagem. A reação de rotulagem não deve ser realizada em buffers contendo aminas livres. Além disso, há risco de precipitação se o estoque de DMSO for diluído em tampão aquoso frio ou em alta concentração final. Precipitados aparecerão como objetos escuros densos sob o microscópio. Além disso, a solução de corante sensível ao pH gruda em tubos regulares de centrífugas plásticas e lava lentamente; portanto, são recomendados tubos de baixa ligação para a etapa de rotulagem. O uso de um corante sensível ao pH, em vez de um corante permanentemente fluorescente, auxilia na identificação de partículas engolfadas, contra partículas que vizinhos à membrana plasmática. Uma vez que há alguma fluorescência no pH neutro, a densidade da carga fagocítica e dos macrófagos iPSC precisam ser mantidos baixos o suficiente para uma segmentação precisa, embora alto o suficiente para que numerosos eventos fagocíticos sejam capturados. A microscopia de alto teor foi capaz de identificar com precisão a fagocitose com uma densidade média de carga no poço (mais de 2 SH-SY5Ys por iPSC-macrófago). Por outro lado, devido à sensibilidade mais fraca do microscópio no espectro vermelho profundo, a segmentação de macrófagos iPSC nos dados de imagem de lapso de tempo de células vivas foi menos confiante e foi necessário usar uma densidade muito baixa de carga para reduzir a probabilidade de falsos positivos (1 SH-SY5Y para cada dois macrófagos iPSC). A validação da segmentação adequada e da densidade da carga deve ser realizada com comparações entre poços não tratados e citochalasin D tratados. Em um ensaio bem otimizado, a citochalasina D deve reduzir o número médio de manchas por célula em 90% em relação a amostras não tratadas.
Outro passo crítico no protocolo é a coloração iPSC-macrófago, que permite que a célula seja identificada e segmentada na análise de imagens para que quaisquer SH-SY5Ys externos sejam excluídos da contagem. O corante recomendado é permeante celular, convertido em um produto fluorescente insolúvel dentro do citoplasma, fixável e não tóxico (ver Tabela de Materiais). A etapa de coloração foi otimizada para o uso de macrófagos iPSC com o ensaio de fagocitose de imagem de alto teor, e sugerimos que ele deve ser retim otimizado se outros tipos de células forem usados. A duração da coloração celular pode ser aumentada para melhorar a deposição do produto fluorescente insolúvel dentro das células. Se a concentração de corante for otimizada, deve-se tomar cuidado para evitar níveis tóxicos do veículo solvente orgânico.
O terceiro fator crítico para o sucesso do ensaio é a análise dos dados. Os gasodutos de análise fornecidos destinam-se a ser de orientação e não prescritivo, pois diferenças na intensidade de coloração ou morfologia celular podem reduzir a eficácia da segmentação dos gasodutos conforme escrito. Algumas otimizações serão, portanto, necessárias, com testes do pipeline sobre controles positivos e negativos adequados, e os parâmetros que devem ser otimizados estão indicados no texto do protocolo. Os controles negativos devem incluir uma condição em que os macrófagos iPSC são pré-tratados com um potente inibidor de fagocitose, como a citochalasina D antes da adição de SH-SY5Ys. Outro possível controle negativo é a adição dos SH-SY5Ys a poços não tratados anteriormente de macrófagos iPSC no final do ensaio, 10 minutos antes da fixação, o que permite algum ajuste da carga, mas é muito curto para que ocorra uma quantidade considerável de fagocitose. Um evento de fagocitose é definido como um objeto vermelho-fluorescente dentro das bordas de um iPSC-macrophage, definido pelo algoritmo de software usando o canal de fluorescência vermelho profundo. Se a segmentação das células for ruim(Figura 2),muitas SH-SY5Ys não fagocytosed em proximidade com iPSC-macrófagos podem ser erroneamente incluídas na análise, ou seja, falsos positivos. O fator mais importante para alcançar uma boa segmentação é o delineamento rigoroso dos macrófagos iPSC. A segmentação para ambas as análises é automatizada, portanto não é possível obter uma segmentação perfeita para cada célula; no entanto, alguns parâmetros podem ser ajustados para tornar a segmentação mais ideal, usando algumas imagens de teste como referência. O controle de citochalasina D é importante para avaliar a segmentação ideal, pois um alto número de eventos fagocíticos detectados nesta condição indica que a segmentação é sub-ideal. A otimização do pipeline de análise de dados deve ser idealmente repetida até que o número de eventos fagocíticos por célula seja 80%-90% menor na condição de citochalasina D versus nenhum inibidor.
Os problemas com o ensaio de fagocitose que são mais propensos a ocorrer são: (1) fluorescência fraca sensível ao pH em controles positivos, (2) distribuição esparsa ou desigual de macrófagos no final do ensaio, ou (3) alto número de falso-positivos na análise de SH-SY5Ys não fagoctos. A solução de problemas da fluorescência fraca sensível ao pH deve primeiro verificar que a coloração dos SH-SY5Ys resultou em uma pelota celular com uma cor magenta forte. Se a cor for fraca, certifique-se de que um estoque de corante fresco seja usado, certifique-se de que o buffer de rotulagem esteja livre de amina, adicione uma lavagem extra aos SH-SY5Ys antes de colorir, verifique se o número correto de SH-SY5Ys foi manchado, certifique-se de que não há precipitações de corante e otimize a concentração de rotulagem do corante. Se os SH-SY5Ys estiverem fortemente manchados, verifique se a concentração adicionada à placa de ensaio está correta e certifique-se de que os macrófagos iPSC são saudáveis e não muito velhos. O segundo tipo de problema, a distribuição desigual do macrófago, pode resultar da perda de células durante a tubulação e devem ser tomadas medidas para reduzir as forças de tubulação experimentadas pelas células, evitando pontas estreitas. Se o problema permanecer, reduza o tempo de incubação do carregamento dos macrófagos iPSC com corante permeante celular. O terceiro problema, em relação à inclusão errônea de partículas não fagocitas na análise, indica que é necessária mais otimização do pipeline de análise. A solução de problemas deve se concentrar em primeiro lugar na segmentação celular e se o software está incluindo objetos adjacentes. Parâmetros específicos que podem ser ajustados são sugeridos nas notas abaixo das etapas relevantes (etapas 6.1.11-6.1.15 para a análise de lapso de tempo de célula viva e etapas 6.2.4-6.2.8 para a análise de alto teor de conteúdo). Se a segmentação celular não puder ser melhorada, a análise de alto teor tem um passo extra (etapa 6.2.8) que exclui macrófagos iPSC segmentados incorretamente. Além disso, o módulo que filtra pontos aceitos de fluorescência sensível ao pH dentro de macrófagos iPSC pode ser otimizado, aumentando a intensidade limiar dos objetos aceitos, o que deve ajudar a excluir sh-SY5Ys não fagocitados (etapa 6.1.17 para a análise de lapso de tempo de células vivas e passo 6.2.11 para a análise de alto teor).
Desenvolvemos dois tipos de leitura de microscopia para o ensaio de fagocitose que cada um tem vantagens e limitações. A imagem de lapso de tempo de células vivas tem o mérito de fornecer informações extras sobre cinética de fagocitose e está mais amplamente disponível do que plataformas de imagem de alto conteúdo. O software de código aberto recomendado é agnóstico para a fonte do microscópio e pode ser usado com qualquer microscópio fluorescente de boa qualidade, com ou sem capacidade de lapso de tempo de célula viva. A principal limitação da imagem de células vivas é a sensibilidade e a óptica limitadas, o que torna mais desafiador detectar e executar uma boa segmentação de macrófagos iPSC. Essa limitação pode ser atenuada, aumentando a duração da coloração iPSC-macrófago, ou mudando para um microscópio mais sensível, se disponível. O ensaio de phagocytosis de imagem de alto conteúdo é a leitura recomendada se um sistema de imagem de alto conteúdo estiver disponível. Sistemas de imagem de alto teor de conteúdo permitem maior rendimento e dados mais confiáveis, permitindo que este ensaio seja usado para triagem, no qual seria esperado um Z' robusto de ≥0,7 para a saída "número de pontos por célula"20. Em comparação com o método de lapso de tempo de células vivas, a leitura de microscopia de alto conteúdo tem maior sensibilidade, maior grau de automação e velocidade, mais poços e campos de imagem podem ser processados e imagens confocal de alta resolução são produzidas. A segmentação celular é mais eficaz com boas imagens, e a segmentação é adicionalmente auxiliada pelo software de análise de imagens de alto conteúdo, fornecendo mais métodos de segmentação celular adequados para células altamente irregulares. O software de análise de imagens de alto teor de conteúdo também calculou mais parâmetros de fagocitose, em comparação com o software de código aberto, como a porcentagem de células fagocíticas. A principal limitação do ensaio de fagocitose de alto teor é de custo e acessibilidade do sistema de imagem e software de análise.
Em conclusão, o ensaio quantitativo de fagocitose apresentado neste artigo é uma ferramenta útil para modelar a fagocitose de microglia de neurônios mortos in vitro. As microglias são modeladas por macrófagos iPSC e os neurônios mortos são modelados por SH-SY5Ys fixos em paraformaldeído. Embora não sejam os modelos de neurônios mais autênticos e mortos/apoptóticos publicados, estes são fáceis de preparar e escaláveis. O ensaio em si é altamente versátil, com dois tipos de leitura de imagem detalhados, e tem potencial para ser adaptado para uso com diferentes modelos de monocultura microglia/macrófago, ou um tipo de célula diferente para atuar como carga fagocítica. A leitura de imagens de alto teor é vantajosa para a obtenção de dados quantitativos e pode ser dimensionada para avaliar pequenos moduladores de moléculas de fagocitose, ou tela variantes genéticas nos macrófagos iPSC. No entanto, uma vez que os sistemas de imagem de alto conteúdo são caros e pesados em dados, uma leitura alternativa de imagem foi incluída no protocolo usando um microscópio de lapso de tempo de células vivas, que poderia ser substituído por qualquer microscópio convencional de fluorescência de boa qualidade, se necessário.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores agradecem ao Dr. Val Millar e ao Dr. Sohaib Nizami por sua assistência com microscopia de alto conteúdo, e o Dr. Daniel Ebner pelo acesso aos microscópios de alto conteúdo. Além disso, os autores agradecem à Dra. Este trabalho foi apoiado pelo Alzheimer's Research UK Oxford Drug Discovery Institute (ARUK ODDI, referência de subvenção ARUK-2020DDI-OX), com apoio adicional à James Martin Stem Cell Facility Oxford (S.A.C.) da Oxford Martin School LC0910-004; Monument Trust Discovery Award do Reino Unido de Parkinson (J-1403); a MRC Dementias Platform UK Stem Cell Network Capital Equipment MC_EX_MR/N50192X/1, Partnership MR/N013255/1 e Momentum MC_PC_16034 Awards.
Materiais
| Name | Company | Catalog Number | Comments |
| 15 mL conical centrifuge tube | Falcon | 352096 | For centrifugation of cells |
| 2-20 µL, 20-200 µL, 100-1000 µL single-channel micropipettes | |||
| 2-mercaptoethanol 50 mM | Gibco | 31350010 | Component of Factory media |
| 4% paraformaldehyde in PBS | Alfa Aesar | J61899 | For fixation of cells |
| 6-well plate, tissue culture treated | |||
| AggreWell-800 24-well plate | STEMCELL Technologies | 34815 | Microwell low-adherence 24-well plate for formation of embryoid bodies |
| Annexin V-FITC Apoptosis Staining / Detection Kit | Abcam | ab14085 | Kit for annexin V-FITC staining , as an assay for quality control of fixed SH-SY5Ys. Kit contains annexin binding buffer, annexin V-FITC, and propidium iodide. |
| Automated cell counter | |||
| Benchtop centrifuge | |||
| Benchtop microcentrifuge | |||
| CellCarrier-96 Ultra Microplates, tissue culture treated, black, 96-well with lid | Perkin Elmer | 6055302 | 96-well tissue culture (TC)-treated microplate with black well walls and an optically-clear bottom, for phagocytosis assay |
| CellProfiler software | Open-source software for analysis of phagocytosis images obtained by live-cell time-lapse microscope. Download for free from website (http://cellprofiler.org/), this protocol used version 2.2.0. | ||
| CellTracker Deep Red dye | Thermo Fisher | C34565 | Deep red-fluorescent, cell-permeant, succinimidyl ester-reactive dye for staining cytoplasm of iPS-macrophages. Dissolve CellTracker Deep Red dye in DMSO to 2 mM (1.4 mg/mL). Use at 1 μM, by dilution of DMSO stock with Macrophage media. |
| Class 2 laminar air flow safety cabinet | |||
| CO2 gas bottle | Accessory for EVOS FL Auto | ||
| CO2 incubator, set to 37°C and 5 % CO2 | |||
| Columbus Image Data Storage and Analysis System | Perkin Elmer | Columbus | Data storage and analysis platform for Opera Phenix. Supports all major high content screening instruments. |
| Cytochalasin D | Cayman | 11330 | Negative control treatment for phagocytosis assay. Reconstitute in DMSO to 10 mM and store aliquots at -20°C, avoid further freeze-thaw cycles. Use at final concentration 10 µM. |
| DMEM/F12 | Gibco | 11320074 | Component of SH-SY5Y media |
| DMSO | Sigma | D8418 | Solvent for CellTracker and pHrodo dyes |
| EVOS FL Auto Imaging System | Thermo Fisher | AMF4300 | Live-cell time-lapse imaging microscope |
| EVOS Light Cube CY5 | Thermo Fisher | AMEP4656 | Accessory for EVOS FL Auto |
| EVOS Light Cube DAPI | Thermo Fisher | AMEP4650 | Accessory for EVOS FL Auto |
| EVOS Light Cube RFP | Thermo Fisher | AMEP4652 | Accessory for EVOS FL Auto |
| EVOS Onstage Incubator | Thermo Fisher | AMC1000 | Accessory for EVOS FL Auto |
| Fetal Bovine Serum | Sigma | F4135 | Component of SH-SY5Y media |
| Flow cytometer | |||
| Flow cytometry analysis software | |||
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Invitrogen | A1413302 | hESC-qualified basement membrane matrix for iPSC culture |
| GlutaMAX Supplement | Gibco | 35050-038 | Component of both Factory and Macrophage media |
| HBSS | Lonza | BE 10-547F | Hank’s balanced salt solution for washing steps |
| Human recombinant BMP4 | Gibco | PHC9534 | Component of Embryoid Body media |
| Human recombinant IL-3 | Gibco | PHC0033 | Component of both Factory and Macrophage media |
| Human recombinant SCF | Miltenyi Biotech | 130-096-695 | Component of Embryoid Body media |
| Human recombinant VEGF | Gibco | PHC9394 | Component of Embryoid Body media |
| Live Cell Imaging Solution | Thermo Fisher | A14291DJ | Phenol red-free HEPES-buffered media for labelling dead SH-SY5Ys |
| Low protein binding 2 mL tubes | Eppendorf | 30108.132 | For staining SH-SY5Ys |
| M-CSF | Thermo Fisher | PHC9501 | Component of both Factory and Macrophage media |
| mTeSR1 Medium | STEMCELL Technologies | 85850 | iPSC media |
| Multichannel 20-200 uL pipette | For liquid handling of 96-well plate | ||
| NucBlue Live ReadyProbes Reagent | Thermo Fisher | R37605 | Hoechst 33342 formulation in a dropper bottle for staining nuclei of iPS-macrophages, use 0.5 drops/mL in Macrophage media. |
| Opera Phenix High-Content Screening System | Perkin Elmer | HH14000000 | High-content imaging microscope, used with Harmony software version 4.9. |
| Penicillin-Streptomycin | Gibco | 15140-122 | Component of Factory, Macrophage, and SH-SY5Y media |
| pHrodo iFL Red STP-Ester | Thermo Fisher | P36011 | pH-sensitive red fluorescent dye for labelling dead SH-SY5Ys. Reconstitute pHrodo iFL Red STP Ester powder in DMSO to a 5 mg/mL concentration. For each 1 million SH-SY5Ys, add 2.5 μL (12.5 μg) of pHrodo iFL Red STP Ester stock to pre-warmed cells suspended in Live Cell Imaging Solution. |
| Serological pipette filler | |||
| T175 flask, tissue culture treated | Vessel for differentiations of iPSC-macrophage precursors, known as "Factories" | ||
| T75 flask | Vessel for SH-SY5Y culture | ||
| Transparent plate sealers | Greiner Bio-One | 676001 | For assay plate storage and transportation |
| TrypLE Express (1X), no phenol red | Gibco | 12604013 | Cell dissociation buffer containing recombinant trypsin-like enzymes and 1.1 mM EDTA, use neat. |
| Water bath, set to 37°C | |||
| X-VIVO 15 Medium with L-glutamine, gentamicin, and phenol red | Lonza | BE04-418F | Component of Factory and Macrophage media |
| X-VIVO 15 Medium with L-glutamine; without gentamicin or phenol red | Lonza | 04-744Q | Phenol red-free macrophage media, for use in phagocytosis without additives or growth factors |
Referências
- Hochreiter-Hufford, A., Ravichandran, K. S. Clearing the dead: apoptotic cell sensing, recognition, engulfment, and digestion. Cold Spring Harbour Perspectives in Biology. 5, 008748 (2013).
- Freeman, S. A., Grinstein, S. Phagocytosis: receptors, signal integration, and the cytoskeleton. Immunological Reviews. 2262, 193-215 (2014).
- Hickman, S., Izzy, S., Sen, P., Morsett, L., El Khoury, J. Microglia in neurodegeneration. Nature Neuroscience. 21 (10), 1359-1369 (2018).
- Galloway, D. A., Phillips, A. E. M., Owen, D. R. J., Moore, C. S. Phagocytosis in the brain: Homeostasis and disease. Frontiers in Immunology. 10, 790 (2019).
- Nizami, S., Hall-Roberts, H., Warrier, S., Cowley, S. A., Di Daniel, E. Microglial inflammation and phagocytosis in Alzheimer's disease: potential therapeutic targets. British Journal of Pharmacology. 176 (18), 3515-3532 (2019).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), 712-716 (2016).
- Neher, J. J., et al. Inhibition of microglial phagocytosis is sufficient to prevent inflammatory neuronal death. The Journal of Immunology. 186 (8), 4973-4983 (2011).
- Brown, G. C., Neher, J. J. Microglial phagocytosis of live neurons. Nature Reviews Neuroscience. 15 (4), 209-216 (2014).
- Scott-Hewitt, N., et al. Local externalization of phosphatidylserine mediates developmental synaptic pruning by microglia. The EMBO Journal. 39 (16), 105380 (2020).
- Li, T., et al. A splicing isoform of GPR56 mediates microglial synaptic refinement via phosphatidylserine binding. The EMBO Journal. 39 (16), 104136 (2020).
- Sapar, M. L., et al. Phosphatidylserine externalization results from and causes neurite degeneration in Drosophila. Cell Reports. 24 (9), 2273-2286 (2018).
- Skjesol, A., et al. The TLR4 adaptor TRAM controls the phagocytosis of Gram-negative bacteria by interacting with the Rab11-family interacting protein 2. PLOS Pathogens. 15 (3), 1007684 (2019).
- Wong, K., Li, X., Ma, Y. Paraformaldehyde induces elevation of intracellular calcium and phosphatidylserine externalization in platelets. Thrombosis Research. 117 (5), 537-542 (2006).
- van Wilgenburg, B., Browne, C., Vowles, J., Cowley, S. A. Efficient, long term production of monocyte-derived macrophages from human pluripotent stem cells under partly-defined and fully-defined conditions. PLoS One. 8 (8), (2013).
- Haenseler, W., et al. A highly efficient human pluripotent stem cell microglia model displays a neuronal-co-culture-specific expression profile and inflammatory response. Stem Cell Reports. 8 (6), 1727-1742 (2017).
- Buchrieser, J., James, W., Moore, M. D. Human induced pluripotent stem cell-derived macrophages share ontogeny with MYB-independent tissue-resident macrophages. Stem Cell Reports. 8 (2), 334-345 (2017).
- Hall-Roberts, H., et al. TREM2 Alzheimer's variant R47H causes similar transcriptional dysregulation to knockout, yet only subtle functional phenotypes in human iPSC-derived macrophages. Alzheimer's Research & Therapy. 12, 151 (2020).
- Friedman, B. A., et al. Diverse brain myeloid expression profiles reveal distinct microglial activation states and aspects of Alzheimer's disease not evident in mouse models. Cell Reports. 22 (3), 832-847 (2018).
- Aziz, M., Yang, W. L., Wang, P. Measurement of phagocytic engulfment of apoptotic cells by macrophages using pHrodo succinimidyl ester. Current Protocols in Immunology. 100, 1-8 (2013).
- Atmaramani, R., Pancrazio, J. J., Black, B. J. Adaptation of robust Z' factor for assay quality assessment in microelectrode array based screening using adult dorsal root ganglion neurons. Journal of Neuroscience Methods. 339, 108699 (2020).
- Fernandes, H. J. R., et al. ER Stress and Autophagic Perturbations Lead to Elevated Extracellular α-Synuclein in GBA-N370S Parkinson's iPSC-Derived Dopamine Neurons. Stem Cell Reports. 6 (3), 342-356 (2016).
- Takahashi, K., Rochford, C. D. P., Neumann, H. Clearance of apoptotic neurons without inflammation by microglial triggering receptor expressed on myeloid cells-2. Journal of Experimental Medicine. 201 (4), 647-657 (2005).
- Kober, D. L., Brett, T. J. TREM2-ligand interactions in health and disease. Journal of Molecular Biology. 429 (11), 1607-1629 (2017).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), 712-716 (2016).
- Witting, A., Müller, P., Herrmann, A., Kettenmann, H., Nolte, C. Phagocytic clearance of apoptotic neurons by microglia/brain macrophages in vitro: Involvement of lectin-, integrin-, and phosphatidylserine-mediated recognition. Journal of Neurochemistry. 75 (3), 1060-1070 (2000).
- Hsieh, C. L., et al. A role for TREM2 ligands in the phagocytosis of apoptotic neuronal cells by microglia. Journal of Neurochemistry. 109 (4), 1144-1156 (2009).
- Beccari, S., Diaz-Aparicio, I., Sierra, A. Quantifying microglial phagocytosis of apoptotic cells in the brain in health and disease. Current Protocols in Immunology. 122 (1), 49 (2018).
- Diaz-Aparicio, I., et al. Microglia actively remodel adult hippocampal neurogenesis through the phagocytosis secretome. Journal of Neuroscience. 40 (7), 1453-1482 (2020).
- Shirotani, K., et al. Aminophospholipids are signal-transducing TREM2 ligands on apoptotic cells. Scientific Reports. 9 (1), 1-9 (2019).
- Garcia-Reitboeck, P., et al. Human induced pluripotent stem cell-derived microglia-like cells harboring TREM2 missense mutations show specific deficits in phagocytosis. Cell Reports. 24 (9), 2300-2311 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados