Method Article
In vitro Quantitative Imaging Assay für Phagozytose toter Neuroblastomzellen durch iPSC-Makrophagen
In diesem Artikel
Zusammenfassung
Neurodegenerative Erkrankungen sind mit dysregulierten Mikrogliafunktionen verbunden. Dieser Artikel beschreibt einen In-vitro-Assay der Phagozytose von Neuroblastomzellen durch iPSC-Makrophagen. Quantitative Mikroskopie-Auslesungen werden sowohl für die Zeitraffer-Bildgebung mit lebenden Zellen als auch für die High-Content-Bildgebung mit festen Zellen beschrieben.
Zusammenfassung
Mikroglia orchestrieren Neuroimmunreaktionen bei mehreren neurodegenerativen Erkrankungen, einschließlich Parkinson und Alzheimer. Mikroglia klären tote und sterbende Neuronen durch den Prozess der Efferozytose, einer spezialisierten Form der Phagozytose. Die Phagozytosefunktion kann durch umweltbedingte oder genetische Risikofaktoren gestört werden, die Mikroglia beeinflussen. Dieser Artikel stellt ein schnelles und einfaches In-vitro-Mikroskopieprotokoll zur Untersuchung der mikroglialen Efferozytose in einem induzierten pluripotenten Stammzellmodell (iPSC) von Mikroglia unter Verwendung einer humanen Neuroblastomzelllinie (SH-SY5Y) vor, die mit einem pH-sensitiven Farbstoff für die phagozytäre Ladung markiert ist. Das Verfahren führt zu einer hohen Ausbeute an toten Neuroblastomzellen, die Oberflächenphosphatidylserin aufweisen, das von Phagozyten als "Eat-Me" -Signal erkannt wird. Der 96-Well-Plattenassay eignet sich für die Zeitrafferbildgebung von Lebendzellen, oder die Platte kann vor der weiteren Verarbeitung erfolgreich fixiert und durch High-Content-Mikroskopie quantifiziert werden. Die Fixed-Cell-High-Content-Mikroskopie ermöglicht es, den Assay für das Screening von niedermolekularen Inhibitoren oder die Beurteilung der phagozytischen Funktion genetischer Varianten-iPSC-Linien zu skalieren. Während dieser Assay entwickelt wurde, um die Phagozytose ganzer toter Neuroblastomzellen durch iPSC-Makrophagen zu untersuchen, kann der Assay leicht für andere Ladungen angepasst werden, die für neurodegenerative Erkrankungen relevant sind, wie Synaptosomen und Myelin und andere phagozytäre Zelltypen.
Einleitung
Mikroglia sind Makrophagen, die im Gehirngewebe ansässig sind, und ihre Funktionen umfassen Immunüberwachung, Koordination von Entzündungsreaktionen auf Verletzungen / Infektionen, synaptische Umgestaltung und Phagozytose von toten Zellen, Myelin, Proteinaggregaten und Krankheitserregern. Phagozytose ist der Prozess, bei dem Mikroglia Fracht mit Oberflächenrezeptoren erkennen und ihr Zytoskelett reorganisieren, um das Objekt zu einem Phagosom zu verschlingen, das dann mit Lysosomen zum Abbau der Ladung verschmilzt. Gesunde Mikroglia phagozytose apoptotische Gehirnzellen, um sie zu entfernen, bevor sie nekrotisch werden1. Die Phagozytose apoptotischer Zellen wird auch als Efferozytose bezeichnet und erfordert die Anzeige eines Phosphatidylserin-"Eat-me"-Signals durch die sterbende Zelle2. Zahlreiche Mikrogliarezeptoren binden direkt an Phosphatidylserin, darunter TIM-4, BAI1, Stabilin-2 und TREM2. Mikrogliale TAM-Rezeptoren (z. B. MERTK) und Integrine binden indirekt an Phosphatidylserin, wobei die Zusatzproteine GAS6 bzw. MFG-E8 verwendet werden. Andere "Eat-Me" -Signale können für die Erkennung sterbender Zellen notwendig sein, dazu gehören Veränderungen der Glykosylierung oder ladung von Oberflächenproteinen; Expression der intrazellulären Proteine ICAM3, Calreticulin, Annexin-I an der Zelloberfläche; oxidiertes LDL; oder Beschichtung der apoptotischen Zelle durch mikrogliaproduziertes KomplementC1q1,2.
Neurodegenerative Erkrankungen, einschließlich Parkinson-Krankheit, Alzheimer-Krankheit, frontotemporale Demenz und amyotrophe Lateralsklerose, wurden mit einer Beeinträchtigung der Mikrogliafunktion in Verbindung gebracht, einschließlich einer Anhäufung von Hirnabfallprodukten wie toten Zellen, Myelinfragmenten und Proteinaggregaten und übertriebenen Entzündungsreaktionen auf diese Reize3. Phagozytose kann bei neurodegenerativen Erkrankungen beeinträchtigt sein und zur Pathologie beitragen, aufgrund einer Kombination von Alterung, Entzündung oder spezifischen genetischen Risikovarianten4,5. Auf der anderen Seite gibt es auch Hinweise aus Tiermodellen neurodegenerativer Erkrankungen, dass Mikroglia ungeeignet lebensfähige Neuronen oder Synapsen phagozytose können6,7,8. Der Mechanismus wird wahrscheinlich durch die Phosphatidylserin-Anzeige beschädigter Neurite ausgelöst, die direkt von den mikroglialen Phagozytoserezeptoren TREM2 oder GPR56 erfasst wird, oder indirekt durch lösliche Komplement-C1q-Beschichtung der mit Phosphatidylserin angereicherten Membran, was zu CR3-vermittelter Phagozytose9,10,11führt .
In-vitro-Assays der Phagozytosefunktion, z. B. zur Beurteilung der phänotypischen Auswirkungen einer genetischen Risikovariante in Mikroglia, werden häufig mit nicht-physiologischen Ladungen wie Latexperlen durchgeführt4. Fluoreszierend markierte Bakterien und Zymosan werden ebenfalls verwendet, die physiologisch, aber für neurodegenerative Erkrankungen nicht relevant sind. Nicht-physiologische phagozytäre Ladungen können verwendet werden, um Defekte in der grundlegenden Maschinerie der phagozytären Verschlingung zu erkennen, aber nicht den ersten "Erkennungsschritt" in der Phagozytose apoptotischer Neuronen genau zu modellieren. Die Größe, Form, Steifigkeit und Art der Ladung bestimmen auch die intrazellulären Signalwege, die aktiviert werden, was zu unterschiedlichen Ergebnissen des Mikroglia-Aktivierungszustands führt. Zum Beispiel sind E.coli-Bakterien im Gegensatz zu menschlichen Zellen klein und steif, und die Lipopolysaccharide auf ihrer Oberfläche werden vom Toll-like-Rezeptor 4 (TLR4) erkannt, der Phagozytose und entzündungsfördernde Signalwege aktiviert2,12.
Im Rahmen von Neurodegenerativen Krankheitsstudien würde eine relevantere phagozytische Ladung Phosphatidylserin auf Plasmamembranen von Säugetieren aufweisen und wäre idealerweise menschlich und neuronal, um Signale einzubeziehen, auf die Mikroglia wahrscheinlich stoßen werden. Für dieses Phagozytose-Protokoll wurde die humane Neuroblastom-Zelllinie SH-SY5Y als leicht zu kulturierendes Neuronenmodell gewählt. Permanente Oberflächen-Phosphatidylserin-Display wurde künstlich durch Paraformaldehyd induziert, von dem zuvor gezeigt wurde, dass es Phosphatidylserin-Display von Blutplättchen verursacht13. Für das Mikrogliazellmodell wurden humane iPSC-Makrophagen verwendet, die das Ontogen- und Transkriptionsprofil menschlicher Mikroglia nachahmen und phagozytisch kompetent sind14,15,16,17. iPSC-Makrophagen sind nicht das authentischste verfügbare Mikrogliamodell, z. B. ahmen sie keine Mikrogliamorphologie nach; Man kann es jedoch durch ein authentischeres Monokultur-iPSC-Modell von Mikroglia ersetzen, wenn gewünscht, wie Haenseler et al.15. Humane iPSC-Modelle sind primären Nagetiermikroglia für die Untersuchung der Neurodegeneration vorzuziehen, da Bedenken hinsichtlich der begrenzten Überlappung der Mikroglia-Transkriptionsmodule bestehen, die in neurodegenerativen Erkrankungsgeweben von Mensch und Maus beobachtet wurden18. Die toten SH-SY5Ys werden mit einem säureempfindlichen Farbstoff gefärbt, der bei neutralem pH-Wert schwach fluoresziert und nach Phagozytose stärker in den Phagolysosomen von iPSC-Makrophagen fluoresziert. Die Verwendung eines säureempfindlichen Farbstoffs verbessert die Genauigkeit der Erkennung phagozytärer Ereignisse, mit Vielseitigkeit für verschiedene Auslesungen von lebenden und fixierten Makrophagen19. Dieses Protokoll beschreibt sowohl die Zeitrafferbildgebung von Phagozytose mit Lebendzellen als auch einen festen High-Content-Bildgebungstest für Phagozytose mit den gleichen Zellvorbereitungsschritten vor dem Auslesen (Abbildung 1).
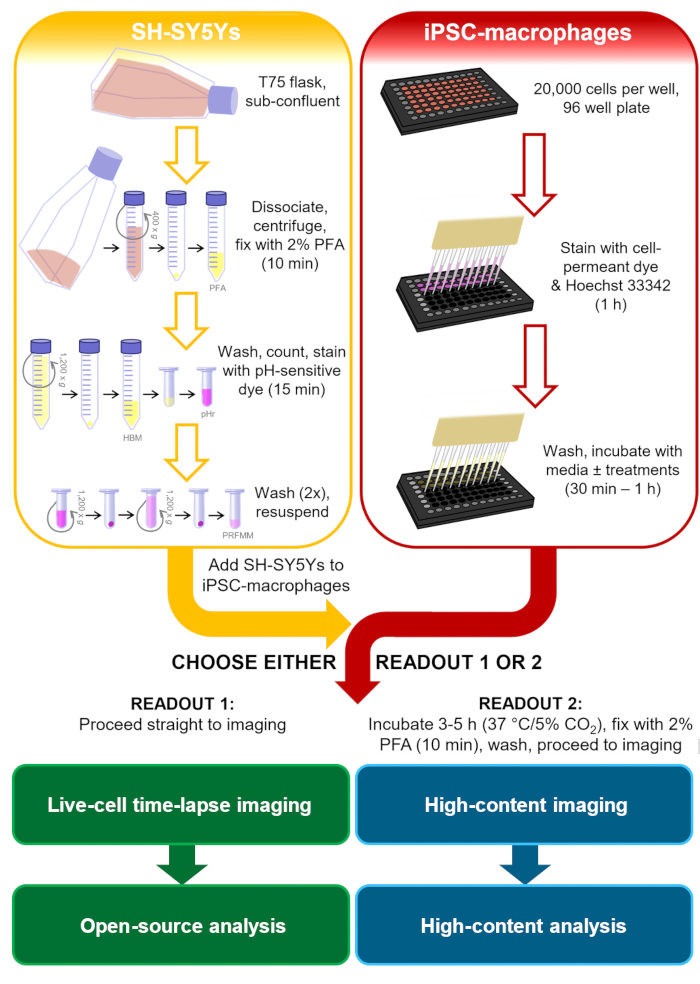
Abbildung 1: Schematische Darstellung der Methodik. Gliederung des Phagozytose-Assays, bei dem die Herstellung der SH-SY5Ys und die Färbung der iPSC-Makrophagen parallel durchgeführt wird und dann die SH-SY5Ys auf die iPSC-Makrophagen pipettiert werden. Entweder wird sofort eine Live-Cell-Zeitraffer-Bildgebung durchgeführt, oder die Zellen werden bei 37 °C/5% CO2 für die erforderliche Dauer inkubiert und vor der Durchführung einer Hochgehaltsmikroskopie fixiert. PFA: Paraformaldehyd, HBM: phenolrotfreie HEPES-gepufferte Medien, pHr: pH-sensitiver rot fluoreszierender Farbstoff STP Esterlösung, PRFMM: phenolrotfreie Makrophagenmedien. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protokoll
Das Protokoll folgt den Richtlinien für die Verwendung menschlicher iPS-Zelllinien, die an der Universität Oxford, Oxford Parkinson's Disease Centre (Ethikkommission: National Health Service, Health Research Authority, NRES Committee South Central, Berkshire, UK (REC 10/H0505/71)) abgeleitet wurden. Menschliche iPS-Geräte sind in einer Sicherheitswerkbank der Klasse II zu handhaben, um den Arbeiter vor möglichen Zufälligen zu schützen. Lokale, nationale und EU-Gesundheits- und Sicherheitsvorschriften müssen eingehalten werden. Die Zusammensetzung der Zellkulturmedien ist in Tabelle 1 aufgeführt,und alle Materialien sind in der ergänzenden Materialtabelleaufgeführt.
1. Zellkultur vor dem Experiment
- Kultur-iPSCs in iPSC-Medien (Tabelle 1) in 6-Well-Platten, vorbeschichtet mit einer hESC-qualifizierten Basalmembranmatrix, subkonfluent und mit einer niedrigen Durchgangszahl.
- Unterscheiden Sie menschliche iPSCs von iPSC-Makrophagenvorläufern: Säen Sie vier Millionen iPSC in eine Mikrowell-24-Well-Platte mit geringem Adhärenz mit 2 ml embryoiden Körpermedien (Tabelle 1), um die embryoide Körperbildung zu fördern und 75% Medienwechsel täglich für 5-6 Tage durchzuführen. Embryoide Körper werden in T175-Kolben überführen, etwa 150 embryoide Körper pro Kolben, die 20 ml Fabrikmedien enthalten (Tabelle 1). Wöchentlich durch Zugabe von 10-20 ml Fabrikmedien füttern.
HINWEIS: iPSC-Makrophagenvorläufer treten nach ca. 2-3 Wochen in den Überstand aus und werden mehrere Monate lang kontinuierlich produziert. Für dieses Experiment ist es vorzuziehen, Zellen ab ca. 6 Wochen nach der Einrichtung der Differenzierungsfabriken zu verwenden. Früher geerntete iPSC-Makrophagen können eine gewisse proliferative Kapazität behalten und sind weniger haftend, was sogar die Aussaat bei einer niedrigen Zelldichte verhindert. Eine obere Altersgrenze für die Phagozytosefähigkeit wurde nicht festgelegt. - Unterscheidung von iPSC-Makrophagen-Vorläufern zu iPSC-Makrophagen: Ernten Sie Vorläufer, indem Sie das erforderliche Überstandsvolumen entfernen; führen Sie es durch ein 40 μm Zellsieb, um Klumpen zu entfernen; Zentrifuge bei 400 x g für 5 min zu Pelletzellen und Resuspend in Makrophagenmedien (Tabelle 1). Samen Sie iPSC-Makrophagen bei 20.000-30.000 Zellen pro Vertiefung in einer mit 96-Well-Gewebekultur (TC) behandelten Mikroplatte mit schwarzen Brunnenwänden und einem optisch klaren Boden in 100 μL Makrophagenmedien pro Vertiefung. Vermeiden Sie die Randbrunnen und füllen Sie diese mit PBS; Dies ist wichtig, um die Auswirkungen der Verdampfung auf den Assay zu reduzieren. Differenzieren Sie für 6-10 Tage durch Inkubation bei 37 °C/5% CO2.
HINWEIS: Für diesen Assay wurde die iPSC-Linie BIONi010-C (ECACC ID: 66540023) verwendet; es kann jedoch eine andere iPSC-Leitung ersetzt werden. - Halten Sie SH-SY5Ys in T75-Kolben mit 20 ml SH-SY5Y-Medien(Tabelle 1)auf Subkonfluenz und passieren Sie alle 3-4 Tage.
| Name | Basismedien | Additiv, Endkonzentration |
| iPSC-Medien | mTeSR1 | - |
| Embryoide Körpermedien | mTeSR1 | BMP4, 50 ng/ml |
| VEGF, 50 ng/ml | ||
| SCF, 20 ng/ml | ||
| Fabrikmedien | XVIVO15 | GlutaMAX, 2 mM |
| Penicillin, 100 Einheiten/ml | ||
| Streptomycin, 100 μg/ml | ||
| 2-Mercaptoethanol, 50 μM | ||
| IL-3, 25 ng/ml | ||
| M-CSF, 100 ng/ml | ||
| Makrophagenmedien | XVIVO15 | GlutaMAX, 2 mM |
| Penicillin, 100 Einheiten/ml | ||
| Streptomycin, 100 μg/ml | ||
| M-CSF, 100 ng/ml | ||
| SH-SY5Y Medien | DMEM/F12 | Fetales Rinderserum, 10% |
| Penicillin, 100 Einheiten/ml | ||
| Streptomycin, 100 μg/ml |
Tabelle 1: Medienrezepte.
Bestandteile von Zellkulturmedien, die im Protokoll verwendet werden. Weitere Details zu den Medienkomponenten finden Sie in der Materialtabelle.
2. Vorbereitung von toten SH-SY5Ys
- In einer biologischen Sicherheitswerkbank der Klasse II dissoziieren SH-SY5Ys durch Zugabe von 4 mL eines Zelldissoziationspuffers, der rekombinante Trypsin-ähnliche Enzyme enthält, und 1,1 mM EDTA (siehe Materialtabelle),die sofort entfernt werden sollten, damit weniger als 1 ml als Dünnschichtschicht verbleibt, die die Zellen beschichtet. 2-3 min bei 37 °C/ 5%CO2 inkubieren.
- 10 ml HBSS zum Spülen in den T75-Kolben geben und die SH-SY5Ys in ein konisches Zentrifugenröhrchen mit 15 ml pipetten. Zentrifuge bei 400 x g für 5 min. Saugen Sie den Überstand an und suspendieren Sie die Zellen in 2 mL phenolrotfreier HEPES-gepufferter Medien (siehe Materialtabelle). Stellen Sie sicher, dass Sie das Pellet vorsichtig wieder auflösen und mit einer 100-1.000 μL Pipette pipettieren, um Klumpen vor der Fixierung aufzubrechen.
- Fixieren Sie die Zellen, indem Sie 2 ml 4% Paraformaldehyd (Endkonzentration 2%) in das Röhrchen geben. 10 min bei Raumtemperatur mit gelegentlichem sanftem Rühren des Röhrchens inkubieren.
- Fügen Sie 10 ml HBSS in die Röhre hinzu. Zentrifuge bei 1.200 x g für 7 min und erneut suspendieren in 2 mL phenolrotfreiem HEPES-gepufferten Medien.
HINWEIS: Nach Schritt 2.4 kann das fixed-SH-SY5Y-Präparat durch Färbung mit Annexin V-FITC qualitätskontrolliert werden, um zugängliches Phosphatidylserin und Propidiniodid zur Messung der Zellpermeabilität mit einer Durchflusszytometrie-Ablesung zu zeigen. Vergleichen Sie die feste Vorbereitung mit SH-SY5Ys, die Sie aus Schritt 2.2 erhalten haben. Siehe Abschnitt 7 und ergänzende Abbildung S1. Die Lagerung der festen SH-SY5Ys nach Schritt 2.4 wird nicht empfohlen, da dies nicht bewertet wurde.
3. Markierung von toten SH-SY5Ys mit pH-empfindlichem rot fluoreszierendem Farbstoff
- Zählen Sie nach Schritt 2.4 die Zellen und entfernen Sie die Gesamtzahl der benötigten Zellen in ein 2 ml proteinarmes Röhre. Für jeweils 1 Million SH-SY5Ys wird das Gesamtvolumen im 2-ml-Röhrchen auf 300-500 μL mit phenolrotfreien HEPES-gepufferten Medien aufgelaufen. Erwärmen Sie die Tube kurz in einem 37 °C Wasserbad.
- Rekonstituieren Sie den pH-sensitiven roten Fluoreszenzfarbstoff STP-Ester (siehe Materialtabelle)und fügen Sie 12,5 μg Farbstoff pro Million SH-SY5Y in die warme 2-ml-Zellröhre zu. Durch Pipettieren vorsichtig mischen. Inkubieren Sie das Rohr bei Raumtemperatur für 30 min, geschützt vor Licht.
HINWEIS: Die STP-Esterspezies des pH-sensitiven Farbstoffs reagiert mit primären Aminen und daher darf der Markierungspuffer keine freien Amine enthalten. Aufgrund der potenziell begrenzten Löslichkeit in wässrigen Puffern den DMSO-gelösten Farbstoff nur zu einem warmen wässrigen Puffer hinzufügen, sofort mischen und auf Anzeichen von Niederschlag untersuchen (dunkle Partikel unter einem Lichtmikroskop). - 1 ml HBSS und Zentrifuge bei 1200 x g für 7 min bei 4 °C hinzufügen. Den Überstand entsorgen und mit 2 mL HBSS waschen. Wiederholen Sie die Zentrifugation.
- Verwerfen Sie den Überstand und suspendieren Sie die Zellen in phenolrotfreien Makrophagenmedien (siehe Materialtabelle)in einer Konzentration von 200.000-1,2 Millionen Zellen/ml, so dass 50 μL 10.000-60.000 Zellen sind (d.h. 0,5x-3x mehr SH-SY5Ys als iPSC-Makrophagen).
HINWEIS: Phenolrot in Medien erhöht die Hintergrundfluoreszenz und daher sollte ein phenolrotfreies Medium verwendet werden, wenn Lebendzellbildgebung durchgeführt werden soll. Eine Lagerung des gefärbten SH-SY5Ys für mehr als ein paar Stunden wird nicht empfohlen, da dies nicht bewertet wurde. Halten Sie gefärbte SH-SY5Ys auf Eis und schützen Sie sie vor Licht.
4. Färbung von iPSC-Makrophagen
- In einer biologischen Sicherheitswerkbank wird in Makrophagenmedien eine Lösung eines tiefrot-fluoreszierenden, zelldurchlässigen, Succinimidylester-reaktiven Farbstoffs hergestellt (siehe Materialtabelle). Fügen Sie Hoechst 33342 hinzu (siehe Materialtabelle). Erwärmen Sie die Arbeitslösung in einem Wasserbad auf 37 °C.
- Saugen Sie das iPSC-Makrophagenmedium schonend an, indem Sie den Zellüberstand mit einer Mehrkanalpipette in ein steriles Reservoir pipettieren. 70 μL/Well der in Schritt 4.1 hergestellten Farbstofflösung werden mit einer Mehrkanalpipette zu iPSC-Makrophagen hinzugefügt. 1 h bei 37 °C/5% CO2 inkubieren.
- Bereiten Sie experimentelle Behandlungen in phenolrotfreien Makrophagenmedien vor. Fügen Sie 10 μM Cytochalasin D als Negativkontrollbehandlung ein. Nach der Inkubation das iPSC-Makrophagenmedium sehr schonend mit einer Mehrkanalpipette absaugen und 100 μL/Well von Hanks gepufferter Kochsalzlösung (HBSS) zum Waschen hinzufügen. HBSS sofort durch sanftes Pipettieren entfernen und dann 100 μL Medien ± Verbindungen hinzufügen. 10 min-1 h bei 37 °C/ 5% CO2 inkubieren.
HINWEIS: Cytochalasin D ist ein starker Aktinhemmer und blockiert die Phagozytose. Für alle experimentellen Behandlungen, die eine längere Inkubation erfordern, z. B. 24-72 h, führen Sie die experimentelle Behandlung vor Schritt 4.1 mit 100 μL / Well der Behandlung in vollständigen Makrophagenmedien durch. Befolgen Sie die Schritte 4.1-4.3 gemäß dem Protokoll, damit eine Zellfärbung durchgeführt wird und anschließend die Behandlung in phenolrotfreien Makrophagenmedien für den Rest des Phagozytose-Assays erneut angewendet wird.
5. Bildgebende Phagozytose
Im Folgenden finden Sie zwei verschiedene Phagozytose-Auslesemethoden, wählen Sie Unterabschnitt 5.1 oder 5.2.
- Zeitraffer-Bildgebung mit Live-Zellen
- Schalten Sie vor der Phagozytose das Lebendzell-Zeitraffer-Bildgebungsmikroskop (siehe Materialtabelle),den Computer, die Umgebungskammer und das CO2-Gas ein. Öffnen Sie die Bilderfassungssoftware. Überprüfen Sie, ob die Lichtwürfel DAPI, RFP und CY5 im Mikroskop installiert sind. Klicken Sie auf Zeitraffer | Inkubation | Aktivieren Sie die Umweltkammer und wählen Sie die Erwärmung auf 37 ° C mit CO2-Gas, stellen Sie auch sicher, dass die Feuchtigkeit de-selekt ist. 30 minuten Zeit für das Mikroskop auf 37 °C erwärmen.
- Während der Compound-Inkubation bei Schritt 4.3 die iPSC-Makrophagenplatte in das Mikroskop laden.
- Klicken Sie auf Image | | erfassen Schiffsexperte. Wählen Sie Well Plate und wählen Sie einen 96-Well-Plattentyp.
- Schalten Sie auf der Registerkarte Bild den Phasenkanal ein und passen Sie die Grob- und Feinfokussierung mit den vertikalen Schiebereglern so an, dass die Zellen im Fokus sind. Passen Sie die Beleuchtungsstärke mit dem horizontalen Schieberegler an. Klicken Sie auf die Kanäle DAPI, RFP und CY5 und passen Sie die Beleuchtungsstärke für jeden Kanal an.
- Klicken Sie auf der Registerkarte System auf Behälterausrichtung kalibrieren und folgen Sie den Anweisungen auf dem Bildschirm.
- Klicken Sie auf Zeitraffer | Routinen | Erstellen Sie eine neue Routine. Benennen Sie auf dem ersten Bildschirm des Zeitraffer-Assistentendie Routine. Klicken Sie auf Weiter. Wählen Sie auf dem zweiten Bildschirm das 20-fache Objektiv aus, wählen Sie Monochrome Aufnahme und wählen Sie die Kanäle DAPI, RFP, CY5 und Phase aus. Wählen Sie nicht die folgenden Optionen: Auto Find Sample, Auto Fine Focus, Z-Stack, Auto Lighting. Klicken Sie auf Weiter.
- Stellen Sie auf dem nächsten Bildschirm ein Beacon in der Mitte jedes Brunnens auf, mit dem das Mikroskop zu den gleichen Koordinaten mit den gleichen Beleuchtungseinstellungen für jeden Zeitpunkt zurückkehren kann. Die Fokussierungs- und Beleuchtungseinstellungen für jedes Beacon sind unabhängig. So legen Sie ein Beacon fest: Ziehen Sie den blauen Kreis an die Position auf der Plattenkarte, verwenden Sie den vertikalen Schieberegler für grobe und feine Fokussierung und klicken Sie, wenn Sie zufrieden sind, auf Beacon hinzufügen. Die Beacon-Einstellungen können später über die Schaltfläche Ausgewählt aktualisieren aktualisiert werden.
- Wenn Sie bereit sind, den Phagozytose-Assay zu starten, entfernen Sie die Assay-Platte und legen Sie sie in eine biologische Sicherheitswerkbank. Verwenden Sie eine Mehrkanalpipette, um 50 μL SH-SY5Ys pro Vertiefung hinzuzufügen, wobei die Seite jeder Vertiefung am Rand der Flüssigkeit hinzugefügt wird.
- Laden Sie die Platte in das Mikroskop und warten Sie ca. 30 Minuten, bis sich die thermische Verschiebung ausgeglichen hat.
HINWEIS: Während der ersten 30 Minuten, in denen sich die Platte im Mikroskop befindet, führt die sich ändernde Temperatur der Assay-Platte dazu, dass sich der Fokus verschiebt. Wenn die Platte nicht ausgeglichen werden darf, werden die aufgenommenen Bilder während des Zeitraffers unschnappbar. - Klicken Sie auf jedes Beacon und aktualisieren Sie die Fokuseinstellung. Klicken Sie auf Weiter. Wählen Sie auf dem nächsten Bildschirm des Zeitraffer-Assistentendas Dateiformat TIFFaus, aktivieren Sie die Option Einzelne Kanäle speichernund aktivieren Sie die Option Video für jeden Beacon erstellenund die Optionen unter Folgende Informationen als Wasserzeichen einschließenzulassen . Klicken Sie auf Weiter.
- Legen Sie die Anzahl der Szenen auf 1 fest. Klicken Sie auf Weiter. Stellen Sie die Dauer und die Intervalle des Zeitraffers ein, z. B. 3 h und Bildgebung alle 5 Minuten. Wählen Sie nicht Nur einen Frame aufnehmenaus. Klicken Sie auf Weiter.
- Aktivieren Sie die Umgebungskammer mit einer Temperatur von 37 °C und CO2 (Feuchtigkeit ist für kurze Experimente optional). Klicken Sie zweimal auf Weiter. Wählen Sie einen Pfad aus, um die Daten zu speichern. Klicken Sie auf Weiter. Klicken Sie auf Start, um den Zeitraffer zu starten.
- High-Content-Bildgebung mit festen Zellen
- Verwenden Sie eine Mehrkanalpipette, um 50 μL der markierten SH-SY5Ys pro Vertiefung hinzuzufügen, wobei sie an der Seite jeder Vertiefung am Rand der Flüssigkeit hinzugefügt wird. Bei 37 °C/ 5% CO2 für 3-5 h inkubieren.
- Nach der Phagozytose-Inkubation Zellüberstände durch Pipettieren mit einer Mehrkanalpipette vorsichtig absaugen und entsorgen. Einmal mit 100 μL PBS waschen.
- Fixieren Sie die Platte durch Zugabe von 100 μL 2% Paraformaldehyd, inkubieren Sie sie für 15 min bei Raumtemperatur.
- Saugen Sie Vertiefungen an und fügen Sie 100 μL PBS hinzu. Abdeckung mit Plattenversiegelung und Folie; bei 4 °C lagern, bis dies erforderlich ist.
HINWEIS: Die Assay-Platte kann mindestens eine Woche lang ohne signifikante Signalverschlechterung auf diese Art gelagert werden. längere Lagerung wurde nicht getestet. - Schalten Sie das hochauflösende Bildgebungsmikroskop ein (siehe Materialtabelle)und öffnen Sie die Bilderfassungssoftware. Laden Sie die Assay-Platte in das Mikroskop, indem Sie oben auf dem Bildschirm auf das Symbol Laden klicken.
- Wählen Sie die Registerkarte Setup aus. Wählen Sie in den Dropdown-Menüs des oberen linken Felds den entsprechenden Plattentyp aus, wählen Sie die Autofokusoption Zwei Spitzen (Standard),wählen Sie das Objektiv 40x Wasser, NA1.1,wählen Sie Konfokalen Modus und wählen Sie Binning von 1.
- Spülen Sie das 40-fache Wasserobjektiv vor Gebrauch über das Menü Einstellungen.
- Verwenden Sie im Feld Kanalauswahl das Symbol +, um die Kanäle DAPI, Alexa 647 und Alexa 568 hinzuzufügen. Stellen Sie diese so ein, dass sie auf einer einzigen Ebene von 1 μm messen. Optimieren Sie die Zeit- und Leistungseinstellungen für die Färbeeffizienz der Assayplatte.
HINWEIS: Als Richtlinie stellen Sie DAPI auf 200 ms Belichtung und 100% Leistung, Alexa 647 bei 1500 ms Belichtung und 100% Leistung und Alexa 568 bei 100 ms Belichtung und 40% Leistung ein. - Stellen Sie sicher, dass die Kanäle nicht gleichzeitig gemessen werden, indem Sie auf Kanalsequenz klicken, um die Kanäle zu trennen.
- Unter Navigations-| Definieren Sie das Layout,wählen Sie die Messbohrungen aus und wählen Sie 9-12 Felder pro Vertiefung aus.
- Klicken Sie während der Einrichtung auf ein repräsentatives Feld auf der Plattenkarte und überprüfen Sie jeden Messkanal nacheinander, um sicherzustellen, dass die Flecken vorhanden sind und dass die Bilder fokussiert sind, indem Sie den Kanalversatz anpassen.
- Damit Daten zur Fernanalyse auf einen Server hochgeladen werden können, klicken Sie auf das Feld Online-Jobs und den entsprechenden Bildschirmnamen. Dies ermöglicht das automatische Hochladen der Daten auf einen Server nach dem Imaging.
- Speichern Sie das Assay-Protokoll, indem Sie auf die Schaltfläche Speichern klicken.
- Klicken Sie oben auf die Registerkarte Experiment ausführen, benennen Sie die Testplatte und klicken Sie dann auf Start.
6. Datenanalyse
Im Folgenden finden Sie zwei verschiedene Datenanalysemethoden: Wählen Sie Unterabschnitt 6.1, wenn Unterabschnitt 5.1 befolgt wurde, oder Unterabschnitt 6.2, wenn Unterabschnitt 5.2 befolgt wurde.
- Analyse von Phagozytosebildern mit einem Zeitraffermikroskop mit lebenden Zellen
- Laden Sie die empfohlene Open-Source-Software herunter und installieren Sie sie (siehe Materialtabelle). Öffnen Sie die Software.
- Wählen Sie im Feld Eingabemodule die Option Bilderaus.
- Öffnen Sie in Windows Explorerden Datenordner, der Unterordner mit den Namen Beacon-1, Beacon-2 usw. enthält. Wählen Sie alle Beacon-Ordner aus, und ziehen Sie sie in das Listenfeld Datei.
- Wählen Sie im Feld Eingabemodule die Option Metadatenaus. Wählen Sie für Metadaten extrahieren?die Option Jaaus. Wählen Sie im Dropdown-Menü neben Metadatenextraktionsmethodedie Option Aus Datei-/Ordnernamen extrahierenaus. Wählen Sie für die Metadatenquelle Ordnernameaus. Klicken Sie auf die Lupe rechts neben dem regulären Ausdruck und geben Sie ".*[\.*](? P.*)$" in das Regex-Textfeld (ohne Anführungszeichen). Klicken Sie auf Senden. Wählen Sie für Extract Metadata From (Metadaten extrahieren aus)die Option All Images (Alle Bilder) aus. Klicken Sie unten auf dem Bildschirm auf Aktualisieren. Die Bilder werden nun nach Beacon gruppiert.
- Wählen Sie im Feld Eingabemodule die Option NamesAndTypesaus. Mit dem folgenden Prozess können Bilder für jeden Zeitpunkt dem richtigen Fluoreszenzkanal zugeordnet werden. Weisen Sie den Bildabgleichsregeln einen Namen zu (Dropdown-Menü). Wählen Sie die Regelkriterien übereinstimmend Mit Alle (Dropdown-Menü) der folgenden Regeln aus. Datei (Dropdown-Menü), Do (Dropdown-Menü), Contain (Dropdown-Menü), DAPI (Textfeld). Name, der diesen Bildern DAPI (Textfeld) zugewiesen werden soll. Wählen Sie den Bildtyp Graustufen-Image (Dropdown-Menü). Legen Sie den Intensitätsbereich über Bildmetadaten fest (Dropdown-Menü).
- Klicken Sie unten auf dem Bildschirm auf Weiteres Bild hinzufügenund wiederholen Sie Schritt 6.1.5. Ersetzen Sie DAPI durch RFP, damit die RFP-Images gruppiert werden.
- Wiederholen Sie Schritt 6.1.6 für die CY5-Kanalbilder.
- Klicken Sie unten auf dem Bildschirm auf Aktualisieren, die Bilddateien werden nun in drei Spalten mit den Bezeichnungen DAPI, RFP und CY5 aufgelistet.
- Wählen Sie im Feld Eingabemodule die Option Gruppenaus. Wählen Sie für Möchten Sie Ihre Bilder gruppieren?die Option Jaaus. Wählen Sie im Dropdown-Menü für Metadatenkategoriedie Option Beaconaus.
- Klicken Sie im Feld Analysemodule mit der rechten Maustaste auf das Leerzeichen, um eine Liste aller Module aufzurufen.
- Klicken Sie auf | hinzufügen | Bildverarbeitung EnhanceOrSuppressFeatures. Wählen Sie DAPI aus dem ersten Dropdown-Feld als Eingabebild aus. Benennen Sie das Ausgabebild als "DAPIspeckles". Wählen Sie den Vorgangstyp Enhance und den Feature-Typ Specklesmit einer Feature-Größe von 20 Pixeln aus. Wählen Sie die Option Geschwindigkeit und Genauigkeit Schnell/Sechseckig.
- Erstellen Sie ein neues Modul. | hinzufügen Objektverarbeitungs- | IdentifyPrimaryObjects. Wählen Sie DAPIspeckles aus dem ersten Dropdown-Feld als Eingabebild aus. Nennen Sie die primären Objekte "Nuclei". Geben Sie den typischen Durchmesser von Objekten als 10 bis 35 Pixeleinheiten ein; Dieser Parameter kann optimiert werden. Wählen Sie die Schwellenwertstrategie Global, die Schwellenwertmethode RidlerCalvard, die Glättungsmethode Automatisch, und geben Sie den Schwellenwertkorrekturfaktor als 12 mit unteren und oberen Grenzen 0-1 an. Ändern Sie die Methode, um verklumpte Objekte in Shape zu unterscheiden, aber lassen Sie andere Parameter bei ihren Standardeinstellungen.
HINWEIS: Die iPSC-Makrophagenkerne wurden in Schritt 6.1.12 nach einem Bildverarbeitungsschritt, der den Durchmesser reduziert und den Kontrast der Kerne erhöht, grob segmentiert. Es ist wichtig, dass nur die hellsten Kerne ausgewählt werden, da die SH-SY5Ys als schwächere Kerne erscheinen und ansonsten mit iPSC-Makrophagen verwechselt werden. Um den Anteil der ausgewählten Kerne anzupassen, erhöhen oder verringern Sie den Schwellenwertkorrekturfaktor. Vergleichen Sie während der Testphase die resultierende Kernselektion mit einem Phasenbild des Beacons, wobei es leicht ist, anhand der Zellmorphologie zwischen iPSC-Makrophagen und SH-SY5Y zu unterscheiden. - Erstellen Sie ein neues Modul. | hinzufügen | Bildverarbeitung CorrectIlluminationCalculate. Wählen Sie CY5 aus dem ersten Dropdown-Feld als Eingabebild aus. Nennen Sie das Ausgabebild "IllumCY5". Wählen Sie unter Wählen Sie wie die Beleuchtungaus , Hintergrund aus dem Dropdown-Menü. Belassen Sie die anderen Parameter bei ihren Standardeinstellungen.
- Erstellen Sie ein neues Modul. Klicken Sie auf | hinzufügen | Bildverarbeitung RichtigErhebungBenen. Wählen Sie CY5 aus dem ersten Dropdown-Feld als Eingabebild aus. Nennen Sie das Ausgabebild "CorrCY5". Wählen Sie unter Beleuchtung auswählendie Option IllumCY5 aus dem Dropdown-Menü aus. Wählen Sie unter Wählen Sie aus, wie die Beleuchtungist , teilen aus dem Dropdown-Menü.
HINWEIS: Der Zweck der Schritte 6.1.13-6.1.14 besteht darin, die Variation der Hintergrundbeleuchtung der CY5-Bilder zu korrigieren, die andernfalls die korrekte Zellsegmentierung beeinträchtigen würde. - Erstellen Sie ein neues Modul. Klicken Sie auf | hinzufügen Objektverarbeitungs- | IdentifySecondaryObjects. Wählen Sie CorrCY5 aus dem ersten Dropdown-Feld als Eingabebild aus. Wählen Sie Kerne als Eingabeobjekte aus. Nennen Sie die sekundären Objekte "Mac". Wählen Sie die Identifizierungsmethode als Entfernung - B. Wählen Sie Die Schwellenwertstrategie Global, die Schwellenwertmethode RidlerCalvard, die Glättungsmethode Keine Glättung, und geben Sie den Schwellenwertkorrekturfaktor als 1 mit unteren und oberen Grenzen 0-1 an. Belassen Sie andere Parameter bei ihren Standardeinstellungen.
HINWEIS: Dieser Zellsegmentierungsschritt erfordert möglicherweise eine Optimierung, indem der Schwellenwertkorrekturfaktor angepasst wird, um Zellgrenzen zu vergrößern oder zu verkleinern. Die Segmentierungseffizienz kann auch verbessert werden, indem die Stärke der iPSC-Makrophagenfärbung oder die Beleuchtung des CY5-Lichtwürfels während der Bildgebung erhöht wird. - Erstellen Sie ein neues Modul. Klicken Sie auf | hinzufügen | Bildverarbeitung EnhanceOrSuppressFeatures. Wählen Sie RFP aus dem ersten Dropdown-Feld als Eingabebild aus. Benennen Sie das Ausgabebild als "FilteredRFP". Wählen Sie den Vorgangstyp Enhance und den Feature-Typ Specklesmit einer Feature-Größe von 15 Pixeln aus. Die Feature-Größe kann optimiert werden. Wählen Sie die Option Geschwindigkeit und Genauigkeit Schnell/Sechseckig.
- Erstellen Sie ein neues Modul. Klicken Sie auf | hinzufügen Objektverarbeitungs- | IdentifyPrimaryObjects. Wählen Sie FilteredRFP aus dem ersten Dropdown-Feld als Eingabebild. Nennen Sie primäre Objekte "pHr". Geben Sie den typischen Durchmesser von Objekten als 5-20 Pixeleinheiten ein. Wählen Sie die Schwellenwertstrategie Manuellaus, und geben Sie manuell einen Schwellenwert ein, z. B. 0,005. Ändern Sie die Methode, um verklumpte Objekte in Shape zu unterscheiden, aber belassen Sie die anderen Parameter bei ihren Standardeinstellungen.
HINWEIS: Die SH-SY5Ys wurden in Schritt 6.1.17 segmentiert, nach einem Bildverarbeitungsschritt, der den Durchmesser reduziert und den Kontrast der Puncta erhöht. Es ist wichtig, eine manuelle Schwelleneinstellung durchzuführen, da die Intensität des pH-empfindlichen Farbstoffs in phagozytierten Partikeln im Laufe der Zeit zunimmt und andere Schwellenwertstrategien die Anzahl der pH-empfindlichen Farbstoffpunktta in frühen Zeitpunkten künstlich aufblähen. Die manuelle Schwelleneinstellung muss für jede nachfolgende experimentelle Wiederholung im Testmodus angepasst werden. - Erstellen Sie ein neues Modul. Klicken Sie auf | hinzufügen Objektverarbeitungs- | RelateObjects. Wählen Sie die Eingabeobjekte pHr aus dem Dropdown-Menü aus. Wählen Sie die Eingabe-übergeordneten Objekte Mac aus dem Dropdown-Menü. Wählen Sie für Calculate Per-Parent Means for All Child Measurements?die Option Yes( Berechnen Sie keine Abstände zwischen Untergeordneten und Eltern (Keine).
HINWEIS: Schritt 6.1.18 bezieht das pH-empfindliche Farbstoffsignal auf die iPSC-Makrophagen und ermöglicht die Messung der durchschnittlichen Anzahl phagozytärer Objekte pro iPSC-Makrophagen. - Erstellen Sie ein neues Modul. Klicken Sie auf | hinzufügen Dateiverarbeitungs- | ExportToSpreadsheet. Wählen Sie das Spaltentrennzeichen als Tabulator aus und fügen Sie ein Präfix für Dateinamen hinzu, um die Beacon-Nummer anzugeben. Wählen Sie bestimmte Messungen für den Export, wie unten angegeben (Schritte 6.1.19.1 - 6.1.19.4); Andere Parameter werden in ihren Standardeinstellungen belassen.
- Bild | Anzahl | Wählen Sie pHr und Mac
- Bild | Dateiname
- Bild | Gruppe
- Mac-| Kinder | Phr
- Klicken Sie im Feld Ausgabe auf Ausgabeeinstellungen anzeigen. Erstellen Sie einen neuen Ordner auf dem Desktop für dieses Experiment und legen Sie diesen als Standardausgabeordner fest.
- Speichern der Pipelinedatei | SpeichernProjekt speichern unter....
- Testen und optimieren Sie die Pipeline auf einem repräsentativen Bild, indem Sie in der unteren linken Ecke auf Testmodus starten klicken. Das Programm wählt automatisch das erste Bild zum Testen aus und jeder Schritt der Pipeline kann durch Klicken auf die Augensymbole, wodurch die Ausgabe sichtbar wird, und dann auf Ausführenklicken. Um das zum Testen verwendete Beacon zu ändern, klicken Sie in der oberen Menüleiste auf Test | Wählen Sie Bildgruppe. Um das Bild (Zeitpunkt) innerhalb eines Beacons zu ändern, klicken Sie in der oberen Menüleiste auf Test | Wählen Sie Image Set. Parameter, die optimiert werden sollen, sind in den vorherigen Schritten angegeben.
- Wenn Sie mit der Pipeline zufrieden sind, klicken Sie auf Testmodus beenden und klicken Sie auf die Symbole für offene Augen, um sie zu schließen. Speichern Sie die Pipeline. Klicken Sie auf Bilder analysieren, um die vollständige Bildanalyse zu starten.
- Die generierten Textdateien können mit einer geeigneten Tabellenkalkulationssoftware als Tabellenkalkulation geöffnet werden, und die Datei mit der Bezeichnung "Bild" enthält eine Zeile für jeden Bildzeitpunkt, wobei die Spalten Parameter darstellen.
HINWEIS: Count_Mac und Count_pHr die Anzahl der iPSC-Makrophagen und die Anzahl der identifizierten pH-empfindlichen Objekte in einem Bild darstellen. Verwenden Sie Count_pHr Daten nicht, da die Zählung schwach fluoreszierende SH-SY5Ys umfasst, die nicht phagozytosiert wurden. Die Spalte Mean_Mac_Children_pHr_Count nimmt die durchschnittliche Anzahl phagozytierten pHr-Objekte pro Mac (Schritt 6.1.18 RelateObjects) für ein einzelnes Bild, d.h. den individuellen Zeitpunkt eines Beacons. - Ordnen Sie die Daten so an, dass jedes Beacon eine separate Spalte in der Tabelle ist, die Bilder sind als Zeilen chronologischer Reihenfolge angeordnet, wobei verschiedene Parameter verschiedene Blätter der Tabellenkalkulationsarbeitsmappe belegen.
- Multiplizieren Sie die Messungen Mean_Mac_Children_pHr_Count mit Count_Mac, um den Parameter Anzahl der Spots pro Bild zu generieren. Berechnen Sie die mittlere Count_Mac für jedes Beacon. Dividieren Sie die Anzahl der Spots pro Bild durch den Mittelwert Count_Mac für dieses Beacon und generieren Sie den Parameter Anzahl der Spots pro Zelle.
HINWEIS: Schritt 6.1.26 korrigiert alle fehlerhaften Schwankungen, die bei der iPSC-Makrophagenanzahl (Count_Mac) auftreten können, indem die Daten auf die durchschnittliche iPSC-Makrophagenanzahl über alle Zeitpunkte eines Beacons normalisiert werden. - Weisen Sie jeder Bildzeile die Zeit seit Beginn der Phagozytose (in min) zu.
- Generieren Sie Mittel und Standardabweichungen für replizierungsbohrungen/Beacons. Stellen Sie die Anzahl der Flecken pro Zelle (y-Achse) gegen die Zeit (x-Achse) grafisch her, um die Phagozytoserate zu visualisieren.
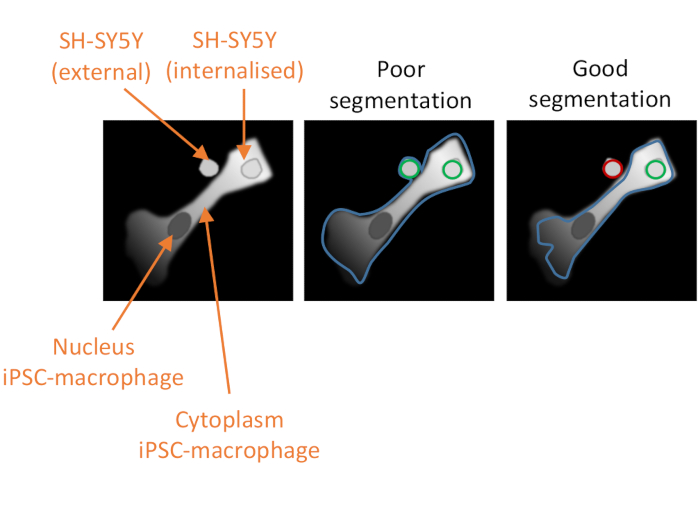
Abbildung 2: Zellsegmentierung in der Hochgehalts-Phagozytose-Analyse. Illustration zur Demonstration einer guten versus schlechten Segmentierung eines iPSC-Makrophagen in unmittelbarer Nähe zu einem nicht phagozytierten SH-SY5Y, wobei ein zweiter SH-SY5Y vollständig phagozytosiert ist. Da beide Zelltypen grau dargestellt sind, wird die durch die Computeranalyse abgegrenzungte iPSC-Makrophagen-Zellgrenze umrissen (blau). SH-SY5Ys, die als Phagozytoseereignisse gezählt werden, werden grün oder rot umrandet, wenn sie von der Analyse ausgeschlossen werden. Das Bild in der Mitte zeigt eine schlechte Segmentierung; Der iPSC-Makrophage hat eine suboptimale Abgrenzung, die die nicht phagozytosierte SH-SY5Y innerhalb der Zellgrenze umfasst, die als Phagozytoseereignis gezählt wird. Das Bild rechts zeigt eine gute Segmentierung aufgrund strengerer Parameter, die den iPSC-Makrophagen-Zellrand definieren, was dazu führte, dass der nicht phagozytierte SH-SY5Y korrekt von der Analyse ausgeschlossen wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Analyse von Phagozytosebildern, die mit einem Hochgehaltsmikroskop erhalten wurden
- Melden Sie sich bei der empfohlenen Bildverarbeitungssoftware an (siehe Materialtabelle).
- Wählen Sie den Ordner mit dem Bildschirmnamen und den Unterordner imaging run aus dem Menü auf der linken Seite aus. Klicken Sie auf das Symbol Bildanalyse (ein Bildschirm mit einer Lupe). Wählen Sie eine repräsentative Vertiefung auf dem Plattenlayout aus, um die Analysepipeline einzurichten.
- Der erste Analysebaustein ist das Eingabebild. Beibehalten Sie die Standardeinstellungen für die Stapelverarbeitung (Einzelne Ebenen) und die Flachfeldkorrektur (Keine). Klicken Sie auf das +-Zeichen in der oberen rechten Ecke des Blocks, um den nächsten Baustein hinzuzufügen, und wählen Sie Find Nuclei.
- Legen Sie in Find Nucleiden Kanal als DAPIfest, die ROI-Population auf None, die Methode der Segmentierung auf C. Das Methodenfeld enthält ein Dropdown-Menü, mit dem der Parameter optimiert werden kann, mit Einstellungen für den gemeinsamen Schwellenwert (z. B. 0,40) und den Bereich (d. h. >30 μm2). Nennen Sie die Ausgangspopulation "Nuclei". Fügen Sie den nächsten Baustein hinzu, indem Sie auf das +-Symbol klicken und Zytoplasma suchen auswählen.
- Legen Sie in Zytoplasma suchenden Kanal als Alexa 647 und die Methode als B fest. Das Methodenfeld enthält ein Dropdown-Menü, mit dem der Parameter optimiert werden kann, mit Einstellungen für den gemeinsamen Schwellenwert (z. B. 0,45) und den individuellen Schwellenwert (z. B. 0,20). Fügen Sie den nächsten Baustein hinzu, indem Sie auf das +-Symbol klicken und Bevölkerung auswählen auswählen.
HINWEIS: Es ist wichtig, die Zytoplasmasegmentierung richtig zu optimieren, so dass alle benachbarten SH-SY5Ys, die nicht phagozytosiert wurden, ausgeschlossen werden, aber keine phagozytosierte Fracht ausgeschlossen wird (siehe Abbildung 2). - Behalten Sie unter Population auswählendie Standardeinstellungen bei, die Populationskerne,methode Common Filters,ein Häkchen für Randobjekte entfernenund die Ausgabepopulation mit dem Namen "Kerne ausgewählt" sind. Fügen Sie den nächsten Baustein hinzu, indem Sie auf das Symbol + klicken und Morphologieeigenschaften berechnen auswählen.
- Legen Sie unter Morphologieeigenschaften berechnendie Population auf Ausgewählte Kerne, den Bereich auf Zelle, die Methode auf Standardfest. Stellen Sie im Dropdown-Menü sicher, dass Fläche und Rundheit ausgewählt sind (μm2). Nennen Sie die Ausgabepopulation "Morphologiezelle". Fügen Sie den nächsten Baustein hinzu, indem Sie auf das +-Symbol klicken und Bevölkerung auswählen auswählen.
- Wählen Sie unter Population (2)auswählen die Population Kerne ausgewähltund die Methode Nach Eigenschaften filternaus. Wählen Sie im Dropdown-Feld unter Filter F1die Option Morphologie-Zellbereich [μm2] aus. Wählen Sie > aus dem Dropdown-Feld rechts aus, und geben Sie 160 in das Feld rechts davon ein. Nennen Sie die Ausgabepopulation "Nuclei Selected 2". Fügen Sie den nächsten Baustein hinzu, indem Sie auf das +-Symbol klicken und Find Spots auswählen.
HINWEIS: Dieser Schritt schließt alle falsch segmentierten Zellen und alle toten Zellen von der weiteren Analyse aus. Es kann notwendig sein, durch Erhöhen oder Verringern der Cut-off-Größe zu optimieren. - Wählen Sie unter Spots suchenden Kanal Alexa 568, die ROI-Population Nuclei Selected 2, die ROI-Region Zelle, Methode Bund nennen Sie die Ausgabepopulation "Spots". Die Methode kann bei Bedarf über das Dropdown-Menü mit Einstellungen für die Erkennungsempfindlichkeit (z. B. 0,20) und die Splitting-Empfindlichkeit (z. B. 0,400) optimiert werden. Fügen Sie den nächsten Baustein hinzu, indem Sie auf das Symbol + klicken und Morphologieeigenschaften berechnen auswählen.
- Wählen Sie unter Morphologieeigenschaften berechnen (2)die Population Spots, Region Spotund Methode Standardaus. Stellen Sie im Dropdown-Menü sicher, dass Fläche und Rundheit ausgewählt sind (μm2). Nennen Sie die Ausgabeeigenschaften "Morphology Spot". Fügen Sie den nächsten Baustein hinzu, indem Sie auf das +-Symbol klicken und Bevölkerung auswählen auswählen.
- Wählen Sie unter Population (3)auswählen die Population Spots und die Methode Filter by Properties aus. Wählen Sie in den Dropdown-Feldern unter Filter F1die Option Spot Area [px2], >, 20. Wählen Sie in den Dropdown-Feldern unter Filter F2die Option Spot-Bereich [px2], <, 2500. Wählen Sie in den Dropdownfeldern unter Filter F3die Option Morphologiefleckrundheit, >, 0,6aus. Wählen Sie in den Dropdownfeldern unter Filter F4die Option Spot to Region Intensity ( >, 2.5. Nennen Sie die Ausgabepopulation "Spots Selected". Fügen Sie den nächsten Baustein hinzu, indem Sie auf das +-Symbol klicken und Bevölkerung auswählen auswählen.
HINWEIS: Die automatisierte Spotauswahl hat viele winzige fluoreszierende Flecken segmentiert, die aus autofluoreszierenden Körpern innerhalb der iPSC-Makrophagen resultieren. Dieser Schritt zielt darauf ab, autofluoreszierende Körper herauszufiltern, indem strenge Grenzwerte auf die Fläche, Rundheit und Intensität der Flecken angewendet werden, und erfordert möglicherweise eine gewisse Optimierung. - Wählen Sie unter Population (4)auswählen die Population Kerne ausgewählt 2 und die Methode Filter by Properties aus. Wählen Sie in den Dropdownfeldern unter Filter F1die Option Anzahl der Spots, >, 0,5aus. Nennen Sie die Ausgabepopulation "Spot Positive Cells". Fügen Sie den nächsten Baustein hinzu, indem Sie auf das Symbol + klicken und Ergebnisse definieren auswählen.
- Wählen Sie unter Ergebnisse definierendie erste Methode als Liste der Ausgaben aus. Die Standardeinstellung ist für die Anzahl der Objekte, die für jede Grundgesamtheit berechnet werden sollen. Klicken Sie auf das Dropdown-Menü für Population: Nuclei Selected 2 und stellen Sie sicher, dass Anzahl der Objekte angekreuzt ist, und wählen Sie im Dropdown-Menü Auf Alle anwenden die Option ALLEaus. Stellen Sie für die Population Spot Positive Cellsicher, dass Anzahl der Objekte angekreuzt ist. Für die anderen Populationen ist es nicht notwendig, Parameter zu melden. Wählen Sie die zweite Methode als Formelausgabeaus, und geben Sie die Formel (a/b)*100 ein. Wählen Sie als Variable A Spot Positive Cell- Anzahl der Objekte, und als Variable B wählen Sie Kerne Ausgewählt 2- Anzahl der Objekte. Benennen Sie die Ausgabe als "Spot Positive Cells (%)".
- Pipeline speichern: Klicken Sie auf das Symbol Analyse auf Festplatte speichern (eine Diskette mit Pfeil nach unten).
- Klicken Sie auf das Symbol Chargenanalyse (ein Trichter- und Zahnradsymbol am oberen Bildschirmrand). Wählen Sie aus den Versuchsordnern auf der linken Seite die Rohdatendatei aus, die die Anzahl der ausgewählten Messungen auf 1aktualisieren soll. Klicken Sie im Bereich Analyseoptionen auf das Dropdown-Menü für Methode, und wählen Sie Vorhandene Analyseaus. Klicken Sie auf die ... neben Skriptdatei und suchen Sie nach der gespeicherten Analysedatei (Suffix .aas). Klicken Sie dann auf den grünen Pfeil neben Analyse starten. Der Analysefortschritt kann durch Klicken auf Jobstatus (in der oberen rechten Ecke des Bildschirms) überwacht werden.
- Sobald die Analyse abgeschlossen ist, klicken Sie auf die Registerkarte Exportieren, wählen Sie den Experimentordner und wählen Sie einen Zielordner aus. Lassen Sie die Standardeinstellungen, die Daten, aber keine TIFF-Bilder exportieren, und starten Sie den Export.
- Öffnen Sie die heruntergeladene Datei als Tabellenkalkulation in einer geeigneten Tabellenkalkulationssoftware. Die Vertiefungen sind in Reihen und die Parameter in Spalten angeordnet. Wählen Sie die Daten in den Spalten Spot Positive Cells (%), Nuclei Selected 2 - Number of Spots - Mean per Well und Nuclei Selected 2 - Total Spot Area - Mean per Well aus, und kopieren Sie diese in neue Tabellen für jeden Parameter. Berechnen Sie den Parametermittelwert für replizierte Vertiefungen jeder Bedingung und stellen Sie gegebenenfalls ein Diagramm dar.
7. Qualitätskontrolltest für die Homogenität von festen SH-SY5Ys
- Sammeln Sie ein Aliquot von lebenden SH-SY5Ys aus Schritt 2.2 und resuspendieren Sie den Annexin-Bindungspuffer aus einem Kit für die Annexin-V-FITC-Färbung (siehe Materialtabelle)in einer Konzentration von etwa 200.000 Zellen pro ml.
- Sammeln Sie ein Aliquot von festen SH-SY5Ys aus Schritt 2.4 und resuspendieren Sie in einem Annexin-Bindungspuffer in einer Konzentration von etwa 200.000 Zellen pro ml.
- Zwei Reagenzgläser mit 5 μL Annexin V-FITC und 5 μL Propidieniodid vorbereiten (siehe Materialtabelle). Fügen Sie 500 μL lebende SH-SY5Ys zu einer Röhre und 500 μL feste SH-SY5Ys zur anderen hinzu.
- Bereiten Sie drei Steuerröhrchen vor: eines mit 5 μL Annexin V-FITC, eines mit 5 μL Propidieniodid und ein Röhrchen leer. Mischen Sie ein 1:1-Verhältnis von live und festen SH-SY5Ys zusammen und fügen Sie 500 μL davon zu jedem Steuerrohr hinzu.
- Rohre vorsichtig durch Pipettieren mischen. Bei Raumtemperatur 10 min vor Licht geschützt inkubieren.
- Sofortige Messung auf einem Durchflusszytometer (Ex = 488 nm; Em = 530 nm) unter Verwendung des FITC-Signaldetektors (normalerweise FL1) für Annexin V-FITC und des Phycoerythrin-Emissionssignaldetektors (normalerweise FL2) für Propidieniodid.
- Verwenden Sie eine beliebige Durchflusszytometrie-Analysesoftware, um Punktdiagramme von FITC vs PI-Signal anzuzeigen, und verwenden Sie ein rechteckiges Gating-Werkzeug, um die doppelt negative Population auszuwählen. Zeigen Sie innerhalb der doppelt negativen Population FSC vs SSC an und verwenden Sie ein polygonales Gating-Tool, um ein Ausschlusstor um die Population mit sehr niedrigem FSC und SSC zu erstellen, das als Trümmer klassifiziert und daher von der weiteren Analyse ausgeschlossen wird. Zeigen Sie die verbleibenden Ereignisse als FITC vs PI-Signal an und verwenden Sie die Steuerelemente für Single-Stained und Unstained, um ein Quadranten-Gate für FITC-/PI-, FITC+/PI-, FITC -/PI+- und FITC+/PI+-Ereignisse festzulegen.
HINWEIS: Vermeiden Sie raue Handhabung, Wirbel oder lange Inkubationen mit lebenden SH-SY5Ys, die eine Phosphatidylserin-Anzeige künstlich induzieren könnten. Fahren Sie unverzüglich mit der Durchflusszytometrie fort. Ein wünschenswertes Ergebnis ist, dass der Anteil der FITC-/PI-Ereignisse in den fixen SH-SY5Ys <5% beträgt. Repräsentative Ergebnisse sind in der Ergänzenden Abbildung S1 dargestellt.
Ergebnisse
Die Zeitraffer-Bildgebung von Lebendzellen wurde mit dem zuvor beschriebenen Protokoll durchgeführt, wobei Wildtyp-iPSC-Makrophagen mit 20.000 Zellen pro Vertiefung ausgesät wurden. Verschiedene Mengen von SH-SY5Ys wurden angewendet (10.000-30.000 pro Well, geschätzt aus der Zellzahl in Schritt 3.1), und der Phagozytosehemmer Cytochalasin D wurde mit einigen Vertiefungen vorinkubiert (1 h), die als Kontrolle zur Hemmung der Phagozytose für jede Menge SH-SY5Ys fungierten. Die Bildgebung begann 40 Minuten nach der Zugabe von SH-SY5Ys und die Bilder wurden in 5-Minuten-Intervallen für die nächsten 3 Stunden aufgenommen (die Daten enthalten die anfängliche Verzögerung von 40 Minuten). Ein repräsentatives Zeitraffervideo ist in den ergänzenden Datenenthalten und analysierte quantitative Daten in Abbildung 3. Mit der Menge von 10.000 SH-SY5Ys pro Vertiefung nahm die Anzahl der phagozytierten Partikel (Flecken) pro Zelle linear mit der Zeit zu und wurde durch Cytochalasin D um etwa 50% gehemmt. Die Hemmung durch Cytochalasin D war schwächer als erwartet, höchstwahrscheinlich verursacht durch unzureichende technische oder biologische Replikate, da nur eine Vertiefung pro Erkrankung mit drei Bildfeldern abgebildet wurde. Bei höheren Mengen an SH-SY5Ys pro Vertiefung (20.000 und 30.000) zeigte die Phagozytose eine schlechte Linearität, wahrscheinlich aufgrund einer schlechten Segmentierung von iPSC-Makrophagen und SH-SY5Ys in einem überfüllteren Sichtfeld.
Die Fixed-Cell-High-Content-Bildgebung wurde mit dem zuvor beschriebenen Protokoll durchgeführt, mit Wildtyp-iPSC-Makrophagen bei 20.000 Zellen pro Vertiefung, mehreren verschiedenen Mengen an SH-SY5Ys (10.000-80.000 pro Bohrung) und der Assay-Platte wurde nach 5 h fixiert und abgebildet. Ein repräsentatives Bild der Phagozytose ist in Abbildung 4Adargestellt, und die analysierten Daten sind in Abbildung 4B17 dargestellt. Die Erhöhung der Menge an SH-SY5Ys führte zu einer höheren Anzahl von phagozytierten Partikeln (Flecken) pro Zelle; Eine Verdoppelung der SH-SY5Y-Menge führt jedoch nur zu einer 1,5-fachen Erhöhung der Anzahl der Spots pro Zelle. Dies deutet darauf hin, dass die getesteten Mengen nicht die Rate für die Phagozytose begrenzen. Anschließend wurde der high-content imaging phagocytosis assay mit mehreren Inhibitoren der Phagozytose validiert (Abbildung 4C)17. Die Aktinpolymerisationshemmer Cytochalasin D und Jasplakinolid hemmten die Phagozytose signifikant um 91% bzw. 90%, wenn sie 1 h vor der Phagozytose vorbebrütet wurden. Das robuste Z' des Assays, wenn Cytochalasin D oder Jasplakinolid als Negativkontrollen verwendet werden, wird mit 0,7 bzw. 0,8 bzw.20berechnet. Der Lysosom-Säuerungshemmer Bafilomycin A1 reduzierte die Phagozytose signifikant um 31%, wenn er 1 h vor der Phagozytose inkubiert wurde. Die schwächere Wirkung des Lysosom-Versauerungsinhibitors im Vergleich zu Aktininhemmern deutet darauf hin, dass der Nachweis der verinnerlichten Ladung möglicherweise keine vollständige Säuerung des Phagosoms erfordert. Rekombinantes Annexin V wurde als Kontrolle verwendet, um Phosphatidylserin, das auf der Oberfläche von SH-SY5Ys exponiert war, spezifisch zu blockieren und zu verhindern, dass phagozytäre Rezeptoren auf den Liganden zugreifen, ein wichtiges "Eat-Me" -Signal. Die Zugabe von rekombinantem Annexin V reduzierte die Phagozytose signifikant um 30%, wenn sie unmittelbar vor der SH-SY5Y-Zugabe zu den Vertiefungen hinzugefügt wurde. Es wurde bestätigt, dass feste SH-SY5Ys Phosphatidylserin unter Verwendung einer fluoreszierenden Annexin-V-Sonde exponierten, während lebende SH-SY5Ys für die Annexin-V-Färbung negativ waren (Abbildung 4D).
Der mikrogliale Phagozytoserezeptor TREM2 hat sich bereits als wichtig für die Phagozytose apoptotischer Neuronen21 erwiesen. Die R47H-Mutation von TREM2 ist ein Risikogen für den späten Ausbruch der Alzheimer-Krankheit und wird angenommen, um die Ligandenbindung von TREM223zu reduzieren. Mit dem Ziel, die phagozytäre Funktion von R47H TREM2 und TREM2 KO zu beurteilen, wurde der fixzellige High-Content-Phagozytose-Assay unter Verwendung isogener iPSC-Makrophagenlinien mit WT/R47H/KO TREM217durchgeführt. Mehrere Längen der Phagozytosedauer von 1 bis 5 h wurden getestet, wobei eine gestaffelte Zugabe von phagozytischer Ladung (40.000 SH-SY5Ys) verwendet wurde. Das resultierende Signal steigt linear auf 4 h an und nivellieren sich bei 5 h leicht (Abbildung 5)17. Eine reduzierte Phagozytoserate und -kapazität (% spotpositive Zellen) zeigte sich bei TREM2 KO im Vergleich zu WT, während die R47H TREM2-Mutante keine veränderte Phagozytose zeigte. Der phagozytäre Defekt in TREM2 KO-Zellen wird durch die R47H TREM2-Mutation nicht phänokopiert, anscheinend weil die TREM2-Funktion ausreicht, um eine normale Phagozytose zu unterstützen.
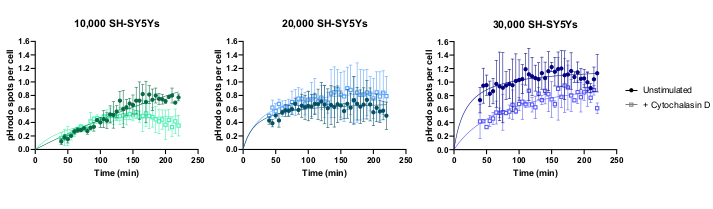
Abbildung 3: Beispieldaten für den Lebendzell-Zeitraffer-Phagozytose-Assay. Aufnahme toter SH-SY5Ys durch Wildtyp-iPSC-Makrophagen BIONi010-C (ECACC ID: 66540023) in 5-Minuten-Intervallen für 3 h. Die auf der Grafik angezeigten Zeiten stammen aus dem Beginn der Phagozytose, einschließlich der ersten 40 Minuten ohne Messung. Die durchschnittliche Anzahl der Flecken pro Zelle aus drei Replikationsbohrungen wird aufgezeichnet. Die Phagozytose von 10.000 SH-SY5Ys wird mit 10 μM Cytochalasin D mit 1 h Vorbehandlung gehemmt, während höhere Mengen an SH-SY5Ys (20.000 und 30.000) eine suboptimale Quantifizierung der Phagozytose aufweisen. Mittelwert ± Standardabweichung (SD), N = 1 Experiment. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
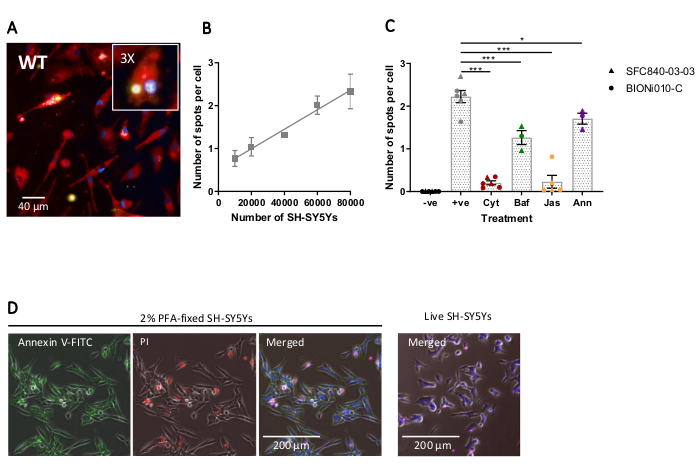
Abbildung 4: Optimierung und Validierung des fixzelligen High-Content-Phagozytose-Assays. (A) Repräsentative High-Content-Mikroskopieaufnahme von SH-SY5Ys Phagozytos, die von Wildtyp-iPSC-Makrophagen BIONi010-C (ECACC ID: 66540023) untersucht wurden. Es wird ein 3 h-Zeitpunkt mit 40.000 SH-SY5Ys angezeigt. Fluoreszenzkanäle werden zusammengeführt, wobei der iPSC-Makrophagenfleck rot, die Kerne blau und SH-SY5Ys gelb dargestellt werden. Das Inset-Panel ist ein 3x vergrößerter Ausschnitt des Bildes. (B) Die Anzahl der Flecken pro Zelle von phagozytosierten toten SH-SY5Ys nach 5 h, wobei unterschiedliche Mengen an Fracht zusätzlich zu Wildtyp-iPSC-Makrophagen verwendet werden. Mittelwert ± Standardfehler des Mittelwerts (REM), für N = 3 Ernten. (C) Phagozytose (3 h) wird mit 10 μM Cytochalasin D (Cyt), 1 μM Bafilomycin A1 (Baf), 1 μM Jasplakinolid (mit 1 h Vorbehandlung; Jas) und 13 μg/ml rekombinantes Annexin V (gleichzeitig zu den toten SH-SY5Ys hinzugefügt; Ann). iPSC-Makrophagen ohne SH-SY5Ys wurden als Negativkontrolle (-ve) verwendet, und die positive (+ve) Kontrolle sind unbehandelte iPSC-Makrophagen mit SH-SY5Ys. Die Daten wurden auf den Mittelwert für die Experimentwiederholung normalisiert. Mittel ± REM, für N = 3-6 Ernten und mit zwei Wildtyp-Zelllinien (SFC840-03-03, die Charakterisierung dieser Linie ist beschrieben in (Fernandes et al.21 und BIONi010-C). 1-Wege-ANOVA mit Dunnetts Post-hoc-Test, Vergleiche mit unbehandelten Zellen. *p < 0,05, ***p < 0,001. (D) Frisch fixierte SH-SY5Ys färben gleichmäßig für die Phosphatidylserin-Anzeige (Annexin V-FITC) und weisen eine begrenzte Zellpermeabilität auf (Propidiiumiodid). Lebende SH-SY5Ys färben sich nicht für Annexin V-FITC oder Propidiumiodid, mit Ausnahme der fokalen Färbung auf den wenigen toten Zellen in Kultur. Die Abbildungen werden mit Genehmigung von Alzheimer's Research & Therapy17reproduziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
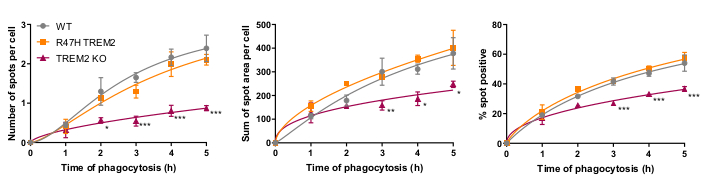
Abbildung 5: Phagozytose ist bei TREM2 KO reduziert, nicht jedoch bei R47H TREM2 iPSC-Makrophagen. Hochgehalts-Phagozytose-Assay mit 40.000 SH-SY5Ys pro Vertiefung mit gestaffelten Zusätzen. Die Mittelwerte wurden für die Parameter quantifiziert: Anzahl der Flecken pro Zelle, Summe der Fleckenbereiche (μm2)pro Zelle und Prozentsatz der Zellen, die phagozytosierte Partikel pro Feld enthalten. Die Daten wurden normalisiert, um für jeden Genotyp pro Experiment zu bedeuten. Mittelwert ± SEM, für N = 3 Ernten. Wiederholte Messungen 2-Wege-ANOVA, Dunnetts Post-hoc-Test, paarweise Vergleiche mit dem WT für jedes Mal: *p < 0,05, **p < 0,01, ***p < 0,001. Die Abbildungen werden mit Genehmigung von Alzheimer's Research & Therapy17reproduziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung S1: Beispiel QC für SH-SY5Ys Vorbereitung. Dissoziierte SH-SY5Ys wurden für 10 min mit 0% (lebende Zellen), 1% und 2% Paraformaldehyd (PFA) fixiert und dann gewaschen. Die Zellen wurden mit Annexin V-FITC und Propidieniodid (PI) gefärbt und sofort mittels Durchflusszytometrie gemessen. Farbdichtepunktdiagramme wurden in einer Durchflusszytometrie-Analysesoftware erstellt, wobei die einzelngefärbten und nicht gefärbten Steuerelemente verwendet wurden, um ein Quadrantentor zu platzieren. Quadranten werden mit dem Prozentsatz der Ereignisse innerhalb dieses Quadranten kommentiert. Lebende Zellen sind hauptsächlich in Q4 und feste Zellen sind hauptsächlich in Q2. Q1 = Annexin V-/PI-, Q2 = Annexin V+/PI+, Q3 = Annexin V+/PI-, Q4 = Annexin V-/PI- (lebende Zellen). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzendes Video: Lebendzell-Zeitraffer-Phagozytose. Repräsentatives Zeitraffervideo von SH-SY5Ys Phagozytos, die von Wildtyp-iPSC-Makrophagen BIONi010-C (ECACC ID: 66540023) gephässigt wurden. Die Bilder wurden alle 5 Minuten für 3 Stunden aufgenommen. Das Video wird zugeschnitten und läuft mit 3 Bildern pro Sekunde, wobei die letzten 1,5 Stunden des Assays angezeigt werden. Die säureempfindlichen farbstoffgefärbten SH-SY5Ys sind rot dargestellt, wobei die Signalintensität mit der Phagosomversauerung zunimmt. Mit Hoechst 33342 gefärbte Zellkerne sind blau dargestellt. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Diskussion
Mikroglia haben wichtige Funktionen, die die Initiierung und das Fortschreiten neurodegenerativer Erkrankungen beeinflussen, einschließlich der Phagozytose apoptotischer Neuronen. Beeinträchtigte mikrogliale Phagozytose und unangemessene Phagozytose von Synapsen wurden beide mit neurodegenerativen Erkrankungen in Verbindung gebracht, obwohl die zugrunde liegenden Mechanismen und die Kausalität nicht gut verstanden werden4,23. Dieser Artikel beschreibt einen Phagozytose-Assay zur Messung der Phagozytose apoptotischer Zellen durch iPSC-Makrophagen, entweder mit einer Live-Cell-Zeitraffer-Bildgebungsanzeige oder einer Fixzell-High-Content-Mikroskopie oder einer Kombination aus beidem auf einem einzigen Assay. Diese Vielseitigkeit bedeutet, dass der Assay verwendet werden kann, um einzelne phagozytäre Ereignisse im Laufe der Zeit in wenigen Vertiefungen zu untersuchen oder für high-content Screening mit mehreren Bedingungen oder Behandlungen verwendet zu werden. Da der High-Content-Assay auf einen einzigen Zeitpunkt fixiert ist, können mehrere Assay-Platten gleichzeitig hergestellt werden. Der High-Content-Assay hat potenziellen Nutzen für die Charakterisierung von Makrophagen/Mikroglia mit krankheitsbedingten genetischen Varianten oder das Screening von niedermolekularen Inhibitoren auf Veränderungen der Phagozytose. Der Assay kann auch leicht angepasst werden, um die Phagozytose anderer Mikrogliamodelle oder möglicherweise Astrozyten zu untersuchen. Der Phagozytose-Assay kann möglicherweise mit Lebendzellbildgebungsflecken, z. B. Mitochondrien-, Kalzium- oder ROS-Indikatoren, multiplexed und eine immunfluoreszierende Färbung nach der Fixierung für Proteine von Interesse durchgeführt werden. Im Vergleich zu bestehenden Phagozytose-Assays, die apoptotische neuronale Zellen verwenden, besteht der Hauptvorteile dieses Protokolls darin, dass die Herstellung der phagozyten Ladung relativ einfach und schnell ist und zu einem einheitlichen Produkt führt. Andere Assays induzieren Apoptose von Neuronen oder SH-SY5Ys mit S-Nitroso-L-Cystein für 2 h25, Okadainsäure für 3 h22, Staurosporin für 4-16 h26,27,28,29 oder UV-Bestrahlung für 24 h30und können zu Zellen in verschiedenen Stadien der Apoptose führen. Darüber hinaus wurden die Live-Cell-Imaging- und High-Content-Imaging-Auslesungen bisher nicht beschrieben, soweit den Autoren bekannt ist. Die Haupteinschränkung der Verwendung der Paraformaldehyd-Fixierung zur Herstellung der phagozytischen Ladung besteht darin, dass sie den Prozess der Apoptose nicht vollständig rekapituliert, da die Fixierung verhindert, dass sich die Zellen in apoptotische Körper aufspalten, die aufgrund ihrer geringeren Größe wahrscheinlich schneller phagozytosiert werden. Es ist nicht bekannt, welche Wirkung die Fixierung auf die Sekretion von Nukleotid-"Find me"-Signalen (z. B. ATP, UDP) aus der Zielzelle hat, die Phagozyten anziehen. Ähnlich wie apoptotische Zellen weisen die fixierten SH-SY5Ys eine gewisse Membranpermeabilität gegenüber Propidieniodid auf. Die Membranpermeabilität ist mit der Freisetzung von "Find Me" -Signalen verbunden; Dies wurde jedoch nicht in den fixierten SH-SY5Ys untersucht, und wenn die Nukleotide zu schnell freigesetzt werden, würden sie weggespült, bevor SH-SY5Ys zu den iPSC-Makrophagen hinzugefügt werden.
Der erste kritische Schritt im Protokoll ist die Färbung toter SH-SY5Ys mit einem STP-Ester eines pH-empfindlichen roten Fluoreszenzfarbstoffs. Dieser Farbstoff reagiert schnell und kovalent mit freien primären Aminen auf der Oberfläche der toten SH-SY5Ys. Die Dauer der Färbung muss nicht optimiert werden; Vor der Kennzeichnung ist jedoch vorsichtshalber mit dem Farbstoff umzugehen. Die Markierungsreaktion darf nicht in Puffern durchgeführt werden, die freie Amine enthalten. Weiterhin besteht Niederschlagsgefahr, wenn der DMSO-Stamm in kaltem wässrigem Puffer oder in hoher Endkonzentration verdünnt wird. Ausfällungen erscheinen als dichte dunkle Objekte unter dem Mikroskop. Zusätzlich haftet die pH-empfindliche Farbstofflösung an normalen Kunststoffzentrifugenröhrchen und wäscht sich langsam ab; Daher werden für den Markierungsschritt niedrig bindende Röhrchen empfohlen. Die Verwendung eines pH-empfindlichen Farbstoffs anstelle eines dauerhaft fluoreszierenden Farbstoffs unterstützt die Identifizierung von verschlungenen Partikeln im Vergleich zu Partikeln, die an die Plasmamembran angrenzen. Da es bei neutralem pH-Wert eine gewisse Fluoreszenz gibt, muss die Dichte von phagozytischer Fracht und iPSC-Makrophagen niedrig genug für eine genaue Segmentierung gehalten werden, obwohl sie hoch genug ist, dass zahlreiche phagozytäre Ereignisse erfasst werden. Die Hochgehaltsmikroskopie war in der Lage, Phagozytose mit einer mittleren Ladungsdichte im Bohrraum (mehr als 2 SH-SY5Ys pro iPSC-Makrophagen) genau zu identifizieren. Umgekehrt war aufgrund der schwächeren Empfindlichkeit des Mikroskops im tiefroten Spektrum die Segmentierung von iPSC-Makrophagen in den Live-Cell-Zeitraffer-Bildgebungsdaten weniger sicher und es war notwendig, eine sehr geringe Ladungsdichte zu verwenden, um die Wahrscheinlichkeit von Fehlalarmen zu reduzieren (1 SH-SY5Y für jeweils zwei iPSC-Makrophagen). Die Validierung der richtigen Segmentierung und Ladungsdichte sollte mit Vergleichen zwischen unbehandelten und Cytochalasin D-behandelten Vertiefungen durchgeführt werden. In einem gut optimierten Assay sollte Cytochalasin D die durchschnittliche Anzahl der Flecken pro Zelle um 90% im Vergleich zu unbehandelten Proben reduzieren.
Ein weiterer kritischer Schritt im Protokoll ist die iPSC-Makrophagenfärbung, die es ermöglicht, die Zelle in der Bildanalyse zu identifizieren und zu segmentieren, so dass externe SH-SY5Ys von der Zählung ausgeschlossen werden. Der empfohlene Farbstoff ist zelldurchlässig, im Zytoplasma in ein unlösliches fluoreszierendes Produkt umgewandelt, fixierbar und ungiftig (siehe Materialtabelle). Der Färbeschritt wurde für den Einsatz von iPSC-Makrophagen mit dem high-content imaging phagocytosis assay optimiert und wir schlagen vor, ihn neu zu optimieren, wenn andere Zelltypen verwendet werden. Die Dauer der Zellfärbung kann erhöht werden, um die Ablagerung des unlöslichen fluoreszierenden Produkts in den Zellen zu verbessern. Wenn die Farbstoffkonzentration optimiert ist, sollte darauf geachtet werden, toxische Konzentrationen des organischen Lösungsmittelvehikels zu vermeiden.
Der dritte kritische Faktor für den Erfolg des Assays ist die Datenanalyse. Die bereitgestellten Analysepipelines sollen eher als Orientierungshilfe denn als Vorschrift dienen, da Unterschiede in der Färbeintensität oder Zellmorphologie die Wirksamkeit der Segmentierung der Pipelines wie geschrieben verringern können. Einige Optimierungen sind daher erforderlich, wobei die Pipeline auf geeignete Positiv- und Negativkontrollen getestet wird, und die Parameter, die optimiert werden sollen, sind im Protokolltext angegeben. Negativkontrollen sollten eine Erkrankung umfassen, bei der iPSC-Makrophagen vor der Zugabe von SH-SY5Ys mit einem starken Phagozytosehemmer wie Cytochalasin D vorbehandelt werden. Eine weitere mögliche Negativkontrolle ist die Zugabe der SH-SY5Ys zu zuvor unbehandelten Vertiefungen von iPSC-Makrophagen am Ende des Assays, 10 Minuten vor der Fixierung, was eine gewisse Ablagerung der Ladung ermöglicht, aber zu kurz ist, um eine nennenswerte Menge an Phagozytose aufzutreten. Ein Phagozytoseereignis ist definiert als ein rot fluoreszierendes Objekt innerhalb der Grenzen eines iPSC-Makrophagen, das vom Softwarealgorithmus unter Verwendung des tiefroten Fluoreszenzkanals definiert wird. Bei schlechter Segmentierung der Zellen (Abbildung 2) können viele nicht phagozytosierte SH-SY5Ys in unmittelbarer Nähe zu iPSC-Makrophagen fälschlicherweise in die Analyse einbezogen werden, d.h. falsch positive Ergebnisse. Der wichtigste Faktor für eine gute Segmentierung ist die stringente Abgrenzung der iPSC-Makrophagen. Die Segmentierung für beide Analysen ist automatisiert, so dass es nicht möglich ist, für jede Zelle eine perfekte Segmentierung zu erhalten. Einige Parameter können jedoch angepasst werden, um die Segmentierung optimaler zu gestalten, wobei einige Testbilder als Referenz verwendet werden. Die Cytochalasin-D-Kontrolle ist wichtig für die Beurteilung einer optimalen Segmentierung, da eine hohe Anzahl von phagozyttischen Ereignissen, die in diesem Zustand festgestellt wurden, darauf hindeutet, dass die Segmentierung suboptimal ist. Die Optimierung der Datenanalyse-Pipeline sollte idealerweise wiederholt werden, bis die Anzahl der phagozyten Ereignisse pro Zelle im Cytochalasin-D-Zustand um 80% -90% niedriger ist als ohne Inhibitor.
Die Probleme mit dem Phagozytose-Assay, die am wahrscheinlichsten auftreten, sind: (1) schwache pH-sensitive Fluoreszenz in Positivkontrollen, (2) spärliche oder ungleichmäßige Verteilung von Makrophagen am Ende des Assays oder (3) hohe Anzahl von falsch positiven Ergebnissen in der Analyse von nicht phagozytosierten SH-SY5Ys. Bei der Fehlerbehebung bei schwacher pH-sensitiver Fluoreszenz sollte zunächst überprüft werden, ob die Färbung des SH-SY5Ys zu einem Zellpellet mit einer starken magentafarbenen Farbe führte. Wenn die Farbe schwach ist, stellen Sie sicher, dass ein frischer Farbstoffvorrat verwendet wird, stellen Sie sicher, dass der Etikettierpuffer aminfrei ist, waschen Sie die SH-SY5Ys vor dem Färben zusätzlich, überprüfen Sie, ob die richtige Anzahl von SH-SY5Ys gefärbt wurde, stellen Sie sicher, dass keine Farbstofffällungen nachgewiesen werden, und optimieren Sie die Markierungskonzentration des Farbstoffs. Wenn die SH-SY5Ys stark gefärbt sind, überprüfen Sie, ob die der Assayplatte zugesetzte Konzentration korrekt ist, und stellen Sie sicher, dass die iPSC-Makrophagen gesund und nicht zu alt sind. Die zweite Art von Problem, die ungleichmäßige Makrophagenverteilung, kann durch den Verlust von Zellen während des Pipettierens entstehen, und es sollten Schritte unternommen werden, um die pipettierenden Kräfte der Zellen zu reduzieren und schmale Bohrungsspitzen zu vermeiden. Wenn das Problem weiterhin besteht, reduzieren Sie die Inkubationszeit für die Beladung der iPSC-Makrophagen mit zelldurchlässigem Farbstoff. Das dritte Problem, die fehlerhafte Einbeziehung von nicht phagozytierten Partikeln in die Analyse, deutet darauf hin, dass eine weitere Optimierung der Analysepipeline erforderlich ist. Die Fehlerbehebung sollte sich zunächst auf die Zellsegmentierung konzentrieren und darauf, ob die Software benachbarte Objekte enthält. Spezifische Parameter, die angepasst werden können, werden in den Anmerkungen unter den relevanten Schritten vorgeschlagen (Schritte 6.1.11-6.1.15 für die Lebendzell-Zeitrafferanalyse und Schritte 6.2.4-6.2.8 für die High-Content-Analyse). Wenn die Zellsegmentierung nicht weiter verbessert werden kann, hat die High-Content-Analyse einen zusätzlichen Schritt (Schritt 6.2.8), der falsch segmentierte iPSC-Makrophagen ausschließt. Darüber hinaus kann das Modul, das akzeptierte Flecken pH-sensitiver Fluoreszenz innerhalb von iPSC-Makrophagen filtert, optimiert werden, wodurch die Schwellenwertintensität akzeptierter Objekte erhöht wird, was dazu beitragen soll, nicht phagozytosierte SH-SY5Ys auszuschließen (Schritt 6.1.17 für die Live-Zell-Zeitrafferanalyse und Schritt 6.2.11 für die High-Content-Analyse).
Wir haben zwei Arten der Mikroskopieauslesung für den Phagozytose-Assay entwickelt, die jeweils Vorteile und Grenzen haben. Die Live-Cell-Zeitraffer-Bildgebung hat den Vorteil, zusätzliche Informationen über die Phagozytose-Kinetik zu liefern und ist breiter verfügbar als High-Content-Bildgebungsplattformen. Die empfohlene Open-Source-Software ist unabhängig von der Mikroskopquelle und kann mit jedem hochwertigen Fluoreszenzmikroskop mit oder ohne Live-Cell-Zeitrafferfähigkeit verwendet werden. Die Haupteinschränkung der Lebendzellbildgebung ist die begrenzte Empfindlichkeit und Optik, die es schwieriger machen, eine gute Segmentierung von iPSC-Makrophagen zu erkennen und durchzuführen. Diese Einschränkung könnte entweder durch eine Erhöhung der Dauer der iPSC-Makrophagenfärbung oder durch den Wechsel zu einem empfindlicheren Mikroskop, falls verfügbar, gemildert werden. Der High-Content Imaging Phagozytosis Assay ist die empfohlene Auslesung, wenn ein High-Content Imaging System verfügbar ist. High-Content-Bildgebungssysteme ermöglichen einen höheren Durchsatz und zuverlässigere Daten, so dass dieser Assay für das Screening verwendet werden kann, bei dem ein robustes Z' von ≥0,7 für die Ausgabe "Anzahl der Spots pro Zelle"20erwartet wird. Im Vergleich zur Lebendzell-Zeitraffermethode hat die hochgehaltige Mikroskopieauslesung eine höhere Empfindlichkeit, einen höheren Automatisierungsgrad und eine höhere Geschwindigkeit, mehr Vertiefungen und Bildgebungsfelder können verarbeitet werden und es werden hochauflösende konfokale Bilder erzeugt. Die Zellsegmentierung ist mit guten Bildern effektiver, und die Segmentierung wird zusätzlich durch die high-content-Bildanalysesoftware unterstützt, die mehr Zellsegmentierungsmethoden bietet, die für stark unregelmäßig geformte Zellen geeignet sind. Die High-Content-Imaging-Analysesoftware berechnete im Vergleich zur Open-Source-Software auch mehr Parameter der Phagozytose, wie z.B. den Prozentsatz der phagozyten Zellen. Die Haupteinschränkung des High-Content-Phagozytose-Assays besteht in den Kosten und der Zugänglichkeit des Bildgebungssystems und der Analysesoftware.
Zusammenfassend lässt sich sagen, dass der in diesem Artikel vorgestellte quantitative Phagozytose-Assay ein nützliches Werkzeug zur Modellierung der Mikroglia-Phagozytose toter Neuronen in vitro ist. Die Mikroglia werden von iPSC-Makrophagen modelliert und die toten Neuronen von paraformaldehydfixierten SH-SY5Ys. Obwohl nicht die authentischsten Mikroglia- und toten/ apoptotischen Neuronenmodelle veröffentlicht wurden, sind diese einfach zu erstellen und skalierbar. Der Assay selbst ist sehr vielseitig, mit zwei Arten von Bildauslesung detailliert und hat das Potenzial, für die Verwendung mit verschiedenen Mikroglia / Makrophagen-Monokulturmodellen oder einem anderen Zelltyp angepasst zu werden, um als phagozytische Fracht zu fungieren. Die hochauflösende Bildauslesung ist vorteilhaft für die Gewinnung quantitativer Daten und kann skaliert werden, um niedermolekulare Modulatoren der Phagozytose zu testen oder genetische Varianten in den iPSC-Makrophagen zu screenen. Da High-Content-Bildgebungssysteme jedoch teuer und datenintensiv sind, wurde eine alternative Bildauslesung mit einem Lebendzell-Zeitraffermikroskop in das Protokoll aufgenommen, das bei Bedarf jedes herkömmliche Fluoreszenzmikroskop von guter Qualität ersetzen könnte.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Die Autoren danken Dr. Val Millar und Dr. Sohaib Nizami für ihre Unterstützung bei der High-Content-Mikroskopie und Dr. Daniel Ebner für den Zugang zu den High-Content-Mikroskopen. Darüber hinaus danken die Autoren Dr. Emma Mead für die Beratung zur Assay-Entwicklung und Frau Cathy Browne für die iPSC-Unterstützung. Diese Arbeit wurde vom Alzheimer's Research UK Oxford Drug Discovery Institute (ARUK ODDI, Förderreferenz ARUK-2020DDI-OX) unterstützt, mit zusätzlicher Unterstützung für die James Martin Stem Cell Facility Oxford (S.A.C.) von der Oxford Martin School LC0910-004; Monument Trust Discovery Award von Parkinson's UK (J-1403); die MRC Dementias Platform UK Stem Cell Network Capital Equipment MC_EX_MR/N50192X/1, Partnership MR/N013255/1 und Momentum MC_PC_16034 Awards.
Materialien
| Name | Company | Catalog Number | Comments |
| 15 mL conical centrifuge tube | Falcon | 352096 | For centrifugation of cells |
| 2-20 µL, 20-200 µL, 100-1000 µL single-channel micropipettes | |||
| 2-mercaptoethanol 50 mM | Gibco | 31350010 | Component of Factory media |
| 4% paraformaldehyde in PBS | Alfa Aesar | J61899 | For fixation of cells |
| 6-well plate, tissue culture treated | |||
| AggreWell-800 24-well plate | STEMCELL Technologies | 34815 | Microwell low-adherence 24-well plate for formation of embryoid bodies |
| Annexin V-FITC Apoptosis Staining / Detection Kit | Abcam | ab14085 | Kit for annexin V-FITC staining , as an assay for quality control of fixed SH-SY5Ys. Kit contains annexin binding buffer, annexin V-FITC, and propidium iodide. |
| Automated cell counter | |||
| Benchtop centrifuge | |||
| Benchtop microcentrifuge | |||
| CellCarrier-96 Ultra Microplates, tissue culture treated, black, 96-well with lid | Perkin Elmer | 6055302 | 96-well tissue culture (TC)-treated microplate with black well walls and an optically-clear bottom, for phagocytosis assay |
| CellProfiler software | Open-source software for analysis of phagocytosis images obtained by live-cell time-lapse microscope. Download for free from website (http://cellprofiler.org/), this protocol used version 2.2.0. | ||
| CellTracker Deep Red dye | Thermo Fisher | C34565 | Deep red-fluorescent, cell-permeant, succinimidyl ester-reactive dye for staining cytoplasm of iPS-macrophages. Dissolve CellTracker Deep Red dye in DMSO to 2 mM (1.4 mg/mL). Use at 1 μM, by dilution of DMSO stock with Macrophage media. |
| Class 2 laminar air flow safety cabinet | |||
| CO2 gas bottle | Accessory for EVOS FL Auto | ||
| CO2 incubator, set to 37°C and 5 % CO2 | |||
| Columbus Image Data Storage and Analysis System | Perkin Elmer | Columbus | Data storage and analysis platform for Opera Phenix. Supports all major high content screening instruments. |
| Cytochalasin D | Cayman | 11330 | Negative control treatment for phagocytosis assay. Reconstitute in DMSO to 10 mM and store aliquots at -20°C, avoid further freeze-thaw cycles. Use at final concentration 10 µM. |
| DMEM/F12 | Gibco | 11320074 | Component of SH-SY5Y media |
| DMSO | Sigma | D8418 | Solvent for CellTracker and pHrodo dyes |
| EVOS FL Auto Imaging System | Thermo Fisher | AMF4300 | Live-cell time-lapse imaging microscope |
| EVOS Light Cube CY5 | Thermo Fisher | AMEP4656 | Accessory for EVOS FL Auto |
| EVOS Light Cube DAPI | Thermo Fisher | AMEP4650 | Accessory for EVOS FL Auto |
| EVOS Light Cube RFP | Thermo Fisher | AMEP4652 | Accessory for EVOS FL Auto |
| EVOS Onstage Incubator | Thermo Fisher | AMC1000 | Accessory for EVOS FL Auto |
| Fetal Bovine Serum | Sigma | F4135 | Component of SH-SY5Y media |
| Flow cytometer | |||
| Flow cytometry analysis software | |||
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Invitrogen | A1413302 | hESC-qualified basement membrane matrix for iPSC culture |
| GlutaMAX Supplement | Gibco | 35050-038 | Component of both Factory and Macrophage media |
| HBSS | Lonza | BE 10-547F | Hank’s balanced salt solution for washing steps |
| Human recombinant BMP4 | Gibco | PHC9534 | Component of Embryoid Body media |
| Human recombinant IL-3 | Gibco | PHC0033 | Component of both Factory and Macrophage media |
| Human recombinant SCF | Miltenyi Biotech | 130-096-695 | Component of Embryoid Body media |
| Human recombinant VEGF | Gibco | PHC9394 | Component of Embryoid Body media |
| Live Cell Imaging Solution | Thermo Fisher | A14291DJ | Phenol red-free HEPES-buffered media for labelling dead SH-SY5Ys |
| Low protein binding 2 mL tubes | Eppendorf | 30108.132 | For staining SH-SY5Ys |
| M-CSF | Thermo Fisher | PHC9501 | Component of both Factory and Macrophage media |
| mTeSR1 Medium | STEMCELL Technologies | 85850 | iPSC media |
| Multichannel 20-200 uL pipette | For liquid handling of 96-well plate | ||
| NucBlue Live ReadyProbes Reagent | Thermo Fisher | R37605 | Hoechst 33342 formulation in a dropper bottle for staining nuclei of iPS-macrophages, use 0.5 drops/mL in Macrophage media. |
| Opera Phenix High-Content Screening System | Perkin Elmer | HH14000000 | High-content imaging microscope, used with Harmony software version 4.9. |
| Penicillin-Streptomycin | Gibco | 15140-122 | Component of Factory, Macrophage, and SH-SY5Y media |
| pHrodo iFL Red STP-Ester | Thermo Fisher | P36011 | pH-sensitive red fluorescent dye for labelling dead SH-SY5Ys. Reconstitute pHrodo iFL Red STP Ester powder in DMSO to a 5 mg/mL concentration. For each 1 million SH-SY5Ys, add 2.5 μL (12.5 μg) of pHrodo iFL Red STP Ester stock to pre-warmed cells suspended in Live Cell Imaging Solution. |
| Serological pipette filler | |||
| T175 flask, tissue culture treated | Vessel for differentiations of iPSC-macrophage precursors, known as "Factories" | ||
| T75 flask | Vessel for SH-SY5Y culture | ||
| Transparent plate sealers | Greiner Bio-One | 676001 | For assay plate storage and transportation |
| TrypLE Express (1X), no phenol red | Gibco | 12604013 | Cell dissociation buffer containing recombinant trypsin-like enzymes and 1.1 mM EDTA, use neat. |
| Water bath, set to 37°C | |||
| X-VIVO 15 Medium with L-glutamine, gentamicin, and phenol red | Lonza | BE04-418F | Component of Factory and Macrophage media |
| X-VIVO 15 Medium with L-glutamine; without gentamicin or phenol red | Lonza | 04-744Q | Phenol red-free macrophage media, for use in phagocytosis without additives or growth factors |
Referenzen
- Hochreiter-Hufford, A., Ravichandran, K. S. Clearing the dead: apoptotic cell sensing, recognition, engulfment, and digestion. Cold Spring Harbour Perspectives in Biology. 5, 008748 (2013).
- Freeman, S. A., Grinstein, S. Phagocytosis: receptors, signal integration, and the cytoskeleton. Immunological Reviews. 2262, 193-215 (2014).
- Hickman, S., Izzy, S., Sen, P., Morsett, L., El Khoury, J. Microglia in neurodegeneration. Nature Neuroscience. 21 (10), 1359-1369 (2018).
- Galloway, D. A., Phillips, A. E. M., Owen, D. R. J., Moore, C. S. Phagocytosis in the brain: Homeostasis and disease. Frontiers in Immunology. 10, 790 (2019).
- Nizami, S., Hall-Roberts, H., Warrier, S., Cowley, S. A., Di Daniel, E. Microglial inflammation and phagocytosis in Alzheimer's disease: potential therapeutic targets. British Journal of Pharmacology. 176 (18), 3515-3532 (2019).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), 712-716 (2016).
- Neher, J. J., et al. Inhibition of microglial phagocytosis is sufficient to prevent inflammatory neuronal death. The Journal of Immunology. 186 (8), 4973-4983 (2011).
- Brown, G. C., Neher, J. J. Microglial phagocytosis of live neurons. Nature Reviews Neuroscience. 15 (4), 209-216 (2014).
- Scott-Hewitt, N., et al. Local externalization of phosphatidylserine mediates developmental synaptic pruning by microglia. The EMBO Journal. 39 (16), 105380 (2020).
- Li, T., et al. A splicing isoform of GPR56 mediates microglial synaptic refinement via phosphatidylserine binding. The EMBO Journal. 39 (16), 104136 (2020).
- Sapar, M. L., et al. Phosphatidylserine externalization results from and causes neurite degeneration in Drosophila. Cell Reports. 24 (9), 2273-2286 (2018).
- Skjesol, A., et al. The TLR4 adaptor TRAM controls the phagocytosis of Gram-negative bacteria by interacting with the Rab11-family interacting protein 2. PLOS Pathogens. 15 (3), 1007684 (2019).
- Wong, K., Li, X., Ma, Y. Paraformaldehyde induces elevation of intracellular calcium and phosphatidylserine externalization in platelets. Thrombosis Research. 117 (5), 537-542 (2006).
- van Wilgenburg, B., Browne, C., Vowles, J., Cowley, S. A. Efficient, long term production of monocyte-derived macrophages from human pluripotent stem cells under partly-defined and fully-defined conditions. PLoS One. 8 (8), (2013).
- Haenseler, W., et al. A highly efficient human pluripotent stem cell microglia model displays a neuronal-co-culture-specific expression profile and inflammatory response. Stem Cell Reports. 8 (6), 1727-1742 (2017).
- Buchrieser, J., James, W., Moore, M. D. Human induced pluripotent stem cell-derived macrophages share ontogeny with MYB-independent tissue-resident macrophages. Stem Cell Reports. 8 (2), 334-345 (2017).
- Hall-Roberts, H., et al. TREM2 Alzheimer's variant R47H causes similar transcriptional dysregulation to knockout, yet only subtle functional phenotypes in human iPSC-derived macrophages. Alzheimer's Research & Therapy. 12, 151 (2020).
- Friedman, B. A., et al. Diverse brain myeloid expression profiles reveal distinct microglial activation states and aspects of Alzheimer's disease not evident in mouse models. Cell Reports. 22 (3), 832-847 (2018).
- Aziz, M., Yang, W. L., Wang, P. Measurement of phagocytic engulfment of apoptotic cells by macrophages using pHrodo succinimidyl ester. Current Protocols in Immunology. 100, 1-8 (2013).
- Atmaramani, R., Pancrazio, J. J., Black, B. J. Adaptation of robust Z' factor for assay quality assessment in microelectrode array based screening using adult dorsal root ganglion neurons. Journal of Neuroscience Methods. 339, 108699 (2020).
- Fernandes, H. J. R., et al. ER Stress and Autophagic Perturbations Lead to Elevated Extracellular α-Synuclein in GBA-N370S Parkinson's iPSC-Derived Dopamine Neurons. Stem Cell Reports. 6 (3), 342-356 (2016).
- Takahashi, K., Rochford, C. D. P., Neumann, H. Clearance of apoptotic neurons without inflammation by microglial triggering receptor expressed on myeloid cells-2. Journal of Experimental Medicine. 201 (4), 647-657 (2005).
- Kober, D. L., Brett, T. J. TREM2-ligand interactions in health and disease. Journal of Molecular Biology. 429 (11), 1607-1629 (2017).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), 712-716 (2016).
- Witting, A., Müller, P., Herrmann, A., Kettenmann, H., Nolte, C. Phagocytic clearance of apoptotic neurons by microglia/brain macrophages in vitro: Involvement of lectin-, integrin-, and phosphatidylserine-mediated recognition. Journal of Neurochemistry. 75 (3), 1060-1070 (2000).
- Hsieh, C. L., et al. A role for TREM2 ligands in the phagocytosis of apoptotic neuronal cells by microglia. Journal of Neurochemistry. 109 (4), 1144-1156 (2009).
- Beccari, S., Diaz-Aparicio, I., Sierra, A. Quantifying microglial phagocytosis of apoptotic cells in the brain in health and disease. Current Protocols in Immunology. 122 (1), 49 (2018).
- Diaz-Aparicio, I., et al. Microglia actively remodel adult hippocampal neurogenesis through the phagocytosis secretome. Journal of Neuroscience. 40 (7), 1453-1482 (2020).
- Shirotani, K., et al. Aminophospholipids are signal-transducing TREM2 ligands on apoptotic cells. Scientific Reports. 9 (1), 1-9 (2019).
- Garcia-Reitboeck, P., et al. Human induced pluripotent stem cell-derived microglia-like cells harboring TREM2 missense mutations show specific deficits in phagocytosis. Cell Reports. 24 (9), 2300-2311 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten