Method Article
Essai d’imagerie quantitative in vitro pour la phagocytose des cellules mortes du neuroblastome par iPSC-Macrophages
Dans cet article
Résumé
Les maladies neurodégénératives sont associées à des fonctions microgliales dérégulées. Cet article décrit un test in vitro de phagocytose des cellules de neuroblastome par les macrophages iPSC. Les lectures de microscopie quantitative sont décrites à la fois pour l’imagerie time-lapse sur cellules vivantes et l’imagerie à haut contenu à cellules fixes.
Résumé
Les microglies orchestrent les réponses neuroimmunes dans plusieurs maladies neurodégénératives, dont la maladie de Parkinson et la maladie d’Alzheimer. La microglie élimine les neurones morts et mourants grâce au processus d’efférocytose, une forme spécialisée de phagocytose. La fonction de phagocytose peut être perturbée par des facteurs de risque environnementaux ou génétiques qui affectent la microglie. Cet article présente un protocole de microscopie in vitro rapide et simple pour étudier l’efférocytose microgliale dans un modèle de microglie de cellules souches pluripotentes induites (iPSC), en utilisant une lignée cellulaire de neuroblastome humain (SH-SY5Y) étiquetée avec un colorant sensible au pH pour la cargaison phagocytaire. La procédure entraîne un rendement élevé de cellules mortes du neuroblastome, qui présentent de la phosphatidylsérine de surface, reconnue comme un signal « mangez-moi » par les phagocytes. Le test sur plaque à 96 puits convient à l’imagerie accélérée de cellules vivantes, ou la plaque peut être fixée avec succès avant un traitement ultérieur et quantifiée par microscopie à haute teneur. La microscopie à haute teneur à cellules fixes permet d’étendre le test pour le dépistage d’inhibiteurs de petites molécules ou l’évaluation de la fonction phagocytaire des lignées génétiques iPSC. Bien que ce test ait été développé pour étudier la phagocytose de cellules de neuroblastome mortes entières par des macrophages iPSC, le test peut être facilement adapté à d’autres cargaisons pertinentes pour les maladies neurodégénératives, telles que les synaptosomes et la myéline, et d’autres types de cellules phagocytaires.
Introduction
Les microglies sont des macrophages résidents du tissu cérébral et leurs fonctions comprennent la surveillance immunitaire, la coordination des réponses inflammatoires aux blessures / infections, le remodelage synaptique et la phagocytose des cellules mortes, de la myéline, des agrégats de protéines et des agents pathogènes. La phagocytose est le processus par lequel les microglies reconnaissent la cargaison avec les récepteurs de surface et réorganisent leur cytosquelette pour engloutir l’objet dans un phagosome, qui fusionne ensuite avec des lysosomes pour la dégradation de la cargaison. Microglia phagocytose saine des cellules cérébrales apoptotiques pour les éliminer avant qu’elles ne deviennent nécrotiques1. La phagocytose des cellules apoptotiques est également connue sous le nom d’efférocytose, et nécessite l’affichage d’un signal de phosphatidylsérine « mange-moi » par la cellule mourante2. De nombreux récepteurs de microglies se lient directement à la phosphatidylsérine, notamment TIM-4, BAI1, Stabilin-2 et TREM2. Les récepteurs TAM microgliaux (p. ex. MERTK) et les intégrines se lient indirectement à la phosphatidylsérine, en utilisant respectivement les protéines accessoires GAS6 ou MFG-E8. D’autres signaux « mangez-moi » peuvent être nécessaires pour la reconnaissance des cellules mourantes, notamment des modifications de la glycosylation ou de la charge de protéines de surface; expression des protéines intracellulaires ICAM3, calréticuline, annexine-I à la surface de la cellule; LDL oxydé; ou revêtement de la cellule apoptotique par un complément produit par microglie C1q1,2.
Les maladies neurodégénératives, y compris la maladie de Parkinson, la maladie d’Alzheimer, la démence frontotemporale et la sclérose latérale amyotrophique ont été associées à une altération de la fonction microgliale, y compris une accumulation de déchets cérébraux tels que des cellules mortes, des fragments de myéline et des agrégats de protéines, et des réponses inflammatoires exagérées à ces stimuli3. La phagocytose peut être altérée dans les maladies neurodégénératives et contribuer à la pathologie, en raison d’une combinaison de vieillissement, d’inflammation ou de variantes de risque génétique spécifiques4,5. D’autre part, il existe également des preuves provenant de modèles animaux de maladies neurodégénératives que la microglie peut phagocytose inappropriée des neurones viables ou des synapses6,7,8. Le mécanisme est susceptible d’être provoqué par l’affichage de la phosphatidylsérine de neurites endommagées, qui est directement détectée par les récepteurs de phagocytose microgliale TREM2 ou GPR56, ou indirectement détectée par le complément soluble C1q recouvrant la membrane enrichie en phosphatidylsérine, conduisant à une phagocytose médiée par CR39,10,11.
Les essais in vitro de la fonction phagocytose, par exemple pour évaluer l’impact phénotypique d’une variante de risque génétique dans la microglie, sont fréquemment effectués à l’aide de cargaisons non physiologiques telles que des perles de latex4. Des bactéries et du zymosan marqués par fluorescence sont également utilisés, qui sont physiologiques mais non pertinents pour les maladies neurodégénératives. Les cargaisons phagocytaires non physiologiques peuvent être utilisées pour détecter des défauts dans la machinerie de base de l’engloutissement phagocytaire, mais ne parviennent pas à modéliser avec précision la première étape de « reconnaissance » de la phagocytose des neurones apoptotiques. La taille, la forme, la rigidité et le type de cargaison dictent également les voies de signalisation intracellulaires qui sont activées, conduisant à différents résultats de l’état d’activation de la microglie. Par exemple, les bactéries E. coli sont petites et rigides, contrairement aux cellules humaines, et les lipopolysaccharides à leur surface sont reconnus par le récepteur de type Toll 4 (TLR4) qui active la phagocytose et les voies de signalisation pro-inflammatoires2,12.
Dans le contexte des études sur les maladies neurodégénératives, une cargaison phagocytaire plus pertinente aurait un affichage de phosphatidylsérine sur les membranes plasmiques des mammifères, et serait idéalement humaine et neuronale, pour inclure des signaux que la microglie est susceptible de rencontrer. Pour ce protocole de phagocytose, la lignée cellulaire de neuroblastome humain SH-SY5Y a été choisie comme modèle de neurone facile à mettre en culture. L’affichage permanent de la phosphatidylsérine de surface a été induit artificiellement par le paraformaldéhyde, dont il a déjà été démontré qu’il provoquait l’affichage de la phosphatidylsérine des plaquettes13. Pour le modèle cellulaire de la microglie, des macrophages iPSC humains ont été utilisés, qui imitent l’ontogenèse et le profil transcriptionnel de la microglie humaine, et sont phagocytairement compétents14,15,16,17. Les macrophages iPSC ne sont pas le modèle de microglie le plus authentique disponible, par exemple, ils n’imitent pas la morphologie des microglies; cependant, on peut le substituer à un modèle de microglie iPSC en monoculture plus authentique si l’on le souhaite, tel que Haenseler et al.15. Les modèles iPSC humains sont préférables à la microglie primaire des rongeurs pour l’étude de la neurodégénérescence, en raison des préoccupations concernant le chevauchement limité des modules transcriptionnels de la microglie observés dans les tissus de maladies neurodégénératives humaines par rapport à la souris18. Les SH-SY5Y morts sont colorés avec un colorant sensible à l’acide qui fluoresce faiblement à pH neutre et plus fortement à l’intérieur des phagolysosomes des macrophages iPSC après phagocytose. L’utilisation d’un colorant sensible à l’acide améliore la précision de la détection des événements phagocytaires, avec une polyvalence pour différentes lectures de macrophages vivants et fixes19. Ce protocole décrit à la fois l’imagerie time-lapse à cellules vivantes de la phagocytose et un test d’imagerie fixe à haute teneur pour la phagocytose, avec les mêmes étapes de préparation cellulaire avant la lecture (Figure 1).
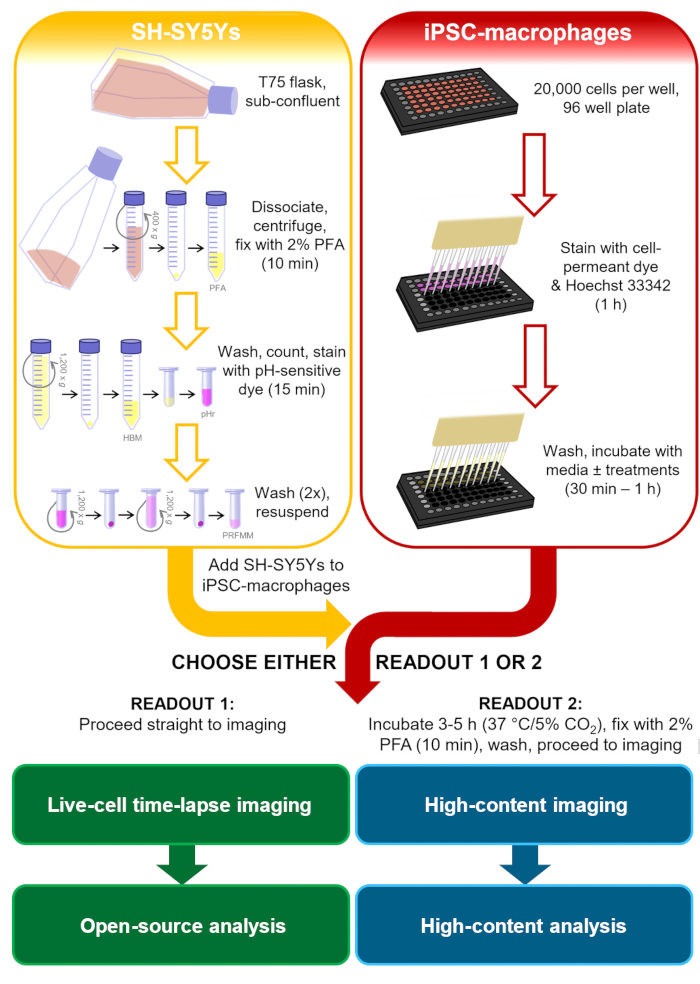
Figure 1: Schéma de méthodologie. Contour du test de phagocytose, où la préparation des SH-SY5Y et la coloration des macrophages iPSC sont effectuées en parallèle, puis les SH-SY5Y sont pipetés sur les macrophages iPSC. Soit l’imagerie time-lapse des cellules vivantes est effectuée immédiatement, soit les cellules sont incubées à 37 °C/5 % de CO2 pendant la durée requise et fixées avant d’effectuer une microscopie à haute teneur. PFA: paraformaldéhyde, HBM: milieu tamponné HEPES sans phénol, pHr: colorant fluorescent rouge sensible au pH SOLUTION D’ester STP, PRFMM: milieux macrophages sans phénol rouge. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
Le protocole suit les lignes directrices pour l’utilisation de lignées cellulaires iPS humaines dérivées de l’Université d’Oxford, Oxford Parkinson’s Disease Centre (Comité d’éthique: National Health Service, Health Research Authority, NRES Committee South Central, Berkshire, Royaume-Uni (REC 10/ H0505/71)). Les CSPi humaines doivent être manipulées dans une armoire de sécurité de classe II afin de protéger le travailleur contre d’éventuels agents adventices. Les réglementations locales, nationales et européennes en matière de santé et de sécurité doivent être respectées. Les compositions des milieux de culture cellulaire sont détaillées dans le tableau 1, et tous les matériaux sont énumérés dans le tableau supplémentaire des matériaux.
1. Culture cellulaire avant l’expérience
- Culture de CSI iPS dans des milieux iPSC (Tableau 1) dans des plaques à 6 puits pré-revêtues d’une matrice de membrane basale qualifiée hESC, sous-confluente et à un faible nombre de passage.
- Différencier les CSI humains des précurseurs de macrophages iPSC : ensemencez quatre millions d’iPSC dans une plaque de 24 puits à faible adhérence avec 2 mL de milieux corporels embryoïdes(tableau 1)pour encourager la formation de corps irysides et effectuer des changements de milieu de 75 % par jour pendant 5 à 6 jours. Transférer les corps d’embryons dans des flacons T175, environ 150 corps d’embryoïdes par flacon, contenant 20 mL de milieux d’usine (Tableau 1). Alimentation hebdomadaire par addition de 10 à 20 mL de milieux d’usine.
REMARQUE: Les précurseurs de macrophages iPSC émergent dans le surnageant après environ 2-3 semaines et sont produits en continu pendant plusieurs mois. Pour cette expérience, il est préférable d’utiliser des cellules à partir d’environ 6 semaines après la mise en place des usines de différenciation. Les macrophages iPSC récoltés plus tôt peuvent conserver une certaine capacité proliférative et sont moins adhérents, empêchant même l’ensemencement à une faible densité cellulaire. Une limite d’âge supérieure pour la capacité de phagocytose n’a pas été déterminée. - Différencier les précurseurs des macrophages iPSC des macrophages iPSC : récolter les précurseurs en éliminant le volume requis de surnageant; le faire passer à travers une passoire cellulaire de 40 μm pour éliminer les amas; centrifuger à 400 x g pendant 5 min pour granuler les cellules et les mettre en service dans des milieux macrophages (Tableau 1). Semer des macrophages iPSC à 20 000-30 000 cellules par puits dans une microplaque traitée par culture tissulaire (TC) de 96 puits avec des parois de puits noires et un fond optiquement clair, dans 100 μL de milieux de macrophages par puits. Évitez les puits de bord et remplissez-les de PBS; ceci est important pour réduire l’effet de l’évaporation sur le test. Différencier pendant 6-10 jours par incubation à 37 °C/5% CO2.
REMARQUE: Pour ce test, la ligne iPSC BIONi010-C (ECACC ID: 66540023) a été utilisée; cependant, une autre ligne iPSC peut être substituée. - Maintenir les SH-SY5Y à la sous-fluidité dans les flacons T75 avec 20 mL de milieu SH-SY5Y (Tableau 1), en passant tous les 3-4 jours.
| Nom | Supports de base | Additif, concentration finale |
| Supports iPSC | mTeSR1 | - |
| Milieux du corps embryoïde | mTeSR1 | BMP4, 50 ng/mL |
| VEGF, 50 ng/mL | ||
| CSAH, 20 ng/mL | ||
| Supports d’usine | XVIVO15 | GlutaMAX, 2 mM |
| Pénicilline, 100 unités/mL | ||
| Streptomycine, 100 μg/mL | ||
| 2-Mercaptoéthanol, 50 μM | ||
| IL-3, 25 ng/mL | ||
| M-CSF, 100 ng/mL | ||
| Supports de macrophages | XVIVO15 | GlutaMAX, 2 mM |
| Pénicilline, 100 unités/mL | ||
| Streptomycine, 100 μg/mL | ||
| M-CSF, 100 ng/mL | ||
| Média SH-SY5Y | DMEM/F12 | Sérum bovin fœtal, 10% |
| Pénicilline, 100 unités/mL | ||
| Streptomycine, 100 μg/mL |
Tableau 1 : Recettes des médias.
Constituants des milieux de culture cellulaire utilisés dans le protocole. Vous trouverez de plus amples détails sur les composants des médias dans le Tableau des matériaux.
2. Préparation des SH-SY5Y morts
- Dans une armoire de sécurité biologique de classe II, dissocier les SH-SY5Y, par addition de 4 mL d’un tampon de dissociation cellulaire contenant des enzymes recombinantes de type trypsine et de 1,1 mM d’EDTA (voir Tableau des matériaux),qui doivent être retirés immédiatement afin qu’il reste moins de 1 mL sous forme de couche mince recouvrant les cellules. Incuber pendant 2-3 min à 37 °C/ 5% CO2.
- Ajouter 10 mL de HBSS dans la fiole T75 pour rincer et pipeter les SH-SY5Y dans un tube de centrifugeuse conique de 15 mL. Centrifuger à 400 x g pendant 5 min. Aspirer le surnageant et re-suspendre les cellules dans 2 mL de milieu tamponné HEPES sans phénol (voir Tableau des matériaux). Assurez-vous de ressuspendre soigneusement la pastille, en pipetant avec une pipette de 100 à 1 000 μL pour briser les touffes avant la fixation.
- Fixez les cellules en ajoutant 2 mL de paraformaldéhyde à 4 % (concentration finale de 2 %) au tube. Incuber pendant 10 min à température ambiante avec une agitation douce occasionnelle du tube.
- Ajouter 10 mL de HBSS au tube. Centrifuger à 1 200 x g pendant 7 min et suspendre à nouveau dans 2 mL de milieu tamponné HEPES sans phénol rouge.
REMARQUE: Après l’étape 2.4, la préparation SH-SY5Y fixe peut être contrôlée en qualité par coloration avec de l’annexine V-FITC pour montrer de la phosphatidylsérine et de l’iodure de propidium accessibles pour mesurer la perméabilité cellulaire avec une lecture de cytométrie en flux. Comparez la préparation fixe aux SH-SY5Y vivants obtenus à partir de l’étape 2.2. Voir la section 7 et la figure supplémentaire S1. Le stockage des SH-SY5Y fixes après l’étape 2.4 n’est pas recommandé car il n’a pas été évalué.
3. Étiquetage des SH-SY5Y morts avec un colorant fluorescent rouge sensible au pH
- Après l’étape 2.4, comptez les cellules et retirez le nombre total de cellules nécessaires dans un tube de 2 mL à faible liaison aux protéines. Pour chaque 1 million de SH-SY5Y, augmentez le volume total dans le tube de 2 mL à 300-500 μL avec un milieu tamponné HEPES sans rouge de phénol. Réchauffez brièvement le tube dans un bain-marie à 37 °C.
- Reconstituer l’ester STP du colorant fluorescent rouge sensible au pH (voir Tableau des matériaux)et ajouter 12,5 μg de colorant par million de SH-SY5Y au tube chaud de 2 mL de cellules. Mélanger doucement par pipetage. Incuber le tube à température ambiante pendant 30 min, à l’abri de la lumière.
REMARQUE: Les espèces d’ester STP du colorant sensible au pH réagissent avec les amines primaires et, par conséquent, le tampon de étiquetage ne doit pas contenir d’amines libres. En raison de la solubilité potentiellement limitée dans les tampons aqueux, ajoutez le colorant dissous par DMSO uniquement pour réchauffer le tampon aqueux, mélangez immédiatement et examinez les signes de précipitation (particules sombres au microscope optique). - Ajouter 1 mL de HBSS et centrifuger à 1200 x g pendant 7 min à 4 °C. Jeter le surnageant et laver avec 2 mL HBSS. Répétez la centrifugation.
- Jeter le surnageant et suspendre à nouveau les cellules dans des milieux de macrophages sans phénol rouge (voir Tableau des matériaux),à une concentration de 200 000 à 1,2 million de cellules / mL, de sorte que 50 μL soit 10 000 à 60 000 cellules (c’est-à-dire 0,5 à 3 fois plus de SH-SY5Y que les macrophages iPSC).
REMARQUE: Le rouge de phénol dans les milieux augmente la fluorescence de fond et, par conséquent, un milieu sans rouge de phénol doit être utilisé si l’imagerie de cellules vivantes doit être effectuée. Le stockage des SH-SY5Y colorés pendant plus de quelques heures n’est pas recommandé car cela n’a pas été évalué. Gardez les SH-SY5Ys tachés sur la glace et protégez-les de la lumière.
4. Coloration des macrophages iPSC
- Dans une armoire de sécurité biologique, préparer une solution dans un milieu macrophage d’un colorant réactif à l’ester succinimidyle fluorescent rouge foncé, perméant aux cellules (voir Tableau des matériaux). Ajouter Hoechst 33342 (voir tableau des matériaux). Réchauffer la solution de travail à 37 °C au bain-marie.
- Aspirer doucement le milieu des macrophages iPSC en pipetant le surnageant de la cellule à l’l’éventreur d’une pipette multicanal dans un réservoir stérile. Ajouter 70 μL/puits de la solution de colorant préparée à l’étape 4.1 aux macrophages iPSC, à l’aide d’une pipette multicanal. Incuber pendant 1 h à 37 °C/5 % de CO2.
- Préparer des traitements expérimentaux dans des milieux de macrophages sans phénol rouge. Inclure 10 μM de cytochalasine D comme traitement témoin négatif. Après l’incubation, aspirer très doucement le milieu macrophage iPSC à l’l’éventrure à l’éventrure à l’éventrant et ajouter 100 μL/puits de solution saline tamponnée (HBSS) de Hank. Retirez immédiatement hbSS par pipetage doux, puis ajoutez 100 μL de milieu ± composés. Incuber pendant 10 min-1 h à 37 °C/ 5% CO2.
REMARQUE: La cytochalasine D est un puissant inhibiteur de l’actine et bloque la phagocytose. Pour tous les traitements expérimentaux qui nécessitent une incubation plus longue, par exemple 24-72 h, effectuer le traitement expérimental avant l’étape 4.1 en utilisant 100 μL / puits de traitement dans des milieux macrophages complets. Suivez les étapes 4.1 à 4.3 conformément au protocole afin que la coloration cellulaire soit effectuée et que le traitement soit ensuite réappliqué dans un milieu macrophage sans phénol rouge pour le reste du test de phagocytose.
5. Phagocytose d’imagerie
Vous trouverez ci-dessous deux méthodes de lecture de phagocytose différentes, choisissez la sous-section 5.1 ou 5.2.
- Imagerie time-lapse sur cellules vivantes
- Avant la phagocytose, allumez le microscope d’imagerie time-lapse à cellules vivantes (voir Tableau des matériaux), l’ordinateur,la chambre d’environnement et le gaz CO2. Ouvrez le logiciel de capture d’image. Vérifiez que les cubes de lumière DAPI, RFP et CY5 sont installés dans le microscope. Cliquez sur Time Lapse | | d’incubons Activez la chambre d’environnement et sélectionnez le réchauffement à 37 ° C avec du gaz CO2, assurez-vous également que l’humidité est désél sélectionnée. Prévoir 30 min pour que le microscope se réchauffe à 37 °C.
- Pendant l’incubation du composé à l’étape 4.3, chargez la plaque de macrophage iPSC dans le microscope.
- Cliquez sur image | Capture | Expert en navire. Sélectionnez Plaque de puits et choisissez un type de plaque à 96 puits.
- Dans l’onglet Image, activez la couche de phase et ajustez la mise au point grossière et fine à l’aide des curseurs verticaux, afin que les cellules soient au point. Ajustez les niveaux d’éclairage avec le curseur horizontal. Cliquez sur les canaux DAPI, RFP et CY5 et ajustez les niveaux d’éclairage pour chaque canal.
- Dans l’onglet Système, cliquez sur Calibrer l’alignement du cuve et suivez les instructions à l’écran.
- Cliquez sur Time Lapse | Routines | Créer une nouvelle routine. Sur le premier écran de l’Assistant Time Lapse, nommez la routine. Cliquez sur Suivant. Sur le deuxième écran, sélectionnez l’objectif 20x, sélectionnez Capture monochrome, puis sélectionnez les canaux DAPI, RFP, CY5 et Phase. Ne sélectionnez pas les options suivantes : Auto Find Sample, Auto fine focus, Z-Stack, Auto lighting. Cliquez sur Suivant.
- Sur l’écran suivant, installez une balise au centre de chaque puits, ce qui permettra au microscope de revenir aux mêmes coordonnées avec les mêmes réglages d’éclairage pour chaque point temporel. Les paramètres de mise au point et d’éclairage de chaque balise sont indépendants. Pour définir une balise: faites glisser le cercle bleu vers l’emplacement sur la carte de la plaque, utilisez le curseur vertical de mise au point grossière et fine et, lorsque vous êtes satisfait, cliquez sur Ajouter une balise. Les paramètres de balise peuvent être mis à jour ultérieurement à l’aide du bouton Mettre à jour la sélection.
- Lorsque vous êtes prêt à commencer le test de phagocytose, retirez la plaque d’essai et placez-la dans une armoire de sécurité biologique. Utilisez une pipette multicanal pour ajouter 50 μL de SH-SY5Ys par puits, en ajoutant sur le côté de chaque puits au bord du liquide.
- Chargez la plaque dans le microscope et attendez environ 30 minutes que le décalage thermique s’équilibre.
REMARQUE: Au cours des 30 premières minutes où la plaque est au microscope, la température changeante de la plaque d’essai entraînera un déplacement de la mise au point. Si la plaque n’est pas autorisée à s’équilibrer, les images capturées seront floues pendant le time-lapse. - Cliquez sur chaque balise et mettez à jour le réglage de mise au point. Cliquez sur Suivant. Sur l’écran suivant de l’Assistant Time Lapse, sélectionnez le format de fichier TIFF, activez l’option Enregistrer les canaux individuels, et activez l’option Créer une vidéo pour chaque balise, et autorisez les options sous Inclure les informations suivantes en tant que filigrane. Cliquez sur Suivant.
- Définissez le nombre de scènes sur 1. Cliquez sur Suivant. Réglez la durée et les intervalles du time-lapse, par exemple 3 h et l’imagerie toutes les 5 minutes. Ne sélectionnez pas Capturer une seule image. Cliquez sur Suivant.
- Activez la chambre d’environnement, avec une température de 37 °C et du CO2 (l’humidité est facultative pour les expériences courtes). Cliquez deux fois sur Suivant. Choisissez un chemin d’accès pour enregistrer les données. Cliquez sur Suivant. Cliquez sur Démarrer pour démarrer le time-lapse.
- Imagerie à haute teneur à cellules fixes
- Utilisez une pipette multicanal pour ajouter 50 μL des SH-SY5Y étiquetés par puits, en ajoutant sur le côté de chaque puits au bord du liquide. Incuber à 37 °C/ 5% CO2 pendant 3-5 h.
- Après l’incubation de la phagocytose, aspirer doucement les surnageants cellulaires en pipetant avec une pipette multicanal et les jeter. Laver une fois avec 100 μL PBS.
- Fixer la plaque en ajoutant 100 μL de paraformaldéhyde à 2%, incuber pendant 15 min à température ambiante.
- Aspirer les puits et ajouter 100 μL de PBS. Couvrir avec un scellant à plaques et une feuille d’aluminium; conserver à 4 °C jusqu’à ce que ce soit nécessaire.
REMARQUE: La plaque d’essai peut être stockée comme ceci pendant au moins une semaine sans dégradation significative du signal; un stockage plus long n’a pas été testé. - Allumez le microscope d’imagerie à haut contenu (voir Table des matériaux)et ouvrez le logiciel de capture d’image. Chargez la plaque d’essai dans le microscope en cliquant sur l’icône Charger en haut de l’écran.
- Sélectionnez l’onglet Configuration. Dans les menus déroulants de la zone supérieure gauche: sélectionnez le type de plaque approprié, sélectionnez l’option de mise au point automatique Two Peak (Par défaut),sélectionnez l’objectif 40x Water, NA1.1, sélectionnez Le mode confocal et sélectionnez binning de 1.
- Rincez l’objectif d’eau 40x avant utilisation, via le menu Paramètres.
- Dans la zone Sélection des canaux, utilisez l’icône + pour ajouter les canaux DAPI, Alexa 647 et Alexa 568. Réglez-les pour qu’ils mesurent à un seul plan de 1 μm. Optimisez les réglages de temps et de puissance pour l’efficacité de coloration de la plaque d’essai.
REMARQUE: À titre indicatif, réglez DAPI à 200 ms d’exposition et 100% de puissance, Alexa 647 à 1500 ms d’exposition et 100% de puissance, et Alexa 568 à 100 ms d’exposition et 40% de puissance. - Assurez-vous que les canaux ne sont pas mesurés simultanément en cliquant sur Séquence de canaux pour séparer les canaux.
- Sous navigation | Définir la disposition, sélectionner les puits de mesure et sélectionner 9 à 12 champs par puits.
- Lors de la configuration, cliquez sur un champ représentatif sur la carte de la plaque et vérifiez chaque canal de mesure à tour de rôle pour vous assurer que la coloration est présente et que les images sont focalisées, en ajustant le décalage du canal.
- Pour que les données soient téléchargées sur un serveur pour une analyse à distance, cliquez sur la case Emplois en ligne et le nom d’écran correspondant; cela permettra le téléchargement automatique des données sur un serveur après l’imagerie.
- Enregistrez le protocole de test en cliquant sur le bouton Enregistrer.
- Cliquez sur l’onglet Exécuter l’expérience en haut et nommez la plaque d’expérience, puis cliquez sur Démarrer.
6. Analyse des données
Vous trouverez ci-dessous deux méthodes d’analyse des données différentes, choisissez la sous-section 6.1 si la sous-section 5.1 a été suivie, ou choisissez la sous-section 6.2 si la sous-section 5.2 a été suivie.
- Analyse d’images de phagocytose obtenues au microscope time-lapse à cellules vivantes
- Téléchargez et installez le logiciel open source recommandé (voir Tableau des matériaux). Ouvrez le logiciel.
- Dans la zone Modules d’entrée, sélectionnez Images.
- À partir de l’Explorateur Windows,ouvrez le dossier de données contenant des sous-dossiers nommés Beacon-1, Beacon-2, etc. Sélectionnez et faites glisser tous les dossiers Beacon dans la zone de liste Fichier.
- Dans la zone Modules d’entrée, sélectionnez Métadonnées. Pour Extraire les métadonnées ?, sélectionnez Oui. Dans le menu déroulant en regard de Méthode d’extraction des métadonnées, choisissez Extraire des noms de fichiers/dossiers. Pour la source de métadonnées, choisissez Nom du dossier. Cliquez sur la loupe à droite de l’expression régulière et tapez ".*[\.*](? P.*)$" dans la zone de texte Regex (à l’exclusion des guillemets). Cliquez sur Soumettre. Pour Extraire les métadonnées de, choisissez Toutes les images. Cliquez sur Mettre à jour en bas de l’écran. Les images seront désormais regroupées par balise.
- Dans la zone Modules d’entrée, sélectionnez NamesAndTypes. Le processus suivant permettra aux images de chaque point temporel d’être affectées au canal de fluorescence correct. Attribuez un nom aux règles de correspondance des images (menu déroulant). Sélectionnez les critères de règle correspondant à Tous (menu déroulant) des règles suivantes. Fichier (menu déroulant), Fait (menu déroulant), Contenir (menu déroulant), DAPI (zone de texte). Nom à attribuer à ces images DAPI (zone de texte). Sélectionnez le type d’image Greyscale Image (menu déroulant). Définissez la plage d’intensité à partir des métadonnées d’image (menu déroulant).
- En bas de l’écran, cliquez sur Ajouter une autre imageet répétez l’étape 6.1.5. Remplacez DAPI par RFP, afin que les images RFP soient regroupées.
- Répétez l’étape 6.1.6 pour les images de canal CY5.
- Cliquez sur Mettre à jour en bas de l’écran, les fichiers image seront maintenant répertoriés dans trois colonnes intitulées DAPI, RFP et CY5.
- Dans la zone Modules d’entrée, sélectionnez Groupes. Pour Voulez-vous regrouper vos images ?, sélectionnez Oui. Dans le menu déroulant Catégorie de métadonnées, choisissez Balise.
- Dans la zone Modules d’analyse, cliquez avec le bouton droit sur l’espace blanc pour appeler une liste de tous les modules.
- Cliquez sur Ajouter | | de traitement d’image EnhanceOrSuppressFonctionnalités. Choisissez DAPI dans la première liste déroulante comme image d’entrée. Nommez l’image de sortie comme « DAPIspeckles ». Sélectionnez le type d’opération Améliorer et le type de fonction Speckles, avec une taille de fonction de 20 pixels. Choisissez l’option vitesse et précision Rapide/Hexagonal.
- Créez un nouveau module. Ajouter | | de traitement d’objets IdentifierPrimaryObjects. Choisissez DAPIpeckles dans la première liste déroulante comme image d’entrée. Nommez les objets primaires « Noyaux ». Entrez le diamètre typique des objets sous forme d’unités de 10 à 35 pixels; ce paramètre peut être optimisé. Choisissez la stratégie deseuil Global , la méthode de seuil RidlerCalvard, la méthode de lissage Automatique, et donnez le facteur de correction de seuil comme 12 avec les limites inférieure et supérieure 0-1. Remplacez la méthode pour distinguer les objets agglomérés par Shape, mais laissez les autres paramètres à leurs paramètres par défaut.
REMARQUE: Les noyaux de macrophages iPSC ont été grossièrement segmentés à l’étape 6.1.12, à la suite d’une étape de traitement d’image qui réduit le diamètre et augmente le contraste des noyaux. Il est important que seuls les noyaux les plus brillants soient sélectionnés, car les SH-SY5Y apparaîtront comme des noyaux plus faibles et seront confondus avec des macrophages iPSC sinon. Pour ajuster la proportion de noyaux sélectionnés, augmentez ou diminuez le facteur de correction du seuil. Pendant la phase de test, comparez la sélection des noyaux résultants à une image de phase de la balise, où il est facile de distinguer entre le macrophage iPSC et SH-SY5Y en utilisant la morphologie cellulaire. - Créez un nouveau module. Ajouter | | de traitement d’image CorrectIlluminationCalculer. Choisissez CY5 dans la première liste déroulante comme image d’entrée. Nommez l’image de sortie « IllumCY5 ». Pour Select How the Illumination (Sélectionner l’éclairage),choisissez Arrière-plan dans le menu déroulant. Laissez les autres paramètres à leurs paramètres par défaut.
- Créez un nouveau module. Cliquez sur Ajouter | | de traitement d’image CorrectIlluminationAppliquer. Choisissez CY5 dans la première liste déroulante comme image d’entrée. Nommez l’image de sortie « CorrCY5 ». Pour Sélectionner l’éclairage, choisissez IllumCY5 dans le menu déroulant. Pour Select How the Illumination (Sélectionner l’éclairage), choisissez Diviser (Divide) dans le menu déroulant.
REMARQUE: Le but des étapes 6.1.13-6.1.14 est de corriger la variation de l’éclairage de fond des images CY5, qui interférerait autrement avec la segmentation correcte des cellules. - Créez un nouveau module. Cliquez sur Ajouter | | de traitement d’objets IdentifierDéseignements Secondaires. Choisissez CorrCY5 dans la première liste déroulante comme image d’entrée. Choisissez Nuclei comme objets d’entrée. Nommez les objets secondaires « Mac ». Choisissez la méthode d’identification comme Distance - B. Sélectionnez la stratégie deseuil Global , méthode de seuil RidlerCalvard, la méthode de lissage Pas de lissage, et donnez le facteur de correction de seuil comme 1 avec les limites inférieure et supérieure 0-1. Laissez les autres paramètres à leurs paramètres par défaut.
REMARQUE : Cette étape de segmentation cellulaire peut nécessiter une optimisation, en ajustant le facteur de correction de seuil pour augmenter ou réduire les limites des cellules. L’efficacité de la segmentation peut également être améliorée en augmentant la résistance de la coloration des macrophages iPSC ou l’éclairage du cube lumineux CY5 pendant l’imagerie. - Créez un nouveau module. Cliquez sur Ajouter | | de traitement d’image EnhanceOrSuppressFonctionnalités. Choisissez RFP dans la première liste déroulante comme image d’entrée. Nommez l’image de sortie comme « FilteredRFP ». Sélectionnez le type d’opération Améliorer et le type de fonction Speckles, avec une taille de fonction de 15 pixels. La taille de la fonctionnalité peut être optimisée. Choisissez l’option vitesse et précision Rapide/Hexagonal.
- Créez un nouveau module. Cliquez sur Ajouter | | de traitement d’objets IdentifierPrimaryObjects. Choisissez FilteredRFP dans la première liste déroulante comme image d’entrée. Nommez les objets principaux " pHr ». Entrez le diamètre typique des objets sous forme d’unités de 5 à 20 pixels. Sélectionnez le Manuel destratégie de seuil et tapez un seuil manuellement, par exemple 0,005. Remplacez la méthode par Forme par les objets agglomérés, mais laissez les autres paramètres à leurs paramètres par défaut.
REMARQUE: Les SH-SY5Y ont été segmentés à l’étape 6.1.17, à la suite d’une étape de traitement d’image qui réduit le diamètre et augmente le contraste de la ponctuation. Il est essentiel d’effectuer un seuillage manuel, car l’intensité du colorant sensible au pH augmente avec le temps dans les particules phagocytosées, et d’autres stratégies de seuil gonfleront artificiellement le nombre de puncta de colorant sensible au pH dans les premiers moments. Le seuillage manuel doit être ajusté pour chaque répétition expérimentale ultérieure, en utilisant le mode test. - Créez un nouveau module. Cliquez sur Ajouter | | de traitement d’objets RelateObjects. Sélectionnez les objets enfants d’entrée pHr dans le menu déroulant. Sélectionnez les objets parents d’entrée Mac dans le menu déroulant. Pour Calculer les moyennes par parent pour toutes les mesures enfants ?,sélectionnez Oui. Ne calculez pas les distances enfant-parent (Aucune).
REMARQUE: L’étape 6.1.18 relie le signal de colorant sensible au pH aux macrophages iPSC, permettant de mesurer le nombre moyen d’objets phagocytosés par macrophage iPSC. - Créez un nouveau module. Cliquez sur Ajouter | | de traitement des fichiers ExportToSpreadsheet. Sélectionnez le délimiteur de colonne comme Tab et ajoutez un préfixe pour les noms de fichiers afin d’indiquer le numéro de balise. Choisissez des mesures spécifiques pour l’exportation, comme indiqué ci-dessous (étapes 6.1.19.1 - 6.1.19.4); laissant les autres paramètres à leurs paramètres par défaut.
- | de l’image Comte | Sélectionnez pHr et Mac
- | de l’image Fichier
- | de l’image Groupe
- | Mac Enfants | Phr
- Dans la zone Sortie, cliquez sur Afficher les paramètres de sortie. Créez un nouveau dossier sur le bureau pour cette expérience et définissez-le comme dossier de sortie par défaut.
- Enregistrer le | de fichier du pipeline EnregistrerProjet sous....
- Testez et optimisez le pipeline sur une image représentative en cliquant sur Démarrer le mode test dans le coin inférieur gauche. Le programme sélectionne automatiquement la première image à tester et chaque étape du pipeline peut être visualisante en cliquant sur les symboles oculaires, ce qui rend la sortie visible, puis en cliquant sur Exécuter. Pour changer la balise utilisée pour les tests, dans la barre de menu supérieure, cliquez sur Tester | Choisissez Groupe d’images. Pour modifier l’image (timepoint) dans une balise, dans la barre de menu supérieure, cliquez sur Tester | Choisissez Image Set( Jeu d’images . Les paramètres qui doivent être optimisés sont indiqués dans les étapes précédentes.
- Lorsque vous êtes satisfait du pipeline, cliquez sur Exit Test Mode et cliquez sur les symboles d’œil ouvert pour les fermer. Enregistrez le pipeline. Cliquez sur Analyser les images pour commencer l’analyse complète des images.
- Les fichiers texte générés peuvent être ouverts sous forme de feuille de calcul avec un tableur approprié, et le fichier intitulé « Image » contiendra une ligne pour chaque point temporel de l’image, les colonnes représentant les paramètres.
REMARQUE : Count_Mac et Count_pHr représentent le nombre de macrophages iPSC et le nombre d’objets sensibles au pH identifiés dans une image. N’utilisez pas Count_pHr données, car le dénombrement comprend des SH-SY5Y faiblement fluorescents qui n’ont pas été phagocytosés. La colonne Mean_Mac_Children_pHr_Count prend le nombre moyen d’objets pHr phagocytosés par Mac (étape 6.1.18 RelateObjects) pour une image individuelle, c’est-à-dire le point temporel individuel d’une balise. - Organisez les données de manière à ce que chaque balise soit une colonne distincte sur la feuille de calcul, les images étant organisées en lignes d’ordre chronologique, avec différents paramètres occupant différentes feuilles du classeur de feuille de calcul.
- Multipliez les mesures Mean_Mac_Children_pHr_Count par Count_Mac, pour générer le paramètre Nombre de points par image. Calculez la moyenne Count_Mac pour chaque balise. Divisez le nombre de points par image par la moyenne Count_Mac de cette balise, générant le paramètre Nombre de points par cellule.
REMARQUE : L’étape 6.1.26 corrige toute fluctuation erronée pouvant se produire dans le nombre de macrophages iPSC (Count_Mac), en normalisant les données au nombre moyen de macrophages iPSC sur tous les points temporels d’une balise. - Attribuez le temps depuis le début de la phagocytose (en min) à chaque ligne d’image.
- Générer des moyennes et un écart-type pour les puits/balises répliqués. Représentez graphiquement le nombre de taches par cellule (axe des y) par rapport au temps (axe des x) pour visualiser le taux de phagocytose.
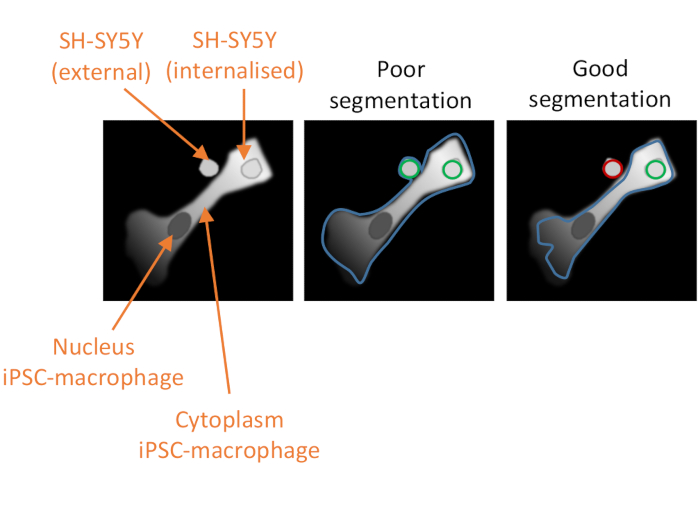
Figure 2: Segmentation cellulaire dans l’analyse de phagocytose à haute teneur. Illustration pour démontrer une bonne et une mauvaise segmentation d’un macrophage iPSC à proximité d’un SH-SY5Y non phagocytosé, avec un deuxième SH-SY5Y entièrement phagocytosé. Avec les deux types de cellules représentés en gris, la limite de la cellule iPSC-macrophage délimitée par l’analyse informatique est soulignée (bleu). Les SH-SY5Y qui sont comptés comme des événements de phagocytose sont soulignés en vert ou en rouge s’ils sont exclus de l’analyse. L’image au milieu montre une mauvaise segmentation; le macrophage iPSC a une délimitation sous-optimale qui inclut le SH-SY5Y non phagocytosé à l’intérieur de la bordure cellulaire, qui sera compté comme un événement de phagocytose. L’image de droite montre une bonne segmentation en raison de paramètres plus stricts définissant la bordure cellulaire iPSC-macrophage, ce qui a conduit à l’exclusion correcte du SH-SY5Y non phagocytosé de l’analyse. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Analyse d’images de phagocytose obtenues au microscope à haute teneur
- Connectez-vous au logiciel de traitement d’image recommandé (voir Tableau des matériaux).
- Sélectionnez le dossier de nom d’écran et le sous-dossier d’exécution de la création d’image dans le menu de gauche. Cliquez sur l’icône Analyse d’image (un écran avec une loupe). Sélectionnez un puits représentatif sur la disposition de la plaque pour configurer le pipeline d’analyse.
- Le premier bloc de construction de l’analyse est l’image d’entrée. Conservez les paramètres par défaut pour le traitement de la pile (Plans individuels) et la correction du champ plat (Aucun). Cliquez sur le signe + dans le coin supérieur droit du bloc, pour ajouter le bloc de construction suivant, puis sélectionnez Trouver des noyaux.
- Dans Find Nuclei, définissez le canal comme DAPI, la population ROI comme None, la méthode de segmentation comme C. La zone de méthode contient un menu déroulant qui permet d’optimiser le paramètre, avec des paramètres pour le seuil commun (c’est-à-dire 0,40) et la zone (c’est-à-dire >30 μm2). Nommez la population de sortie « Noyaux ». Ajoutez le bloc de construction suivant en cliquant sur le symbole + et sélectionnez Find Cytoplasm.
- Dans Find Cytoplasm, définissez le canal comme Alexa 647 et la méthode comme B. La zone de méthode contient un menu déroulant qui permet d’optimiser le paramètre, avec des paramètres pour le seuil commun (c.-à-d. 0,45) et le seuil individuel (c.-à-d. 0,20). Ajoutez le bloc de construction suivant en cliquant sur le symbole + et sélectionnez Sélectionner la population.
REMARQUE: Il est essentiel d’optimiser correctement la segmentation du cytoplasme afin qu’elle exclue tous les SH-SY5Y adjacents qui n’ont pas été phagocytosés, mais n’exclut pas la cargaison phagocytosée (voir Figure 2). - Dans Sélectionner la population, conservez les paramètres par défaut, qui seront les noyaux depopulation , la méthode Filtres communs, une coche pour Supprimer les objets de bordureet la population de sortie nommée « Noyaux sélectionnés ». Ajoutez le bloc de construction suivant en cliquant sur le symbole + et sélectionnez Calculer les propriétés de morphologie.
- Dans Calculer les propriétés de morphologie, définissez la population sur Noyaux sélectionnés, la région sur Cellule, la méthode sur Standard. Dans le menu déroulant, assurez-vous que la surface et la rondeur sont sélectionnées (μm2). Nommez la population de sortie « Cellule de morphologie ». Ajoutez le bloc de construction suivant en cliquant sur le symbole + et sélectionnez Sélectionner la population.
- Dans Sélectionner la population (2), choisissez la population Noyaux sélectionnéset la méthode Filtrer par propriétés. Dans la liste déroulante sous Filtre F1, sélectionnez Morphology Cell Area [μm2]. Choisissez > dans la liste déroulante à droite et tapez 160 dans la zone à droite. Nommez la population de sortie « Noyaux sélectionnés 2 ». Ajoutez le bloc de construction suivant en cliquant sur le symbole + et sélectionnez Find Spots.
REMARQUE : cette étape exclut toutes les cellules mal segmentées et toutes les cellules mortes d’une analyse plus approfondie. Il peut être nécessaire d’optimiser en augmentant ou en diminuant la taille de coupure. - Dans Find Spots, sélectionnez le canal Alexa 568, la population ROI Nuclei Selected 2, la région ROI Cell, méthode B, et nommez la population de sortie « Spots ». La méthode peut être optimisée, si nécessaire, à l’aide du menu déroulant, avec des paramètres de sensibilité de détection (c.-à-d. 0,20) et de sensibilité de fractionnement (c.-à-d. 0,400). Ajoutez le bloc de construction suivant en cliquant sur le symbole + et sélectionnez Calculer les propriétés de morphologie.
- Dans Calculer les propriétés de morphologie (2), sélectionnez la population Spots, région Spot, et méthode Standard. Dans le menu déroulant, assurez-vous que la surface et la rondeur sont sélectionnées (μm2). Nommez les propriétés de sortie « Morphology Spot ». Ajoutez le bloc de construction suivant en cliquant sur le symbole + et sélectionnez Sélectionner la population.
- Dans Sélectionner la population (3), sélectionnez les taches de population et la méthode Filtrer par propriétés. Dans les zones déroulantes sous Filtre F1, sélectionnez Zone spot [px2], >, 20. Dans les zones déroulantes sous Filtre F2, sélectionnez Zone spot [px2], <, 2500. Dans les zones déroulantes sous Filtre F3, sélectionnez Morphologie Arrondi des taches, >, 0,6. Dans les zones déroulantes sous Filtre F4, sélectionnez Intensité du spot à la région, >, 2.5. Nommez la population de sortie « Spots Selected ». Ajoutez le bloc de construction suivant en cliquant sur le symbole + et sélectionnez Sélectionner la population.
REMARQUE: La sélection automatique des points aura segmenté de nombreuses minuscules taches fluorescentes résultant de corps autofluorescents dans les macrophages iPSC. Cette étape vise à filtrer les corps autofluorescents en appliquant des coupures strictes à la zone, à la rondeur et à l’intensité des taches, et peut nécessiter une certaine optimisation. - Dans Sélectionner la population (4), sélectionnez la population Noyaux sélectionnés 2 et la méthode Filtrer par propriétés. Dans les zones déroulantes sous Filtre F1, sélectionnez Nombre de spots, >, 0,5. Nommez la population de sortie « Spot Positive Cells ». Ajoutez le bloc de construction suivant en cliquant sur le symbole + et sélectionnez Définir les résultats.
- Dans Définir les résultats, sélectionnez la première méthode en tant que Liste des sorties. Le paramètre par défaut est le nombre d’objets à calculer pour chaque population. Cliquez sur le menu déroulant Population: Nuclei Selected 2 et assurez-vous que Nombre d’objets est coché, et dans le menu déroulant Appliquer à tous, sélectionnez TOUS. Pour la population Spot Positive Cell, assurez-vous que nombre d’objets est coché. Pour les autres populations, il n’est pas nécessaire de déclarer des paramètres. Sélectionnez la deuxième méthode comme Sortie de formule, puis tapez la formule (a/b)*100. Choisissez comme variable A Spot Positive Cell- Nombre d’objets, et comme variable B choisissez Nuclei Selected 2- Number of Objects. Nommez la sortie comme « Spot Positive Cells (%) ».
- Enregistrer le pipeline : cliquez sur l’icône Enregistrer l’analyse sur disque (une disquette avec flèche vers le bas).
- Cliquez sur l’icône Analyse par lots (un symbole d’entonnoir et de rouages en haut de l’écran). Dans les dossiers expérimentaux de gauche, sélectionnez le fichier de données brutes, qui doit mettre à jour le nombre de mesures sélectionnées à 1. Dans la région Options d’analyse, cliquez sur le menu déroulant Méthode, puis sélectionnez Analyse existante. Cliquez sur le ... en regard de Fichier de script et recherchez le fichier d’analyse enregistré (suffixed .aas). Ensuite, cliquez sur la flèche verte à côté de Démarrer l’analyse. La progression de l’analyse peut être surveillée en cliquant sur État de la tâche (dans le coin supérieur droit de l’écran).
- Une fois l’analyse terminée, cliquez sur l’onglet Exporter, choisissez le dossier d’expérience et sélectionnez un dossier de destination. Conservez les paramètres par défaut, qui exportent les données mais pas les images TIFF, et démarrez l’exportation.
- Ouvrez le fichier téléchargé sous forme de feuille de calcul dans un tableur approprié. Les puits sont disposés en lignes et les paramètres en colonnes. Sélectionnez les données dans des colonnes intitulées Cellules positives ponctuelles (%), Noyaux sélectionnés 2 - Nombre de points - Moyenne par puits et Noyaux sélectionnés 2 - Surface totale des points - Moyenne par puits, et copiez-les dans de nouvelles feuilles de calcul pour chaque paramètre. Calculez la moyenne des paramètres pour les puits répliqués de chaque condition et tracez un graphique approprié.
7. Essai de contrôle de la qualité pour l’homogénéité des SH-SY5Y fixes
- Prélever une aliquote de SH-SY5Y vivants à partir de l’étape 2.2 et le mettre en service dans le tampon de liaison annexine à partir d’un kit de coloration à l’annexine V-FITC (voir tableau des matériaux)à une concentration d’environ 200 000 cellules par mL.
- Prélever une aliquote de SH-SY5Y fixes à partir de l’étape 2.4 et les mettre en danger dans un tampon de liaison annexine à une concentration d’environ 200 000 cellules par mL.
- Préparer deux tubes à essai avec 5 μL d’annexine V-FITC et 5 μL d’iodure de propidium (voir tableau des matériaux). Ajouter 500 μL de SH-SY5Ys vivants à un tube et 500 μL de SH-SY5Y fixes à l’autre.
- Préparer trois tubes témoins : un avec 5 μL d’annexine V-FITC, un avec 5 μL d’iodure de propidium et un tube vide. Mélangez ensemble un rapport de 1:1 de SH-SY5Ys vivants et fixes et ajoutez-en 500 μL à chaque tube de contrôle.
- Mélanger les tubes doucement par pipetage. Incuber à température ambiante pendant 10 min, à l’abri de la lumière.
- Mesurer immédiatement sur un cytomètre de flux(Ex = 488 nm; Em = 530 nm) en utilisant le détecteur de signal FITC (généralement FL1) pour l’annexine V-FITC, et le détecteur de signal d’émission de phycoérythrine (généralement FL2) pour l’iodure de propidium.
- Utilisez n’importe quel logiciel d’analyse de cytométrie en flux pour afficher les diagrammes de points du signal FITC vs PI et utilisez un outil de contrôle rectangulaire pour sélectionner la population doublement négative. Dans la population à double négatif, affichez FSC vs SSC et utilisez un outil de contrôle polygonal pour créer une porte d’exclusion autour de la population avec très faible FSC et SSC, qui est classée comme débris et donc exclue d’une analyse plus approfondie. Affichez les événements restants en tant que signal FITC vs PI et utilisez les contrôles à un seul point et non colorés pour définir une porte quadrant pour les événements FITC-/PI-, FITC+/PI-, FITC -/PI+ et FITC+/PI+.
REMARQUE: Évitez les manipulations brutales, les vortex ou les longues incubations avec des SH-SY5Y vivants, qui pourraient induire artificiellement l’affichage de la phosphatidylsérine. Procéder à la cytométrie en flux sans délai. Un résultat souhaitable est que la proportion d’événements FITC-/PI- est de <5% dans les SH-SY5Y fixes. Les résultats représentatifs sont présentés à la figure supplémentaire S1.
Résultats
L’imagerie time-lapse de cellules vivantes a été réalisée à l’aide du protocole décrit précédemment, avec des macrophages iPSC de type sauvage ensemencés à 20 000 cellules par puits. Différentes quantités de SH-SY5Y ont été appliquées (10 000-30 000 par puits, selon les estimations du nombre de cellules à l’étape 3.1), et l’inhibiteur de la phagocytose cytochalasine D a été pré-incubé (1 h) avec certains puits, agissant comme un contrôle pour inhiber la phagocytose pour chaque quantité de SH-SY5Ys. L’imagerie a commencé 40 minutes après l’ajout de SH-SY5Y et les images ont été capturées à des intervalles de 5 minutes pendant les 3 heures suivantes (les données incluent le délai initial de 40 minutes). Une vidéo time-lapse représentative est incluse dans les données supplémentaireset les données quantitatives analysées illustrées à la figure 3. Avec la quantité de 10 000 SH-SY5Ys par puits, le nombre de particules phagocytosées (taches) par cellule a augmenté linéairement avec le temps, et a été inhibé d’environ 50% par la cytochalasine D. L’inhibition par la cytochalasine D a été plus faible que prévu, probablement causée par des répliques techniques ou biologiques insuffisantes, car un seul puits par condition a été imagé avec trois champs d’image. Avec des quantités plus élevées de SH-SY5Y par puits (20 000 et 30 000), la phagocytose présentait une faible linéarité, probablement en raison d’une mauvaise segmentation des macrophages iPSC et des SH-SY5Y dans un champ de vision plus encombré.
L’imagerie à haute teneur en cellules fixes a été réalisée à l’aide du protocole décrit précédemment, avec des macrophages iPSC de type sauvage à 20 000 cellules par puits, plusieurs quantités différentes de SH-SY5Y (10 000 à 80 000 par puits), et la plaque d’essai a été fixée et imagée après 5 h. Une image représentative de la phagocytose est présentée à la figure 4A, et les données analysées montrées à la figure 4B17. L’augmentation de la quantité de SH-SY5Y a entraîné un nombre plus élevé de particules phagocytosées (taches) par cellule; cependant, un doublement de la quantité de SH-SY5Y n’entraîne qu’une augmentation de 1,5 fois du nombre de taches par cellule. Cela indique que les quantités testées ne limitent pas le taux de phagocytose. Par la suite, le test de phagocytose d’imagerie à haute teneur a été validé à l’aide de plusieurs inhibiteurs de la phagocytose (Figure 4C)17. Les inhibiteurs de la polymérisation de l’actine cytochalasine D et jasplakinolide ont significativement inhibé la phagocytose de 91% et 90%, respectivement, lorsqu’ils ont été pré-incubés pendant 1 h avant la phagocytose. Le Z' robuste du test lorsque la cytochalasine D ou le jasplakinolide sont utilisés comme témoins négatifs est calculé comme 0,7 et 0,8, respectivement20. L’inhibiteur de l’acidification des lysosomes, la bafilomycine A1, a significativement réduit la phagocytose de 31%, lorsqu’il est incubé 1 h avant la phagocytose. L’effet plus faible de l’inhibiteur d’acidification du lysosome par rapport aux inhibiteurs de l’actine suggère que la détection de la cargaison internalisée peut ne pas nécessiter une acidification complète du phagosome. L’annexine V recombinante a été utilisée comme témoin pour bloquer spécifiquement la phosphatidylsérine exposée à la surface des SH-SY5Y, empêchant les récepteurs phagocytaires d’accéder au ligand, un signal important de « manger-moi ». L’ajout d’annexine V recombinante a considérablement réduit la phagocytose de 30 %, lorsqu’elle est ajoutée aux puits immédiatement avant l’ajout de SH-SY5Y. Il a été confirmé que les SH-SY5Y fixes exposaient la phosphatidylsérine à l’aide d’une sonde fluorescente annexine V, tandis que les SH-SY5Y vivants étaient négatifs pour la coloration à l’annexine V(figure 4D).
Le récepteur microglial de la phagocytose TREM2 s’est déjà avéré important pour la phagocytose des neurones apoptotiques21. La mutation R47H de TREM2 est un gène de risque d’apparition tardive de la maladie d’Alzheimer et est supposée réduire la liaison au ligand de TREM223. Dans le but d’évaluer la fonction phagocytaire de R47H TREM2 et TREM2 KO, le test de phagocytose à haute teneur en cellules fixes a été réalisé à l’aide de lignées isogéniques de macrophages iPSC avec WT/R47H/KO TREM217. Plusieurs longueurs de durée de phagocytose de 1 à 5 h ont été testées, en utilisant une addition échelonnée de cargaison phagocytaire (40 000 SH-SY5Ys). Le signal résultant augmente linéairement jusqu’à 4 h, se stabilisant légèrement à 5 h (Figure 5)17. Une réduction du taux et de la capacité de phagocytose (% de cellules positives ponctuelles) était évidente dans le TREM2 KO par rapport à WT, tandis que le mutant R47H TREM2 n’a pas montré de phagocytose altérée. Le défaut phagocytaire dans les cellules TREM2 KO n’est pas phénocopié par la mutation R47H TREM2, apparemment parce que la fonction TREM2 est suffisante pour soutenir une phagocytose normale.
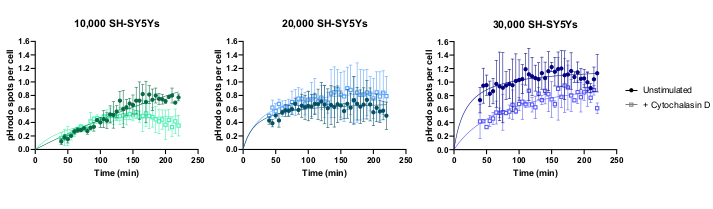
Figure 3: Exemples de données pour le test de phagocytose time-lapse à cellules vivantes. Absorption des SH-SY5Y morts par les macrophages iPSC de type sauvage BIONi010-C (ECACC ID: 66540023) imagés à des intervalles de 5 minutes pendant 3 h. Les temps affichés sur le graphique sont à partir de l’initiation de la phagocytose, y compris les 40 premières minutes sans mesure. Le nombre moyen de taches par cellule provenant de trois puits répliqués est tracé. La phagocytose de 10 000 SH-SY5Ys est inhibée par 10 μM de cytochalasine D avec 1 h de prétraitement, tandis que des quantités plus élevées de SH-SY5Y (20 000 et 30 000) ont une quantification sous-optimale de la phagocytose. Moyenne ± écart-type (ET), N = 1 expérience. Veuillez cliquer ici pour voir une version agrandie de cette figure.
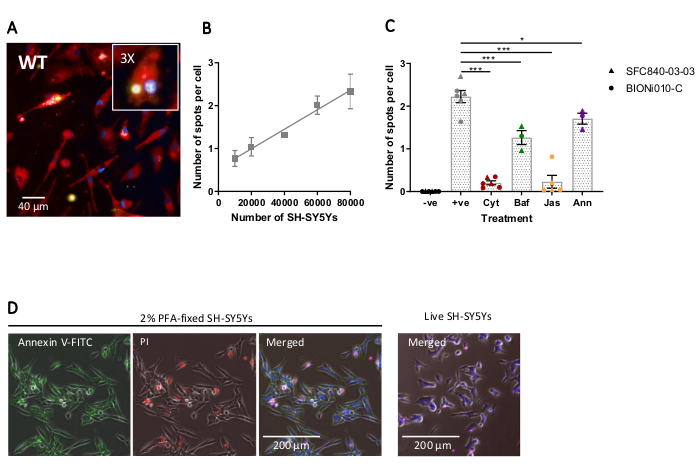
Figure 4: Optimisation et validation du test de phagocytose à haute teneur à cellules fixes. (A) Image microscopique représentative à haute teneur de SH-SY5Ys phagocytosé par des macrophages iPSC de type sauvage BIONi010-C (ECACC ID: 66540023). Un point temporel de 3 h avec 40 000 SH-SY5Ys est affiché. Les canaux de fluorescence sont fusionnés, avec la coloration des macrophages iPSC en rouge, les noyaux en bleu et les SH-SY5Y en jaune. Le panneau en médaillon est une section de l’image agrandie de 3x. (B) Le nombre de taches par cellule de SH-SY5Y morts phagocytosés après 5 h, en utilisant différentes quantités de cargaison ajoutées aux macrophages iPSC de type sauvage. Moyenne ± erreur-type de la moyenne (SEM), pour N = 3 récoltes. (C) La phagocytose (3 h) est inhibée avec 10 μM de cytochalasine D (Cyt), 1 μM de bafilomycine A1 (Baf), 1 μM de jasplakinolide (avec 1 h de prétraitement; Jas), et 13 μg/mL d’annexine V recombinante (ajoutée simultanément aux SH-SY5Y morts; Ann). Les macrophages iPSC sans SH-SY5Y ajoutés ont été utilisés comme témoin négatif (-ve), et le contrôle positif (+ve) est des macrophages iPSC non traités avec SH-SY5Y ajoutés. Les données ont été normalisées à la moyenne pour la répétition de l’expérience. Moyennes ± SEM, pour N = 3-6 récoltes et avec deux lignées cellulaires de type sauvage (SFC840-03-03, la caractérisation de cette lignée est décrite dans (Fernandes et al.21 et BIONi010-C). ANOVA 1 voie avec le test post-hoc de Dunnett, comparaisons avec des cellules non traitées. *p < 0,05, ***p < 0,001. (D) Les SH-SY5Y fraîchement fixés se colorent uniformément pour l’affichage de la phosphatidylsérine (annexine V-FITC) et ont une perméabilité cellulaire limitée (iodure de propidium). Les SH-SY5Y vivants ne tachent pas l’annexine V-FITC ou l’iodure de propidium, à l’exception de la coloration focale présente sur les quelques cellules mortes en culture. Les chiffres sont reproduits avec la permission d’Alzheimer’s Research & Therapy17. Veuillez cliquer ici pour voir une version agrandie de cette figure.
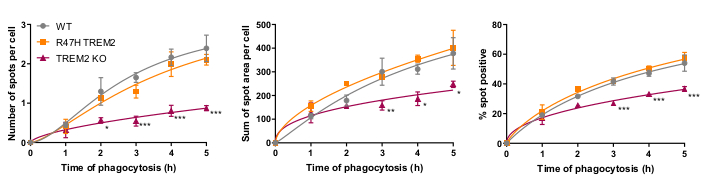
Figure 5: La phagocytose est réduite dans TREM2 KO mais pas chez les macrophages R47H TREM2 iPSC. Test de phagocytose à haute teneur effectué avec 40 000 SH-SY5Ys par puits avec des ajouts échelonnés. Les moyennes ont été quantifiées pour les paramètres : nombre de taches par cellule, somme des zones ponctuelles (μm2)par cellule et pourcentage de cellules contenant des particules phagocytosées par champ. Les données ont été normalisées pour signifier pour chaque génotype par expérience. Moyenne ± SEM, pour N = 3 récoltes. ANOVA à 2 voies à mesures répétées, test post-hoc de Dunnett, comparaisons par paires avec le WT pour chaque fois: *p < 0,05, **p < 0,01, ***p < 0,001. Les chiffres sont reproduits avec la permission d’Alzheimer’s Research & Therapy17. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire S1 : Exemple de CQ pour la préparation de SH-SY5Ys. Les SH-SY5Y dissociés ont été fixés pendant 10 minutes avec 0% (cellules vivantes), 1% et 2% de paraformaldéhyde (PFA), puis lavés. Les cellules ont été colorées avec de l’annexine V-FITC et de l’iodure de propidium (IP) et immédiatement mesurées par cytométrie en flux. Des diagrammes de points de densité de couleur ont été créés dans un logiciel d’analyse de cytométrie en flux, en utilisant les commandes à un seul point coloré et non coloré pour placer une porte quadrant. Les quadrants sont annotés avec le pourcentage d’événements dans ce quadrant. Les cellules vivantes sont principalement au Q4, et les cellules fixes sont principalement au Q2. Q1 = annexine V-/PI-, Q2 = annexine V+/PI+, Q3 = annexine V+/PI-, Q4 = annexine V-/PI- (cellules vivantes). Veuillez cliquer ici pour télécharger ce fichier.
Vidéo supplémentaire : Phagocytose time-lapse à cellules vivantes. Vidéo time-lapse représentative des SH-SY5Y phagocytosés par les macrophages iPSC de type sauvage BIONi010-C (ECACC ID: 66540023). Les images ont été prises toutes les 5 minutes pendant 3 h. La vidéo est recadrée et s’exécute à 3 images par seconde, montrant les dernières 1,5 heure du test. Les SH-SY5Y colorés aux colorants sensibles à l’acide sont représentés en rouge, l’intensité du signal augmentant avec l’acidification des phagosomes. Les noyaux cellulaires colorés avec Hoechst 33342 sont représentés en bleu. Veuillez cliquer ici pour télécharger cette vidéo.
Discussion
Les microglies ont des fonctions importantes qui affectent l’initiation et la progression des maladies neurodégénératives, y compris la phagocytose des neurones apoptotiques. Une phagocytose microgliale altérée et une phagocytose inappropriée des synapses ont toutes deux été associées à des maladies neurodégénératives, bien que les mécanismes sous-jacents et la causalité ne soient pas bien compris4,23. Cet article décrit un test de phagocytose pour mesurer la phagocytose des cellules apoptotiques par les macrophages iPSC, avec une lecture d’imagerie time-lapse de cellules vivantes ou une microscopie à haute teneur à cellules fixes, ou une combinaison des deux sur un seul essai. Cette polyvalence signifie que le test peut être utilisé pour étudier des événements phagocytaires individuels au fil du temps dans quelques puits ou utilisé pour un dépistage à haute teneur avec plusieurs conditions ou traitements. Étant donné que le test à haute teneur est fixé à un seul point temporel, plusieurs plaques de dosage peuvent être préparées simultanément. Le test à haute teneur a une utilité potentielle pour caractériser les macrophages / microglies avec des variantes génétiques associées à la maladie ou le dépistage des inhibiteurs de petites molécules pour les changements de phagocytose. Le test peut également être facilement adapté pour étudier la phagocytose d’autres modèles de microglies, ou potentiellement d’astrocytes. Le test de phagocytose peut potentiellement être multiplexé avec des taches d’imagerie de cellules vivantes, par exemple des indicateurs de mitochondries, de calcium ou de ROS, et une coloration immunofluorescente post-fixation pour les protéines d’intérêt peut être effectuée. Par rapport aux tests de phagocytose existants qui utilisent des cellules neuronales apoptotiques, les principaux avantages conférés par ce protocole sont que la préparation de la cargaison phagocytaire est relativement simple et rapide, et aboutit à un produit uniforme. D’autres tests induisent l’apoptose des neurones ou SH-SY5Y avec la S-nitroso-L-cystéine pendant 2 h25,l’acide okadaïque pendant 3 h22,la staurosporine pendant 4-16 h26,27,28,29 ou l’irradiation UV pendant 24 h30,et peuvent entraîner des cellules à différents stades d’apoptose. En outre, l’imagerie sur cellules vivantes et les lectures d’imagerie à haut contenu n’ont pas encore été décrites, à la connaissance des auteurs. La principale limitation de l’utilisation de la fixation au paraformaldéhyde pour préparer la cargaison phagocytaire est qu’elle ne récapitule pas complètement le processus d’apoptose, car la fixation empêche les cellules de se diviser en corps apoptotiques, qui sont susceptibles d’être phagocytosés plus rapidement en raison de leur plus petite taille. On ne sait pas quel effet la fixation a sur la sécrétion de signaux nucléotidiques « trouvez-moi » (par exemple, ATP, UDP) de la cellule cible qui attirent les phagocytes. Semblables aux cellules apoptotiques, les SH-SY5Y fixes présentent une certaine perméabilité membranaire à l’iodure de propidium. La perméabilité membranaire est associée à la libération de signaux « trouvez-moi »; cependant, cela n’a pas été étudié dans les SH-SY5Y fixes, et si les nucléotides sont libérés trop rapidement, ils seront emportés avant que les SH-SY5Y ne soient ajoutés aux macrophages iPSC.
La première étape critique du protocole est la coloration des SH-SY5Y morts avec un ester STP d’un colorant fluorescent rouge sensible au pH. Ce colorant réagit rapidement et de manière covalente avec les amines primaires libres à la surface des SH-SY5Y morts. La durée de la coloration n’a pas besoin d’être optimisée; cependant, il faut prendre soin de manipuler le colorant avant l’étiquetage. La réaction de étiquetage ne doit pas être effectuée dans des tampons contenant des amines libres. De plus, il existe un risque de précipitations si le stock de DMSO est dilué dans un tampon aqueux froid ou à une concentration finale élevée. Les précipités apparaîtront comme des objets sombres denses au microscope. De plus, la solution de colorant sensible au pH adhère aux tubes de centrifugeuse en plastique ordinaires et se lave lentement; par conséquent, des tubes à faible liaison sont recommandés pour l’étape d’étiquetage. L’utilisation d’un colorant sensible au pH, au lieu d’un colorant fluorescent permanent, aide à identifier les particules englouties, par rapport aux particules qui se voisinent de la membrane plasmique. Comme il y a une certaine fluorescence à pH neutre, la densité de la cargaison phagocytaire et des macrophages iPSC doit être maintenue suffisamment faible pour une segmentation précise, bien que suffisamment élevée pour que de nombreux événements phagocytaires soient capturés. La microscopie à haute teneur était capable d’identifier avec précision la phagocytose avec une densité moyenne de cargaison dans le puits (plus de 2 SH-SY5Ys par macrophage iPSC). Inversement, en raison de la sensibilité plus faible du microscope dans le spectre rouge profond, la segmentation des macrophages iPSC dans les données d’imagerie time-lapse des cellules vivantes était moins fiable et il était nécessaire d’utiliser une très faible densité de cargaison pour réduire la probabilité de faux positifs (1 SH-SY5Y pour deux macrophages iPSC). La validation de la segmentation et de la densité de la cargaison appropriées doit être effectuée avec des comparaisons entre les puits non traités et les puits traités à la cytochalasine D. Dans un test bien optimisé, la cytochalasine D devrait réduire le nombre moyen de taches par cellule de 90% par rapport aux échantillons non traités.
Une autre étape critique du protocole est la coloration des macrophages iPSC, qui permet d’identifier et de segmenter la cellule dans l’analyse d’image afin que tous les SH-SY5Y externes soient exclus du comptage. Le colorant recommandé est perméable aux cellules, converti en un produit fluorescent insoluble dans le cytoplasme, réparable et non toxique (voir Tableau des matériaux). L’étape de coloration a été optimisée pour l’utilisation de macrophages iPSC avec le test de phagocytose d’imagerie à haute teneur, et nous suggérons qu’elle devrait être ré-optimisée si d’autres types de cellules sont utilisés. La durée de la coloration cellulaire peut être augmentée pour améliorer le dépôt du produit fluorescent insoluble dans les cellules. Si la concentration de colorant est optimisée, il faut veiller à éviter les niveaux toxiques du solvant organique.
Le troisième facteur critique pour le succès du test est l’analyse des données. Les pipelines d’analyse fournis sont destinés à être indicatifs plutôt que normatifs, car les différences d’intensité de coloration ou de morphologie cellulaire peuvent réduire l’efficacité de la segmentation des pipelines telle qu’elle est écrite. Certaines optimisations seront donc nécessaires, avec des tests du pipeline sur des contrôles positifs et négatifs appropriés, et les paramètres qui devraient être optimisés sont indiqués dans le texte du protocole. Les témoins négatifs doivent inclure une condition où les macrophages iPSC sont prétraités avec un puissant inhibiteur de phagocytose tel que la cytochalasine D avant l’ajout de SH-SY5Ys. Un autre contrôle négatif possible est l’ajout des SH-SY5Y à des puits de macrophages iPSC non traités auparavant à la fin du test, 10 minutes avant la fixation, ce qui permet un certain tassement de la cargaison mais est trop court pour qu’une quantité appréciable de phagocytose se produise. Un événement de phagocytose est défini comme un objet fluorescent rouge dans les limites d’un macrophage iPSC, défini par l’algorithme du logiciel à l’aide du canal de fluorescence rouge profond. Si la segmentation des cellules est médiocre(Figure 2),de nombreux SH-SY5Y non phagocytosés à proximité des macrophages iPSC peuvent être inclus par erreur dans l’analyse, c’est-à-dire des faux positifs. Le facteur le plus important pour obtenir une bonne segmentation est la délimitation rigoureuse des macrophages iPSC. La segmentation pour les deux analyses est automatisée, il n’est donc pas possible d’obtenir une segmentation parfaite pour chaque cellule; cependant, quelques paramètres peuvent être ajustés pour rendre la segmentation plus optimale, en utilisant quelques images de test comme référence. Le contrôle de la cytochalasine D est important pour évaluer la segmentation optimale car un nombre élevé d’événements phagocytaires détectés dans cette condition indique que la segmentation est sous-optimale. L’optimisation du pipeline d’analyse des données devrait idéalement être répétée jusqu’à ce que le nombre d’événements phagocytaires par cellule soit inférieur de 80% à 90% dans la condition de cytochalasine D par rapport à l’absence d’inhibiteur.
Les problèmes avec le test de phagocytose qui sont les plus susceptibles de se produire sont: (1) une faible fluorescence sensible au pH chez les témoins positifs, (2) une distribution clairsemée ou inégale des macrophages à la fin du test, ou (3) un nombre élevé de faux positifs dans l’analyse à partir de SH-SY5Y non phagocytosés. Le dépannage de la fluorescence sensible au pH faible doit d’abord vérifier que la coloration des SH-SY5Y a donné une pastille cellulaire avec une forte couleur magenta. Si la couleur est faible, assurez-vous qu’un colorant frais est utilisé, assurez-vous que le tampon d’étiquetage est exempt d’amine, ajoutez un lavage supplémentaire aux SH-SY5Y avant la coloration, vérifiez si le nombre correct de SH-SY5Ys a été coloré, assurez-vous qu’aucun précipité de colorant n’est en évidence et optimisez la concentration d’étiquetage du colorant. Si les SH-SY5Y sont fortement colorés, vérifiez si la concentration ajoutée à la plaque d’essai est correcte et assurez-vous que les macrophages iPSC sont sains et pas trop vieux. Le deuxième type de problème, la distribution inégale des macrophages, peut résulter de la perte de cellules pendant le pipetage et des mesures doivent être prises pour réduire les forces de pipetage subies par les cellules, en évitant les pointes à alésage étroit. Si le problème persiste, réduisez le temps d’incubation du chargement des macrophages iPSC avec un colorant perméant aux cellules. Le troisième problème, concernant l’inclusion erronée de particules non phagocytosées dans l’analyse, indique qu’une plus grande optimisation du pipeline d’analyse est nécessaire. Le dépannage doit d’abord se concentrer sur la segmentation des cellules et sur la question de savoir si le logiciel inclut des objets adjacents. Les paramètres spécifiques qui peuvent être ajustés sont suggérés dans les notes ci-dessous les étapes pertinentes (étapes 6.1.11-6.1.15 pour l’analyse time-lapse sur cellules vivantes et étapes 6.2.4-6.2.8 pour l’analyse à haute teneur). Si la segmentation cellulaire ne peut pas être encore améliorée, l’analyse à haute teneur comporte une étape supplémentaire (étape 6.2.8) qui exclut les macrophages iPSC mal segmentés. En outre, le module qui filtre les taches acceptées de fluorescence sensibles au pH dans les macrophages iPSC peut être optimisé, en augmentant l’intensité seuil des objets acceptés, ce qui devrait aider à exclure les SH-SY5Y non phagocytosés (étape 6.1.17 pour l’analyse time-lapse des cellules vivantes et étape 6.2.11 pour l’analyse à haute teneur).
Nous avons développé deux types de lecture microscopique pour le test de phagocytose qui présentent chacun des avantages et des limites. L’imagerie time-lapse à cellules vivantes a le mérite de fournir des informations supplémentaires sur la cinétique de la phagocytose et est plus largement disponible que les plates-formes d’imagerie à haut contenu. Le logiciel open source recommandé est agnostique à la source du microscope et pourrait être utilisé avec n’importe quel microscope fluorescent de bonne qualité, avec ou sans capacité time-lapse à cellules vivantes. La principale limite de l’imagerie des cellules vivantes est la sensibilité et l’optique limitées, ce qui rend plus difficile la détection et la bonne segmentation des macrophages iPSC. Cette limitation pourrait être atténuée soit en augmentant la durée de la coloration des macrophages iPSC, soit en passant à un microscope plus sensible, le cas échéant. Le test de phagocytose d’imagerie à haute teneur est la lecture recommandée si un système d’imagerie à haute teneur est disponible. Les systèmes d’imagerie à haut contenu permettent un débit plus élevé et des données plus fiables, ce qui permet d’utiliser ce test pour le criblage, dans lequel un Z' robuste de ≥0,7 serait attendu pour la sortie « nombre de taches par cellule »20. Par rapport à la méthode time-lapse à cellules vivantes, la lecture microscopique à haut contenu a une sensibilité plus élevée, un degré plus élevé d’automatisation et de vitesse, plus de puits et de champs d’imagerie peuvent être traités et des images confocales haute résolution sont produites. La segmentation cellulaire est plus efficace avec de bonnes images, et la segmentation est également facilitée par le logiciel d’analyse d’imagerie à haut contenu fournissant plus de méthodes de segmentation cellulaire adaptées aux cellules de forme très irrégulière. Le logiciel d’analyse d’imagerie à haut contenu a également calculé plus de paramètres de phagocytose, par rapport au logiciel open source, tels que le pourcentage de cellules phagocytaires. La principale limite du test de phagocytose à haute teneur est le coût et l’accessibilité du système d’imagerie et du logiciel d’analyse.
En conclusion, le test quantitatif de phagocytose présenté dans cet article est un outil utile pour modéliser la phagocytose microglie des neurones morts in vitro. Les microglies sont modélisées par des macrophages iPSC et les neurones morts sont modélisés par des SH-SY5Ys fixés au paraformaldéhyde. Bien qu’ils ne soient pas les modèles de microglies et de neurones morts/apoptotiques les plus authentiques publiés, ils sont faciles à préparer et évolutifs. Le test lui-même est très polyvalent, avec deux types de lecture d’imagerie détaillée, et il a le potentiel d’être adapté pour une utilisation avec différents modèles de monoculture de microglies / macrophages, ou un type de cellule différent pour agir comme la cargaison phagocytaire. La lecture d’imagerie à haut contenu est avantageuse pour obtenir des données quantitatives et peut être mise à l’échelle pour essayer les modulateurs de petites molécules de la phagocytose, ou les variantes génétiques de dépistage dans les macrophages iPSC. Cependant, étant donné que les systèmes d’imagerie à haut contenu sont coûteux et riches en données, une lecture d’imagerie alternative a été incluse dans le protocole à l’aide d’un microscope accéléré à cellules vivantes, qui pourrait être substitué à tout microscope à fluorescence conventionnel de bonne qualité, si nécessaire.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient le Dr Val Millar et le Dr Sohaib Nizami pour leur aide en microscopie à haut contenu, et le Dr Daniel Ebner pour l’accès aux microscopes à haute teneur. De plus, les auteurs remercient la Dre Emma Mead pour ses conseils en matière de développement d’essais et Mme Cathy Browne pour son soutien à l’iPSC. Ce travail a été soutenu par l’Alzheimer’s Research UK Oxford Drug Discovery Institute (ARUK ODDI, référence de subvention ARUK-2020DDI-OX), avec un soutien supplémentaire au James Martin Stem Cell Facility Oxford (S.A.C.) de l’Oxford Martin School LC0910-004; Monument Trust Discovery Award de Parkinson’s UK (J-1403); la MRC Dementias Platform UK Stem Cell Network Capital Equipment MC_EX_MR/N50192X/1, Partnership MR/N013255/1 et Momentum MC_PC_16034 Awards.
matériels
| Name | Company | Catalog Number | Comments |
| 15 mL conical centrifuge tube | Falcon | 352096 | For centrifugation of cells |
| 2-20 µL, 20-200 µL, 100-1000 µL single-channel micropipettes | |||
| 2-mercaptoethanol 50 mM | Gibco | 31350010 | Component of Factory media |
| 4% paraformaldehyde in PBS | Alfa Aesar | J61899 | For fixation of cells |
| 6-well plate, tissue culture treated | |||
| AggreWell-800 24-well plate | STEMCELL Technologies | 34815 | Microwell low-adherence 24-well plate for formation of embryoid bodies |
| Annexin V-FITC Apoptosis Staining / Detection Kit | Abcam | ab14085 | Kit for annexin V-FITC staining , as an assay for quality control of fixed SH-SY5Ys. Kit contains annexin binding buffer, annexin V-FITC, and propidium iodide. |
| Automated cell counter | |||
| Benchtop centrifuge | |||
| Benchtop microcentrifuge | |||
| CellCarrier-96 Ultra Microplates, tissue culture treated, black, 96-well with lid | Perkin Elmer | 6055302 | 96-well tissue culture (TC)-treated microplate with black well walls and an optically-clear bottom, for phagocytosis assay |
| CellProfiler software | Open-source software for analysis of phagocytosis images obtained by live-cell time-lapse microscope. Download for free from website (http://cellprofiler.org/), this protocol used version 2.2.0. | ||
| CellTracker Deep Red dye | Thermo Fisher | C34565 | Deep red-fluorescent, cell-permeant, succinimidyl ester-reactive dye for staining cytoplasm of iPS-macrophages. Dissolve CellTracker Deep Red dye in DMSO to 2 mM (1.4 mg/mL). Use at 1 μM, by dilution of DMSO stock with Macrophage media. |
| Class 2 laminar air flow safety cabinet | |||
| CO2 gas bottle | Accessory for EVOS FL Auto | ||
| CO2 incubator, set to 37°C and 5 % CO2 | |||
| Columbus Image Data Storage and Analysis System | Perkin Elmer | Columbus | Data storage and analysis platform for Opera Phenix. Supports all major high content screening instruments. |
| Cytochalasin D | Cayman | 11330 | Negative control treatment for phagocytosis assay. Reconstitute in DMSO to 10 mM and store aliquots at -20°C, avoid further freeze-thaw cycles. Use at final concentration 10 µM. |
| DMEM/F12 | Gibco | 11320074 | Component of SH-SY5Y media |
| DMSO | Sigma | D8418 | Solvent for CellTracker and pHrodo dyes |
| EVOS FL Auto Imaging System | Thermo Fisher | AMF4300 | Live-cell time-lapse imaging microscope |
| EVOS Light Cube CY5 | Thermo Fisher | AMEP4656 | Accessory for EVOS FL Auto |
| EVOS Light Cube DAPI | Thermo Fisher | AMEP4650 | Accessory for EVOS FL Auto |
| EVOS Light Cube RFP | Thermo Fisher | AMEP4652 | Accessory for EVOS FL Auto |
| EVOS Onstage Incubator | Thermo Fisher | AMC1000 | Accessory for EVOS FL Auto |
| Fetal Bovine Serum | Sigma | F4135 | Component of SH-SY5Y media |
| Flow cytometer | |||
| Flow cytometry analysis software | |||
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Invitrogen | A1413302 | hESC-qualified basement membrane matrix for iPSC culture |
| GlutaMAX Supplement | Gibco | 35050-038 | Component of both Factory and Macrophage media |
| HBSS | Lonza | BE 10-547F | Hank’s balanced salt solution for washing steps |
| Human recombinant BMP4 | Gibco | PHC9534 | Component of Embryoid Body media |
| Human recombinant IL-3 | Gibco | PHC0033 | Component of both Factory and Macrophage media |
| Human recombinant SCF | Miltenyi Biotech | 130-096-695 | Component of Embryoid Body media |
| Human recombinant VEGF | Gibco | PHC9394 | Component of Embryoid Body media |
| Live Cell Imaging Solution | Thermo Fisher | A14291DJ | Phenol red-free HEPES-buffered media for labelling dead SH-SY5Ys |
| Low protein binding 2 mL tubes | Eppendorf | 30108.132 | For staining SH-SY5Ys |
| M-CSF | Thermo Fisher | PHC9501 | Component of both Factory and Macrophage media |
| mTeSR1 Medium | STEMCELL Technologies | 85850 | iPSC media |
| Multichannel 20-200 uL pipette | For liquid handling of 96-well plate | ||
| NucBlue Live ReadyProbes Reagent | Thermo Fisher | R37605 | Hoechst 33342 formulation in a dropper bottle for staining nuclei of iPS-macrophages, use 0.5 drops/mL in Macrophage media. |
| Opera Phenix High-Content Screening System | Perkin Elmer | HH14000000 | High-content imaging microscope, used with Harmony software version 4.9. |
| Penicillin-Streptomycin | Gibco | 15140-122 | Component of Factory, Macrophage, and SH-SY5Y media |
| pHrodo iFL Red STP-Ester | Thermo Fisher | P36011 | pH-sensitive red fluorescent dye for labelling dead SH-SY5Ys. Reconstitute pHrodo iFL Red STP Ester powder in DMSO to a 5 mg/mL concentration. For each 1 million SH-SY5Ys, add 2.5 μL (12.5 μg) of pHrodo iFL Red STP Ester stock to pre-warmed cells suspended in Live Cell Imaging Solution. |
| Serological pipette filler | |||
| T175 flask, tissue culture treated | Vessel for differentiations of iPSC-macrophage precursors, known as "Factories" | ||
| T75 flask | Vessel for SH-SY5Y culture | ||
| Transparent plate sealers | Greiner Bio-One | 676001 | For assay plate storage and transportation |
| TrypLE Express (1X), no phenol red | Gibco | 12604013 | Cell dissociation buffer containing recombinant trypsin-like enzymes and 1.1 mM EDTA, use neat. |
| Water bath, set to 37°C | |||
| X-VIVO 15 Medium with L-glutamine, gentamicin, and phenol red | Lonza | BE04-418F | Component of Factory and Macrophage media |
| X-VIVO 15 Medium with L-glutamine; without gentamicin or phenol red | Lonza | 04-744Q | Phenol red-free macrophage media, for use in phagocytosis without additives or growth factors |
Références
- Hochreiter-Hufford, A., Ravichandran, K. S. Clearing the dead: apoptotic cell sensing, recognition, engulfment, and digestion. Cold Spring Harbour Perspectives in Biology. 5, 008748 (2013).
- Freeman, S. A., Grinstein, S. Phagocytosis: receptors, signal integration, and the cytoskeleton. Immunological Reviews. 2262, 193-215 (2014).
- Hickman, S., Izzy, S., Sen, P., Morsett, L., El Khoury, J. Microglia in neurodegeneration. Nature Neuroscience. 21 (10), 1359-1369 (2018).
- Galloway, D. A., Phillips, A. E. M., Owen, D. R. J., Moore, C. S. Phagocytosis in the brain: Homeostasis and disease. Frontiers in Immunology. 10, 790 (2019).
- Nizami, S., Hall-Roberts, H., Warrier, S., Cowley, S. A., Di Daniel, E. Microglial inflammation and phagocytosis in Alzheimer's disease: potential therapeutic targets. British Journal of Pharmacology. 176 (18), 3515-3532 (2019).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), 712-716 (2016).
- Neher, J. J., et al. Inhibition of microglial phagocytosis is sufficient to prevent inflammatory neuronal death. The Journal of Immunology. 186 (8), 4973-4983 (2011).
- Brown, G. C., Neher, J. J. Microglial phagocytosis of live neurons. Nature Reviews Neuroscience. 15 (4), 209-216 (2014).
- Scott-Hewitt, N., et al. Local externalization of phosphatidylserine mediates developmental synaptic pruning by microglia. The EMBO Journal. 39 (16), 105380 (2020).
- Li, T., et al. A splicing isoform of GPR56 mediates microglial synaptic refinement via phosphatidylserine binding. The EMBO Journal. 39 (16), 104136 (2020).
- Sapar, M. L., et al. Phosphatidylserine externalization results from and causes neurite degeneration in Drosophila. Cell Reports. 24 (9), 2273-2286 (2018).
- Skjesol, A., et al. The TLR4 adaptor TRAM controls the phagocytosis of Gram-negative bacteria by interacting with the Rab11-family interacting protein 2. PLOS Pathogens. 15 (3), 1007684 (2019).
- Wong, K., Li, X., Ma, Y. Paraformaldehyde induces elevation of intracellular calcium and phosphatidylserine externalization in platelets. Thrombosis Research. 117 (5), 537-542 (2006).
- van Wilgenburg, B., Browne, C., Vowles, J., Cowley, S. A. Efficient, long term production of monocyte-derived macrophages from human pluripotent stem cells under partly-defined and fully-defined conditions. PLoS One. 8 (8), (2013).
- Haenseler, W., et al. A highly efficient human pluripotent stem cell microglia model displays a neuronal-co-culture-specific expression profile and inflammatory response. Stem Cell Reports. 8 (6), 1727-1742 (2017).
- Buchrieser, J., James, W., Moore, M. D. Human induced pluripotent stem cell-derived macrophages share ontogeny with MYB-independent tissue-resident macrophages. Stem Cell Reports. 8 (2), 334-345 (2017).
- Hall-Roberts, H., et al. TREM2 Alzheimer's variant R47H causes similar transcriptional dysregulation to knockout, yet only subtle functional phenotypes in human iPSC-derived macrophages. Alzheimer's Research & Therapy. 12, 151 (2020).
- Friedman, B. A., et al. Diverse brain myeloid expression profiles reveal distinct microglial activation states and aspects of Alzheimer's disease not evident in mouse models. Cell Reports. 22 (3), 832-847 (2018).
- Aziz, M., Yang, W. L., Wang, P. Measurement of phagocytic engulfment of apoptotic cells by macrophages using pHrodo succinimidyl ester. Current Protocols in Immunology. 100, 1-8 (2013).
- Atmaramani, R., Pancrazio, J. J., Black, B. J. Adaptation of robust Z' factor for assay quality assessment in microelectrode array based screening using adult dorsal root ganglion neurons. Journal of Neuroscience Methods. 339, 108699 (2020).
- Fernandes, H. J. R., et al. ER Stress and Autophagic Perturbations Lead to Elevated Extracellular α-Synuclein in GBA-N370S Parkinson's iPSC-Derived Dopamine Neurons. Stem Cell Reports. 6 (3), 342-356 (2016).
- Takahashi, K., Rochford, C. D. P., Neumann, H. Clearance of apoptotic neurons without inflammation by microglial triggering receptor expressed on myeloid cells-2. Journal of Experimental Medicine. 201 (4), 647-657 (2005).
- Kober, D. L., Brett, T. J. TREM2-ligand interactions in health and disease. Journal of Molecular Biology. 429 (11), 1607-1629 (2017).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), 712-716 (2016).
- Witting, A., Müller, P., Herrmann, A., Kettenmann, H., Nolte, C. Phagocytic clearance of apoptotic neurons by microglia/brain macrophages in vitro: Involvement of lectin-, integrin-, and phosphatidylserine-mediated recognition. Journal of Neurochemistry. 75 (3), 1060-1070 (2000).
- Hsieh, C. L., et al. A role for TREM2 ligands in the phagocytosis of apoptotic neuronal cells by microglia. Journal of Neurochemistry. 109 (4), 1144-1156 (2009).
- Beccari, S., Diaz-Aparicio, I., Sierra, A. Quantifying microglial phagocytosis of apoptotic cells in the brain in health and disease. Current Protocols in Immunology. 122 (1), 49 (2018).
- Diaz-Aparicio, I., et al. Microglia actively remodel adult hippocampal neurogenesis through the phagocytosis secretome. Journal of Neuroscience. 40 (7), 1453-1482 (2020).
- Shirotani, K., et al. Aminophospholipids are signal-transducing TREM2 ligands on apoptotic cells. Scientific Reports. 9 (1), 1-9 (2019).
- Garcia-Reitboeck, P., et al. Human induced pluripotent stem cell-derived microglia-like cells harboring TREM2 missense mutations show specific deficits in phagocytosis. Cell Reports. 24 (9), 2300-2311 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon