Method Article
Test di imaging quantitativo in vitro per la fagocitosi delle cellule morte del neuroblastoma da parte di iPSC-Macrophages
In questo articolo
Riepilogo
Le malattie neurodegenerative sono associate a funzioni microglia disregolate. Questo articolo delinea un test in vitro della fagocitosi delle cellule di neuroblastoma da parte dei macrofagi iPSC. Le lettura quantitative al microscopio sono descritte sia per l'imaging time-lapse a cellule vive che per l'imaging ad alto contenuto a cellule fisse.
Abstract
Le microglia orchestrano le risposte neuroimmmune in diverse malattie neurodegenerative, tra cui il morbo di Parkinson e il morbo di Alzheimer. Le microglia eliminano i neuroni morti e morenti attraverso il processo di efferocitosi, una forma specializzata di fagocitosi. La funzione di fagocitosi può essere interrotta da fattori di rischio ambientali o genetici che influenzano la microglia. Questo documento presenta un protocollo di microscopia in vitro rapido e semplice per lo studio dell'efferocitosi microgliale in un modello di microglia a cellule staminali pluripotenti indotte (iPSC), utilizzando una linea cellulare di neuroblastoma umano (SH-SY5Y) etichettata con un colorante sensibile al pH per il carico fagocitico. La procedura si traduce in un alto rendimento di cellule di neuroblastoma morto, che mostrano fosfatidilserina di superficie, riconosciuta come un segnale "mangia-me" dai fagociti. Il test della piastra a 96 pozzetti è adatto per l'imaging time-lapse di cellule vive, oppure la piastra può essere fissata con successo prima di un'ulteriore elaborazione e quantificata mediante microscopia ad alto contenuto. La microscopia ad alto contenuto a cellule fisse consente di scalare il saggio per lo screening di inibitori di piccole molecole o per valutare la funzione fagocitica delle linee iPSC delle varianti genetiche. Mentre questo test è stato sviluppato per studiare la fagocitosi di cellule di neuroblastoma morte intere da iPSC-macrofagi, il test può essere facilmente adattato per altri carichi rilevanti per malattie neurodegenerative, come sinaptosomi e mielina e altri tipi di cellule fagocitiche.
Introduzione
Le microglia sono macrofagi residenti nei tessuti cerebrali e le loro funzioni includono la sorveglianza immunitaria, il coordinamento delle risposte infiammatorie a lesioni / infezioni, il rimodellamento sinaptico e la fagocitosi di cellule morte, mielina, aggregati proteici e agenti patogeni. La fagocitosi è il processo attraverso il quale le microglia riconoscono il carico con i recettori di superficie e riorganizzano il loro citoscheletro per inghiottire l'oggetto in un fagosoma, che poi si fonde con i lisosomi per la degradazione del carico. Microglia sane fagocitosi apoptotiche cellule cerebrali per rimuoverle prima che diventino necrotiche1. La fagocitosi delle cellule apoptotiche è anche nota come efferocitosi e richiede la visualizzazione di un segnale "eat-me" di fosfatidilserina da parte della cellula morente2. Numerosi recettori della microglia si legano direttamente alla fosfatidilserina, tra cui TIM-4, BAI1, Stabilin-2 e TREM2. I recettori TAM microgliali (ad esempio, MERTK) e le integrine si legano indirettamente alla fosfatidilserina, utilizzando rispettivamente le proteine accessorie GAS6 o MFG-E8. Altri segnali "eat-me" possono essere necessari per il riconoscimento delle cellule morenti, questi includono cambiamenti nella glicosilazione o nella carica delle proteine di superficie; espressione di proteine intracellulari ICAM3, calreticulina, annessina-I sulla superficie cellulare; LDL ossidato; o rivestimento della cellula apoptotica da parte del complemento prodotto dalla microglia C1q1,2.
Le malattie neurodegenerative, tra cui il morbo di Parkinson, il morbo di Alzheimer, la demenza frontotemporale e la sclerosi laterale amiotrofica sono state associate a compromissione della funzione della microglia, tra cui un accumulo di prodotti di scarto del cervello come cellule morte, frammenti di mielina e aggregati proteici e risposte infiammatorie esagerate a questi stimoli3. La fagocitosi può essere compromessa nelle malattie neurodegenerative e contribuire alla patologia, a causa di una combinazione di invecchiamento, infiammazione o specifiche varianti di rischio genetico4,5. D'altra parte, ci sono anche prove da modelli animali di malattie neurodegenerative che la microglia può inappropriatamente fagocitosi neuroni vitali o sinapsi6,7,8. È probabile che il meccanismo sia istigato dalla visualizzazione di fosfatidilserina di neuriti danneggiati, che viene direttamente rilevata dai recettori della fagocitosi microgliale TREM2 o GPR56, o indirettamente percepita dal complemento solubile C1q che riveste la membrana arricchita di fosfatidilserina, portando alla fagocitosi mediata da CR39,10,11.
I saggi in vitro della funzione di fagocitosi, ad esempio per valutare l'impatto fenotipico di una variante a rischio genetico nella microglia, vengono spesso eseguiti utilizzando carichi non fisiologici come le perle di lattice4. Vengono utilizzati anche batteri e zimosan etichettati fluorescentemente, che sono fisiologici ma non rilevanti per le malattie neurodegenerative. I carichi fagocitici non fisiologici possono essere utilizzati per rilevare difetti nel meccanismo di base dell'inghiottimento fagocitico, ma non riescono a modellare con precisione il primo passaggio di "riconoscimento" nella fagocitosi dei neuroni apoptotici. Le dimensioni, la forma, la rigidità e il tipo di carico dettano anche le vie di segnalazione intracellulare che vengono attivate, portando a diversi esiti dello stato di attivazione della microglia. Ad esempio, i batteri E.coli sono piccoli e rigidi, a differenza delle cellule umane, e i lipopolisaccaridi sulla loro superficie sono riconosciuti dal recettore Toll-like 4 (TLR4) che attiva la fagocitosi e le vie di segnalazione pro-infiammatorie2,12.
Nel contesto degli studi sulle malattie neurodegenerative, un carico fagocitico più rilevante avrebbe una visualizzazione di fosfatidilserina sulle membrane plasmatiche dei mammiferi e, idealmente, sarebbe umano e neuronale, per includere segnali che le microglia potrebbero incontrare. Per questo protocollo di fagocitosi, la linea cellulare di neuroblastoma umano SH-SY5Y è stata scelta come modello di neurone facile da coltura. La visualizzazione permanente della fosfatidilserina superficiale è stata indotta artificialmente dalla paraformaldeide, che in precedenza ha dimostrato di causare la visualizzazione della fosfatidilserina delle piastrine13. Per il modello di cellule della microglia sono stati utilizzati iPSC-macrofagi umani, che imitano l'ontogenesi e il profilo trascrizionale della microglia umana e sono fagociticamente competenti14,15,16,17. i macrofagi iPSC non sono il modello di microglia più autentico disponibile, ad esempio, non imitano la morfologia della microglia; tuttavia, si può sostituirlo con un modello di microglia iPSC monocoltura più autentico, se lo si desidera, come Haenseler et al.15. I modelli iPSC umani sono preferibili alla microglia primaria dei roditori per lo studio della neurodegenerazione, a causa delle preoccupazioni sulla limitata sovrapposizione dei moduli trascrizionali della microglia osservati nei tessuti delle malattie neurodegenerative umane rispetto a quelle dei topi18. Gli SH-SY5Y morti sono colorati con un colorante acido-sensibile che fluoresce debolmente a pH neutro e più fortemente all'interno dei fagolisiosomi dei macrofagi iPSC dopo la fagocitosi. L'utilizzo di un colorante acido-sensibile migliora l'accuratezza del rilevamento di eventi fagocitici, con versatilità per diverse lettura di macrofagi vivi e fissi19. Questo protocollo delinea sia l'imaging time-lapse a cellule vive della fagocitosi, sia un test di imaging fisso ad alto contenuto per la fagocitosi, con le stesse fasi di preparazione cellulare prima della lettura (Figura 1).
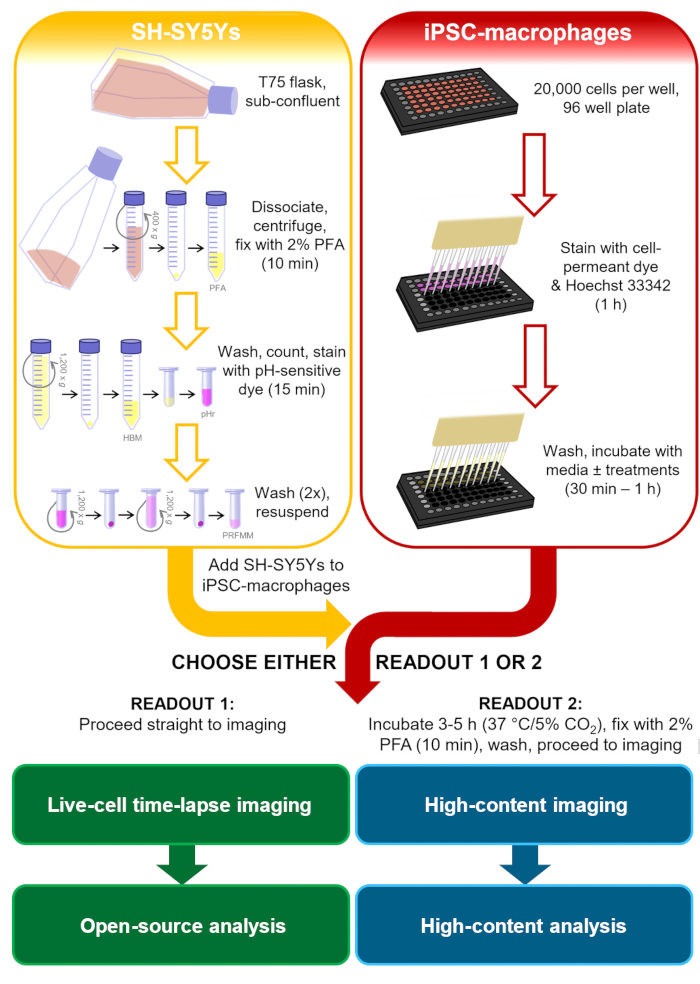
Figura 1: Diagramma schematico della metodologia. Schema del test di fagocitosi, in cui la preparazione degli SH-SY5Y e la colorazione dei macrofagi iPSC vengono eseguite in parallelo, e quindi gli SH-SY5Y vengono pipettati sui macrofagi iPSC. L'imaging time-lapse delle cellule vive viene eseguito immediatamente o le cellule vengono incubate a 37 ° C / 5% CO2 per la durata richiesta e fissate prima di eseguire la microscopia ad alto contenuto. PFA: paraformaldeide, HBM: fenolo red-free HEPES-buffered media, pHr: pH-sensitive red fluorescent dye STP Ester solution, PRFMM: phenol red-free macrophage media. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocollo
Il protocollo segue le linee guida per l'uso di linee cellulari iPS umane derivate presso l'Università di Oxford, Oxford Parkinson's Disease Centre (Comitato etico: National Health Service, Health Research Authority, NRES Committee South Central, Berkshire, UK (REC 10/H0505/71)). Le iPSC umane devono essere maneggiate all'interno di un armadio di sicurezza di Classe II per proteggere il lavoratore da possibili agenti avventizi. Le normative locali, nazionali e dell'UE in materia di salute e sicurezza devono essere rispettate. Le composizioni dei mezzi di coltura cellulare sono dettagliate nella Tabella 1e tutti i materiali sono elencati nella Tabella supplementare dei materiali.
1. Coltura cellulare prima dell'esperimento
- iPSC di coltura in mezzi iPSC (Tabella 1) in piastre a 6 pozzetti pre-rivestite con una matrice di membrana basale qualificata hESC, sub-confluente e ad un basso numero di passaggio.
- Differenziare le iPSC umane dai precursori iPSC-macrofagi: seminare quattro milioni di iPSC in una piastra a 24 pozzetti a bassa aderenza microwell con 2 ml di supporti corporei embrioidi(Tabella 1)per incoraggiare la formazione del corpo embrioide ed eseguire cambiamenti del 75% dei media ogni giorno per 5-6 giorni. Trasferire corpi embrioidi in palloni T175, circa 150 corpi embrioidi per pallone, contenenti 20 ml di supporti di fabbrica (Tabella 1). Alimentazione settimanale con aggiunta di 10-20 ml di supporti di fabbrica.
NOTA: i precursori iPSC-macrofagi emergono nel surnatante dopo circa 2-3 settimane e vengono prodotti continuamente per diversi mesi. Per questo esperimento, è preferibile utilizzare cellule a partire da circa 6 settimane dopo l'installazione delle fabbriche di differenziazione. I macrofagi iPSC raccolti in precedenza possono mantenere una certa capacità proliferativa e sono meno aderenti, impedendo anche la semina a bassa densità cellulare. Non è stato determinato un limite di età superiore per la capacità di fagocitosi. - Differenziare i precursori iPSC-macrofagi in iPSC-macrofagi: raccogliere i precursori rimuovendo il volume richiesto di surnatante; passarlo attraverso un filtro cellulare da 40 μm per rimuovere i grumi; centrifugare a 400 x g per 5 minuti a pellet di cellule e risusciso in macrofagi (Tabella 1). Semina iPSC-macrofagi a 20.000-30.000 cellule per pozzetto in una micropiastra trattata con coltura tissutale (TC) a 96 pozzetti con pareti di pozzetto nero e un fondo otticamente chiaro, in 100 μL di macrofagi per pozzetto. Evitare i pozzi dei bordi e riempirli con PBS; questo è importante per ridurre l'effetto dell'evaporazione sul test. Differenziare per 6-10 giorni mediante incubazione a 37 °C/5% CO2.
NOTA: Per questo test è stata utilizzata la linea iPSC BIONi010-C (ECACC ID: 66540023); tuttavia, un'altra linea iPSC può essere sostituita. - Mantenere SH-SY5Ys alla sub-confluenza in palloni T75 con 20 mL di supporti SH-SY5Y (Tabella 1), che passano ogni 3-4 giorni.
| Nome | Supporti di base | Additivo, concentrazione finale |
| Supporti iPSC | mTeSR1 | - |
| Media del corpo embrionale | mTeSR1 | BMP4, 50 ng/mL |
| VEGF, 50 ng/mL | ||
| SCF, 20 ng/mL | ||
| Supporti di fabbrica | XVIVO15 · | GlutaMAX, 2 mM |
| Penicillina, 100 unità/ml | ||
| Streptomicina, 100 μg/mL | ||
| 2-Mercaptoetanolo, 50 μM | ||
| IL-3, 25 ng/mL | ||
| M-CSF, 100 ng/mL | ||
| Macrofagi media | XVIVO15 · | GlutaMAX, 2 mM |
| Penicillina, 100 unità/ml | ||
| Streptomicina, 100 μg/mL | ||
| M-CSF, 100 ng/mL | ||
| Supporti SH-SY5Y | DMEM/F12 | Siero bovino fetale, 10% |
| Penicillina, 100 unità/ml | ||
| Streptomicina, 100 μg/mL |
Tabella 1: Ricette multimediali.
Costituenti dei mezzi di coltura cellulare utilizzati nel protocollo. Ulteriori dettagli sui componenti del supporto sono disponibili nella Tabella dei materiali.
2. Preparazione di SH-SY5Y morti
- In un armadio di sicurezza biologica di classe II, dissociare SH-SY5Ys, con l'aggiunta di 4 mL di un tampone di dissociazione cellulare contenente enzimi ricombinanti simili alla tripsina e 1,1 mM edTA (vedi Tabella dei materiali), che deve essere rimosso immediatamente in modo che rimanga meno di 1 mL come un film sottile che ricopre le cellule. Incubare per 2-3 min a 37 °C/ 5% CO2.
- Aggiungere 10 mL di HBSS al pallone T75 per risciacquare e pipettare l'SH-SY5Ys in un tubo centrifugo conico da 15 mL. Centrifuga a 400 x g per 5 min. Aspirare il surnatante e ri-sospendere le cellule in 2 mL di mezzo tamponato HEPES privo di fenolo rosso (vedi Tabella dei materiali). Assicurarsi di risospendare accuratamente il pellet, pipettando con una pipetta da 100-1.000 μL per rompere i grumi prima della fissazione.
- Fissare le cellule aggiungendo 2 ml di paraformaldeide al 4% (concentrazione finale 2%) al tubo. Incubare per 10 minuti a temperatura ambiente con occasionale agitazione delicata del tubo.
- Aggiungere 10 ml di HBSS al tubo. Centrifugare a 1.200 x g per 7 minuti e ri-sospendere in 2 mL di mezzo tamponato HEPES privo di fenolo rosso.
NOTA: Dopo la fase 2.4, il preparato fisso-SH-SY5Y può essere controllato in base alla qualità mediante colorazione con annessina V-FITC per mostrare fosfatidilserina e ioduro di propidio accessibili per misurare la permeabilità cellulare con una lettura della citometria a flusso. Confrontare la preparazione fissa con gli SH-SY5Y vivi ottenuti dal passaggio 2.2. Vedere paragrafo 7 e figura supplementare S1. La memorizzazione degli SH-SY5Y fissi dopo il passaggio 2.4 non è raccomandata in quanto non è stata valutata.
3. Etichettatura di SH-SY5Y morti con colorante fluorescente rosso sensibile al pH
- Dopo il passaggio 2.4, contare le cellule e rimuovere il numero totale di cellule necessarie in un tubo a basso legame proteico da 2 ml. Per ogni 1 milione di SH-SY5Y, il volume totale nel tubo da 2 ml è pari a 300-500 μL con un mezzo hePES buffered privo di fenolo rosso. Riscaldare brevemente il tubo a bagnomaria a 37 °C.
- Ricostituire l'estere STP del colorante fluorescente rosso sensibile al pH (vedere Tabella dei materiali)e aggiungere 12,5 μg di colorante per milione di SH-SY5Y al tubo caldo da 2 ml di cellule. Mescolare delicatamente con il pipettaggio. Incubare il tubo a temperatura ambiente per 30 minuti, al riparo dalla luce.
NOTA: La specie estere STP del colorante sensibile al pH reagisce con le ammine primarie e pertanto il tampone di etichettatura non deve contenere ammine libere. A causa della solubilità potenzialmente limitata nei tamponi acquosi, aggiungere il colorante disciolto DMSO solo al tampone acquoso riscaldato, mescolare immediatamente ed esaminare i segni di precipitato (particelle scure al microscopio ottico). - Aggiungere 1 mL di HBSS e centrifugare a 1200 x g per 7 min a 4 °C. Scartare il surnatante e lavare con 2 ml di HBSS. Ripetere la centrifugazione.
- Scartare il surnatante e ri-sospendere le cellule in mezzi macrofagici privi di fenolo rosso (vedi Tabella dei materiali), ad una concentrazione di 200.000-1,2 milioni di cellule / mL in modo che 50 μL siano 10.000-60.000 cellule (cioè 0,5x-3x più SH-SY5Ys rispetto ai macrofagi iPSC).
NOTA: il rosso fenolo nei media aumenta la fluorescenza di fondo e pertanto è necessario utilizzare un mezzo privo di fenolo rosso se si deve eseguire l'imaging delle cellule vive. La conservazione degli SH-SY5Ys colorati per più di qualche ora non è raccomandata in quanto non è stata valutata. Mantenere gli SH-SY5Ys macchiati sul ghiaccio e proteggerli dalla luce.
4. Colorazione dei macrofagi iPSC
- In un armadio di sicurezza biologica, preparare una soluzione in mezzo macrofagico di un colorante rosso-fluorescente, cell-permeante, succinimidyl ester-reattivo (vedi Tabella dei materiali). Aggiungere Hoechst 33342 (vedi Tabella dei materiali). Riscaldare la soluzione di lavoro a 37 °C a bagnomaria.
- Aspirare delicatamente il mezzo iPSC-macrofago pipettando il surnatante cellulare con una pipetta multicanale in un serbatoio sterile. Aggiungere 70 μL/pozzetta della soluzione colorante preparata al punto 4.1 ai macrofagi iPSC, utilizzando una pipetta multicanale. Incubare per 1 ora a 37 °C/5% CO2.
- Preparare trattamenti sperimentali in mezzi macrofagi privi di fenolo rosso. Includere 10 μM di citocalasina D come trattamento di controllo negativo. Dopo l'incubazione aspirare il mezzo iPSC-macrofago molto delicatamente con una pipetta multicanale e aggiungere 100 μL / pozzetti della soluzione salina tamponata (HBSS) di Hank per il lavaggio. Rimuovere immediatamente HBSS mediante pipettaggio delicato, quindi aggiungere 100 μL di ± composti. Incubare per 10 min-1 h a 37 °C/ 5% CO2.
NOTA: La citocalasina D è un potente inibitore dell'actina e blocca la fagocitosi. Per tutti i trattamenti sperimentali che richiedono un'incubazione più lunga, ad esempio 24-72 ore, eseguire il trattamento sperimentale prima della fase 4.1 utilizzando 100 μL / pozzet di trattamento in mezzi macrofagici completi. Seguire i passaggi 4.1-4.3 come da protocollo in modo che venga eseguita la colorazione cellulare e successivamente il trattamento venga riapplicato in mezzi macrofagi privi di fenolo rosso per il resto del test di fagocitosi.
5. Fagocitosi di imaging
Di seguito sono riportati due diversi metodi di lettura della fagocitosi, scegliere la sottosezione 5.1 o 5.2.
- Imaging time-lapse live-cell
- Prima della fagocitosi, accendere il microscopio di imaging time-lapse a cellule vive (vedere Tabella dei materiali),computer, camera d'ambiente e gas CO2. Apri il software di acquisizione delle immagini. Verificare che i cubi di luce DAPI, RFP e CY5 siano installati nel microscopio. Clicca su Time Lapse | Incubare | Abilita la camera ambiente e seleziona il riscaldamento a 37 ° C con gas CO2, assicurati anche che l'umidità sia deseleziona. Lasciare 30 minuti affinché il microscopio si riscaldi a 37 °C.
- Durante l'incubazione del composto al passo 4.3, caricare la piastra iPSC-macrofagica nel microscopio.
- Clicca su Immagine | Cattura | Esperto di navi. Selezionare Piastra pozzo e scegliere un tipo di piastra a 96 pozzetti.
- Nella scheda Immagine, attivate il canale di fase e regolate la messa a fuoco grossolana e fine utilizzando i cursori verticali, in modo che le celle siano a fuoco. Regola i livelli di illuminazione con il cursore orizzontale. Fare clic sui canali DAPI, RFP e CY5 e regolare i livelli di illuminazione per ciascun canale.
- Nella scheda Sistema, fare clic su Calibra allineamento vaso e seguire le istruzioni visualizzate.
- Clicca su Time Lapse | Routine | Crea nuova routine. Nella prima schermata della procedura guidata Time Lapse, denominare la routine. Fare clic su Avanti. Nella seconda schermata, selezionare l'obiettivo 20x, selezionare Acquisizione monocromatica e selezionare i canali DAPI, RFP, CY5 e Phase. Non selezionare le seguenti opzioni: Ricerca automatica campione, Messa a fuoco fine automatica, Z-Stack, Illuminazione automatica. Fare clic su Avanti.
- Nella schermata successiva impostare un faro al centro di ciascun pozzo, che consentirà al microscopio di tornare alle stesse coordinate con le stesse impostazioni di illuminazione per ogni punto temporale. Le impostazioni di messa a fuoco e illuminazione per ciascun beacon sono indipendenti. Per impostare un beacon: trascina il cerchio blu nella posizione sulla mappa della piastra, usa il cursore verticale di messa a fuoco grossolana e fine e, quando sei soddisfatto, fai clic su Aggiungi beacon. Le impostazioni beacon possono essere aggiornate in seguito utilizzando il pulsante Aggiorna selezionati.
- Quando si è pronti per iniziare il test di fagocitosi, rimuovere la piastra di analisi e metterla in un armadietto di sicurezza biologica. Utilizzare una pipetta multicanale per aggiungere 50 μL di SH-SY5Ys per pozzetta, aggiungendo al lato di ciascun pozzetta sul bordo del liquido.
- Caricare la piastra nel microscopio e attendere circa 30 minuti affinché lo spostamento termico si equilibra.
NOTA: durante i primi 30 minuti in cui la piastra è al microscopio, il cambiamento di temperatura della piastra di analisi causerà lo spostamento della messa a fuoco. Se la piastra non è autorizzata a equilibrarsi, le immagini acquisite si sposteranno fuori fuoco durante il time-lapse. - Fai clic su ciascun beacon e aggiorna l'impostazione di messa a fuoco. Fare clic su Avanti. Nella schermata successiva della procedura guidata Time Lapse, selezionare il formato di file TIFF, abilitare l'opzione salva singoli canalie abilitare l'opzione per creare video per ogni beacone consentire le opzioni sotto Includi le seguenti informazioni come filigrana. Fare clic su Avanti.
- Impostare il numero di scene su 1. Fare clic su Avanti. Imposta la durata e gli intervalli del time-lapse, ad esempio 3 ore e l'imaging ogni 5 minuti. Non selezionate Cattura un solo fotogramma. Fare clic su Avanti.
- Abilita la camera ambiente, con una temperatura di 37 °C e CO2 (l'umidità è facoltativa per brevi esperimenti). Fare clic su Avanti due volte. Scegliere un percorso per salvare i dati. Fare clic su Avanti. Fare clic su Start per avviare il time-lapse.
- Imaging ad alto contenuto a cellule fisse
- Utilizzare una pipetta multicanale per aggiungere 50 μL di SH-SY5Ys etichettati per pozzetti, aggiungendo al lato di ciascun pozzettino sul bordo del liquido. Incubare a 37 °C/ 5% CO2 per 3-5 h.
- Dopo l'incubazione della fagocitosi, aspirare delicatamente i supernatanti cellulari pipettando con una pipetta multicanale e scartare. Lavare una volta con 100 μL PBS.
- Fissare la piastra con l'aggiunta di 100 μL di paraformaldeide al 2%, incubare per 15 minuti a temperatura ambiente.
- Aspirare i pozzi e aggiungere 100 μL di PBS. Coprire con sigillante a piastre e lamina; conservare a 4 °C fino a quando richiesto.
NOTA: La piastra di analisi può essere conservata in questo modo per almeno una settimana senza una significativa degradazione del segnale; lo stoccaggio più lungo non è stato testato. - Accendere il microscopio per immagini ad alto contenuto (vedere Tabella dei materiali)e aprire il software di acquisizione delle immagini. Caricare la piastra di analisi nel microscopio facendo clic sull'icona Carica nella parte superiore dello schermo.
- Selezionare la scheda Configurazione. Nei menu a discesa della casella in alto a sinistra: selezionare il tipo di piastra appropriato, selezionare l'opzione di messa a fuoco automatica Due picchi (predefinito),selezionare l'obiettivo 40x Acqua, NA1.1,selezionare Modalità confocale e selezionare binning di 1.
- Lavare l'obiettivo acqua 40x prima dell'uso, tramite il menu Impostazioni.
- Nella casella Selezione canale, usa l'icona + per aggiungere i canali DAPI, Alexa 647 e Alexa 568. Impostare questi per misurare su un singolo piano di 1 μm. Ottimizzare le impostazioni di tempo e potenza per l'efficienza di colorazione della piastra di dosaggio.
NOTA: come linea guida, impostare DAPI a 200 ms di esposizione e 100% di potenza, Alexa 647 a 1500 ms di esposizione e 100% di potenza e Alexa 568 a 100 ms di esposizione e 40% di potenza. - Assicurarsi che i canali non vengano misurati contemporaneamente facendo clic su Sequenza canali per separare i canali.
- In navigazione | Definire il layout, selezionare i pozzi di misurazione e selezionare 9-12 campi per pozzo.
- Durante la configurazione, fare clic su un campo rappresentativo sulla mappa della piastra e controllare ogni canale di misurazione a turno, per assicurarsi che la colorazione sia presente e che le immagini siano focalizzate, regolando l'offset del canale.
- Per caricare i dati su un server per l'analisi remota, fare clic sulla casella Lavori online e sul relativo nome utente; ciò consentirà il caricamento automatico dei dati su un server dopo l'imaging.
- Salvare il protocollo di analisi facendo clic sul pulsante Salva.
- Fai clic sulla scheda Esegui esperimento in alto e assegna un nome alla piastra dell'esperimento, quindi fai clic su Avvia.
6. Analisi dei dati
Di seguito sono riportati due diversi metodi di analisi dei dati, scegliere la sottosezione 6.1 se è stata seguita la sottosezione 5.1 o scegliere la sottosezione 6.2 se è stata seguita la sottosezione 5.2.
- Analisi di immagini di fagocitosi ottenute al microscopio time-lapse a cellule vive
- Scaricare e installare il software open source consigliato (vedere Tabella dei materiali). Aprire il software.
- Nella casella Moduli di input selezionare Immagini.
- Da Esplora risorse, apri la cartella dei dati, contenente sottocartelle denominate Beacon-1, Beacon-2, ecc. Selezionare e trascinare tutte le cartelle Beacon nella casella di riepilogo File.
- Nella casella Moduli di input selezionare Metadati. Per Estrai metadati?, selezionare Sì. Nel menu a discesa accanto a Metodo di estrazione dei metadati, scegli Estrai da nomi di file / cartelle. Per l'origine dei metadati, scegliere Nome cartella. Fare clic sulla lente di ingrandimento a destra dell'espressione regolare e digitare ".*[\.*](? P.*)$" nella casella di testo Regex (escluse le virgolette). Clicca su Invia. Per Estrai metadati da, scegliere Tutte le immagini. Fai clic su Aggiorna nella parte inferiore dello schermo. Le immagini saranno ora raggruppate per beacon.
- Nella casella Moduli di input selezionare NamesAndTypes. Il seguente processo consentirà di assegnare le immagini per ogni punto temporale al canale di fluorescenza corretto. Assegna un nome alle regole di corrispondenza delle immagini (menu a discesa). Selezionare i criteri delle regole corrispondenti a Tutti (menu a discesa) delle regole seguenti. File (menu a discesa), Fa (menu a discesa), Contiene (menu a discesa), DAPI (casella di testo). Nome da assegnare a queste immagini DAPI (casella di testo). Selezionare il tipo di immagine Greyscale Image (menu a tendina). Imposta l'intervallo di intensità da Metadati immagine (menu a discesa).
- Nella parte inferiore dello schermo, fare clic su Aggiungi un'altra immaginee ripetere il passaggio 6.1.5. Sostituire DAPI con RFP, in modo che le immagini RFP siano raggruppate.
- Ripetere il passaggio 6.1.6 per le immagini del canale CY5.
- Fare clic su Aggiorna nella parte inferiore dello schermo, i file di immagine verranno ora elencati in tre colonne denominate DAPI, RFP e CY5.
- Nella casella Moduli di input selezionare Gruppi. Per Si desidera raggruppare le immagini?, selezionare Sì. Nel menu a discesa per Categoria metadati, scegli Beacon.
- Nella casella Moduli di analisi fare clic con il pulsante destro del mouse sullo spazio vuoto per richiamare un elenco di tutti i moduli.
- Clicca su Aggiungi | | di elaborazione delle immagini EnhanceOrSuppressFeatures. Scegliere DAPI dalla prima casella a discesa come immagine di input. Denominare l'immagine di output come "DAPIspeckles". Selezionate il tipo di operazione Migliora (Enhance) e il tipo di feature Speckles, con una dimensione della feature di 20 pixel. Scegli l'opzione velocità e precisione Veloce/Esagonale.
- Creare un nuovo modulo. Aggiungi | | di elaborazione degli oggetti IdentifyPrimaryObjects. Scegliere DAPIspeckles dalla prima casella a discesa come immagine di input. Denominare gli oggetti primari "Nuclei". Inserire il diametro tipico degli oggetti come unità da 10 a 35 pixel; questo parametro può essere ottimizzato. Scegli la strategia di soglia globale,il metodo di soglia RidlerCalvard,il metodo di levigatura automaticae dai il fattore di correzione della soglia come 12 con limiti inferiore e superiore 0-1. Modificare il metodo per distinguere gli oggetti raggruppati in Shape, ma lasciare altri parametri alle impostazioni predefinite.
NOTA: I nuclei iPSC-macrofagi sono stati approssimativamente segmentati nella fase 6.1.12, seguendo una fase di elaborazione delle immagini che riduce il diametro e aumenta il contrasto dei nuclei. È importante che vengano selezionati solo i nuclei più luminosi poiché gli SH-SY5Y si presenteranno come nuclei più deboli e saranno scambiati per iPSC-macrofagi altrimenti. Per regolare la proporzione di nuclei selezionati, aumentare o diminuire il fattore di correzione della soglia. Durante la fase di test, confrontare la selezione dei nuclei risultante con un'immagine di fase del beacon, dove è facile distinguere tra iPSC-macrophage e SH-SY5Y usando la morfologia cellulare. - Creare un nuovo modulo. Aggiungi | | di elaborazione delle immagini CorrectIlluminationCalcola. Scegli CY5 dalla prima casella a discesa come immagine di input. Denominare l'immagine di output "IllumCY5". Per Seleziona come si è l'illuminazione, scegli Sfondo dal menu a discesa. Lasciare gli altri parametri alle impostazioni predefinite.
- Creare un nuovo modulo. Clicca su Aggiungi | | di elaborazione delle immagini CorrectIlluminationApply. Scegli CY5 dalla prima casella a discesa come immagine di input. Denominare l'immagine di output "CorrCY5". Per Seleziona l'illuminazione, scegli IllumCY5 dal menu a discesa. Per Seleziona come si trova l'illuminazione, scegli Dividi dal menu a discesa.
NOTA: lo scopo dei passaggi 6.1.13-6.1.14 è correggere la variazione dell'illuminazione di sfondo delle immagini CY5, che altrimenti interferirebbe con la corretta segmentazione cellulare. - Creare un nuovo modulo. Clicca su Aggiungi | | di elaborazione degli oggetti IdentifySecondaryObjects. Scegliere CorrCY5 dalla prima casella a discesa come immagine di input. Selezionate Nuclei (Nuclei) come oggetti di input. Assegna agli oggetti secondari il nome "Mac". Scegli il metodo di identificazione come Distanza - B. Selezionare la strategia di soglia Globale, metodo di soglia RidlerCalvard, il metodo di levigatura Nessun livellamentoe dare il fattore di correzione della soglia come 1 con limiti inferiore e superiore 0-1. Lasciare altri parametri alle impostazioni predefinite.
NOTA: questo passaggio di segmentazione delle celle potrebbe richiedere l'ottimizzazione, regolando il fattore di correzione della soglia in modo che cresca o riduca i limiti delle celle. L'efficienza di segmentazione può anche essere migliorata aumentando la forza della colorazione iPSC-macrofagica o l'illuminazione del cubo di luce CY5 durante l'imaging. - Creare un nuovo modulo. Clicca su Aggiungi | | di elaborazione delle immagini EnhanceOrSuppressFeatures. Scegliere RFP dalla prima casella a discesa come immagine di input. Denominare l'immagine di output come "FilteredRFP". Selezionate il tipo di operazione Migliora (Enhance) e il tipo di feature Speckles, con una dimensione della feature di 15 pixel. La dimensione della feature può essere ottimizzata. Scegli l'opzione velocità e precisione Veloce/Esagonale.
- Creare un nuovo modulo. Clicca su Aggiungi | | di elaborazione degli oggetti IdentifyPrimaryObjects. Scegliere FilteredRFP dalla prima casella a discesa come immagine di input. Denominare gli oggetti primari "pHr". Immettere il diametro tipico degli oggetti come unità da 5 a 20 pixel. Selezionare la strategia di soglia Manualee digitare una soglia manualmente, ad esempio 0,005. Modificare il metodo per distinguere gli oggetti raggruppati in Shape, ma lasciare gli altri parametri alle impostazioni predefinite.
NOTA: gli SH-SY5Y sono stati segmentati nel passaggio 6.1.17, seguendo una fase di elaborazione delle immagini che riduce il diametro e aumenta il contrasto del puncta. È fondamentale eseguire la soglia manuale, poiché l'intensità del colorante sensibile al pH aumenta nel tempo nelle particelle fagocitose e altre strategie di soglia gonfiano artificialmente il numero di puncta coloranti sensibili al pH nei primi punti temporali. La soglia manuale deve essere regolata per ogni successiva ripetizione sperimentale, utilizzando la modalità di prova. - Creare un nuovo modulo. Clicca su Aggiungi | | di elaborazione degli oggetti RelateObjects. Selezionare gli oggetti figlio di input pHr dal menu a discesa. Seleziona gli oggetti padre di input Mac dal menu a discesa. Per Calcolare le medie per genitore per tutte le misurazioni figlio?, selezionate Sì. Non calcolare le distanze figlio-genitore (Nessuno).
NOTA: Il passo 6.1.18 mette in relazione il segnale del colorante sensibile al pH con i macrofagi iPSC, consentendo la misurazione del numero medio di oggetti fagociti per iPSC-macrofago. - Creare un nuovo modulo. Clicca su Aggiungi | | di elaborazione dei file ExportToSpreadsheet. Selezionare il delimitatore di colonne come Tab e aggiungere un prefisso per i nomi dei file per indicare il numero del beacon. Scegliere misure specifiche per l'esportazione, come indicato di seguito (passaggi 6.1.19.1 - 6.1.19.4); lasciando altri parametri alle impostazioni predefinite.
- | immagine Conta | Seleziona pHr e Mac
- | immagine Filename
- | immagine Gruppo
- | Mac | bambini Phr
- Nella casella Output, fare clic su Visualizza impostazioni di output. Creare una nuova cartella sul desktop per questo esperimento e impostare questa come cartella di output predefinita.
- Salvare il file della pipeline | SaveProject come....
- Testare e ottimizzare la pipeline su un'immagine rappresentativa facendo clic su Avvia modalità test nell'angolo in basso a sinistra. Il programma seleziona automaticamente la prima immagine per il test e ogni passaggio della pipeline può essere visualizzato facendo clic sui simboli dell'occhio, che rende visibile l'output, e quindi facendo clic su Esegui. Per modificare il beacon utilizzato per i test, nella barra dei menu in alto fare clic su Test | Scegliere Gruppo di immagini. Per modificare l'immagine (timepoint) all'interno di un beacon, nella barra dei menu in alto fare clic su Test | Scegliere Set di immagini. I parametri che devono essere ottimizzati sono indicati nei passaggi precedenti.
- Quando sei soddisfatto della pipeline, fai clic su Esci dalla modalità test e fai clic sui simboli dell'occhio aperto per chiuderli. Salvate la pipeline. Fare clic su Analizza immagini per avviare l'analisi completa delle immagini.
- I file di testo generati possono essere aperti come foglio di calcolo con un software di foglio di calcolo appropriato e il file etichettato "Immagine" conterrà una riga per ogni punto temporale dell'immagine, con le colonne che rappresentano i parametri.
NOTA: Count_Mac e Count_pHr rappresentano il numero di macrofagi iPSC e il numero di oggetti sensibili al pH identificati in un'immagine. Non utilizzare dati Count_pHr, poiché il conteggio include SH-SY5Ys vagamente fluorescenti che non sono stati fagocitosi. La colonna Mean_Mac_Children_pHr_Count prende il numero medio di oggetti pHr fagociti per Mac (passaggio 6.1.18 RelateObjects) per una singola immagine, cioè un singolo punto temporale di un beacon. - Disporre i dati in modo che ogni beacon sia una colonna separata sul foglio di calcolo, le immagini disposte come righe di ordine cronologico, con parametri diversi che occupano fogli diversi della cartella di lavoro del foglio di calcolo.
- Moltiplicare le misurazioni Mean_Mac_Children_pHr_Count per Count_Mac, per generare il parametro Numero di punti per immagine. Calcola la Count_Mac media per ogni Beacon. Dividere il numero di punti per immagine per la media Count_Mac per quel beacon, generando il parametro Numero di punti per cella.
NOTA: il passaggio 6.1.26 corregge eventuali fluttuazioni errate che possono verificarsi nel conteggio dei macrofagi iPSC (Count_Mac), normalizzando i dati al conteggio medio dei macrofagi iPSC in tutti i punti temporali di un beacon. - Assegna il tempo dall'inizio della fagocitosi (in min) a ciascuna riga di immagine.
- Generare mezzi e deviazione standard per replicare pozzi / beacon. Rappresentare graficamente il numero di punti per cella (asse y) rispetto al tempo (asse x) per visualizzare il tasso di fagocitosi.
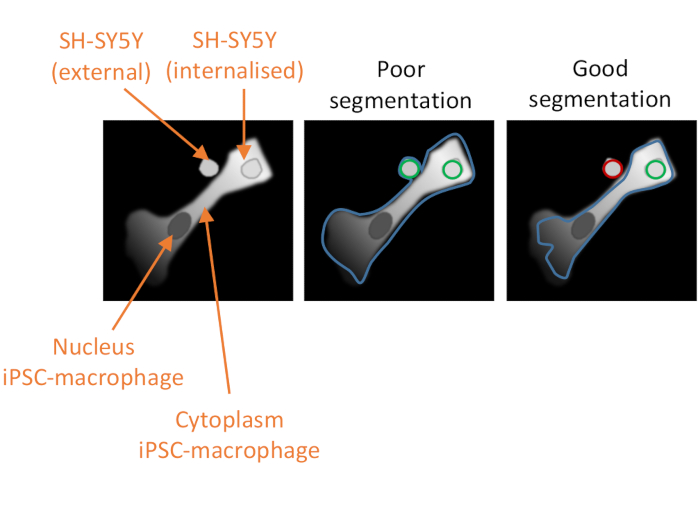
Figura 2: Segmentazione cellulare nell'analisi della fagocitosi ad alto contenuto. Illustrazione per dimostrare una buona rispetto alla scarsa segmentazione di un macrofago iPSC in prossimità di un SH-SY5Y non fagocitoso, con un secondo SH-SY5Y completamente fagocitoso. Con entrambi i tipi di cellule mostrati in grigio, il bordo cellulare iPSC-macrofago delineato dall'analisi al computer è delineato (blu). Gli SH-SY5Y che vengono conteggiati come eventi di fagocitosi sono delineati in verde o in rosso se esclusi dall'analisi. L'immagine al centro mostra una scarsa segmentazione; l'iPSC-macrofago ha una delineazione sub-ottimale che include l'SH-SY5Y non fagocito all'interno del bordo cellulare, che sarà conteggiato come un evento di fagocitosi. L'immagine a destra mostra una buona segmentazione a causa di parametri più rigorosi che definiscono il bordo cellulare iPSC-macrofago, che ha portato alla corretta esclusione dall'analisi dell'SH-SY5Y non fagocitoso. Fare clic qui per visualizzare una versione più grande di questa figura.
- Analisi di immagini di fagocitosi ottenute con microscopio ad alto contenuto
- Accedere al software di elaborazione delle immagini consigliato (vedere Tabella dei materiali).
- Selezionare la cartella del nome dello schermo e la sottocartella di esecuzione dell'immagine dal menu a sinistra. Fare clic sull'icona Analisi immagine (una schermata con una lente di ingrandimento). Selezionate un pozzetti rappresentativo nel layout della piastra per l'impostazione della pipeline di analisi.
- Il primo blocco predefinito di analisi è l'immagine di input. Lasciare le impostazioni predefinite per l'elaborazione dello stack (Singoli piani) e lacorrezioneflatfield ( Nessuno ). Fare clic sul segno + nell'angolo in alto a destra del blocco, per aggiungere il blocco predefinito successivo e selezionare Trova nuclei.
- In Find Nuclei, impostare il canale come DAPI, la popolazione ROI come None, il metodo di segmentazione come C. La casella del metodo contiene un menu a discesa che consente di ottimizzare il parametro, con le impostazioni per la soglia comune (ad esempio, 0,40) e l'area (ad esempio, >30 μm2). Denominare la popolazione di output "Nuclei". Aggiungi il blocco predefinito successivo facendo clic sul simbolo + e seleziona Trova citoplasma.
- In Trova citoplasma, imposta il canale come Alexa 647 e il metodo come B. La casella del metodo contiene un menu a discesa che consente di ottimizzare il parametro, con le impostazioni per la soglia comune (ad esempio, 0,45) e la soglia individuale (ad esempio, 0,20). Aggiungi il blocco predefinito successivo facendo clic sul simbolo + e seleziona Seleziona popolazione.
NOTA: è fondamentale ottimizzare correttamente la segmentazione del citoplasma in modo che escluda qualsiasi SH-SY5Y adiacente che non è stato fagocitoso ma non escluda il carico fagocitoso (vedere Figura 2). - In Seleziona popolazione , mantenere le impostazioni predefinite,che saranno Nucleidi popolazione , metodo Filtri comuni, un segno di spunta per Rimuovi oggetti di confinee la popolazione di output denominata "Nuclei selezionati". Aggiungere il blocco predefinito successivo facendo clic sul simbolo + e selezionare Calcola proprietà morfologiche.
- In Calcola proprietà morfologiche,impostare la popolazione su Nuclei selezionati,la regione su Cellula,il metodo su Standard. Nel menu a discesa, assicurarsi che l'area e la rotondità siano selezionate (μm2). Denominare la popolazione in uscita "Cella morfologica". Aggiungi il blocco predefinito successivo facendo clic sul simbolo + e seleziona Seleziona popolazione.
- In Seleziona popolazione (2), scegliere la popolazione Nuclei selezionatie il metodo Filtra per proprietà. Nella casella a discesa sotto Filtro F1, selezionare Area cella morfologia [μm2]. Scegli > dalla casella a discesa a destra e digita 160 nella casella a destra di quella. Denominare la popolazione in uscita "Nuclei selezionati 2". Aggiungi il blocco predefinito successivo facendo clic sul simbolo + e seleziona Trova punti.
NOTA: questo passaggio esclude da ulteriori analisi tutte le cellule segmentate in modo improprio e le cellule morte. Potrebbe essere necessario ottimizzare aumentando o diminuendo la dimensione del cut-off. - In Trova Spot,seleziona il canale Alexa 568,la popolazione ROI Nuclei Selezionati 2,la celladella regione ROI, metodo B,e assegna il nome alla popolazione di output "Spots". Il metodo può essere ottimizzato, se necessario, utilizzando il menu a discesa, con impostazioni per la sensibilità di rilevamento (ad esempio, 0,20) e la sensibilità di divisione (ad esempio, 0,400). Aggiungere il blocco predefinito successivo facendo clic sul simbolo + e selezionare Calcola proprietà morfologiche.
- In Calcola proprietà morfologiche (2), selezionare la popolazione Macchie, regione Spote metodo Standard. Nel menu a discesa, assicurarsi che l'area e la rotondità siano selezionate (μm2). Denominare le proprietà di output "Morphology Spot". Aggiungi il blocco predefinito successivo facendo clic sul simbolo + e seleziona Seleziona popolazione.
- In Seleziona popolazione (3), selezionare la popolazione Macchie e il metodo Filtra per proprietà. Nelle caselle a discesa sotto Filtro F1, selezionare Area spot [px2], >, 20. Nelle caselle a discesa sotto Filtro F2, selezionare Area spot [px2], <, 2500. Nelle caselle a discesa sotto Filtro F3, selezionare Rotondità punto morfologico, >, 0.6. Nelle caselle a discesa sotto Filtro F4, selezionare Intensità da spot a regione, >, 2.5. Assegnare alla popolazione di output il nome "Spot Selected". Aggiungi il blocco predefinito successivo facendo clic sul simbolo + e seleziona Seleziona popolazione.
NOTA: La selezione automatica dei punti avrà segmentato molti minuscoli granelli fluorescenti che derivano da corpi autofluorescenti all'interno dei macrofagi iPSC. Questo passaggio mira a filtrare i corpi autofluorescenti applicando tagli rigorosi all'area, alla rotondità e all'intensità delle macchie e potrebbe richiedere una certa ottimizzazione. - In Seleziona popolazione (4), selezionare la popolazione Nuclei selezionati 2 e il metodo Filtra per proprietà. Nelle caselle a discesa sotto Filtro F1, selezionare Numero di punti, >, 0.5. Denominare la popolazione di output "Spot Positive Cells". Aggiungere il blocco predefinito successivo facendo clic sul simbolo + e selezionare Definisci risultati.
- In Definisci risultati, selezionare il primo metodo come Elenco di output. L'impostazione predefinita è il numero di oggetti da calcolare per ogni popolazione. Fare clic sul menu a discesa per Popolazione: nuclei selezionati 2 e assicurarsi che il numero di oggetti sia selezionato, quindi nel menu a discesa Applica a tutti selezionare TUTTI. Per la popolazione Spot Positive Cell, assicurarsi che il numero di oggetti sia spuntato. Per le altre popolazioni, non è necessario riportare alcun parametro. Selezionare il secondo metodo come Output formulae digitare la formula (a/b)*100. Scegliere come variabile A Spot Cella positiva - Numero di oggettie come variabile B scegliere Nuclei selezionati 2- Numero di oggetti. Denominare l'output come "Spot Positive Cells (%)".
- Salva la pipeline: clicca sull'icona Salva analisi su disco (un floppy disk con freccia in giù).
- Fare clic sull'icona Analisi batch (un simbolo di imbuto e ingranaggi nella parte superiore dello schermo). Dalle cartelle sperimentali a sinistra, selezionare il file di dati grezzi, che dovrebbe aggiornare il numero di misurazioni selezionate a 1. Nell'area Opzioni analisi, fate clic sul menu a discesa Metodoe selezionate Analisi esistente. Clicca sul ... accanto a File di script e cercare il file di analisi salvato (suffisso .aas). Quindi, fai clic sulla freccia verde accanto a Avvia analisi. L'avanzamento dell'analisi può essere monitorato facendo clic su Stato processo (nell'angolo in alto a destra dello schermo).
- Una volta completata l'analisi, fai clic sulla scheda Esporta, scegli la cartella dell'esperimento e seleziona una cartella di destinazione. Lasciare le impostazioni predefinite, che esportano i dati ma non le immagini TIFF, e avviare l'esportazione.
- Aprire il file scaricato come foglio di calcolo in un software per fogli di calcolo appropriato. I pozzi sono disposti in righe e i parametri in colonne. Selezionare i dati nelle colonne denominate Cellule spot positive (%), Nuclei selezionati 2 - Numero di punti - Media per pozzo e Nuclei selezionati 2 - Area totale di punti - Media per pozzo e copiarli in nuovi fogli di calcolo per ciascun parametro. Calcolare la media dei parametri per i pozzi di replica di ciascuna condizione e il grafico appropriato.
7. Test di controllo qualità per l'omogeneità di SH-SY5Y fissi
- Raccogliere un'aliquota di SH-SY5Ys vivi dal punto 2.2 e ricandidare nel tampone legante l'annexin da un kit per la colorazione dell'annexin V-FITC (vedi Tabella dei materiali)ad una concentrazione di circa 200.000 cellule per ml.
- Raccogliere un'aliquota di SH-SY5Y fissi dal punto 2.4 e ricaspenare nel tampone legante l'annessina ad una concentrazione di circa 200.000 cellule per mL.
- Preparare due provette con 5 μL di allegatina V-FITC e 5 μL di ioduro di propidio (vedi Tabella dei materiali). Aggiungere 500 μL di SH-SY5Ys vivi a un tubo e 500 μL di SH-SY5Y fissi all'altro.
- Preparare tre tubi di controllo: uno con 5 μL di annessina V-FITC, uno con 5 μL di ioduro di propidio e un tubo vuoto. Mescolare insieme un rapporto 1:1 di SH-SY5Y vivi e fissi e aggiungere 500 μL di questo a ciascun tubo di controllo.
- Mescolare delicatamente i tubi mediante pipettaggio. Incubare a temperatura ambiente per 10 minuti, al riparo dalla luce.
- Misurare immediatamente su un citometro a flusso(Ex = 488 nm; Em = 530 nm) utilizzando il rilevatore di segnale FITC (di solito FL1) per l'annessina V-FITC e il rilevatore di segnale di emissione di ficoeritrina (di solito FL2) per lo ioduro di propidio.
- Utilizzare qualsiasi software di analisi della citometria a flusso per visualizzare i dot plot del segnale FITC vs PI e utilizzare uno strumento di gating rettangolare per selezionare la popolazione a doppia negatività. All'interno della popolazione a doppio negativo, visualizzare FSC vs SSC e utilizzare uno strumento di gating poligonale per creare un cancello di esclusione intorno alla popolazione con FSC e SSC molto bassi, che è classificato come detriti e quindi escluso da ulteriori analisi. Visualizzare gli eventi rimanenti come segnale FITC vs PI e utilizzare i controlli a macchia singola e non macchiati per impostare un gate quadrante per gli eventi FITC-/PI-, FITC+/PI-, FITC -/PI+ e FITC+/PI+.
NOTA: Evitare manipolazioni approssimative, vortici o lunghe incubazioni con SH-SY5Y vivi, che potrebbero indurre artificialmente la visualizzazione della fosfatidilserina. Procedere alla citometria a flusso senza indugio. Un risultato auspicabile è che la percentuale di eventi FITC-/PI- è <5% negli SH-SY5Y fissi. I risultati rappresentativi sono mostrati nella Figura supplementare S1.
Risultati
L'imaging time-lapse delle cellule vive è stato eseguito utilizzando il protocollo precedentemente delineato, con macrofagi iPSC di tipo selvatico seminati a 20.000 cellule per pozzedo. Sono state applicate diverse quantità di SH-SY5Y (10.000-30.000 per bene come stimato dal conteggio cellulare nel passaggio 3.1) e l'inibitore della fagocitosi citocalasina D è stato pre-incubato (1 ora) con alcuni pozzezze, agendo come controllo per inibire la fagocitosi per ogni quantità di SH-SY5Ys. L'imaging è iniziato 40 minuti dopo l'aggiunta di SH-SY5Y e le immagini sono state acquisite a intervalli di 5 minuti per le successive 3 ore (i dati includono il ritardo iniziale di 40 minuti). Un video time-lapse rappresentativo è incluso nei dati supplementarie i dati quantitativi analizzati mostrati nella Figura 3. Con la quantità di 10.000 SH-SY5Y per pozzo, il numero di particelle fagocitose (macchie) per cellula è aumentato linearmente con il tempo ed è stato inibito di circa il 50% dalla citocalasina D. L'inibizione da parte della citocalasina D è stata più debole del previsto, molto probabilmente causata da repliche tecniche o biologiche insufficienti, poiché è stato ripreso un solo pozzo per condizione con tre campi immagine. Con quantità più elevate di SH-SY5Y per pozzetto (20.000 e 30.000), la fagocitosi ha mostrato una scarsa linearità, probabilmente a causa della scarsa segmentazione di iPSC-macrofagi e SH-SY5Y in un campo visivo più affollato.
L'imaging ad alto contenuto a cellule fisse è stato eseguito utilizzando il protocollo precedentemente delineato, con macrofagi iPSC di tipo selvaggio a 20.000 cellule per pozzetti, diverse quantità di SH-SY5Y (10.000-80.000 per pozzetti) e la piastra di analisi è stata fissata e grafata dopo 5 ore. Un'immagine rappresentativa della fagocitosi è presentata in Figura 4Ae i dati analizzati mostrati in Figura 4B17. L'aumento della quantità di SH-SY5Y ha comportato un numero maggiore di particelle fagocitose (macchie) per cellula; tuttavia, un raddoppio della quantità di SH-SY5Y porta solo ad un aumento di 1,5 volte del numero di punti per cella. Ciò indica che le quantità testate non sono limitanti alla fagocitosi. Successivamente il saggio di fagocitosi di imaging ad alto contenuto è stato validato utilizzando diversi inibitori della fagocitosi (Figura 4C)17. Gli inibitori della polimerizzazione dell'actina citocalasina D e jasplakinolide hanno inibito significativamente la fagocitosi del 91% e del 90%, rispettivamente, quando pre-incubati per 1 ora prima della fagocitosi. Il robusto Z' del saggio quando la citocalasina D o il jasplakinolide sono usati come controlli negativi è calcolato come 0,7 e 0,8, rispettivamente20. L'inibitore dell'acidificazione del lisosoma bafilomicina A1 ha ridotto significativamente la fagocitosi del 31%, quando incubato 1 ora prima della fagocitosi. L'effetto più debole dell'inibitore dell'acidificazione del lisosoma rispetto agli inibitori dell'actina suggerisce che il rilevamento del carico internalizzato potrebbe non richiedere la completa acidificazione del fagosoma. L'annessina V ricombinante è stata utilizzata come controllo per bloccare specificamente la fosfatidilserina esposta sulla superficie di SH-SY5Ys, impedendo ai recettori fagocitici di accedere al ligando, un importante segnale "mangia-me". L'aggiunta di annessina V ricombinante ha ridotto significativamente la fagocitosi del 30%, se aggiunta ai pozzi immediatamente prima dell'aggiunta di SH-SY5Y. È stato confermato che gli SH-SY5Y fissi esponevano la fosfatidilserina, utilizzando una sonda fluorescente di annessina V, mentre gli SH-SY5Y vivi erano negativi per la colorazione dell'annessina V (Figura 4D).
Il recettore della fagocitosi microgliale TREM2 ha precedentemente dimostrato di essere importante per la fagocitosi dei neuroni apoptotici21. La mutazione R47H di TREM2 è un gene di rischio per l'insorgenza tardiva della malattia di Alzheimer e si ipotizza di ridurre il legame del ligando di TREM223. Con l'obiettivo di valutare la funzione fagocitica di R47H TREM2 e TREM2 KO, il test di fagocitosi ad alto contenuto a cellule fisse è stato eseguito utilizzando linee iPSC-macrofagi isogeniche con WT/R47H/KO TREM217. Sono state testate diverse lunghezze di durata della fagocitosi da 1 a 5 ore, utilizzando un'aggiunta scagliona di carico fagocitico (40.000 SH-SY5Y). Il segnale risultante aumenta linearmente a 4 h, livellandosi leggermente a 5 h (Figura 5)17. La riduzione del tasso e della capacità di fagocitosi (% di cellule spot positive) era evidente nel KO TREM2 rispetto al WT, mentre il mutante R47H TREM2 non mostrava fagocitosi alterata. Il difetto fagocitico nelle cellule TREM2 KO non è fenocopiato dalla mutazione R47H TREM2, apparentemente perché la funzione TREM2 è sufficiente a supportare la normale fagocitosi.
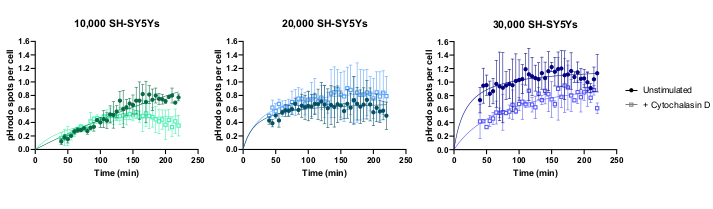
Figura 3: Dati di esempio per il saggio di fagocitosi time-lapse a cellule vive. Assorbimento di SH-SY5Y morti da parte di macrofagi iPSC di tipo selvatico BIONi010-C (ECACC ID: 66540023) ripreso a intervalli di 5 minuti per 3 ore. I tempi visualizzati sul grafico sono dall'inizio della fagocitosi, compresi i primi 40 minuti senza misurazione. Viene tracciato il numero medio di punti per cella da tre pozzi replicati. La fagocitosi di 10.000 SH-SY5Ys è inibita con 10 μM di citocalasina D con 1 ora di pre-trattamento, mentre quantità più elevate di SH-SY5Y (20.000 e 30.000) hanno una quantificazione subottimale della fagocitosi. Deviazione standard media ± (SD), N = 1 esperimento. Fare clic qui per visualizzare una versione più grande di questa figura.
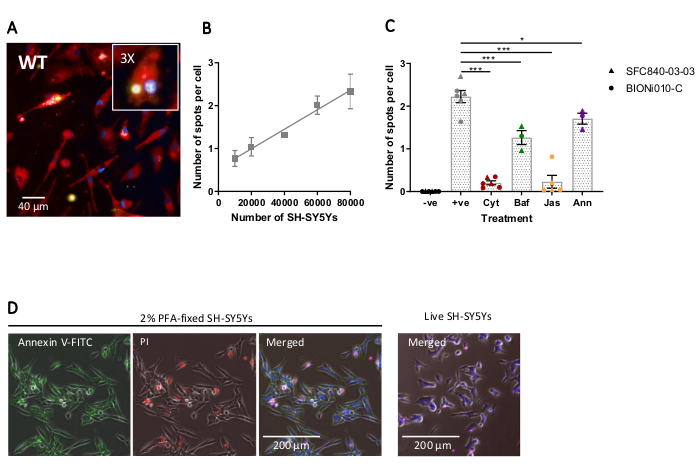
Figura 4: Ottimizzazione e validazione del saggio di fagocitosi ad alto contenuto a cellule fisse. (A) Immagine rappresentativa al microscopio ad alto contenuto di FAGOCITO SH-SY5YS da iPSC-macrofagi wild-type BIONi010-C (ECACC ID: 66540023). Viene mostrato un time-point di 3 ore con 40.000 SH-SY5Y. I canali di fluorescenza sono uniti, con la macchia iPSC-macrofagica mostrata come rossa, i nuclei come blu e SH-SY5Ys come giallo. Il pannello dell'inserto è una sezione dell'immagine ingrandita 3x. (B) Il numero di macchie per cellula di SH-SY5Ys morti fagocitosi dopo 5 ore, utilizzando diverse quantità di carico oltre ai macrofagi iPSC di tipo selvaggio. Media ± errore standard della media (SEM), per N = 3 raccolti. (C) La fagocitosi (3 h) è inibita con 10 μM di citocalasina D (Cyt), 1 μM di bafilomicina A1 (Baf), 1 μM di jasplakinolide (con 1 ora di pretrattamento; Jas) e 13 μg/mL di annessina V ricombinante (aggiunta simultaneamente agli SH-SY5Y morti; Anna). i macrofagi iPSC senza SH-SY5Y aggiunti sono stati usati come controllo negativo (-ve), e il controllo positivo (+ve) è ipsc-macrofagi non trattati con SH-SY5Ys aggiunti. I dati sono stati normalizzati alla media per la ripetizione dell'esperimento. Mezzi ± SEM, per N = 3-6 raccolti e con due linee cellulari wild-type (SFC840-03-03, la caratterizzazione di questa linea è descritta in (Fernandes et al.21 e BIONi010-C). ANOVA a 1 via con test post-hoc di Dunnett, confronti con cellule non trattate. *p < 0,05, ***p < 0,001. (D) Gli SH-SY5Y appena fissati si colorano uniformemente per la visualizzazione della fosfatidilserina (annessina V-FITC) e hanno una permeabilità cellulare limitata (ioduro di propidio). Gli SH-SY5Y vivi non si macchiano per l'annessina V-FITC o lo ioduro di propidio, ad eccezione della colorazione focale presente sulle poche cellule morte in coltura. Le figure sono riprodotte con il permesso di Alzheimer's Research & Therapy17. Fare clic qui per visualizzare una versione più grande di questa figura.
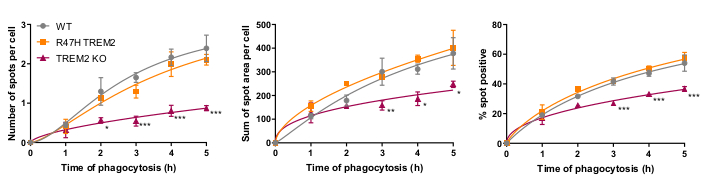
Figura 5: La fagocitosi è ridotta in TREM2 KO ma non in R47H TREM2 iPSC-macrofagi. Saggio di fagocitosi ad alto contenuto eseguito con 40.000 SH-SY5Y per pozzo con aggiunte sfalsate. I mezzi sono stati quantificati per i parametri: numero di punti per cellula, somma di aree spot (μm2) per cellula e percentuale di cellule contenenti particelle fagocitose per campo. I dati sono stati normalizzati in modo da significare per ogni genotipo per esperimento. Media ± SEM, per N = 3 raccolti. ANOVA a 2 vie a misure ripetute, il test post-hoc di Dunnett, confronti a coppie con il WT per ogni volta: *p < 0,05, **p < 0,01, ***p < 0,001. Le figure sono riprodotte con il permesso di Alzheimer's Research & Therapy17. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura supplementare S1: Esempio qc per la preparazione sh-SY5Ys. Gli SH-SY5Y dissociati sono stati fissati per 10 minuti con lo 0% (cellule vive), l'1% e il 2% di paraformaldeide (PFA), quindi lavati. Le cellule sono state colorate con annessina V-FITC e ioduro di propidio (PI) e immediatamente misurate mediante citometria a flusso. I dot plot di densità di colore sono stati creati nel software di analisi della citometria a flusso, utilizzando i controlli a macchia singola e non macchiata per posizionare un cancello a quadrante. I quadranti sono annotati con la percentuale di eventi all'interno di quel quadrante. Le cellule vive sono principalmente in Q4 e le cellule fisse sono principalmente in Q2. Q1 = annessina V-/PI-, Q2 = annessina V+/PI+, Q3 = annessina V+/PI-, Q4 = annessina V-/PI- (cellule vive). Fare clic qui per scaricare questo file.
Video supplementare: Fagocitosi time-lapse live-cell. Video time-lapse rappresentativo di FAGOCI DI SH-SY5Ys da iPSC-macrofagi di tipo selvaggio BIONi010-C (ID ECACC: 66540023). Le immagini sono state scattate ogni 5 minuti per 3 ore. Il video viene ritagliato e viene eseguito a 3 fotogrammi al secondo, mostrando le ultime 1,5 ore del test. Gli SH-SY5Ys colorati con coloranti sensibili agli acidi sono mostrati in rosso, l'intensità del segnale aumenta con l'acidificazione dei fagosomi. I nuclei cellulari colorati con Hoechst 33342 sono mostrati in blu. Clicca qui per scaricare questo video.
Discussione
Le microglia hanno importanti funzioni che influenzano l'inizio e la progressione delle malattie neurodegenerative, compresa la fagocitosi dei neuroni apoptotici. La fagocitosi microgliale compromessa e la fagocitosi inappropriata delle sinapsi sono state entrambe associate a malattie neurodegenerative, sebbene i meccanismi sottostanti e la causalità non siano ben compresi4,23. Questo documento delinea un test di fagocitosi per misurare la fagocitosi delle cellule apoptotiche da parte dei macrofagi iPSC, con una lettura di imaging time-lapse a cellule vive o una microscopia ad alto contenuto a cellule fisse, o una combinazione di entrambi su un singolo test. Questa versatilità significa che il test può essere utilizzato per studiare singoli eventi fagocitici nel tempo in pochi pozzeggi o utilizzato per screening ad alto contenuto con più condizioni o trattamenti. Poiché il saggio ad alto contenuto è fissato in un singolo punto temporale, è possibile preparare più piastre di analisi contemporaneamente. Il test ad alto contenuto ha una potenziale utilità per caratterizzare macrofagi / microglia con varianti genetiche associate alla malattia o per lo screening di inibitori di piccole molecole per le modifiche alla fagocitosi. Il test può anche essere facilmente adattato per studiare la fagocitosi di altri modelli di microglia o potenzialmente astrociti. Il test della fagocitosi può potenzialmente essere multiplexato con macchie di imaging di cellule vive, ad esempio mitocondri, calcio o indicatori ROS e può essere eseguita una colorazione immunofluorescente post-fissazione per proteine di interesse. Rispetto ai saggi di fagocitosi esistenti che utilizzano cellule neuronali apoptotiche, i principali vantaggi che questo protocollo conferisce è che la preparazione del carico fagocitico è relativamente semplice e rapida e si traduce in un prodotto uniforme. Altri saggi inducono apoptosi di neuroni o SH-SY5Ys con S-nitroso-L-cisteina per 2 h25, acido okadaico per 3 h22, staurosporina per 4-16 h26,27,28,29 o irradiazione UV per 24 h30e possono provocare cellule in diversi stadi di apoptosi. Inoltre, l'imaging di cellule vive e le lettura di immagini ad alto contenuto non sono state precedentemente descritte, per quanto ne sanno gli autori. Il principale limite dell'uso della fissazione della paraformaldeide per preparare il carico fagocitico è che non ricapitola completamente il processo di apoptosi, poiché la fissazione impedisce alle cellule di dividersi in corpi apoptotici, che probabilmente saranno fagocitosi più rapidamente a causa delle loro dimensioni più piccole. Non è noto quale effetto abbia la fissazione sulla secrezione di segnali nucleotidici "trovami" (ad esempio, ATP, UDP) dalla cellula bersaglio che attirano i fagociti. Simile alle cellule apoptotiche, le SH-SY5Y fisse mostrano una certa permeabilità della membrana allo ioduro di propidio. La permeabilità della membrana è associata al rilascio di segnali "trovami"; tuttavia, questo non è stato studiato negli SH-SY5Y fissi e, se il nucleotide viene rilasciato troppo rapidamente, verrebbe lavato via prima che gli SH-SY5Y vengano aggiunti ai macrofagi iPSC.
Il primo passo critico nel protocollo è la colorazione di SH-SY5Y morti con un estere STP di un colorante fluorescente rosso sensibile al pH. Questo colorante reagisce rapidamente e covalentemente con ammine primarie libere sulla superficie delle SH-SY5Y morte. La durata della colorazione non ha bisogno di essere ottimizzata; tuttavia, è necessario prestare attenzione con la manipolazione del colorante prima dell'etichettatura. La reazione di etichettatura non deve essere eseguita in tamponi contenenti ammine libere. Inoltre, vi è il rischio di precipitazioni se lo stock dmSO viene diluito in un tampone acquoso freddo o ad alta concentrazione finale. I precipitati appariranno come oggetti scuri densi al microscopio. Inoltre, la soluzione colorante sensibile al pH si attacca ai normali tubi di centrifuga in plastica e si lava via lentamente; pertanto, i tubi a bassa legatura sono raccomandati per la fase di etichettatura. L'uso di un colorante sensibile al pH, invece di un colorante permanentemente fluorescente, aiuta l'identificazione delle particelle inghiottite, rispetto alle particelle che si trovano vicino alla membrana plasmatica. Poiché c'è una certa fluorescenza a pH neutro, la densità del carico fagocitico e dei macrofagi iPSC deve essere mantenuta abbastanza bassa per una segmentazione accurata, anche se abbastanza alta da catturare numerosi eventi fagocitici. La microscopia ad alto contenuto è stata in grado di identificare con precisione la fagocitosi con una media densità di carico nel pozzo (più di 2 SH-SY5Y per iPSC-macrofago). Al contrario, a causa della minore sensibilità del microscopio nello spettro rosso intenso, la segmentazione dei macrofagi iPSC nei dati di imaging time-lapse delle cellule vive era meno sicura ed era necessario utilizzare una densità di carico molto bassa per ridurre la probabilità di falsi positivi (1 SH-SY5Y per ogni due macrofagi iPSC). La convalida della corretta segmentazione e densità del carico deve essere eseguita con confronti tra pozzi non trattati e citocalasina trattati con D. In un test ben ottimizzato, la citocalasina D dovrebbe ridurre il numero medio di macchie per cellula del 90% rispetto ai campioni non trattati.
Un altro passo critico nel protocollo è la colorazione iPSC-macrofagica, che consente di identificare e segmentare la cellula nell'analisi delle immagini in modo che eventuali SH-SY5Y esterni siano esclusi dal conteggio. Il colorante raccomandato è permeante cellulare, convertito in un prodotto fluorescente insolubile all'interno del citoplasma, fissabile e non tossico (vedi Tabella dei materiali). La fase di colorazione è stata ottimizzata per l'uso di macrofagi iPSC con il test di fagocitosi di imaging ad alto contenuto e suggeriamo che dovrebbe essere ri-ottimizzato se vengono utilizzati altri tipi di cellule. La durata della colorazione cellulare può essere aumentata per migliorare la deposizione del prodotto fluorescente insolubile all'interno delle cellule. Se la concentrazione del colorante è ottimizzata, è necessario prestare attenzione per evitare livelli tossici del veicolo solvente organico.
Il terzo fattore critico per il successo del test è l'analisi dei dati. Le pipeline di analisi fornite sono destinate ad essere di orientamento piuttosto che prescrittive, poiché le differenze nell'intensità della colorazione o nella morfologia cellulare possono ridurre l'efficacia della segmentazione delle tubazioni come scritto. Saranno quindi necessarie alcune ottimizzazioni, con test della pipeline su opportuni controlli positivi e negativi, e i parametri che dovrebbero essere ottimizzati sono indicati nel testo del protocollo. I controlli negativi dovrebbero includere una condizione in cui i macrofagi iPSC sono pre-trattati con un potente inibitore della fagocitosi come la citocalasina D prima dell'aggiunta di SH-SY5Ys. Un altro possibile controllo negativo è l'aggiunta degli SH-SY5Y a pozzezze precedentemente non trattati di macrofagi iPSC alla fine del test, 10 minuti prima della fissazione, che consente un certo assestamento del carico ma è troppo breve per una quantità apprezzabile di fagocitosi. Un evento di fagocitosi è definito come un oggetto rosso-fluorescente all'interno dei bordi di un macrofago iPSC, definito dall'algoritmo software che utilizza il canale di fluorescenza rosso profondo. Se la segmentazione delle cellule è scarsa (Figura 2), molti SH-SY5Y non fagocitosi in prossimità di iPSC-macrofagi possono essere erroneamente inclusi nell'analisi, cioè falsi positivi. Il fattore più importante per ottenere una buona segmentazione è la delineazione rigorosa dei macrofagi iPSC. La segmentazione per entrambe le analisi è automatizzata, quindi non è possibile ottenere una segmentazione perfetta per ogni cellula; tuttavia, alcuni parametri possono essere regolati per rendere la segmentazione più ottimale, utilizzando alcune immagini di prova come riferimento. Il controllo della citocalasina D è importante per valutare la segmentazione ottimale perché un numero elevato di eventi fagocitici rilevati in questa condizione indica che la segmentazione è sub-ottimale. L'ottimizzazione della pipeline di analisi dei dati dovrebbe idealmente essere ripetuta fino a quando il numero di eventi fagocitici per cellula è inferiore dell'80%-90% nella condizione di citocalasina D rispetto a nessun inibitore.
I problemi con il test della fagocitosi che hanno maggiori probabilità di verificarsi sono: (1) debole fluorescenza sensibile al pH nei controlli positivi, (2) distribuzione sparsa o irregolare dei macrofagi alla fine del test o (3) un numero elevato di falsi positivi nell'analisi da SH-SY5Y non fagocitosi. La risoluzione dei problemi di debole fluorescenza sensibile al pH dovrebbe in primo luogo verificare che la colorazione degli SH-SY5Ys abbia provocato un pellet cellulare con un forte colore magenta. Se il colore è debole, assicurarsi che venga utilizzato un colorante fresco, assicurarsi che il tampone di etichettatura sia privo di ammine, aggiungere un lavaggio extra agli SH-SY5Y prima della colorazione, verificare se il numero corretto di SH-SY5Y è stato colorato, assicurarsi che non siano presenti precipitati di colorante e ottimizzare la concentrazione di etichettatura del colorante. Se gli SH-SY5Y sono fortemente macchiati, controllare se la concentrazione aggiunta alla piastra del saggio è corretta e assicurarsi che i macrofagi iPSC siano sani e non troppo vecchi. Il secondo tipo di problema, la distribuzione irregolare dei macrofagi, può derivare dalla perdita di cellule durante il pipettaggio e dovrebbero essere prese misure per ridurre le forze di pipettaggio sperimentate dalle cellule, evitando punte a foro stretto. Se il problema persiste, ridurre il tempo di incubazione del caricamento dei macrofagi iPSC con colorante cell-permeante. Il terzo problema, riguardante l'errata inclusione di particelle non fagocitose nell'analisi, indica che è necessaria una maggiore ottimizzazione della pipeline di analisi. La risoluzione dei problemi dovrebbe concentrarsi in primo luogo sulla segmentazione delle celle e sul fatto che il software includa oggetti adiacenti. I parametri specifici che possono essere regolati sono suggeriti nelle note sottostanti i passaggi pertinenti (passaggi 6.1.11-6.1.15 per l'analisi time-lapse live-cell e passaggi 6.2.4-6.2.8 per l'analisi ad alto contenuto). Se la segmentazione cellulare non può essere ulteriormente migliorata, l'analisi ad alto contenuto ha un passo in più (passo 6.2.8) che esclude i macrofagi iPSC segmentati in modo improprio. Inoltre, il modulo che filtra le macchie accettate di fluorescenza sensibile al pH all'interno dei macrofagi iPSC può essere ottimizzato, aumentando l'intensità di soglia degli oggetti accettati, il che dovrebbe aiutare a escludere SH-SY5Y non fagocito (passo 6.1.17 per l'analisi time-lapse delle cellule vive e passo 6.2.11 per l'analisi ad alto contenuto).
Abbiamo sviluppato due tipi di lettura al microscopio per il test della fagocitosi che presentano vantaggi e limitazioni. L'imaging time-lapse a cellule vive ha il merito di fornire informazioni aggiuntive sulla cinetica della fagocitosi ed è più ampiamente disponibile rispetto alle piattaforme di imaging ad alto contenuto. Il software open source consigliato è agnostico rispetto alla sorgente del microscopio e potrebbe essere utilizzato con qualsiasi microscopio fluorescente di buona qualità, con o senza capacità di time-lapse di cellule vive. Il principale limite dell'imaging delle cellule vive è la sensibilità e l'ottica limitate, che rendono più difficile rilevare ed eseguire una buona segmentazione dei macrofagi iPSC. Questa limitazione potrebbe essere mitigata aumentando la durata della colorazione dei macrofagi iPSC o passando a un microscopio più sensibile, se disponibile. Il test di fagocitosi di imaging ad alto contenuto è la lettura raccomandata se è disponibile un sistema di imaging ad alto contenuto. I sistemi di imaging ad alto contenuto consentono un throughput più elevato e dati più affidabili, consentendo di utilizzare questo test per lo screening, in cui ci si aspetterebbe un robusto Z' di ≥0,7 per l'uscita "numero di punti per cella"20. Rispetto al metodo time-lapse live-cell, la lettura al microscopio ad alto contenuto ha una maggiore sensibilità, un maggiore grado di automazione e velocità, è possibile elaborare più pozzi e campi di imaging e produrre immagini confocali ad alta risoluzione. La segmentazione cellulare è più efficace con buone immagini e la segmentazione è inoltre aiutata dal software di analisi di imaging ad alto contenuto che fornisce più metodi di segmentazione cellulare adatti a cellule di forma altamente irregolare. Il software di analisi di imaging ad alto contenuto ha anche calcolato più parametri di fagocitosi, rispetto al software open source, come la percentuale di cellule fagocitiche. Il principale limite del test di fagocitosi ad alto contenuto è quello del costo e dell'accessibilità del sistema di imaging e del software di analisi.
In conclusione, il saggio quantitativo di fagocitosi presentato in questo articolo è uno strumento utile per modellare la fagocitosi delle microglia dei neuroni morti in vitro. Le microglia sono modellate da iPSC-macrofagi e i neuroni morti sono modellati da SH-SY5Y fissati alla paraformaldeide. Sebbene non siano i modelli di microglia e neuroni morti / apoptotici più autentici pubblicati, questi sono facili da preparare e scalabili. Il test stesso è altamente versatile, con due tipi di lettura dell'imaging dettagliati, e ha il potenziale per essere adattato per l'uso con diversi modelli di monocoltura di microglia / macrofagi o un diverso tipo di cellula per agire come carico fagocitico. La lettura di immagini ad alto contenuto è vantaggiosa per ottenere dati quantitativi e può essere scalata fino a saggiare modulatori di piccole molecole di fagocitosi o varianti genetiche di screening nei macrofagi iPSC. Tuttavia, poiché i sistemi di imaging ad alto contenuto sono costosi e pesanti per i dati, una lettura di imaging alternativa è stata inclusa nel protocollo utilizzando un microscopio time-lapse a cellule vive, che potrebbe essere sostituito da qualsiasi microscopio a fluorescenza convenzionale di buona qualità, se necessario.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano il Dr. Val Millar e il Dr. Sohaib Nizami per la loro assistenza con la microscopia ad alto contenuto e il Dr. Daniel Ebner per l'accesso ai microscopi ad alto contenuto. Inoltre, gli autori ringraziano la dottoressa Emma Mead per i consigli sullo sviluppo del test e la signora Cathy Browne per il supporto iPSC. Questo lavoro è stato supportato dall'Alzheimer's Research UK Oxford Drug Discovery Institute (ARUK ODDI, grant reference ARUK-2020DDI-OX), con ulteriore supporto alla James Martin Stem Cell Facility Oxford (S.A.C.) della Oxford Martin School LC0910-004; Monument Trust Discovery Award dal Parkinson's UK (J-1403); MRC Dementias Platform UK Stem Cell Network Capital Equipment MC_EX_MR/N50192X/1, Partnership MR/N013255/1 e Momentum MC_PC_16034 Awards.
Materiali
| Name | Company | Catalog Number | Comments |
| 15 mL conical centrifuge tube | Falcon | 352096 | For centrifugation of cells |
| 2-20 µL, 20-200 µL, 100-1000 µL single-channel micropipettes | |||
| 2-mercaptoethanol 50 mM | Gibco | 31350010 | Component of Factory media |
| 4% paraformaldehyde in PBS | Alfa Aesar | J61899 | For fixation of cells |
| 6-well plate, tissue culture treated | |||
| AggreWell-800 24-well plate | STEMCELL Technologies | 34815 | Microwell low-adherence 24-well plate for formation of embryoid bodies |
| Annexin V-FITC Apoptosis Staining / Detection Kit | Abcam | ab14085 | Kit for annexin V-FITC staining , as an assay for quality control of fixed SH-SY5Ys. Kit contains annexin binding buffer, annexin V-FITC, and propidium iodide. |
| Automated cell counter | |||
| Benchtop centrifuge | |||
| Benchtop microcentrifuge | |||
| CellCarrier-96 Ultra Microplates, tissue culture treated, black, 96-well with lid | Perkin Elmer | 6055302 | 96-well tissue culture (TC)-treated microplate with black well walls and an optically-clear bottom, for phagocytosis assay |
| CellProfiler software | Open-source software for analysis of phagocytosis images obtained by live-cell time-lapse microscope. Download for free from website (http://cellprofiler.org/), this protocol used version 2.2.0. | ||
| CellTracker Deep Red dye | Thermo Fisher | C34565 | Deep red-fluorescent, cell-permeant, succinimidyl ester-reactive dye for staining cytoplasm of iPS-macrophages. Dissolve CellTracker Deep Red dye in DMSO to 2 mM (1.4 mg/mL). Use at 1 μM, by dilution of DMSO stock with Macrophage media. |
| Class 2 laminar air flow safety cabinet | |||
| CO2 gas bottle | Accessory for EVOS FL Auto | ||
| CO2 incubator, set to 37°C and 5 % CO2 | |||
| Columbus Image Data Storage and Analysis System | Perkin Elmer | Columbus | Data storage and analysis platform for Opera Phenix. Supports all major high content screening instruments. |
| Cytochalasin D | Cayman | 11330 | Negative control treatment for phagocytosis assay. Reconstitute in DMSO to 10 mM and store aliquots at -20°C, avoid further freeze-thaw cycles. Use at final concentration 10 µM. |
| DMEM/F12 | Gibco | 11320074 | Component of SH-SY5Y media |
| DMSO | Sigma | D8418 | Solvent for CellTracker and pHrodo dyes |
| EVOS FL Auto Imaging System | Thermo Fisher | AMF4300 | Live-cell time-lapse imaging microscope |
| EVOS Light Cube CY5 | Thermo Fisher | AMEP4656 | Accessory for EVOS FL Auto |
| EVOS Light Cube DAPI | Thermo Fisher | AMEP4650 | Accessory for EVOS FL Auto |
| EVOS Light Cube RFP | Thermo Fisher | AMEP4652 | Accessory for EVOS FL Auto |
| EVOS Onstage Incubator | Thermo Fisher | AMC1000 | Accessory for EVOS FL Auto |
| Fetal Bovine Serum | Sigma | F4135 | Component of SH-SY5Y media |
| Flow cytometer | |||
| Flow cytometry analysis software | |||
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Invitrogen | A1413302 | hESC-qualified basement membrane matrix for iPSC culture |
| GlutaMAX Supplement | Gibco | 35050-038 | Component of both Factory and Macrophage media |
| HBSS | Lonza | BE 10-547F | Hank’s balanced salt solution for washing steps |
| Human recombinant BMP4 | Gibco | PHC9534 | Component of Embryoid Body media |
| Human recombinant IL-3 | Gibco | PHC0033 | Component of both Factory and Macrophage media |
| Human recombinant SCF | Miltenyi Biotech | 130-096-695 | Component of Embryoid Body media |
| Human recombinant VEGF | Gibco | PHC9394 | Component of Embryoid Body media |
| Live Cell Imaging Solution | Thermo Fisher | A14291DJ | Phenol red-free HEPES-buffered media for labelling dead SH-SY5Ys |
| Low protein binding 2 mL tubes | Eppendorf | 30108.132 | For staining SH-SY5Ys |
| M-CSF | Thermo Fisher | PHC9501 | Component of both Factory and Macrophage media |
| mTeSR1 Medium | STEMCELL Technologies | 85850 | iPSC media |
| Multichannel 20-200 uL pipette | For liquid handling of 96-well plate | ||
| NucBlue Live ReadyProbes Reagent | Thermo Fisher | R37605 | Hoechst 33342 formulation in a dropper bottle for staining nuclei of iPS-macrophages, use 0.5 drops/mL in Macrophage media. |
| Opera Phenix High-Content Screening System | Perkin Elmer | HH14000000 | High-content imaging microscope, used with Harmony software version 4.9. |
| Penicillin-Streptomycin | Gibco | 15140-122 | Component of Factory, Macrophage, and SH-SY5Y media |
| pHrodo iFL Red STP-Ester | Thermo Fisher | P36011 | pH-sensitive red fluorescent dye for labelling dead SH-SY5Ys. Reconstitute pHrodo iFL Red STP Ester powder in DMSO to a 5 mg/mL concentration. For each 1 million SH-SY5Ys, add 2.5 μL (12.5 μg) of pHrodo iFL Red STP Ester stock to pre-warmed cells suspended in Live Cell Imaging Solution. |
| Serological pipette filler | |||
| T175 flask, tissue culture treated | Vessel for differentiations of iPSC-macrophage precursors, known as "Factories" | ||
| T75 flask | Vessel for SH-SY5Y culture | ||
| Transparent plate sealers | Greiner Bio-One | 676001 | For assay plate storage and transportation |
| TrypLE Express (1X), no phenol red | Gibco | 12604013 | Cell dissociation buffer containing recombinant trypsin-like enzymes and 1.1 mM EDTA, use neat. |
| Water bath, set to 37°C | |||
| X-VIVO 15 Medium with L-glutamine, gentamicin, and phenol red | Lonza | BE04-418F | Component of Factory and Macrophage media |
| X-VIVO 15 Medium with L-glutamine; without gentamicin or phenol red | Lonza | 04-744Q | Phenol red-free macrophage media, for use in phagocytosis without additives or growth factors |
Riferimenti
- Hochreiter-Hufford, A., Ravichandran, K. S. Clearing the dead: apoptotic cell sensing, recognition, engulfment, and digestion. Cold Spring Harbour Perspectives in Biology. 5, 008748 (2013).
- Freeman, S. A., Grinstein, S. Phagocytosis: receptors, signal integration, and the cytoskeleton. Immunological Reviews. 2262, 193-215 (2014).
- Hickman, S., Izzy, S., Sen, P., Morsett, L., El Khoury, J. Microglia in neurodegeneration. Nature Neuroscience. 21 (10), 1359-1369 (2018).
- Galloway, D. A., Phillips, A. E. M., Owen, D. R. J., Moore, C. S. Phagocytosis in the brain: Homeostasis and disease. Frontiers in Immunology. 10, 790 (2019).
- Nizami, S., Hall-Roberts, H., Warrier, S., Cowley, S. A., Di Daniel, E. Microglial inflammation and phagocytosis in Alzheimer's disease: potential therapeutic targets. British Journal of Pharmacology. 176 (18), 3515-3532 (2019).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), 712-716 (2016).
- Neher, J. J., et al. Inhibition of microglial phagocytosis is sufficient to prevent inflammatory neuronal death. The Journal of Immunology. 186 (8), 4973-4983 (2011).
- Brown, G. C., Neher, J. J. Microglial phagocytosis of live neurons. Nature Reviews Neuroscience. 15 (4), 209-216 (2014).
- Scott-Hewitt, N., et al. Local externalization of phosphatidylserine mediates developmental synaptic pruning by microglia. The EMBO Journal. 39 (16), 105380 (2020).
- Li, T., et al. A splicing isoform of GPR56 mediates microglial synaptic refinement via phosphatidylserine binding. The EMBO Journal. 39 (16), 104136 (2020).
- Sapar, M. L., et al. Phosphatidylserine externalization results from and causes neurite degeneration in Drosophila. Cell Reports. 24 (9), 2273-2286 (2018).
- Skjesol, A., et al. The TLR4 adaptor TRAM controls the phagocytosis of Gram-negative bacteria by interacting with the Rab11-family interacting protein 2. PLOS Pathogens. 15 (3), 1007684 (2019).
- Wong, K., Li, X., Ma, Y. Paraformaldehyde induces elevation of intracellular calcium and phosphatidylserine externalization in platelets. Thrombosis Research. 117 (5), 537-542 (2006).
- van Wilgenburg, B., Browne, C., Vowles, J., Cowley, S. A. Efficient, long term production of monocyte-derived macrophages from human pluripotent stem cells under partly-defined and fully-defined conditions. PLoS One. 8 (8), (2013).
- Haenseler, W., et al. A highly efficient human pluripotent stem cell microglia model displays a neuronal-co-culture-specific expression profile and inflammatory response. Stem Cell Reports. 8 (6), 1727-1742 (2017).
- Buchrieser, J., James, W., Moore, M. D. Human induced pluripotent stem cell-derived macrophages share ontogeny with MYB-independent tissue-resident macrophages. Stem Cell Reports. 8 (2), 334-345 (2017).
- Hall-Roberts, H., et al. TREM2 Alzheimer's variant R47H causes similar transcriptional dysregulation to knockout, yet only subtle functional phenotypes in human iPSC-derived macrophages. Alzheimer's Research & Therapy. 12, 151 (2020).
- Friedman, B. A., et al. Diverse brain myeloid expression profiles reveal distinct microglial activation states and aspects of Alzheimer's disease not evident in mouse models. Cell Reports. 22 (3), 832-847 (2018).
- Aziz, M., Yang, W. L., Wang, P. Measurement of phagocytic engulfment of apoptotic cells by macrophages using pHrodo succinimidyl ester. Current Protocols in Immunology. 100, 1-8 (2013).
- Atmaramani, R., Pancrazio, J. J., Black, B. J. Adaptation of robust Z' factor for assay quality assessment in microelectrode array based screening using adult dorsal root ganglion neurons. Journal of Neuroscience Methods. 339, 108699 (2020).
- Fernandes, H. J. R., et al. ER Stress and Autophagic Perturbations Lead to Elevated Extracellular α-Synuclein in GBA-N370S Parkinson's iPSC-Derived Dopamine Neurons. Stem Cell Reports. 6 (3), 342-356 (2016).
- Takahashi, K., Rochford, C. D. P., Neumann, H. Clearance of apoptotic neurons without inflammation by microglial triggering receptor expressed on myeloid cells-2. Journal of Experimental Medicine. 201 (4), 647-657 (2005).
- Kober, D. L., Brett, T. J. TREM2-ligand interactions in health and disease. Journal of Molecular Biology. 429 (11), 1607-1629 (2017).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), 712-716 (2016).
- Witting, A., Müller, P., Herrmann, A., Kettenmann, H., Nolte, C. Phagocytic clearance of apoptotic neurons by microglia/brain macrophages in vitro: Involvement of lectin-, integrin-, and phosphatidylserine-mediated recognition. Journal of Neurochemistry. 75 (3), 1060-1070 (2000).
- Hsieh, C. L., et al. A role for TREM2 ligands in the phagocytosis of apoptotic neuronal cells by microglia. Journal of Neurochemistry. 109 (4), 1144-1156 (2009).
- Beccari, S., Diaz-Aparicio, I., Sierra, A. Quantifying microglial phagocytosis of apoptotic cells in the brain in health and disease. Current Protocols in Immunology. 122 (1), 49 (2018).
- Diaz-Aparicio, I., et al. Microglia actively remodel adult hippocampal neurogenesis through the phagocytosis secretome. Journal of Neuroscience. 40 (7), 1453-1482 (2020).
- Shirotani, K., et al. Aminophospholipids are signal-transducing TREM2 ligands on apoptotic cells. Scientific Reports. 9 (1), 1-9 (2019).
- Garcia-Reitboeck, P., et al. Human induced pluripotent stem cell-derived microglia-like cells harboring TREM2 missense mutations show specific deficits in phagocytosis. Cell Reports. 24 (9), 2300-2311 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon