Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Biyomedikal ve Biyomühendislik Araştırmaları için Ahtapot Ekosistemi Kurulması
Bu Makalede
Özet
Ahtapotların benzersiz fizyolojik ve anatomik yapılarını anlamak biyomedikal araştırmaları büyük ölçüde etkileyebilir. Bu kılavuz, bu türe uyum sağlamak için bir deniz ortamının nasıl kurulup sürdürüleceğizlerini gösterir ve ahtapotun sinir sistemi anatomisini ve işlevini görselleştirmek için son teknoloji görüntüleme ve analitik yaklaşımları içerir.
Özet
Biyomedikal araştırmalardaki birçok gelişme, farklı türlerdeki belirli işlevleri destekleyen anatomik ve hücresel mekanizmaların keşfedilmelerinden ilham alınmıştır. Ahtapot, bilim insanlarına nörobilim, robotik, rejeneratif tıp ve protez alanları hakkında yeni bilgiler veren bu olağanüstü hayvanlardan biridir. Bu sefalopod türüyle yapılan araştırmalar, projenin başarısı için kritik öneme sahip ahtapot ve ekosistemi için karmaşık tesislerin ve yoğun bakımın kurulumunu gerektirir. Bu sistem, hayvan için güvenli ve temiz bir ortam sağlamak için birden fazla mekanik ve biyolojik filtreleme sistemi gerektirir. Kontrol sistemi ile birlikte, tesisin uzun vadede etkin bir şekilde çalışması için özel rutin bakım ve temizlik gereklidir. Tankın manzarasını değiştirerek, çeşitli avları birleştirerek ve üzerinde çalışmaları için zorlu görevler sunarak bu akıllı hayvanlara zenginleştirilmiş bir ortam sağlamaları önerilir. Sonuçlarımız arasında MRG ve tüm vücut otoflüoresans görüntülemenin yanı sıra sinir sistemini daha iyi anlamak için davranışsal çalışmalar bulunmaktadır. Ahtapotlar, biyomedikal araştırmaların birçok alanını etkileyebilecek benzersiz fizyolojiye sahiptir. Onlara sürdürülebilir bir ekosistem sağlamak, farklı yeteneklerini ortaya çıkarmanın ilk önemli adımıdır.
Giriş
Biyomedikal araştırma ve biyomedikal mühendisliğindeki yeni kavramlar genellikle biyolojik türlerin çevresel ve fizyolojik koşulları ve zorlukları ele almak için sahip oldukları belirli stratejileri belirlemekle ilham almaktadır. Örneğin, ateşböceklerindeki floresan özelliklerini anlamak, diğer model organizmalarda hücresel aktiviteyi rapor edebilecek yeni floresan sensörlerin geliştirilmesine yol açmıştır1; alglerde ışıkla aktive edilen iyon kanallarının tanımlanması hücresel ve zamansal spesifik ışık bazlı-nöromodülasyonun gelişmesine yol açmıştır2,3,4,5; Dünya'nın manyetik alanına göre gezinen cam yayın balığındaki proteinlerin keşfedilmesi manyetik tabanlı nöromodülasyonun gelişmesine yol açmıştır6,7,8,9,10,11; Aplysia'daki sifon refleksini anlamak, davranışın hücresel temelini anlamada etkili olmuştur12,13,14.
Araştırmacılar, geleneksel olmayan laboratuvar türlerinin sahip olduğu fizyolojik işlevler üzerindeki benzersiz güçlü yönlerden ve yeni bakış açılarından yararlanarak mevcut biyomühendislik ve filogenetik araç kutusunu genişletmeye devam ediyor. Federal kurumlar, çeşitli türler üzerinde gerçekleştirilen yeni çalışmaları finanse ederek bu çalışma çizgilerini desteklemeye başlıyorlar.
Eşsiz anatomi ve yenilenme yeteneklerine sahip bir hayvan cinsinin yanı sıra her bir kolunun adaptif kontrolü, büyüleyici biyologlar ve mühendisler ve toplumun her kesiminden büyüleyici kitleler Ahtapot17'dir. Nitekim, ahtapotun fizyolojisi ve davranışının birçok yönü son on yıllarda incelenmiştir15,16,17,18,19,20,21,22,23,24,25,26 . Bununla birlikte, moleküler ve evrimsel biyoloji, robotik, hareket kaydı, görüntüleme, makine öğrenimi ve elektrofizyolojideki son gelişmeler ahtapot fizyolojisi ve davranışı ile ilgili keşifleri hızlandırır ve bunları yenilikçi biyomühendislik stratejilerine çevirir27,28,29,30,31,32,33,34,35 ,36,37,38,39.
Burada, farklı geçmişlerden, bilimsel ilgi alanlarından ve hedeflerden bilim adamları ve mühendisler için ilgi ve alaka düzeyi olacak ahtapot hayvancılığının nasıl kurulacağını ve sürdürüleceğini açıklıyoruz. Bununla birlikte, sonuçlarımız ahtapotların nörobilim ve nöromühendislik araştırmalarında uygulanmasına odaklanmaktadır. Ahtapot, merkezi beyinde 45 milyon nöron, optik loblarda 180 milyon nöron ve sekiz eksenel kordon ve periferik gangliyonda ek 350 milyon nöron ile oldukça gelişmiş bir sinir sistemine sahiptir; karşılaştırıldığında, bir köpek benzer sayıda nörona ve bir kediye sadece yarısına sahiptir40. Omurgalı sinir sisteminin aksine, ahtapotun beynindeki milyonlarca nöronun kolunun eksenel kordonlarındaki milyonlarca nörona bağlayan sadece 32K efferent ve 140K afferent lifleri vardır40,41,42. Bu nispeten az sayıda birbirine bağlı lif, ahtapotların sahip olduğu benzersiz dağıtılmış nöronal kontrolü vurgulayarak, motor programlarının yürütülmesine ilişkin ayrıntıların çoğunun eksenel kordonun kendisinde gerçekleştirildiğini göstermektedir. Ahtapotun kolları, kabın içinde olsalar bile kavanoz kapaklarını açma gibi manipülasyon becerilerini sağlayan olağanüstü ince motor kontrolüne sahiptir. Bu son derece gelişmiş prehensile motor yeteneği Cephalopods sınıfına özgüdür (ahtapot, mürekkep balığı ve kalamar)43.
Gerçekten de, yüz milyonlarca yıllık evrim boyunca ahtapot, bilimsel ve mühendislik alanlarında yeni gelişim ve ilerlemeye ilham veren olağanüstü ve sofistike bir genom ve fizyolojik sistem43.44 geliştirmiştir. Örneğin, ahtapotun emicilerinin anatomik yapısına dayanan suya dayanıklı bir yapışkan yama ıslak ve kuru yüzeylere yapışabilir45; ahtapotun kamuflaj derisinden esinlenen sentetik bir kamuflaj malzemesi, düz, 2D bir yüzeyi tümsekler ve çukurlarla üç boyutlu bir yüzeye dönüştürebilir46. Gelecekte vücudun içinde cerrahi aletler olarak hizmet verebilecek minyatür yumuşak ve otonom robotlar (yani Octobots); ve tank benzeri bir robot48'e bağlı bir kol (yani OctoArm) da geliştirilmiştir. Biyomedikal araştırmalarda ahtapotların birçok türü kullanılır, örneğin Ahtapot vulgaris, Ahtapot sinensis, Ahtapot variabilis ve Ahtapot bimaküloidleri (O. bimaküloidler); O. vulgaris ve O. bimaculoides en yaygın 34,49,50'dir. Farklı ahtapot genomlarının son dizilimi bu cinsi özel olarak ilgi çekici kılmaktadır ve ahtapot araştırmalarında yeni sınırlar açmaktadır34,43,51,52.
Kurulumumuzda kullanılan bimaküloidler, ilk olarak 1949'da keşfedilen ve Orta Kaliforniya'dan Baja California yarımadasının güneyine kadar Kuzeydoğu Pasifik kıyılarındaki sığ sularda bulunabilen orta büyüklükte bir ahtapot türüdür17. Gözlerinin altındaki mantındaki sahte göz lekeleri tarafından tanınabilir. Dev Pasifik Ahtapotu (Enteroctopus dofleini) ve Common Octopus (O. vulgaris) ile karşılaştırıldığında, Kaliforniya İki Noktalı Ahtapot (O. bimaküloidler) nispeten küçüktür, birkaç santimetreden daha küçük başlar ve bir çocuk olarak hızlı büyür. Bir laboratuvarda yükseltildiğinde, yetişkin mantle boyutu ortalama 100 cm'ye kadar büyüyebilir ve 800 g53,54 ağırlığa kadar çıkabilir. Ahtapotlar ilk 200 gün içinde hızlı bir büyüme dönemine sahiptir; O zamana kadar yetişkin olarak kabul edilirler ve hayatlarının geri kalanında büyümeye devam ederler55,56,57. Ahtapotlar yamyam olabilir, özellikle her iki cinsiyet de bir tank içinde bir araya geldiğinde; bu nedenle, ayrı tanklarda ayrı ayrı barındırılmaları gerekir58.
Protokol
Tüm hayvan çalışmaları Michigan Eyalet Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından onaylandı.
1. Ahtapot tank ekipmanı kurulumu
- İlk olarak, Malzeme Tablosunda gösterildiği gibi, deniz çevre sistemine dahil edilecek bir akvaryum için biyolojik olmayan tüm malzemeleri elde edin. Boyutlar inç olarak sağlanır.
- Kurulumdan önce tüm boru, boru ve filtre sistemi parçalarını %70 etanol ve deiyonize (DI) su ile yıkayın. Temizlik yaparken sabun veya başka kimyasallar kullanmayın.
- Karbon fiberden yapılmış dört masa ayağı ve 2 inç x 2 inç x 23 inç (Bölüm #72) boyutlarına sahip bir fiberglas masa 13 inç x 49 inç x 1/2 inç (Bölüm #71) yerleştirin. Bacakları doğrudan masanın köşelerinin altına takın.
- Üst yüzeyin altında, masa ayaklarının her birinin arasına, masanın alt kısmına ve doğrudan üst rafın kenarına bağlı 2 inç x 2 inç uzunluğunda (Bölüm #72) karbon fiber stabilizasyon ayraçları yerleştirin. Vidalarla aynı boyutlara sahip başka bir rafı doğrudan masanın altındaki zemine takın. Tank üst yüzeye otururken pompanın (bkz. Malzeme Masası) doğrudan alt raf yüzeyine oturmasına izin verin. Bu sistem Şekil 1'de gösterilmiştir.
NOT: Tanktan su çıkışı yerçekimi ile beslenir ve maksimum drenaj kafası basıncını sağlamak için tanka girip çıkanlar hariç tüm boruların tankın altından daha düşük olması gerekir.

Şekil 1: Ahtapot tankı kurulumu. Su girişi ve çıkışı (a). Her biri 1,22 m x 0,3 m (b) alana sahip üç ahtapot tankı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Cam kesme matkap uçları kullanarak tankın yanlarından birinden 2 inç uzaklıkta tek bir 13/4 inç delik açın. Su çıkış emme ekranının altı, Şekil 2a'nın sağ tarafında gösterildiği gibi çıkış deliğinin yüksekliğini belirleyecektir. Su seviyesi emme ekranı tarafından belirlenecek ve su sıçrama bölgesine izin verecek şekilde tankın üstünden en az 6 inç olması gerekecektir.
- Bölümleri kalıcı olarak bağlamak için bir PVC astar ve çimento kullanın. Bunu yapmak için, önce, amaçlanan erkek PVC borunun ucunun ucunun dişi borunun ucuna kaydırın. Astarın ve çimentonun borunun dışında gösterilmesini önlemek için hala görülebilen erkek kısmının dışına bir parça ressam bandı yerleştirin. Bantlamadan sonra parçaları ayırın ve çimentonun aynı alana uygulanmasını takiben erkek borusunun dışına hafif bir astar kat yerleştirin.
- Erkek borusunu, çimento uygulamasından sonra mümkün olan en kısa sürede dişi boruya yeniden haline koyun ve bandı çıkarın. Astar ve çimentonun uygulanmasından 24 saat sonra, yeni bağlanan parçaları DI suyu ile yıkayın. Kürleme süresi için daha fazla yol tarifi için çimento ürününe bakın.
NOT: PVC astar ve çimento kullanmadan önce tüm boru ve ekipmanların kurulumunun düzgün bir şekilde yerleştirildiğından emin olun; boru uzunluğu gereksinimleri değişebilir. - Ardından, emme ekranının 1 inç dış çap (OD) ucunun dirsek ekleminin 1 inç iç çap (ID) ucuna kalıcı olarak bağlayın. Dirsek ekleminin ucunu düz PVC boruya (1 inç OD) bağlayın. Düz borunun diğer tarafını daha sonra duvar boyunca düz adaptör dişi soket bağlantısının 1 inç kimliğine bağlayın.
NOT: Kimlik, borunun iç duvarları arasındaki en geniş mesafeyi ifade eder. OD, boru genişliğinin dışını ifade eder. - Duvar içi düz adaptörü 1 inç OD ile düz 4 inç uzunluğundaki PVC boruya kalıcı olarak bağlayın (adım 1.8'den itibaren). Bu boru tankın dışına bakacak.
- Düz boruyu PVC konektörün ortasına kalıcı olarak bağlayın (1 inç ID Tee şeklinde; adım 1.9'dan itibaren). Ardından, iki adet 6 inç uzunluğunda (Bölüm #69) boruyu (1 inç OD) tee konektörünün her iki ucuna da kalıcı olarak bağlayın-biri doğrudan hava salınımı için yukarı bakacak ve diğeri su akışı için doğrudan aşağı bakacak şekilde.
- Aşağı doğru uzatılmış düz boruyu (adım 1.10'dan) dişi soket dikenli boruya (1 inç ID) düz adaptöre kalıcı olarak bağlayın. Dikenli boru adaptörüne 36 inç uzunluğunda kauçuk bir tüp (3/4 inç kimlik) takın.
- Soğutma sistemini su çıkış borusu ile kartpan sistemi arasına yerleştirin.
- Sistemle birlikte gelen 3/4 inç diken bağlantı parçalarını soğutucu ünitesinin giriş ve çıkış bağlantı noktalarına takın. Lastik boruyu (adım 1.11'den itibaren) soğutucunun giriş bağlantısına koyun.
- Şekil 2b'de gösterildiği gibi, soğutucu çıkışından (adım 1.12'den) 3/4 inç kimlik tüpünün yeni bir parçasını (adım 1.13'ten) karter sisteminin girişine bağlayın.
- Ardından, 200 μm gözenek boyutuna sahip 4 inç x 12 inç çorap filtresini Şekil 2'de gösterildiği gibi belirlenen alana yerleştirin. Ayrıca, Şekil 2'de gösterildiği gibi, protein sıyırıcıyı ve geri dönüş pompasını uygun alanlarına yerleştirin. Dönüş pompası ile birlikte, otomatik üst şamandıra vanasını pompa alanının iç duvarına, pompanın su giriş kısmının 2 inç üstüne takın; gerekirse pompanın tanktan çıkarılmasını engellemeyin.
- 12 inç uzunluğunda düz bir tüpü (3/4 inç OD) pompanın çıkışına (adım 1,15'ten itibaren) kalıcı olarak bağlayın. 3/4 inç OD düz tüpün diğer ucunda, tüpün OD'sini 3/4 inç ID 45 ° dirsek eklemine kalıcı olarak bağlayın. Eklemin diğer ucuna, 3/4 inçlik bir OD boruyu kalıcı olarak bağlayın.
- Düz tüpün diğer ucunun (adım 1,16'dan) düz bir azaltıcı adaptörün 3/4 inç kimliğine takın. Daha büyük adaptör ucunun (2 inç OD) UV ışığının girişine kalıcı olarak bağlanın.
NOT: Düz boru uzunlukları değişebilir. - Ardından, UV ışık girişi yerleşimini pompanın çıkış borusuyla (adım 1.17'den itibaren) eşleştirin, böylece boru ışık ve pompa arasında bükülmez (adım 1.15'ten itibaren). UV ışık ataşman deliklerine uyacak şekilde stabilizasyon ayraçlarına delikler açın. Vidaların boyutunu matkap ucuyla eşleştirin ve verilen vidaları kullanarak UV ışığını masaya takın.
- Başka bir azaltıcı adaptörün 2 inç tarafını UV ışığının çıkışına kalıcı olarak bağlayın (adım 1.18'den itibaren). Adaptörün 1 inç kimliğine 5 inç uzunluğunda düz bir tüpün 1 inçlik bir OD'sini takın. Ardından, 1 inç kimliği olan 90° köşe parçasını 1 inç OD tüpüne bağlayın; köşe parçasının eklenmemiş ucunun, su girişinin amaçlandığı tankın yanına doğru işaret etmesi (adım 1,5 ile aynı taraf).
- Köşenin diğer ucunun (adım 1.19'dan) akış kontrol ünitesinin girişiyle 1 inç OD'ye sahip 6 inç uzunluğunda bir tüpe (Bölüm #69) kalıcı olarak bağlayın (Bölüm #2). Akış izleme ünitesinin çıkışına başka bir 1 inç OD tüpünü (Bölüm #69) kalıcı olarak bağlayın; uzunluk tankın yan tarafının en az 3 inç ötesine uzanmalıdır.
- 13/4 inç cam kesme matkap ucu (Bölüm #1) kullanarak, hedeflenen su hattının 3 inç üzerinde ve su çıkış deliğine sahip olanın karşısındaki tarafta tankın yanından (Şekil 1a) 2 inç uzakta yeni bir delik açın. Tankın dışına bakan 1 inç kayma (Bölüm #77) ile başka bir duvar içi bölme bağlantısı takın.
- Bölme kaymasına, 1 inç OD ve 4 inç uzunluğunda (Bölüm #69) düz bir tüpü kalıcı olarak bağlayın. Bu borunun tanktan uzattığı mesafeye uyacak şekilde 1.21 adımının son bölümünden boruyu kesin. Açık boruların her birine kalıcı olarak 90° tüp (Bölüm #65) bağlayın ve her iki köşe parçasını da kalıcı olarak bağlayan son bir 1 inç OD düz boruyu (Bölüm #69) kesin.
NOT: Şekil 3 akvaryum sisteminin basit bir temsilini göstermektedir. - Kontrol sisteminin geri kalanını (Bölüm #34) kurun, önce güç şeridini (Bölüm #53) tablonun kendisine veya yakındaki bir duvara monte edin. Yanına sıvı izleme modülini takın (Bölüm #2).
- Akış sensörlerini, güç şeridini ve sızıntı algılama sensörlerini modüle bağlayın. Alg kutusuna bağlı büyüme ışığını (bölüm #26) ayarlayın (Şekil 2).
- Akış sensörunu, UV ışığını, büyüme ışığını, pompayı ve protein sıyırıcıyı enerji çubuğuna takın. Su kontrol sistemi programlamasını üretici kılavuzuna göre ayarlayın.
- Piyasada bulunan yarım bardak tuzu 1 galon ters ozmos (RO) veya deiyonize (DI) su ile karıştırarak tuzlu su hazırlayın. Bir tankı ve karter sistemini tamamen doldurmak için 45 galon yapın.
- Karter sistemi akış kontrol ünitesindeki pompayı açın ve otomatik üstten kapatma vanası kapalı konuma gelene kadar tuzlu su eklemeye devam edin, böylece ek tatlı su gerekmez.
- Su dolduktan sonra, doldurmayı durdurun ve tercih edilir sıcaklık aralığı olduğu için sıcaklığı 18 °C ila 22 °C arasında ayarlamak için su soğutma ünitesini açın53. Protein sıyırıcıyı aç.
- Tankın dibine 30 kg ezilmiş mercan ve alg kutusunun dibine ezilmiş mercan tabakası ekleyin. Ahtapot ortamına birden fazla canlı kaya ve diğer eklemeleri ekleyin. Tankın açıklığı için bir üst yerleştirin.
NOT: Canlı kayalar, bakteri ve algler gibi makroskopik deniz yaşamının yaşadığı ölü mercanlardır. - Tuzlu su akvaryumlarında kullanılan nitrifying bakterilerini ambalaja yönlendirildiği gibi ekleyin. Su test kitleri, pH sensörü ve sıcaklık sensörü ile her gün sıcaklık, tuzluluk, pH, amonyak, nitrit ve nitrat kontrol ederek bunu yönlendirilmiş olarak eklemeye devam edin. Amonyak, nitrit ve nitrat seviyeleri için güvenli değerler sırasıyla 0,5 ppm, 0,25 ppm ve 10 ppm'in altındadır58.
- Tuzlu su mikroorganizmalarının büyümesine izin vermek için nitrifying bakterilerinin ekildiği günler için UV ışığının kapalı olduğundan emin olun. Parametreler güvenli aralıklarda olduktan sonra UV ışığı yeniden etkinleştirilebilir.
- Sistem kurulduktan sonra, pH ve oksijenasyonun sırasıyla 8.0-8.4 ve
 59'da olup olmadığını da kontrol edin. Akvaryuma herhangi bir hayvan eklemeden önce, bir bakır su test kiti kullanarak sistem içinde herhangi bir bakır ve oksijen seviyesinin olup olmadığını kontrol edin.
59'da olup olmadığını da kontrol edin. Akvaryuma herhangi bir hayvan eklemeden önce, bir bakır su test kiti kullanarak sistem içinde herhangi bir bakır ve oksijen seviyesinin olup olmadığını kontrol edin.
NOT: Bakır omurgasızlara zarar verir ve balık solungaçlarındaki osmoregülasyona müdahale eder60,61. - Suda bakır bulunursa, DI/RO su kaynağını test edin. Su kaynağının bakır içermediğini belirledikten sonra% 30 su değişimi gerçekleştirin ve aktif karbon bloğunu (Bölüm #46) suya yerleştirin. Sorun devam ederse, tam bir su değişimi gerçekleştirin ve tüm parçaları temizleyin.
- Tüm su parametrelerinin güvenli seviyelerde olduğu belirlendikten sonra, ahtapotları eklemeden en az bir hafta önce sisteme 10 hayalet karides ekleyin. Bu, bakteriler için biyokütlenin tanıtılmasına ve genel su kalitesinin belirtmesine yardımcı olacaktır.
- Alg kutusuna ek akvaryum ekosistemi sakinleri ekleyin. Buna Chaetomorpha spp. (spagetti algleri), Trochus Sp. dahildir. (bantlı trochus salyangozu) ve Mercenaria mercenaria (kiraztaşı istiridye).

Şekil 2: Kartem sistemi. Kartem sisteminin yan görünümü (a). Kartem sisteminin üst görünümü (b). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
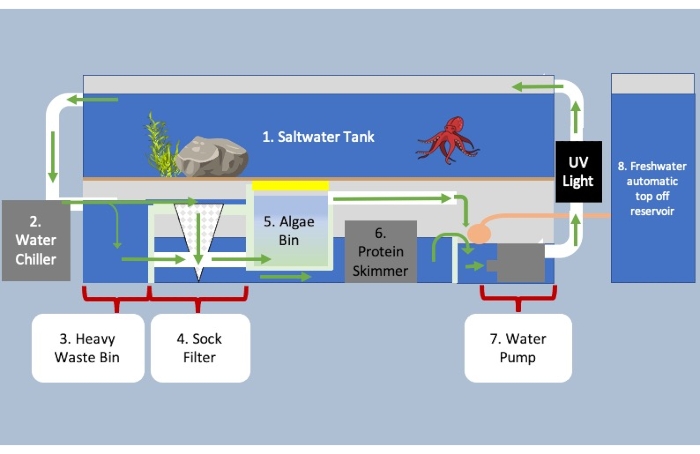
Şekil 3: Tankın ve çevre kontrol ünitelerin altında kartperte filtreleme sistemine sahip akvaryum. Yeşil oklar sistemden geçen su akışının yönünü gösterir. Soğutma için birinci bölümden ikiye ve ağır biyolojik maddeyi daha hafif maddeden ayırmak için üçe akan su. Ağır atıklar alta ve bölüm beşe doğru yüzerken, daha küçük biyolojik madde bölüm 4 içindeki çorap filtresine akar. Su, beş numaralı bölümün altındaki dört bölümden akarak, su içindeki kalan atıkları gidermek için protein sıyırıcısına altıda girer. Alg kutusu, atıkları, amonyağı ve nitratları parçalamak ve suyu oksijene bağlamak için mikroorganizmalar içerir. Sistemin son bölümünde, tanka geri pompalanmadan önce buharlaşmayı hesaba katmak için daha fazla su eklenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Depolama tankları
- Biri tuzlu su, diğeri RO suyu için olmak üzere iki uzun boylu 60 galonluk su depolama tankı kurun. Tatlı su deposunun maksimum dolum hattının masadan daha uzun olduğundan emin olun. Karter sistemindeki şamandıra vanasının otomatik tepesine 1/4 inçlik bir boru takın ve borunun diğer ucunu tatlı su tankının dibine takın.
NOT: Bu, su buharlaşırsa yeniden doldurmaktır. Tuz suda kalacak. - Tuzlu su deposunu suyla doldurun ve tanka orantılı miktarda tuz ekleyin. Karıştırma ve uygun oksijenlenme için tuzlu su depolama tankını sürekli havalandırın. Tuzun tam olarak karıştırılmasını sağlamak için kullanmadan önce bir saat bekleyin.
NOT: Tuzlu su deposu, temizledikten sonra tankları doldurmak için kullanışlıdır.
3. Gıda tankı kurulumu
- Karidesi bir haftadan uzun süre canlı tutmak için, tuzluluk 30 ppt'nin altında ve sıcaklık 25 ° C'ye yakın olan ahtapottan ayrı bir tankta saklayın.
- Bunu yapmak için, ahtapot tankları olgunlaştıktan bir hafta sonra, 8 galon olgunlaşmış tuzlu suyu karides tankına aktarın. Tankın dibine 15 kg ezilmiş mercan ekleyin. Kalıplama için lekeleri gizlemek için tanka birkaç canlı kaya ekleyin (Şekil 4).
NOT: Olgunlaşmış deniz suyu, 1.30. - Tankın kenarına bir kutu filtresi takın. Kutu filtresini üretici tarafından yönlendirildiği şekilde ayarlayın. Tankın yanına, tanka takılı bir hava taşı ile bir tüpe bağlı bir hava pompası ekleyin.
- Filtreyi temizleyin ve filtre pedlerini her hafta değiştirin. Ayrıca, suyun% 25'inin aynı anda değiştirilmesi gerekecektir. 1.30. adımda açıklandığı gibi su test kitleri ile gıda tanklarında günlük azot, pH ve sıcaklık parametrelerini kontrol edin. Su azot parametreleri yüksek kalırsa, ek su değişiklikleri gerçekleştirin ve suya bir azot emici torba ekleyin; veya sorunlar bir aydan uzun sürerse, karidesin daha büyük bir tanka taşınması gerekir.
- Ezilmiş mercan tortusuz dağılır dağılır dağılmaz karides ekleyin. Önce karides eklemek için, varışta, biyowaste kaldırmak için küçük tuzlu su tankına su sevk etmeden karidesi 5 dakika hareket ettirın. Daha sonra karides doğrudan tanka eklenebilir. Varışta sivrisinek balıkları doğrudan karides tankına eklenebilir.
NOT: Karides ve Sivrisinek balıkları, malzeme sayfasında listelenen herhangi bir canlı hayvan ticari tedarikçisinden veya diğer gıda tedarikçilerinden satın alınabilir. Ahtapotların buzları çözülmüş karides sunmak da mümkündür. - Karides ve balıkları, yiyecek talimatlarına belirtildiği gibi balık gevreği, ölü bitki örtüsü veya alg62 ile besleyin.
- Yengeç tankı için 1 galon tuzlu su ve 10 kg çakıl taşı ekleyin. Çakıl taşlarını bir tarafa yığın ve bir tarafta kuru arazi, diğer tarafta 2 cm tuzlu su bırakın (Şekil 4'te belirtildiği gibi). Bu omurgasızlar için en uygun çevresel su parametreleri sırasıyla 30-35 ppt ve tuzluluk ve sıcaklık için 22-25 °C olmalıdır11,63.
- Keman yengeçlerini doğrudan tanka ekleyin (Şekil 4). Yengeçler hayatlarının çoğunu karada geçirecekler, ancak bir seferde birkaç gün su altında kalabilecekler, bu da kısmen su altında kalan tankı uzun süreli hayatta kalmaları için çok önemli hale getirecek.
- Tankın kuru alanında yemeğe balık gevreği ekleyerek günde bir kez keman yengeçlerini besleyin. Yengeçleri çıkararak ve tuzlu suyun% 100'ünü değiştirerek haftalık olarak temizleyin. Çakıl taşlarını temizleyin.
- Ahtapotların kendilerini açması ve başka bir su filtreleme mekanizması sağlaması için tuzlu su tanklarında deniz bivalve yumuşakçalarını (midye ve midye) saklayın64.
- Ahtapot tankının filtreleme sistemine gereksiz bir atık yükü bindirmemek için midyeleri ilk hafta ayrı bir boş tankın içine yerleştirin.
NOT: Midyeler ahtapotun tercih ettikleri yiyecek olsa da, varıştan kısa bir süre sonra ölme olasılıkları daha yüksektir ve büyük miktarlarda bulunurlarsa tank içindeki biyolojik atıkları önemli ölçüde artıracaktır.
4. Ahtapotun tanka girişi
- Amonyak, nitrit ve nitrat seviyelerinin sırasıyla 0,5 ppm, 0,25 ppm ve 10 ppm'in altında olduğundan emin olun. Ahtapot yakmasını tanktan çıkarmak için su el pompası hazır bulun. Bu işlem için iki kişinin olması da önerilir.
- Varışta, torbayı tartıya yerleştirin ve ahtapot çıkarıldıktan sonra torbanın ağırlığını çıkarın. Hayvanı tanklarına aktarırken su oksijenlenmesini artırmak için torbaya bir hava taşı ekleyin. Nakliye suyunun sıcaklığını ve tuzluluğunu ölçün. Sevkiyat sonrası uzun süreli hastalık vakalarını kaydedin.
- Torbadan tanka herhangi bir su aktarmadan, taşıma torbasının sıcaklığını değiştirmeye başlamak için taşıma torbasını tankın ucuna kısmen su altında kalan torba ile asın. Suyun % 10'unu torbadan çıkarın ve lavaboya dökin. Depodan torbaya aynı miktarda su ekleyin. Torbadaki su sıcaklığı tanktaki su sıcaklığından en fazla 1° farklı olana kadar her 10 dakikada bir tekrarlayın.
- Torbanın ve tankın sıcaklık farkı 1° içinde olduğunda, ahtapotları kendi tanklarına taşımak için eldiven takıldığından emin olun. Hareket etmek için, transfer sırasında destek sağlamak için her iki ellerinizi ahtapotun altına yerleştirin; ikinci kişinin emişli kolları çantanın yanından hafifçe çekmesi gerekecektir.
- Ahtapot torbadan çıktıktan sonra, nakliye çantasından mümkün olduğunca az su aktararak yeni yaşam alanının suyuna hızla taşıyın. Ahtapotun tanktayken serbest bıraktıklarından herhangi bir mürekkep çıkarmak için el pompasını kullanın. Şimdi hayvanın yaklaşık ağırlığını elde etmek için torbayı suyla tartın.
- Varıştan sonraki ilk 2 hafta boyunca ahtapotun ağırlıklarının yaklaşık% 4 ila% 8'i olması gereken günlük tüketimini izleyin58,65,66. Ahtapot günde dört kez kontrol edilmelidir; bu, 2 hafta sonra günde iki kez azaltılabilir. Gıda tüketimini gerektiği gibi ayarlamak için her iki haftada bir tartın.
NOT: Bazı ahtapot türlerinin tanklarından kaçtıkları bilinmektedir, bu nedenle tanklarının kapağına 2,5 kg ağırlık yerleştirmeniz önerilir.
5. Günlük bakım
- pH, amonyak, nitrit ve nitrat için piyasada bulunan tuzlu su test kitini kullanarak, kit ile birlikte verilen dört test tüpüne kit yönlendirilmiş miktarda tank suyu ekleyin. Test kitinde belirtildiği gibi, ilgili tüpe kolorimetrik reaktan miktarını ekleyin.
- Amonyak, nitrit ve nitrat seviyeleri sırasıyla 0,5 ppm, 0,25 ppm ve 10 ppm'in üzerindeyse, biyokütleyi çorap filtresinden yıkayın veya yeni bir çorap filtresine değiştirin. Ayrıca, bir fırça ile sıyırıcının tepesinden biyokütleyi temizleyin ve tanka ek denitrifying bakterileri ekleyin. Sorunlar devam ederse, tatlı tuzlu suyun% 25'ini değiştirin.
NOT: Yukarıdaki adımlar ekosistem içindeki azot bileşiklerini azaltır. - Tüm ölü yengeç ve karides karkaslarını ve el pompası kullanarak ahtapot dışkı maddelerini tanktan çıkarın. Kalan tüm canlı yengeçleri tanktan çıkarın ve depolama tankına geri taşıyın. Ardından, tank içindeki büyük nesneleri yeniden düzenleyin.
- Ahtapotun günlük yiyeceği yengeç sayısının yarısını 1,25 +/- 0,25 g ağırlığındaki tanka tanıtın. Buzları çözülmüş karidesleri veya küçük erkek keman yengeçlerini yavru ahtapotlara besleyin. Deneye bağlı olarak, yengeçler ve karidesler tankın herhangi bir yerinde veya doğrudan ahtapota tanıtılabilir.
NOT: Ahtapotların günlük gıda tüketimi ağırlıklarının %4-%8'idir67. Dondurulmuş karides, ahtapotun ağırlığına göre bir besin kaynağı olarak da sağlanabilir. - Günde beş hayalet karides ikram et. Bu deneyde ortalama üç tane tüketildi. Ahtapota çeşitli yiyecekler sağlamak için, haftada bir kez canlı istiridye veya midye verin ve her zaman tankın içinde üç sivrisinek balığı saklayın.
NOT: Hayvanlara çeşitli yiyecekler vermek gerekli değildir ve deneyler sırasında hayvanların yiyecek tarafından baştan çıkmasını önleyebilir. Ahtapot besleme ve davranışını en iyi şekilde izlemek için burada kullanılan beslenme programı, kiloya göre yengeç sayısının yarısını tanıtmak ve karides sayısını sabah beşe çıkarmaktır. Akşamları, yengeçlerin ikinci yarısını tankla tanıştırın.
6. Haftalık sanitasyon
- Karter sistemini temizlemeden önce sıyırıcı, pompa ve alg kutusu ışıklarını kapatın. Ardından, suyu çıkarmadan önce sistemin otomatik vanasını kapatın. Son olarak, sıyırıcıyı ve tüm suyu sadece kartil sisteminden çıkarın.
- Biyokütlenin çoğunu duvarlarından çıkarmak için alg kutusunu hafifçe ovalayın. Kartem alanının geri kalanını bir fırça ile temizleyin. Çorap filtresini çıkarın, sirke ile temizleyin ve kurumasına izin verin; her hafta başka bir çorap filtresi ile döndürün ve her üç ayda bir yenileriyle değiştirin. Haftalık olarak yağsızın üstünden biyokütleyi çıkarın ve temizleyin.
NOT: Mikrobiyal büyümeye eğilimli çizikler oluşturacağından plastiği temizlemek için metal kullanmaktan kaçının. - Sıyırıcıyı tekrar sisteme koyun ve tuzlu suyla doldurmaya başlayın. Pompa alanı dolmaya başladığında, tüm sistemler tekrar açılabilir. Şamandıra vanasının otomatik üst kısmı kapalı konumdayken su eklemeyi bırakın.

Şekil 4: Keman yengeçleri için tank (Minuca pugnax). Tankın tabanı kuru yatak için, diğer yarısı ise 2 cm sığ tuzlu su için belirlenmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Hayalet karides tankı (Palaemonetes paludosus). Karides tankındaki kayalar, karideslerin saklanması ve erimesinin yanı sıra mikroorganizmaların büyümesi için yerler sağlar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
7. hasta hayvanların bakımı
- Ahtapot sağlıklı yaşam değerlendirmek için kılavuz referans66 izleyin.
NOT: Dişi ahtapotlar için, yaşam döngüsünün sonu normalde yumurta bıraktıktan sonra başlar. Hayvan yiyecek tüketimini azaltmaya başlayacak ve yemeyi tamamen bırakacak ve daha uyuşuk hale gelecektir. Yaşam sonu sürecinden sonraki ömür değişir. Hayvanı beslemek ve izlemek dışında başka bir işlem yapılmalıdır. Senescent erkekler gıda tüketimini azaltacak ve uyuşuk68 olacaktır.
8. Ahtapot anestezisi
- Butler-Struben ve ark.69'da ayrıntılı olarak belirtildiği gibi ahtapot anestezisi gerçekleştirin.
- En az 15 cm uzunluğunda kapaklı 6 L'lik bir kap elde edin. Ahtapotun tankından doğrudan kaba 4 L su yerleştirin ve su ortamına oksijen yaymak için hava taşlı küçük bir hava pompası kullanarak 4 L tuzlu su için havalandırma sağlayın58.
- Ahtapot tanıtımından önce, kabın içine% 1 EtOH ekleyin. Ahtapotu kullanmadan önce, sifondan su solumayı sayarak dakikadaki nefes sayısını kaydedin.
NOT: Araştırmacının laboratuvarındaki ahtapotlar için temel solunumlar dakikada 16 - 24 nefestir. - Ahtapotu hareket ettirmeden önce ahtapotun cilt pigmentasyonunu ve taban çizgisi solunum hızını kaydedin. Ahtapotu çevresindeki suyla kepçeleyerek temiz bir 4 L açık ağız kabı kullanarak tanktan çıkarın.
NOT: Anestezi sırasında solunum hızları mutlaka tam anesteziyi göstermez. - Ahtapotu kaptayken tartın ve iki ellerinizi ahtapotun gövdesinin etrafına yerleştirerek ve yukarı kaldırarak hareket ettirın. Emişli uzuvları konteyner duvarlarından çıkarmak için ikinci bir kişiye ihtiyaç duyulabilir.
- Ahtapotu% 1 EtOH ile hazırlanan kaba hızla hareket ettirın. Olası bir kaçışı önlemek için kapağı kapatın.
- İlk 5 dakikanın sonunda sifondan su soluma sayarak ahtapotun dakikada solunumunu kaydedin. Solunum taban çizgisinin üzerinde kalırsa ve hayvan hafif bir tutama yanıt vermeye devam ederse, suya ek% 0.25 EtOH ekleyin. Suya etanol ilavesi maksimum% 3 EtOH'a kadar devam edebilir.
NOT: Ahtapotun bilinçsiz olduğunun bir göstergesi kromatoforlarının kontrolünü kaybetmesidir. Bu durumda cilt normalden daha soluk görünür. Diğer bir gösterge, kolları hafifçe sıkıştırmak ve motor bir tepki olup olmadığını test etmektir. Bu noktada hala yanıt yoksa, ahtapot bilinçsizdir ve deneyler yapılabilir. - Anestezi altındayken ahtapotun nefes alışını ve rengini izleyerek işlem süresince bilinçsiz kalmasını sağlayın. Ahtapot işlem sırasında uyanmaya başlarsa, ek bir 0.25% EtOH ekleyin.
- Etanol anestezisinin etkilerini tersine çevirmek için ahtapotu kalıcı tutma tankından yeni bir 4 L veya daha fazla oksijenli su tankına aktarın. Respirasyonlar normale döndüğünde ahtapot aktif hale gelir ve cildi normal pigmentlere döner; tankına geri hareket ettirilebilir.
9. Ahtapot ötenazisi
- Fiorito ve ark., Moltschaniwskyj ve ark., ve Butler-Struben ve al57,58,69'da ayrıntılı olarak açık olarak belirtildiği gibi ahtapot ötanazisi için uluslararası standartları izleyin.
- Ahtapotun tutma tankından 4 L su ile yeni bir 6 L kap hazırlayın. Ötanazi tankına% 4 konsantrasyonda MgCl2 karıştırın. Ahtapotu uyuşturmak için 8.1 ile 8.9 arasında adımlar gerçekleştirin.
- 8.8 adımından sonra ahtapotu ötenazi tankına taşıyın. Nefes durduktan sonra, 5 dakika bekleyin ve ahtapotun bir decerebrasyonunu gerçekleştirin veya ötanazi tankında 5 dakika daha saklayın.
10. O. bimaküloidlerin davranışı
- Ahtapotu, bir vidalı kapak kabı kullanmak için eğitilecekleri sabahları beslemeyin. Beslenmeye yönelik alanı gösteren bir kamera kayıt cihazı kurun.
- Yüzey boyunca 1 mm çapında delikler ve konteyner boyunca su akışı için kapak ile 50 mL vida kapağı tüpü elde edin. Kabın içine bir kemancı yengeci yerleştirin. Tankın dibinde kalması için kabın içine veya dışına bağlı bir ağırlık yerleştirin.
- Kabı tankın altına açık alana ve ahtapotun ve kameranın görüşüne yerleştirin. Yengeç 4 saat sonra yenmediyse, tüpten çıkarın ve günün beslenme programına devam edin. Bu egzersizi her gün yapmaya devam edin.
NOT: Bu şekil 6'da gösterilmiştir ve temsili sonuç bölümünde ele alınmıştır.
11. Ahtapot MRI
NOT: Daha önce ahtapotun retinasında uyandırılan fonksiyonel MRG yanıtları uyuşturulmuş hayvanlarda ölçüldü70. Burada, ahtapotun sinir sisteminin saatlerce tarama gerektiren ultra yüksek uzamsal çözünürlüklü MR'ını elde ettik. Böylece, bu ötenazili bir O. bimaküloidlerde gerçekleştirildi.
- 7T sistemi kullanarak MRI görüntülerini alın. Ahtapotu, dokunun hidrasyonunu korumak için mutfak sınıfı polivinil klorür plastik bir sargıya sarın. Ahtapotu sargıya yerleştirin, uçlarına sıkıştırın ve sonra mühürlemek için yuvarlayın.
- Beynin ve birden fazla kolun görüntülerini elde etmek için 4 cm çapında bir hacim iletim / alma bobini kullanın. Aşağıdaki parametrelerle T1 ağırlıklı RARE dizisini kullanın: 1500 ms'lik tekrarlama süresi (TR), 20 ms yankı süresi (TE), 117 x 117 x 500 μm çözünürlük, 100 ortalama, RARE faktörü 8. Bunlar kemirgen beyinlerini görüntülemek için tipik MRI parametreleridir. RARE faktörü kullanmak görüntülemeyi daha hızlı hale getirirken, sinyal-gürültü oranını artırmak için 100 görüntü birlikte ortalama verilir71.
- 86 mm hacimli iletim bobini ve 4 x 4 cm 4 kanallı dizi alma bobini kullanarak ahtapot kolunu görüntüleyin. Cerrahi makas kullanarak bir kolu kesin ve fosfat tamponlu salinle dolu 15 mL konik bir tüpe yerleştirin.
NOT: Sıra, TR/TE = 4000/2.17 ms, inversiyon gecikmesi 1050 ms, 100 x 100 x 500 μm çözünürlük, 9 ortalama, tarama süresi 1.5 saat (Şekil 7) parametrelerine sahip T1_weighted bir inversiyon kurtarma dizisiydi (Şekil 7). Ters çevirme geri kazanım dizisi sudan gelen sinyali geçersiz kılar ve görüntü içindeki kontrastı artırır; bu dizi kol iç anatomisinin görselleştirilmesine izin verdiği için seçildi72.
12. Kriyo-floresan tomografi (CFT) görüntüleme
- Ahtapotu flaşla dondurun: Duman kaputunda çalışın. Bir Dewar'ın altını kuru buzla örtün ve sonra altıgenlerle doldurun. Ahtapotu yavaşça yaklaşık 10 dakika boyunca altıgenlere küçümseyin, ahtapotu soğuk altıgenlerle tamamen örtmek için gerektiği gibi taze altıgenler ve kuru buz ekleyin. Ahtapotu gömülene kadar -20 °C'de dondurun.
- Ahtapotu gömün ve bölümleyin: CFT üreticisi tarafından sağlanan araçları kullanarak ahtapotu tutmak için uygun boyutta dikdörtgen bir kalıp oluşturun. Kalıbın altını OCT (optimum kesme sıcaklığı) ortamı (histoloji laboratuvarlarında kullanılan standart malzeme) ile örtün ve yarı katı bir jelde donmasını bırakın.
- Donmuş ahtapotu OCT'nin jel tabakasına yerleştirin ve ardından 2-3 katman halinde OCT ile yavaşça örtün. Dökme adımları arasında, OCT jel aşamasına gelene kadar blok adımlarını dondurun. Ahtapot tamamen kaplandıktan sonra, bloğu -20 °C'de en az 12 saat dondurun.
- Örneği kriyo-floresan tomografi sistemine yükleyin73.
- Bölüm ve görüntü tüm ötenazi O. bimaküloidler mezoskopik çözünürlükte 3 emisyon/ ekscitasyon filtreleri kullanarak böylece birkaç 3D izotropik veri kümesi üreten.
- Kesit kol ve sindirim sistemine ulaştığında, daha fazla histoloji için bölümleri slaytlara aktarın.
- Ham veri kümesini, hızlı işlemeyi etkinleştirmek için özel olarak tasarlanmış CFT satıcısından yeniden yapılandırma yazılımına yükleyin.
- Her dalga boyu için yüzey altı floresan etkilerinin kaldırılması da dahil olmak üzere, yer işareti hizalaması, histogram dengeleme ve floresan düzeltmeleri ve normalleştirme kullanarak 3 boyutlu bir yığını yeniden oluşturun.
- Son 3D yığını rekonstrüksiyon aracı tarafından üretildikten sonra, görüntüleme yazılımı aracıyla verileri görselleştirin ve 3D Maksimum Yoğunluk Projeksiyonları (3D-MIPS) ile birlikte beyaz ışık ve floresan kaplamalarla uçuplamalar oluşturun, örneğin Şekil 873.
Sonuçlar
Çalışmalarımızdaki tüm hayvanlar vahşi doğadan elde edildi ve bu nedenle tam yaşları belirlenemedi ve laboratuvarda kalmaları değişkendi. Ahtapot durumu her gün gözlendi. Parazitler, bakteriler, cilt hasarı veya anormal davranışlar görmedik. Hayvanların ortalama ağırlığı 170.38 +/- 77.25 g idi. Her hayvan kendi 40 galonluk tanklarında yaşıyordu. Bir hafta boyunca bir tank için kaydedilen parametreler için ortalama ± standart sapma şunlardı: pH 8.4 ± 0.0, tuzluluk 34.06 ± 0.61 ppt, sıca...
Tartışmalar
Sistem Kurulumu:
Akvaryum ekosistemi, suyu filtrelemek ve oksijenleştirmek için hem mekanik hem de biyolojik yöntemlerin uygulandığı şekilde geliştirilmiştir. Sistemin filtreleme elemanları, azot ve oksijen seviyelerini korumak için çorap filtreleri, protein sıyırıcıları ve düzenli temizlik kullanır. Daha da önemlisi, tehlikeli azotlu bileşikleri ve diğer biyolojik atıkları tüketmek ve fotosentez işlemleriyle suyu havalamak için deniz mikroorganizmalarına da güveniyoruz. E...
Açıklamalar
Tüm yazarlar çıkar çatışması olmadığını beyan eder.
Teşekkürler
Bu çalışma NIH UF1NS115817 (G.P.) tarafından desteklendi. G.P., NIH'nin R01NS072171 ve R01NS098231 hibeleri tarafından kısmen desteklenmektedir. Emit Imaging'den Patrick Zakrzewki ve Mohammed Farhoud'a Xerra Görüntüleme Platformu'ndaki verilerin toplanması ve görselleştirilmesindeki yardım ve destekleri için teşekkür ederiz. MSU'nun Bruker Biospin ile bir araştırma anlaşması var.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1-3/4 in. Drill Bit | Home Depot | 204074205 | Glass cutting tool Part number:1 |
| 1" flow sensors | Neptune Systems | Local Dealer | Pipe with sensor to measure water flow Part number:2 |
| 1" Slip Bulkhead Strainer | Bulk Reef Supply | 207113 | Strainer for water leaving tank Part number:3 |
| 10 gallon tank | Preuss Pets | Local Dealer | Fiddler crab holding tank Part number:4 |
| 4 inch X 12 inch 200 Micron Nylon Monofiliment Mesh Filter Sock w/ Plastic Ring | AQUAMAXX | UJ41171 | Filter for large organic matter in sump Part number:5 |
| 40 gallon aquarium | Preuss Pets | Local Dealer | 4 Food aquarium tanks Part number:6 |
| 60g poly tanks - rectangle | Preuss Pets | Local Dealer | 2 Water Storage (salt and freshwater) Part number:7 |
| Active Aqua 1/10th HP Hydroponic or Aquarium Chiller 2018 Model | WayWe | 719574198463 | For cooling water continuously Part number:8 |
| ALAZCO 2 Soft-Grip Handle Heavy-Duty Tile Grout Brush | ALAZCO | B06W2FT5V5 | Tank Cleaning Part number:9 |
| Ammonia Testing Kit | Aquarium Pharmaceuticals | 33D | For water testing Part number:10 |
| Apex system WiFi | Neptune Systems | Local Dealer | System connection for off site monitoring Part number:11 |
| API Aquarium Test Kit | Amazon | B001EUE808 | For water testing Part number:12 |
| API Copper Test Kit | Amazon | B0006JDWH8 | For water testing Part number:13 |
| Aqua Ultraviolet Classic UV 25 Watt Series Units | Aqua Ultraviolet | A00028 | For removing bacteria leaving sump system Part number:14 |
| AquaClear 50 Foam Filter Inserts, 3 pack | Aquaclear | A1394 | Food Tank Carbon Filter Inserts Part number:15 |
| Aqueon QuietFlow LED PRO Aquarium Power Filter 30 | Aqueon | 100106082 | Food tank filtering units Part number:16 |
| Auto Top Off Kit (ATK) (Each includes 1 FMM module, 2 optical sensors and 1 float) | Neptune Systems | Local Dealer | For freshwater tank Part number:17 |
| Automatic top off from RODI (LLC) | Neptune Systems | Local Dealer | From water storage to octopus tanks Part number:18 |
| Banded Trochus Snail | LiveAquaria | CN-112080 | For algae bin Part number:19 |
| Chaetomorpha Algae, Aquacultured | LiveAquaria | BVJ-76354 | For algae bin Part number:20 |
| Clams - Live, Hard Shell, Cherrystone, Wild, USA Dozen | Fulton Fish Market | N/A | Live food Part number:21 |
| Classic Sea Salt Mix - Tropic Marin | Bulk Reef Supply | 211813 | Salt for tank water Part number:22 |
| Clear Masterkleer Soft PVC Plastic Tubing, for Air and Water, 3/4" ID, 1" OD | McMaster | 5233K71 | Cleaning tool Part number:23 |
| Continuum Aquablade-P Acrylic Safe Algae Scraper W/ Plastic Blade - 15 Inch | Marine Depot | 4C31001 | Cleaning tool Part number:24 |
| Copper Testing Kit | Aquarium Pharmaceuticals | 65L | For water testing Part number:25 |
| Curve Refugium CREE LED Aquarium Light | Eshopps | 6500K | Algae bin light Part number:26 |
| Eheim 1262 return pumps | EHEIM | 1250219 | Pump for storage tanks Part number:27 |
| Eshopps R-100 Refugium Sump GEN 3 | Eshopps | 15000 | Sump system Part number:28 |
| Ethyl Alcohol, 200 Proof | Sigma-Aldrich | 64-17-5 | Anesthesia Part number:29 |
| Extech DO600 ExStik II Dissolved Oxygen Meter | Extech | DO600 | Oxygen measurement Part number:30 |
| Fiddler Crabs; live; dozen | NORTHEAST BRINE SHRIMP | N/A | Live food Part number:31 |
| Filter Cartridges | Aqueon | 100106087 | Food tank filters Part number:32 |
| Florida Crushed Coral Dry Sand - CaribSea | Bulk Reef Supply | 212959 | Sediment for bottom of tank Part number:33 |
| FMM module | Neptune Systems | Local Dealer | Controller for apex system Part number:34 |
| Fritz-Zyme TurboStart 900 - Fritz | Bulk Reef Supply | 213036 | Bacteria start Part number:35 |
| Hand Operated Drum Pump, Siphon, Basic Pump with Spout, For Container Type Bucket, Pail | Grainger | 38Y789 | Water Hand Pump Part number:36 |
| High pH Testing Kit | Aquarium Pharmaceuticals | 27 | For water testing Part number:37 |
| Imagitarium Fine Mesh Net for Shrimp | Petco | 2580993 | Shrimp and fish transfer net Part number:38 |
| Leak Detection Kit (LDK) - Includes FMM module plus 2 ALD sensors | Neptune Systems | Local Dealer | Placed on floor to detect water Part number:39 |
| Lee`S Algae Scrubber Pad Jumbo - Glass | Marine Depot | LE12007 | Cleaning tool Part number:40 |
| Live rocks | Preuss Pets | Local Dealer | Habitat for octopus Part number:41 |
| Long Bottle Cleaning Brush 17" Extra Long | Haomaomao | B07FS7J7PN | Tank Cleaning Part number:42 |
| Magnesium chloride | Sigma-Aldrich | M1028-100ML | Euthanasia Part number:43 |
| Magnetic Probe Rack | Neptune Systems | Local Dealer | For holding apex sensor probes Part number:44 |
| Marine Ghost Shrimp | NORTHEAST BRINE SHRIMP | N/A | Live food Part number:45 |
| Marineland C-Series Canister Carbon Bags Filter Media, 2 count | Chewy | 98331 | For elevated copper levels Part number:46 |
| Nitra-Zorb Bag | Aquarium Pharmaceuticals | AP2213 | Absorbs nitrogen compounds Part number:47 |
| Nitrate Testing Kit | Aquarium Pharmaceuticals | LR1800 | For water testing Part number:48 |
| Nitrite Testing Kit | Aquarium Pharmaceuticals | 26 | For water testing Part number:49 |
| Pawfly 2 Inch Air Stones Cylinder 6 PCS Bubble Diffuser Airstones for Aquarium Fish Tank Pump Blue | Amazon | B076S56XWX | Aerate water Part number:50 |
| Penn Plax Airline Tubing for Aquariums –Clear and Flexible Resists Kinking, 8 Feet Standard | Amazon | B0002563MM | Tubing for connecting air pump to air stone Part number:51 |
| Plumbing with unions/valves plus 3/4" flex hose | Preuss Pets | Local Dealer | Water transport Part number:52 |
| PM1 module | Neptune Systems | Local Dealer | Power control module for apex Part number:53 |
| Protein skimmer | Reef Octopus | AC20284 | Removes biowaste from system Part number:54 |
| PVC Apex Mounting board, grommets, wire mounts | Neptune Systems | Local Dealer | Helps ensure organization for wires and tubing within system Part number:55 |
| PVC Regular Cement and 4-Ounce NSF Purple Primer | Amazon | Oatey - 30246 | For connecting PVC pipes Part number:56 |
| RODI unit | Neptune Systems | Local Dealer | RO Water Part number:57 |
| Salinity Probes | HANNA probes | HI98319 | Measures salinity of water Part number:58 |
| Seachem Pristine Aquarium Treatment | Seachem | 1438 | Provides bacteria that break down excess food, waste and detritus Part number:59 |
| Seachem Stability Fish Tank Stabilizer | Seachem | 116012607 | Seachem Stability will rapidly and safely establish the aquarium biofilter in freshwater and marine systems Part number:60 |
| Set of lexan tops | Preuss Pets | Local Dealer | Aquarium tank lids Part number:61 |
| Set of Various extended length aquabus cables | Neptune Systems | Local Dealer | Cables for Apex system Part number:62 |
| SLSON Aquarium Algae Scraper Double Sided Sponge Brush Cleaner Long Handle Fish Tank Scrubber for Glass Aquariums | Amazon | B07DC2TZCJ | Cleaning tool Part number:63 |
| Standard-Wall PVC Pipe Fitting for Water, 45 Degree Elbow Adapter, 3/4 Socket Female x 3/4 Socket Male | McMaster | 4880K189 | PVC pipe Part number:64 |
| Standard-Wall PVC Pipe Fitting for Water, 90 Degree Elbow Adapter, 1 Socket Female x 1 Socket Male | McMaster | 4880K773 | PVC pipe Part number:65 |
| Standard-Wall PVC Pipe Fitting for Water, Adapter, 1 Socket-Connect Female x 1 Barbed Male | McMaster | 4880K415 | PVC pipe Part number:66 |
| Standard-Wall PVC Pipe Fitting for Water, Straight Reducer, 2 Socket Female x 3/4 Socket Female | McMaster | 4880K008 | PVC pipe Part number:67 |
| Standard-Wall PVC Pipe Fitting for Water, Tee Connector, White, 1 Size Socket-Connect Female | McMaster | 4880K43 | PVC pipe Part number:68 |
| Standard-Wall Unthreaded Rigid PVC Pipe for Water, 1 Pipe Size, 10 Feet Long | McMaster | 48925K13 | PVC pipe Part number:69 |
| Standard-Wall Unthreaded Rigid PVC Pipe for Water, 3/4 Pipe Size, 5 Feet Long | McMaster | 48925K92 | PVC pipe Part number:70 |
| Structural FRP Fiberglass Sheet, 48" Wide x 96" Long, 1/2" Thick | McMaster | 8537K15 | Table top material Part number:71 |
| Structural FRP Fiberglass Square Tube, 10 Feet Long, 2" Wide x 2" High Outside, 1/8" Wall Thickness | McMaster | 8548K33 | Structural table material Part number:72 |
| Tank Sediment | TopDawg Pet Supply | 8479001207 | Sediment for bottom of fiddler crab tank Part number:73 |
| Temperature probe | Neptune Systems | Local Dealer | Temperature probe for tanks Part number:74 |
| Tetra TetraMarine Large Saltwater Flakes for all Marine Fish | Amazon | B00025K0US | Fish, shrimp, and crab food Part number:75 |
| Tetra Whisper Aquarium Air Pump for 10 gallon Aquariums | Petco | 2335234 | Air pump for smaller tanks Part number:76 |
| Thick-Wall Through-Wall Pipe Fitting, for Water, PVC Connector, 1 Socket-Connect Female | McMaster | 36895K843 | PVC pipe Part number:77 |
| Vectra s2 pump | Bulk Reef Supply | 212141 | Aquarium Pump Part number:78 |
| Water Pump | TACKLIFE | GHWP1A | Pump for cleaning tanks Part number:79 |
| Wyze Cam v2 1080p HD Indoor WiFi Smart Home Camera with Night Vision | Amazon | B076H3SRXG | DeepLabCut Recording Part number:80 |
Referanslar
- Wet, J. R., Wood, K. V., DeLuca, M., Helinski, D. R., Subramani, S. Firefly luciferase gene: structure and expression in mammalian cells. Molecular and Cellular Biology. 7 (2), 725-737 (1987).
- Han, X., Boyden, E. S. Multiple-color optical activation, silencing, and desynchronization of neural activity, with single-spike temporal resolution. PLoS One. 2 (3), 299 (2007).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Li, N., et al. Optogenetic-guided cortical plasticity after nerve injury. Proceedings of the National Academy of Sciences of the United States of America. 108 (21), 8838-8843 (2011).
- Airan, R. D., Li, N., Gilad, A. A., Pelled, G. Genetic tools to manipulate MRI contrast. NMR Biomedicine. 26 (7), 803-809 (2013).
- Cywiak, C., et al. Non-invasive neuromodulation using rTMS and the electromagnetic-perceptive gene (EPG) facilitates plasticity after nerve injury. Brain Stimulation. 13 (6), 1774-1783 (2020).
- Hwang, J., et al. Regulation of Electromagnetic Perceptive Gene Using Ferromagnetic Particles for the External Control of Calcium Ion Transport. Biomolecules. 10 (2), (2020).
- Lu, H., et al. Transcranial magnetic stimulation facilitates neurorehabilitation after pediatric traumatic brain injury. Scientific Reports. 5, 14769 (2015).
- Krishnan, V., et al. Wireless control of cellular function by activation of a novel protein responsive to electromagnetic fields. Bioscience Reports. 8 (1), 8764 (2018).
- Mitra, S., Barnaba, C., Schmidt, J., Pelled, G., Gilad, A. A. Functional characterization of an electromagnetic perceptive protein. bioRxiv. , 329946 (2020).
- Hunt, R. D., et al. Swimming direction of the glass catfish is responsive to magnetic stimulation. PLoS One. 16 (3), 0248141 (2021).
- Kandel, E. R., Krasne, F. B., Strumwasser, F., Truman, J. W. Cellular mechanisms in the selection and modulation of behavior. Neurosciences Research Program bulletin. 17, 521 (1979).
- Carew, T. J., Castellucci, V. F., Kandel, E. R. An analysis of dishabituation and sensitization of the gill-withdrawal reflex in Aplysia. International Journal of Neuroscience. 2 (2), 79-98 (1971).
- Kandel, E. R. The molecular biology of memory storage: a dialog between genes and synapses. Bioscience Reports. 21 (5), 565-611 (2001).
- Forsythe, J. W., Hanlon, R. T. Effect of temperature on laboratory growth, reproduction and life-span of octopus-bimaculoides. Marine Biology. 98 (3), 369-379 (1988).
- Forsythe, J. W., Hanlon, R. T. Behavior, body patterning and reproductive-biology of octopus-bimaculoides from California. Malacologia. 29 (1), 41-55 (1988).
- Pickford, B. M. The Octopus bimaculatus problem: A study in sibling species. Bulletin of the Bingham Oceanographic Collection. 12, 1-66 (1949).
- Sumbre, Y., Fiorito, G., Flash, T. Control of octopus arm extension by a peripheral motor program. Science. 293 (5536), 1845-1848 (2001).
- Gutfreund, Y., et al. Organization of octopus arm movements: a model system for studying the control of flexible arms. Journal of Neuroscience. 16 (22), 7297-7307 (1996).
- Gutfreund, Y., Matzner, H., Flash, T., Hochner, B. Patterns of motor activity in the isolated nerve cord of the octopus arm. The Biological Bulletin. 211 (3), 212-222 (2006).
- Hague, T., Florini, M., Andrews, P. L. R. Preliminary in vitro functional evidence for reflex responses to noxious stimuli in the arms of Octopus vulgaris. Journal of Experimental Marine Biology and Ecology. 447, 100-105 (2013).
- Hochner, B., Brown, E. R., Langella, M., Shomrat, T., Fiorito, G. A learning and memory area in the octopus brain manifests a vertebrate-like long-term potentiation. Journal of Neurophysiology. 90 (5), 3547-3554 (2003).
- Hochner, B., Glanzman, D. L. Evolution of highly diverse forms of behavior in molluscs. Current Biology. 26 (20), 965-971 (2016).
- Hvorecny, L. M., et al. Octopuses (Octopus bimaculoides) and cuttlefishes (Sepia pharaonis, S. officinalis) can conditionally discriminate. Animal Cognition. 10 (4), 449-459 (2007).
- Kier, W. M., Stella, M. P. The arrangement and function of octopus arm musculature and connective tissue. Journal of Morphology. 268 (10), 831-843 (2007).
- Levy, G., Hochner, B. Embodied organization of octopus vulgaris morphology, vision, and locomotion. Frontiers in Physiology. 8, 164 (2017).
- Giorgio-Serchi, F., Arienti, A., Laschi, C. Underwater soft-bodied pulsed-jet thrusters: Actuator modeling and performance profiling. The International Journal of Robotics Research. 35 (11), 1308-1329 (2016).
- Han, S., Kim, T., Kim, D., Park, Y., Jo, S. Use of deep learning for characterization of microfluidic soft sensors. IEEE Robotics and Automation Letters. 3 (2), 873-880 (2018).
- Hanassy, S., Botvinnik, A., Flash, T., Hochner, B. Stereotypical reaching movements of the octopus involve both bend propagation and arm elongation. Bioinspiration and Biomimetics. 10 (3), 035001 (2015).
- Hochner, B., Shomrat, T., Fiorito, G. The octopus: a model for a comparative analysis of the evolution of learning and memory mechanisms. The Biological Bulletin. 210 (3), 308-317 (2006).
- Imperadore, P., Fiorito, G. Cephalopod tissue regeneration: consolidating over a century of knowledge. Frontiers in Physiology. 9, 593 (2018).
- Imperadore, P., et al. Nerve regeneration in the cephalopod mollusc Octopus vulgaris: label-free multiphoton microscopy as a tool for investigation. Journal of the Royal Society, Interface. 15 (141), 20170889 (2018).
- Levy, G., Flash, T., Hochner, B. Arm coordination in octopus crawling involves unique motor control strategies. Current Biology. 25 (9), 1195-1200 (2015).
- Li, F., et al. Chromosome-level genome assembly of the East Asian common octopus (Octopus sinensis) using PacBio sequencing and Hi-C technology. Molecular Ecology Resources. 20 (6), 1572-1582 (2020).
- Lopes, V. M., Rosa, R., Costa, P. R. Presence and persistence of the amnesic shellfish poisoning toxin, domoic acid, in octopus and cuttlefish brains. Marine Environmental Research. 133, 45-48 (2018).
- Mazzolai, B., Margheri, L., Dario, P., Laschi, C. Measurements of octopus arm elongation: Evidence of differences by body size and gender. Journal of Experimental Marine Biology and Ecology. 447, 160-164 (2013).
- McMahan, W., et al. . Proceedings 2006 IEEE International Conference on Robotics and Automation, 2006. , 2336-2341 (2006).
- Meisel, D. V., Kuba, M., Byrne, R. A., Mather, J. The effect of predatory presence on the temporal organization of activity in Octopus vulgaris. Journal of Experimental Marine Biology and Ecology. 447, 75-79 (2013).
- Nesher, N., Levy, G., Grasso, F. W., Hochner, B. Self-recognition mechanism between skin and suckers prevents octopus arms from interfering with each other. Current Biology. 24 (11), 1271-1275 (2014).
- Wells, M. J. . Octopus : Physiology and behaviour of an advanced invertebrate. , (1978).
- Young, J. Z. . The anatomy of the nervous system of Octopus vulgaris. , (1971).
- Zullo, L., Sumbre, G., Agnisola, C., Flash, T., Hochner, B. Nonsomatotopic organization of the higher motor centers in octopus. Current Biology. 19 (19), 1632-1636 (2009).
- Albertin, C. B., et al. The octopus genome and the evolution of cephalopod neural and morphological novelties. Nature. 524 (7564), 220-224 (2015).
- Albertin, C. B., Simakov, O. Cephalopod Biology: At the intersection between genomic and organismal novelties. Annual Review if Animal Biosciences. 8, 71-90 (2020).
- Baik, S., et al. A wet-tolerant adhesive patch inspired by protuberances in suction cups of octopi. Nature. 546 (7658), 396-400 (2017).
- Pikul, J. H., et al. Stretchable surfaces with programmable 3D texture morphing for synthetic camouflaging skins. Science. 358 (6360), 210 (2017).
- Wehner, M., et al. An integrated design and fabrication strategy for entirely soft, autonomous robots. Nature. 536 (7617), 451-455 (2016).
- McMahan, W., et al. Field trials and testing of the OctArm continuum manipulator. Proceedings 2006 IEEE International Conference on Robotics and Automation, 2006. ICRA. , 2336-2341 (2006).
- Hochner, B., Brown, E. R., Langella, M., Shomrat, T., Fiorito, G. A learning and memory area in the octopus brain manifests a vertebrate-like long-term potentiation. Journal of Neurophysiology. 90 (5), 3547-3554 (2003).
- Tapia-Vasquez, A. E., et al. Proteomic identification and physicochemical characterisation of paramyosin and collagen from octopus (Octopus vulgaris) and jumbo squid (Dosidicus gigas). International Journal of Food Science & Technology. 55 (10), 3246-3253 (2020).
- Kim, B. -. M., et al. The genome of common long-arm octopus Octopus minor. GigaScience. 7 (11), (2018).
- Zarrella, I., et al. The survey and reference assisted assembly of the Octopus vulgaris genome. Scientific data. 6 (1), 13 (2019).
- Forsythe, J. W., Hanlon, R. T. Effect of temperature on laboratory growth, reproduction and life span of Octopus bimaculoides. Marine Biology. 98 (3), 369-379 (1988).
- Stoskopf, M. K., Oppenheim, B. S. Anatomic features of Octopus bimaculoides and Octopus digueti. Journal of Zoo and Wildlife Medicine. 27 (1), 1-18 (1996).
- Ramos, J. E., et al. Body size, growth and life span: implications for the polewards range shift of Octopus tetricus in south-eastern Australia. PLoS One. 9 (8), 103480 (2014).
- Hanlon, R. T., Forsythe, J. W. Advances in the laboratory culture of octopuses for biomedical research. Lab Animal Science. 35 (1), 33-40 (1985).
- Moltschaniwskyj, N. A., Carter, C. G. Protein synthesis, degradation, and retention: mechanisms of indeterminate growth in cephalopods. Physiological and Biochemical Zoology. 83 (6), 997-1008 (2010).
- Fiorito, G., et al. Guidelines for the care and welfare of Cephalopods in Research -A consensus based on an initiative by CephRes, FELASA and the Boyd Group. Lab Animal. 49, 1-90 (2015).
- Valverde, J. C., Garcia, B. G. Suitable dissolved oxygen levels for common octopus (Octopus vulgaris cuvier, 1797) at different weights and temperatures: analysis of respiratory behaviour. Aquaculture. 244 (1-4), 303-314 (2005).
- Cardeilhac, P. T., Whitaker, B. R. Copper Treatments: Uses and Precautions. Veterinary Clinics of North America: Small Animal Practice. 18 (2), 435-448 (1988).
- Hodson, P. V., Borgman, U., Shear, H. Toxicity of copper to aquatic biota. Copper in the Environment. (2), 307-372 (1979).
- Poole, B. M. Techniques for the culture of ghost shrimp (palaemonetes pugio). Environmental Toxicology and Chemistry. 7 (12), 989-995 (1988).
- Burggren, W. W. Respiration and circulation in land crabs: novel variations on the marine design. American Zoologist. 32 (3), 417-427 (1992).
- Reitsma, J., Murphy, D. C., Archer, A. F., York, R. H. Nitrogen extraction potential of wild and cultured bivalves harvested from nearshore waters of Cape Cod, USA. Marine Pollution Bulletin. 116 (1), 175-181 (2017).
- Messenger, J. B. Cephalopod chromatophores: neurobiology and natural history. Biological Reviews. 76 (4), 473-528 (2001).
- Morgan Holst, M. M., Miller-Morgan, T. The Use of a species-specific health and welfare assessment tool for the giant pacific octopus, enteroctopus dofleini. Journal of Applied Animal Welfare Science. 24 (3), 272-291 (2021).
- Rosas, C., et al. Energy balance of Octopus maya fed crab or an artificial diet. Marine Biology. 152 (2), 371-381 (2007).
- Anderson, R. C., Wood, J. B., Byrne, R. A. Octopus Senescence: The Beginning of the end. Journal of Applied Animal Welfare Science. 5 (4), 275-283 (2002).
- Butler-Struben, H. M., Brophy, S. M., Johnson, N. A., Crook, R. J. In vivo recording of neural and behavioral correlates of anesthesia induction, reversal, and euthanasia in cephalopod molluscs. Frontiers in Physiology. 9, 109 (2018).
- Jiang, X., et al. Octopus visual system: A functional MRI model for detecting neuronal electric currents without a blood-oxygen-level-dependent confound. Magnetic Resonance in Medicine. 72 (5), 1311-1319 (2014).
- Hennig, J., Nauerth, A., Friedburg, H. RARE imaging: a fast imaging method for clinical MR. Magnetic Resonance in Medicine. 3 (6), 823-833 (1986).
- Brant-Zawadzki, M., Gillan, G. D., Nitz, W. R. MP RAGE: a three-dimensional, T1-weighted, gradient-echo sequence--initial experience in the brain. Radiology. 182 (3), 769-775 (1992).
- Bertapelle, C., Polese, G., Di Cosmo, A. Enriched environment increases PCNA and PARP1 Levels in Octopus vulgaris central nervous system: first evidence of adult neurogenesis in Lophotrochozoa. Journal of Experimental Zoology Part B: Molecular and Developmental Evolution. 328 (4), 347-359 (2017).
- Maselli, V., Polese, G., Soudy, A. -. S. A., Buglione, M., Cosmo, A. D. Cognitive stimulation induces differential gene expression in Octopus vulgaris: The key role of protocadherins. Biology. 9, (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır