Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Établir un écosystème Octopus pour la recherche biomédicale et la bio-ingénierie
Dans cet article
Résumé
Comprendre les structures physiologiques et anatomiques uniques des pieuvres peut avoir un impact considérable sur la recherche biomédicale. Ce guide montre comment mettre en place et maintenir un environnement marin pour accueillir cette espèce et comprend des approches d’imagerie et d’analyse de pointe pour visualiser l’anatomie et la fonction du système nerveux de la pieuvre.
Résumé
De nombreux développements dans la recherche biomédicale ont été inspirés par la découverte de mécanismes anatomiques et cellulaires qui soutiennent des fonctions spécifiques chez différentes espèces. La pieuvre est l’un de ces animaux exceptionnels qui a donné aux scientifiques de nouvelles connaissances dans les domaines des neurosciences, de la robotique, de la médecine régénérative et des prothèses. La recherche sur cette espèce de céphalopodes nécessite la mise en place d’installations complexes et de soins intensifs pour la pieuvre et son écosystème, ce qui est essentiel à la réussite du projet. Ce système nécessite plusieurs systèmes de filtrage mécaniques et biologiques pour fournir un environnement sûr et propre à l’animal. En plus du système de contrôle, un entretien et un nettoyage de routine spécialisés sont nécessaires pour que l’installation continue de fonctionner efficacement à long terme. Il est conseillé de fournir un environnement enrichi à ces animaux intelligents en modifiant le paysage du réservoir, en incorporant une variété de proies et en leur présentant des tâches difficiles. Nos résultats comprennent une IRM et une imagerie d’autofluorescence du corps entier ainsi que des études comportementales pour mieux comprendre leur système nerveux. Les pieuvres possèdent une physiologie unique qui peut avoir un impact sur de nombreux domaines de la recherche biomédicale. Leur fournir un écosystème durable est la première étape cruciale pour découvrir leurs capacités distinctes.
Introduction
Les nouveaux concepts de la recherche biomédicale et du génie biomédical sont souvent inspirés par l’identification de stratégies spécifiques que les espèces biologiques possèdent pour faire face aux conditions et aux défis environnementaux et physiologiques. Par exemple, la compréhension des propriétés de fluorescence chez les lucioles a conduit à la mise au point de nouveaux capteurs fluorescents capables de signaler l’activité cellulaire dans d’autres organismes modèles1; l’identification des canaux ioniques activés par la lumière dans les algues a conduit au développement d’une neuromodulation cellulaire et temporelle spécifique basée sur la lumière2,3,4,5; la découverte de protéines chez le poisson-chat en verre qui naviguent en fonction du champ magnétique terrestre a conduit au développement de la neuromodulation magnétique6,7,8,9,10,11; la compréhension du réflexe de siphon dans l’aplysie a joué un rôle déterminant dans la compréhension de la base cellulaire du comportement12,13,14.
Les chercheurs continuent de développer la boîte à outils actuelle de la bio-ingénierie et de la phylogénétique en tirant parti des forces uniques et des nouvelles perspectives sur les fonctions physiologiques des espèces de laboratoire non conventionnelles. Les organismes fédéraux commencent à soutenir ces lignes d’études en finançant de nouveaux travaux réalisés sur diverses espèces.
Un genre d’animaux avec une anatomie et des capacités de régénération uniques ainsi que le contrôle adaptatif de chacun de ses bras, des biologistes et des ingénieurs fascinants, et captivant des publics de toutes les parties de la société est le Octopus17. En effet, de nombreux aspects de la physiologie et du comportement de la pieuvre ont été étudiés au cours des dernières décennies15,16,17,18,19,20,21,22,23,24,25,26 . Cependant, les développements récents en biologie moléculaire et évolutive, en robotique, en enregistrement de mouvement, en imagerie, en apprentissage automatique et en électrophysiologie accélèrent les découvertes liées à la physiologie et au comportement des pieuvres et les traduisent en stratégies innovantes de bio-ingénierie27,28,29,30,31,32,33,34,35 ,36,37,38,39.
Nous décrivons ici comment mettre en place et maintenir l’élevage de poulpes, ce qui serait intéressant et pertinent pour les scientifiques et les ingénieurs de différents horizons, intérêts scientifiques et objectifs. Néanmoins, nos résultats se concentrent sur l’application des pieuvres dans la recherche en neurosciences et en neuro-ingénierie. La pieuvre a un système nerveux très développé avec 45 millions de neurones dans le cerveau central, 180 millions de neurones dans les lobes optiques et 350 millions de neurones supplémentaires dans les huit cordons axiaux et les ganglions périphériques; en comparaison, un chien a un nombre similaire de neurones et un chat seulement la moitié de celui-ci40. Contrairement au système nerveux des vertébrés, il n’y a que 32K fibres efférentes et 140K afférentes reliant les millions de neurones du cerveau de la pieuvre aux millions de neurones de chacun des cordons axiaux de leur bras40,41,42. Ces fibres interconnectées relativement peu nombreuses suggèrent que la plupart des détails pour l’exécution des programmes moteurs sont effectués dans le cordon axial lui-même, soulignant le contrôle neuronal distribué de manière unique que possèdent les pieuvres. Les bras de la pieuvre ont un contrôle de la motricité fine extraordinaire leur permettant des compétences de manipulation telles que l’ouverture des couvercles des bocaux, même lorsqu’ils sont à l’intérieur du récipient. Cette capacité motrice préhensile très développée est unique à la classe des céphalopodes (poulpe, seiche et calmar)43.
En effet, au cours de centaines de millions d’années d’évolution, la pieuvre a développé un génome et un système physiologique remarquables et sophistiqués43,44 qui ont inspiré de nouveaux développements et progrès dans les domaines scientifiques et techniques. Par exemple, un patch adhésif résistant à l’eau basé sur la structure anatomique des ventouses de la pieuvre peut coller aux surfaces humides et sèches45; un matériau de camouflage synthétique inspiré de la peau de camouflage de la pieuvre peut transformer une surface plane en 2D en une surface tridimensionnelle avec des bosses et des fosses46. Des robots miniatures souples et autonomes (c.-à-d. des Octobots) qui, à l’avenir, pourraient servir d’outils chirurgicaux à l’intérieur du corps47; et un bras (c’est-à-dire OctoArm) attaché à un robot de type char48 ont également été développés. De nombreuses espèces de pieuvres sont utilisées dans la recherche biomédicale, par exemple Octopus vulgaris, Octopus sinensis, Octopus variabilis et Octopus bimaculoides (O. bimaculoides); O. vulgaris et O. bimaculoides étant les plus communs34,49,50. Le séquençage récent de différents génomes de poulpe rend ce genre particulièrement intéressant et ouvre de nouvelles frontières dans la recherche sur les poulpes34,43,51,52.
O. bimaculoides utilisé dans notre installation est une espèce de poulpe de taille moyenne, découverte pour la première fois en 1949, que l’on peut trouver dans les eaux peu profondes au large de la côte nord-est du Pacifique, du centre de la Californie au sud de la péninsule de Basse-Californie17. Il peut être reconnu par les fausses taches oculaires sur son manteau sous ses yeux. Comparée à la pieuvre géante du Pacifique (Enteroctopus dofleini) et à la pieuvre commune (O. vulgaris), la pieuvre à deux points de Californie (O. bimaculoides) est relativement petite, commençant par quelques centimètres et se développant rapidement en tant que juvénile. Lorsqu’il est élevé dans un laboratoire, la taille du manteau adulte peut atteindre une taille moyenne de 100 cm et peser jusqu’à 800 g53,54. Les pieuvres ont une période de croissance rapide dans leurs 200 premiers jours; à ce moment-là, ils sont considérés comme des adultes et continuent de grandir tout au long de leur vie55,56,57. Les pieuvres peuvent être cannibales, surtout lorsque les deux sexes sont logés ensemble dans un réservoir; par conséquent, ils doivent être logés individuellement dans des réservoirs séparés58.
Protocole
Toutes les études sur les animaux ont été approuvées par l’Institutional Animal Care and Use Committee (IACUC) de la Michigan State University.
1. Installation de l’équipement du réservoir Octopus
- Tout d’abord, obtenez tous les matériaux non biologiques pour un aquarium qui seront incorporés dans le système environnemental marin, comme indiqué dans le tableau des matériaux. Les tailles sont fournies en pouces.
- Lavez toutes les pièces des tubes, de la tuyauterie et du système de filtration avec de l’éthanol à 70 % et de l’eau désionisée (DI) avant l’installation. N’utilisez pas de savon ou d’autres produits chimiques lors du nettoyage.
- Placez une table en fibre de verre de 13 pouces x 49 pouces x 1/2 pouce (partie #71) avec quatre pieds de table en fibre de carbone et avec les dimensions de 2 pouces x 2 pouces x 23 pouces (partie #72). Fixez les pieds directement sous les coins de la table.
- Sous la surface supérieure, entre chacun des pieds de la table, placez des broches de stabilisation en fibre de carbone de 2 pouces x 2 pouces de long (partie #72) attachées au dessous de la table et directement contre le bord de l’étagère supérieure. Fixez avec des vis une autre étagère de mêmes dimensions directement sur le sol sous la table. Laissez la pompe (voir Tableau des matériaux) reposer directement sur la surface inférieure de l’étagère tandis que le réservoir se trouve sur la surface supérieure. Ce système est illustré à la figure 1.
REMARQUE: La sortie d’eau du réservoir est alimentée par gravité et tous les tubes, à l’exception de ceux qui entrent et sortent du réservoir, doivent être inférieurs au fond du réservoir pour assurer une pression maximale de la tête de drainage.

Figure 1 : Configuration du réservoir Octopus. Entrée et sortie d’eau (a). Trois réservoirs de poulpe d’une superficie de 1,22 m x 0,3 m (b) chacun. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Percez un seul trou de 13/4 pouces, à 2 pouces de l’un des côtés du réservoir, à l’aide de forets de coupe de verre. Le bas de l’écran d’aspiration de sortie d’eau déterminera l’élévation du trou de sortie comme indiqué sur le côté droit de la figure 2a. Le niveau d’eau sera déterminé par l’écran d’aspiration et devra être à au moins 6 pouces du haut du réservoir, ce qui permettra une zone d’éclaboussures d’eau.
- Utilisez un apprêt en PVC et du ciment pour connecter les sections en permanence. Pour ce faire, faites d’abord glisser l’extrémité du tuyau en PVC mâle prévu dans l’extrémité du tuyau femelle. Placez un morceau de ruban adhésif de peintre à l’extérieur de la partie masculine qui est encore visible pour empêcher l’apprêt et le ciment de montrer à l’extérieur du tuyau. Séparez les pièces après le ruban adhésif et placez une légère couche d’apprêt à l’extérieur du tuyau mâle après l’application du ciment dans la même zone.
- Réajustez le tuyau mâle dans le tuyau femelle, dès que possible, après l’application de ciment et retirez le ruban adhésif. 24 h après l’application de l’apprêt et du ciment, laver les pièces nouvellement connectées avec de l’eau DI. Pour le temps de durcissement, regardez le produit de ciment pour plus d’instructions.
REMARQUE: Assurez-vous que la configuration de tous les tubes et de l’équipement est correctement placée avant d’utiliser un apprêt et du ciment en PVC; les exigences en matière de longueur de tuyau peuvent varier. - Ensuite, connectez en permanence l’extrémité de diamètre extérieur (OD) de 1 pouce de l’écran d’aspiration à l’extrémité de diamètre intérieur (ID) de 1 pouce de l’articulation du coude. Connectez l’extrémité du joint du coude à un tube en PVC droit (1 pouce OD). Connectez l’autre côté du tube droit puis à l’ID de 1 pouce de la prise femelle de l’adaptateur droit à paroi traversante.
REMARQUE: ID fait référence à la distance la plus large entre les parois intérieures du tuyau. OD fait référence à l’extérieur de la largeur du tube. - Connectez en permanence l’adaptateur droit à paroi traversante à un tuyau en PVC droit de 4 pouces de long avec un OD de 1 pouce (à partir de l’étape 1.8). Ce tuyau fera face à l’extérieur du réservoir.
- Connectez en permanence le tuyau droit au centre du connecteur en PVC (1 pouce en forme de TEE ID; à partir de l’étape 1.9). Ensuite, connectez en permanence deux tuyaux de 6 pouces de long (partie #69) (1 pouce OD) aux deux extrémités opposées du connecteur de départ - l’un orienté directement vers le haut pour la libération d’air et l’autre directement vers le bas pour l’écoulement de l’eau.
- Connectez en permanence le tuyau droit étendu vers le bas (à partir de l’étape 1.10) à un adaptateur droit de tuyau barbelé à douille femelle (ID de 1 pouce). Fixez un tube en caoutchouc de 36 pouces de long (ID de 3/4 de pouce) à l’adaptateur de tuyau barbelé.
- Placez le système de refroidissement entre le tuyau de sortie d’eau et le système de puisard.
- Fixez les raccords de barbe de 3/4 de pouce fournis avec le système aux ports d’entrée et de sortie de l’unité de refroidissement. Placez le tube en caoutchouc (à partir de l’étape 1.11) sur le raccord d’entrée du refroidisseur.
- Connectez un nouveau morceau de tube ID de 3/4 de pouce (à partir de l’étape 1.13) de la sortie du refroidisseur (à partir de l’étape 1.12) à l’entrée du système de puisard, comme illustré à la figure 2b.
- Ensuite, placez le filtre à chaussettes de 4 pouces x 12 pouces, avec une taille de pore de 200 μm, dans sa zone désignée, comme illustré à la figure 2. De plus, comme illustré à la figure 2, placez l’écumeur de protéines et la pompe de retour dans les zones appropriées. Avec la pompe de retour, fixez la vanne à flotteur automatique à la paroi intérieure de la zone de la pompe, à 2 pouces au-dessus du sommet de l’entrée d’eau de la pompe; ne bloquez pas le retrait de la pompe du réservoir, si nécessaire.
- Connectez en permanence un tube droit de 12 pouces de long (3/4 de pouce OD) à la sortie de la pompe (à partir de l’étape 1.15). À l’autre extrémité du tube droit OD de 3/4 de pouce, connectez en permanence l’OD du tube à un joint de coude ID 45° de 3/4 de pouce. À l’autre extrémité du joint, connectez en permanence un tube OD de 3/4 de pouce.
- Fixez l’autre extrémité du tube droit (à partir de l’étape 1.16) à l’ID de 3/4 de pouce d’un adaptateur réducteur droit. Connectez en permanence l’extrémité plus grande de l’adaptateur (OD de 2 pouces) à l’entrée de la lumière UV.
REMARQUE: Les longueurs de tubes droits peuvent varier. - Ensuite, faites correspondre le placement de l’entrée de lumière UV avec le tuyau de sortie de la pompe (à partir de l’étape 1.17) afin que le tuyau ne se plie pas entre la lumière et la pompe (à partir de l’étape 1.15). Percez des trous dans l’orthèse de stabilisation pour correspondre aux trous de fixation de la lumière UV. Faites correspondre la taille des vis avec le foret et fixez la lumière UV à la table à l’aide des vis données.
- Connectez en permanence le côté 2 pouces d’un autre adaptateur réducteur à la sortie de la lumière UV (à partir de l’étape 1.18). Fixez un OD de 1 pouce d’un tube droit de 5 pouces de long à l’ID de 1 pouce de l’adaptateur. Ensuite, connectez une pièce d’angle de 90 ° avec l’ID de 1 pouce au tube OD de 1 pouce; avoir l’extrémité non attachée de la pièce d’angle pointant vers le côté du réservoir où l’apport d’eau est destiné à aller (même côté qu’à l’étape 1.5).
- Connectez en permanence l’autre extrémité du coin (à partir de l’étape 1.19) à un tube de 6 pouces de long (partie #69) ayant un OD de 1 pouce avec l’entrée de l’unité de contrôle du débit (partie #2). Connectez en permanence un autre tube OD de 1 pouce (pièce n ° 69) à la sortie de l’unité de surveillance du débit; la longueur doit s’étendre au moins 3 pouces au-delà du côté du réservoir.
- À l’aide d’un foret de coupe de verre de 13/4 pouce (partie #1), coupez un nouveau trou à 3 pouces au-dessus de la ligne de flottaison prévue et à 2 pouces du côté du réservoir (Figure 1a) du côté opposé à celui ayant un trou de sortie d’eau. Fixez un autre raccord de cloison à paroi traversante avec un glissement de 1 pouce (partie #77) face à l’extérieur du réservoir.
- Au glissement de la cloison, connectez un tube droit avec le 1 pouce OD et 4 pouces de longueur (partie #69) en permanence. Coupez le tube de la dernière partie de l’étape 1.21 pour correspondre à la distance que ce tube s’étend du réservoir. Connectez en permanence un tube à 90 ° (partie n ° 65) à chacun des tuyaux ouverts et coupez un dernier tube droit OD de 1 pouce (partie n ° 69) qui relie en permanence les deux pièces d’angle.
REMARQUE: La figure 3 montre une représentation simple du système d’aquarium. - Installez le reste du système de commande (partie #34), en montant d’abord la multiprise (partie #53) sur la table elle-même ou sur un mur voisin. À côté de lui se trouve le module de surveillance des fluides (Partie #2).
- Connectez le capteur de débit, la multiprise et les capteurs de détection de fuite au module. Installez le feu de croissance (partie #26) qui est attaché au bac à algues (Figure 2).
- Branchez le capteur de débit, la lumière UV, la lumière de croissance, la pompe et l’écumeur de protéines à la barre d’énergie. Configurez la programmation du système de contrôle de l’eau conformément au manuel du fabricant.
- Préparez de l’eau salée en mélangeant une demi-tasse de mélange de sel disponible dans le commerce avec 1 gallon d’eau d’osmose inverse (OI) ou désionisée (DI). Faites 45 gallons pour remplir complètement un réservoir et un système de puisard.
- Allumez la pompe dans le régulateur de débit du système de puisard et continuez à ajouter de l’eau salée jusqu’à ce que la vanne de dérivation automatique soit en position d’arrêt, de sorte qu’aucune eau douce supplémentaire n’est nécessaire.
- Une fois que l’eau est pleine, arrêtez le remplissage et allumez l’unité de refroidissement à l’eau pour régler la température entre 18 °C et 22 °C, car il s’agit de la plage de température préférable53. Allumez l’écumeur de protéines.
- Ajouter 30 kg de corail broyé au fond du réservoir ainsi qu’une couche de corail broyé au fond du bac à algues. Ajoutez plusieurs roches vivantes et tout autre ajout à l’environnement de la pieuvre. Placez un dessus pour couvrir l’ouverture du réservoir.
REMARQUE: Les roches vivantes sont des coraux morts qui sont habités par la vie marine macroscopique telle que les bactéries et les algues. - Ajouter les bactéries nitrifiantes utilisées dans les aquariums d’eau salée comme indiqué sur l’emballage. Continuez à l’ajouter comme indiqué, en vérifiant quotidiennement la température, la salinité, le pH, l’ammoniac, le nitrite et le nitrate avec des kits de test d’eau, un capteur de pH et un capteur de température. Les valeurs sûres pour les niveaux d’ammoniac, de nitrite et de nitrate sont inférieures à 0,5 ppm, 0,25 ppm et 10 ppm respectivement58.
- Assurez-vous que la lumière UV est éteinte pendant les jours où des bactéries nitrifiantes sont ajoutées pour permettre aux micro-organismes d’eau salée de se développer. Une fois que les paramètres sont dans des plages de sécurité, la lumière UV peut être réactivée.
- Une fois le système établi, vérifiez également que le pH et l’oxygénation sont à 8,0-8,4 et
 59, respectivement. Avant d’ajouter des animaux à l’aquarium, vérifiez la présence de cuivre et d’oxygène dans le système à l’aide d’un kit d’analyse de l’eau en cuivre.
59, respectivement. Avant d’ajouter des animaux à l’aquarium, vérifiez la présence de cuivre et d’oxygène dans le système à l’aide d’un kit d’analyse de l’eau en cuivre.
REMARQUE: Le cuivre cause des dommages aux invertébrés et interfère avec l’osmorégulation dans les branchies des poissons60,61. - Si du cuivre se trouve dans l’eau, testez la source d’eau DI/RO. Après avoir déterminé que la source d’eau ne contient pas de cuivre, effectuez un changement d’eau de 30% et placez le bloc de charbon actif (partie #46) dans l’eau. Si le problème persiste, effectuez un changement d’eau complet et nettoyez toutes les pièces.
- Une fois que tous les paramètres de l’eau ont été déterminés à des niveaux sûrs, ajoutez 10 crevettes fantômes dans le système au moins une semaine avant d’ajouter les pieuvres. Cela aidera à introduire de la biomasse pour les bactéries et indiquera la qualité globale de l’eau.
- Ajoutez des habitants supplémentaires de l’écosystème de l’aquarium au bac à algues. Cela inclut Chaetomorpha spp. (algue spaghetti), Trochus Sp. (escargot trochus à bandes) et Mercenaria mercenaria (palourdes en cerisier).

Figure 2 : Système de puisard. Vue latérale du système de puisard (a). Vue de dessus du système de puisard (b). Veuillez cliquer ici pour voir une version agrandie de cette figure.
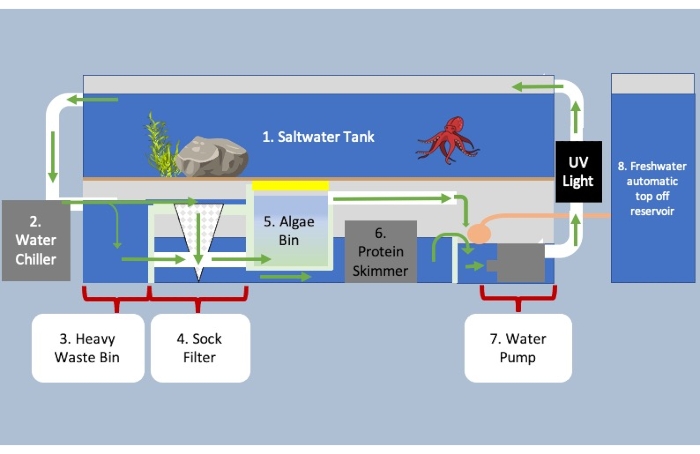
Figure 3 : Aquarium avec système de filtrage du puisard sous le réservoir et les unités de contrôle de l’environnement. Les flèches vertes indiquent la direction de l’écoulement de l’eau dans le système. L’eau s’écoule de la section un à la section deux pour le refroidissement et sur la troisième pour séparer la matière biologique lourde de la matière plus légère. Les déchets lourds flottent vers le bas et vers la section cinq, tandis que la plus petite matière biologique s’écoule dans le filtre à chaussettes de la section quatre. L’eau s’écoule de quatre sous la section cinq entrant dans l’écumoire de protéines en six pour éliminer les déchets restants dans l’eau. Le bac à algues contient des micro-organismes pour décomposer les déchets, l’ammoniac et les nitrates ainsi que pour oxygéner l’eau. Dans la dernière partie du système, plus d’eau est ajoutée pour tenir compte de l’évaporation avant d’être pompée dans le réservoir. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Réservoirs de stockage
- Installez deux grands réservoirs de stockage d’eau de 60 gallons, l’un pour l’eau salée et l’autre pour l’eau d’osmose inverse. Assurez-vous que la ligne de remplissage maximale du réservoir d’eau douce est plus haute que la table. Fixez un tube de 1/4 de pouce au sommet automatique de la vanne à flotteur dans le système de puisard et fixez l’autre extrémité du tube au fond du réservoir d’eau douce.
REMARQUE: Il s’agit de remplir si l’eau s’évapore. Le sel restera dans l’eau. - Remplissez le réservoir d’eau salée avec de l’eau et ajoutez la quantité proportionnelle de sel au réservoir. Aérer en continu le réservoir de stockage d’eau salée pour le mélange et l’oxygénation appropriée. Attendez une heure avant utilisation pour assurer un mélange complet du sel.
REMARQUE: Le réservoir d’eau salée est utile pour remplir les réservoirs après le nettoyage.
3. Configuration du réservoir de nourriture
- Pour garder les crevettes en vie pendant plus d’une semaine, conservez-les dans un réservoir séparé de la pieuvre avec une salinité inférieure à 30 ppt et une température proche de 25 ° C.
- Pour ce faire, une semaine après la maturation des réservoirs de poulpe, transférez 8 gallons d’eau salée mûrie dans le réservoir de crevettes. Ajouter 15 kg de corail broyé au fond du réservoir. Ajoutez quelques roches vivantes au réservoir pour les cachettes de mue (Figure 4).
REMARQUE: L’eau de mer mature fait référence au processus permettant aux bactéries marines de se développer dans l’eau salée, comme indiqué à l’étape 1.30. - Fixez un filtre cannister au bord du réservoir. Configurez le filtre cannister selon les instructions du fabricant. Ajoutez une pompe à air à côté du réservoir relié à un tube avec une pierre à air attachée dans le réservoir.
- Nettoyez le filtre et changez les tampons filtrants chaque semaine. En outre, 25% de l’eau devra être changée en même temps. Vérifiez quotidiennement les paramètres d’azote, de pH et de température dans les réservoirs alimentaires à l’aide de kits d’analyse de l’eau décrits à l’étape 1.30. Si les paramètres d’azote de l’eau restent élevés, effectuez des changements d’eau supplémentaires et ajoutez un sac absorbant d’azote à l’eau; ou si les problèmes persistent plus d’un mois, les crevettes devront être déplacées dans un réservoir plus grand.
- Ajouter des crevettes dès que les sédiments coralliens broyés sont dissipés. Pour ajouter d’abord des crevettes, à l’arrivée, déplacez les crevettes sans expédier d’eau dans le petit réservoir d’eau salée pendant 5 minutes pour éliminer les biodéchets. Ensuite, les crevettes peuvent être ajoutées directement au réservoir. Les poissons moustiques, à l’arrivée, peuvent être ajoutés directement à l’aquarium de crevettes.
REMARQUE: Les crevettes et les poissons moustiques peuvent être achetés auprès de tout fournisseur commercial d’animaux vivants indiqué sur la feuille de matériau ou d’autres fournisseurs d’aliments. Il est également possible de proposer des poulpes de crevettes décongelées. - Nourrissez les crevettes et les poissons avec des flocons de poisson, de la végétation morte ou des algues62, comme indiqué dans les instructions alimentaires.
- Pour le réservoir de crabe, ajoutez 1 gallon d’eau salée et 10 kg de cailloux. Empilez les cailloux d’un côté en laissant la terre ferme d’un côté et 2 cm d’eau salée de l’autre côté (comme indiqué à la figure 4). Les paramètres environnementaux optimaux de l’eau pour ces invertébrés devraient être de 30-35 ppt et de 22-25 °C pour la salinité et la température11,63, respectivement.
- Ajouter les crabes violoneux directement dans le réservoir (Figure 4). Les crabes passeront la majeure partie de leur vie sur terre, mais peuvent être sous l’eau pendant quelques jours à la fois, ce qui rend le réservoir partiellement sous l’eau crucial pour leur survie à long terme.
- Nourrissez les crabes violoneux une fois par jour en ajoutant des flocons de poisson dans le plat sur la zone sèche de l’aquarium. Nettoyez chaque semaine en enlevant les crabes et en changeant 100% de l’eau salée. Nettoyez les cailloux.
- Entreposer les mollusques bivalves marins (palourdes et moules) dans les réservoirs d’eau salée pour que les pieuvres puissent s’ouvrir et fournir un autre mécanisme de filtrage de l’eau64.
- Placez les moules dans un réservoir séparé inoccupé pendant la première semaine pour éviter de placer une charge de déchets inutile sur le système de filtrage du réservoir de poulpe.
REMARQUE: Bien que les moules aient été la nourriture de choix de la pieuvre, elles sont plus susceptibles de mourir peu de temps après leur arrivée et augmenteront considérablement les déchets biologiques dans le réservoir si elles sont présentes en grande quantité.
4. Introduction de la pieuvre dans le réservoir
- Assurez-vous que les niveaux d’ammoniac, de nitrite et de nitrate sont inférieurs à 0,5 ppm, 0,25 ppm et 10 ppm respectivement. Ayez une pompe à main à eau disponible pour retirer l’encre de pieuvre du réservoir. Il est également recommandé d’avoir deux personnes pour cette procédure.
- À l’arrivée, placez le sac sur la balance et soustrayez le poids du sac après le retrait de la pieuvre. Ajoutez une pierre à air au sac pour augmenter l’oxygénation de l’eau tout en transférant l’animal dans son réservoir. Mesurez la température et la salinité de l’eau d’expédition. Enregistrer les cas de maladie prolongée après l’expédition.
- Sans transférer d’eau du sac au réservoir, suspendez le sac de transport au-dessus du coin du réservoir avec le sac partiellement immergé dans l’eau du réservoir pour commencer à changer la température du sac de transport. Retirez 10% de l’eau du sac et déversez-la dans l’évier. Ajoutez la même quantité d’eau du réservoir au sac. Répétez toutes les 10 minutes jusqu’à ce que la température de l’eau dans le sac ne soit pas différente de plus de 1 ° de la température de l’eau dans le réservoir.
- Une fois que la différence de température du sac et du réservoir est inférieure à 1°, assurez-vous que des gants sont portés pour déplacer les pieuvres vers leur réservoir individuel. Pour bouger, placez les deux mains sous la pieuvre pour fournir un soutien pendant le transfert; la deuxième personne devra tirer doucement les bras aspirés du côté du sac.
- Une fois que la pieuvre est sortie du sac, déplacez-la rapidement dans l’eau de son nouvel habitat en transférant le moins d’eau possible du sac d’expédition. Utilisez la pompe à main pour retirer toute encre que la pieuvre libère lorsqu’elle est dans le réservoir. Maintenant, pesez le sac avec de l’eau pour obtenir le poids approximatif de l’animal.
- Pendant les 2 premières semaines après son arrivée, surveillez la consommation quotidienne de la pieuvre qui devrait être d’environ 4% à 8% de son poids58,65,66. La pieuvre doit être vérifiée quatre fois par jour; cela peut être réduit à deux fois par jour après 2 semaines. Peser toutes les deux semaines pour ajuster leur consommation alimentaire au besoin.
REMARQUE: Certaines espèces de poulpes sont connues pour s’échapper de leur réservoir, il est donc conseillé de placer un poids de 2,5 kg sur le couvercle de leur réservoir.
5. Soins quotidiens
- À l’aide d’un kit d’analyse de pH, d’ammoniac, de nitrite et de nitrate disponible dans le commerce, ajoutez la quantité d’eau de réservoir dirigée par le kit aux quatre tubes à essai fournis avec le kit. Comme spécifié sur le kit de test, ajoutez la quantité de réactif colorimétrique au tube correspondant.
- Si les niveaux d’ammoniac, de nitrite et de nitrate sont supérieurs à 0,5 ppm, 0,25 ppm et 10 ppm respectivement, lavez la biomasse du filtre à chaussettes ou changez pour un nouveau filtre à chaussettes. De plus, nettoyez la biomasse du haut de l’écumoire avec une brosse et ajoutez des bactéries dénitrifiantes supplémentaires au réservoir. Si les problèmes persistent, remplacez 25% de l’eau salée douce.
REMARQUE: Les étapes ci-dessus réduisent les composés azotés dans l’écosystème. - Retirez toutes les carcasses de crabes et de crevettes morts du réservoir ainsi que toute matière fécale de poulpe à l’aide d’une pompe à main. Retirez tous les crabes vivants restants du réservoir et replacez-les dans le réservoir de stockage. Ensuite, réorganisez les gros objets dans le réservoir.
- Introduisez la moitié du nombre de crabes que la pieuvre mangerait quotidiennement dans le réservoir pesant 1,25 +/- 0,25 g. Nourrissez les crevettes décongelées ou les petits crabes violoneux mâles avec les pieuvres juvéniles. Selon l’expérience, les crabes et les crevettes peuvent être introduits n’importe où dans le réservoir ou directement dans la pieuvre.
REMARQUE: La consommation alimentaire quotidienne des pieuvres est de 4% à 8% de leur poids67. Les crevettes congelées peuvent également être fournies comme source de nourriture en fonction du poids de la pieuvre. - Offrez cinq crevettes fantômes par jour. En moyenne, trois ont été consommés dans cette expérience. Pour fournir une variété de nourriture à la pieuvre, donnez une palourde ou une moule vivante une fois par semaine et maintenez toujours trois poissons moustiques à l’intérieur de l’aquarium.
REMARQUE: Donner aux animaux une variété de nourriture n’est pas nécessaire et peut empêcher les animaux d’être attirés par la nourriture pendant les expériences. Le programme d’alimentation utilisé ici pour surveiller au mieux l’alimentation et le comportement des poulpes consiste à introduire la moitié du nombre de crabes en fonction du poids et à augmenter le nombre de crevettes à cinq heures du matin. Dans la soirée, introduisez la deuxième moitié des crabes dans le réservoir.
6. Assainissement hebdomadaire
- Éteignez les lumières de l’écumeur, de la pompe et du bac à algues avant de nettoyer le système de puisard. Ensuite, éteignez la vanne automatique du système avant de retirer l’eau. Enfin, retirez l’écumoire et toute l’eau uniquement du système de puisard.
- Frottez légèrement le bac à algues pour éliminer la majeure partie de la biomasse de ses murs. Nettoyez le reste de la zone de puisard avec une brosse. Retirez le filtre à chaussettes, nettoyez-le avec du vinaigre et laissez-le sécher; alternez avec un autre filtre à chaussettes chaque semaine en remplaçant par de nouveaux tous les trois mois. Retirez et nettoyez la biomasse du haut de l’écumoire chaque semaine.
REMARQUE: Évitez d’utiliser du métal pour nettoyer le plastique, car il créerait des rayures qui pourraient être sujettes à la croissance microbienne. - Remettez l’écumeur dans le système et commencez à le remplir d’eau salée. Lorsque la zone de la pompe commence à se remplir, tous les systèmes peuvent être rallumés. Arrêtez d’ajouter de l’eau lorsque le haut automatique de la vanne à flotteur est en position d’arrêt.

Figure 4 : Réservoir pour crabes violoneux (Minuca pugnax). Le fond du réservoir est à moitié désigné pour le lit sec et l’autre moitié pour 2 cm d’eau salée peu profonde. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Réservoir pour crevettes fantômes (Palaemonetes paludosus). Les roches dans le réservoir de crevettes fournissent des endroits pour que les crevettes se cachent et muent ainsi que pour la croissance de micro-organismes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
7. Soins aux animaux malades
- Suivez le guide reference66 pour évaluer le bien-être des poulpes.
REMARQUE: Pour les pieuvres femelles, la fin du cycle de vie commence normalement après la ponte. L’animal commencera à diminuer sa consommation de nourriture et cessera complètement de manger et deviendra plus léthargique. La durée de vie après le processus de fin de vie varie. Aucune autre mesure ne peut être prise, si ce n’est l’alimentation et la surveillance de l’animal. Les mâles sénescents diminueront leur consommation alimentaire et deviendront léthargiques68.
8. Anesthésie par poulpe
- Effectuer une anesthésie de poulpe comme détaillé dans Butler-Struben et al.69.
- Procurez-vous un récipient de 6 L avec un couvercle d’au moins 15 cm de haut. Placez 4 L d’eau directement du réservoir de la pieuvre dans le récipient et aérez 4 L d’eau salée à l’aide d’une petite pompe à air avec de la pierre à air pour disséminer l’oxygène dans l’environnement aquatique58.
- Avant l’introduction de la pieuvre, ajoutez 1% d’EtOH au récipient. Avant de manipuler la pieuvre, enregistrez le nombre de respirations par minute en comptant l’expiration de l’eau du siphon.
REMARQUE: Pour les pieuvres dans le laboratoire du chercheur, la respiration de base est de 16 à 24 respirations par minute. - Avant de déplacer la pieuvre, enregistrez la pigmentation de la peau de la pieuvre et la fréquence respiratoire de base. Retirez la pieuvre du réservoir à l’aide d’un récipient propre à bouche ouverte de 4 L en la ramassant avec l’eau environnante.
REMARQUE: Pendant l’anesthésie, les fréquences respiratoires n’indiquent pas nécessairement une anesthésie complète. - Pesez la pieuvre dans le récipient, puis déplacez-la en plaçant les deux mains autour du corps de la pieuvre et en la soulevant. Une deuxième personne peut être nécessaire pour retirer les membres aspirés des parois du conteneur.
- Déplacez rapidement la pieuvre dans le récipient préparé avec 1% d’EtOH. Fermez le couvercle pour éviter une éventuelle fuite.
- Enregistrez la respiration de la pieuvre par minute en comptant l’expiration de l’eau du siphon à la fin des 5 premières minutes. Si la respiration reste au-dessus de la ligne de base et que l’animal continue de réagir à un léger pincement, ajoutez 0,25 % d’EtOH supplémentaire à l’eau. L’ajout d’éthanol à l’eau peut se poursuivre jusqu’à un maximum de 3% EtOH.
REMARQUE: Une indication que la pieuvre est inconsciente est sa perte de contrôle de ses chromatophores. Dans ce cas, la peau semble plus pâle que la normale. Une autre indication est de pincer légèrement les bras et de tester s’il y a une réponse motrice. S’il n’y a toujours pas de réponse à ce stade, la pieuvre est inconsciente et des expériences peuvent être effectuées. - Sous anesthésie, surveillez la respiration et la couleur de la pieuvre pour vous assurer qu’elle reste inconsciente pendant toute la durée de la procédure. Si la pieuvre commence à se réveiller pendant la procédure, ajoutez 0,25% EtOH supplémentaire.
- Pour inverser les effets de l’anesthésie à l’éthanol, transférez la pieuvre dans un nouveau réservoir d’eau oxygénée de 4 L ou plus à partir de son réservoir de rétention permanent. Une fois que les respirations reviennent à la normale, la pieuvre devient active et sa peau revient à des pigments normaux; il peut être replacé dans son réservoir.
9. Euthanasie du poulpe
- Suivez les normes internationales pour l’euthanasie du poulpe telles que détaillées dans Fiorito et al., Moltschaniwskyj et al., et Butler-Struben et al57,58,69.
- Préparez un nouveau récipient de 6 L avec 4 L d’eau du réservoir de rétention de la pieuvre. Mélanger dans MgCl2 à une concentration de 4% dans le réservoir d’euthanasie. Effectuez des étapes de 8,1 à 8,9 pour anesthésier la pieuvre.
- Déplacez la pieuvre après l’étape 8.8 vers le réservoir d’euthanasie. Après l’arrêt de la respiration, attendez 5 minutes et effectuez une décérébration de la pieuvre ou gardez dans le réservoir d’euthanasie pendant 5 minutes supplémentaires.
10. Comportement de O. bimaculoides
- Ne nourrissez pas la pieuvre le matin où elle sera entraînée à utiliser un récipient à bouchon à vis. Installez un appareil d’enregistrement par caméra pointant vers la zone destinée à l’alimentation.
- Obtenez un tube à bouchon à vis de 50 mL avec des trous de 1 mm de diamètre sur toute la surface et le bouchon pour l’écoulement de l’eau dans tout le récipient. Placez un crabe violoneux dans le récipient. Placez un poids à l’intérieur du conteneur ou attaché à l’extérieur pour qu’il reste au fond du réservoir.
- Placez le récipient au fond du réservoir dans la zone ouverte et à la vue de la pieuvre et de la caméra. Si le crabe n’a pas été mangé après 4 h, retirez-le de la sonde et reprenez le programme d’alimentation pour la journée. Continuez à effectuer cet exercice tous les jours.
REMARQUE : Ceci est illustré à la figure 6 et discuté dans la section des résultats représentatifs.
11. IRM du poulpe
NOTE : Auparavant, les réponses IRM fonctionnelles évoquées dans la rétine de la pieuvre étaient mesurées chez des animaux anesthésiés70. Ici, nous avons obtenu une IRM à ultra-haute résolution spatiale du système nerveux de la pieuvre qui a nécessité des heures de balayage. Ainsi, cela a été réalisé dans un O. bimaculoides euthanasié.
- Obtenez des images IRM à l’aide d’un système 7T. Enveloppez la pieuvre dans une pellicule de plastique polychlorure de vinyle de qualité cuisine pour maintenir l’hydratation des tissus. Placez la pieuvre sur l’enveloppe, glissez les extrémités, puis roulez pour sceller.
- Utilisez une bobine d’émission/réception de volume de 4 cm de diamètre pour acquérir des images du cerveau et de plusieurs bras. Utilisez la séquence RARE pondérée T1 avec les paramètres suivants : Temps de répétition (TR) de 1500 ms, temps d’écho (TE) de 20 ms, résolution de 117 x 117 x 500 μm, moyennes 100, facteur RARE 8. Ce sont des paramètres IRM typiques pour l’imagerie du cerveau des rongeurs. L’utilisation d’un facteur RARE rend l’imagerie plus rapide, tandis que 100 images sont moyennées ensemble pour augmenter le rapport signal/bruit71.
- Imagez le bras de poulpe à l’aide d’une bobine d’émission de volume de 86 mm et d’une bobine de réception à 4 canaux de 4 x 4 cm. Coupez un bras à l’aide de ciseaux chirurgicaux et placez-le dans un tube conique de 15 mL rempli de solution saline tamponnée au phosphate.
REMARQUE: La séquence était une séquence de récupération d’inversion T1_weighted (MP-RAGE) avec des paramètres: TR / TE = 4000 / 2,17 ms, délai d’inversion 1050 ms, résolution 100 x 100 x 500 μm, 9 moyennes, temps de balayage 1,5 h (Figure 7). Une séquence d’inversion-récupération annule le signal de l’eau et augmente le contraste dans l’image; cette séquence a été choisie car elle permet de visualiser l’anatomie interne du bras72.
12. Imagerie par cryo-tomographie par fluorescence (CFT)
- Gelez la pieuvre : Travaillez dans une hotte. Couvrez le fond d’un Dewar avec de la glace sèche, puis remplissez-le d’hexanes. Abaissez lentement la pieuvre dans les hexanes pendant environ 10 minutes, en ajoutant des hexanes frais et de la glace carbonique au besoin pour couvrir complètement la pieuvre avec des hexanes froids. Conserver la pieuvre congelée à -20 °C jusqu’à ce qu’elle soit encastrée.
- Intégrer et sectionner la pieuvre: Créez un moule rectangulaire de la taille appropriée pour maintenir la pieuvre à l’aide des outils fournis par le fabricant cft. Couvrir le fond du moule avec un support OCT (température de coupe optimale) (matériau standard utilisé dans les laboratoires d’histologie) et laisser geler en un gel semi-solide.
- Placez la pieuvre congelée dans la couche de gel de l’OCT, puis couvrez lentement avec de l’OCT en 2-3 couches. Entre les étapes de coulée, congelez les étapes du bloc jusqu’à ce que l’OCT soit au stade du gel. Une fois la pieuvre entièrement recouverte, congeler le bloc pendant au moins 12 h à -20 °C.
- Chargez l’échantillon dans le système de tomographie par cryofluorescence73.
- Découpez et imagez l’ensemble des O. bimaculoides euthanasiés à résolution mésoscopique à l’aide de 3 filtres d’émission/excitation, produisant ainsi plusieurs ensembles de données isotropes 3D.
- Lorsque la section atteint le bras et le système digestif, transférez les sections sur les lames pour une histologie plus approfondie.
- Chargez le jeu de données brut dans le logiciel de reconstruction du fournisseur CFT spécialement conçu pour permettre un traitement rapide.
- Reconstruisez une pile en 3 dimensions à l’aide de l’alignement des repères, de l’équilibrage de l’histogramme et des corrections et normalisations de fluorescence, y compris l’élimination des effets de fluorescence du sous-sol pour chaque longueur d’onde.
- Une fois que la pile 3D finale est produite par l’outil de reconstruction, visualisez les données avec l’outil logiciel d’imagerie et créez des survols avec des superpositions de lumière blanche et de fluorescence ainsi que des projections d’intensité maximale 3D (3D-MIPS), par exemple, la figure 873.
Résultats
Tous les animaux de nos études ont été obtenus dans la nature, et donc leur âge exact n’a pas pu être déterminé et leur séjour en laboratoire était variable. L’état de poulpe a été observé quotidiennement. Nous n’avons pas vu de parasites, de bactéries, de lésions cutanées ou de comportements anormaux. Le poids moyen des animaux était de 170,38 +/- 77,25 g. Chaque animal habitait son propre réservoir de 40 gallons. L’écart-type moyen ± pour les paramètres enregistrés pour un réservoir sur u...
Discussion
Configuration du système :
L’écosystème de l’aquarium a été développé de manière à ce que des méthodes mécaniques et biologiques de filtrage et d’oxygénation de l’eau soient utilisées. Les éléments filtrants du système utilisent des filtres à chaussettes, des écumeurs de protéines et un nettoyage régulier pour maintenir les niveaux d’azote et d’oxygène. Plus important encore, nous comptons également sur les micro-organismes marins pour consommer les composés azotés ...
Déclarations de divulgation
Tous les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Ce travail a été soutenu par NIH UF1NS115817 (G.P.). G.P. est partiellement soutenu par les subventions des NIH R01NS072171 et R01NS098231. Nous tenons à remercier Patrick Zakrzewki et Mohammed Farhoud d’Emit Imaging pour leur aide et leur soutien dans la collecte et la visualisation des données sur la plate-forme xerra Imaging. MSU a un accord de recherche avec Bruker Biospin.
matériels
| Name | Company | Catalog Number | Comments |
| 1-3/4 in. Drill Bit | Home Depot | 204074205 | Glass cutting tool Part number:1 |
| 1" flow sensors | Neptune Systems | Local Dealer | Pipe with sensor to measure water flow Part number:2 |
| 1" Slip Bulkhead Strainer | Bulk Reef Supply | 207113 | Strainer for water leaving tank Part number:3 |
| 10 gallon tank | Preuss Pets | Local Dealer | Fiddler crab holding tank Part number:4 |
| 4 inch X 12 inch 200 Micron Nylon Monofiliment Mesh Filter Sock w/ Plastic Ring | AQUAMAXX | UJ41171 | Filter for large organic matter in sump Part number:5 |
| 40 gallon aquarium | Preuss Pets | Local Dealer | 4 Food aquarium tanks Part number:6 |
| 60g poly tanks - rectangle | Preuss Pets | Local Dealer | 2 Water Storage (salt and freshwater) Part number:7 |
| Active Aqua 1/10th HP Hydroponic or Aquarium Chiller 2018 Model | WayWe | 719574198463 | For cooling water continuously Part number:8 |
| ALAZCO 2 Soft-Grip Handle Heavy-Duty Tile Grout Brush | ALAZCO | B06W2FT5V5 | Tank Cleaning Part number:9 |
| Ammonia Testing Kit | Aquarium Pharmaceuticals | 33D | For water testing Part number:10 |
| Apex system WiFi | Neptune Systems | Local Dealer | System connection for off site monitoring Part number:11 |
| API Aquarium Test Kit | Amazon | B001EUE808 | For water testing Part number:12 |
| API Copper Test Kit | Amazon | B0006JDWH8 | For water testing Part number:13 |
| Aqua Ultraviolet Classic UV 25 Watt Series Units | Aqua Ultraviolet | A00028 | For removing bacteria leaving sump system Part number:14 |
| AquaClear 50 Foam Filter Inserts, 3 pack | Aquaclear | A1394 | Food Tank Carbon Filter Inserts Part number:15 |
| Aqueon QuietFlow LED PRO Aquarium Power Filter 30 | Aqueon | 100106082 | Food tank filtering units Part number:16 |
| Auto Top Off Kit (ATK) (Each includes 1 FMM module, 2 optical sensors and 1 float) | Neptune Systems | Local Dealer | For freshwater tank Part number:17 |
| Automatic top off from RODI (LLC) | Neptune Systems | Local Dealer | From water storage to octopus tanks Part number:18 |
| Banded Trochus Snail | LiveAquaria | CN-112080 | For algae bin Part number:19 |
| Chaetomorpha Algae, Aquacultured | LiveAquaria | BVJ-76354 | For algae bin Part number:20 |
| Clams - Live, Hard Shell, Cherrystone, Wild, USA Dozen | Fulton Fish Market | N/A | Live food Part number:21 |
| Classic Sea Salt Mix - Tropic Marin | Bulk Reef Supply | 211813 | Salt for tank water Part number:22 |
| Clear Masterkleer Soft PVC Plastic Tubing, for Air and Water, 3/4" ID, 1" OD | McMaster | 5233K71 | Cleaning tool Part number:23 |
| Continuum Aquablade-P Acrylic Safe Algae Scraper W/ Plastic Blade - 15 Inch | Marine Depot | 4C31001 | Cleaning tool Part number:24 |
| Copper Testing Kit | Aquarium Pharmaceuticals | 65L | For water testing Part number:25 |
| Curve Refugium CREE LED Aquarium Light | Eshopps | 6500K | Algae bin light Part number:26 |
| Eheim 1262 return pumps | EHEIM | 1250219 | Pump for storage tanks Part number:27 |
| Eshopps R-100 Refugium Sump GEN 3 | Eshopps | 15000 | Sump system Part number:28 |
| Ethyl Alcohol, 200 Proof | Sigma-Aldrich | 64-17-5 | Anesthesia Part number:29 |
| Extech DO600 ExStik II Dissolved Oxygen Meter | Extech | DO600 | Oxygen measurement Part number:30 |
| Fiddler Crabs; live; dozen | NORTHEAST BRINE SHRIMP | N/A | Live food Part number:31 |
| Filter Cartridges | Aqueon | 100106087 | Food tank filters Part number:32 |
| Florida Crushed Coral Dry Sand - CaribSea | Bulk Reef Supply | 212959 | Sediment for bottom of tank Part number:33 |
| FMM module | Neptune Systems | Local Dealer | Controller for apex system Part number:34 |
| Fritz-Zyme TurboStart 900 - Fritz | Bulk Reef Supply | 213036 | Bacteria start Part number:35 |
| Hand Operated Drum Pump, Siphon, Basic Pump with Spout, For Container Type Bucket, Pail | Grainger | 38Y789 | Water Hand Pump Part number:36 |
| High pH Testing Kit | Aquarium Pharmaceuticals | 27 | For water testing Part number:37 |
| Imagitarium Fine Mesh Net for Shrimp | Petco | 2580993 | Shrimp and fish transfer net Part number:38 |
| Leak Detection Kit (LDK) - Includes FMM module plus 2 ALD sensors | Neptune Systems | Local Dealer | Placed on floor to detect water Part number:39 |
| Lee`S Algae Scrubber Pad Jumbo - Glass | Marine Depot | LE12007 | Cleaning tool Part number:40 |
| Live rocks | Preuss Pets | Local Dealer | Habitat for octopus Part number:41 |
| Long Bottle Cleaning Brush 17" Extra Long | Haomaomao | B07FS7J7PN | Tank Cleaning Part number:42 |
| Magnesium chloride | Sigma-Aldrich | M1028-100ML | Euthanasia Part number:43 |
| Magnetic Probe Rack | Neptune Systems | Local Dealer | For holding apex sensor probes Part number:44 |
| Marine Ghost Shrimp | NORTHEAST BRINE SHRIMP | N/A | Live food Part number:45 |
| Marineland C-Series Canister Carbon Bags Filter Media, 2 count | Chewy | 98331 | For elevated copper levels Part number:46 |
| Nitra-Zorb Bag | Aquarium Pharmaceuticals | AP2213 | Absorbs nitrogen compounds Part number:47 |
| Nitrate Testing Kit | Aquarium Pharmaceuticals | LR1800 | For water testing Part number:48 |
| Nitrite Testing Kit | Aquarium Pharmaceuticals | 26 | For water testing Part number:49 |
| Pawfly 2 Inch Air Stones Cylinder 6 PCS Bubble Diffuser Airstones for Aquarium Fish Tank Pump Blue | Amazon | B076S56XWX | Aerate water Part number:50 |
| Penn Plax Airline Tubing for Aquariums –Clear and Flexible Resists Kinking, 8 Feet Standard | Amazon | B0002563MM | Tubing for connecting air pump to air stone Part number:51 |
| Plumbing with unions/valves plus 3/4" flex hose | Preuss Pets | Local Dealer | Water transport Part number:52 |
| PM1 module | Neptune Systems | Local Dealer | Power control module for apex Part number:53 |
| Protein skimmer | Reef Octopus | AC20284 | Removes biowaste from system Part number:54 |
| PVC Apex Mounting board, grommets, wire mounts | Neptune Systems | Local Dealer | Helps ensure organization for wires and tubing within system Part number:55 |
| PVC Regular Cement and 4-Ounce NSF Purple Primer | Amazon | Oatey - 30246 | For connecting PVC pipes Part number:56 |
| RODI unit | Neptune Systems | Local Dealer | RO Water Part number:57 |
| Salinity Probes | HANNA probes | HI98319 | Measures salinity of water Part number:58 |
| Seachem Pristine Aquarium Treatment | Seachem | 1438 | Provides bacteria that break down excess food, waste and detritus Part number:59 |
| Seachem Stability Fish Tank Stabilizer | Seachem | 116012607 | Seachem Stability will rapidly and safely establish the aquarium biofilter in freshwater and marine systems Part number:60 |
| Set of lexan tops | Preuss Pets | Local Dealer | Aquarium tank lids Part number:61 |
| Set of Various extended length aquabus cables | Neptune Systems | Local Dealer | Cables for Apex system Part number:62 |
| SLSON Aquarium Algae Scraper Double Sided Sponge Brush Cleaner Long Handle Fish Tank Scrubber for Glass Aquariums | Amazon | B07DC2TZCJ | Cleaning tool Part number:63 |
| Standard-Wall PVC Pipe Fitting for Water, 45 Degree Elbow Adapter, 3/4 Socket Female x 3/4 Socket Male | McMaster | 4880K189 | PVC pipe Part number:64 |
| Standard-Wall PVC Pipe Fitting for Water, 90 Degree Elbow Adapter, 1 Socket Female x 1 Socket Male | McMaster | 4880K773 | PVC pipe Part number:65 |
| Standard-Wall PVC Pipe Fitting for Water, Adapter, 1 Socket-Connect Female x 1 Barbed Male | McMaster | 4880K415 | PVC pipe Part number:66 |
| Standard-Wall PVC Pipe Fitting for Water, Straight Reducer, 2 Socket Female x 3/4 Socket Female | McMaster | 4880K008 | PVC pipe Part number:67 |
| Standard-Wall PVC Pipe Fitting for Water, Tee Connector, White, 1 Size Socket-Connect Female | McMaster | 4880K43 | PVC pipe Part number:68 |
| Standard-Wall Unthreaded Rigid PVC Pipe for Water, 1 Pipe Size, 10 Feet Long | McMaster | 48925K13 | PVC pipe Part number:69 |
| Standard-Wall Unthreaded Rigid PVC Pipe for Water, 3/4 Pipe Size, 5 Feet Long | McMaster | 48925K92 | PVC pipe Part number:70 |
| Structural FRP Fiberglass Sheet, 48" Wide x 96" Long, 1/2" Thick | McMaster | 8537K15 | Table top material Part number:71 |
| Structural FRP Fiberglass Square Tube, 10 Feet Long, 2" Wide x 2" High Outside, 1/8" Wall Thickness | McMaster | 8548K33 | Structural table material Part number:72 |
| Tank Sediment | TopDawg Pet Supply | 8479001207 | Sediment for bottom of fiddler crab tank Part number:73 |
| Temperature probe | Neptune Systems | Local Dealer | Temperature probe for tanks Part number:74 |
| Tetra TetraMarine Large Saltwater Flakes for all Marine Fish | Amazon | B00025K0US | Fish, shrimp, and crab food Part number:75 |
| Tetra Whisper Aquarium Air Pump for 10 gallon Aquariums | Petco | 2335234 | Air pump for smaller tanks Part number:76 |
| Thick-Wall Through-Wall Pipe Fitting, for Water, PVC Connector, 1 Socket-Connect Female | McMaster | 36895K843 | PVC pipe Part number:77 |
| Vectra s2 pump | Bulk Reef Supply | 212141 | Aquarium Pump Part number:78 |
| Water Pump | TACKLIFE | GHWP1A | Pump for cleaning tanks Part number:79 |
| Wyze Cam v2 1080p HD Indoor WiFi Smart Home Camera with Night Vision | Amazon | B076H3SRXG | DeepLabCut Recording Part number:80 |
Références
- Wet, J. R., Wood, K. V., DeLuca, M., Helinski, D. R., Subramani, S. Firefly luciferase gene: structure and expression in mammalian cells. Molecular and Cellular Biology. 7 (2), 725-737 (1987).
- Han, X., Boyden, E. S. Multiple-color optical activation, silencing, and desynchronization of neural activity, with single-spike temporal resolution. PLoS One. 2 (3), 299 (2007).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Li, N., et al. Optogenetic-guided cortical plasticity after nerve injury. Proceedings of the National Academy of Sciences of the United States of America. 108 (21), 8838-8843 (2011).
- Airan, R. D., Li, N., Gilad, A. A., Pelled, G. Genetic tools to manipulate MRI contrast. NMR Biomedicine. 26 (7), 803-809 (2013).
- Cywiak, C., et al. Non-invasive neuromodulation using rTMS and the electromagnetic-perceptive gene (EPG) facilitates plasticity after nerve injury. Brain Stimulation. 13 (6), 1774-1783 (2020).
- Hwang, J., et al. Regulation of Electromagnetic Perceptive Gene Using Ferromagnetic Particles for the External Control of Calcium Ion Transport. Biomolecules. 10 (2), (2020).
- Lu, H., et al. Transcranial magnetic stimulation facilitates neurorehabilitation after pediatric traumatic brain injury. Scientific Reports. 5, 14769 (2015).
- Krishnan, V., et al. Wireless control of cellular function by activation of a novel protein responsive to electromagnetic fields. Bioscience Reports. 8 (1), 8764 (2018).
- Mitra, S., Barnaba, C., Schmidt, J., Pelled, G., Gilad, A. A. Functional characterization of an electromagnetic perceptive protein. bioRxiv. , 329946 (2020).
- Hunt, R. D., et al. Swimming direction of the glass catfish is responsive to magnetic stimulation. PLoS One. 16 (3), 0248141 (2021).
- Kandel, E. R., Krasne, F. B., Strumwasser, F., Truman, J. W. Cellular mechanisms in the selection and modulation of behavior. Neurosciences Research Program bulletin. 17, 521 (1979).
- Carew, T. J., Castellucci, V. F., Kandel, E. R. An analysis of dishabituation and sensitization of the gill-withdrawal reflex in Aplysia. International Journal of Neuroscience. 2 (2), 79-98 (1971).
- Kandel, E. R. The molecular biology of memory storage: a dialog between genes and synapses. Bioscience Reports. 21 (5), 565-611 (2001).
- Forsythe, J. W., Hanlon, R. T. Effect of temperature on laboratory growth, reproduction and life-span of octopus-bimaculoides. Marine Biology. 98 (3), 369-379 (1988).
- Forsythe, J. W., Hanlon, R. T. Behavior, body patterning and reproductive-biology of octopus-bimaculoides from California. Malacologia. 29 (1), 41-55 (1988).
- Pickford, B. M. The Octopus bimaculatus problem: A study in sibling species. Bulletin of the Bingham Oceanographic Collection. 12, 1-66 (1949).
- Sumbre, Y., Fiorito, G., Flash, T. Control of octopus arm extension by a peripheral motor program. Science. 293 (5536), 1845-1848 (2001).
- Gutfreund, Y., et al. Organization of octopus arm movements: a model system for studying the control of flexible arms. Journal of Neuroscience. 16 (22), 7297-7307 (1996).
- Gutfreund, Y., Matzner, H., Flash, T., Hochner, B. Patterns of motor activity in the isolated nerve cord of the octopus arm. The Biological Bulletin. 211 (3), 212-222 (2006).
- Hague, T., Florini, M., Andrews, P. L. R. Preliminary in vitro functional evidence for reflex responses to noxious stimuli in the arms of Octopus vulgaris. Journal of Experimental Marine Biology and Ecology. 447, 100-105 (2013).
- Hochner, B., Brown, E. R., Langella, M., Shomrat, T., Fiorito, G. A learning and memory area in the octopus brain manifests a vertebrate-like long-term potentiation. Journal of Neurophysiology. 90 (5), 3547-3554 (2003).
- Hochner, B., Glanzman, D. L. Evolution of highly diverse forms of behavior in molluscs. Current Biology. 26 (20), 965-971 (2016).
- Hvorecny, L. M., et al. Octopuses (Octopus bimaculoides) and cuttlefishes (Sepia pharaonis, S. officinalis) can conditionally discriminate. Animal Cognition. 10 (4), 449-459 (2007).
- Kier, W. M., Stella, M. P. The arrangement and function of octopus arm musculature and connective tissue. Journal of Morphology. 268 (10), 831-843 (2007).
- Levy, G., Hochner, B. Embodied organization of octopus vulgaris morphology, vision, and locomotion. Frontiers in Physiology. 8, 164 (2017).
- Giorgio-Serchi, F., Arienti, A., Laschi, C. Underwater soft-bodied pulsed-jet thrusters: Actuator modeling and performance profiling. The International Journal of Robotics Research. 35 (11), 1308-1329 (2016).
- Han, S., Kim, T., Kim, D., Park, Y., Jo, S. Use of deep learning for characterization of microfluidic soft sensors. IEEE Robotics and Automation Letters. 3 (2), 873-880 (2018).
- Hanassy, S., Botvinnik, A., Flash, T., Hochner, B. Stereotypical reaching movements of the octopus involve both bend propagation and arm elongation. Bioinspiration and Biomimetics. 10 (3), 035001 (2015).
- Hochner, B., Shomrat, T., Fiorito, G. The octopus: a model for a comparative analysis of the evolution of learning and memory mechanisms. The Biological Bulletin. 210 (3), 308-317 (2006).
- Imperadore, P., Fiorito, G. Cephalopod tissue regeneration: consolidating over a century of knowledge. Frontiers in Physiology. 9, 593 (2018).
- Imperadore, P., et al. Nerve regeneration in the cephalopod mollusc Octopus vulgaris: label-free multiphoton microscopy as a tool for investigation. Journal of the Royal Society, Interface. 15 (141), 20170889 (2018).
- Levy, G., Flash, T., Hochner, B. Arm coordination in octopus crawling involves unique motor control strategies. Current Biology. 25 (9), 1195-1200 (2015).
- Li, F., et al. Chromosome-level genome assembly of the East Asian common octopus (Octopus sinensis) using PacBio sequencing and Hi-C technology. Molecular Ecology Resources. 20 (6), 1572-1582 (2020).
- Lopes, V. M., Rosa, R., Costa, P. R. Presence and persistence of the amnesic shellfish poisoning toxin, domoic acid, in octopus and cuttlefish brains. Marine Environmental Research. 133, 45-48 (2018).
- Mazzolai, B., Margheri, L., Dario, P., Laschi, C. Measurements of octopus arm elongation: Evidence of differences by body size and gender. Journal of Experimental Marine Biology and Ecology. 447, 160-164 (2013).
- McMahan, W., et al. . Proceedings 2006 IEEE International Conference on Robotics and Automation, 2006. , 2336-2341 (2006).
- Meisel, D. V., Kuba, M., Byrne, R. A., Mather, J. The effect of predatory presence on the temporal organization of activity in Octopus vulgaris. Journal of Experimental Marine Biology and Ecology. 447, 75-79 (2013).
- Nesher, N., Levy, G., Grasso, F. W., Hochner, B. Self-recognition mechanism between skin and suckers prevents octopus arms from interfering with each other. Current Biology. 24 (11), 1271-1275 (2014).
- Wells, M. J. . Octopus : Physiology and behaviour of an advanced invertebrate. , (1978).
- Young, J. Z. . The anatomy of the nervous system of Octopus vulgaris. , (1971).
- Zullo, L., Sumbre, G., Agnisola, C., Flash, T., Hochner, B. Nonsomatotopic organization of the higher motor centers in octopus. Current Biology. 19 (19), 1632-1636 (2009).
- Albertin, C. B., et al. The octopus genome and the evolution of cephalopod neural and morphological novelties. Nature. 524 (7564), 220-224 (2015).
- Albertin, C. B., Simakov, O. Cephalopod Biology: At the intersection between genomic and organismal novelties. Annual Review if Animal Biosciences. 8, 71-90 (2020).
- Baik, S., et al. A wet-tolerant adhesive patch inspired by protuberances in suction cups of octopi. Nature. 546 (7658), 396-400 (2017).
- Pikul, J. H., et al. Stretchable surfaces with programmable 3D texture morphing for synthetic camouflaging skins. Science. 358 (6360), 210 (2017).
- Wehner, M., et al. An integrated design and fabrication strategy for entirely soft, autonomous robots. Nature. 536 (7617), 451-455 (2016).
- McMahan, W., et al. Field trials and testing of the OctArm continuum manipulator. Proceedings 2006 IEEE International Conference on Robotics and Automation, 2006. ICRA. , 2336-2341 (2006).
- Hochner, B., Brown, E. R., Langella, M., Shomrat, T., Fiorito, G. A learning and memory area in the octopus brain manifests a vertebrate-like long-term potentiation. Journal of Neurophysiology. 90 (5), 3547-3554 (2003).
- Tapia-Vasquez, A. E., et al. Proteomic identification and physicochemical characterisation of paramyosin and collagen from octopus (Octopus vulgaris) and jumbo squid (Dosidicus gigas). International Journal of Food Science & Technology. 55 (10), 3246-3253 (2020).
- Kim, B. -. M., et al. The genome of common long-arm octopus Octopus minor. GigaScience. 7 (11), (2018).
- Zarrella, I., et al. The survey and reference assisted assembly of the Octopus vulgaris genome. Scientific data. 6 (1), 13 (2019).
- Forsythe, J. W., Hanlon, R. T. Effect of temperature on laboratory growth, reproduction and life span of Octopus bimaculoides. Marine Biology. 98 (3), 369-379 (1988).
- Stoskopf, M. K., Oppenheim, B. S. Anatomic features of Octopus bimaculoides and Octopus digueti. Journal of Zoo and Wildlife Medicine. 27 (1), 1-18 (1996).
- Ramos, J. E., et al. Body size, growth and life span: implications for the polewards range shift of Octopus tetricus in south-eastern Australia. PLoS One. 9 (8), 103480 (2014).
- Hanlon, R. T., Forsythe, J. W. Advances in the laboratory culture of octopuses for biomedical research. Lab Animal Science. 35 (1), 33-40 (1985).
- Moltschaniwskyj, N. A., Carter, C. G. Protein synthesis, degradation, and retention: mechanisms of indeterminate growth in cephalopods. Physiological and Biochemical Zoology. 83 (6), 997-1008 (2010).
- Fiorito, G., et al. Guidelines for the care and welfare of Cephalopods in Research -A consensus based on an initiative by CephRes, FELASA and the Boyd Group. Lab Animal. 49, 1-90 (2015).
- Valverde, J. C., Garcia, B. G. Suitable dissolved oxygen levels for common octopus (Octopus vulgaris cuvier, 1797) at different weights and temperatures: analysis of respiratory behaviour. Aquaculture. 244 (1-4), 303-314 (2005).
- Cardeilhac, P. T., Whitaker, B. R. Copper Treatments: Uses and Precautions. Veterinary Clinics of North America: Small Animal Practice. 18 (2), 435-448 (1988).
- Hodson, P. V., Borgman, U., Shear, H. Toxicity of copper to aquatic biota. Copper in the Environment. (2), 307-372 (1979).
- Poole, B. M. Techniques for the culture of ghost shrimp (palaemonetes pugio). Environmental Toxicology and Chemistry. 7 (12), 989-995 (1988).
- Burggren, W. W. Respiration and circulation in land crabs: novel variations on the marine design. American Zoologist. 32 (3), 417-427 (1992).
- Reitsma, J., Murphy, D. C., Archer, A. F., York, R. H. Nitrogen extraction potential of wild and cultured bivalves harvested from nearshore waters of Cape Cod, USA. Marine Pollution Bulletin. 116 (1), 175-181 (2017).
- Messenger, J. B. Cephalopod chromatophores: neurobiology and natural history. Biological Reviews. 76 (4), 473-528 (2001).
- Morgan Holst, M. M., Miller-Morgan, T. The Use of a species-specific health and welfare assessment tool for the giant pacific octopus, enteroctopus dofleini. Journal of Applied Animal Welfare Science. 24 (3), 272-291 (2021).
- Rosas, C., et al. Energy balance of Octopus maya fed crab or an artificial diet. Marine Biology. 152 (2), 371-381 (2007).
- Anderson, R. C., Wood, J. B., Byrne, R. A. Octopus Senescence: The Beginning of the end. Journal of Applied Animal Welfare Science. 5 (4), 275-283 (2002).
- Butler-Struben, H. M., Brophy, S. M., Johnson, N. A., Crook, R. J. In vivo recording of neural and behavioral correlates of anesthesia induction, reversal, and euthanasia in cephalopod molluscs. Frontiers in Physiology. 9, 109 (2018).
- Jiang, X., et al. Octopus visual system: A functional MRI model for detecting neuronal electric currents without a blood-oxygen-level-dependent confound. Magnetic Resonance in Medicine. 72 (5), 1311-1319 (2014).
- Hennig, J., Nauerth, A., Friedburg, H. RARE imaging: a fast imaging method for clinical MR. Magnetic Resonance in Medicine. 3 (6), 823-833 (1986).
- Brant-Zawadzki, M., Gillan, G. D., Nitz, W. R. MP RAGE: a three-dimensional, T1-weighted, gradient-echo sequence--initial experience in the brain. Radiology. 182 (3), 769-775 (1992).
- Bertapelle, C., Polese, G., Di Cosmo, A. Enriched environment increases PCNA and PARP1 Levels in Octopus vulgaris central nervous system: first evidence of adult neurogenesis in Lophotrochozoa. Journal of Experimental Zoology Part B: Molecular and Developmental Evolution. 328 (4), 347-359 (2017).
- Maselli, V., Polese, G., Soudy, A. -. S. A., Buglione, M., Cosmo, A. D. Cognitive stimulation induces differential gene expression in Octopus vulgaris: The key role of protocadherins. Biology. 9, (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon