Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Создание экосистемы осьминога для биомедицинских и биоинженерных исследований
В этой статье
Резюме
Понимание уникальных физиологических и анатомических структур осьминогов может оказать большое влияние на биомедицинские исследования. Это руководство демонстрирует, как настроить и поддерживать морскую среду для размещения этого вида, и включает в себя современные методы визуализации и аналитические подходы для визуализации анатомии и функции нервной системы осьминога.
Аннотация
Многие разработки в биомедицинских исследованиях были вдохновлены открытием анатомических и клеточных механизмов, которые поддерживают определенные функции у разных видов. Осьминог является одним из этих исключительных животных, которые дали ученым новое понимание в области неврологии, робототехники, регенеративной медицины и протезирования. Исследования с этим видом головоногих моллюсков требуют создания сложных учреждений и интенсивной терапии как для осьминога, так и для его экосистемы, что имеет решающее значение для успеха проекта. Эта система требует нескольких механических и биологических систем фильтрации, чтобы обеспечить безопасную и чистую среду для животного. Наряду с системой управления требуется специализированное текущее техническое обслуживание и очистка для эффективного поддержания работы объекта в течение длительного времени. Рекомендуется обеспечить обогащенную среду для этих умных животных, изменяя ландшафт аквариума, включая разнообразную добычу и вводя сложные задачи для их работы. Наши результаты включают МРТ и аутофлуоресцентную визуализацию всего тела, а также поведенческие исследования, чтобы лучше понять их нервную систему. Осьминоги обладают уникальной физиологией, которая может повлиять на многие области биомедицинских исследований. Предоставление им устойчивой экосистемы является первым важным шагом в раскрытии их отличительных возможностей.
Введение
Новые концепции в биомедицинских исследованиях и биомедицинской инженерии часто вдохновляются определением конкретных стратегий, которыми обладают биологические виды для решения экологических и физиологических условий и проблем. Например, понимание свойств флуоресценции у светлячков привело к разработке новых флуоресцентных датчиков, которые могут сообщать о клеточной активности в других модельных организмах1; идентификация ионных каналов, активируемых светом в водорослях, привела к развитию клеточной и временной специфической световой нейромодуляции2,3,4,5; обнаружение белков в стеклянном соме, которые ориентируются в соответствии с магнитным полем Земли, привело к развитию магнитной нейромодуляции6,7,8,9,10,11; Понимание сифонного рефлекса в Aplysia сыграло важную роль в понимании клеточной основы поведения12,13,14.
Исследователи продолжают расширять современный набор инструментов биоинженерии и филогенетики, используя уникальные сильные стороны и новые перспективы физиологических функций, которые имеют нетрадиционные лабораторные виды. Федеральные агентства начинают поддерживать эти направления исследований, финансируя новые работы, выполненные на различных видах.
Одним из родов животных с уникальной анатомией и возможностями регенерации, а также адаптивным управлением каждым из его рук, увлекательными биологами и инженерами и увлекательными аудиториями из всех частей общества является Octopus17. Действительно, многие аспекты физиологии и поведения осьминога были изучены за последние десятилетия15,16,17,18,19,20,21,22,23,24,25,26 . Однако последние разработки в области молекулярной и эволюционной биологии, робототехники, записи движения, визуализации, машинного обучения и электрофизиологии ускоряют открытия, связанные с физиологией и поведением осьминога, и переводят их в инновационные стратегии биоинженерии27,28,29,30,31,32,33,34,35 ,36,37,38,39.
Здесь мы описываем, как создать и поддерживать разведение осьминогов, которое будет представлять интерес и актуальность для ученых и инженеров из разных слоев общества, научных интересов и целей. Тем не менее, наши результаты сосредоточены на применении осьминогов в нейробиологии и нейроинженерных исследованиях. Осьминог имеет высокоразвитую нервную систему с 45 миллионами нейронов в центральном мозге, 180 миллионами нейронов в зрительных долях и дополнительными 350 миллионами нейронов в восьми осевых тяжях и периферических ганглиях; для сравнения, собака имеет аналогичное количество нейронов, а кошка только половина из них 40. В отличие от нервной системы позвоночных, существует только 32K эфферентных и 140K афферентных волокон, соединяющих миллионы нейронов в мозге осьминога с миллионами нейронов в осевых тяжках каждой из их рук40,41,42. Эти относительно немногие взаимосвязанные волокна предполагают, что большинство деталей для выполнения двигательных программ выполняются в самом осевом шнуре, подчеркивая уникально распределенный нейронный контроль, которым обладают осьминоги. Руки осьминога имеют исключительный тонкий моторный контроль, позволяющий им манипулировать навыками, такими как открытие крышек банок, даже когда они находятся внутри контейнера. Эта высокоразвитая моторная способность является уникальной для класса головоногих моллюсков (осьминог, каракатица и кальмар)43.
Действительно, за сотни миллионов лет эволюции осьминог разработал замечательный и сложный геном и физиологическую систему43,44, которая вдохновила на новые разработки и прогресс в научных и инженерных областях. Например, водостойкий клейкий пластырь на основе анатомического строения присосок осьминога может прилипать к влажным и сухим поверхностям45; синтетический камуфляжный материал, вдохновленный камуфляжной кожей осьминога, может превратить плоскую 2D-поверхность в трехмерную с бугорками и ямами46. Миниатюрные мягкие и автономные роботы (т.е. октоботы), которые в будущем могли бы служить хирургическими инструментами внутри тела47; также была разработана рука (т.е. OctoArm), прикрепленная к танкоподобному роботу48. Многие виды осьминогов используются в биомедицинских исследованиях, например, Octopus vulgaris, Octopus sinensis, Octopus variabilis и Octopus bimaculoides (O. bimaculoides); Наиболее распространенными являются O. vulgaris и O. bimaculoides34,49,50. Недавнее секвенирование различных геномов осьминогов делает этот род особенно интересным и открывает новые рубежи в исследованиях осьминогов34,43,51,52.
O. bimaculoides, используемый в нашей установке, является видом осьминога среднего размера, впервые обнаруженным в 1949 году, который можно найти на мелководье у северо-восточного побережья Тихого океана от центральной Калифорнии до юга полуострова Нижняя Калифорния17. Его можно узнать по ложным пятнам на его мантии под глазами. По сравнению с гигантским тихоокеанским осьминогом (Enteroctopus dofleini) и обыкновенным осьминогом (O. vulgaris), калифорнийский двухточечный осьминог (O. bimaculoides) относительно невелик по размеру, начиная с меньшего количества сантиметров, быстро растет как молодь. При выращивании в лаборатории размер взрослой мантии может вырасти до среднего размера 100 см и весить до 800 г53,54. Осьминоги имеют быстрый период роста в течение первых 200 дней; к тому времени они считаются взрослыми и продолжают расти на протяжении всей оставшейся жизни55,56,57. Осьминоги могут быть каннибалами, особенно когда оба пола размещены вместе в аквариуме; поэтому их нужно размещать индивидуально в отдельных резервуарах58.
протокол
Все исследования на животных были одобрены Институциональным комитетом по уходу за животными и их использованию (IACUC) Мичиганского государственного университета.
1. Настройка оборудования резервуара Octopus
- Во-первых, получить все небиологические материалы для аквариума, которые будут включены в морскую экологическую систему, как показано в Таблице материалов. Размеры указаны в дюймах.
- Перед установкой промывайте все части труб, трубопроводов и фильтрующих систем 70% этанолом и деионизированной (DI) водой. Не используйте мыло или любые другие химические вещества при очистке.
- Поместите стол из стекловолокна 13 дюймов x 49 дюймов x 1/2 дюйма (Часть #71) с четырьмя ножками стола из углеродного волокна и с размерами 2 дюйма x 2 дюйма x 23 дюйма (Часть #72). Прикрепите ножки непосредственно под углами столешницы.
- Под верхней поверхностью, между каждой из ножек стола, поместите 2 дюйма х 2 дюйма в длину (часть No 72) стабилизационные скобки из углеродного волокна, прикрепленные к нижней стороне стола и непосредственно к краю верхней полки. Прикрепите саморезами еще одну полку с такими же размерами непосредственно на землю под столом. Пусть насос (см. Таблицу материалов) находится непосредственно на нижней поверхности полки, в то время как резервуар находится на верхней поверхности. Эта система показана на рисунке 1.
ПРИМЕЧАНИЕ: Выход воды из резервуара подается силой тяжести, и все трубки, за исключением тех, которые подаются в резервуар и из него, должны быть ниже, чем нижняя часть резервуара, чтобы обеспечить максимальное давление дренажного напора.

Рисунок 1: Установка резервуара Octopus. Вход и выход воды (a). Три резервуара для осьминогов площадью 1,22 м x 0,3 м (b). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Просверлите одно отверстие 13/4 дюйма, в 2 дюймах от одной из сторон резервуара, используя стеклянные режущие сверла. Нижняя часть экрана всасывания воды будет определять высоту выходного отверстия, как показано на правой стороне рисунка 2a. Уровень воды будет определяться всасывающим экраном и должен быть не менее 6 дюймов от верхней части резервуара, что позволяет создать зону разбрызгивания воды.
- Используйте грунтовку из ПВХ и цемент для постоянного соединения секций. Для этого сначала сдвиньте конец предполагаемой мужской трубы из ПВХ в конец женской трубы. Поместите кусок малярной ленты на внешнюю сторону мужской части, которая все еще видна, чтобы грунтовка и цемент не показывались на внешней стороне трубы. Отделите детали после тейпирования и поместите легкий слой грунтовки на внешнюю сторону мужской трубы после нанесения цемента в той же области.
- Переоборудуйте мужскую трубу в женскую трубу, как можно скорее, после нанесения цемента и снимите ленту. Через 24 ч после нанесения грунтовки и цемента промыть вновь соединившиеся детали водой DI. Для времени отверждения посмотрите на цементный продукт для дальнейших направлений.
ПРИМЕЧАНИЕ: Убедитесь, что установка всех труб и оборудования размещена должным образом перед использованием грунтовки и цемента из ПВХ; Требования к длине трубы могут отличаться. - Затем навсегда подключите конец наружного диаметра (OD) всасывающего экрана к концу локтевого соединения внутреннего диаметра 1 дюйм (ID). Подключите конец коленного сустава к прямой трубке из ПВХ (1 дюйм OD). Подключите другую сторону прямой трубки, затем к 1-дюймовому идентификатору сквозного прямого адаптера гнездового разъема.
ПРИМЕЧАНИЕ: ID относится к самому широкому расстоянию между внутренними стенками трубы. OD относится к внешней стороне ширины трубки. - Постоянно подключайте сквозной прямой адаптер к прямой трубе из ПВХ длиной 4 дюйма с 1-дюймовым OD (из шага 1.8). Эта труба будет обращена из резервуара.
- Постоянно подключайте прямую трубу к центру разъема ПВХ (1 дюйм ID Tee в форме; из шага 1.9). Затем постоянно соедините две трубы длиной 6 дюймов (часть No 69) (1 дюйм OD) с обоими противоположными концами тройникового разъема - один обращен непосредственно вверх для выпуска воздуха, а другой непосредственно вниз для потока воды.
- Постоянно подключайте удлиненную вниз прямую трубу (от шага 1.10) к прямому адаптеру с колючей трубой (1-дюймовый ID). Прикрепите резиновую трубку длиной 36 дюймов (3/4 дюйма ID) к адаптеру колючей трубы.
- Поместите систему охлаждения между трубой на выходе воды и системой отстойников.
- Прикрепите 3/4-дюймовые барбусные фитинги, которые поставляются с системой, к входным и выходным портам блока чиллера. Поместите резиновую трубку (из шага 1.11) на впускной фитинг чиллера.
- Подключите новый кусок 3/4-дюймовой идентификационной трубки (из шага 1.13) от выхода чиллера (из шага 1.12) во входное отверстие системы отстойников, как показано на рисунке 2b.
- Затем поместите носковый фильтр размером 4 x 12 дюймов с размером пор 200 мкм в назначенную область, как показано на рисунке 2. Кроме того, как показано на рисунке 2, поместите белковый скиммер и возвратный насос в соответствующие области. Вместе с обратным насосом прикрепите автоматический верхний поплавковый клапан к внутренней стенке насосной зоны, на 2 дюйма выше верхней части водозаборного отверстия насоса; не блокируйте извлечение насоса из резервуара, если это необходимо.
- Постоянно подключайте прямую трубку длиной 12 дюймов (3/4 дюйма OD) к выходу насоса (с шага 1.15). На другом конце прямой трубки OD 3/4 дюйма постоянно подключайте OD трубки к 3/4-дюймовому коленному суставу ID 45 °. К другому концу соединения постоянно подключите 3/4-дюймовую трубку OD.
- Прикрепите другой конец прямой трубки (от шага 1.16) к 3/4-дюймовому ID прямого редукционного адаптера. Постоянно подключайте больший конец адаптера (2-дюймовый OD) к входу ультрафиолетового света.
ПРИМЕЧАНИЕ: Длина прямых труб может варьироваться. - Затем сопоставьте размещение входного отверстия ультрафиолетового излучения с выходной трубой насоса (из шага 1.17), чтобы труба не изгибалась между светом и насосом (из шага 1.15). Просверлите отверстия в стабилизационной скобе в соответствии с отверстиями для крепления ультрафиолетового излучения. Сопоставьте размер винтов с сверлом и прикрепите ультрафиолетовый свет к столу с помощью заданных винтов.
- Постоянно подключайте 2-дюймовую сторону другого редукционного адаптера к выходу ультрафиолетового света (из шага 1.18). Прикрепите 1-дюймовый OD прямой трубки длиной 5 дюймов к 1-дюймовому идентификатору адаптера. Затем подключите уголок под углом 90° с 1-дюймовым идентификатором к 1-дюймовой трубке OD; иметь неприкрепленный конец угловой части, указывающий на сторону резервуара, куда должен поступать ввод воды (та же сторона, что и на шаге 1.5).
- Постоянно соедините другой конец угла (от шага 1.19) к трубке длиной 6 дюймов (часть No69), имеющей 1-дюймовый OD с входом блока управления потоком (часть No2). Постоянно подключать другую 1-дюймовую трубку OD (часть No69) к выходу блока контроля потока; длина должна простираться не менее чем на 3 дюйма за пределы боковой части резервуара.
- Используя 13/4-дюймовое стеклорежущее сверло (часть No 1), вырежьте новое отверстие на 3 дюйма выше предполагаемой ватерлинии и на расстоянии 2 дюймов от стороны резервуара (рисунок 1a) на стороне, противоположной той, которая имеет выходное отверстие. Прикрепите еще одну сквозную переборку с 1-дюймовым скольжением (часть No 77), обращенным к баку.
- К проскальзыванию переборки подключите прямую трубку с 1-дюймовым OD и длиной 4 дюйма (часть #69) на постоянной основе. Сократите трубку с последней части шага 1.21, чтобы она соответствовала расстоянию, которое эта трубка простирается от резервуара. Постоянно подключите трубку 90° (часть No 65) к каждой из открытых труб и вырежьте конечную 1-дюймовую прямую трубку OD (часть No 69), которая постоянно соединяет обе угловые части.
ПРИМЕЧАНИЕ: На рисунке 3 показано простое представление аквариумной системы. - Настройте остальную часть системы управления (Часть #34), сначала установив разветвитель питания (Часть #53) к самому столу или к соседней стене. Рядом с ним смонтируйте модуль контроля жидкости (Часть No2).
- Подключите к модулю датчик расхода, разветвитель питания и датчики обнаружения утечек. Установите индикатор роста (часть #26), который прикреплен к бункеру водорослей (рисунок 2).
- Подключите датчик потока, ультрафиолетовый свет, свет роста, насос и белковый скиммер к энергетическому батончику. Настройте программирование системы управления водой в соответствии с руководством производителя.
- Подготовьте соленую воду, смешав половину чашки коммерчески доступной солевой смеси с 1 галлоном воды обратного осмоса (RO) или деионизированной (DI). Сделайте 45 галлонов, чтобы полностью заполнить один резервуар и систему отстойников.
- Включите насос в контроллере расхода системы отстойников и продолжайте добавлять соленую воду до тех пор, пока автоматический верхний клапан не окажется в выключенном положении, чтобы не требовалось дополнительной пресной воды.
- Как только вода наполнится, прекратите наполнение и включите блок охлаждения воды, чтобы установить температуру от 18 ° C до 22 ° C, так как это предпочтительный температурный диапазон53. Включите белковый скиммер.
- Добавьте 30 кг измельченного коралла на дно резервуара, а также слой измельченного коралла на дно бункера водорослей. Добавьте несколько живых камней и любые другие дополнения к окружающей среде осьминога. Поместите сверху, чтобы закрыть отверстие резервуара.
ПРИМЕЧАНИЕ: Живые породы - это мертвые кораллы, которые населены макроскопическими морскими обитателями, такими как бактерии и водоросли. - Добавьте нитрифицирующие бактерии, используемые в аквариумах с морской водой, как указано на упаковке. Продолжайте добавлять это в соответствии с указаниями, ежедневно проверяя температуру, соленость, pH, аммиак, нитрит и нитрат с помощью наборов для тестирования воды, датчика pH и датчика температуры. Безопасные значения для уровней аммиака, нитритов и нитратов ниже 0,5 ppm, 0,25 ppm и 10 ppm соответственно58.
- Убедитесь, что ультрафиолетовый свет выключен в течение дней, когда добавляются нитрифицирующие бактерии, чтобы позволить микроорганизмам морской воды расти. После того, как параметры находятся в пределах безопасных диапазонов, ультрафиолетовый свет может быть реактивирован.
- После того, как система установлена, также проверьте, что рН и оксигенация находятся на уровне 8,0-8,4 и
 59 соответственно. Прежде чем добавлять каких-либо животных в аквариум, проверьте наличие каких-либо уровней меди и кислорода в системе, используя набор для тестирования медной воды.
59 соответственно. Прежде чем добавлять каких-либо животных в аквариум, проверьте наличие каких-либо уровней меди и кислорода в системе, используя набор для тестирования медной воды.
ПРИМЕЧАНИЕ: Медь повреждает беспозвоночных и препятствует осморегуляции в жабрах рыб60,61. - Если в воде обнаружена медь, проверьте источник воды DI/RO. После определения того, что источник воды не содержит меди, выполните 30% замену воды и поместите блок активированного угля (часть No 46) в воду. Если проблема не устранена, выполните полную замену воды и очистите все детали.
- После того, как все параметры воды будут определены в пределах безопасных уровней, добавьте 10 креветок-призраков в систему, по крайней мере, за неделю до добавления осьминогов. Это поможет ввести биомассу для бактерий и указать на общее качество воды.
- Добавьте дополнительных обитателей аквариумной экосистемы в бункер водорослей. К ним относятся Chaetomorpha spp. (спагетти-водоросли), Trochus Sp. (полосатая улитка трохус) и Mercenaria mercenaria (вишневые моллюски).

Рисунок 2: Система отстойников. Вид сбоку системы отстойников (а). Вид сверху системы отстойников (b). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
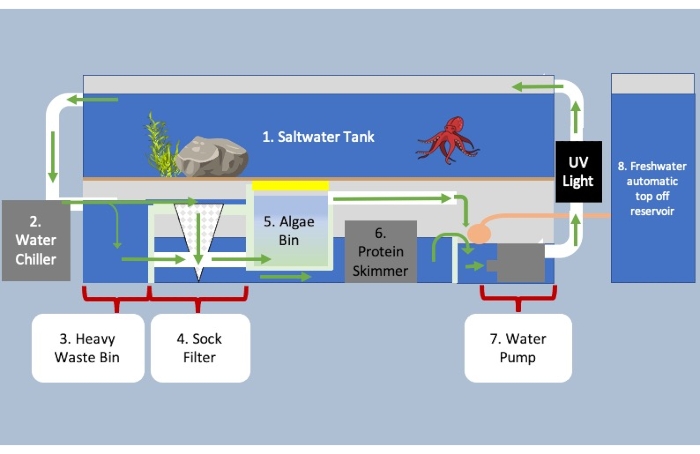
Рисунок 3: Аквариум с системой фильтрации отстойников под резервуаром и блоками контроля окружающей среды. Зелеными стрелками обозначено направление потока воды через систему. Вода, текущая из секции с первой по вторую для охлаждения и на три, чтобы отделить тяжелое биологическое вещество от более легкого вещества. Тяжелые отходы всплывают на дно и выходят в пятую секцию, в то время как более мелкое биологическое вещество поступает в фильтр носков в четвертой секции. Вода течет из четырех под пятой секцией, входя в белковый скиммер в шести, чтобы удалить оставшиеся отходы в воде. Бункер водорослей содержит микроорганизмы для разрушения отходов, аммиака и нитратов, а также для насыщения воды кислородом. В последней части системы добавляется больше воды для учета испарения перед закачкой обратно в резервуар. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Резервуары для хранения
- Установите два высоких 60-галлонных резервуара для хранения воды, один для соленой воды, а другой для воды обратного осмоса. Убедитесь, что максимальная линия заполнения резервуара для пресной воды выше, чем стол. Прикрепите 1/4-дюймовую трубку к автоматической верхней части поплавкового клапана в системе отстойников и прикрепите другой конец трубки к нижней части резервуара для пресной воды.
ПРИМЕЧАНИЕ: Это делается для пополнения, если вода испаряется. Соль останется в воде. - Наполните резервуар с соленой водой водой и добавьте в резервуар пропорциональное количество соли. Непрерывная аэрация резервуара для хранения соленой воды для смешивания и правильной оксигенации. Подождите час перед употреблением, чтобы обеспечить полное перемешивание соли.
ПРИМЕЧАНИЕ: Резервуар для морской воды полезен для заправки резервуаров после очистки.
3. Установка резервуара для пищевых продуктов
- Для сохранения креветок живыми дольше недели храните их в отдельном резервуаре от осьминога с соленостью ниже 30 ppt и температурой, близкой к 25 °C.
- Для этого через неделю после созревания резервуаров для осьминогов переложите 8 галлонов созревшей соленой воды в резервуар для креветок. Добавьте 15 кг измельченного коралла на дно резервуара. Добавьте несколько живых камней в резервуар для укрытия для линьки (рисунок 4).
ПРИМЕЧАНИЕ: Зрелая морская вода относится к процессу, позволяющему морским бактериям расти в соленой воде, как показано на этапе 1.30. - Прикрепите фильтр канистры к краю резервуара. Настройте фильтр канистры в соответствии с указаниями производителя. Добавьте воздушный насос рядом с резервуаром, соединенным с трубкой с прикрепленным воздушным камнем, помещенным в резервуар.
- Очищайте фильтр и меняйте фильтрующие прокладки каждую неделю. Кроме того, 25% воды нужно будет менять одновременно. Ежедневно проверяйте параметры азота, pH и температуры в пищевых резервуарах с помощью наборов для тестирования воды, как описано в шаге 1.30. Если параметры азота воды остаются высокими, выполните дополнительные изменения воды и добавьте в воду мешок для поглощения азота; или, если проблемы сохраняются дольше месяца, креветку нужно будет переместить в больший резервуар.
- Добавляйте креветки, как только измельченный коралловый осадок рассеивается. Чтобы сначала добавить креветок, по прибытии переместите креветок без транспортировки воды в небольшой резервуар с морской водой в течение 5 минут, чтобы удалить биоотходы. Затем креветки можно добавлять прямо в резервуар. Рыба-комар по прибытии может быть добавлена непосредственно в резервуар для креветок.
ПРИМЕЧАНИЕ: Креветки и москитные рыбы можно приобрести у любого коммерческого поставщика живых животных, указанного на листе материалов, или у других поставщиков продуктов питания. Также можно предложить осьминогам размороженные креветки. - Кормите креветок и рыб рыб рыбными хлопьями, мертвой растительностью или водорослями62, как указано в инструкциях к пище.
- Для крабового аквариума добавьте 1 галлон соленой воды и 10 кг гальки. Сложите гальку с одной стороны, оставив сушу с одной стороны и 2 см соленой воды с другой стороны (как отмечено на рисунке 4). Оптимальные параметры окружающей среды для этих беспозвоночных должны составлять 30-35 ppt и 22-25 °C для солености и температуры11,63 соответственно.
- Добавьте крабов-скрипачей прямо в резервуар (рисунок 4). Крабы проводят большую часть своей жизни на суше, но могут находиться под водой в течение нескольких дней за раз, что делает резервуар, который частично находится под водой, решающим для их долгосрочного выживания.
- Кормите крабов-скрипачей один раз в день, добавляя рыбные хлопья в блюдо на сухом участке аквариума. Очищайте еженедельно, удаляя крабов и меняя 100% соленой воды. Очистите гальку.
- Храните морских двустворчатых моллюсков (моллюсков и мидий) в резервуарах с морской водой, чтобы осьминоги открылись и обеспечили еще один механизм фильтрации воды64.
- Поместите мидии в отдельный незанятый резервуар на первую неделю, чтобы избежать размещения ненужной нагрузки отходов на систему фильтрации резервуара для осьминога.
ПРИМЕЧАНИЕ: В то время как мидии были предпочтительной пищей осьминога, они с большей вероятностью умрут вскоре после прибытия и значительно увеличат биологические отходы в аквариуме, если они присутствуют в больших количествах.
4. Введение осьминога в аквариум
- Убедитесь, что уровни аммиака, нитритов и нитратов ниже 0,5 ppm, 0,25 ppm и 10 ppm соответственно. Имейте водяной ручной насос для удаления чернил осьминога из резервуара. Также рекомендуется иметь двух человек для этой процедуры.
- По прибытии положите сумку на весы и вычтите вес сумки после того, как осьминог будет удален. Добавьте воздушный камень в мешок, чтобы увеличить оксигенацию воды при переносе животного в свой резервуар. Измерьте температуру и соленость судоходной воды. Фиксируйте случаи длительного заболевания после отгрузки.
- Не перекладывая воду из мешка в бак, повесьте транспортный мешок над углом резервуара с мешком, частично погруженным в воду резервуара, чтобы начать изменять температуру транспортного мешка. Извлеките 10% воды из пакета и сбросьте вниз по раковине. Добавьте такое же количество воды из бака в пакет. Повторять каждые 10 мин до тех пор, пока температура воды в пакете не будет отличаться не более чем на 1° от температуры воды в баке.
- Как только разница температур в сумке и резервуаре окажется в пределах 1°, убедитесь, что перчатки надеты для перемещения осьминогов в их индивидуальный резервуар. Чтобы двигаться, поместите обе руки под осьминога, чтобы обеспечить поддержку во время передачи; второму человеку нужно будет осторожно вытащить всасываемые руки со стороны сумки.
- Как только осьминог выйдет из мешка, быстро переместите его в воду своей новой среды обитания, перенеся как можно меньше воды из транспортного мешка. Используйте ручной насос, чтобы удалить все чернила, которые выпускает осьминог, находясь в резервуаре. Теперь взвесьте мешок с водой, чтобы получить приблизительный вес животного.
- В течение первых 2 недель после прибытия контролируйте ежедневное потребление осьминога, которое должно составлять от 4% до 8% от их веса58,65,66. Осьминога следует проверять четыре раза в день; это может быть уменьшено до двух раз в день через 2 недели. Взвешивайтесь каждые две недели, чтобы скорректировать потребление пищи по мере необходимости.
ПРИМЕЧАНИЕ: Известно, что некоторые виды осьминогов выходят из своего аквариума, поэтому желательно поместить вес 2,5 кг на крышку их резервуара.
5. Ежедневный уход
- Используя коммерчески доступный набор для тестирования соленой воды на рН, аммиак, нитриты и нитраты, добавьте количество воды в резервуаре, направленное на комплект, в четыре пробирки, поставляемые с комплектом. Как указано на испытательном комплекте, добавьте количество колориметрического реагента в соответствующую трубку.
- Если уровни аммиака, нитритов и нитратов выше 0,5 ppm, 0,25 ppm и 10 ppm соответственно, вымойте биомассу из носкового фильтра или перейдите на новый носковый фильтр. Кроме того, очистите биомассу от верхней части скиммера с помощью щетки и добавьте дополнительные денитрифицирующие бактерии в резервуар. Если проблемы сохраняются, то замените 25% пресной соленой воды.
ПРИМЕЧАНИЕ: Вышеуказанные шаги уменьшают содержание соединений азота в экосистеме. - Удалите все мертвые туши крабов и креветок из аквариума, а также любые фекалии осьминога с помощью ручного насоса. Извлеките всех оставшихся живых крабов из резервуара и переместите их обратно в резервуар для хранения. Затем переставьте большие объекты внутри резервуара.
- Введите половину количества крабов, которых осьминог съедал бы ежедневно, в аквариум весом 1,25 +/- 0,25 г. Кормите размороженных креветок или мелких самцов крабов-скрипачей молодым осьминогам. В зависимости от эксперимента, крабы и креветки могут быть введены в любом месте аквариума или непосредственно осьминогу.
ПРИМЕЧАНИЕ: Ежедневное потребление пищи осьминогами составляет 4-8% от их веса67. Замороженные креветки также могут быть предоставлены в качестве источника пищи в зависимости от веса осьминога. - Предложите пять креветок-призраков ежедневно. В среднем в этом эксперименте было потреблено три. Чтобы обеспечить осьминога разнообразной пищей, давайте одному живому моллюску или мидиям один раз в неделю и всегда держите трех рыб комаров внутри аквариума.
ПРИМЕЧАНИЕ: Предоставление животным разнообразной пищи не требуется и может предотвратить соблазнение животных пищей во время экспериментов. График кормления, используемый здесь для лучшего мониторинга кормления и поведения осьминога, заключается в том, чтобы ввести половину количества крабов в зависимости от веса и увеличить количество креветок до пяти утром. Вечером вводят вторую половину крабов в аквариум.
6. Еженедельная санитария
- Выключите скиммер, насос и лампы для водорослей перед очисткой системы отстойников. Затем выключите автоматический клапан системы перед удалением воды. Наконец, удалите скиммер и всю воду только из системы отстойников.
- Слегка очистите контейнер для водорослей, чтобы удалить большую часть биомассы с его стенок. Очистите остальную часть отстойника щеткой. Снимите фильтр для носков, очистите уксусом и дайте ему высохнуть; каждую неделю чередуйте с другим носковым фильтром, заменяя его новым каждые три месяца. Еженедельно удаляйте и очищайте биомассу из верхней части скиммера.
ПРИМЕЧАНИЕ: Избегайте использования металла для очистки пластика, так как он создаст царапины, которые могут быть склонны к росту микробов. - Поместите скиммер обратно в систему и начните заправку соленой водой. Когда область насоса начинает заполняться, все системы могут быть снова включены. Прекратите добавление воды, когда автоматическая верхняя часть поплавкового клапана находится в выключенном положении.

Рисунок 4: Резервуар для крабов-скрипачей (Minuca pugnax). Дно резервуара наполовину предназначено для сухого слоя, а другая половина для 2 см мелкой соленой воды. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Резервуар для креветок-призраков (Palaemonetes paludosus). Камни в резервуаре для креветок обеспечивают места для укрытия и линьки креветок, а также для роста микроорганизмов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
7. Уход за нездоровыми животными
- Следуйте руководству reference66 , чтобы оценить самочувствие осьминога.
ПРИМЕЧАНИЕ: Для самок осьминогов конец жизненного цикла обычно начинается после откладывания яиц. Животное начнет уменьшать потребление пищи и вообще перестанет есть и станет более вялым. Продолжительность жизни после окончания срока службы варьируется. Никакие дальнейшие действия не могут быть предприняты, кроме кормления и мониторинга животного. Стареющие самцы уменьшат потребление пищи и станут вялыми68.
8. Анестезия осьминога
- Выполняйте анестезию осьминогов, как подробно описано в Butler-Struben et al.69.
- Приобретите контейнер объемом 6 л с крышкой высотой не менее 15 см. Поместите 4 л воды непосредственно из резервуара осьминога в контейнер и обеспечьте аэрацию 4 л соленой воды с помощью небольшого воздушного насоса с воздушным камнем для распространения кислорода в водную среду58.
- Перед введением осьминога добавьте в контейнер 1% EtOH. Перед обработкой осьминога запишите количество вдохов в минуту, подсчитав выдох воды из сифона.
ПРИМЕЧАНИЕ: Для осьминогов в лаборатории исследователя исходное дыхание составляет 16 - 24 вдоха в минуту. - Перед перемещением осьминога запишите пигментацию кожи осьминога и базовую частоту дыхания. Извлеките осьминога из резервуара, используя чистый контейнер с открытым ртом объемом 4 л, зачерпнув его окружающей водой.
ПРИМЕЧАНИЕ: Во время анестезии частота дыхания не обязательно указывает на полную анестезию. - Взвесьте осьминога, находясь в контейнере, а затем переместите его, поместив обе руки вокруг тела осьминога и подняв его вверх. Второй человек может понадобиться для удаления всасываемых конечностей со стенок контейнера.
- Быстро переместите осьминога в подготовленный контейнер с 1% EtOH. Закройте крышку, чтобы предотвратить возможный побег.
- Запишите дыхание осьминога в минуту, отсчитав выдох воды из сифона в конце первых 5 мин. Если дыхание остается выше исходного уровня и животное продолжает реагировать на легкое защемление, добавьте дополнительно 0,25% EtOH в воду. Добавление этанола в воду может продолжаться максимум до 3% EtOH.
ПРИМЕЧАНИЕ: Одним из признаков того, что осьминог находится без сознания, является потеря контроля над своими хроматофорами. В этом случае кожа выглядит бледнее, чем обычно. Еще одним показанием является легкое защемление рук и проверка того, есть ли двигательная реакция. Если в этот момент все еще нет ответа, осьминог находится без сознания, и могут быть проведены эксперименты. - Находясь под наркозом, следите за дыханием и цветом осьминога, чтобы убедиться, что он остается без сознания в течение всего периода процедуры. Если осьминог начинает просыпаться во время процедуры, добавьте дополнительно 0,25% EtOH.
- Чтобы обратить вспять эффекты этаноловой анестезии, переместите осьминога в новый резервуар с оксигенированной водой объемом 4 л или более из его постоянного резервуара для хранения. Как только дыхание приходит в норму, осьминог становится активным, а его кожа возвращается к нормальным пигментам; его можно переместить обратно в его резервуар.
9. Эвтаназия осьминога
- Следуйте международным стандартам эвтаназии осьминогов, подробно описанным в Fiorito et al., Moltschaniwskyj et al., and Butler-Struben et al57,58,69.
- Подготовьте новый контейнер объемом 6 л с 4 л воды из резервуара для хранения осьминога. Смешайте с MgCl2 до концентрации 4% в резервуар для эвтаназии. Выполните шаги от 8.1 до 8.9, чтобы обезболить осьминога.
- Переместите осьминога после шага 8.8 в резервуар для эвтаназии. После остановки дыхания подождите 5 мин и выполните децеребрацию осьминога или подержите в резервуаре для эвтаназии еще 5 минут.
10. Поведение O. bimaculoides
- Не кормите осьминога по утрам, когда они будут обучены использовать контейнер с винтовой крышкой. Настройте записывающее устройство камеры, указывающее на область, предназначенную для кормления.
- Получите 50 мл винтовой колпачковой трубки с отверстиями диаметром 1 мм по всей поверхности и колпачком для потока воды по всему контейнеру. Поместите краба-скрипача в контейнер. Поместите груз внутрь контейнера или прикрепите к внешней стороне, чтобы он оставался на дне резервуара.
- Поместите контейнер на дно резервуара в пределах открытой местности и в поле зрения осьминога и камеры. Если краб не был съеден через 4 ч, то выньте его из пробирки и возобновите график кормления на сутки. Продолжайте выполнять это упражнение ежедневно.
ПРИМЕЧАНИЕ: Это показано на рисунке 6 и обсуждается в разделе репрезентативных результатов.
11. МРТ осьминога
ПРИМЕЧАНИЕ: Ранее вызванные функциональные ответы МРТ в сетчатке осьминога были измерены у анестезированных животных70. Здесь мы получили МРТ нервной системы осьминога со сверхвысоким пространственным разрешением, которое требовало нескольких часов сканирования. Таким образом, это было выполнено в усыпленном O. bimaculoides.
- Получение МРТ-изображений с помощью системы 7T. Заверните осьминога в кухонную поливинилхлоридную полиэтиленовую пленку для поддержания гидратации тканей. Поместите осьминога на обертку, заверните в концы, а затем сверните, чтобы запечатать.
- Используйте объемную катушку передачи/приема диаметром 4 см для получения изображений мозга и нескольких рук. Используйте взвешенную последовательность T1 RARE со следующими параметрами: время повторения (TR) 1500 мс, время эха (TE) 20 мс, разрешение 117 x 117 x 500 мкм, 100 средних значений, коэффициент RARE 8. Это типичные параметры МРТ для визуализации мозга грызунов. Использование коэффициента RARE ускоряет получение изображения, в то время как 100 изображений усредняются вместе, чтобы увеличить отношение сигнал/шум71.
- Представьте себе рычаг осьминога с помощью передающей катушки объема 86 мм и 4-канальной катушки приема 4 x 4 см. Отрежьте руку хирургическими ножницами и поместите ее в коническую трубку объемом 15 мл, заполненную фосфатно-буферным физиологическим раствором.
ПРИМЕЧАНИЕ: Последовательность представляла собой T1_weighted инверсионную последовательность восстановления (MP-RAGE) с параметрами: TR/TE = 4000/2,17 мс, задержка инверсии 1050 мс, разрешение 100 x 100 x 500 мкм, 9 средних значений, время сканирования 1,5 ч (рисунок 7). Инверсионно-восстановительная последовательность обнуляет сигнал от воды и увеличивает контрастность внутри изображения; эта последовательность была выбрана потому, что она позволяет визуализировать внутреннюю анатомию arm72.
12. Криофлуоресцентная томография (ЦФТ)
- Вспышка-заморозка осьминога: Работайте в вытяжном капюшоне. Накройте дно Дьюара сухим льдом, а затем заполните гексанами. Медленно опустите осьминога в гексаны в течение примерно 10 минут, добавляя свежие гексаны и сухой лед по мере необходимости, чтобы полностью покрыть осьминога холодными гексанами. Держите осьминога замороженным при -20 °C до тех пор, пока он не будет внедрен.
- Встраивание и секционирование осьминога: Создайте прямоугольную форму соответствующего размера для удержания осьминога, используя инструменты, предоставленные производителем CFT. Накройте дно формы средой OCT (оптимальная температура резания) (стандартный материал, используемый в гистологических лабораториях) и дайте ей замерзнуть до полутвердого геля.
- Поместите замороженного осьминога в гель-слой ОКТ, а затем медленно накройте ОКТ в 2-3 слоя. Между этапами заливки заморозьте ступени блока до тех пор, пока ОКТ не достигнет стадии геля. После того, как осьминог будет полностью покрыт, заморозьте блок не менее 12 ч при -20 °C.
- Загрузите образец в криофлуоресцентную томографическую систему73.
- Секция и изображение всего усыпленного O. bimaculoides с мезоскопическим разрешением с использованием 3 фильтров излучения / возбуждения, тем самым производя несколько 3D-изотропных наборов данных.
- Когда сечение достигнет руки и пищеварительной системы, перенесите срезы на слайды для дальнейшей гистологии.
- Загрузите необработанный набор данных в программное обеспечение для реконструкции от поставщика CFT, специально разработанное для обеспечения быстрой обработки.
- Реконструкция 3-мерного стека с использованием выравнивания ориентиров, балансировки гистограммы, а также флуоресцентных коррекций и нормализации, включая удаление эффектов подповерхностной флуоресценции для каждой длины волны.
- После того, как окончательный 3D-стек будет создан инструментом реконструкции, визуализируйте данные с помощью программного инструмента визуализации и создайте пролеты с белым светом и флуоресцентными наложениями вместе с 3D-проекциями максимальной интенсивности (3D-MIPS), например, рисунок 873.
Результаты
Все животные в наших исследованиях были получены из дикой природы, и поэтому их точный возраст не мог быть определен, и их пребывание в лаборатории было переменным. Состояние осьминога наблюдалось ежедневно. Мы не видели паразитов, бактерий, повреждений кожи или ненормального поведени?...
Обсуждение
Настройка системы:
Аквариумная экосистема была разработана таким образом, что используются как механические, так и биологические методы фильтрации и насыщения воды кислородом. Фильтрующие элементы системы используют носковые фильтры, белковые скиммеры и регулярную очистк...
Раскрытие информации
Все авторы заявляют об отсутствии конфликта интересов.
Благодарности
Эта работа была поддержана NIH UF1NS115817 (G.P.). G.P. частично поддерживается грантами NIH R01NS072171 и R01NS098231. Мы хотели бы поблагодарить Патрика Закшевки и Мохаммеда Фархуда из Emit Imaging за помощь и поддержку в сборе и визуализации данных на платформе Xerra Imaging. МГУ имеет исследовательское соглашение с Bruker Biospin.
Материалы
| Name | Company | Catalog Number | Comments |
| 1-3/4 in. Drill Bit | Home Depot | 204074205 | Glass cutting tool Part number:1 |
| 1" flow sensors | Neptune Systems | Local Dealer | Pipe with sensor to measure water flow Part number:2 |
| 1" Slip Bulkhead Strainer | Bulk Reef Supply | 207113 | Strainer for water leaving tank Part number:3 |
| 10 gallon tank | Pruss Pets | Local Dealer | Fiddler crab holding tank Part number:4 |
| 4 inch X 12 inch 200 Micron Nylon Monofiliment Mesh Filter Sock w/ Plastic Ring | AQUAMAXX | UJ41171 | Filter for large organic matter in sump Part number:5 |
| 40 gallon aquarium | Pruss Pets | Local Dealer | 4 Food aquarium tanks Part number:6 |
| 60g poly tanks - rectangle | Pruss Pets | Local Dealer | 2 Water Storage (salt and freshwater) Part number:7 |
| Active Aqua 1/10th HP Hydroponic or Aquarium Chiller 2018 Model | WayWe | 719574198463 | For cooling water continuously Part number:8 |
| ALAZCO 2 Soft-Grip Handle Heavy-Duty Tile Grout Brush | ALAZCO | B06W2FT5V5 | Tank Cleaning Part number:9 |
| Ammonia Testing Kit | Aquarium Pharmaceuticals | 33D | For water testing Part number:10 |
| Apex system WiFi | Neptune Systems | Local Dealer | System connection for off site monitoring Part number:11 |
| API Aquarium Test Kit | Amazon | B001EUE808 | For water testing Part number:12 |
| API Copper Test Kit | Amazon | B0006JDWH8 | For water testing Part number:13 |
| Aqua Ultraviolet Classic UV 25 Watt Series Units | Aqua Ultraviolet | A00028 | For removing bacteria leaving sump system Part number:14 |
| AquaClear 50 Foam Filter Inserts, 3 pack | Aquaclear | A1394 | Food Tank Carbon Filter Inserts Part number:15 |
| Aqueon QuietFlow LED PRO Aquarium Power Filter 30 | Aqueon | 100106082 | Food tank filtering units Part number:16 |
| Auto Top Off Kit (ATK) (Each includes 1 FMM module, 2 optical sensors and 1 float) | Neptune Systems | Local Dealer | For freshwater tank Part number:17 |
| Automatic top off from RODI (LLC) | Neptune Systems | Local Dealer | From water storage to octopus tanks Part number:18 |
| Banded Trochus Snail | LiveAquaria | CN-112080 | For algae bin Part number:19 |
| Chaetomorpha Algae, Aquacultured | LiveAquaria | BVJ-76354 | For algae bin Part number:20 |
| Clams - Live, Hard Shell, Cherrystone, Wild, USA Dozen | Fulton Fish Market | N/A | Live food Part number:21 |
| Classic Sea Salt Mix - Tropic Marin | Bulk Reef Supply | 211813 | Salt for tank water Part number:22 |
| Clear Masterkleer Soft PVC Plastic Tubing, for Air and Water, 3/4" ID, 1" OD | McMaster | 5233K71 | Cleaning tool Part number:23 |
| Continuum Aquablade-P Acrylic Safe Algae Scraper W/ Plastic Blade - 15 Inch | Marine Depot | 4C31001 | Cleaning tool Part number:24 |
| Copper Testing Kit | Aquarium Pharmaceuticals | 65L | For water testing Part number:25 |
| Curve Refugium CREE LED Aquarium Light | Eshopps | 6500K | Algae bin light Part number:26 |
| Eheim 1262 return pumps | EHEIM | 1250219 | Pump for storage tanks Part number:27 |
| Eshopps R-100 Refugium Sump GEN 3 | Eshopps | 15000 | Sump system Part number:28 |
| Ethyl Alcohol, 200 Proof | Sigma-Aldrich | 64-17-5 | Anesthesia Part number:29 |
| Extech DO600 ExStik II Dissolved Oxygen Meter | Extech | DO600 | Oxygen measurment Part number:30 |
| Fiddler Crabs; live; dozen | NORTHEAST BRINE SHRIMP | N/A | Live food Part number:31 |
| Filter Cartrages | Aqueon | 100106087 | Food tank filters Part number:32 |
| Florida Crushed Coral Dry Sand - CaribSea | Bulk Reef Supply | 212959 | Sedimate for bottom of tank Part number:33 |
| FMM module | Neptune Systems | Local Dealer | Controller for apex system Part number:34 |
| Fritz-Zyme TurboStart 900 - Fritz | Bulk Reef Supply | 213036 | Bacteria start Part number:35 |
| Hand Operated Drum Pump, Siphon, Basic Pump with Spout, For Container Type Bucket, Pail | Granger | 38Y789 | Water Hand Pump Part number:36 |
| High pH Testing Kit | Aquarium Pharmaceuticals | 27 | For water testing Part number:37 |
| Imagitarium Fine Mesh Net for Shrimp | Petco | 2580993 | Shrimp and fish transfer net Part number:38 |
| Leak Detection Kit (LDK) - Includes FMM module plus 2 ALD sensors | Neptune Systems | Local Dealer | Placed on floor to detect water Part number:39 |
| Lee`S Algae Scrubber Pad Jumbo - Glass | Marine Depot | LE12007 | Cleaning tool Part number:40 |
| Live rocks | Pruss Pets | Local Dealer | Habitat for octopus Part number:41 |
| Long Bottle Cleaning Brush 17" Extra Long | Haomaomao | B07FS7J7PN | Tank Cleaning Part number:42 |
| Magnesium chloride | Sigma-Aldrich | M1028-100ML | Euthanasia Part number:43 |
| Magnetic Probe Rack | Neptune Systems | Local Dealer | For holding apex sensor probes Part number:44 |
| Marine Ghost Shrimp | NORTHEAST BRINE SHRIMP | N/A | Live food Part number:45 |
| Marineland C-Series Canister Carbon Bags Filter Media, 2 count | Chewy | 98331 | For elevated copper levels Part number:46 |
| Nitra-Zorb Bag | Aquarium Pharmaceuticals | AP2213 | Absorbes nirtogen compounds Part number:47 |
| Nitrate Testing Kit | Aquarium Pharmaceuticals | LR1800 | For water testing Part number:48 |
| Nitrite Testing Kit | Aquarium Pharmaceuticals | 26 | For water testing Part number:49 |
| Pawfly 2 Inch Air Stones Cylinder 6 PCS Bubble Diffuser Airstones for Aquarium Fish Tank Pump Blue | Amazon | B076S56XWX | Aierating water Part number:50 |
| Penn Plax Airline Tubing for Aquariums –Clear and Flexible Resists Kinking, 8 Feet Standard | Amazon | B0002563MM | Tubing for connecting air pump to air stone Part number:51 |
| Plumbing with unions/valves plus 3/4" flex hose | Pruss Pets | Local Dealer | Water transport Part number:52 |
| PM1 module | Neptune Systems | Local Dealer | Power control module for apex Part number:53 |
| Protein skimmer | Reef Octopus | AC20284 | Removes biowaste from system Part number:54 |
| PVC Apex Mounting board, grommets, wire mounts | Neptune Systems | Local Dealer | Helps ensure organization for wires and tubing within system Part number:55 |
| PVC Regular Cement and 4-Ounce NSF Purple Primer | Amazon | Oatey - 30246 | For connecting PVC pipes Part number:56 |
| RODI unit | Neptune Systems | Local Dealer | RO Water Part number:57 |
| Salinity Probes | HANNA probes | HI98319 | Measures salinity of water Part number:58 |
| Seachem Pristine Aquarium Treatment | Sea Chem | 1438 | Provides bacteria that break down excess food, waste and detritus Part number:59 |
| Seachem Stability Fish Tank Stabilizer | Sea Chem | 116012607 | Seachem Stability will rapidly and safely establish the aquarium biofilter in freshwater and marine systems Part number:60 |
| Set of lexan tops | Pruss Pets | Local Dealer | Aquarium tank lids Part number:61 |
| Set of Various extended length aquabus cables | Neptune Systems | Local Dealer | Cables for Apex system Part number:62 |
| SLSON Aquarium Algae Scraper Double Sided Sponge Brush Cleaner Long Handle Fish Tank Scrubber for Glass Aquariums | Amazon | B07DC2TZCJ | Cleaning tool Part number:63 |
| Standard-Wall PVC Pipe Fitting for Water, 45 Degree Elbow Adapter, 3/4 Socket Female x 3/4 Socket Male | McMaster | 4880K189 | PVC pipe Part number:64 |
| Standard-Wall PVC Pipe Fitting for Water, 90 Degree Elbow Adapter, 1 Socket Female x 1 Socket Male | McMaster | 4880K773 | PVC pipe Part number:65 |
| Standard-Wall PVC Pipe Fitting for Water, Adapter, 1 Socket-Connect Female x 1 Barbed Male | McMaster | 4880K415 | PVC pipe Part number:66 |
| Standard-Wall PVC Pipe Fitting for Water, Straight Reducer, 2 Socket Female x 3/4 Socket Female | McMaster | 4880K008 | PVC pipe Part number:67 |
| Standard-Wall PVC Pipe Fitting for Water, Tee Connector, White, 1 Size Socket-Connect Female | McMaster | 4880K43 | PVC pipe Part number:68 |
| Standard-Wall Unthreaded Rigid PVC Pipe for Water, 1 Pipe Size, 10 Feet Long | McMaster | 48925K13 | PVC pipe Part number:69 |
| Standard-Wall Unthreaded Rigid PVC Pipe for Water, 3/4 Pipe Size, 5 Feet Long | McMaster | 48925K92 | PVC pipe Part number:70 |
| Structural FRP Fiberglass Sheet, 48" Wide x 96" Long, 1/4" Thick | McMaster | 8537K15 | Table top material Part number:71 |
| Structural FRP Fiberglass Square Tube, 10 Feet Long, 2" Wide x 2" High Outside, 1/8" Wall Thickness | McMaster | 8548K33 | Structural table materal Part number:72 |
| Tank Sediment | TopDawg Pet Supply | 8479001207 | Sediment for bottom of fiddler crab tank Part number:73 |
| Temperature probe | Neptune Systems | Local Dealer | Temperature probe for tanks Part number:74 |
| Tetra TetraMarine Large Saltwater Flakes for all Marine Fish | Amazon | B00025K0US | Fish, shrimp, and crab food Part number:75 |
| Tetra Whisper Aquarium Air Pump for 10 gallon Aquariums | Petco | 2335234 | Air pump for smaller tanks Part number:76 |
| Thick-Wall Through-Wall Pipe Fitting, for Water, PVC Connector, 1 Socket-Connect Female | McMaster | 36895K843 | PVC pipe Part number:77 |
| Vectra s2 pump | Bulk Reef Supply | 212141 | Aquarium Pump Part number:78 |
| Water Pump | TACKLIFE | GHWP1A | Pump for cleaning tanks Part number:79 |
| Wyze Cam v2 1080p HD Indoor WiFi Smart Home Camera with Night Vision | Amazon | B076H3SRXG | DeepLabCut Recording Part number:80 |
Ссылки
- Wet, J. R., Wood, K. V., DeLuca, M., Helinski, D. R., Subramani, S. Firefly luciferase gene: structure and expression in mammalian cells. Molecular and Cellular Biology. 7 (2), 725-737 (1987).
- Han, X., Boyden, E. S. Multiple-color optical activation, silencing, and desynchronization of neural activity, with single-spike temporal resolution. PLoS One. 2 (3), 299 (2007).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Li, N., et al. Optogenetic-guided cortical plasticity after nerve injury. Proceedings of the National Academy of Sciences of the United States of America. 108 (21), 8838-8843 (2011).
- Airan, R. D., Li, N., Gilad, A. A., Pelled, G. Genetic tools to manipulate MRI contrast. NMR Biomedicine. 26 (7), 803-809 (2013).
- Cywiak, C., et al. Non-invasive neuromodulation using rTMS and the electromagnetic-perceptive gene (EPG) facilitates plasticity after nerve injury. Brain Stimulation. 13 (6), 1774-1783 (2020).
- Hwang, J., et al. Regulation of Electromagnetic Perceptive Gene Using Ferromagnetic Particles for the External Control of Calcium Ion Transport. Biomolecules. 10 (2), (2020).
- Lu, H., et al. Transcranial magnetic stimulation facilitates neurorehabilitation after pediatric traumatic brain injury. Scientific Reports. 5, 14769 (2015).
- Krishnan, V., et al. Wireless control of cellular function by activation of a novel protein responsive to electromagnetic fields. Bioscience Reports. 8 (1), 8764 (2018).
- Mitra, S., Barnaba, C., Schmidt, J., Pelled, G., Gilad, A. A. Functional characterization of an electromagnetic perceptive protein. bioRxiv. , 329946 (2020).
- Hunt, R. D., et al. Swimming direction of the glass catfish is responsive to magnetic stimulation. PLoS One. 16 (3), 0248141 (2021).
- Kandel, E. R., Krasne, F. B., Strumwasser, F., Truman, J. W. Cellular mechanisms in the selection and modulation of behavior. Neurosciences Research Program bulletin. 17, 521 (1979).
- Carew, T. J., Castellucci, V. F., Kandel, E. R. An analysis of dishabituation and sensitization of the gill-withdrawal reflex in Aplysia. International Journal of Neuroscience. 2 (2), 79-98 (1971).
- Kandel, E. R. The molecular biology of memory storage: a dialog between genes and synapses. Bioscience Reports. 21 (5), 565-611 (2001).
- Forsythe, J. W., Hanlon, R. T. Effect of temperature on laboratory growth, reproduction and life-span of octopus-bimaculoides. Marine Biology. 98 (3), 369-379 (1988).
- Forsythe, J. W., Hanlon, R. T. Behavior, body patterning and reproductive-biology of octopus-bimaculoides from California. Malacologia. 29 (1), 41-55 (1988).
- Pickford, B. M. The Octopus bimaculatus problem: A study in sibling species. Bulletin of the Bingham Oceanographic Collection. 12, 1-66 (1949).
- Sumbre, Y., Fiorito, G., Flash, T. Control of octopus arm extension by a peripheral motor program. Science. 293 (5536), 1845-1848 (2001).
- Gutfreund, Y., et al. Organization of octopus arm movements: a model system for studying the control of flexible arms. Journal of Neuroscience. 16 (22), 7297-7307 (1996).
- Gutfreund, Y., Matzner, H., Flash, T., Hochner, B. Patterns of motor activity in the isolated nerve cord of the octopus arm. The Biological Bulletin. 211 (3), 212-222 (2006).
- Hague, T., Florini, M., Andrews, P. L. R. Preliminary in vitro functional evidence for reflex responses to noxious stimuli in the arms of Octopus vulgaris. Journal of Experimental Marine Biology and Ecology. 447, 100-105 (2013).
- Hochner, B., Brown, E. R., Langella, M., Shomrat, T., Fiorito, G. A learning and memory area in the octopus brain manifests a vertebrate-like long-term potentiation. Journal of Neurophysiology. 90 (5), 3547-3554 (2003).
- Hochner, B., Glanzman, D. L. Evolution of highly diverse forms of behavior in molluscs. Current Biology. 26 (20), 965-971 (2016).
- Hvorecny, L. M., et al. Octopuses (Octopus bimaculoides) and cuttlefishes (Sepia pharaonis, S. officinalis) can conditionally discriminate. Animal Cognition. 10 (4), 449-459 (2007).
- Kier, W. M., Stella, M. P. The arrangement and function of octopus arm musculature and connective tissue. Journal of Morphology. 268 (10), 831-843 (2007).
- Levy, G., Hochner, B. Embodied organization of octopus vulgaris morphology, vision, and locomotion. Frontiers in Physiology. 8, 164 (2017).
- Giorgio-Serchi, F., Arienti, A., Laschi, C. Underwater soft-bodied pulsed-jet thrusters: Actuator modeling and performance profiling. The International Journal of Robotics Research. 35 (11), 1308-1329 (2016).
- Han, S., Kim, T., Kim, D., Park, Y., Jo, S. Use of deep learning for characterization of microfluidic soft sensors. IEEE Robotics and Automation Letters. 3 (2), 873-880 (2018).
- Hanassy, S., Botvinnik, A., Flash, T., Hochner, B. Stereotypical reaching movements of the octopus involve both bend propagation and arm elongation. Bioinspiration and Biomimetics. 10 (3), 035001 (2015).
- Hochner, B., Shomrat, T., Fiorito, G. The octopus: a model for a comparative analysis of the evolution of learning and memory mechanisms. The Biological Bulletin. 210 (3), 308-317 (2006).
- Imperadore, P., Fiorito, G. Cephalopod tissue regeneration: consolidating over a century of knowledge. Frontiers in Physiology. 9, 593 (2018).
- Imperadore, P., et al. Nerve regeneration in the cephalopod mollusc Octopus vulgaris: label-free multiphoton microscopy as a tool for investigation. Journal of the Royal Society, Interface. 15 (141), 20170889 (2018).
- Levy, G., Flash, T., Hochner, B. Arm coordination in octopus crawling involves unique motor control strategies. Current Biology. 25 (9), 1195-1200 (2015).
- Li, F., et al. Chromosome-level genome assembly of the East Asian common octopus (Octopus sinensis) using PacBio sequencing and Hi-C technology. Molecular Ecology Resources. 20 (6), 1572-1582 (2020).
- Lopes, V. M., Rosa, R., Costa, P. R. Presence and persistence of the amnesic shellfish poisoning toxin, domoic acid, in octopus and cuttlefish brains. Marine Environmental Research. 133, 45-48 (2018).
- Mazzolai, B., Margheri, L., Dario, P., Laschi, C. Measurements of octopus arm elongation: Evidence of differences by body size and gender. Journal of Experimental Marine Biology and Ecology. 447, 160-164 (2013).
- McMahan, W., et al. . Proceedings 2006 IEEE International Conference on Robotics and Automation, 2006. , 2336-2341 (2006).
- Meisel, D. V., Kuba, M., Byrne, R. A., Mather, J. The effect of predatory presence on the temporal organization of activity in Octopus vulgaris. Journal of Experimental Marine Biology and Ecology. 447, 75-79 (2013).
- Nesher, N., Levy, G., Grasso, F. W., Hochner, B. Self-recognition mechanism between skin and suckers prevents octopus arms from interfering with each other. Current Biology. 24 (11), 1271-1275 (2014).
- Wells, M. J. . Octopus : Physiology and behaviour of an advanced invertebrate. , (1978).
- Young, J. Z. . The anatomy of the nervous system of Octopus vulgaris. , (1971).
- Zullo, L., Sumbre, G., Agnisola, C., Flash, T., Hochner, B. Nonsomatotopic organization of the higher motor centers in octopus. Current Biology. 19 (19), 1632-1636 (2009).
- Albertin, C. B., et al. The octopus genome and the evolution of cephalopod neural and morphological novelties. Nature. 524 (7564), 220-224 (2015).
- Albertin, C. B., Simakov, O. Cephalopod Biology: At the intersection between genomic and organismal novelties. Annual Review if Animal Biosciences. 8, 71-90 (2020).
- Baik, S., et al. A wet-tolerant adhesive patch inspired by protuberances in suction cups of octopi. Nature. 546 (7658), 396-400 (2017).
- Pikul, J. H., et al. Stretchable surfaces with programmable 3D texture morphing for synthetic camouflaging skins. Science. 358 (6360), 210 (2017).
- Wehner, M., et al. An integrated design and fabrication strategy for entirely soft, autonomous robots. Nature. 536 (7617), 451-455 (2016).
- McMahan, W., et al. Field trials and testing of the OctArm continuum manipulator. Proceedings 2006 IEEE International Conference on Robotics and Automation, 2006. ICRA. , 2336-2341 (2006).
- Hochner, B., Brown, E. R., Langella, M., Shomrat, T., Fiorito, G. A learning and memory area in the octopus brain manifests a vertebrate-like long-term potentiation. Journal of Neurophysiology. 90 (5), 3547-3554 (2003).
- Tapia-Vasquez, A. E., et al. Proteomic identification and physicochemical characterisation of paramyosin and collagen from octopus (Octopus vulgaris) and jumbo squid (Dosidicus gigas). International Journal of Food Science & Technology. 55 (10), 3246-3253 (2020).
- Kim, B. -. M., et al. The genome of common long-arm octopus Octopus minor. GigaScience. 7 (11), (2018).
- Zarrella, I., et al. The survey and reference assisted assembly of the Octopus vulgaris genome. Scientific data. 6 (1), 13 (2019).
- Forsythe, J. W., Hanlon, R. T. Effect of temperature on laboratory growth, reproduction and life span of Octopus bimaculoides. Marine Biology. 98 (3), 369-379 (1988).
- Stoskopf, M. K., Oppenheim, B. S. Anatomic features of Octopus bimaculoides and Octopus digueti. Journal of Zoo and Wildlife Medicine. 27 (1), 1-18 (1996).
- Ramos, J. E., et al. Body size, growth and life span: implications for the polewards range shift of Octopus tetricus in south-eastern Australia. PLoS One. 9 (8), 103480 (2014).
- Hanlon, R. T., Forsythe, J. W. Advances in the laboratory culture of octopuses for biomedical research. Lab Animal Science. 35 (1), 33-40 (1985).
- Moltschaniwskyj, N. A., Carter, C. G. Protein synthesis, degradation, and retention: mechanisms of indeterminate growth in cephalopods. Physiological and Biochemical Zoology. 83 (6), 997-1008 (2010).
- Fiorito, G., et al. Guidelines for the care and welfare of Cephalopods in Research -A consensus based on an initiative by CephRes, FELASA and the Boyd Group. Lab Animal. 49, 1-90 (2015).
- Valverde, J. C., Garcia, B. G. Suitable dissolved oxygen levels for common octopus (Octopus vulgaris cuvier, 1797) at different weights and temperatures: analysis of respiratory behaviour. Aquaculture. 244 (1-4), 303-314 (2005).
- Cardeilhac, P. T., Whitaker, B. R. Copper Treatments: Uses and Precautions. Veterinary Clinics of North America: Small Animal Practice. 18 (2), 435-448 (1988).
- Hodson, P. V., Borgman, U., Shear, H. Toxicity of copper to aquatic biota. Copper in the Environment. (2), 307-372 (1979).
- Poole, B. M. Techniques for the culture of ghost shrimp (palaemonetes pugio). Environmental Toxicology and Chemistry. 7 (12), 989-995 (1988).
- Burggren, W. W. Respiration and circulation in land crabs: novel variations on the marine design. American Zoologist. 32 (3), 417-427 (1992).
- Reitsma, J., Murphy, D. C., Archer, A. F., York, R. H. Nitrogen extraction potential of wild and cultured bivalves harvested from nearshore waters of Cape Cod, USA. Marine Pollution Bulletin. 116 (1), 175-181 (2017).
- Messenger, J. B. Cephalopod chromatophores: neurobiology and natural history. Biological Reviews. 76 (4), 473-528 (2001).
- Morgan Holst, M. M., Miller-Morgan, T. The Use of a species-specific health and welfare assessment tool for the giant pacific octopus, enteroctopus dofleini. Journal of Applied Animal Welfare Science. 24 (3), 272-291 (2021).
- Rosas, C., et al. Energy balance of Octopus maya fed crab or an artificial diet. Marine Biology. 152 (2), 371-381 (2007).
- Anderson, R. C., Wood, J. B., Byrne, R. A. Octopus Senescence: The Beginning of the end. Journal of Applied Animal Welfare Science. 5 (4), 275-283 (2002).
- Butler-Struben, H. M., Brophy, S. M., Johnson, N. A., Crook, R. J. In vivo recording of neural and behavioral correlates of anesthesia induction, reversal, and euthanasia in cephalopod molluscs. Frontiers in Physiology. 9, 109 (2018).
- Jiang, X., et al. Octopus visual system: A functional MRI model for detecting neuronal electric currents without a blood-oxygen-level-dependent confound. Magnetic Resonance in Medicine. 72 (5), 1311-1319 (2014).
- Hennig, J., Nauerth, A., Friedburg, H. RARE imaging: a fast imaging method for clinical MR. Magnetic Resonance in Medicine. 3 (6), 823-833 (1986).
- Brant-Zawadzki, M., Gillan, G. D., Nitz, W. R. MP RAGE: a three-dimensional, T1-weighted, gradient-echo sequence--initial experience in the brain. Radiology. 182 (3), 769-775 (1992).
- Bertapelle, C., Polese, G., Di Cosmo, A. Enriched environment increases PCNA and PARP1 Levels in Octopus vulgaris central nervous system: first evidence of adult neurogenesis in Lophotrochozoa. Journal of Experimental Zoology Part B: Molecular and Developmental Evolution. 328 (4), 347-359 (2017).
- Maselli, V., Polese, G., Soudy, A. -. S. A., Buglione, M., Cosmo, A. D. Cognitive stimulation induces differential gene expression in Octopus vulgaris: The key role of protocadherins. Biology. 9, (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены