Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İçsel Olarak Düzensiz Proteinlerin Kendi Kendine İlişkilerini Tespit Etmek ve Karakterize Etmek için Paramanyetik Gevşeme Geliştirmesi
Bu Makalede
Özet
Doğası gereği düzensiz proteinlerde zayıf ve geçici moleküller arası ve moleküller arası etkileşimleri tespit etmek için paramanyetik gevşeme geliştirme NMR spektroskopisinin uygulanması için bir protokol sunulmaktadır.
Özet
Proteinler içindeki doğal olarak düzensiz proteinler ve içsel olarak düzensiz bölgeler, insan proteomunun büyük ve işlevsel olarak önemli bir bölümünü oluşturur. Bu dizilerin oldukça esnek doğası, çeşitli biyomoleküler ortaklarla zayıf, uzun menzilli ve geçici etkileşimler oluşturmalarına izin verir. Spesifik ancak düşük afiniteli etkileşimler, rastgele bağlanmayı teşvik eder ve özünde düzensiz tek bir segmentin çok sayıda hedef bölgeyle etkileşime girmesini sağlar. Bu etkileşimlerin geçici doğası nedeniyle, tek ve baskın bir konformasyon oluşturmak için proteinlere dayanan yapısal biyoloji yöntemleriyle karakterize edilmeleri zor olabilir. Paramanyetik gevşeme geliştirme NMR, zayıf ve geçici etkileşimlerin yapısal temelini tanımlamak ve tanımlamak için yararlı bir araçtır. Doğası gereği düzensiz proteinler ile bunların proteini, nükleik asidi veya diğer biyomoleküler ortakları arasında oluşan düşük nüfuslu karşılaşma komplekslerini karakterize etmek için paramanyetik gevşeme geliştirmesini kullanmak için ayrıntılı bir protokol açıklanmaktadır.
Giriş
İçsel bozukluk (ID), kendiliğinden stabil ikincil veya üçüncül yapılara katlanmayan, ancak biyolojik olarak aktif olan proteinleri (IDP'ler) veya proteinler (IDR'ler) içindeki bölgeleri tanımlar. Genel olarak, IDP/IDR'lerin işlevi, fizyolojik koşullarda biyomoleküllerle spesifik ancak geri dönüşümlü etkileşimleri kolaylaştırmaktır1. Bu nedenle, IDP'ler ve IDR'ler, çoklu protein komplekslerinin işe alınması, organizasyonu ve stabilizasyonu dahil olmak üzere bir dizi hücresel fonksiyonda yer alır, örneğin, splisozom2'nin montajı ve aktivitesi, DNA hasarı3 bölgelerinde bileşenlerin işe alınması ve organizasyonu, transkripsiyon komplekslerinin4 veya kromatin yeniden şekillendirici BAF5'in işe alınmasının organizasyonu ve stabilizasyonu. Ek olarak, IDP'ler, farklı bağlanma ortakları için rastgele cinsel ilişkilerinin hücresel protein ağları aracılığıyla bilgi aktarımına aracılık etmelerini sağladığı sinyal bağlantı noktalarında bulunur6. Son zamanlarda yapılan çalışmalar, IDR bölgelerinin sıvı-sıvı faz ayırma işlemi yoluyla biyomoleküler kondensatlar oluşturarak kendi kendine birleşme eğilimini de ortaya koymuştur7. ID'yi içeren yukarıda bahsedilen işlevlerin birçoğunun artık kondens oluşumunun bir yönünü de içerdiği düşünülmektedir8. ID'nin biyomoleküler kompleks montajı, stabilizasyonu, iskelesi ve sinyal iletimi için önemine rağmen, IDP'ler ve IDR'ler tipik olarak x-ışını kristalografisi veya kriyojenik elektron mikroskobu kullanılarak yapısal araştırmalara uygun olmadığından, spesifik etkileşimlerinin atomik ayrıntılarının tanımlanması zordur.
Nükleer manyetik rezonans (NMR), sert veya homojen yapısal toplulukların varlığına bağlı olmadığı, ancak tek tek çekirdeklerin yakın yerel ortamı hakkında rapor verdiği için ID'yi araştırmak için ideal bir tekniktir. Belirli bir moleküldeki bir çekirdeğin rezonans frekansı veya kimyasal kayması, yerel elektronik dağılımın neden olduğu zayıf manyetik alanlardan etkilenir ve bu da bağ uzunluklarına, açılarına, diğer çekirdeklerin yakınlığına, bağlanma ortaklarıyla etkileşimlere ve diğer faktörlerebağlıdır 9. Böylece, her çekirdek, yerel kimyasal ortamındaki değişikliklere duyarlı, benzersiz, bölgeye özgü bir yapısal prob görevi görür. Bu avantajlara rağmen, NMR bir yığın tekniğidir ve gözlemlenen kimyasal kayma, belirli bir çekirdek tarafından örneklenen tüm ortamların ortalamasıdır. Birçoğu bu sayıda açıklanan bir dizi NMR tekniği, ortalama kimyasal kaymada10,11 bulunan yüksek enerjili, düşük nüfuslu biyomoleküler konformasyonlar hakkında yapısal, dinamik ve kinetik bilgileri geri kazanmak için geliştirilmiştir. Geçici olarak doldurulmuş olmasına rağmen, bu durumların tanımlanması ve ölçülmesi, işlevsel mekanizmaların ayrıntılarını belirlemek için önemlidir12. Örneğin, IDP'ler ve IDR'ler söz konusu olduğunda, konformasyonel topluluk, fizyolojik bağlanma ortaklarıyla karşılaşma komplekslerinin oluşumu için üretken olan konformasyonları tercihen örneklemek için önyargılı olabilir. Bu durumların tespiti ve kalıntıya özgü moleküller arası ve moleküller arası etkileşimlerin ve dinamiklerin tanımlanması, protein fonksiyonunun ve kompleks oluşumunun altında yatan yapısal mekanizmaları belirlemek için önemlidir.
IDP/IDR aracılı biyomoleküler komplekslerin oluşumu için önemli olan geçici, düşük nüfuslu durumları araştırmak için paramanyetik gevşeme geliştirme (PRE) NMR'yi kullanmak için bir protokol açıklanmaktadır13. Bu yaklaşım, α-sinüklein 14,15'ten amiloid fibrillerin montajını veya FUS16'nın kendi kendine birleşmesini destekleyenler gibi geçici protein-protein etkileşimlerini incelemek ve ayrıca sinyal proteinleri 17 arasındaki gibi spesifik protein-protein etkileşimlerini karakterize etmek için kullanışlıdır. Spesifik moleküller arası ve moleküller arası etkileşimlerin tercihli olarak sıkıştırılmış durumların yanı sıra kendi kendine birleşmeyi yönlendiren bölgeye özgü etkileşimlerle sonuçlandığı, kendi kendini ilişkilendiren bir IDP örneği sunulmaktadır.
PRE, bir çekirdeğin, genellikle bir nitroksit grubu üzerinde eşleşmemiş bir elektron şeklinde veya bir paramanyetik metal atomu18 olarak sağlanan izotropik bir g-tensörü ile bir paramanyetik merkeze manyetik dipolar etkileşiminden kaynaklanır (Şekil 1). Anizotropik g-tensörlü atomlar da bir PRE etkisi üretirken, bu sistemlerin analizi, yalancı temas kaymaları (PCS) veya artık dipolar eşleşmenin (RDC) katkıda bulunduğu karıştırıcı etkiler nedeniyle daha zordur13,19. Bir çekirdek ile paramanyetik merkez arasındaki etkileşimin gücü, ikisi arasındaki <r-6> mesafesine bağlıdır. Bu etkileşim, nükleer gevşeme oranlarında bir artışa neden olur, bu da uzun menzilli etkileşimler (~ 10-35 Å) için bile tespit edilebilir çizgi genişlemesine neden olur, çünkü eşleşmemiş elektronun manyetik momenti çok güçlüdür20,21. PRE ile geçici durumların tespiti, aşağıdaki iki koşulun karşılanması durumunda mümkündür; (1) geçici etkileşim, NMR zaman ölçeğinde hızlı bir değişim içindedir (gözlemlenen kimyasal kayma, değiş tokuş durumlarının nüfus ağırlıklı ortalamasıdır); ve (2) çekirdeklerin paramanyetik merkez mesafesi, geçici nüfuslu durumda ana durum11'den daha kısadır. Enine PRE, Γ2 ile gösterilir ve pratik amaçlar için, bir paramanyetik merkez içeren bir numune ile bir diyamanyetik kontrol arasındaki 1H enine gevşeme oranlarındaki farktan hesaplanır. Hızlı ve yavaş değişim rejimlerinde PRE teorisinin ve ilgili sözde temas kaymalarının derinlemesine bir tedavisi için, okuyucu Clore ve çalışma arkadaşları13,22 tarafından yapılan kapsamlı incelemelere yönlendirilir. Burada sadece 1H N-Γ2'nin hızlı değişim rejiminde olduğu durum dikkate alınır, burada PRE'nin r-6 bağımlılığı nedeniyle, gözlenen gevşeme oranı hem paramanyetik merkezin çekirdeğe yaklaştığı mesafe hem de bu konformasyonda geçirdiği süre ile ilgilidir. Bu nedenle, yakın bir yaklaşım içermeyen geçici konformasyonlar küçük bir PRE üretirken, daha yakın etkileşimler, kısa ömürlü olsa bile, daha büyük bir PRE üretecektir.
IDP'ler için PRE, tek bir molekül içinde (molekül içi) ve ayrı moleküller (termoleküler) arasında meydana gelen etkileşimleri ölçmek ve ayırt etmek için kullanılır. Bir NMR görünür (örneğin, 15N-etiketli) veya NMR görünmez (örneğin, doğal bolluk 14N) proteinine bir paramanyetik merkez ekleyerek, PRE'nin kaynağı (moleküller arası veya moleküller arası) belirlenebilir (Şekil 2). Bir sistein kalıntısı ekleyen bölgeye yönelik mutajenez, bir proteine bir paramanyetik merkez (spin-label) eklemek için uygun bir yaklaşımdır23. Metal şelatlama (EDTA bazlı) ve serbest radikal (nitroksit bazlı) dahil olmak üzere spin etiketleri olarak kullanılmak üzere çeşitli molekül türleri önerilmiştir24. Çeşitli nitroksit spin etiketleri tanımlanmıştır ve methanetiosülfonat, maleimid ve iyodoasetamid25,26 gibi farklı sistein reaktif kimyaları ile mevcuttur (Şekil 1). Etiketin veya bağlayıcının doğal esnekliği belirli analizler için sorunlu olabilir ve bu durumlarda, etiketin hareketini sınırlamak için hacimli kimyasal gruplar eklemek veya etiketi proteine sabitlemek için ikinci bir bağlayıcının kullanılması gibi farklı stratejiler önerilmiştir (iki bölge eki)27, 28. Ek olarak, ticari olarak temin edilebilen etiketler diastereomerik proteinler içerebilir, ancak genellikle bu, gözlemlenen PRE29'a katkıda bulunmayacaktır. Maleimid kimyası yoluyla serbest bir sisteine bağlanan 3-Maleimido-PROXYL'in kullanımı, kolayca temin edilebildiği, uygun maliyetli, geri dönüşümsüz olduğu ve indirgeyici ajan tris (2-karboksietil) fosfin (TCEP) etiketleme reaksiyonu boyunca çözelti içinde tutulabildiği için açıklanmaktadır. 3-Maleimido-PROXYL izotropik bir g-tensöre sahip olduğundan, hiçbir PCS veya RDC indüklenmez ve aynı kimyasal kayma atamaları hem paramanyetik hem de diyamanyetik numuneleriçin kullanılabilir 13.
1H N-T2, daha önce 8 ila 12 zaman noktasından oluşan tam bir evrim serisini toplamak kadar doğru olduğu gösterilen iki zaman noktası stratejisi (T a, Tb) kullanılarak ölçülür30. İlk zaman noktası (T a) pratik olarak sıfıra yakın olarak ayarlanır ve ikinci zaman noktasının optimum uzunluğu, belirli bir numune için beklenen en büyük PRE'nin büyüklüğüne bağlıdır ve şu şekilde tahmin edilebilir: Tb ~ 1.15/(R 2,dia + Γ 2) burada R2,dia, diyamanyetik numunenin R2'sini temsil eder13. En büyük PRE'lerin büyüklüğü bilinmiyorsa, Tb'yi proteinin 1 H T2'sinin ~bir katına ayarlamak iyi bir başlangıç tahminidir ve sinyali gürültüye iyileştirmek için T2'yi ayarlayarak daha da optimize edilir. Bu iki noktalı ölçüm stratejisi, PRE'leri ölçmek için gereken deneysel süreyi önemli ölçüde azaltır ve özellikle moleküller arasındaki spesifik olmayan temasların etkilerini en aza indirmek için nispeten seyreltik numuneler kullanıldığından, daha fazla sinyal ortalaması için zaman sağlar. 1H N-T2'yi ölçmek için HSQC tabanlı bir darbe dizisi kullanılır ve başka bir yerdeayrıntılı olarak açıklanmıştır 30. Daha iyi hassasiyet için, ileri ve geri BECERIKLİ transferlerin sert darbeleri şekilli darbelerle değiştirilebilir; alternatif olarak, dizi kolayca TROSY tabanlı bir okuma31'e dönüştürülür. IDP'ler tipik olarak, benzer büyüklükteki küresel proteinlerden daha dar çizgi genişliklerine (doğal bozukluk nedeniyle) neden olan çok daha uzun enine gevşeme oranlarına sahip olduklarından, spektral çözünürlüğü iyileştirmek ve IDP'lerin doğasında bulunan kimyasal kayma dağılım sınırlamasını hafifletmek için dolaylı boyutta uzun alım süreleri kullanılabilir.
PRE, protein-protein ve protein-nükleik asit etkileşimlerini, özellikle geçici veya düşük nüfuslu etkileşimleri incelemek için yararlı bir araçtır. Protein saflaştırma, sahaya yönelik spin etiketleme, nabız programının ayarlanması ve kalibre edilmesi, NMR verilerinin işlenmesi ve yorumlanması dahil olmak üzere PRE'leri ölçmek için uygun bir NMR numunesinin hazırlanması için ayrıntılı bir protokol sağlanır. Numune konsantrasyonu, spin etiketinin seçimi ve paramanyetik bileşenlerin çıkarılması dahil olmak üzere veri kalitesini ve deneysel sonucu etkileyebilecek önemli deneysel hususlar not edilmiştir.
Protokol
Protokol için genel gereksinimler: protein saflaştırma tesisleri, UV-Vis spektrometresi, yüksek alanlı NMR spektrometresi ve işletim yazılımı, işlem sonrası analiz yazılımı; NMRPipe32, Sparky 33 (veya CCPN Analizi 34 veya NMRViewJ35).
1. PRE ölçümleri için bir proteinin rekombinant ekspresyonu ve saflaştırılması
- İlgilenilen protein için tek bir sistein kalıntısı olacak şekilde bir ekspresyon yapısı tasarlayın. İlgilenilen proteinde farklı pozisyonlarda serbest bir sistein eklemek için çoklu mutasyonlar gerekecektir36.
- Yerleşik bir protokol37 kullanarak ilgilenilen proteinin doğal bolluğu (14N) veya 15N etiketli bir örneğini ifade edin ve saflaştırın.
NOT: E. coli ekspresyon sistemleri, 15 N'lik izotopik zenginleştirme, biyomoleküler heteronükleer NMR spektroskopisi için minimum bir gereklilik olduğundan, rekombinant protein ekspresyonu için uygun maliyetli ve sağlam bir yöntem sağlar. Tipik adımlar, minimal ortamda ekspresyon, kromatografik saflaştırma ve afinite saflaştırma etiketinin çıkarılmasıdır. Bu protokol, NMR araştırmaları için uygun kalitede yeterli protein üretebilen sağlam bir ekspresyon ve saflaştırma protokolünün oluşturulduğunu varsayar.- Serbest sisteinin reaksiyonunu ve IDP'ler için moleküller arası disülfür bağlarının oluşumunu önlemek için tüm saflaştırma adımlarında tamponlarda 1 mM indirgeyici ajan (DTT veya TCEP) bulundurun.
NOT: Bazı sistemler, proteinin spesifik özelliklerinin yanı sıra saflaştırma için seçilen sıcaklık, pH ve tampon sistemine bağlı olarak indirgeyici olmayan koşullara daha toleranslı ve daha az agregasyona eğilimli olabilir38. - Devam etmeden önce saflaştırma için kullanılan afinite etiketlerini çıkarın, çünkü bunlar proteinle öngörülemeyen şekillerde spesifik olmayan bir şekilde etkileşime girebilir veya muhtemelen yanlışlıkla istenmeyen bir bağlanma bölgesi olarak hizmet edebilecek reaktif sistein kalıntıları içerebilir.
- Çözücü PRE'lerin katkısını değerlendirmek için spin etiketinin çözünür bir versiyonu ile karıştırılmış sistein mutasyon(lar)ı olmadan 15N etiketli bir referans numunesi hazırlayın.
- Serbest sisteinin reaksiyonunu ve IDP'ler için moleküller arası disülfür bağlarının oluşumunu önlemek için tüm saflaştırma adımlarında tamponlarda 1 mM indirgeyici ajan (DTT veya TCEP) bulundurun.
2. 3-Maleimido-PROXYL nitroksit spin etiketinin konjuge edilmesi
- Saflaştırılmış proteini 50 mM Tris pH 7 ve 1 mM TCEP içeren gazı alınmış bir tamponda saklayın veya değiştirin; tampon ayrıca protein çözünürlüğüne yardımcı olmak için gerekirse 8 M'ye kadar üre içerebilir.
Alternatif olarak, bir protein stok çözeltisini, gazı alınmış 50 mM Tris pH 7 ve 1 mM TCEP tamponunun en az 10 hacim eşdeğerine hızla seyreltin. Spin etiketi eklemeden önce protein konsantrasyonunun en az 100 μM olduğundan emin olun. - İlgilenilen proteinin 20x molar fazlasına bir stok çözeltisinden 3-Maleimido proxyl ekleyin. Numuneyi ışıktan ve oksijenden koruyun ve gece boyunca oda sıcaklığında veya 4 °C'de inkübe edin; Nazik sallama veya nutasyon, etiketleme verimliliğini artırabilir.
- 3-Maleimido proxyl tozunu %95 etanol içinde çözerek spin etiketinin stok çözeltilerini hazırlayın. Stokların tamamı -80 °C'de 6 aydan daha kısa süre saklanabilir.
- Kritik adım: Spesifik olmayan çözücü PRE'leri önlemek için reaksiyona girmemiş serbest spin etiketini çıkarın. Bunu, protein örneğinin jel filtrasyonu veya (tercihen) kapsamlı diyalizi ile elde edin. Bu adım aynı zamanda proteini NMR için uygun bir tampona sokacaktır.
NOT: İndirgeyici maddeler taze olarak hazırlanmalı ve tampon bileşenleri arasındaki uyumluluk dikkate alınmalıdır; örneğin, TCEP fosfat bazlı tamponlarda hızla bozunur ve bu kombinasyondan kaçınılmalıdır39. - Bu adımdan itibaren kullanılan tüm tamponlara, paramanyetik iyonları veya spin etiketli söndürücüleri uzaklaştırmak için iki değerlikli ve geçiş metalleri için seçici bir şelatlama reçinesi uygulayın. Protein bir NMR tamponunda saklanamıyorsa, hızla seyreltilecek proteini NMR için uygun bir tampona konsantre edin.
- Spin-label birleştirme verimliliğinin izlenmesi.
- Çözelti 40'taki serbest sülfhidril gruplarını ölçmek için Ellman reaktifini (5,5-ditio-bis-(2-nitrobenzoik asit) kullanın.
NOT: Ayrıntılı protokoller üreticiden temin edilebilir. Buradaki amaçlar için, spin etiketinin dahil edilmesinin belirlenmesi önemlidir, serbest sülfhidril gruplarının konsantrasyonu toplam protein konsantrasyonu ile karşılaştırılır. Serbest sülfhidril gruplarının yüzdesi, nitroksit spin etiketi iliştirilmemiş moleküllerin yüzdesidir. - İlgilenilen proteine spin-etiket katılımını değerlendirmek için etiketli sistein kalıntısına karşılık gelen pikin yoğunluğunu izleyin.
NOT: Bu, proteinin spin etiketleme derecesini belirlemek için hızlı ve etkili bir yaklaşımdır. Spin etiketinin tamamen dahil edilmesi, tepe noktasının spektrumdan kaybolmasına neden olacaktır. IDP'lerin zayıf dağılım karakteristiği ile mutant sistein kalıntısına karşılık gelen tepe noktası her zaman kolayca tanımlanamayabilir ve bu nedenle Ellman reaktifinin (adım 2.6.1) kullanılması önerilir.
- Çözelti 40'taki serbest sülfhidril gruplarını ölçmek için Ellman reaktifini (5,5-ditio-bis-(2-nitrobenzoik asit) kullanın.
3. Molekül içi veya moleküller arası PRE'yi ölçmek için NMR numunesi hazırlayın
- Molekül içi PRE ölçümü için numune hazırlayın
- NMR için uygun bir tamponda en az 100 μM, ancak 300 μM'den fazla olmayan bir konsantrasyona kadar 15N izotopik olarak zenginleştirilmiş, spin etiketli protein hazırlayın. Toplam numune hacmi (D2Odahil) 500 - 550 μL'dir.
NOT: Yaygın NMR tamponları arasında fosfat, asetat, (bi)karbonat ve TRIS bulunur. MES, HEPES gibi iyi tamponlar da uygun olabilir. Diğer çözelti bileşenleriyle çapraz reaktivite olmamasını sağlamak için arabellekleri seçerken dikkatli olun. - Su ile amid proton değişiminin etkilerini en aza indirmek için pH'ın ~7.2 veya daha düşük olduğundan emin olun. Tuz konsantrasyonunu mümkün olduğunca düşük tutun (tipik olarak 150 mM'den az), ancak birincil husus protein stabilitesini korumaktır.
NOT: Yüksek tuz koşullarında NMR deneyleri yürütme yaklaşımları başka bir yerdeaçıklanmıştır 41.
- NMR için uygun bir tamponda en az 100 μM, ancak 300 μM'den fazla olmayan bir konsantrasyona kadar 15N izotopik olarak zenginleştirilmiş, spin etiketli protein hazırlayın. Toplam numune hacmi (D2Odahil) 500 - 550 μL'dir.
- Moleküller arası PRE ölçümü için numune hazırlayın
- Bu adımı veya adım 3.1'i izleyin; Aynı anda yapılmazlar. Seçilen NMR tamponunda 14N doğal bolluk, spin etiketli protein hazırlayın.
- Protein numunesini, 15N izotopik olarak zenginleştirilmiş, spin etiketli olmayan proteini, %1-50 14N doğal bolluk, spin etiketli protein ile karıştırarak hazırlayın, böylece nihai konsantrasyon 3.1.1'de hazırlanan numune ile aynı olur. Toplam numune hacmi (D2Odahil) 500 - 550 μL'dir.
- İncelenen her protein için 15N ve 14N proteinlerinin oranını ampirik olarak optimize edin. 14N-spin etiketli proteinin %1, %5 ve %20 oranları iyi başlangıç noktalarıdır.
NOT: Eklenen 14N-spin etiketli proteinin bir fonksiyonu olarak PRE'nin birikmesi, belirli bir etkiyi gösterir; gözlemlenen PRE, mesafeye ve popülasyona (yukarıda tartışıldığı gibi) bağlı olduğundan örneğe özgüdür ve bu nedenle, etkileşim özellikle geçici ise daha yüksek oranlarda 14N-spin etiketli protein gerekli olacaktır17.
- NMR (molekül içi veya moleküller arası) numuneyi, uzun saplı (5") cam pipet veya mikropipet kullanarak yüksek alanlı mıknatıslarda kullanıma uygun 9 mm'lik bir NMR tüpüne aktarın. Alan kilitlemeyi kolaylaştırmak için tüm NMR numunelerinin %5-10 D2Oiçerdiğinden emin olun.
NOT: Gerekli numune hacmini azaltmak için polimer tapalar kullanan NMR tüpleri, etkili numune şimleme ile ilgili zorluklar nedeniyle PRE ölçümleri için önerilmez.
4. NMR spektrometresini ayarlayın ve belirli parametreleri deneyin
- Süper iletken, yüksek alanlı NMR spektrometreleri etrafında çalışırken çok dikkatli olun.
NOT: Tehlikeler, metalik nesnelerin mıknatısa doğru ani hızlanmasından kaynaklanan yaralanmaları, implante edilmiş tıbbi cihazlarla etkileşimi ve bir mıknatısın sönmesi durumundaN2 ve He2 gazının aniden salınmasından kaynaklanan boğulmayı içerir. Aşağıdaki adımlar, okuyucunun gerekli eğitimden geçtiğini, bu ve diğer yerel tehlikelerin farkında olduğunu ve NMR spektrometresini çalıştırmak için tesis yöneticisinden onay aldığını varsayar. Bir adım veya talimattan şüphe duyduğunuzda, olası kişisel yaralanmaları veya spektrometrenin hasar görmesini önlemek için tesis yöneticisine veya deneyimli kullanıcıya danışın. - Aşağıdaki adımlarda, satın alma kontrol yazılımının modern bir sürümünü çalıştıran ticari bir NMR spektrometresi varsayılmaktadır. Darbe programını ve parametre dosyalarını indirin ve bunları uygun dizinlere yerleştirin.
NOT: Bruker spektrometresi ve TopSpin (3.2 veya üstü) ile kullanıma uygun bir darbe programı ve parametre seti, yazarlardan talep üzerine temin edilebilir.- Kritik adım: Yerel olmayan NMR darbe programlarının kurulumuna aşinalık varsayılır; Gerekirse tesis yöneticisine veya deneyimli bir kullanıcıya danışın.
- Numuneyi mıknatısa yerleştirin, Kilitle komutunu kullanarak 2H sinyalini kilitleyin, 1H kanalını tesis protokollerine göre ayarlayın ve eşleştirin (kesin prosedür, probun bir uzaktan ayarlama ve eşleştirme modülü ile donatılıp donatılmadığına bağlı olacaktır).
- Solvent sinyal bastırmasını optimize etmek için topshim alt yordamını kullanarak şimleri ayarlayın.
- Standart yöntemleri kullanarak 1H ve 15N 90° darbeleri kalibre edin.
- Popt programını kullanarak 1H darbeyi kalibre edin (darbe uzunluğunu tahmin etmek için önce darbeyi kullanın).
- 15N darbeyi standart bir örneğe göre kalibre edin; Bir teknik direktör veya deneyimli bir kullanıcı ile görüşerek bu değerin yakın zamanda kalibre edildiğinden emin olun.
- Alternatif olarak, sıfır sinyal elde edilene kadar bir HMQC deneyinin 15° darbelerinden birini değiştirerek numune üzerindeki 90 N darbeyi kalibre edin.
- Şekil aracı (stdisp) alt yordamını kullanarak şekilli darbeler için doğru zayıflamayı belirleyin.
- Klasör simgesine tıklayarak uygun darbe şekli dosyasını açın. Şekillendirilmiş darbeler, ACQUPARS'ın darbe parametreleri bölümünde bulunur.
- Darbe tanım dosyasını yükleyin ve Dalga Formunu Analiz Et > Şekli Entegre Et'e tıklayın. Kalibre edilmiş 1H 90° sert darbeyi, istenen şekilli darbe uzunluğunu ve dönüşü (90° veya 180°) girin.
- Kalibre edilmiş 90° darbe için zayıflamaya güç seviyesi değişikliğini ekleyerek şekillendirilmiş darbenin güç seviyesini hesaplayın.
- Süpürme genişliğini, taşıyıcı frekansını optimize etmek ve su bastırmayı kontrol etmek için standart bir 1H, 15N HSQC (hsqcetfpf3gpsi) kaydedin25.
- sw ve td komutlarını kullanarak veya doğrudan uygun iletişim kutularında tarama genişliğini ve dolaylı boyut artışlarının sayısını ayarlayın. Tipik olarak, PRE'leri toplamak için, spektrum katlanmayacak şekilde spektral genişlikler seçilir.
5. 1HN-T 2 deneyini kurun
- Şekilli darbeleri yukarıda açıklandığı gibi kalibre edin (4.4.5-4.5.7). PRE deneyi için şekillendirilmiş darbe parametre dosyaları Eburp2.1000 (90° darbe), Reburp.1000 ve Iburp2.1000'dir. ACQUPARS sekmesindeki darbe parametreleri bölümüne kalibre edilmiş darbe uzunluklarını girin.
- Bu deney, iki zaman gecikme noktası yaklaşımı30'u kullanarak 1H NT2'yi ölçer.
- Vdlist dosyasını düzenleyerek zaman gecikmelerini ayarlayın, ilk gecikme (Ta) 0,01 ms olarak ayarlanır.
- Beklenen maksimum PRE (T b ~ 1.15/(R 2,dia + Γ 2) ile olan ilişkiyi kullanarak ikinci gecikmeyi (T b) seçin, burada R 2,dia, diyamanyetik numunenin R2'sini temsil eder13. Gözlenen gevşemeye PRE katkısının büyüklüğü hakkında önceden bilgi sahibi olmadan, Tb'yi ~1x 1H T2'ye ayarlamak iyi bir başlangıç noktasıdır.
- Ardından, T a ve T b spektrumlarının ilk artışlarını (efp komutuyla işlenir) karşılaştırarak ve Tb'yi sinyalin başlangıç değerinin %40-50'si arasında düşecek şekilde ayarlayarak uygun bir değer belirleyin.
NOT: Bu yaklaşım, yüksek konsantrasyonlu (50 μM'<) numuneler için gerekli bir husus olan spektral sinyal-gürültüyü optimize eder. Uygun Tb değerleri örneğe bağlıdır, ancak ortalama büyüklükteki bir protein için tipik olarak 8 - 40 ms arasında değişir.
- Yeterli sinyal ortalaması için kaydedilecek karmaşık noktaların sayısını ve tarama sayısını belirleyin. IDP'ler, karşılaştırılabilir büyüklükteki katlanmış proteinlerden daha uzun 15N T2'ye sahip olduklarından, dolaylı boyutta daha uzun edinim süreleri kullanılabilir.
NOT: Bu değer, proteinin spesifik özelliklerine bağlıdır, ancak kabaca 15N T2'den tahmin edilebilir ve FID'deki sinyal bozulmasını izleyerek optimize edilebilir. Doğrudan boyut için, çoğu numune için 1024* karmaşık nokta (13 ppm tarama genişliği, 112,6 ms toplama süresi) yeterlidir. - Deneme süresini hesaplamak için expt komutunu kullanın ve ardından zg komutuyla denemeyi başlatın.
6. Askorbik asit ile spin etiketini azaltarak diyamanyetik bir numune yapın
- Sodyum askorbatı NMR tamponunda çözün ve pH'ı orijinal NMR tamponuna uyacak şekilde ayarlayın.
- Sodyum askorbat stoğunun konsantrasyonunu hesaplayın, böylece numune hacminde en az değişiklikle spin etiketinin konsantrasyonu üzerinde 10x molar fazla askorbat eklenebilir. Örneğin, 100 μM'lik bir protein numunesi için 100 mM'lik bir askorbat stoğu uygundur. Döndürme etiketinin azaltılması, toplam numune hacminin sadece %1'i olan 5,5 μL askorbik asit stok çözeltisinin eklenmesini gerektirecektir.
- Tüpün kenarının altına bir damlacık yerleştirerek NMR tüpüne gerekli miktarda askorbik asit ekleyin, tüpü kapatın, karıştırmak için tüpü dikkatlice ters çevirin ve ardından numuneyi tüpün dibine yerleştirmek için elle kranklanmış bir santrifüjde 10-20 s boyunca 200-400 x g'da döndürün.
- Işıktan korumak için NMR tüpünü folyoya sarın ve reaksiyonun en az 3 saat devam etmesine izin verin.
- Paramanyetik numune için kullanılan aynı parametreleri kullanarak diyamanyetik numune üzerine 1H NT2 kaydedin.
- Darbeleri yeniden kalibre edin. Ancak, paramanyetik ölçümlerden değişmemeleri gerekirdi; Önemli ölçüde farklılarsa (> 0,5 μs fark), numune kalitesini (örn. bozunma, çökeltme) dikkate alın.
- Diyamanyetik ve paramanyetik numuneler için belirtilen gevşeme gecikmeleri (vdlist), kukla tarama sayısı, toplanan tarama sayısı, toplanan karmaşık nokta sayısı, toplama süresi, tarama genişlikleri ve taşıyıcı frekansları dahil olmak üzere tüm alım parametrelerinin aynı kaldığından emin olun.
7. Proses paramanyetik ve diyamanyetik spektrumları
- Verileri NMRPipe ve Sparky'nin yüklü ve yapılandırılmış olduğu yerel bilgisayara veya iş istasyonuna kopyalayın. ser dosyasını içeren deneme verileri dizininde proc adlı bir klasör oluşturun.
- NMRPipe komut dosyalarını fid.com, p3d.com ve nmrproc.com proc'a kopyalayın (işleme komut dosyaları yazarların isteği üzerine mevcuttur).
- Bruker veri biçimini (ser) NMRPipe biçimine dönüştürmek için fid.com komut dosyasını kullanın.
- Sözde 3B düzlemleri ayrı spektrumlara bölmek için p3D.com komut dosyasını kullanın.
- fid.com komut dosyasının çıktısını okumak, çözücü bastırma, bir pencere işlevi uygulamak, ham verilere sıfırlar eklemek (sıfır doldurma), faz düzeltmesi uygulamak, bir Fourier dönüşümü yürütmek, verileri görüntülemek için kırpmak ve işlenen verileri diske yazmak için nmrproc.com komut dosyasını kullanın. Komut dosyası, kaydedilen her gevşeme gecikmesi için bir dosya çıkarır (T a ve Tb).
NOT: Bu komut dosyalarının her biri, her denemenin belirli ayrıntıları için işlemeyi optimize etmek üzere özelleştirilebilir. Öğreticiler ve örnek veri kümeleri, NMRPipe web sitesinde bulunan NMRPipe dağıtımınadahil edilmiştir 32. NMRDraw, işleme sırasında spektral görüntüleme için kullanılabilir (örneğin, uygun faz açılarının ayarlanması vb.). NMRPipe komutları için kullanılabilen seçenekler, nmrPipe -help komutu kullanılarak görüntülenebilir.
8. Rezonans atamalarını aktarın ve tepe yüksekliklerini çıkarın
- Komutu kullanarak her spektrum dosyası için dosya başlığı bilgilerini değiştirin (hem paramanyetik hem de diyamanyetik örnekler için Ta, Tb ) sethdr [dosyaadı] -ndim 2.
- 33-8.3 adımlarını izleyerek en yüksek yükseklikleri 8.5 çıkarmak için Sparky'yi kullanın. NMRPipe (NMRDraw)32, CCPN Analysis 34 ve NMRViewJ35 dahil olmak üzere diğer yazılım paketleri de uygundur.
- Spektral dosyaları Sparky'ye okuyun. Bu adımda veri seti, proteindeki spin etiketinin her bir konumu için ölçülen, hem paramanyetik hem de diyamanyetik numuneler için her bir zaman noktası spektrumu (Ta, Tb) için bir spektrumdan oluşacaktır.
- Tepe noktalarını seçmek için Sparky'yi kullanın (komut: F8, ardından tıklayıp sürükleyin) ve bir referans tepe listesinden tepe listesini aktarma aracını kullanarak atamaları aktarın.
NOT: İlgilenilen proteinin rezonans atamaları, gözlemlenen PRE'lerin diziye özgü yorumlanması için gereklidir36.- Hem paramanyetik hem de diyamanyetik spektrumlardaki konturları aynı seviyeye ayarlayın. Konturları, zaman gecikmesinden sonra toplanan spektrumların kasıtlı olarak tepe noktalarını dışlamaması, ancak Ta spektrumlarının aşırı gürültülü olmaması için yeterince yüksek olması için ayarladığınızdan emin olun.
- Her spektrum için yeni tepe listelerini kaydedin ve ölçülen tepe yoğunluğunu ve Sparky hesaplanan sinyal-gürültü oranını ekleyin (komut: tepe listesini açmak için lt , yoğunluk ve SNR sütunlarını dahil etmek için seçeneklere tıklayın, komut: kaydet).
9. Her kalıntı için 1HNT 2 oranlarını çıkarın ve PRE'yi hesaplayın
- Tepe listelerini elektronik tablo yazılımına veya Python gibi tercih edilen bir programlama diline aktarın.
NOT: Protein üzerindeki her bir spin etiketi konumu için, veri seti, hem paramanyetik hem de diyamanyetik deneyler için her biri T a ve Tb olmak üzere ilişkili tepe yoğunluklarına sahip dört tepe listesinden oluşacaktır. - Aşağıdaki denklemi kullanarak hem paramanyetik hem de diyamanyetik numuneler için 1HN R2 hesaplayın:
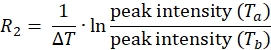
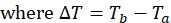
- Paramanyetik ve diyamanyetik numuneler için her bir kalıntı için gevşeme oranını belirlemek için yukarıdaki denklemi kullanın.
- Aşağıdaki denklemi kullanarak her kalıntı için 1HN-Γ 2 oranını belirleyin:
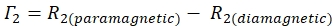
- Her kalıntı için tepe yüksekliğinin belirsizliğini hesaplamak için Sparky hesaplanan sinyal-gürültü oranını (SNR) kullanın.
- Denklemi kullanarak hatayı yayın:

- Grafik 1HN-Γ 2, 9.6'da hesaplanan hatayı içeren bir dağılım grafiği kullanılarak kalıntı sayısının bir fonksiyonu olarak.
Sonuçlar
Molekül içi 1HN-Γ 2 PRE'ler, RNA bağlayıcı protein EWSR142'nin düşük karmaşıklık alanından türetilen, kendi kendine birleşen, içsel olarak düzensiz bir fragman (kalıntılar 171-264) üzerine kaydedildi (Şekil 3). Spin-etiket bağlantı noktasına yakın sıralı kalıntıların (örneğin, Şekil 3'teki kalıntı 178 veya 260) önemli ölçüde genişlemesi beklenir ve spektrumd...
Tartışmalar
Kendinden düzensiz proteinler ve PRE kullanan çeşitli bağlanma ortakları arasında düşük popülasyonlarda var olan geçici etkileşimleri karakterize etmek için bir yöntem sunulmuştur. Gösterilen örnekte, protein kendi kendine ilişkilidir ve bu nedenle PRE, moleküller arası ve moleküller arası etkileşimlerin bir kombinasyonundan kaynaklanabilir. Bu yöntem, iki farklı protein arasındaki etkileşimlerin karakterize edilebildiği heterojen numunelere kolayca genişletilebilir. Proteinin farklı bölgel...
Açıklamalar
Tüm yazarlar makaleyi okumuş ve onaylamıştır. Herhangi bir çıkar çatışması beyan edilmez.
Teşekkürler
Yararlı tartışmalar ve teknik yardım için Dr. Jinfa Ying ve Kristin Cano'ya teşekkür ederiz. DSL bir St. Baldrick's Scholar'dır ve St. Baldrick's Foundation'ın (634706) desteğini kabul eder. Bu çalışma kısmen DSL'ye Welch Vakfı (AQ-2001-20190330), Max ve Minnie Tomerlin Voelcker Fonu (DSL'ye Voelcker Vakfı Genç Araştırmacı Hibesi), DSL'ye UTHSA Başlangıç Fonları ve CNJ'ye Çocuk Sağlığı alanında Greehey Yüksek Lisans Bursu tarafından desteklenmiştir. Bu çalışma, San Antonio'daki Texas Üniversitesi Sağlık Bilimleri Merkezi'ndeki Kurumsal Araştırma Çekirdeklerinin bir parçası olan Yapısal Biyoloji Çekirdek Tesislerinde yürütülen ve Araştırma Başkan Yardımcılığı Ofisi ve Mays Kanser Merkezi İlaç Keşfi ve Yapısal Biyoloji Ortak Kaynağı (NIH P30 CA054174) tarafından desteklenen araştırmalara dayanmaktadır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.45 µm and 0.22 µm syringe filters | Millipore Sigma | SLHVM33RS SLGVR33RS | Filter lysate before first purification step and before size exclusion chromatography. |
| 100 mm Petri Dish | Fisher | FB0875713 | Agar plates for bacterial transformation. |
| 14N Ammonium chloride | Sigma Aldrich | 576794 | Use of 15N in M9 medium will produce an NMR visible protein, 14N will produces an NMR invisible protein |
| 15N Ammonium chloride | Sigma Aldrich | 299251 | Use of 15N in M9 medium will produce an NMR visible protein, 14N will produces an NMR invisible protein |
| 3 L Fernbach baffled flask | Corning | 431523 | Bacterial expression culture |
| 3-Maleimido-Proxyl | Sigma Aldrich | 253375 | Nitroxide spin label |
| 50 mL conical centrifuge tubes | Thermo Fisher | 14-432-22 | Solution/protein storage |
| Amicon centrifugal filter | Millipore Sigma | UFC900308 | Protein concentration |
| Ampicillan | Sigma Aldrich | A5354 | Antibiotic for a selective marker, exact choice depends on the expression construct plasmid |
| Analytical balance | Oahus | 30061978 | Explorer Pro, for weighing reagents |
| Ascorbic acid | Sigma Aldrich | AX1775 | Reduces nitroxide spin label |
| Autoclave | Sterilize glassware and culture media | ||
| Calcium chloride | Sigma Aldrich | C4901 | M9 media component |
| Centrifuge bottles | Thermo Fisher | 010-1459 | Harvest E. coli cells after recombinant protein expression |
| Centrifuge, hand-crank | Thomas Scientific | 0241C68 | Boekel hand-driven, low-speed centrifuge with 15 mL buckets that can accommodate NMR tubes |
| Chelex 100 | Sigma Aldrich | C7901 | Remove contaminating paramagnetic compounds from buffer solutions |
| Computer workstation | Linux or Mac OS compatable with NMR data processing and analysis software packages such as NMRPipe and Sparky | ||
| Deuterium oxide | Sigma Aldrich | 151882 | Needed for NMR lock signal |
| Dextrose | Sigma Aldrich | D9434 | M9 media component |
| Dibasic Sodium Phosphate | Sigma Aldrich | S5136 | M9 media component |
| Ellman's reagent (5,5-dithio-bis-(2-nitrobenzoic acid) | Thermo Fisher | 22582 | Quantification of free cystiene residues |
| High speed centrifuge tubes | Thermo Fisher | 3114-0050 | Used to clear bacterial lysate. |
| High-field NMR instrument (600 - 800 MHz) | Bruker | Equiped with a multichannel cryogenic probe and temperature control | |
| IMAC column, HisTrap FF | Cytvia | 17528601 | Initial fractionation of crude bacterial lysate |
| Isopropyl B-D-thiogalactoside (IPTG) | Sigma Aldrich | I6758 | Induces protein expression for genes under control of lac operator |
| LB agar | Thermo Fisher | 22700025 | Items are used for transforming E. coli to express protein of interest, substitions for any of these items with like products is acceptable. |
| LB broth | Thermo Fisher | 12780052 | |
| Low-pressure chromatography system | Bio-Rad | 7318300 | BioRad BioLogic is used for low-pressure chomatograph such as running IMAC columns |
| Magnesium sulfate | Sigma Aldrich | M7506 | M9 media component |
| Medium pressure chromatography system | Bio-Rad | 7880007 | BioRad NGC equipped with a multi-wavelength detector, pH and conductivity monitors, and automatic fraction collector |
| MEM vitamin solution | Sigma Aldrich | M6895 | M9 media component |
| Microfluidizer | Avestin | EmulsiFlex-C3 | Provides rapid and efficient bacterial cell lysis |
| Micropipettes | Thermo Fisher | Calibrated set of micropippetters with properly fitting disposable tips (available from multiple manufacturers e.g. Eppendorf) | |
| Monobasic potassium phosphate | Sigma Aldrich | 1551139 | M9 media component |
| NMR pipettes | Sigma Aldrich | 255688 | To remove sample from NMR tube |
| NMR sample tube | NewEra | NE-SL5 | Suitable for high-field NMR spectrometers |
| Preparative Centrifuge | Beckman Coulter | Avanti J-HC | Harvest E. coli cells after recombinant protein expression |
| Round bottom polystyrene centrifuge tubes | Corning | 352057 | Clear bacterial lysate |
| Shaking incubator | Eppendorf | S44I200005 | Temperature controlled growth of E. coli starter and expression cultures |
| Sodium chloride | Sigma Aldrich | S5886 | M9 media component |
| Sonicating water bath and vacuum source | Thomas Scientific | Used to degas buffer solutions | |
| Sonicator | Thermo Fisher | FB505110 | Used for bacterial cell lysis or shearing bacterial DNA |
| Spectrophotometer | Implen | OD600 Diluphotometer | Monitor growth of E.coli protein expression cultures |
| Superdex 200 16/600 size exculsion colum | Cytvia | 28989333 | Final protein purification step |
| Topspin software, version 3.2 or later | Bruker | Operating software for the NMR instrument | |
| Transformation competent E. coli cells | Thermo Fisher | C600003 | One Shot BL21 Star (DE3) chemically competent E. coli, other strains may be compatable |
| Tris(2-carboxyethyl)phosphine (TCEP) | ThermoFisher | 20490 | Reducing agent compatable with some sulfhydryl-reactive conjugations |
| UV-Vis spectrophotometer | Implen | NP80 | Measure protein concentration. |
| Water bath, temperature controlled | ThermoFisher | FSGPD25 | For heat shock step of bacterial transformation |
| Yeast extract | Sigma Aldrich | Y1625 | For supplementing M9 media if required |
Referanslar
- Dyson, H. J., Wright, P. E. Intrinsically unstructured proteins and their functions. Nature Reviews: Molecular Cell Biology. 6 (3), 197-208 (2005).
- Korneta, I., Bujnicki, J. M. Intrinsic disorder in the human spliceosomal proteome. PLoS Computational Biology. 8 (8), 1002641 (2012).
- Frege, T., Uversky, V. N. Intrinsically disordered proteins in the nucleus of human cells. Biochemistry and Biophysics Reports. 1, 33-51 (2015).
- Liu, J., et al. Intrinsic disorder in transcription factors. Biochemistry. 45 (22), 6873-6888 (2006).
- El Hadidy, N., Uversky, V. N. Intrinsic disorder of the BAF complex: Roles in chromatin remodeling and disease development. International Journal of Molecular Sciences. 20 (21), (2019).
- Wright, P. E., Dyson, H. J. Intrinsically disordered proteins in cellular signalling and regulation. Nature Reviews: Molecular Cell Biology. 16 (1), 18-29 (2015).
- Brangwynne, C. P. Phase transitions and size scaling of membrane-less organelles. Journal of Cell Biology. 203 (6), 875-881 (2013).
- Shin, Y., Brangwynne, C. P. Liquid phase condensation in cell physiology and disease. Science. 357 (6357), (2017).
- Cavanagh, J. . Protein NMR spectroscopy : principles and practice. 1st edition. , (2018).
- Sekhar, A., Kay, L. E. NMR paves the way for atomic level descriptions of sparsely populated, transiently formed biomolecular conformers. Proceedings of the National Academy of Sciences of the United States of America. 110 (32), 12867-12874 (2013).
- Anthis, N. J., Clore, G. M. Visualizing transient dark states by NMR spectroscopy. Quarterly Reviews of Biophysics. 48 (1), 35-116 (2015).
- Alderson, T. R., Kay, L. E. NMR spectroscopy captures the essential role of dynamics in regulating biomolecular function. Cell. 184 (3), 577-595 (2021).
- Clore, G. M., Iwahara, J. Theory, practice, and applications of paramagnetic relaxation enhancement for the characterization of transient low-population states of biological macromolecules and their complexes. Chemical Reviews. 109 (9), 4108-4139 (2009).
- Wu, K. P., Baum, J. Detection of transient interchain interactions in the intrinsically disordered protein alpha-synuclein by NMR paramagnetic relaxation enhancement. Journal of the American Chemical Society. 132 (16), 5546-5547 (2010).
- Janowska, M. K., Wu, K. P., Baum, J. Unveiling transient protein-protein interactions that modulate inhibition of alpha-synuclein aggregation by beta-synuclein, a pre-synaptic protein that co-localizes with alpha-synuclein. Scientific Reports. 5, 15164 (2015).
- Murthy, A. C., et al. Molecular interactions underlying liquid-liquid phase separation of the FUS low-complexity domain. Nature Structural & Molecular Biology. 26 (7), 637-648 (2019).
- Fawzi, N. L., Doucleff, M., Suh, J. Y., Clore, G. M. Mechanistic details of a protein-protein association pathway revealed by paramagnetic relaxation enhancement titration measurements. Proceedings of the National Academy of Sciences of the United States of America. 107 (4), 1379-1384 (2010).
- Griffith, O. H., Waggoner, A. S. Nitroxide free radicals: spin labels for probing biomolecular structure. Accounts of Chemical Research. 2 (2), 17-24 (1969).
- Bertini, I., Luchinat, C., Parigi, G., Ravera, E. . NMR of Paramagnetic Macromolecules, Applications to Metallobiomolecules and Models. 2 edn. , (2016).
- Bloembergen, N., Purcell, E. M., Pound, R. V. Relaxation effects in nuclear magnetic resonance absorption. Physical Review. 73 (7), 679-712 (1948).
- Solomon, I. Relaxation processes in a system of two spins. Physical Review. 99 (2), 559 (1955).
- Clore, G. M. Practical aspects of paramagnetic relaxation enhancement in biological macromolecules. Methods in Enzymology. 564, 485-497 (2015).
- Klare, J. P. Site-directed spin labeling EPR spectroscopy in protein research. Biological Chemistry. 394 (10), 1281-1300 (2013).
- Clore, G. M., Tang, C., Iwahara, J. Elucidating transient macromolecular interactions using paramagnetic relaxation enhancement. Current Opinion in Structural Biology. 17 (5), 603-616 (2007).
- Melanson, M., Sood, A., Torok, F., Torok, M. Introduction to spin label electron paramagnetic resonance spectroscopy of proteins. Biochemistry and Molecular Biology Education. 41 (3), 156-162 (2013).
- Czogalla, A., Pieciul, A., Jezierski, A., Sikorski, A. F. Attaching a spin to a protein -- site-directed spin labeling in structural biology. Acta Biochimica Polonica. 54 (2), 235-244 (2007).
- Lindfors, H. E., de Koning, P. E., Drijfhout, J. W., Venezia, B., Ubbink, M. Mobility of TOAC spin-labelled peptides binding to the Src SH3 domain studied by paramagnetic NMR. Journal of Biomolecular NMR. 41 (3), 157-167 (2008).
- Fawzi, N. L., et al. A rigid disulfide-linked nitroxide side chain simplifies the quantitative analysis of PRE data. Journal of Biomolecular NMR. 51 (1-2), 105-114 (2011).
- Bleicken, S., et al. gem-Diethyl pyrroline nitroxide spin labels: Synthesis, EPR characterization, rotamer libraries and biocompatibility. ChemistryOpen. 8 (8), 1035 (2019).
- Iwahara, J., Tang, C., Clore, G. M. Practical aspects of 1H transverse paramagnetic relaxation enhancement measurements on macromolecules. Journal of Magnetic Resonance. 184, 185-195 (2007).
- Venditti, V., Fawzi, N. L. Probing the atomic structure of transient protein contacts by paramagnetic relaxation enhancement solution NMR. Methods in Molecular Biology. 1688, 243-255 (2018).
- Delaglio, F., et al. NMRPipe: a multidimensional spectral processing system based on UNIX pipes. Journal of Biomolecular NMR. 6 (3), 277-293 (1995).
- Lee, W., Tonelli, M., Markley, J. L. NMRFAM-SPARKY: enhanced software for biomolecular NMR spectroscopy. Bioinformatics. 31 (8), 1325-1327 (2015).
- Vranken, W. F., et al. The CCPN data model for NMR spectroscopy: development of a software pipeline. Proteins. 59 (4), 687-696 (2005).
- Johnson, B. A. Using NMRView to visualize and analyze the NMR spectra of macromolecules. Methods in Molecular Biology. 278, 313-352 (2004).
- Sjodt, M., Clubb, R. T. Nitroxide labeling of proteins and the determination of paramagnetic relaxation derived distance restraints for NMR studies. Bio-Protocol. 7 (7), (2017).
- Zhang, H., van Ingen, H. Isotope-labeling strategies for solution NMR studies of macromolecular assemblies. Current Opinion in Structural Biology. 38, 75-82 (2016).
- Rabdano, S. O., et al. Onset of disorder and protein aggregation due to oxidation-induced intermolecular disulfide bonds: case study of RRM2 domain from TDP-43. Scientific Reports. 7 (1), 11161 (2017).
- Burns, J. A., Butler, J. C., Moran, J., Whitesides, G. M. Selective reduction of disulfides by tris(2-carboxyethyl)phosphine. Journal of Organic Chemistry. 56 (8), 2648-2650 (1991).
- Ellman, G. L. Tissue sulfhydryl groups. Archives of Biochemistry and Biophysics. 82 (1), 70-77 (1959).
- Binbuga, B., Boroujerdi, A. F., Young, J. K. Structure in an extreme environment: NMR at high salt. Protein Science. 16 (8), 1783-1787 (2007).
- Schwartz, J. C., Cech, T. R., Parker, R. R. Biochemical properties and biological functions of FET proteins. Annual Review of Biochemistry. 84, 355-379 (2015).
- Nabuurs, S. M., de Kort, B. J., Westphal, A. H., van Mierlo, C. P. Non-native hydrophobic interactions detected in unfolded apoflavodoxin by paramagnetic relaxation enhancement. European Biophysics Journal. 39 (4), 689-698 (2010).
- Wiedemann, C., Kumar, A., Lang, A., Ohlenschlager, O. Cysteines and disulfide bonds as structure-forming units: Insights from different domains of life and the potential for characterization by NMR. Frontiers in Chemistry. 8, 280 (2020).
- Wommack, A. J., et al. NMR solution structure and condition-dependent oligomerization of the antimicrobial peptide human defensin 5. Biochemistry. 51 (48), 9624-9637 (2012).
- Taylor, A. M., et al. Detailed characterization of cysteine-less P-glycoprotein reveals subtle pharmacological differences in function from wild-type protein. British Journal of Pharmacology. 134 (8), 1609-1618 (2001).
- Hu, K., Doucleff, M., Clore, G. M. Using multiple quantum coherence to increase the 15N resolution in a three-dimensional TROSY HNCO experiment for accurate PRE and RDC measurements. Journal of Magnetic Resonance. 200 (2), 173-177 (2009).
- Anthis, N. J., Doucleff, M., Clore, G. M. Transient, sparsely populated compact states of apo and calcium-loaded calmodulin probed by paramagnetic relaxation enhancement: interplay of conformational selection and induced fit. Journal of the American Chemical Society. 133 (46), 18966-18974 (2011).
- Battiste, J. L., Wagner, G. Utilization of site-directed spin labeling and high-resolution heteronuclear nuclear magnetic resonance for global fold determination of large proteins with limited nuclear overhauser effect data. Biochemistry. 39 (18), 5355-5365 (2000).
- Donaldson, L. W., et al. Structural characterization of proteins with an attached ATCUN motif by paramagnetic relaxation enhancement NMR spectroscopy. Journal of the American Chemical Society. 123 (40), 9843-9847 (2001).
- Gaponenko, V., et al. Protein global fold determination using site-directed spin and isotope labeling. Protein Science. 9 (2), 302-309 (2000).
- Trindade, I. B., Invernici, M., Cantini, F., Louro, R. O., Piccioli, M. PRE-driven protein NMR structures: an alternative approach in highly paramagnetic systems. FEBS Journal. 288 (9), 3010-3023 (2021).
- Nitsche, C., Otting, G. Pseudocontact shifts in biomolecular NMR using paramagnetic metal tags. Progress in Nuclear Magnetic Resonance Spectroscopy. 98-99, 20-49 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır