Method Article
İnsan Kaynaklı Pluripotent Kök Hücre Kaynaklı Tip 2 Alveolar Epitel Hücrelerinin 3D Küreleri ve 2D Hava-Sıvı Arayüz Kültürlerinin Üretilmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Mevcut protokol, insan kaynaklı pluripotent kök hücre kaynaklı tip 2 alveoler epitel benzeri hücreleri (iAT2'ler) tanımlamaktadır. Bu hücreler 3D kültürde kendini yenileyen küreler olarak kültürlenebilir veya hava-sıvı arayüzü (ALI) kültürüne uyarlanabilir.
Özet
Akciğerde, alveoler epitel çevresel uyaranlara karşı fiziksel bir bariyerdir ve homeostaz ve hastalıkta önemli bir rol oynar. Tip 2 alveoler epitel hücreleri (AT2'ler) distal akciğer epitelinin fakültatif progenitörleridir. AT2'lerin disfonksiyonu ve yaralanması çeşitli akciğer hastalıklarından kaynaklanabilir ve bunlara katkıda bulunabilir. AT2 biyolojisinin daha iyi anlaşılması, bu nedenle, akciğer biyolojisini ve hastalığını anlamak için kritik öneme sahiptir; Bununla birlikte, birincil insan AT2'lerinin izole edilmesi genellikle zordur ve tedarikte sınırlıdır. Bu sınırlamaların üstesinden gelmek için, insan kaynaklı pluripotent kök hücre (iPSC) kaynaklı tip 2 alveoler epitel hücreleri (iAT2'ler), in vivo akciğer gelişimini özetleyen yönlendirilmiş bir farklılaşma protokolü ile üretilebilir. iAT2'ler besleyicisiz koşullarda büyür, insan yetişkin birincil AT2'lerle transkriptomik bir programı paylaşır ve AT2'lerin üretim, paketleme ve yüzey aktif madde salgılanması gibi temel işlevlerini yerine getirir. Bu protokol, üç boyutlu (3D) kültürde seri geçiş yoluyla kendi kendini yenileyen iAT2'leri sürdürme veya iAT2'leri hava-sıvı arayüzü (ALI) kültürüne uyarlama yöntemlerini detaylandırır. iAT2'lerin tek hücreli bir süspansiyonu, 3D çözünür bazal membran matrisinde (bundan böyle "matris" olarak anılacaktır) kaplanmadan önce üretilir ve burada tek katmanlı epitel kürelerine kendiliğinden monte edilirler. 3D kültürdeki iAT2'ler, 2D ALI kültüründe geçirilecek veya kaplanacak tek hücreli süspansiyonlara seri olarak ayrıştırılabilir. ALI kültüründe, iAT2'ler apikal yüzeyi havaya maruz kalan polarize bir tek katman oluşturur ve bu platformu çevresel maruziyetlere kolayca uygun hale getirir. Bu nedenle, bu protokol, SFTPCtdDomates ifadesi ile belirtilen AT2 programını korurken, 15 pasaj üzerinde giriş hücresi başına 1 x 1030 hücreden oluşan tükenmez bir iAT2 kaynağı üretir. Elde edilen hücreler, genetik mutasyonları incelemek, çevresel maruziyetleri modellemek veya ilaçları taramak için uygulanabilecek tekrarlanabilir ve ilgili bir platformu temsil eder.
Giriş
Akciğerde, hava yolu ve alveoler epitel hücreleri, solunan aerosoller yoluyla bulaşan patojenler ve sigara dumanı gibi zararlı uyaranlar da dahil olmak üzere solunan çevresel maruziyetlerle karşılaşan ilk kişilerdir. Tip 2 alveoler epitel hücreleri (AT2'ler), distal akciğer epitelinin fakültatif progenitörleri olduklarından, alveoler yüzey gerilimini hafifletmek için yüzey aktif maddeler ürettikleri ve inhale maruziyetlere doğuştan gelen bağışıklık tepkisini monte ettikleri için akciğer homeostazının korunmasında esastır 1,2. Bununla birlikte, AT2 disfonksiyonu, akciğer yaralanmalarından veya SFTPC, SFTPB ve ABCA3 3,4,5 gibi AT2'lerde seçici olarak eksprese edilen genlerdeki mutasyonlardan kaynaklanabilir. Bu genetik mutasyonları incelemek için önceki yaklaşımlar, fare modellerine6 veya ölümsüzleştirilmiş hücre hatlarına tanıtılan mühendislik ürünü, mutasyon içeren vektörlere dayanıyordu7. Bu nedenle, genetik ve çevresel bozulmaların fizyolojik olarak ilgili hücre tiplerinde ve üretken bir in vitro sistemde AT2'ler üzerindeki etkilerini modelleyebilen platformlara, AT2'lerin sağlık ve hastalıkta oynadığı rolü daha iyi anlamak için ihtiyaç vardır.
Havadaki maruziyetlerin modellenmesi açısından, primer hava yolu epitel hücrelerinin hava-sıvı arayüzü (ALI) kültürleri, sigara dumanı8'e anahtar moleküler yanıtları ortaya çıkarmak ve hava yolu enfeksiyonu 9,10'u modellemek için başarıyla kullanılmıştır. Hastalıkta önemli bir enfeksiyon veya yaralanma bölgesi olan alveoler epitel için karşılaştırılabilir bir ALI kültür sistemi, hava yolu epitel model sistemine kıyasla çok daha az gelişmiştir. Ölümsüzleştirilmiş hücre hatları ALI'de alveoler epitel11,12 için bir vekil olarak kültürlenmiştir, ancak bu hücre hatları primer alveoler epitel hücrelerinden transkriptomik olarak farklıdır13 ve sürfaktan salgılama veya ALI 12'de sıkı kavşaklar oluşturma yeteneği gibi anahtar hücresel mekanizmalardan yoksundur. Birincil insan AT2'leri, fibroblastların varlığında 3D kürelerde kültürlenebilir 1,14, ancak eksplant akciğerlerinden sınırlı erişilebilirlik ve bugüne kadar çoğu kültürde yaşlanma veya hücresel fenotipi kaybetme eğilimleri de dahil olmak üzere sınırlamalara tabidir. Bu özellikler, primer AT2'nin in vitro çalışmaların yaygın olarak benimsenmesinin önünde engeller sunmaktadır, ancak birincil AT2'lerin15,16,17,18'in genişletilmesi için besleyicisiz 3D kültürlerin optimize edilmesinde son zamanlarda ilerleme kaydedilmiştir.
İnsan kaynaklı pluripotent kök hücre (iPSC) kaynaklı tip 2 alveoler epitel hücreleri (iAT2s)19 üretmek için in vivo gelişimsel kilometre taşlarını özetlemek için yönlendirilmiş farklılaşma protokolleri geliştirilmiştir. iAT2'ler, fibroblast besleyicilerin yokluğunda, "CK + DCI"19 olarak adlandırılan CHIR99021, KGF, deksametazon, cAMP ve 3-izobütil-1-metilksantin (IBMX) içeren tanımlanmış bir ortamda 3D serumsuz kültürde kendiliğinden yenilenen küreler olarak büyür ve >20 pasajları20,21 için kültürlenebilir. Dahası, iAT2'ler insan yetişkin birincil AT2'leri ile transkriptomik bir programı paylaşır, lamel cisimler oluşturur ve yüzey aktif madde19,21,22 üretir ve paketler. Bu protokol, hücreleri tek hücreli bir süspansiyona ayırarak iAT2'lerin seri geçişini detaylandırır. Bu noktada, iAT2'ler 3D kültürde yeniden kaplanabilir ve daha da genişletilebilir veya 2D ALI kültürü23'te kaplanabilir. Bu yöntemler, homeostaz ve hastalık20,22'de AT2'lerin içsel biyolojisini incelemek ve daha önce gösterildiği gibi, ölçeklenebilir, fizyolojik olarak ilgili bir platform23,24'te bileşiklerin veya uyaranların etkilerini sorgulamak için kullanılabilir.
Protokol
İnsan iPSC hatlarının farklılaşmasını içeren tüm deneyler, Boston Üniversitesi Kurumsal İnceleme Kurulu'na (protokol H33122) uygun olarak gerçekleştirilmiştir. iPSC'lere yeniden programlanmak üzere tedarik edilen dermal fibroblastlar, Washington Üniversitesi Tıp Fakültesi, St. Louis, MO İnsan Araştırma Koruma Ofisi'nin onayı altında, yazılı bilgilendirilmiş onamla bir donörden elde edildi.
1. Alveosfer ayrışması
- Tablo 1'de belirtilen bileşime göre tam serumsuz farklılaşma ortamı (cSFDM) hazırlayın.
- Hazırlanan cSFDM tabanında CK + DCI ortamını Tablo 2'ye göre hazırlayın.
- Deneysel ihtiyaçlar için gerekli olan buz üzerinde 2D (insan embriyonik kök hücre nitelikli) ve / veya 3D (büyüme faktörü azaltılmış) matrisi çözün.
- Tüm CK + DCI ortamını, 12 delikli bir plakada, yönlendirilmiş farklılaşma19'dan türetilen alveosferler içeren 3D matris damlacıklarından vakum ile bir pipet veya aspire edici pipet kullanarak aspire edin.
- Damlacık başına 1 mL dispaz (2 mg / mL) ekleyin. P1000 pipet kullanarak damlacığı yavaşça dispase içine pipetleyin. 1 saat boyunca 37 °C'de inkübe edin, 30 dakika sonra bir kez yukarı ve aşağı pipetleyin.
- Ayrışmış organoidleri (Adım 1.5'ten) dispazdaki bir matris damlacığından 15 mL'lik bir konik tüpe aktarın. Yıkamak için, 10 mL Iscove's Modified Dulbecco's Medium ekleyin (IMDM, bkz.
- Oda sıcaklığında 5 dakika boyunca 300 x g'da santrifüj. Süpernatantı bir pipet veya vakumla aspire edici pipet kullanarak aspire edin ve mümkün olduğunca az süpernatant bırakın.
NOT: Tüm dispasları çıkarmak önemlidir, çünkü kalan herhangi bir dispase, hücrelerin daha sonra tohumlanacağı matrisi çözebilir. Peletin üzerinde berrak bir pus görülürse, dispase matrisi tamamen çözmemiştir ve 37 ° C'de 20-30 dakika daha pelete daha fazla dispase eklenebilir. - Hücreleri damlacık başına% 0.05 tripsin 1 mL'de yeniden askıya alın ve 12 delikli plakaya geri aktarın. 12-15 dakika boyunca 37 ° C'de inkübe edin. Ayrışmayı mikroskop altında gözlemleyin. Bu aşamada hücreleri aşırı pipetlemekten kaçının.
NOT: İnkübasyonun sonunda, hücrelerin bir P1000 pipetle 3-5 kez pipetleme yaptıktan sonra tek hücreli bir süspansiyon elde etmeleri gerekir. iAT2'lerin ALI'ye (Adım 3) geçirilmesi için, tripsinizasyon süresinin en aza indirilmesi gerekir (maksimum 12 dakika), böylece hücreler, hücre kültürü ekine kaplanmaya hazır olduğunda tek hücreli süspansiyon yerine 2-3 hücreli kümeler halinde olur. - Tripsinin etkisini eşit hacimde FBS içeren bir ortamla durdurun (DMEM'de% 10 ES nitelikli FBS). Oda sıcaklığında 5 dakika boyunca 300 x g'da santrifüj.
- Hücreleri 10 mL IMDM ile yıkayın. Oda sıcaklığında 5 dakika boyunca 300 x g'da santrifüj.
- Hücreleri saymak için uygun bir hacimde yeniden askıya alın ve ardından bir hemositometre kullanarak hücreleri sayın (bkz.
NOT: 400 hücre/μL'de tohumlanmış bir akıcıdan 50 μL matris damlacığından beklenen verim damlacık başına 500.000 ila 1,5 x 106 hücredir. - 3B matriste kaplama (Adım 2) ve / veya ALI kültürü için hücre kültürü eklerine kaplama (Adım 3) yaparak alveosferler oluşturmak için iAT2 hücrelerinin tek hücreli süspansiyonunu kullanın.
2.3D iAT2'lerin kaplanması
- Saydıktan sonra (Adım 1.11), 3B matriste yeniden plakalanacak istenen hücrelerin sayısını belirleyin (12 delikli bir plakanın kuyucuğu başına 50-100 μL 3D matris damlacıkları ile matrisin 400 hücresi / μL'si). Hücreleri oda sıcaklığında 5 dakika boyunca 300 x g'da santrifüj yapın. Bir pipet kullanarak mümkün olduğunca fazla süpernatantı çıkarın.
- 3B matristeki hücreleri yeniden askıya alın. Matriksin polimerleşmesini önlemek için gerekirse hızlı ve buz üzerinde yeniden askıya alın (sıcak olduğunda ortaya çıkar).
- Kuyu başına bir adet 3D matris damlacığını önceden ısıtılmış 12 delikli bir plakaya dağıtmak için bir P200 pipet kullanın. Matris damlacığında kabarcıklar oluşmasını önlemek için pipeti dikkatlice uygulayın. Birden fazla damlacık dağıtırken hücre süspansiyonunun yerleşmesine izin vermeyin.
- Matris damlacıklarının polimerize olmasına izin vermek için plakayı 20-30 dakika boyunca 37 ° C'lik bir inkübatöre yerleştirin.
- Matris damlacığını örtmek için kuyu başına 1 mL CK + DCI + 10 μM Y-27632 ortamı ekleyin (bkz.
- 72 saat sonra, ortamı 10 μM Y-27632 olmadan CK + DCI olarak değiştirin.
- Ortamı her 48-72 saatte bir taze CK + DCI ile değiştirin.
NOT: iAT2'lerin tipik olarak hücre hattına ve kaplama yoğunluğuna bağlı olarak yaklaşık her 10-14 günde bir geçmesi gerekecektir.
3. iAT2'lerin ALI'ya geçirilmesi
- Dulbecco'nun Modifiye Kartal Orta/Besin Karışımı F-12'sindeki (DMEM/F12) 2B matrisi, üreticinin 2B matris talimatlarına göre çalışma çözeltisine seyrelterek kullanımdan 1 saat önce taze kaplanmış 6,5 mm hücre kültürü eklerini hazırlayın (bkz. Ardından, 6,5 mm hücre kültürü kesici ucu başına 100 μL seyreltilmiş matris ekleyin. Matriksin 37 °C'lik bir inkübatörde 30 dakika veya oda sıcaklığında 1 saat boyunca polimerize olmasına izin verin.
- Hücre kültürü eklerinden fazla matrisi bir pipet veya aspire edici pipet kullanarak vakumla aspire edin ve DMEM / F12 ile bir kez durulayın. Hücreleri eklemeden hemen önce bu yıkamayı aspire edin.
- Saydıktan sonra, kültür eklerinde istenen sayıda hücreyi tohumlamak için gerekli hücre sayısını belirleyin (520.000 canlı hücre / cm2, 6.5 mm hücre kültürü eki başına 172.000 canlı hücreye eşdeğer). Hücreleri oda sıcaklığında 5 dakika boyunca 300 x g'da santrifüj yapın. Mümkün olduğunca fazla süpernatant çıkarın.
- Hücre kültürü eki başına 100 μL CK + DCI + 10 μM Y-27632 ile tohumlamak için hücreleri uygun hacimde yeniden askıya alın (hücre süspansiyonu 1.720 hücre / μL olmalıdır). Hücre kültürü ekinin apikal bölmesine 100 μL ekleyin. Hücrelerin hücre kültürü eki boyunca eşit dağılımını sağlamak için plakayı çapraz bir düzende nazikçe çalkalayın ve 4x hedefinde mikroskop altında kontrol ederek bunu onaylayın.
NOT: Tohumlama yoğunluğu kritiktir ve 6,5 mm hücre kültürü eki başına 160.000-300.000 hücre arasında değişen optimizasyon gerektirebilir. Calcein yeşili (bakınız Malzeme Tablosu) hücre geçirgen boyası hücrelere eklenebilir ve tohumlamadan sonra hücreleri görselleştirmek için ters çevrilmiş bir floresan mikroskopta görüntülenebilir. - Her hücre kültürü ekinin bazolateral bölmesine 500 μL CK + DCI + 10 μM Y-27632 ekleyin.
- ALI'yi başlatmak için bir pipet kullanarak tohumlamadan sonra apikal CK + DCI + 10 μM Y-27632 orta 48 saat aspire edin ("hava asansörü" olarak bilinir).
NOT: Bu noktada hücreler% 100 akıcı olmalıdır. Hücreler% 100 birleşik değilse, Adım 3.7-3.8 hala belirtilen zaman noktalarında gerçekleştirilmelidir; birleşik hücre monokatmanlarının oluşması daha uzun sürebilir. - 72 saat sonra Y-27632 ortamının bazolateral CK + DCI + 10 μM'sini 10 μM Y-27632 olmadan CK + DCI olarak değiştirin.
NOT: Apikal tarafa minimum düzeyde "sızıntı" olmalıdır. Bununla birlikte, bu ilk birkaç gün içinde meydana gelirse, daha fazla sızıntı kalmayana kadar apikal tarafı günlük olarak aspire etmeye devam edin. - Bazolateral ortamı her 48-72 saatte bir taze CK + DCI ile değiştirin.
NOT: ALI kültürlerinde kullanılan iAT2'ler, kaplamadan sonraki 5-14 günde maksimum olarak olgunlaştırılır. - Daha uzun süreli deneyler için, gerekirse hücreleri kaplama sonrası 28 güne kadar dikkatli bir izleme ile koruyun.
NOT: Hücrelerin kesici ucun kenarından soyulması veya tek katmanda deliklerin oluşması gibi ALI başarısızlığının görünür belirtileri, kültürde aşırı uzun bir süre sonra gözlemlenebilir, bu noktada ALI artık deneyler için kullanılamaz.
Sonuçlar
iAT2'ler tek hücreli bir süspansiyona geçirildi ve daha sonra ALI kültürü için hücre kültürü ekleri üzerinde 3D matriste veya 2D olarak yeniden kaplandı (Şekil 1). Tek hücreli ayrışmadan sonra, iAT2'ler akış sitometrisi ile analiz edildi. Kısaca, kalsein mavisi canlılık boyası (1:1000) ile fosfat tamponlu salin (PBS) içinde% 1 fetal sığır serumunda (FBS) yeniden askıya alınan hücreler, fragman olmayanlar, singletlar ve tdTomato'lar için geçit olan bir akış sitometresinde analiz edildi. Burada, örnek olarak, kültürde zaman içinde AT2 programının görselleştirilmesi ve izlenmesi kolaylığı için endojen SFTPC lokusunu hedefleyen bir tdDomates muhabirine sahip olan SPC2 hattı (SPC2-ST-B2 klon20) bulunmaktadır (Şekil 2A). iAT2 SFTPC-tdDomates ifadesi, 3B matriste küreler halinde yeniden kaplandığında (Şekil 2B) ve hücre kültürü eklerine kaplandığında (Şekil 2C) korunmuştur. Transepitelyal elektrik direnci (TEER), ALI kültürünün bütünlüğünü belirlemek için ölçülebilir (Şekil 2D). TEER'i ölçmek için, apikal odaya 100 μL CK + DCI ortamı eklenmiş bir voltohmmetre kullanıldı (Malzeme Tablosuna bakınız). Tohumlanmış hücrelerin yokluğunda Matrigel ile kaplanmış hücre kültürü ekleri boşluk olarak muamele edildi. Her kuyuda üç yerde okumalar yapıldı.

Şekil 1: Protokol iş akışının şematik gösterimi. Bu şeklin daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
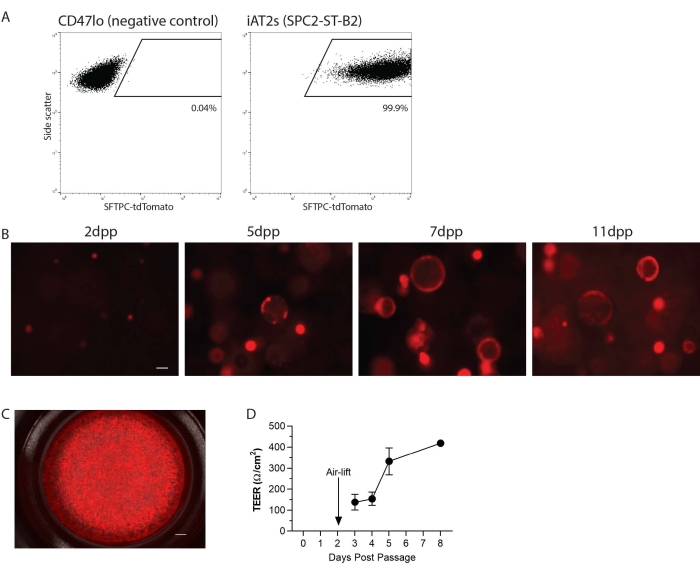
Şekil 2: Protokolün temsili sonuçları. (A) 3D olarak kültürlenmiş insan kaynaklı pluripotent kök hücre kaynaklı tip 2 alveoler epitel benzeri hücrelerde (iAT2'ler) SFTPC-tdDomates için temsili akış sitometrisi sonuçları. Gösterilen negatif kontrol akciğer dışı endodermdir (CD47lo). (B) Geçişten sonraki çeşitli günlerde (dpp) 3D olarak kültürlenen iAT2'lerin temsili canlı hücre görüntülemesi (SFTPC-tdDomates, ölçek çubuğu = 50 μm). (C) Hava-sıvı arayüzünde kaplanmış iAT2'lerin temsili canlı hücre görüntülemesi (SFTPC-tdDomates, ölçek çubuğu = 500 nm). (D) Hava-sıvı arayüzünde kaplanmış iAT2'lerin temsili transepitelyal elektriksel direnci. n = 3, hata çubukları standart sapmayı gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Reaktif | 500 mL için hacim | Son konsantrasyon |
| Iscove'un Modifiye Dulbecco'nun Ortamı (IMDM) | 375 mL | 75% |
| Ham'ın F-12 Besin Karışımı (F12) | 125 mL | 25% |
| B-27 (RA ile) takviyesi | 5 mL | 1% |
| N-2 takviyesi | 2,5 mL | 0.50% |
| BSA (%7.5 stok) | 3,3 mL | 0.05% |
| Primosin (50 mg/mL stok) | 1 mL | 100 μg/mL |
| Glutamax (100x stok) | 5 mL | 1 adet |
| Askorbik Asit (50 mg/mL stok) | 500 μL | 50 μg/mL |
| 1-Tiyogliserol (MTG) (2 mL IMDM'de 26 μL'den) | 1,5 mL | 4,5 x 10-4 M |
Tablo 1: Serumsuz farklılaşma ortamının (cSFDM) bileşimi.
| Reaktif | Son konsantrasyon |
| CHIR99021 | 3 μM |
| rhKGF | 10 ng/mL |
| Deksametazon | 50 nM |
| 8-bromoadenozin 30,50-siklik monofosfat sodyum tuzu (cAMP) | 0,1 mM |
| 3-İzobütil-1-metilksantin (IBMX) | 0,1 mM |
Tablo 2: CK + DCI ortamının bileşimleri.
Tartışmalar
AT2'ler akciğer homeostazını korur ve bu anahtar alveoler hücrelerin işlev bozukluğu çeşitli akciğer hastalıklarına hem neden olabilir hem de bunlardan kaynaklanabilir. Birincil insan AT2'lerine erişmenin ve izole etmenin zorluğu nedeniyle, iAT2'ler üretilir. Başka bir yerde açıklanan yönlendirilmiş farklılaşma yöntemleri25 ve burada açıklanan genişleme ve hücre tohumlaması uygulanarak, herhangi bir bireyden üretilen iPSC'ler, sağlam bir şekilde kendi kendini yenileyen iAT2'lere ayırt edilebilir, böylece temel biyomedikal araştırma geliştirme çalışmaları, hastalık modellemesi, hücre bazlı tedaviler veya ilaç ekranları dahil olmak üzere biyomedikal araştırmalar için hastaya özgü hücreler sağlanır. Mevcut protokol, iAT2'leri tek hücreli bir süspansiyona ayırmak için bir yöntemi detaylandırır, bu daha sonra hücre genişlemesi için alveolosferler üretmek üzere 3D Matrigel'de yeniden kaplanabilir veya daha ileri deneyler için 2D ALI kültüründe yeniden kaplanabilir.
Protokolün hem 3D hem de ALI kültürlerinde başarılı bir şekilde geçiş ve yeniden kaplama sağlamak için birkaç kritik adımı vardır. Mekanik tritürasyon en aza indirilmelidir, çünkü aşırı pipetleme hücre canlılığını azaltabilir. Ek olarak, iAT2'lerin hem 3D hem de 2D ALI kültürlerinde tohumlama yoğunluğu kritik öneme sahiptir; 3D kültür için, genel olarak, 400 hücre / μL 3D Matrigel çoğu iPSC hattı için idealdir. Bununla birlikte, 100-500 hücre / μL arasında bir yoğunluk aralığı zaman zaman başarılı olmuştur ve yoğunluğu optimize etmek farklı hücre hatları için gerekli olabilir. ALI kültürü için, iAT2'lerin hücre kültürü ekleri üzerindeki tohumlama yoğunluğunu optimize etmek, tohumlamadan 48 saat sonra (yani, hava kaldırma gününde) birleştirilmiş bir tek katmanlı hücre elde etmek için de gereklidir. Bazı iAT2 satırları kesici uç başına daha fazla hücre gerektirir; bu nedenle, sorun giderme gerekiyorsa, 24 delikli hücre kültürü ekleri için 160.000-300.000 hücre/ekleme aralığı önerilir. 3D kültürler ayrıca, tohumlama yoğunluğunu 400 hücre / μL 3D matriste tutarak ve matris damlacık boyutunu sırasıyla 25 μL ve 20 μL'ye düşürerek 24 ve 48 kuyucuklu plakalara ölçeklendirilebilir. ALI kültürleri, her bir kesici ucu matrisin 30 μL'si ile kaplayarak, kesici uç başına 30 μL'de 80.000 hücreyi kaplayarak ve kuyu başına 150 μL bazolateral medya ile beslenerek 96 delikli hücre kültürü eklerine ölçeklendirilebilir. Tohumlama yoğunluğu ve matris ve ortam hacimlerinin diğer plaka formatları için uygun şekilde ölçeklendirilmesi ve optimize edilmesi gerekir.
Bu protokolün bir sınırlaması, ALI kaplaması için kullanılan hücrelerin iAT2 ALI'leri oluşturmak için NKX2-1 + ve SFTPC + 19,20,21,23 olacak kadar saflaştırılması gerektiğidir ve ALI kültürü oluşumu hattan satıra değişebilir. Ek olarak, bu protokol yalnızca AT2 kültürlerinin genişlemesine ve üretilmesine izin verir ve tek bir anahtar alveolar hücre tipine dayanan indirgemeci bir model sistemi sağlar. Önemli olarak, alveolar tip 1 hücreler gibi diğer ilgili alveolar hücre tipleri bu platformlardan eksikti. Diğer gruplar, birincil insan AT2'lerini fibroblastlı veya fibroblastsız sferoidler veya organotipik kültürler olarak kültürlemede başarılı olmuşlardır 1,14,15,16,17; Bununla birlikte, birincil insan AT2'leri, ALI koşulları26 olmadan normal 2D kültürde kültürlendiğinde anahtar yüzey aktif maddelerin ekspresyonunu kaybetme eğilimindedir. Ayrıca, son zamanlarda yapılan çalışmalar, iAT2'lerin taze, kültürsüz insan birincil AT2s27'den daha yüksek proliferatif belirteçler ve daha düşük AT2 olgunlaşma belirteçleri ifade ettiğini göstermiştir. iAT2'ler ve taze birincil insan AT2'leri arasındaki bu farklılıklara rağmen, kültürlenmiş birincil AT2'lerin bile taze, kültürlenmemiş birincil AT2'lerden transkriptomik farklılıklar gösterdiğini ve böylece bu in vitro modellerin in vivo akciğer biyolojisini modellemek için çeşitli güçlü yönlere ve sınırlamalara sahip olduğu sonucuna vardık.
iAT2 platformu, hasta kaynaklı iPSC'lerden19,20 genetik mutasyonları incelemek için uygulanabilir. Sistem ayrıca, yüksek verimli ilaç taramasına uyum sağlamak için büyük ölçüde ölçeklendirilebilir. Ek olarak, iAT2 ALI'ler viral veya bakteriyel enfeksiyon veya sigara dumanına, e-sigara buharına veya diğer aerosollere maruz kalma gibi çevresel maruziyetler için uygundur23. Özetle, iAT2'lerin hem 3D hem de 2D ALI kültürlerini oluşturmak için kullanılan bu protokol, hastalıkla ilgili bir hücre tipinin uzun vadeli kültürüne izin verir ve bu hücrelerin birçok uygulamada kullanılmasını sağlayan fizyolojik, ölçeklenebilir bir platform sağlar.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Wilson, Kotton ve Hawkins laboratuvarlarının üyelerine yararlı tartışmaları için içtenlikle teşekkür ederiz. Ayrıca Greg Miller'a (CReM Laboratuvar Yöneticisi) ve Marianne James'e (iPSC Çekirdek Yöneticisi) paha biçilmez destekleri için minnettarız. Brian Tilton ve BUMC Flow Cytometry Core'a hücre sıralama konusundaki teknik yardımları için teşekkür ederiz (NIH hibe #1S10OD021587-01A1 tarafından desteklenmektedir). Bu çalışma, RBW'ye verilen Avustralya Ulusal Sağlık ve Tıbbi Araştırma Konseyi'nden bir CJ Martin Erken Kariyer Bursu ile desteklenmiştir; NIH hibe F30HL147426 KMA; Pulmoner Fibrozis Vakfı'ndan bir I.M. Rosenzweig Genç Araştırmacı Ödülü ve Boston Üniversitesi Klinik ve Translasyonel Bilim Enstitüsü (1UL1TR001430) aracılığıyla KDA'ya Entegre Pilot Hibe Ödülü; İsviçre Ulusal Bilim Vakfı (P2ELP3_191217) ABA'ya; NIH, DNK'ya U01HL148692, U01HL134745, U01HL134766 ve R01HL095993 verir; ve NIH, AAW'ye verilen U01TR001810, R01DK101510 ve R01DK117940'ı hibe eder; iPSC bakımı, bankacılığı ve paylaşımı NIH hibesi NO1 75N92020C00005 tarafından desteklenmektedir. Şekil 1, Biorender.com kullanılarak oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3-Isobutyl-1-methylxanthine (IBMX) | Sigma | I5879 | For CKDCI |
| 12 Well Cell Culture Plate | Corning | 3513 | Plates for culturing |
| 1-Thioglycerol (MTG) | M6145 | Sigma | For CKDCI |
| 2D Matrigel (matrix) - Matrigel hESC-Qualified Matrix | Corning | 8774552 | To coat ALI Transwells |
| 3D Matrigel (matrix) - Growth Factor Reduced Matrigel | Corning | 356230 | To grow iAT2 spheres in |
| 8-bromoadenosine 30,50-cyclic monophosphate sodium salt (cAMP) | Sigma | B7880 | For CKDCI |
| Ascorbic Acid | A4544 | Sigma | For CKDCI |
| B27 w/out retinoic acid | Life Technologies | 12587-010 | For CKDCI |
| Bovine Serum Albumin (BSA) (7.5%) | Thermo Fisher | 15260037 | For CKDCI |
| Calcein blue | Life Technologies | C1429 | For live/dead discrimination in flow cytometry |
| Calcein green | Life Technologies | C1430 | Optional visualisation of cells on cell culture insert |
| Cell culture inserts - Costar 6.5 mm Clear Transwells with 0.4 µm pore size | Millipore-Sigma | CLS3470-48EA | ALI transwells |
| CHIR99021 | Tocris | 4423 | For CKDCI |
| Dexamethasone | Sigma | D4902 | For CKDCI |
| Dispase (2 mg/mL) | Thermo Fisher | 354235 | To dissolve matrigel |
| Dulbecco's Modified Eagle Medium (DMEM) | Thermo Fisher | 11995 | To make trypsin inactivation media (10% FBS in DMEM) |
| Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12 (DMEM/F12) | Thermo Fisher | A4192002 | To wash |
| Dulbecco's phosphate buffered saline (PBS) | Thermo Fisher | 14190 | For flow cytometric analyses |
| Fetal bovine serum (FBS) (Hyclone charaterized) | GE Healthcare Life Sciences | SH30071.03 | To make trypsin inactivation media (10% FBS in DMEM) |
| Glutamax | Life Technologies | 35050-061 | For CKDCI |
| Ham's F-12 Nutrient Mixture (F12) | Cellgro | 10-080-CV | For CKDCI |
| Hemocytometer | Fisher | 02-671-6 | For cell counting |
| Invivogen Primocin 1 G (50 mg/mL) | Fisher Scientific | NC9392943 | For CKDCI |
| Iscove's Modified Dulbecco's Medium (IMDM) | Thermo Fisher | 12440053 | For CKDCI |
| Millicell ERS-2 Voltohmeter | Millipore | MERS00002 | To measure trans-epithlial electrical resistance |
| N2 supplement | Life Technologies | 17502-048 | For CKDCI |
| Recombinant human KGF | R&D Systems | 251-KG-010 | For CKDCI |
| Retinoic acid | Sigma | R2625 | For CKDCI |
| Trypan blue | Thermo Fisher | 15250061 | For cell count during passaging |
| Trypsin-EDTA (0.05%) | Gibco | 25-300-062 | To dissociate iAT2 spheres |
| Y-27632 dihydrochloride | Tocris | 1254 | Add to cells after passaging |
Referanslar
- Barkauskas, C. E., et al. Type 2 alveolar cells are stem cells in adult lung. Journal of Clinical Investigation. 123 (7), 3025-3036 (2013).
- Mason, R. J., Williams, M. C. Type II alveolar cell. Defender of the alveolus. American Review of Respiratory Disease. 115 (6), 81-91 (1977).
- Nogee, L. M., et al. A mutation in the surfactant protein C gene associated with familial interstitial lung disease. New England Journal of Medicine. 344 (8), 573-579 (2001).
- Nogee, L. M., et al. A mutation in the surfactant protein B gene responsible for fatal neonatal respiratory disease in multiple kindreds. Journal of Clinical Investigation. 93 (4), 1860-1863 (1994).
- Shulenin, S., et al. ABCA3 gene mutations in newborns with fatal surfactant deficiency. New England Journal of Medicine. 350 (13), 1296-1303 (2004).
- Nureki, S. I., et al. Expression of mutant Sftpc in murine alveolar epithelia drives spontaneous lung fibrosis. Journal of Clinical Investigation. 128 (9), 4008-4024 (2018).
- Katzen, J., et al. An SFTPC BRICHOS mutant links epithelial ER stress and spontaneous lung fibrosis. Journal of Clinical Investigation Insight. 4 (6), 126125 (2019).
- Mathis, C., et al. Human bronchial epithelial cells exposed in vitro to cigarette smoke at the air-liquid interface resemble bronchial epithelium from human smokers. American Journal of Physiology-Lung Cellular and Molecular Physiology. 304 (7), 489-503 (2013).
- Purkayastha, A., et al. Direct exposure to SARS-CoV-2 and cigarette Smoke increases infection severity and alters the stem cell-derived airway repair response. Cell Stem Cell. 27 (6), 869-875 (2020).
- Matrosovich, M. N., Matrosovich, T. Y., Gray, T., Roberts, N. A., Klenk, H. D. Human and avian influenza viruses target different cell types in cultures of human airway epithelium. Proceedings of the National Academy of Sciences. 101 (13), 4620-4624 (2004).
- Tollstadius, B. F., Silva, A. C. G. d., Pedralli, B. C. O., Valadares, M. C. Carbendazim induces death in alveolar epithelial cells: A comparison between submerged and at the air-liquid interface cell culture. Toxicology in Vitro. 58, 78-85 (2019).
- Winton, H. L., et al. Cell lines of pulmonary and non-pulmonary origin as tools to study the effects of house dust mite proteinases on the regulation of epithelial permeability. Clinical and Experimental Allergy. 28 (10), 1273-1285 (1998).
- Kanagaki, S., et al. Hydroxypropyl cyclodextrin improves amiodarone-induced aberrant lipid homeostasis of alveolar cells. American Journal of Respiratory Cell and Molecular Biology. 64 (4), 504-514 (2021).
- Sucre, J. M. S., et al. Successful establishment of primary type 2 alveolar epithelium with 3D organotypic co-culture. American Journal of Respiratory Cell and Molecular Biology. 59 (2), 158-166 (2018).
- Kobayashi, Y., et al. Persistence of a regeneration-associated, transitional alveolar epithelial cell state in pulmonary fibrosis. Nature Cell Biology. 22, 934-946 (2020).
- Choi, J., et al. Inflammatory signals induce AT2 cell-derived damage-associated transient progenitors that mediate alveolar regeneration. Cell Stem Cell. 27 (3), 366-382 (2020).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Katsura, H., et al. Human lung stem cell-based alveolospheres provide insights into SARS-CoV-2-mediated interferon responses and pneumocyte dysfunction. Cell Stem Cell. 27 (6), 890-904 (2020).
- Jacob, A., et al. Differentiation of human pluripotent stem cells into functional lung alveolar epithelial cells. Cell Stem Cell. 21 (4), 472-488 (2017).
- Alysandratos, K. -. D., et al. Patient-specific iPSCs carrying an SFTPC mutation reveal the intrinsic alveolar epithelial dysfunction at the inception of interstitial lung disease. Cell Reports. 36 (9), 109636 (2021).
- Hurley, K., et al. Reconstructed single-cell fate trajectories define lineage plasticity windows during differentiation of human PSC-derived distal lung progenitors. Cell Stem Cell. 26 (4), 593-608 (2020).
- Sun, Y. L., et al. Heterogeneity in human iPSC-derived alveolar epithelial type II cells revealed with ABCA3/SFTPC reporters. American Journal of Respiratory Cell and Molecular Biology. 65 (4), 442-460 (2021).
- Abo, K. M., et al. Human pluripotent stem cell-derived alveolar type 2 cells mature and respond to environmental exposures in air-liquid interface culture. Journal of Clinical Investigation Insight. 7 (6), (2022).
- Huang, J., et al. SARS-CoV-2 infection of pluripotent stem cell-derived human lung alveolar type 2 cells elicits a rapid epithelial-intrinsic inflammatory response. Cell Stem Cell. 27 (6), 962-973 (2020).
- Jacob, A., et al. Derivation of self-renewing lung alveolar epithelial type II cells from human pluripotent stem cells. Nature Protocols. 14 (12), 3303-3332 (2019).
- Beers, M. F., Moodley, Y. When is an alveolar type 2 cell an alveolar type 2 cell? A conundrum for lung stem cell biology and regenerative medicine. American Journal of Respiratory Cell and Molecular Biology. 57 (1), 18-27 (2017).
- Alysandratos, K. D., et al. Impact of cell culture on the transcriptomic programs of primary and iPSC-derived human alveolar type 2 cells. bioRxiv. , (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır