Method Article
Генерация 3D-сфер и 2D-культур воздушно-жидкостного интерфейса индуцированных человеком плюрипотентных стволовых клеток типа 2 альвеолярных эпителиальных клеток
* Эти авторы внесли равный вклад
В этой статье
Резюме
Настоящий протокол описывает индуцированные человеком плюрипотентные стволовые клетки, полученные из альвеолярных эпителиально-подобных клеток типа 2 (iAT2s). Эти клетки могут быть культивированы как самообновляющиеся сферы в 3D-культуре или адаптированы к культуре воздушно-жидкостного интерфейса (ALI).
Аннотация
В легких альвеолярный эпителий является физическим барьером от стимулов окружающей среды и играет важную роль в гомеостазе и заболеваниях. Альвеолярные эпителиальные клетки типа 2 (AT2s) являются факультативными предшественниками дистального эпителия легкого. Дисфункция и повреждение AT2s могут быть результатом и способствовать различным заболеваниям легких. Таким образом, улучшение понимания биологии AT2 имеет решающее значение для понимания биологии легких и болезней; однако первичные человеческие AT2, как правило, трудно изолировать и ограничены в поставках. Чтобы преодолеть эти ограничения, индуцированные человеком плюрипотентные стволовые клетки (iPSC), полученные из альвеолярных эпителиальных клеток типа 2 (iAT2s), могут быть сгенерированы с помощью протокола направленной дифференцировки, который повторяет развитие легких in vivo . iAT2 растут в условиях без кормушек, разделяют транскриптомную программу с первичными AT2 для взрослых людей и выполняют ключевые функции AT2, такие как производство, упаковка и секреция поверхностно-активного вещества. В этом протоколе подробно описываются методы поддержания самообновляющихся iAT2 посредством последовательного прохождения в трехмерной (3D) культуре или адаптации iAT2 к культуре интерфейса воздух-жидкость (ALI). Одноклеточная суспензия iAT2s генерируется перед покрытием в 3D солюбилизированной базальной мембранной матрице (далее именуемой «матрицей»), где они самособираются в монослойные эпителиальные сферы. iAT2s в 3D-культуре могут быть последовательно диссоциированы на одноклеточные суспензии для прохождения или покрытия в культуре 2D ALI. В культуре ALI iAT2 образуют поляризованный монослой с апикальной поверхностью, подверженной воздействию воздуха, что делает эту платформу легко поддающейся воздействию окружающей среды. Следовательно, этот протокол генерирует неисчерпаемый запас iAT2, производя более 1 x 1030 ячеек на входную ячейку в течение 15 проходов, сохраняя при этом программу AT2, указанную экспрессией SFTPCtdTomato . Полученные клетки представляют собой воспроизводимую и релевантную платформу, которая может быть применена для изучения генетических мутаций, моделирования воздействия окружающей среды или скрининга лекарств.
Введение
В легких дыхательные пути и альвеолярные эпителиальные клетки первыми сталкиваются с вдыхаемым воздействием окружающей среды, включая патогены, передаваемые через вдыхаемые аэрозоли и вредные раздражители, такие как сигаретный дым. Альвеолярные эпителиальные клетки типа 2 (AT2s) необходимы для поддержания гомеостаза легких, поскольку они являются факультативными предшественниками дистального эпителия легкого, продуцируют поверхностно-активные вещества для снятия альвеолярного поверхностного натяжения и устанавливают врожденный иммунный ответ на вдыхаемые воздействия 1,2. Однако дисфункция AT2 может быть результатом травм легких или мутаций в генах, которые избирательно экспрессируются в AT2, таких как SFTPC, SFTPB и ABCA3 3,4,5. Предыдущие подходы к изучению этих генетических мутаций основывались на мышиных моделях6 или инженерных, содержащих мутации векторах, введенных в увековеченные клеточные линии7. Поэтому платформы, которые могут моделировать влияние генетических и экологических возмущений на AT2s в физиологически значимых типах клеток и в продуктивной системе in vitro, необходимы для дальнейшего понимания роли AT2 в здоровье и болезнях.
С точки зрения моделирования воздушно-капельного воздействия, культуры воздушно-жидкостного интерфейса (ALI) эпителиальных клеток первичных дыхательных путей были успешно использованы для выявления ключевых молекулярных реакций на сигаретный дым8 и для моделирования инфекции дыхательных путей 9,10. Сопоставимая система культуры ALI для альвеолярного эпителия, ключевого места инфекции или травмы при заболевании, гораздо менее развита по сравнению с системой эпителиальной модели дыхательных путей. Увековеченные клеточные линии были культивированы в ALI в качестве прокси для альвеолярного эпителия 11,12, но эти клеточные линии транскриптомно отличаются от первичных альвеолярных эпителиальных клеток13 и не имеют ключевого клеточного механизма, такого как способность секретировать поверхностно-активные вещества или образовывать плотные соединения в ALI12. Первичные человеческие AT2 могут культивироваться в 3D-сферах в присутствии фибробластов 1,14, но подвержены ограничениям, включая ограниченную доступность из эксплантных легких и их тенденцию к старению или потере клеточного фенотипа в большинстве культур на сегодняшний день. Эти характеристики представляют собой препятствия для широкого внедрения первичных исследований AT2 in vitro, хотя в последнее время был достигнут прогресс в оптимизации 3D-культур без кормушек для расширения первичных AT2s 15,16,17,18.
Протоколы направленной дифференцировки были разработаны для рекапитуляции этапов развития in vivo для генерации индуцированных человеком плюрипотентных стволовых клеток (iPSC) альвеолярных эпителиальных клеток типа 2 (iAT2s)19. iAT2 растут как самообновляющиеся сферы в 3D-культуре без сыворотки в определенной среде, содержащей CHIR99021, KGF, дексаметазон, цАМФ и 3-изобутил-1-метилксантин (IBMX), называемой «CK + DCI»19, в отсутствие фибробластных питателей и могут культивироваться в течение >20 проходов20,21. Кроме того, iAT2 разделяют транскриптомную программу со взрослыми первичными AT2 человека, образуют пластинчатые тела, а также производят и упаковывают поверхностно-активное вещество 19,21,22. Этот протокол детализирует последовательное прохождение iAT2 путем диссоциации ячеек на одноэлементную суспензию. На этом этапе iAT2 могут быть повторно покрыты и расширены в 3D-культуре или покрыты 2D-культурой ALI23. Эти методы могут быть использованы для изучения внутренней биологии AT2 при гомеостазе и заболевании 20,22 и для опроса эффектов соединений или стимулов в масштабируемой, физиологически значимой платформе23,24, как было показано ранее.
протокол
Все эксперименты, связанные с дифференциацией человеческих линий iPSC, проводились в соответствии с Институциональным наблюдательным советом Бостонского университета (протокол H33122). Дермальные фибробласты, закупленные для перепрограммирования в iPSCs, были получены от донора с письменного информированного согласия с одобрения Управления по защите исследований человека Медицинской школы Вашингтонского университета, Сент-Луис, штат Миссури.
1. Диссоциация альвеолосферы
- Готовят полную безымянную дифференцировочную среду (цСФДМ) в соответствии с композицией, указанной в таблице 1.
- Подготовьте носители CK + DCI в подготовленной базе cSFDM согласно таблице 2.
- Оттаивание 2D (человеческих эмбриональных стволовых клеток) и / или 3D (снижение фактора роста) матрицы на льду по мере необходимости для экспериментальных нужд.
- Аспирировать всю среду CK + DCI с помощью пипетки или аспирационной пипетки с вакуумом из 3D-матричных капель, содержащих альвеолосферы, полученные из направленной дифференцировки19, в 12-луночной пластине.
- Добавьте 1 мл диспазы (2 мг/мл) на каплю. Аккуратно пипсируйте каплю в диспазу с помощью пипетки P1000. Инкубировать при 37 °C в течение 1 ч, пипеткой вверх и вниз один раз через 30 мин.
- Перенос диссоциированных органоидов (из шага 1.5) из одной матричной капли в диспазе в коническую трубку объемом 15 мл. Для стирки добавьте 10 мл модифицированной среды Dulbecco компании Iscove (IMDM, см. Таблицу материалов).
- Центрифуга при 300 х г в течение 5 мин при комнатной температуре. Аспирируйте супернатант с помощью пипетки или аспирационной пипетки с вакуумом, оставляя как можно меньше супернатанта.
ПРИМЕЧАНИЕ: Важно удалить всю диспазу, так как любая оставшаяся диспаза может растворить матрицу, в которую впоследствии будут засеяны клетки. Если над гранулой видна прозрачная дымка, диспаза не полностью растворила матрицу, и к грануле можно добавить больше диспазы еще на 20-30 мин при 37 °C. - Повторно суспендируют клетки в 1 мл 0,05% трипсина на каплю и переносят обратно в 12-луночную пластину. Инкубировать при 37 °C в течение 12-15 мин. Наблюдайте за диссоциацией под микроскопом. Избегайте чрезмерной пипетки клеток на этом этапе.
ПРИМЕЧАНИЕ: В конце инкубации клетки должны достичь одноклеточной суспензии после пипетки 3-5 раз пипеткой P1000. Для передачи iAT2s в ALI (этап 3) время трипсинизации должно быть сведено к минимуму (максимум 12 мин), так что клетки находятся в 2-3-клеточных сгустках, а не в одноклеточной суспензии, когда они готовы к покрытию на вставку клеточной культуры. - Прекращают действие трипсина при равном объеме FBS-содержащей среды (10% ES-квалифицированных FBS в DMEM). Центрифуга при 300 х г в течение 5 мин при комнатной температуре.
- Промыть клетки 10 мл IMDM. Центрифуга при 300 х г в течение 5 мин при комнатной температуре.
- Повторно суспендируйте ячейки в соответствующем объеме для подсчета, а затем подсчитайте клетки с помощью гемоцитометра (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Из одной сливающейся матричной капли объемом 50 мкл, посеянной при 400 клетках/мкл, ожидаемый выход составляет от 500 000 до 1,5 х 106 клеток на каплю. - Используйте одноклеточную суспензию клеток iAT2 для генерации альвеолосфер путем покрытия в 3D-матрице (шаг 2) и/или покрытия на вставках клеточной культуры для культуры ALI (шаг 3).
2.3D покрытие iAT2s
- После подсчета (этап 1.11) определите количество желаемых ячеек для повторного нанесения в 3D-матрицу (400 ячеек/мкл матрицы с 50-100 мкл капель 3D-матрицы на лунку 12-луночной пластины). Центрифугируйте ячейки при 300 х г в течение 5 мин при комнатной температуре. Удалите как можно больше супернатанта с помощью пипетки.
- Повторное суспендирование ячеек в 3D-матрице. Повторное суспендирование быстро и на льду, если это необходимо, чтобы предотвратить полимеризацию матрицы (что происходит при нагревании).
- Используйте пипетку P200, чтобы дозировать одну каплю 3D-матрицы на лунку в предварительно нагретую 12-луночную пластину. Пипетку осторожно, чтобы избежать образования пузырьков в матричной капле. Не позволяйте клеточной суспензии оседать при дозировании нескольких капель.
- Поместите пластину в инкубатор при температуре 37 °C на 20-30 мин, чтобы дать каплям матрицы полимеризоваться.
- Добавьте 1 мл CK + DCI + 10 мкМ среды Y-27632 (см. Таблицу материалов) на лунку, чтобы покрыть матричную каплю.
- Через 72 ч изменить среду на CK + DCI без 10 мкМ Y-27632.
- Заменяйте среду свежим CK + DCI каждые 48-72 ч.
ПРИМЕЧАНИЕ: iAT2, как правило, необходимо проходить примерно каждые 10-14 дней, в зависимости от клеточной линии и плотности покрытия.
3. Передача iAT2 в ALI
- Подготовьте свежепокрытые 6,5 мм вставки для посева клеток за 1 ч перед использованием, разбавляя 2D-матрицу в модифицированной среде/питательной смеси F-12 (DMEM/F12) компании Dulbecco в рабочий раствор в соответствии с инструкциями производителя для 2D-матрицы (см. Таблицу материалов). Затем добавляют 100 мкл разбавленной матрицы на 6,5 мм клеточной культуры. Дайте матрице полимеризоваться в инкубаторе при 37 °C в течение 30 мин или при комнатной температуре в течение 1 ч.
- Аспирируйте избыточную матрицу из вставок клеточной культуры с помощью пипетки или аспирационной пипетки вакуумом и промывайте один раз DMEM/F12. Аспирировать эту промывку непосредственно перед добавлением клеток.
- После подсчета определите количество необходимых клеток для посева требуемого количества клеток во вкладышах культуры (520 000 живых клеток/см2, что эквивалентно 172 000 живых клеток на 6,5 мм клеточной культуральной вставки). Центрифугируйте ячейки при 300 х г в течение 5 мин при комнатной температуре. Удалите как можно больше супернатанта.
- Повторно суспендировать клетки в соответствующем объеме для посева со 100 мкл CK + DCI + 10 мкМ Y-27632 на вставку клеточной культуры (клеточная суспензия должна быть 1,720 клеток/мкл). Добавьте 100 мкл в апикальный отсек вкладыша клеточной культуры. Осторожно перемешивайте пластину в перекрестном рисунке, чтобы обеспечить равномерное распределение клеток по вставке клеточной культуры, и подтвердите это, проверив под микроскопом 4x объектив.
ПРИМЕЧАНИЕ: Плотность посева имеет решающее значение и может потребовать оптимизации в диапазоне от 160 000 до 300 000 клеток на вставку культуры клеток толщиной 6,5 мм. Кальцеиновый зеленый (см. Таблицу материалов) клеточно-проницаемый краситель можно добавлять в клетки и просматривать на перевернутом флуоресцентном микроскопе для визуализации клеток после посева. - Добавьте 500 мкл CK + DCI + 10 мкМ Y-27632 в базолатеральный отсек каждой вставки клеточной культуры.
- Аспиратная апикальная CK + DCI + 10 мкМ среды Y-27632 через 48 ч после посева с использованием пипетки для инициирования ALI (известной как «эрлифт»).
ПРИМЕЧАНИЕ: Ячейки должны быть на 100% сливающимися в этот момент. Если ячейки не сливаются на 100%, шаги 3.7-3.8 все равно следует выполнять в указанные моменты времени; Монослои сливающихся клеток могут образовываться дольше. - Изменить базолатеральную КФК + DCI + 10 мкМ среды Y-27632 через 72 ч на CK + DCI без 10 мкМ Y-27632.
ПРИМЕЧАНИЕ: Должна быть минимальная, если таковая имеется, «утечка» среды на апикальную сторону. Однако, если это происходит в первые несколько дней, продолжайте аспирировать аспиральную сторону ежедневно, пока не произойдет дальнейшей утечки. - Заменяйте базолатеральную среду свежим CK + DCI каждые 48-72 ч.
ПРИМЕЧАНИЕ: iAT2, используемые в культурах ALI, максимально созревают через 5-14 дней после нанесения покрытия. - Поддерживайте клетки с тщательным мониторингом в течение 28 дней после покрытия, если это необходимо, для более длительных экспериментов.
ПРИМЕЧАНИЕ: Видимые признаки отказа ALI, такие как отслаивание клеток от края вставки или образование отверстий в монослое, могут наблюдаться после чрезмерного времени в культуре, после чего ALI больше не может использоваться для экспериментов.
Результаты
iAT2 перемещали в одноклеточную суспензию, а затем перемещали в 3D-матрицу или в 2D на вставки клеточной культуры для культуры ALI (рисунок 1). После одноклеточной диссоциации iAT2 анализировали методом проточной цитометрии. Вкратце, клетки, повторно суспендированные в 1% фетальной бычьей сыворотке (FBS) в фосфатно-буферном физиологическом растворе (PBS) с красителем жизнеспособности кальциена синего цвета (1:1000), были проанализированы на проточном цитометре, находящегося на нефрагментах, синглетах и tdTomato. Здесь, в качестве примера, приведена линия SPC2 (клон SPC2-ST-B220), которая имеет репортер tdTomato, предназначенный для эндогенного локуса SFTPC для удобства визуализации и отслеживания программы AT2 с течением времени в культуре (рисунок 2A). Экспрессия iAT2 SFTPC-tdTomato поддерживалась при перепокрытии в 3D-матрице в виде сфер (рисунок 2B) и при нанесении на вставки клеточной культуры (рисунок 2C). Трансэпителиальное электрическое сопротивление (TEER) может быть измерено для определения целостности культуры ALI (рисунок 2D). Для измерения TEER использовался вольтомметр (см. Таблицу материалов) со 100 мкл среды CK + DCI, добавленной в апикальную камеру. Вставки клеточной культуры, покрытые Матригелем, в отсутствие засеянных клеток обрабатывались как заготовки. Показания проводились в трех местах в каждом колодце.

Рисунок 1: Схематическое представление рабочего процесса протокола. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
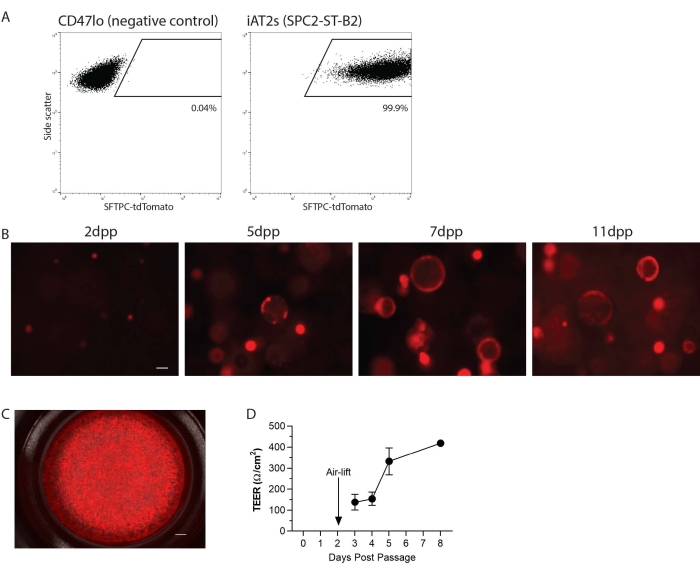
Рисунок 2: Репрезентативные результаты протокола. (A) Результаты репрезентативной проточной цитометрии для SFTPC-tdTomato в индуцированных человеком плюрипотентных стволовых клетках, полученных из альвеолярных эпителиально-подобных клеток типа 2 (iAT2s), культивируемых в 3D. Отрицательным показанным контролем является нелегочная энтодерма (CD47lo). (B) Репрезентативная визуализация живых клеток iAT2s, культивируемых в 3D в различные дни после прохождения (dpp) (SFTPC-tdTomato, шкала = 50 мкм). (C) Репрезентативная визуализация живых клеток iAT2s, покрытых на границе раздела воздух-жидкость (SFTPC-tdTomato, шкала бар = 500 нм). (D) Репрезентативное трансэпителиальное электрическое сопротивление iAT2, покрытое на границе раздела воздух-жидкость. n = 3, полосы погрешностей указывают на стандартное отклонение. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Реагентов | Объем для 500 мл | Конечная концентрация |
| Модифицированная среда Дульбекко (IMDM) | 375 мл | 75% |
| Питательная смесь F-12 (F12) | 125 мл | 25% |
| Добавка B-27 (с RA) | 5 мл | 1% |
| Дополнение N-2 | 2,5 мл | 0.50% |
| BSA (7,5% акций) | 3,3 мл | 0.05% |
| Примоцин (запас 50 мг/мл) | 1 мл | 100 мкг/мл |
| Глутамакс (100x шт.) | 5 мл | в 1 раз |
| Аскорбиновая кислота (запас 50 мг/мл) | 500 мкл | 50 мкг/мл |
| 1-тиоглицерин (MTG) (от 26 мкл в 2 мл IMDM) | 1,5 мл | 4,5 x 10-4 М |
Таблица 1: Состав полной бессывороточной дифференцирующей среды (цСФДМ).
| Реагент | Конечная концентрация |
| ЧИР99021 | 3 мкМ |
| рКГФ | 10 нг/мл |
| Дексаметазон | 50 нМ |
| 8-бромоаденозин 30,50-циклическая монофосфатная натриевая соль (цАМФ) | 0.1 мМ |
| 3-изобутил-1-метилксантин (IBMX) | 0.1 мМ |
Таблица 2: Составы сред CK + DCI.
Обсуждение
AT2 поддерживают гомеостаз легких, и дисфункция этих ключевых альвеолярных клеток может как вызывать, так и возникать в результате различных заболеваний легких. Из-за сложности доступа и изоляции первичных человеческих AT2 генерируются iAT2. Применяя методы направленной дифференцировки, описанные в другом месте25 , и расширение и посев клеток, описанные здесь, ИПСК, полученные от любого человека, могут быть дифференцированы в надежно самообновляющиеся iAT2, тем самым обеспечивая специфические для пациента клетки для биомедицинских исследований, включая фундаментальные биомедицинские исследования, моделирование заболеваний, клеточную терапию или скрининг лекарств. В настоящем протоколе подробно описан способ диссоциации iAT2s на одноклеточную суспензию, которая затем может быть повторно покрыта в 3D Matrigel для генерации альвеолосфер для расширения клеток или повторно покрыта в культуре 2D ALI для дальнейших экспериментов.
Протокол имеет несколько важных шагов для обеспечения успешной передачи и повторного покрытия как в 3D, так и в ALI культурах. Механическая тритурация должна быть сведена к минимуму, так как чрезмерное пипетирование может снизить жизнеспособность клеток. Кроме того, плотность посева iAT2s как в 3D, так и в 2D ALI культурах имеет решающее значение; для 3D-культуры, в целом, 400 клеток / мкл 3D Matrigel является оптимальным для большинства линий iPSC. Тем не менее, диапазон плотностей от 100-500 клеток / мкл иногда был успешным, и оптимизация плотности может потребоваться для различных клеточных линий. Для культуры ALI оптимизация плотности посева iAT2s на вставках клеточной культуры также необходима для достижения сливающегося монослоя клеток через 48 ч после посева (т.е. в день эрлифта). Некоторые линии iAT2 требуют больше ячеек на вставку; таким образом, если требуется поиск и устранение неисправностей, рекомендуется диапазон от 160 000 до 300 000 ячеек/вкладышей для 24-луночных вставок клеточных культур. 3D-культуры также могут быть масштабированы до 24- и 48-луночных пластин путем поддержания плотности посева на уровне 400 клеток/мкл 3D-матрицы и уменьшения размера капель матрицы до 25 мкл и 20 мкл соответственно. Культуры ALI могут быть масштабированы до 96-луночных клеточных культур путем покрытия каждой вставки 30 мкл матрицы, покрытия 80 000 клеток в 30 мкл на вставку и подачи 150 мкл базолатеральной среды на лунку. Плотность посева, а также объемы матриц и носителей должны быть масштабированы и оптимизированы соответствующим образом для других форматов пластин.
Ограничением этого протокола является то, что клетки, используемые для покрытия ALI, должны быть достаточно очищены, чтобы быть NKX2-1+ и SFTPC + 19,20,21,23 для формирования iAT2 ALIs, и формирование культуры ALI может варьироваться от линии к линии. Кроме того, этот протокол позволяет расширять и генерировать культуры только AT2, обеспечивая редукционистскую модельную систему, основанную на одном ключевом типе альвеолярных клеток. Важно отметить, что другие соответствующие типы альвеолярных клеток, такие как альвеолярные клетки типа 1, отсутствовали на этих платформах. Другие группы добились успеха в культивировании первичных человеческих AT2 в виде сфероидов или оловоорганических культур с фибробластами или без них 1,14,15,16,17; однако первичные человеческие AT2, как правило, теряют экспрессию ключевых поверхностно-активных веществ при культивировании в нормальной 2D-культуре без условий ALI26. Кроме того, недавняя работа показала, что iAT2s экспрессируют более высокие пролиферативные маркеры и более низкие маркеры созревания AT2, чем свежие, некультурные первичные AT2s27 человека. Несмотря на эти различия между iAT2 и свежими первичными человеческими AT2, мы обнаружили, что даже культивируемые первичные AT2 демонстрируют транскриптомные отличия от свежих, некультурных первичных AT2s27, и, таким образом, пришли к выводу, что эти модели in vitro имеют различные сильные стороны и ограничения для моделирования биологии легких in vivo.
Платформа iAT2 может быть применена для изучения генетических мутаций из IPSCs19,20, полученных от пациентов. Система также может быть существенно расширена для обеспечения высокопроизводительного скрининга лекарств. Кроме того, iAT2 ALI пригодны для воздействия окружающей среды, такого как вирусная или бактериальная инфекция или воздействие сигаретного дыма, паров электронных сигарет или других аэрозолей23. Таким образом, этот протокол для генерации как 3D, так и 2D ALI культур iAT2s позволяет проводить долгосрочную культуру типа клеток, связанных с заболеванием, и обеспечивает физиологическую, масштабируемую платформу, которая позволяет использовать эти клетки во многих приложениях.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы искренне благодарим членов лабораторий Уилсона, Коттона и Хокинса за их полезные обсуждения. Мы также очень благодарны Грегу Миллеру (менеджер лаборатории CReM) и Марианне Джеймс (менеджер iPSC Core) за их неоценимую поддержку. Мы благодарим Брайана Тилтона и BUMC Flow Cytometry Core за их техническую помощь в сортировке клеток (при поддержке гранта NIH #1S10OD021587-01A1). Эта работа была поддержана стипендией CJ Martin Early Career Fellowship от Австралийского национального совета по здравоохранению и медицинским исследованиям, присужденной RBW; Грант NIH F30HL147426 для KMA; награда I.M. Rosenzweig Junior Investigator Award от Фонда легочного фиброза и Награда за интегрированный пилотный грант через Институт клинических и трансляционных наук Бостонского университета (1UL1TR001430) для KDA; Швейцарский национальный научный фонд (P2ELP3_191217) в ABA; NIH предоставляет DNK гранты U01HL148692, U01HL134745, U01HL134766 и R01HL095993; и гранты NIH U01TR001810, R01DK101510 и R01DK117940, присужденные AAW; Обслуживание, банковское обслуживание и совместное использование iPSC поддерживаются грантом NIH NO1 75N92020C00005. Рисунок 1 был создан с использованием Biorender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| 3-Isobutyl-1-methylxanthine (IBMX) | Sigma | I5879 | For CKDCI |
| 12 Well Cell Culture Plate | Corning | 3513 | Plates for culturing |
| 1-Thioglycerol (MTG) | M6145 | Sigma | For CKDCI |
| 2D Matrigel (matrix) - Matrigel hESC-Qualified Matrix | Corning | 8774552 | To coat ALI Transwells |
| 3D Matrigel (matrix) - Growth Factor Reduced Matrigel | Corning | 356230 | To grow iAT2 spheres in |
| 8-bromoadenosine 30,50-cyclic monophosphate sodium salt (cAMP) | Sigma | B7880 | For CKDCI |
| Ascorbic Acid | A4544 | Sigma | For CKDCI |
| B27 w/out retinoic acid | Life Technologies | 12587-010 | For CKDCI |
| Bovine Serum Albumin (BSA) (7.5%) | Thermo Fisher | 15260037 | For CKDCI |
| Calcein blue | Life Technologies | C1429 | For live/dead discrimination in flow cytometry |
| Calcein green | Life Technologies | C1430 | Optional visualisation of cells on cell culture insert |
| Cell culture inserts - Costar 6.5 mm Clear Transwells with 0.4 µm pore size | Millipore-Sigma | CLS3470-48EA | ALI transwells |
| CHIR99021 | Tocris | 4423 | For CKDCI |
| Dexamethasone | Sigma | D4902 | For CKDCI |
| Dispase (2 mg/mL) | Thermo Fisher | 354235 | To dissolve matrigel |
| Dulbecco's Modified Eagle Medium (DMEM) | Thermo Fisher | 11995 | To make trypsin inactivation media (10% FBS in DMEM) |
| Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12 (DMEM/F12) | Thermo Fisher | A4192002 | To wash |
| Dulbecco's phosphate buffered saline (PBS) | Thermo Fisher | 14190 | For flow cytometric analyses |
| Fetal bovine serum (FBS) (Hyclone charaterized) | GE Healthcare Life Sciences | SH30071.03 | To make trypsin inactivation media (10% FBS in DMEM) |
| Glutamax | Life Technologies | 35050-061 | For CKDCI |
| Ham's F-12 Nutrient Mixture (F12) | Cellgro | 10-080-CV | For CKDCI |
| Hemocytometer | Fisher | 02-671-6 | For cell counting |
| Invivogen Primocin 1 G (50 mg/mL) | Fisher Scientific | NC9392943 | For CKDCI |
| Iscove's Modified Dulbecco's Medium (IMDM) | Thermo Fisher | 12440053 | For CKDCI |
| Millicell ERS-2 Voltohmeter | Millipore | MERS00002 | To measure trans-epithlial electrical resistance |
| N2 supplement | Life Technologies | 17502-048 | For CKDCI |
| Recombinant human KGF | R&D Systems | 251-KG-010 | For CKDCI |
| Retinoic acid | Sigma | R2625 | For CKDCI |
| Trypan blue | Thermo Fisher | 15250061 | For cell count during passaging |
| Trypsin-EDTA (0.05%) | Gibco | 25-300-062 | To dissociate iAT2 spheres |
| Y-27632 dihydrochloride | Tocris | 1254 | Add to cells after passaging |
Ссылки
- Barkauskas, C. E., et al. Type 2 alveolar cells are stem cells in adult lung. Journal of Clinical Investigation. 123 (7), 3025-3036 (2013).
- Mason, R. J., Williams, M. C. Type II alveolar cell. Defender of the alveolus. American Review of Respiratory Disease. 115 (6), 81-91 (1977).
- Nogee, L. M., et al. A mutation in the surfactant protein C gene associated with familial interstitial lung disease. New England Journal of Medicine. 344 (8), 573-579 (2001).
- Nogee, L. M., et al. A mutation in the surfactant protein B gene responsible for fatal neonatal respiratory disease in multiple kindreds. Journal of Clinical Investigation. 93 (4), 1860-1863 (1994).
- Shulenin, S., et al. ABCA3 gene mutations in newborns with fatal surfactant deficiency. New England Journal of Medicine. 350 (13), 1296-1303 (2004).
- Nureki, S. I., et al. Expression of mutant Sftpc in murine alveolar epithelia drives spontaneous lung fibrosis. Journal of Clinical Investigation. 128 (9), 4008-4024 (2018).
- Katzen, J., et al. An SFTPC BRICHOS mutant links epithelial ER stress and spontaneous lung fibrosis. Journal of Clinical Investigation Insight. 4 (6), 126125 (2019).
- Mathis, C., et al. Human bronchial epithelial cells exposed in vitro to cigarette smoke at the air-liquid interface resemble bronchial epithelium from human smokers. American Journal of Physiology-Lung Cellular and Molecular Physiology. 304 (7), 489-503 (2013).
- Purkayastha, A., et al. Direct exposure to SARS-CoV-2 and cigarette Smoke increases infection severity and alters the stem cell-derived airway repair response. Cell Stem Cell. 27 (6), 869-875 (2020).
- Matrosovich, M. N., Matrosovich, T. Y., Gray, T., Roberts, N. A., Klenk, H. D. Human and avian influenza viruses target different cell types in cultures of human airway epithelium. Proceedings of the National Academy of Sciences. 101 (13), 4620-4624 (2004).
- Tollstadius, B. F., Silva, A. C. G. d., Pedralli, B. C. O., Valadares, M. C. Carbendazim induces death in alveolar epithelial cells: A comparison between submerged and at the air-liquid interface cell culture. Toxicology in Vitro. 58, 78-85 (2019).
- Winton, H. L., et al. Cell lines of pulmonary and non-pulmonary origin as tools to study the effects of house dust mite proteinases on the regulation of epithelial permeability. Clinical and Experimental Allergy. 28 (10), 1273-1285 (1998).
- Kanagaki, S., et al. Hydroxypropyl cyclodextrin improves amiodarone-induced aberrant lipid homeostasis of alveolar cells. American Journal of Respiratory Cell and Molecular Biology. 64 (4), 504-514 (2021).
- Sucre, J. M. S., et al. Successful establishment of primary type 2 alveolar epithelium with 3D organotypic co-culture. American Journal of Respiratory Cell and Molecular Biology. 59 (2), 158-166 (2018).
- Kobayashi, Y., et al. Persistence of a regeneration-associated, transitional alveolar epithelial cell state in pulmonary fibrosis. Nature Cell Biology. 22, 934-946 (2020).
- Choi, J., et al. Inflammatory signals induce AT2 cell-derived damage-associated transient progenitors that mediate alveolar regeneration. Cell Stem Cell. 27 (3), 366-382 (2020).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Katsura, H., et al. Human lung stem cell-based alveolospheres provide insights into SARS-CoV-2-mediated interferon responses and pneumocyte dysfunction. Cell Stem Cell. 27 (6), 890-904 (2020).
- Jacob, A., et al. Differentiation of human pluripotent stem cells into functional lung alveolar epithelial cells. Cell Stem Cell. 21 (4), 472-488 (2017).
- Alysandratos, K. -. D., et al. Patient-specific iPSCs carrying an SFTPC mutation reveal the intrinsic alveolar epithelial dysfunction at the inception of interstitial lung disease. Cell Reports. 36 (9), 109636 (2021).
- Hurley, K., et al. Reconstructed single-cell fate trajectories define lineage plasticity windows during differentiation of human PSC-derived distal lung progenitors. Cell Stem Cell. 26 (4), 593-608 (2020).
- Sun, Y. L., et al. Heterogeneity in human iPSC-derived alveolar epithelial type II cells revealed with ABCA3/SFTPC reporters. American Journal of Respiratory Cell and Molecular Biology. 65 (4), 442-460 (2021).
- Abo, K. M., et al. Human pluripotent stem cell-derived alveolar type 2 cells mature and respond to environmental exposures in air-liquid interface culture. Journal of Clinical Investigation Insight. 7 (6), (2022).
- Huang, J., et al. SARS-CoV-2 infection of pluripotent stem cell-derived human lung alveolar type 2 cells elicits a rapid epithelial-intrinsic inflammatory response. Cell Stem Cell. 27 (6), 962-973 (2020).
- Jacob, A., et al. Derivation of self-renewing lung alveolar epithelial type II cells from human pluripotent stem cells. Nature Protocols. 14 (12), 3303-3332 (2019).
- Beers, M. F., Moodley, Y. When is an alveolar type 2 cell an alveolar type 2 cell? A conundrum for lung stem cell biology and regenerative medicine. American Journal of Respiratory Cell and Molecular Biology. 57 (1), 18-27 (2017).
- Alysandratos, K. D., et al. Impact of cell culture on the transcriptomic programs of primary and iPSC-derived human alveolar type 2 cells. bioRxiv. , (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены