Method Article
Generazione di sfere 3D e colture di interfaccia aria-liquido 2D di cellule epiteliali alveolari di tipo 2 derivate da cellule staminali pluripotenti indotte dall'uomo
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il presente protocollo descrive le cellule staminali pluripotenti derivate dall'uomo di tipo 2 alveolari epiteliali (iAT2s). Queste cellule possono essere coltivate come sfere auto-rinnovanti in coltura 3D o adattate alla coltura di interfaccia aria-liquido (ALI).
Abstract
Nel polmone, l'epitelio alveolare è una barriera fisica dagli stimoli ambientali e svolge un ruolo essenziale nell'omeostasi e nella malattia. Le cellule epiteliali alveolari di tipo 2 (AT2) sono i progenitori facoltativi dell'epitelio polmonare distale. La disfunzione e le lesioni degli AT2 possono derivare e contribuire a varie malattie polmonari. Una migliore comprensione della biologia AT2 è, quindi, fondamentale per comprendere la biologia polmonare e la malattia; tuttavia, gli AT2 umani primari sono generalmente difficili da isolare e limitati nella fornitura. Per superare queste limitazioni, le cellule epiteliali alveolari di tipo 2 derivate da cellule staminali pluripotenti indotte dall'uomo (iPSC) (iAT2s) possono essere generate attraverso un protocollo di differenziazione diretta che ricapitola lo sviluppo polmonare in vivo . Gli iAT2 crescono in condizioni prive di alimentatore, condividono un programma trascrittomico con AT2 primari adulti umani ed eseguono funzioni chiave di AT2 come produzione, confezionamento e secrezione di tensioattivi. Questo protocollo descrive in dettaglio i metodi per mantenere iAT2 auto-rinnovanti attraverso il passaggio seriale in coltura tridimensionale (3D) o l'adattamento di iAT2 alla cultura di interfaccia aria-liquido (ALI). Una sospensione a singola cellula di iAT2s viene generata prima della placcatura in matrice di membrana basale solubilizzata 3D (di seguito denominata "matrice"), dove si auto-assemblano in sfere epiteliali monostrato. IAT2 in coltura 3D possono essere dissociati in serie in sospensioni monocellulari da passare o placcati in coltura ALI 2D. Nella cultura ALI, gli iAT2 formano un monostrato polarizzato con la superficie apicale esposta all'aria, rendendo questa piattaforma facilmente suscettibile di esposizioni ambientali. Quindi, questo protocollo genera una fornitura inesauribile di iAT2, producendo verso l'alto di 1 x 1030 celle per cella di ingresso su 15 passaggi mantenendo il programma AT2 indicato dall'espressione di SFTPCtdTomato . Le cellule risultanti rappresentano una piattaforma riproducibile e pertinente che può essere applicata per studiare mutazioni genetiche, modellare esposizioni ambientali o farmaci da screening.
Introduzione
Nel polmone, le vie aeree e le cellule epiteliali alveolari sono le prime a incontrare esposizioni ambientali inalate, compresi gli agenti patogeni trasmessi tramite aerosol inalati e stimoli nocivi come il fumo di sigaretta. Le cellule epiteliali alveolari di tipo 2 (AT2s) sono essenziali per mantenere l'omeostasi polmonare in quanto sono i progenitori facoltativi dell'epitelio polmonare distale, producono tensioattivi per alleviare la tensione superficiale alveolare e montano la risposta immunitaria innata alle esposizioni inalate 1,2. Tuttavia, la disfunzione AT2 può derivare da lesioni polmonari o mutazioni in geni che sono espressi selettivamente in AT2, come SFTPC, SFTPB e ABCA3 3,4,5. Gli approcci precedenti per lo studio di queste mutazioni genetiche si sono basati su modelli murini6 o vettori ingegnerizzati contenenti mutazioni introdotti in linee cellulari immortalizzate7. Pertanto, sono necessarie piattaforme in grado di modellare gli effetti delle perturbazioni genetiche e ambientali sugli AT2 nei tipi di cellule fisiologicamente rilevanti e in un sistema produttivo in vitro per comprendere ulteriormente il ruolo che gli AT2 svolgono nella salute e nella malattia.
In termini di modellazione delle esposizioni aerodisperse, le colture di interfaccia aria-liquido (ALI) di cellule epiteliali primarie delle vie aeree sono state utilizzate con successo per rivelare risposte molecolari chiave al fumo di sigaretta8 e per modellare l'infezione delle vie aeree 9,10. Un sistema di coltura ALI comparabile per l'epitelio alveolare, un sito chiave di infezione o lesione nella malattia, è molto meno sviluppato rispetto al sistema modello epiteliale delle vie aeree. Le linee cellulari immortalizzate sono state coltivate all'ALI come proxy per l'epitelio alveolare11,12, ma queste linee cellulari sono trascrittomicamente distinte dalle cellule epiteliali alveolari primarie13 e mancano di macchinari cellulari chiave, come la capacità di secernere tensioattivi o formare giunzioni strette ad ALI12. Gli AT2 umani primari possono essere coltivati in sfere 3D in presenza di fibroblasti1,14 ma sono soggetti a limitazioni, tra cui la limitata accessibilità dei polmoni di espianto e la loro tendenza a senescere o perdere fenotipo cellulare nella maggior parte delle culture fino ad oggi. Queste caratteristiche presentano ostacoli all'adozione diffusa di studi primari in vitro at2, sebbene siano stati compiuti recenti progressi nell'ottimizzazione delle colture 3D prive di alimentatore per l'espansione di AT2 primari 15,16,17,18.
Sono stati sviluppati protocolli di differenziazione diretta per ricapitolare le tappe dello sviluppo in vivo per generare cellule epiteliali alveolari di tipo 2 derivate da cellule staminali pluripotenti indotte dall'uomo (iPSC)19. Gli iAT2 crescono come sfere auto-rinnovanti in coltura 3D senza siero in un mezzo definito contenente CHIR99021, KGF, desametasone, cAMP e 3-isobutil-1-metilxantina (IBMX), definito "CK + DCI"19, in assenza di alimentatori di fibroblasti e possono essere coltivati per >20 passaggi20,21. Inoltre, gli iAT2 condividono un programma trascrittomico con AT2 primari adulti umani, formano corpi lamellari e producono e confezionano tensioattivi 19,21,22. Questo protocollo descrive in dettaglio il passaggio seriale di iAT2 dissociando le cellule in una sospensione a cella singola. A questo punto, iAT2s può essere replicato ed espanso ulteriormente nella cultura 3D o placcato nella cultura ALI 2D23. Questi metodi possono essere utilizzati per studiare la biologia intrinseca degli AT2 nell'omeostasi e nella malattia20,22 e per interrogare gli effetti di composti o stimoli in una piattaforma scalabile e fisiologicamente rilevante23,24, come è stato precedentemente dimostrato.
Protocollo
Tutti gli esperimenti che coinvolgono la differenziazione di linee iPSC umane sono stati eseguiti in conformità con l'Institutional Review Board della Boston University (protocollo H33122). I fibroblasti dermici, procurati per la riprogrammazione in iPSC, sono stati ottenuti da un donatore con consenso informato scritto, sotto l'approvazione dell'Ufficio per la protezione della ricerca umana della Washington University School of Medicine, St. Louis, MO. Le iPSC riprogrammate sono state generate presso il Center for Regenerative Medicine della Boston University e il Boston Medical Center, Boston, MA.
1. Dissociazione dell'alveolosfera
- Preparare mezzi di differenziazione completi privi di siero (cSFDM) secondo la composizione menzionata nella Tabella 1.
- Preparare i supporti CK + DCI nella base cSFDM preparata come da Tabella 2.
- Scongelare la matrice 2D (qualificata per cellule staminali embrionali umane) e/o 3D (fattore di crescita ridotto) su ghiaccio come richiesto per le esigenze sperimentali.
- Aspirare tutto il mezzo CK + DCI utilizzando una pipetta o una pipetta aspirante con vuoto dalle goccioline della matrice 3D contenenti alveolosfere, derivate dalla differenziazione diretta19, in una piastra a 12 pozzetti.
- Aggiungere 1 mL di dispasi (2 mg/mL) per goccia. Pipettare delicatamente la goccia nella dispacciata utilizzando una pipetta P1000. Incubare a 37 °C per 1 ora, pipettare su e giù una volta dopo 30 min.
- Trasferire gli organoidi dissociati (dal punto 1.5) da una goccia di matrice nella dispasi a un tubo conico da 15 mL. Per lavare, aggiungere 10 ml di Dulbecco modificato di Iscove (IMDM, vedi Tabella dei materiali).
- Centrifugare a 300 x g per 5 minuti a temperatura ambiente. Aspirare il surnatante usando una pipetta o aspirare la pipetta con il vuoto, lasciando il minor numero possibile di surnatante.
NOTA: è importante rimuovere tutte le dispasi poiché qualsiasi dispase rimanente potrebbe dissolvere la matrice in cui le cellule verranno successivamente seminate. Se si vede una foschia chiara sopra il pellet, la dispasi non ha completamente disciolto la matrice e più dispase può essere aggiunta al pellet per altri 20-30 minuti a 37 °C. - Risospesciare le cellule in 1 mL di tripsina allo 0,05% per goccia e trasferirle nuovamente nella piastra a 12 pozzetti. Incubare a 37 °C per 12-15 min. Osservare la dissociazione al microscopio. Evitare di pipettare eccessivamente le cellule in questa fase.
NOTA: Alla fine dell'incubazione, le cellule devono ottenere una sospensione a cella singola dopo il pipettaggio 3-5 volte con una pipetta P1000. Per il passaggio di iAT2s ad ALI (Fase 3), il tempo di tripsinizzazione deve essere ridotto al minimo (massimo 12 minuti), in modo tale che le cellule siano in grumi a 2-3 cellule piuttosto che in sospensione a singola cellula quando sono pronte per la placcatura sull'inserto di coltura cellulare. - Interrompere l'azione della tripsina con un volume uguale di mezzo contenente FBS (FBS qualificato ES al 10% in DMEM). Centrifugare a 300 x g per 5 minuti a temperatura ambiente.
- Lavare le celle con 10 ml di IMDM. Centrifugare a 300 x g per 5 minuti a temperatura ambiente.
- Risospesare le celle in un volume appropriato per il conteggio, quindi contare le celle utilizzando un emocitometro (vedere Tabella dei materiali).
NOTA: da una goccia di matrice confluente da 50 μL seminata a 400 cellule/μL, la resa prevista è da 500.000 a 1,5 x 106 cellule per goccia. - Utilizzare la sospensione unicellulare di cellule iAT2 per generare alveolosfere placcando nella matrice 3D (Step 2) e/o placcando su inserti di coltura cellulare per la coltura ALI (Step 3).
2.3D placcatura di iAT2s
- Dopo il conteggio (Passo 1.11), determinare il numero di cellule desiderate da riplamare nella matrice 3D (400 celle/μL della matrice con 50-100 μL di goccioline di matrice 3D per pozzetto di una piastra a 12 pozzetti). Centrifugare le celle a 300 x g per 5 minuti a temperatura ambiente. Rimuovere il più possibile il surnatante usando una pipetta.
- Risospendare le celle nella matrice 3D. Risospesso rapidamente e su ghiaccio, se necessario, per evitare che la matrice polimerizzi (che si verifica quando è calda).
- Utilizzare una pipetta P200 per erogare una goccia di matrice 3D per pozzetto in una piastra preriscaldata a 12 pozzetti. Pipettare con attenzione per evitare di creare bolle nella goccia della matrice. Non lasciare che la sospensione cellulare si depositi durante l'erogazione di più goccioline.
- Posizionare la piastra in un incubatore a 37 °C per 20-30 minuti per consentire alle goccioline della matrice di polimerizzare.
- Aggiungere 1 mL di CK + DCI + 10 μM di Y-27632 medium (vedere Tabella dei materiali) per pozzetto per coprire la goccia della matrice.
- Dopo 72 h, cambiare il mezzo in CK + DCI senza 10 μM di Y-27632.
- Sostituire il mezzo con CK + DCI fresco ogni 48-72 ore.
NOTA: gli iAT2 dovranno in genere essere passati approssimativamente ogni 10-14 giorni, a seconda della linea cellulare e della densità di placcatura.
3. Passaggio di iAT2s ad ALI
- Preparare inserti di coltura cellulare da 6,5 mm appena rivestiti 1 ora prima dell'uso diluendo la matrice 2D nella miscela modificata Eagle Medium/Nutrient Mixture F-12 (DMEM/F12) di Dulbecco alla soluzione di lavoro secondo le istruzioni del produttore per la matrice 2D (vedere Tabella dei materiali). Quindi, aggiungere 100 μL della matrice diluita per inserto di coltura cellulare da 6,5 mm. Lasciare polimerizzare la matrice in un incubatore a 37 °C per 30 minuti o a temperatura ambiente per 1 ora.
- Aspirare la matrice in eccesso dagli inserti di coltura cellulare utilizzando una pipetta o una pipetta aspirante con vuoto e risciacquare una volta con DMEM/F12. Aspirare questo lavaggio immediatamente prima di aggiungere le cellule.
- Dopo il conteggio, determinare il numero di cellule necessarie per seminare il numero desiderato di cellule negli inserti di coltura (520.000 cellule vive / cm2, equivalenti a 172.000 cellule vive per inserto di coltura cellulare da 6,5 mm). Centrifugare le celle a 300 x g per 5 minuti a temperatura ambiente. Rimuovere il più possibile il surnatante.
- Risospese le cellule nel volume appropriato per seminare con 100 μL di CK + DCI + 10 μM Y-27632 per inserto di coltura cellulare (la sospensione cellulare deve essere di 1.720 cellule / μL ). Aggiungere 100 μL al compartimento apicale dell'inserto di coltura cellulare. Agitare delicatamente la piastra in un modello incrociato per garantire una distribuzione uniforme delle cellule attraverso l'inserto di coltura cellulare e confermarlo controllando al microscopio a 4x obiettivo.
NOTA: la densità di semina è fondamentale e può richiedere un'ottimizzazione, che va da 160.000 a 300.000 celle per inserto di coltura cellulare da 6,5 mm. Il colorante permeabile alle cellule verde calceina (vedi Tabella dei materiali) può essere aggiunto alle cellule e visualizzato su un microscopio fluorescente invertito per visualizzare le cellule dopo la semina. - Aggiungere 500 μL di CK + DCI + 10 μM di Y-27632 al compartimento basolaterale di ciascun inserto di coltura cellulare.
- Aspirare apicale CK + DCI + 10 μM di Y-27632 medio 48 ore dopo la semina utilizzando una pipetta per avviare ALI (noto come "air-lift").
NOTA: a questo punto le celle devono essere confluenti al 100%. Se le celle non sono confluenti al 100%, i passaggi 3.7-3.8 devono comunque essere eseguiti nei punti temporali indicati; i monostrati cellulari confluenti possono richiedere più tempo per formarsi. - Cambiare il basolaterale CK + DCI + 10 μM del mezzo Y-27632 dopo 72 h in CK + DCI senza 10 μM Y-27632.
NOTA: Ci dovrebbe essere una minima" "perdita" di mezzo sul lato apicale. Tuttavia, se ciò si verifica nei primi giorni, continuare ad aspirare il lato apicale ogni giorno fino a quando non vi sono ulteriori perdite. - Sostituire il mezzo basolaterale con CK + DCI fresco ogni 48-72 ore.
NOTA: Gli iAT2 utilizzati nelle colture ALI sono maturati al massimo a 5-14 giorni dopo la placcatura. - Mantenere le cellule con un attento monitoraggio fino a 28 giorni dopo la placcatura, se necessario, per una sperimentazione più prolungata.
NOTA: Segni visibili di fallimento dell'ALI, come la desquamazione delle cellule lontano dal bordo dell'inserto o la formazione di fori nel monostrato, possono essere osservati dopo un tempo troppo esteso in coltura, a quel punto l'ALI non è più utilizzabile per gli esperimenti.
Risultati
Gli iAT2 sono stati passati a una sospensione monocellulare e quindi replicati in matrice 3D o in 2D su inserti di coltura cellulare per la coltura ALI (Figura 1). Dopo la dissociazione a singola cellula, gli iAT2 sono stati analizzati mediante citometria a flusso. In breve, le cellule risospese in siero bovino fetale all'1% (FBS) in soluzione salina tamponata con fosfato (PBS) con colorante di vitalità blu calceina (1:1000) sono state analizzate su un citometro a flusso, gating per non frammenti, singoletti e tdTomato. Ecco, come esempio, la linea SPC2 (SPC2-ST-B2 clone20), che ha un reporter tdTomato mirato al locus SFTPC endogeno per facilitare la visualizzazione e il tracciamento del programma AT2 nel tempo in coltura (Figura 2A). L'espressione iAT2 SFTPC-tdTomato è stata mantenuta quando è stata riformulata nella matrice 3D come sfere (Figura 2B) e quando placcata su inserti di colture cellulari (Figura 2C). La resistenza elettrica transepiteliale (TEER) può essere misurata per determinare l'integrità della coltura ALI (Figura 2D). Per misurare TEER, è stato utilizzato un voltohmmetro (vedi Tabella dei materiali), con 100 μL di mezzo CK + DCI aggiunto alla camera apicale. Gli inserti di coltura cellulare rivestiti con Matrigel in assenza di cellule seminate sono stati trattati come spazi vuoti. Le letture sono state prese in tre punti in ogni pozzo.

Figura 1: Rappresentazione schematica del flusso di lavoro del protocollo. Fare clic qui per visualizzare una versione più grande di questa figura.
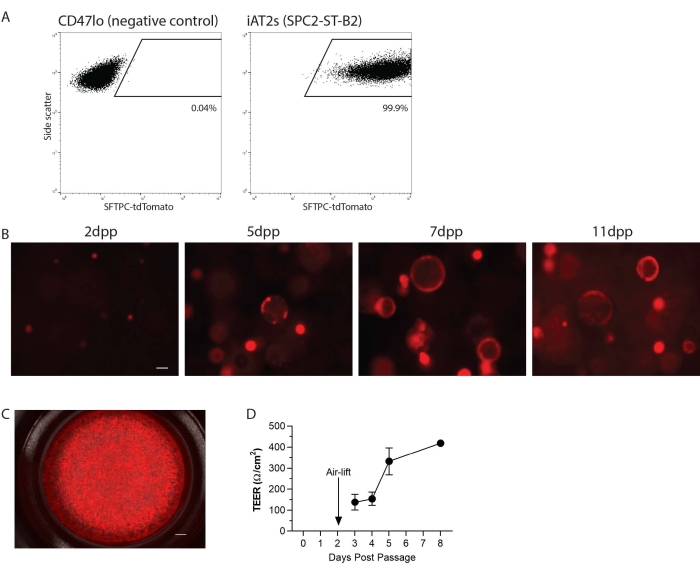
Figura 2: Risultati rappresentativi del protocollo. (A) Risultati rappresentativi della citometria a flusso per SFTPC-tdTomato in cellule staminali pluripotenti derivate da cellule staminali pluripotenti derivate dall'uomo di tipo 2 epiteliali (iAT2s) coltivate in 3D. Il controllo negativo mostrato è l'endoderma non polmonare (CD47lo). (B) Imaging rappresentativo di cellule vive di iAT2 coltivati in 3D in vari giorni dopo il passaggio (dpp) (SFTPC-tdTomato, barra di scala = 50 μm). (C) Imaging rappresentativo di cellule vive di iAT2 placcati all'interfaccia aria-liquido (SFTPC-tdTomato, barra di scala = 500 nm). (D) Resistenza elettrica transepiteliale rappresentativa di iAT2 placcati all'interfaccia aria-liquido. n = 3, le barre di errore indicano la deviazione standard. Fare clic qui per visualizzare una versione più grande di questa figura.
| Reagenti | Volume per 500 mL | Concentrazione finale |
| Iscove's Modified Dulbecco's Medium (IMDM) | 375 ml | 75% |
| Miscela di nutrienti F-12 di Ham (F12) | 125 ml | 25% |
| Supplemento B-27 (con RA) | 5 ml | 1% |
| Supplemento N-2 | 2,5 ml | 0.50% |
| BSA (7,5% azioni) | 3,3 ml | 0.05% |
| Primocin (50 mg/mL di brodo) | 1 ml | 100 μg/ml |
| Glutamax (100x stock) | 5 ml | 1x |
| Acido ascorbico (50 mg/mL di brodo) | 500 μL | 50 μg/mL |
| 1-tioglicerolo (MTG) (da 26 μL in 2 mL IMDM) | 1,5 ml | 4,5 x 10-4 M |
Tabella 1: Composizione del mezzo di differenziazione completo senza siero (cSFDM).
| Reagente | Concentrazione finale |
| CHIR99021 · | 3 μM |
| rhKGF | 10 ng/ml |
| Desametasone | 50 nM |
| 8-bromoadenosina 30,50-ciclico monofosfato sale sodico (cAMP) | 0,1 mM |
| 3-isobutil-1-metilxantina (IBMX) | 0,1 mM |
Tabella 2: Composizioni dei supporti CK + DCI.
Discussione
Gli AT2 mantengono l'omeostasi polmonare e la disfunzione di queste cellule alveolari chiave può sia causare che derivare da varie malattie polmonari. A causa della difficoltà di accedere e isolare gli AT2 umani primari, vengono generati iAT2. Applicando i metodi di differenziazione diretta descritti altrove25 e l'espansione e la semina cellulare qui descritte, le iPSC generate da qualsiasi individuo possono essere differenziate in iAT2 robustamente auto-rinnovanti, fornendo così cellule specifiche per il paziente per la ricerca biomedica, compresi studi di sviluppo della ricerca biomedica di base, modellazione delle malattie, terapie cellulari o screening farmacologici. Il presente protocollo descrive un metodo per dissociare iAT2s in una sospensione a singola cellula, che può quindi essere replicata in Matrigel 3D per generare alveolosfere per l'espansione cellulare o riplazionata in coltura ALI 2D per ulteriori esperimenti.
Il protocollo ha diversi passaggi critici per garantire il successo del passaging e del replating in entrambe le colture 3D e ALI. La triturazione meccanica deve essere ridotta al minimo, poiché un pipettaggio eccessivo può ridurre la vitalità cellulare. Inoltre, la densità di semina di iAT2 in entrambe le colture ALI 3D e 2D è fondamentale; per la coltura 3D, in generale, 400 cellule / μL di Matrigel 3D è ottimale per la maggior parte delle linee iPSC. Tuttavia, una gamma di densità da 100-500 celle / μL ha, a volte, avuto successo e l'ottimizzazione della densità può essere necessaria per diverse linee cellulari. Per la coltura ALI, l'ottimizzazione della densità di semina di iAT2 sugli inserti di coltura cellulare è anche essenziale per ottenere un monostrato confluente di cellule 48 ore dopo la semina (cioè il giorno del sollevamento aereo). Alcune linee iAT2 richiedono più celle per inserto; pertanto, se è necessaria la risoluzione dei problemi, si consiglia un intervallo da 160.000 a 300.000 celle/inserto per inserti di colture cellulari a 24 pozzetti. Le colture 3D possono anche essere scalate a piastre a 24 e 48 pozzetti mantenendo la densità di semina a 400 cellule / μL di matrice 3D e riducendo la dimensione delle goccioline della matrice a 25 μL e 20 μL, rispettivamente. Le colture ALI possono essere scalate a inserti di coltura cellulare a 96 pozzetti rivestendo ogni inserto con 30 μL di matrice, placcando 80.000 cellule in 30 μL per inserto e alimentando con 150 μL di mezzi basolaterali per pozzetto. La densità di semina e i volumi di matrice e supporti devono essere scalati e ottimizzati di conseguenza per altri formati di lastre.
Una limitazione di questo protocollo è che le cellule utilizzate per la placcatura ALI devono essere sufficientemente purificate per essere NKX2-1+ e SFTPC+19,20,21,23 per formare IAT2 ALI, e la formazione di colture ALI può variare da linea a linea. Inoltre, questo protocollo consente l'espansione e la generazione di colture solo AT2, fornendo un sistema di modelli riduzionisti basato su un singolo tipo di cellula alveolare chiave. È importante sottolineare che altri tipi di cellule alveolari rilevanti, come le cellule alveolari di tipo 1, mancavano da queste piattaforme. Altri gruppi hanno avuto successo nella coltivazione di AT2 umani primari come sferoidi o colture organotipiche con o senza fibroblasti 1,14,15,16,17; tuttavia, gli AT2 umani primari tendono a perdere la loro espressione di tensioattivi chiave quando coltivati in normali colture 2D senza condizioni ALI26. Inoltre, lavori recenti hanno dimostrato che gli iAT2 esprimono marcatori proliferativi più elevati e marcatori di maturazione AT2 più bassi rispetto agli AT2 primari umani freschi e non coltivati27. Nonostante queste differenze tra iAT2 e AT2 umani primari freschi, abbiamo scoperto che anche gli AT2 primari coltivati mostravano differenze trascrittomiche da AT2 primari freschi e non coltivati27, e quindi concludono che questi modelli in vitro hanno vari punti di forza e limitazioni per la modellazione della biologia polmonare in vivo.
La piattaforma iAT2 può essere applicata per studiare mutazioni genetiche da iPSC derivate dal paziente19,20. Il sistema potrebbe anche essere sostanzialmente scalato per ospitare lo screening dei farmaci ad alto rendimento. Inoltre, gli IA ALI iAT2 sono adatti per esposizioni ambientali come infezioni virali o batteriche o esposizione a fumo di sigaretta, vapore di sigaretta elettronica o altri aerosol23. In sintesi, questo protocollo per la generazione di colture ALI 3D e 2D di iAT2s consente la coltura a lungo termine di un tipo di cellula rilevante per la malattia e fornisce una piattaforma fisiologica e scalabile che consente l'utilizzo di queste cellule in molte applicazioni.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo sinceramente i membri dei laboratori Wilson, Kotton e Hawkins per le loro utili discussioni. Siamo anche molto grati a Greg Miller (CReM Laboratory Manager) e Marianne James (iPSC Core Manager) per il loro inestimabile supporto. Ringraziamo Brian Tilton e il BUMC Flow Cytometry Core per la loro assistenza tecnica con lo smistamento cellulare (supportata dalla sovvenzione NIH #1S10OD021587-01A1). Questo lavoro è stato supportato da una CJ Martin Early Career Fellowship dell'Australian National Health and Medical Research Council assegnata a RBW; NIH concede F30HL147426 a KMA; un I.M. Rosenzweig Junior Investigator Award dalla Pulmonary Fibrosis Foundation e un Integrated Pilot Grant Award attraverso il Boston University Clinical & Translational Science Institute (1UL1TR001430) a KDA; Fondo nazionale svizzero per la ricerca scientifica (P2ELP3_191217) all'ABA; NIH concede U01HL148692, U01HL134745, U01HL134766 e R01HL095993 a DNK; e le sovvenzioni NIH U01TR001810, R01DK101510 e R01DK117940 assegnate ad AAW; La manutenzione, l'attività bancaria e la condivisione di iPSC sono supportate dalla sovvenzione NIH NO1 75N92020C00005. La Figura 1 è stata creata utilizzando Biorender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| 3-Isobutyl-1-methylxanthine (IBMX) | Sigma | I5879 | For CKDCI |
| 12 Well Cell Culture Plate | Corning | 3513 | Plates for culturing |
| 1-Thioglycerol (MTG) | M6145 | Sigma | For CKDCI |
| 2D Matrigel (matrix) - Matrigel hESC-Qualified Matrix | Corning | 8774552 | To coat ALI Transwells |
| 3D Matrigel (matrix) - Growth Factor Reduced Matrigel | Corning | 356230 | To grow iAT2 spheres in |
| 8-bromoadenosine 30,50-cyclic monophosphate sodium salt (cAMP) | Sigma | B7880 | For CKDCI |
| Ascorbic Acid | A4544 | Sigma | For CKDCI |
| B27 w/out retinoic acid | Life Technologies | 12587-010 | For CKDCI |
| Bovine Serum Albumin (BSA) (7.5%) | Thermo Fisher | 15260037 | For CKDCI |
| Calcein blue | Life Technologies | C1429 | For live/dead discrimination in flow cytometry |
| Calcein green | Life Technologies | C1430 | Optional visualisation of cells on cell culture insert |
| Cell culture inserts - Costar 6.5 mm Clear Transwells with 0.4 µm pore size | Millipore-Sigma | CLS3470-48EA | ALI transwells |
| CHIR99021 | Tocris | 4423 | For CKDCI |
| Dexamethasone | Sigma | D4902 | For CKDCI |
| Dispase (2 mg/mL) | Thermo Fisher | 354235 | To dissolve matrigel |
| Dulbecco's Modified Eagle Medium (DMEM) | Thermo Fisher | 11995 | To make trypsin inactivation media (10% FBS in DMEM) |
| Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12 (DMEM/F12) | Thermo Fisher | A4192002 | To wash |
| Dulbecco's phosphate buffered saline (PBS) | Thermo Fisher | 14190 | For flow cytometric analyses |
| Fetal bovine serum (FBS) (Hyclone charaterized) | GE Healthcare Life Sciences | SH30071.03 | To make trypsin inactivation media (10% FBS in DMEM) |
| Glutamax | Life Technologies | 35050-061 | For CKDCI |
| Ham's F-12 Nutrient Mixture (F12) | Cellgro | 10-080-CV | For CKDCI |
| Hemocytometer | Fisher | 02-671-6 | For cell counting |
| Invivogen Primocin 1 G (50 mg/mL) | Fisher Scientific | NC9392943 | For CKDCI |
| Iscove's Modified Dulbecco's Medium (IMDM) | Thermo Fisher | 12440053 | For CKDCI |
| Millicell ERS-2 Voltohmeter | Millipore | MERS00002 | To measure trans-epithlial electrical resistance |
| N2 supplement | Life Technologies | 17502-048 | For CKDCI |
| Recombinant human KGF | R&D Systems | 251-KG-010 | For CKDCI |
| Retinoic acid | Sigma | R2625 | For CKDCI |
| Trypan blue | Thermo Fisher | 15250061 | For cell count during passaging |
| Trypsin-EDTA (0.05%) | Gibco | 25-300-062 | To dissociate iAT2 spheres |
| Y-27632 dihydrochloride | Tocris | 1254 | Add to cells after passaging |
Riferimenti
- Barkauskas, C. E., et al. Type 2 alveolar cells are stem cells in adult lung. Journal of Clinical Investigation. 123 (7), 3025-3036 (2013).
- Mason, R. J., Williams, M. C. Type II alveolar cell. Defender of the alveolus. American Review of Respiratory Disease. 115 (6), 81-91 (1977).
- Nogee, L. M., et al. A mutation in the surfactant protein C gene associated with familial interstitial lung disease. New England Journal of Medicine. 344 (8), 573-579 (2001).
- Nogee, L. M., et al. A mutation in the surfactant protein B gene responsible for fatal neonatal respiratory disease in multiple kindreds. Journal of Clinical Investigation. 93 (4), 1860-1863 (1994).
- Shulenin, S., et al. ABCA3 gene mutations in newborns with fatal surfactant deficiency. New England Journal of Medicine. 350 (13), 1296-1303 (2004).
- Nureki, S. I., et al. Expression of mutant Sftpc in murine alveolar epithelia drives spontaneous lung fibrosis. Journal of Clinical Investigation. 128 (9), 4008-4024 (2018).
- Katzen, J., et al. An SFTPC BRICHOS mutant links epithelial ER stress and spontaneous lung fibrosis. Journal of Clinical Investigation Insight. 4 (6), 126125 (2019).
- Mathis, C., et al. Human bronchial epithelial cells exposed in vitro to cigarette smoke at the air-liquid interface resemble bronchial epithelium from human smokers. American Journal of Physiology-Lung Cellular and Molecular Physiology. 304 (7), 489-503 (2013).
- Purkayastha, A., et al. Direct exposure to SARS-CoV-2 and cigarette Smoke increases infection severity and alters the stem cell-derived airway repair response. Cell Stem Cell. 27 (6), 869-875 (2020).
- Matrosovich, M. N., Matrosovich, T. Y., Gray, T., Roberts, N. A., Klenk, H. D. Human and avian influenza viruses target different cell types in cultures of human airway epithelium. Proceedings of the National Academy of Sciences. 101 (13), 4620-4624 (2004).
- Tollstadius, B. F., Silva, A. C. G. d., Pedralli, B. C. O., Valadares, M. C. Carbendazim induces death in alveolar epithelial cells: A comparison between submerged and at the air-liquid interface cell culture. Toxicology in Vitro. 58, 78-85 (2019).
- Winton, H. L., et al. Cell lines of pulmonary and non-pulmonary origin as tools to study the effects of house dust mite proteinases on the regulation of epithelial permeability. Clinical and Experimental Allergy. 28 (10), 1273-1285 (1998).
- Kanagaki, S., et al. Hydroxypropyl cyclodextrin improves amiodarone-induced aberrant lipid homeostasis of alveolar cells. American Journal of Respiratory Cell and Molecular Biology. 64 (4), 504-514 (2021).
- Sucre, J. M. S., et al. Successful establishment of primary type 2 alveolar epithelium with 3D organotypic co-culture. American Journal of Respiratory Cell and Molecular Biology. 59 (2), 158-166 (2018).
- Kobayashi, Y., et al. Persistence of a regeneration-associated, transitional alveolar epithelial cell state in pulmonary fibrosis. Nature Cell Biology. 22, 934-946 (2020).
- Choi, J., et al. Inflammatory signals induce AT2 cell-derived damage-associated transient progenitors that mediate alveolar regeneration. Cell Stem Cell. 27 (3), 366-382 (2020).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Katsura, H., et al. Human lung stem cell-based alveolospheres provide insights into SARS-CoV-2-mediated interferon responses and pneumocyte dysfunction. Cell Stem Cell. 27 (6), 890-904 (2020).
- Jacob, A., et al. Differentiation of human pluripotent stem cells into functional lung alveolar epithelial cells. Cell Stem Cell. 21 (4), 472-488 (2017).
- Alysandratos, K. -. D., et al. Patient-specific iPSCs carrying an SFTPC mutation reveal the intrinsic alveolar epithelial dysfunction at the inception of interstitial lung disease. Cell Reports. 36 (9), 109636 (2021).
- Hurley, K., et al. Reconstructed single-cell fate trajectories define lineage plasticity windows during differentiation of human PSC-derived distal lung progenitors. Cell Stem Cell. 26 (4), 593-608 (2020).
- Sun, Y. L., et al. Heterogeneity in human iPSC-derived alveolar epithelial type II cells revealed with ABCA3/SFTPC reporters. American Journal of Respiratory Cell and Molecular Biology. 65 (4), 442-460 (2021).
- Abo, K. M., et al. Human pluripotent stem cell-derived alveolar type 2 cells mature and respond to environmental exposures in air-liquid interface culture. Journal of Clinical Investigation Insight. 7 (6), (2022).
- Huang, J., et al. SARS-CoV-2 infection of pluripotent stem cell-derived human lung alveolar type 2 cells elicits a rapid epithelial-intrinsic inflammatory response. Cell Stem Cell. 27 (6), 962-973 (2020).
- Jacob, A., et al. Derivation of self-renewing lung alveolar epithelial type II cells from human pluripotent stem cells. Nature Protocols. 14 (12), 3303-3332 (2019).
- Beers, M. F., Moodley, Y. When is an alveolar type 2 cell an alveolar type 2 cell? A conundrum for lung stem cell biology and regenerative medicine. American Journal of Respiratory Cell and Molecular Biology. 57 (1), 18-27 (2017).
- Alysandratos, K. D., et al. Impact of cell culture on the transcriptomic programs of primary and iPSC-derived human alveolar type 2 cells. bioRxiv. , (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon