Method Article
Génération de sphères 3D et de cultures d’interface air-liquide 2D de cellules épithéliales pluripotentes de type 2 dérivées de cellules souches pluripotentes induites par l’homme
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le présent protocole décrit les cellules alvéolaires de type 2 dérivées de cellules souches pluripotentes de type 2 induites par l’homme (iAT2s). Ces cellules peuvent être cultivées en tant que sphères auto-renouvelées en culture 3D ou adaptées à la culture d’interface air-liquide (ALI).
Résumé
Dans les poumons, l’épithélium alvéolaire est une barrière physique contre les stimuli environnementaux et joue un rôle essentiel dans l’homéostasie et la maladie. Les cellules épithéliales alvéolaires de type 2 (AT2s) sont les progéniteurs facultatifs de l’épithélium pulmonaire distal. Le dysfonctionnement et les blessures des AT2 peuvent résulter de diverses maladies pulmonaires et y contribuer. Une meilleure compréhension de la biologie de l’AT2 est donc essentielle pour comprendre la biologie pulmonaire et la maladie; cependant, les AT2 humains primaires sont généralement difficiles à isoler et leur offre est limitée. Pour surmonter ces limites, les cellules épithéliales alvéolaires de type 2 dérivées de cellules souches pluripotentes induites par l’homme (iPSC) peuvent être générées par un protocole de différenciation dirigée qui récapitule le développement pulmonaire in vivo . Les iAT2 se développent dans des conditions sans mangeoire, partagent un programme transcriptomique avec des AT2 primaires adultes humains et exécutent des fonctions clés des AT2 telles que la production, l’emballage et la sécrétion de tensioactif. Ce protocole détaille les méthodes de maintien des iAT2 auto-renouvelés par le biais d’un passage en série en culture tridimensionnelle (3D) ou d’adaptation des iAT2 à la culture d’interface air-liquide (ALI). Une suspension unicellulaire d’iAT2 est générée avant le placage dans une matrice de membrane basale solubilisée 3D (ci-après dénommée « matrice »), où ils s’auto-assemblent en sphères épithéliales monocouches. Les iAT2 en culture 3D peuvent être dissociés en série en suspensions unicellulaires pour être passés ou plaqués en culture ALI 2D. Dans la culture ALI, les iAT2 forment une monocouche polarisée avec la surface apicale exposée à l’air, ce qui rend cette plate-forme facilement adaptable aux expositions environnementales. Par conséquent, ce protocole génère un apport inépuisable d’iAT2, produisant plus de 1 x 1030 cellules par cellule d’entrée sur 15 passages tout en maintenant le programme AT2 indiqué par l’expression SFTPCtdTomato . Les cellules résultantes représentent une plate-forme reproductible et pertinente qui peut être appliquée pour étudier les mutations génétiques, modéliser les expositions environnementales ou dépister les médicaments.
Introduction
Dans les poumons, les voies respiratoires et les cellules épithéliales alvéolaires sont les premières à rencontrer des expositions environnementales inhalées, y compris des agents pathogènes transmis par des aérosols inhalés et des stimuli nocifs tels que la fumée de cigarette. Les cellules épithéliales alvéolaires de type 2 (AT2) sont essentielles au maintien de l’homéostasie pulmonaire car elles sont les progéniteurs facultatifs de l’épithélium pulmonaire distal, produisent des tensioactifs pour soulager la tension superficielle alvéolaire et augmentent la réponse immunitaire innée aux expositions inhalées 1,2. Cependant, le dysfonctionnement de l’AT2 peut résulter de lésions pulmonaires ou de mutations dans des gènes exprimés sélectivement dans les AT2, tels que SFTPC, SFTPB et ABCA3 3,4,5. Les approches précédentes pour étudier ces mutations génétiques reposaient sur des modèlesmurins 6 ou des vecteurs artificiels contenant des mutations introduits dans des lignées cellulaires immortalisées7. Par conséquent, des plates-formes capables de modéliser les effets des perturbations génétiques et environnementales sur les AT2 dans les types de cellules physiologiquement pertinents et dans un système in vitro productif sont nécessaires pour mieux comprendre le rôle que jouent les AT2 dans la santé et la maladie.
En termes de modélisation des expositions en suspension dans l’air, des cultures d’interface air-liquide (ALI) de cellules épithéliales primaires des voies respiratoires ont été utilisées avec succès pour révéler des réponses moléculaires clés à la fumée de cigarette8 et pour modéliser l’infection des voies respiratoires 9,10. Un système de culture ALI comparable pour l’épithélium alvéolaire, un site clé d’infection ou de blessure dans la maladie, est beaucoup moins développé que le système modèle épithélial des voies respiratoires. Des lignées cellulaires immortalisées ont été cultivées à ALI comme proxy pour l’épithélium alvéolaire11,12, mais ces lignées cellulaires sont transcriptomiquement distinctes des cellules épithéliales alvéolaires primaires13 et manquent de mécanismes cellulaires clés, tels que la capacité de sécréter des tensioactifs ou de former des jonctions serrées à ALI12. Les AT2 humains primaires peuvent être cultivés dans des sphères 3D en présence de fibroblastes1,14, mais sont soumis à des limitations, notamment l’accessibilité limitée des poumons explants et leur tendance à sénescer ou à perdre le phénotype cellulaire dans la plupart des cultures à ce jour. Ces caractéristiques présentent des obstacles à l’adoption généralisée des études primaires sur l’AT2 in vitro, bien que des progrès récents aient été réalisés dans l’optimisation des cultures 3D sans mangeoire pour l’expansion des AT2 primaires 15,16,17,18.
Des protocoles de différenciation dirigée ont été développés pour récapituler les étapes du développement in vivo afin de générer des cellules souches pluripotentes induites par l’homme (iPSC) dérivées de cellules épithéliales de type 2 (iAT2s)19. Les iAT2 se développent sous forme de sphères auto-renouvelées en culture 3D sans sérum dans un milieu défini contenant CHIR99021, KGF, dexaméthasone, AMPc et 3-isobutyl-1-méthylxanthine (IBMX), appelé « CK + DCI"19, en l’absence de mangeoires de fibroblastes et peuvent être cultivés pour les passages >2020,21. De plus, les iAT2 partagent un programme transcriptomique avec des AT2 primaires adultes humains, forment des corps lamellaires et produisent et emballent le tensioactif 19,21,22. Ce protocole détaille le passage en série des iAT2 en dissociant les cellules en une suspension monocellulaire. À ce stade, les iAT2 peuvent être replaqués et étendus en culture 3D ou plaqués en culture ALI2D 23. Ces méthodes peuvent être utilisées pour étudier la biologie intrinsèque des AT2 dans l’homéostasie et la maladie20,22 et pour interroger les effets de composés ou de stimuli dans une plate-forme évolutive et physiologiquement pertinente23,24, comme cela a déjà été montré.
Protocole
Toutes les expériences impliquant la différenciation de lignées iPSC humaines ont été réalisées conformément à l’Institutional Review Board de l’Université de Boston (protocole H33122). Les fibroblastes dermiques, achetés pour être reprogrammés en CSPi, ont été obtenus auprès d’un donneur avec le consentement éclairé écrit, sous l’approbation du Bureau de protection de la recherche humaine de la Washington University School of Medicine, St. Louis, MO. Des IPSC reprogrammés ont été générés au Center for Regenerative Medicine de l’Université de Boston et au Boston Medical Center, Boston, MA.
1. Dissociation de l’alvéolosphère
- Préparer un milieu de différenciation complet sans sérum (CSFDM) selon la composition mentionnée dans le tableau 1.
- Préparer les supports CK + DCI dans la base cSFDM préparée conformément au tableau 2.
- Décongeler la matrice 2D (qualifiée de cellules souches embryonnaires humaines) et/ou 3D (facteur de croissance réduit) sur la glace selon les besoins expérimentaux.
- Aspirer tout le milieu CK + DCI à l’aide d’une pipette ou d’une pipette aspirante avec vide à partir des gouttelettes de matrice 3D contenant des alvéolosphères, dérivées de la différenciation dirigée19, dans une plaque à 12 puits.
- Ajouter 1 mL de dispase (2 mg/mL) par gouttelette. Pipettez doucement la gouttelette dans la dispase à l’aide d’une pipette P1000. Incuber à 37 °C pendant 1 h, en pipetant de haut en bas une fois après 30 min.
- Transférer les organoïdes dissociés (à partir de l’étape 1.5) d’une gouttelette de matrice dans la dispase dans un tube conique de 15 mL. Pour laver, ajoutez 10 mL de milieu de Dulbecco modifié d’Iscove (IMDM, voir Tableau des matériaux).
- Centrifuger à 300 x g pendant 5 min à température ambiante. Aspirer le surnageant à l’aide d’une pipette ou d’une pipette aspirante sous vide, en laissant le moins de surnageant possible.
REMARQUE: Il est important d’enlever toute dispase car toute dispase restante peut dissoudre la matrice dans laquelle les cellules seront ensuite ensemencées. Si une brume claire est observée au-dessus de la pastille, la dispase n’a pas complètement dissous la matrice, et plus de dispase peut être ajoutée à la pastille pendant encore 20-30 min à 37 ° C. - Remettre les cellules en suspension dans 1 mL de trypsine à 0,05 % par gouttelette et les transférer à nouveau dans la plaque de 12 puits. Incuber à 37 °C pendant 12-15 min. Observez la dissociation au microscope. Évitez de trop pipeter les cellules à ce stade.
REMARQUE: À la fin de l’incubation, les cellules doivent obtenir une suspension à cellule unique après avoir pipeté 3 à 5 fois avec une pipette P1000. Pour le passage des iAT2 à ALI (étape 3), le temps de trypsinisation doit être minimisé (maximum 12 min), de sorte que les cellules soient en amas de 2 à 3 cellules plutôt qu’en suspension unicellulaire lorsqu’elles sont prêtes à être plaquées sur l’insert de culture cellulaire. - Arrêtez l’action de la trypsine avec un volume égal de milieu contenant du FBS (10% de FBS qualifié ES dans DMEM). Centrifuger à 300 x g pendant 5 min à température ambiante.
- Lavez les cellules avec 10 mL d’IMDM. Centrifuger à 300 x g pendant 5 min à température ambiante.
- Remettez en suspension les cellules dans un volume approprié pour le comptage, puis comptez les cellules à l’aide d’un hémocytomètre (voir Tableau des matériaux).
REMARQUE: À partir d’une gouttelette de matrice confluente de 50 μL ensemencée à 400 cellules / μL, le rendement attendu est de 500 000 à 1,5 x 106 cellules par gouttelette. - Utilisez la suspension unicellulaire des cellules iAT2 pour générer des alvéolosphères par placage dans la matrice 3D (étape 2) et/ou placage sur des inserts de culture cellulaire pour la culture ALI (étape 3).
2.3D placage d’iAT2s
- Après comptage (étape 1.11), déterminer le nombre de cellules souhaitées à replaquer dans la matrice 3D (400 cellules/μL de la matrice avec 50-100 μL de gouttelettes de matrice 3D par puits d’une plaque de 12 puits). Centrifuger les cellules à 300 x g pendant 5 min à température ambiante. Retirez autant de surnageant que possible à l’aide d’une pipette.
- Remettez en suspension les cellules de la matrice 3D. Remettez en suspension rapidement et sur de la glace, si nécessaire, pour empêcher la matrice de polymériser (ce qui se produit à chaud).
- Utilisez une pipette P200 pour distribuer une gouttelette de matrice 3D par puits dans une plaque préchauffée de 12 puits. Pipettez soigneusement pour éviter de créer des bulles dans la gouttelette de matrice. Ne laissez pas la suspension cellulaire se déposer pendant la distribution de plusieurs gouttelettes.
- Placez la plaque dans un incubateur à 37 °C pendant 20 à 30 min pour permettre aux gouttelettes de la matrice de polymériser.
- Ajouter 1 mL de CK + DCI + 10 μM de milieu Y-27632 (voir tableau des matériaux) par puits pour couvrir la gouttelette matricielle.
- Après 72 h, changer le milieu en CK + DCI sans 10 μM de Y-27632.
- Remplacez le milieu par du CK + DCI frais toutes les 48-72 h.
REMARQUE: Les iAT2 devront généralement être passés environ tous les 10 à 14 jours, en fonction de la lignée cellulaire et de la densité de placage.
3. Transmission des iAT2 à ALI
- Préparer des inserts de culture cellulaire de 6,5 mm fraîchement enduits 1 h avant utilisation en diluant la matrice 2D dans le mélange modifié Eagle Medium/Nutrient Mixture F-12 (DMEM/F12) de Dulbecco pour la solution de travail conformément aux instructions du fabricant pour la matrice 2D (voir tableau des matériaux). Ensuite, ajoutez 100 μL de matrice diluée par insert de culture cellulaire de 6,5 mm. Laisser la matrice polymériser dans un incubateur à 37 °C pendant 30 min ou à température ambiante pendant 1 h.
- Aspirer l’excès de matrice des inserts de culture cellulaire à l’aide d’une pipette ou d’une pipette d’aspiration sous vide et rincer une fois avec du DMEM/F12. Aspirer ce lavage immédiatement avant d’ajouter les cellules.
- Après comptage, déterminer le nombre de cellules nécessaires pour ensemencer le nombre souhaité de cellules dans les inserts de culture (520 000 cellules vivantes/cm2, soit l’équivalent de 172 000 cellules vivantes par insert de culture cellulaire de 6,5 mm). Centrifuger les cellules à 300 x g pendant 5 min à température ambiante. Enlevez autant de surnageant que possible.
- Remettre les cellules dans le volume approprié pour les ensemencer avec 100 μL de CK + DCI + 10 μM Y-27632 par insert de culture cellulaire (la suspension cellulaire doit être de 1 720 cellules / μL ). Ajouter 100 μL au compartiment apical de l’insert de culture cellulaire. Agitez doucement la plaque dans un motif croisé pour assurer une distribution uniforme des cellules à travers l’insert de culture cellulaire, et confirmez cela en vérifiant au microscope à l’objectif 4x.
REMARQUE: La densité d’ensemencement est critique et peut nécessiter une optimisation, allant de 160 000 à 300 000 cellules par insert de culture cellulaire de 6,5 mm. Le colorant perméable aux cellules vert calcéine (voir Tableau des matériaux) peut être ajouté aux cellules et visualisé sur un microscope fluorescent inversé pour visualiser les cellules après l’ensemencement. - Ajouter 500 μL de CK + DCI + 10 μM de Y-27632 dans le compartiment basolatéral de chaque insert de culture cellulaire.
- Aspirer l’apical CK + DCI + 10 μM de milieu Y-27632 48 h après l’ensemencement à l’aide d’une pipette pour initier l’ALI (connu sous le nom de « transport par air »).
REMARQUE: Les cellules doivent être 100% confluentes à ce stade. Si les cellules ne sont pas confluentes à 100%, les étapes 3.7 à 3.8 doivent toujours être effectuées aux points temporels indiqués; les monocouches de cellules confluentes peuvent prendre plus de temps à se former. - Changer le milieu basolatéral CK + DCI + 10 μM du milieu Y-27632 après 72 h en CK + DCI sans 10 μM Y-27632.
REMARQUE: Il devrait y avoir un minimum, voire aucun, « fuite » de milieu du côté apical. Cependant, si cela se produit dans les premiers jours, continuez à aspirer le côté apical tous les jours jusqu’à ce qu’il n’y ait plus de fuite. - Remplacez le milieu basolatéral par du CK + DCI frais toutes les 48-72 h.
REMARQUE: Les iAT2 utilisés dans les cultures ALI sont matures au maximum 5 à 14 jours après le placage. - Maintenez les cellules avec une surveillance attentive jusqu’à 28 jours après le placage, si nécessaire, pour une expérimentation plus prolongée.
REMARQUE: Des signes visibles de défaillance de l’ALI, tels que le pelage des cellules loin du bord de l’insert ou la formation de trous dans la monocouche, peuvent être observés après un temps de culture prolongé, auquel cas l’ALI n’est plus utilisable pour les expériences.
Résultats
Les iAT2 ont été passés dans une suspension monocellulaire, puis replaqués dans une matrice 3D ou en 2D sur des inserts de culture cellulaire pour la culture ALI (Figure 1). Après dissociation unicellulaire, les iAT2 ont été analysés par cytométrie en flux. Brièvement, les cellules remises en suspension dans 1% de sérum fœtal bovin (FBS) dans une solution saline tamponnée au phosphate (PBS) avec un colorant de viabilité bleu de calcéine (1:1000) ont été analysées sur un cytomètre en flux, à la recherche de non-fragments, de singlets et de tdTomato. Voici, à titre d’exemple, la ligne SPC2 (clone SPC2-ST-B220), qui a un rapporteur tdTomato ciblé sur le locus endogène SFTPC pour faciliter la visualisation et le suivi du programme AT2 au fil du temps en culture (Figure 2A). L’expression iAT2 SFTPC-tdTomato a été maintenue lorsqu’elle a été replaquée dans la matrice 3D sous forme de sphères (Figure 2B) et lorsqu’elle a été plaquée sur des inserts de culture cellulaire (Figure 2C). La résistance électrique trans-épithéliale (TEER) peut être mesurée pour déterminer l’intégrité de la culture ALI (Figure 2D). Pour mesurer TEER, un voltohmmètre a été utilisé (voir Tableau des matériaux), avec 100 μL de milieu CK + DCI ajouté à la chambre apicale. Les inserts de culture cellulaire recouverts de Matrigel en l’absence de cellules ensemencées ont été traités comme des blancs. Des lectures ont été prises à trois endroits dans chaque puits.

Figure 1 : Représentation schématique du flux de travail du protocole. Cliquez ici pour afficher une version agrandie de cette figure.
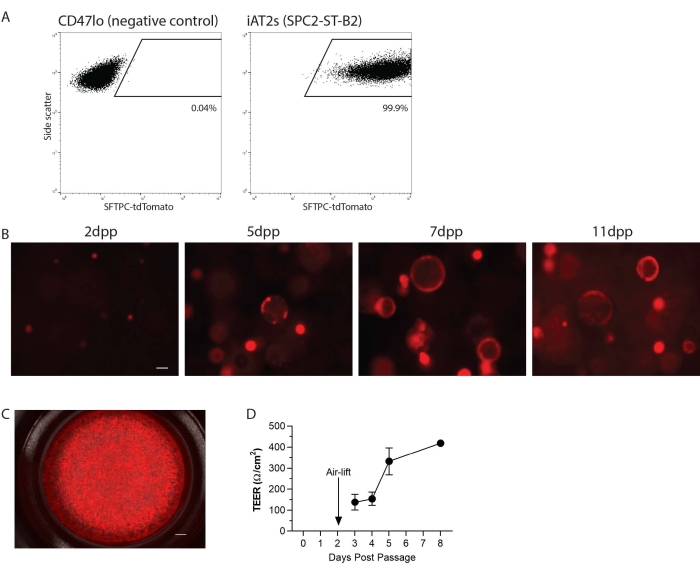
Figure 2 : Résultats représentatifs du protocole. (A) Résultats représentatifs de cytométrie en flux pour SFTPC-tdTomato dans les cellules alvéolaires de type 2 dérivées de cellules souches pluripotentes de type 2 (iAT2s) induites par l’homme cultivées en 3D. Le témoin négatif montré est l’endoderme non pulmonaire (CD47lo). (B) Imagerie représentative sur cellules vivantes d’iAT2 cultivés en 3D à différents jours après le passage (dpp) (SFTPC-tdTomato, barre d’échelle = 50 μm). (C) Imagerie représentative sur cellules vivantes d’iAT2 plaqués à l’interface air-liquide (SFTPC-tdTomato, barre d’échelle = 500 nm). (D) Résistance électrique transépithéliale représentative des iAT2 plaqués à l’interface air-liquide. n = 3, les barres d’erreur indiquent l’écart-type. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Réactifs | Volume pour 500 mL | Concentration finale |
| Support de Dulbecco modifié d’Iscove (IMDM) | 375 mL | 75% |
| Mélange nutritif F-12 de jambon (F12) | 125 mL | 25% |
| Supplément B-27 (avec PR) | 5 mL | 1% |
| Supplément N-2 | 2,5 mL | 0.50% |
| BSA (7,5 % des actions) | 3,3 mL | 0.05% |
| Primocine (stock de 50 mg/mL) | 1 mL | 100 μg/mL |
| Glutamax (100x stock) | 5 mL | 1x |
| Acide ascorbique (stock de 50 mg/mL) | 500 μL | 50 μg/mL |
| 1-thioglycérol (MTG) (à partir de 26 μL dans 2 mL IMDM) | 1,5 mL | 4,5 x 10-4 M |
Tableau 1 : Composition du milieu de différenciation complet sans sérum (CSFDM).
| Réactif | Concentration finale |
| CHIR99021 | 3 μM |
| rhKGF | 10 ng/mL |
| Dexaméthasone | 50 nM |
| 8-bromoadénosine 30,50-monophosphate cyclique sel de sodium (AMPc) | 0,1 mM |
| 3-isobutyl-1-méthylxanthine (IBMX) | 0,1 mM |
Tableau 2 : Compositions des milieux CK + DCI.
Discussion
Les AT2 maintiennent l’homéostasie pulmonaire, et le dysfonctionnement de ces cellules alvéolaires clés peut à la fois causer et résulter de diverses maladies pulmonaires. En raison de la difficulté d’accéder et d’isoler les AT2 humains primaires, des iAT2 sont générés. En appliquant les méthodes de différenciation dirigée décrites ailleurs25 et l’expansion et l’ensemencement cellulaire décrits ici, les CSPi générées par n’importe quel individu peuvent être différenciées en iAT2 robustes et auto-renouvelées, fournissant ainsi des cellules spécifiques au patient pour la recherche biomédicale, y compris les études de développement de la recherche biomédicale fondamentale, la modélisation des maladies, les thérapies cellulaires ou les dépistages de médicaments. Le présent protocole détaille une méthode de dissociation des iAT2 en une suspension monocellulaire, qui peut ensuite être replaquée dans 3D Matrigel pour générer des alvéolosphères pour l’expansion cellulaire ou replaquée en culture ALI 2D pour d’autres expériences.
Le protocole comporte plusieurs étapes critiques pour assurer le succès du passage et du replaquage dans les cultures 3D et ALI. La trituration mécanique doit être minimisée, car un pipetage excessif peut diminuer la viabilité des cellules. En outre, la densité d’ensemencement des iAT2 dans les cultures ALI 3D et 2D est essentielle; pour la culture 3D, en général, 400 cellules/μL de Matrigel 3D sont optimales pour la plupart des lignées iPSC. Cependant, une gamme de densités allant de 100 à 500 cellules / μL a parfois été couronnée de succès, et l’optimisation de la densité peut être nécessaire pour différentes lignées cellulaires. Pour la culture ALI, l’optimisation de la densité d’ensemencement des iAT2 sur les inserts de culture cellulaire est également essentielle pour obtenir une monocouche confluente de cellules 48 h après l’ensemencement (c’est-à-dire le jour du transport aérien). Certaines lignes iAT2 nécessitent plus de cellules par insertion ; ainsi, si un dépannage est nécessaire, une plage de 160 000 à 300 000 cellules/insert pour les inserts de culture cellulaire à 24 puits est recommandée. Les cultures 3D peuvent également être mises à l’échelle sur des plaques de 24 et 48 puits en maintenant la densité d’ensemencement à 400 cellules/μL de matrice 3D et en réduisant la taille des gouttelettes de la matrice à 25 μL et 20 μL, respectivement. Les cultures ALI peuvent être mises à l’échelle à des inserts de culture cellulaire à 96 puits en recouvrant chaque insert de 30 μL de matrice, en placant 80 000 cellules dans 30 μL par insert et en alimentant avec 150 μL de milieu basolatéral par puits. La densité d’ensemencement et les volumes de matrice et de support doivent être mis à l’échelle et optimisés en conséquence pour d’autres formats de plaques.
Une limitation de ce protocole est que les cellules utilisées pour le placage ALI doivent être suffisamment purifiées pour être NKX2-1+ et SFTPC+19,20,21,23 pour former des AILE iAT2, et la formation de la culture ALI peut varier d’une lignée à l’autre. En outre, ce protocole permet l’expansion et la génération de cultures AT2 uniquement, fournissant un système de modèle réductionniste basé sur un seul type de cellule alvéolaire clé. Il est important de noter que d’autres types de cellules alvéolaires pertinentes, telles que les cellules alvéolaires de type 1, étaient absents de ces plates-formes. D’autres groupes ont réussi à cultiver des AT2 humains primaires sous forme de sphéroïdes ou de cultures organotypiques avec ou sans fibroblastes 1,14,15,16,17; cependant, les AT2 humains primaires ont tendance à perdre l’expression de tensioactifs clés lorsqu’ils sont cultivés en culture 2D normale sans conditions ALI26. En outre, des travaux récents ont montré que les iAT2 expriment des marqueurs prolifératifs plus élevés et des marqueurs de maturation AT2 inférieurs à ceux des AT2 primaires humains frais et non cultivés27. Malgré ces différences entre les iAT2 et les AT2 humains primaires frais, nous avons constaté que même les AT2 primaires cultivés présentaient des différences transcriptomiques par rapport aux AT2 primaires27 frais et non cultivés, et nous concluons donc que ces modèles in vitro ont diverses forces et limites pour la modélisation de la biologie pulmonaire in vivo.
La plate-forme iAT2 peut être appliquée pour étudier les mutations génétiques des CSPi dérivées du patient19,20. Le système pourrait également être considérablement mis à l’échelle pour permettre le dépistage de drogues à haut débit. En outre, les ALE iAT2 conviennent aux expositions environnementales telles que les infections virales ou bactériennes ou l’exposition à la fumée de cigarette, à la vapeur de cigarette électronique ou à d’autres aérosols23. En résumé, ce protocole de génération de cultures ALI 3D et 2D d’iAT2 permet la culture à long terme d’un type cellulaire pertinent pour la maladie et fournit une plate-forme physiologique et évolutive qui permet l’utilisation de ces cellules dans de nombreuses applications.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions sincèrement les membres des laboratoires Wilson, Kotton et Hawkins pour leurs discussions utiles. Nous sommes également très reconnaissants à Greg Miller (CReM Laboratory Manager) et Marianne James (iPSC Core Manager) pour leur soutien inestimable. Nous remercions Brian Tilton et le BUMC Flow Cytometry Core pour leur assistance technique avec le tri cellulaire (soutenue par la subvention des NIH #1S10OD021587-01A1). Ce travail a été soutenu par une bourse CJ Martin Early Career Fellowship de l’Australian National Health and Medical Research Council décernée à RBW; Subvention des NIH F30HL147426 à KMA; une bourse I.M. Rosenzweig Junior Investigator de la Pulmonary Fibrosis Foundation et une bourse de subvention pilote intégrée du Boston University Clinical & Translational Science Institute (1UL1TR001430) à KDA; Fonds national suisse (P2ELP3_191217) à l’ABA; Les NIH accordent U01HL148692, U01HL134745, U01HL134766 et R01HL095993 à DNK; et les subventions des NIH U01TR001810, R01DK101510 et R01DK117940 attribuées à AAW; La maintenance, les opérations bancaires et le partage iPSC sont pris en charge par la subvention NIH NO1 75N92020C00005. La figure 1 a été créée à l’aide de Biorender.com.
matériels
| Name | Company | Catalog Number | Comments |
| 3-Isobutyl-1-methylxanthine (IBMX) | Sigma | I5879 | For CKDCI |
| 12 Well Cell Culture Plate | Corning | 3513 | Plates for culturing |
| 1-Thioglycerol (MTG) | M6145 | Sigma | For CKDCI |
| 2D Matrigel (matrix) - Matrigel hESC-Qualified Matrix | Corning | 8774552 | To coat ALI Transwells |
| 3D Matrigel (matrix) - Growth Factor Reduced Matrigel | Corning | 356230 | To grow iAT2 spheres in |
| 8-bromoadenosine 30,50-cyclic monophosphate sodium salt (cAMP) | Sigma | B7880 | For CKDCI |
| Ascorbic Acid | A4544 | Sigma | For CKDCI |
| B27 w/out retinoic acid | Life Technologies | 12587-010 | For CKDCI |
| Bovine Serum Albumin (BSA) (7.5%) | Thermo Fisher | 15260037 | For CKDCI |
| Calcein blue | Life Technologies | C1429 | For live/dead discrimination in flow cytometry |
| Calcein green | Life Technologies | C1430 | Optional visualisation of cells on cell culture insert |
| Cell culture inserts - Costar 6.5 mm Clear Transwells with 0.4 µm pore size | Millipore-Sigma | CLS3470-48EA | ALI transwells |
| CHIR99021 | Tocris | 4423 | For CKDCI |
| Dexamethasone | Sigma | D4902 | For CKDCI |
| Dispase (2 mg/mL) | Thermo Fisher | 354235 | To dissolve matrigel |
| Dulbecco's Modified Eagle Medium (DMEM) | Thermo Fisher | 11995 | To make trypsin inactivation media (10% FBS in DMEM) |
| Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12 (DMEM/F12) | Thermo Fisher | A4192002 | To wash |
| Dulbecco's phosphate buffered saline (PBS) | Thermo Fisher | 14190 | For flow cytometric analyses |
| Fetal bovine serum (FBS) (Hyclone charaterized) | GE Healthcare Life Sciences | SH30071.03 | To make trypsin inactivation media (10% FBS in DMEM) |
| Glutamax | Life Technologies | 35050-061 | For CKDCI |
| Ham's F-12 Nutrient Mixture (F12) | Cellgro | 10-080-CV | For CKDCI |
| Hemocytometer | Fisher | 02-671-6 | For cell counting |
| Invivogen Primocin 1 G (50 mg/mL) | Fisher Scientific | NC9392943 | For CKDCI |
| Iscove's Modified Dulbecco's Medium (IMDM) | Thermo Fisher | 12440053 | For CKDCI |
| Millicell ERS-2 Voltohmeter | Millipore | MERS00002 | To measure trans-epithlial electrical resistance |
| N2 supplement | Life Technologies | 17502-048 | For CKDCI |
| Recombinant human KGF | R&D Systems | 251-KG-010 | For CKDCI |
| Retinoic acid | Sigma | R2625 | For CKDCI |
| Trypan blue | Thermo Fisher | 15250061 | For cell count during passaging |
| Trypsin-EDTA (0.05%) | Gibco | 25-300-062 | To dissociate iAT2 spheres |
| Y-27632 dihydrochloride | Tocris | 1254 | Add to cells after passaging |
Références
- Barkauskas, C. E., et al. Type 2 alveolar cells are stem cells in adult lung. Journal of Clinical Investigation. 123 (7), 3025-3036 (2013).
- Mason, R. J., Williams, M. C. Type II alveolar cell. Defender of the alveolus. American Review of Respiratory Disease. 115 (6), 81-91 (1977).
- Nogee, L. M., et al. A mutation in the surfactant protein C gene associated with familial interstitial lung disease. New England Journal of Medicine. 344 (8), 573-579 (2001).
- Nogee, L. M., et al. A mutation in the surfactant protein B gene responsible for fatal neonatal respiratory disease in multiple kindreds. Journal of Clinical Investigation. 93 (4), 1860-1863 (1994).
- Shulenin, S., et al. ABCA3 gene mutations in newborns with fatal surfactant deficiency. New England Journal of Medicine. 350 (13), 1296-1303 (2004).
- Nureki, S. I., et al. Expression of mutant Sftpc in murine alveolar epithelia drives spontaneous lung fibrosis. Journal of Clinical Investigation. 128 (9), 4008-4024 (2018).
- Katzen, J., et al. An SFTPC BRICHOS mutant links epithelial ER stress and spontaneous lung fibrosis. Journal of Clinical Investigation Insight. 4 (6), 126125 (2019).
- Mathis, C., et al. Human bronchial epithelial cells exposed in vitro to cigarette smoke at the air-liquid interface resemble bronchial epithelium from human smokers. American Journal of Physiology-Lung Cellular and Molecular Physiology. 304 (7), 489-503 (2013).
- Purkayastha, A., et al. Direct exposure to SARS-CoV-2 and cigarette Smoke increases infection severity and alters the stem cell-derived airway repair response. Cell Stem Cell. 27 (6), 869-875 (2020).
- Matrosovich, M. N., Matrosovich, T. Y., Gray, T., Roberts, N. A., Klenk, H. D. Human and avian influenza viruses target different cell types in cultures of human airway epithelium. Proceedings of the National Academy of Sciences. 101 (13), 4620-4624 (2004).
- Tollstadius, B. F., Silva, A. C. G. d., Pedralli, B. C. O., Valadares, M. C. Carbendazim induces death in alveolar epithelial cells: A comparison between submerged and at the air-liquid interface cell culture. Toxicology in Vitro. 58, 78-85 (2019).
- Winton, H. L., et al. Cell lines of pulmonary and non-pulmonary origin as tools to study the effects of house dust mite proteinases on the regulation of epithelial permeability. Clinical and Experimental Allergy. 28 (10), 1273-1285 (1998).
- Kanagaki, S., et al. Hydroxypropyl cyclodextrin improves amiodarone-induced aberrant lipid homeostasis of alveolar cells. American Journal of Respiratory Cell and Molecular Biology. 64 (4), 504-514 (2021).
- Sucre, J. M. S., et al. Successful establishment of primary type 2 alveolar epithelium with 3D organotypic co-culture. American Journal of Respiratory Cell and Molecular Biology. 59 (2), 158-166 (2018).
- Kobayashi, Y., et al. Persistence of a regeneration-associated, transitional alveolar epithelial cell state in pulmonary fibrosis. Nature Cell Biology. 22, 934-946 (2020).
- Choi, J., et al. Inflammatory signals induce AT2 cell-derived damage-associated transient progenitors that mediate alveolar regeneration. Cell Stem Cell. 27 (3), 366-382 (2020).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Katsura, H., et al. Human lung stem cell-based alveolospheres provide insights into SARS-CoV-2-mediated interferon responses and pneumocyte dysfunction. Cell Stem Cell. 27 (6), 890-904 (2020).
- Jacob, A., et al. Differentiation of human pluripotent stem cells into functional lung alveolar epithelial cells. Cell Stem Cell. 21 (4), 472-488 (2017).
- Alysandratos, K. -. D., et al. Patient-specific iPSCs carrying an SFTPC mutation reveal the intrinsic alveolar epithelial dysfunction at the inception of interstitial lung disease. Cell Reports. 36 (9), 109636 (2021).
- Hurley, K., et al. Reconstructed single-cell fate trajectories define lineage plasticity windows during differentiation of human PSC-derived distal lung progenitors. Cell Stem Cell. 26 (4), 593-608 (2020).
- Sun, Y. L., et al. Heterogeneity in human iPSC-derived alveolar epithelial type II cells revealed with ABCA3/SFTPC reporters. American Journal of Respiratory Cell and Molecular Biology. 65 (4), 442-460 (2021).
- Abo, K. M., et al. Human pluripotent stem cell-derived alveolar type 2 cells mature and respond to environmental exposures in air-liquid interface culture. Journal of Clinical Investigation Insight. 7 (6), (2022).
- Huang, J., et al. SARS-CoV-2 infection of pluripotent stem cell-derived human lung alveolar type 2 cells elicits a rapid epithelial-intrinsic inflammatory response. Cell Stem Cell. 27 (6), 962-973 (2020).
- Jacob, A., et al. Derivation of self-renewing lung alveolar epithelial type II cells from human pluripotent stem cells. Nature Protocols. 14 (12), 3303-3332 (2019).
- Beers, M. F., Moodley, Y. When is an alveolar type 2 cell an alveolar type 2 cell? A conundrum for lung stem cell biology and regenerative medicine. American Journal of Respiratory Cell and Molecular Biology. 57 (1), 18-27 (2017).
- Alysandratos, K. D., et al. Impact of cell culture on the transcriptomic programs of primary and iPSC-derived human alveolar type 2 cells. bioRxiv. , (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon