Method Article
Erzeugung von 3D-Kugeln und 2D-Luft-Flüssig-Grenzflächenkulturen von humanen induzierten pluripotenten Stammzell-abgeleiteten alveolären Epithelzellen vom Typ 2
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt humane induzierte pluripotente Stammzell-abgeleitete alveoläre Epithel-ähnliche Zellen (iAT2s) vom Typ 2. Diese Zellen können als selbsterneuernde Kugeln in 3D-Kultur kultiviert oder an die Luft-Flüssigkeits-Interface-Kultur (ALI) angepasst werden.
Zusammenfassung
In der Lunge ist das Alveolarepithel eine physikalische Barriere gegen Umweltreize und spielt eine wesentliche Rolle bei Homöostase und Erkrankungen. Typ 2 alveoläre Epithelzellen (AT2s) sind die fakultativen Vorläufer des distalen Lungenepithels. Funktionsstörungen und Verletzungen von AT2s können von verschiedenen Lungenerkrankungen herrühren und dazu beitragen. Ein besseres Verständnis der AT2-Biologie ist daher entscheidend für das Verständnis der Lungenbiologie und -krankheit; Primäre menschliche AT2 sind jedoch im Allgemeinen schwer zu isolieren und in der Versorgung begrenzt. Um diese Einschränkungen zu überwinden, können humane induzierte pluripotente Stammzellen (iPSC)-abgeleitete Typ 2 alveoläre Epithelzellen (iAT2s) durch ein gerichtetes Differenzierungsprotokoll erzeugt werden, das die In-vivo-Lungenentwicklung rekapituliert. iAT2s wachsen unter feederfreien Bedingungen, teilen sich ein transkriptomisches Programm mit menschlichen primären AT2s für Erwachsene und führen Schlüsselfunktionen von AT2s wie Produktion, Verpackung und Sekretion von Tensiden aus. Dieses Protokoll beschreibt die Methoden zur Aufrechterhaltung selbsterneuernder iAT2s durch serielles Passieren in dreidimensionaler (3D) Kultur oder Anpassung von iAT2s an die Luft-Flüssigkeits-Schnittstelle (ALI)-Kultur. Eine Einzelzellsuspension von iAT2s wird vor der Beschichtung in einer 3D-Solubilisierungsmembranmatrix (im Folgenden als "Matrix" bezeichnet) erzeugt, wo sie sich selbst zu einschichtigen Epithelkugeln zusammensetzen. iAT2s in 3D-Kultur können seriell in Einzelzellsuspensionen dissoziiert werden, um in 2D-ALI-Kultur durchgelassen oder plattiert zu werden. In der ALI-Kultur bilden iAT2s eine polarisierte Monoschicht, wobei die apikale Oberfläche der Luft ausgesetzt ist, wodurch diese Plattform leicht für Umwelteinflüsse zugänglich ist. Daher erzeugt dieses Protokoll einen unerschöpflichen Vorrat an iAT2s und produziert mehr als 1 x 1030 Zellen pro Eingangszelle über 15 Passagen unter Beibehaltung des AT2-Programms, das durchSFTPC tdTomato-Expression angezeigt wird. Die resultierenden Zellen stellen eine reproduzierbare und relevante Plattform dar, die angewendet werden kann, um genetische Mutationen zu untersuchen, Umweltexpositionen zu modellieren oder Medikamente zu screenen.
Einleitung
In der Lunge sind die Atemwege und die Alveolarepithelzellen die ersten, die inhalativen Umweltbelastungen ausgesetzt sind, einschließlich Krankheitserregern, die über inhalative Aerosole und schädliche Reize wie Zigarettenrauch übertragen werden. Typ 2 Alveolarepithelzellen (AT2s) sind für die Aufrechterhaltung der Lungenhomöostase unerlässlich, da sie die fakultativen Vorläufer des distalen Lungenepithels sind, Tenside zur Linderung der alveolären Oberflächenspannung produzieren und die angeborene Immunantwort auf inhalative Expositionen aufbauen 1,2. AT2-Dysfunktion kann jedoch aus Lungenverletzungen oder Mutationen in Genen resultieren, die selektiv in AT2s exprimiert werden, wie SFTPC, SFTPB und ABCA3 3,4,5. Bisherige Ansätze zur Untersuchung dieser genetischen Mutationen stützten sich auf Mausmodelle6 oder konstruierte, mutationshaltige Vektoren, die in unsterbliche Zelllinien7 eingeführt wurden. Daher werden Plattformen benötigt, die die Auswirkungen genetischer und umweltbedingter Störungen auf AT2s in den physiologisch relevanten Zelltypen und in einem produktiven In-vitro-System modellieren können, um die Rolle von AT2 für Gesundheit und Krankheit besser zu verstehen.
In Bezug auf die Modellierung von Luftexpositionen wurden Luft-Flüssig-Grenzflächenkulturen (ALI) von primären Atemwegsepithelzellen erfolgreich eingesetzt, um wichtige molekulare Reaktionen auf Zigarettenrauch8 aufzudecken und eine Atemwegsinfektion zu modellieren 9,10. Ein vergleichbares ALI-Kultursystem für das Alveolarepithel, eine Schlüsselstelle der Infektion oder Verletzung von Krankheiten, ist im Vergleich zum Atemwegsepithelmodellsystem viel weniger entwickelt. Immortalisierte Zelllinien wurden bei ALI als Stellvertreter für das Alveolarepithel11,12 kultiviert, aber diese Zelllinien unterscheiden sich transkriptomisch von primären alveolären Epithelzellen 13 und haben keine wichtige zelluläre Maschinerie, wie die Fähigkeit, Tenside abzusondern oder Engstellen bei ALI 12 zu bilden. Primäre menschliche AT2s können in Gegenwart von Fibroblasten 1,14 in 3D-Kugeln kultiviert werden, unterliegen jedoch Einschränkungen, einschließlich der begrenzten Zugänglichkeit von explantierten Lungen und ihrer Tendenz, den zellulären Phänotyp in den meisten Kulturen zu seneszieren oder zu verlieren. Diese Merkmale stellen Hindernisse für die weit verbreitete Einführung primärer AT2-In-vitro-Studien dar, obwohl in jüngster Zeit Fortschritte bei der Optimierung von feederfreien 3D-Kulturen für die Expansion von primären AT2s15,16,17,18 erzielt wurden.
Gerichtete Differenzierungsprotokolle wurden entwickelt, um in vivo Entwicklungsmeilensteine zu rekapitulieren, um humane induzierte pluripotente Stammzellen (iPSC)-abgeleitete Typ 2 alveoläre Epithelzellen (iAT2s)19 zu erzeugen. iAT2s wachsen als selbsterneuernde Kugeln in 3D-serumfreier Kultur in einem definierten Medium, das CHIR99021, KGF, Dexamethason, cAMP und 3-Isobutyl-1-methylxanthin (IBMX) enthält, genannt "CK + DCI"19, in Abwesenheit von Fibroblasten-Feedern und können für >20 Passagen20,21 kultiviert werden. Darüber hinaus teilen sich iAT2s ein transkriptomisches Programm mit menschlichen primären AT2s für Erwachsene, bilden lamellare Körper und produzieren und verpacken Tensid 19,21,22. Dieses Protokoll beschreibt die serielle Übertragung von iAT2s, indem die Zellen zu einer Einzelzellensuspension dissoziiert werden. An dieser Stelle können iAT2s in 3D-Kultur neu plattiert und erweitert oder in 2D-ALI-Kultur23 plattiert werden. Diese Methoden können verwendet werden, um die intrinsische Biologie von AT2s in Homöostase und Krankheit 20,22 zu untersuchen und die Wirkungen von Verbindungen oder Reizen in einer skalierbaren, physiologisch relevanten Plattform23,24 zu untersuchen, wie zuvor gezeigt wurde.
Protokoll
Alle Experimente zur Differenzierung menschlicher iPSC-Linien wurden in Übereinstimmung mit dem Institutional Review Board der Boston University (Protokoll H33122) durchgeführt. Die dermalen Fibroblasten, die für die Reprogrammierung zu iPSCs beschafft wurden, wurden von einem Spender mit schriftlicher Einverständniserklärung unter Genehmigung des Human Research Protection Office der Washington University School of Medicine, St. Louis, MO, erhalten. Reprogrammierte iPS-Zellen wurden am Zentrum für Regenerative Medizin der Boston University und am Boston Medical Center, Boston, MA, erzeugt.
1. Dissoziation der Alveolosphäre
- Es werden vollständige serumfreie Differenzierungsmedien (cSFDM) gemäß der in Tabelle 1 genannten Zusammensetzung hergestellt.
- Bereiten Sie CK + DCI-Medien in der vorbereiteten cSFDM-Basis gemäß Tabelle 2 vor.
- Tauwetter Sie 2D- (humane embryonale Stammzell-qualifizierte) und/oder 3D-Matrix (wachstumsfaktorreduziert) auf Eis, je nach Bedarf für die experimentellen Bedürfnisse.
- Absaugen Sie das gesamte CK + DCI-Medium mit einer Pipette oder einer Ansaugpipette mit Vakuum aus den 3D-Matrixtröpfchen, die Alveolosphären enthalten, abgeleitet von der gerichteten Differenzierung19, in einer 12-Well-Platte.
- Fügen Sie 1 ml Dispase (2 mg / ml) pro Tröpfchen hinzu. Pipetten Sie den Tröpfchen vorsichtig mit einer P1000-Pipette in die Dispase. Bei 37 °C für 1 h inkubieren und nach 30 min einmal auf und ab pipettieren.
- Die dissoziierten Organoide (aus Schritt 1.5) werden von einem Matrixtröpfchen in der Dispase in ein 15 ml konisches Röhrchen übertragen. Zum Waschen fügen Sie 10 ml Modified Dulbecco's Medium von Iscove hinzu (IMDM, siehe Materialtabelle).
- Zentrifüchte bei 300 x g für 5 min bei Raumtemperatur. Saugen Sie den Überstand mit einer Pipette oder einer Ansaugpipette mit Vakuum ab, wobei so wenig Überstand wie möglich verbleibt.
HINWEIS: Es ist wichtig, alle Dispase zu entfernen, da jede verbleibende Dispase die Matrix auflösen kann, in die die Zellen anschließend gesät werden. Wenn ein klarer Dunst über dem Pellet zu sehen ist, hat die Dispase die Matrix nicht vollständig aufgelöst, und dem Pellet kann für weitere 20-30 min bei 37 ° C mehr Dispase hinzugefügt werden. - Resuspendieren Sie die Zellen in 1 ml 0,05% Trypsin pro Tröpfchen und übertragen Sie zurück auf die 12-Well-Platte. Bei 37 °C für 12-15 min inkubieren. Beobachten Sie die Dissoziation unter einem Mikroskop. Vermeiden Sie es, die Zellen in diesem Stadium zu überpipettieren.
HINWEIS: Am Ende der Inkubation müssen die Zellen eine Einzelzellsuspension erreichen, nachdem sie 3-5 Mal mit einer P1000-Pipette pipettiert wurden. Für die Weitergabe von iAT2s an ALI (Schritt 3) muss die Trypsinisierungszeit minimiert werden (maximal 12 min), so dass sich die Zellen in 2-3-Zell-Klumpen und nicht in Einzelzellsuspension befinden, wenn sie für die Beschichtung auf den Zellkultureinsatz bereit sind. - Stoppen Sie die Wirkung von Trypsin mit einem gleichen Volumen an FBS-haltigem Medium (10% ES-qualifiziertes FBS in DMEM). Zentrifüchte bei 300 x g für 5 min bei Raumtemperatur.
- Waschen Sie die Zellen mit 10 ml IMDM. Zentrifüchte bei 300 x g für 5 min bei Raumtemperatur.
- Suspendieren Sie die Zellen in einem geeigneten Volumen für die Zählung und zählen Sie dann die Zellen mit einem Hämozytometer (siehe Materialtabelle).
HINWEIS: Von einem konfluierenden 50-μL-Matrixtröpfchen, das mit 400 Zellen / μL ausgesät ist, beträgt der erwartete Ertrag 500.000 bis 1,5 x 106 Zellen pro Tröpfchen. - Verwenden Sie die Einzelzellsuspension von iAT2-Zellen, um Alveolosphären durch Plattieren in der 3D-Matrix (Schritt 2) und/oder Plattieren auf Zellkultureinsätzen für die ALI-Kultur (Schritt 3) zu erzeugen.
2.3D Beschichtung von iAT2s
- Bestimmen Sie nach dem Zählen (Schritt 1.11) die Anzahl der gewünschten Zellen, die in der 3D-Matrix neu beschichtet werden sollen (400 Zellen/μL der Matrix mit 50-100 μL 3D-Matrixtröpfchen pro Vertiefung einer 12-Well-Platte). Zentrifen Sie die Zellen bei 300 x g für 5 min bei Raumtemperatur. Entfernen Sie so viel Überstand wie möglich mit einer Pipette.
- Suspendieren Sie die Zellen in der 3D-Matrix. Resuspendieren Sie bei Bedarf schnell und auf Eis, um zu verhindern, dass die Matrix polymerisiert (was beim Erwärmen auftritt).
- Verwenden Sie eine P200-Pipette, um einen 3D-Matrixtropfen pro Vertiefung in eine vorgewärmte 12-Well-Platte zu dosieren. Pipette vorsichtig, um Blasen im Matrixtröpfchen zu vermeiden. Lassen Sie nicht zu, dass sich die Zellsuspension bei der Abgabe mehrerer Tröpfchen absetzt.
- Legen Sie die Platte für 20-30 Minuten in einen 37 ° C-Inkubator, damit die Matrixtröpfchen polymerisieren können.
- Fügen Sie 1 ml CK + DCI + 10 μM Y-27632-Medium (siehe Materialtabelle) pro Vertiefung hinzu, um das Matrixtröpfchen abzudecken.
- Wechseln Sie nach 72 h auf CK + DCI ohne 10 μM Y-27632.
- Ersetzen Sie das Medium alle 48-72 h durch frisches CK + DCI.
HINWEIS: iAT2s müssen in der Regel etwa alle 10-14 Tage durchlaufen werden, abhängig von der Zelllinie und der Beschichtungsdichte.
3. Weitergabe von iAT2s an ALI
- Bereiten Sie frisch beschichtete 6,5-mm-Zellkultureinsätze 1 h vor der Verwendung vor, indem Sie die 2D-Matrix in Dulbeccos modifizierter Eagle Medium/Nutrient Mixture F-12 (DMEM/F12) gemäß den Anweisungen des Herstellers für die 2D-Matrix (siehe Materialtabelle) zu einer Arbeitslösung verdünnen. Fügen Sie dann 100 μL der verdünnten Matrix pro 6,5 mm Zellkultureinsatz hinzu. Lassen Sie die Matrix in einem 37 °C Inkubator für 30 Minuten oder bei Raumtemperatur für 1 h polymerisieren.
- Die überschüssige Matrix aus den Zellkultureinsätzen mit einer Pipette oder einer Ansaugpipette mit Vakuum absaugen und einmal mit DMEM/F12 abspülen. Saugen Sie diese Wäsche unmittelbar vor dem Hinzufügen der Zellen ab.
- Bestimmen Sie nach dem Zählen die Anzahl der erforderlichen Zellen, um die gewünschte Anzahl von Zellen in den Kultureinsätzen zu säen (520.000 lebende Zellen/cm2, entsprechend 172.000 lebende Zellen pro 6,5 mm Zellkultureinsatz). Zentrifen Sie die Zellen bei 300 x g für 5 min bei Raumtemperatur. Entfernen Sie so viel Überstand wie möglich.
- Resuspendieren Sie die Zellen im entsprechenden Volumen mit 100 μL CK + DCI + 10 μM Y-27632 pro Zellkultureinsatz (Zellsuspension sollte 1.720 Zellen/μL betragen). 100 μL in das apikale Kompartiment des Zellkultureinsatzes geben. Rühren Sie die Platte vorsichtig in einem Kreuzmuster, um eine gleichmäßige Verteilung der Zellen über den Zellkultureinsatz zu gewährleisten, und bestätigen Sie dies, indem Sie unter einem Mikroskop auf 4x Objektiv überprüfen.
HINWEIS: Die Aussaatdichte ist kritisch und erfordert möglicherweise eine Optimierung, die von 160.000 bis 300.000 Zellen pro 6,5 mm Zellkultureinsatz reicht. Calceingrün (siehe Tabelle der Materialien) zelldurchlässiger Farbstoff kann den Zellen zugesetzt und auf einem invertierten Fluoreszenzmikroskop betrachtet werden, um die Zellen nach der Aussaat sichtbar zu machen. - 500 μL CK + DCI + 10 μM Y-27632 in das basolaterale Kompartiment jedes Zellkultureinsatzes geben.
- Aspirationsapikales CK + DCI + 10 μM Y-27632 mittel 48 h nach der Aussaat mit einer Pipette zur Initiierung von ALI (bekannt als "Lufttransport").
HINWEIS: Die Zellen sollten zu diesem Zeitpunkt zu 100% konfluent sein. Wenn die Zellen nicht zu 100% konfluent sind, sollten die Schritte 3.7-3.8 immer noch zu den angegebenen Zeitpunkten durchgeführt werden. Die Bildung konfluenter Zellmonoschichten kann länger dauern. - Ändern Sie das basolaterale CK + DCI + 10 μM des Y-27632-Mediums nach 72 h in CK + DCI ohne 10 μM Y-27632.
HINWEIS: Es sollte minimal, wenn überhaupt, "Leck" von Medium auf die apikale Seite geben. Wenn dies jedoch in den ersten Tagen der Fall ist, aspirieren Sie die apikale Seite täglich weiter, bis keine weitere Leckage auftritt. - Ersetzen Sie das basolaterale Medium alle 48-72 h durch frisches CK + DCI.
HINWEIS: Die in ALI-Kulturen verwendeten iAT2s sind maximal 5-14 Tage nach der Beschichtung gereift. - Pflegen Sie die Zellen mit sorgfältiger Überwachung für bis zu 28 Tage nach der Beschichtung, falls erforderlich, für längeres Experimentieren.
HINWEIS: Sichtbare Anzeichen eines ALI-Versagens, wie das Abschälen der Zellen vom Rand des Inserts oder die Bildung von Löchern in der Monoschicht, können nach einer überlangen Zeit in der Kultur beobachtet werden, zu welchem Zeitpunkt der ALI nicht mehr für Experimente verwendbar ist.
Ergebnisse
Die iAT2s wurden in eine Einzelzellsuspension überführt und dann in 3D-Matrix oder in 2D auf Zellkultureinsätzen für die ALI-Kultur neu plattiert (Abbildung 1). Nach der Einzelzelldissoziation wurden die iAT2s mittels Durchflusszytometrie analysiert. Kurz gesagt, die Zellen, die in 1% fetalem Rinderserum (FBS) in phosphatgepufferter Kochsalzlösung (PBS) mit calcinblauem Viabilitätsfarbstoff (1:1000) resuspendiert wurden, wurden auf einem Durchflusszytometer, Gating für Nicht-Fragmente, Singulette und tdTomato analysiert. Hier als Beispiel ist die SPC2-Linie (SPC2-ST-B2-Klon 20), die einen tdTomato-Reporter hat, der auf den endogenen SFTPC-Locus ausgerichtet ist, um die Visualisierung und Verfolgung des AT2-Programms im Laufe der Zeit in Kultur zu erleichtern (Abbildung 2A). Der iAT2 SFTPC-tdTomato-Ausdruck wurde beibehalten, wenn er in der 3D-Matrix als Kugeln neu plattiert wurde (Abbildung 2B) und wenn er auf Zellkultureinsätzen plattiert wurde (Abbildung 2C). Der transepitheliale elektrische Widerstand (TEER) kann gemessen werden, um die Integrität der ALI-Kultur zu bestimmen (Abbildung 2D). Zur Messung von TEER wurde ein Voltrohmenmessgerät verwendet (siehe Materialtabelle), wobei der apikalen Kammer 100 μL CK + DCI-Medium hinzugefügt wurden. Die Zellkultureinsätze, die in Abwesenheit von ausgesäten Zellen mit Matrigel beschichtet waren, wurden als Rohlinge behandelt. Die Messwerte wurden an drei Stellen in jedem Brunnen durchgeführt.

Abbildung 1: Schematische Darstellung des Protokollworkflows. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
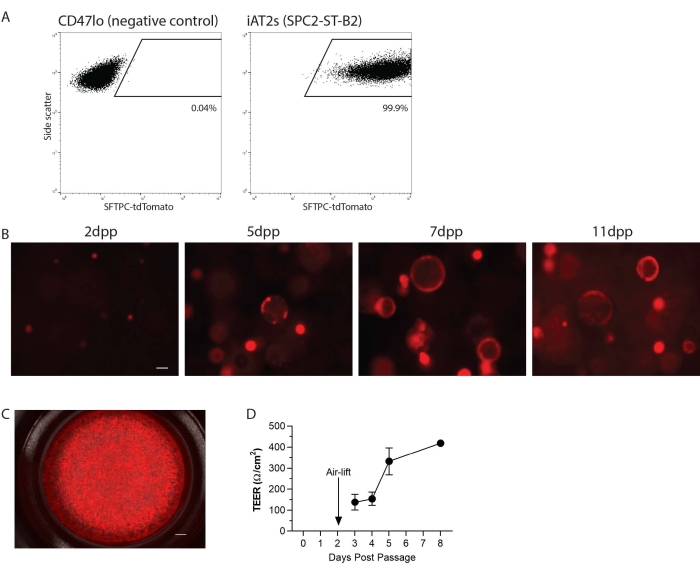
Abbildung 2: Repräsentative Ergebnisse des Protokolls. (A) Repräsentative Durchflusszytometrieergebnisse für SFTPC-tdTomato in humanen induzierten pluripotenten Stammzell-abgeleiteten alveolären Epithel-ähnlichen Zellen (iAT2s), die in 3D kultiviert wurden. Die gezeigte Negativkontrolle ist ein Nicht-Lungenendoderm (CD47lo). (B) Repräsentative Lebendzellbildgebung von in 3D kultivierten iAT2s an verschiedenen Tagen nach der Passage (dpp) (SFTPC-tdTomato, Skalenbalken = 50 μm). (C) Repräsentative Lebendzellbildgebung von iAT2s, die an der Luft-Flüssigkeits-Grenzfläche plattiert sind (SFTPC-tdTomato, Skalenbalken = 500 nm). (D) Repräsentativer transepithelialer elektrischer Widerstand von iAT2s, die an der Luft-Flüssigkeits-Grenzfläche plattiert sind. n = 3, Fehlerbalken zeigen die Standardabweichung an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Reagenzien | Volumen für 500 ml | Endkonzentration |
| Iscoves modifiziertes Dulbecco-Medium (IMDM) | 375 ml | 75% |
| Schinken F-12 Nährstoffmischung (F12) | 125 ml | 25% |
| B-27 (mit RA) Ergänzung | 5 ml | 1% |
| N-2 Ergänzung | 2,5 ml | 0.50% |
| BSA (7,5% Lagerbestand) | 3,3 ml | 0.05% |
| Primocin (50 mg/ml Brühe) | 1 ml | 100 μg/ml |
| Glutamax (100x Lagerbestand) | 5 ml | 1x |
| Ascorbinsäure (50 mg/ml Vorrat) | 500 μL | 50 μg/ml |
| 1-Thioglycerin (MTG) (ab 26 μL in 2 mL IMDM) | 1,5 ml | 4,5 x 10-4 m |
Tabelle 1: Zusammensetzung des vollständigen serumfreien Differenzierungsmediums (cSFDM).
| Reagenz | Endkonzentration |
| CHIR99021 | 3 μM |
| rhKGF | 10 ng/ml |
| Dexamethason | 50 nM |
| 8-Bromoakenosin 30,50-cyclisches Monophosphat-Natriumsalz (cAMP) | 0,1 mM |
| 3-Isobutyl-1-methylxanthin (IBMX) | 0,1 mM |
Tabelle 2: Zusammensetzungen der CK + DCI-Medien.
Diskussion
AT2s erhalten die Lungenhomöostase, und eine Funktionsstörung dieser wichtigen Alveolarzellen kann verschiedene Lungenerkrankungen verursachen und daraus resultieren. Aufgrund der Schwierigkeit, auf primäre menschliche AT2s zuzugreifen und sie zu isolieren, werden iAT2s erzeugt. Durch die Anwendung der an anderer Stelle beschriebenen gerichteten Differenzierungsmethoden25 und der hier beschriebenen Expansion und Zellaussaat können aus jedem Individuum erzeugte iPS-Zellen in robust selbsterneuernde iAT2s differenziert werden, wodurch patientenspezifische Zellen für die biomedizinische Forschung bereitgestellt werden, einschließlich grundlegender biomedizinischer Forschungsentwicklungsstudien, Krankheitsmodellierung, zellbasierter Therapien oder Arzneimittelscreenings. Das vorliegende Protokoll beschreibt eine Methode zur Dissoziation von iAT2s zu einer Einzelzellsuspension, die dann in 3D-Matrigel neu plattiert werden kann, um Alveolosphären für die Zellexpansion zu erzeugen, oder in 2D-ALI-Kultur für weitere Experimente neu plattiert werden kann.
Das Protokoll umfasst mehrere wichtige Schritte, um eine erfolgreiche Weitergabe und Neuplattierung sowohl in 3D- als auch in ALI-Kulturen sicherzustellen. Mechanische Verreibungen müssen minimiert werden, da übermäßiges Pipettieren die Lebensfähigkeit der Zellen verringern kann. Darüber hinaus ist die Seeding-Dichte von iAT2s sowohl in 3D- als auch in 2D-ALI-Kulturen von entscheidender Bedeutung. Für die 3D-Kultur sind im Allgemeinen 400 Zellen / μL 3D-Matrigel für die meisten iPSC-Linien optimal. Ein Bereich von Dichten von 100-500 Zellen / μL war jedoch manchmal erfolgreich, und eine Optimierung der Dichte kann für verschiedene Zelllinien erforderlich sein. Für die ALI-Kultur ist die Optimierung der Aussaatdichte von iAT2s auf den Zellkultureinsätzen ebenfalls unerlässlich, um eine konfluierende Monoschicht von Zellen 48 h nach der Aussaat (d.h. am Tag der Luftbrücke) zu erreichen. Einige iAT2-Zeilen erfordern mehr Zellen pro Einfüge. Wenn also eine Fehlerbehebung erforderlich ist, wird ein Bereich von 160.000-300.000 Zellen / Einsatz für 24-Well-Zellkultureinsätze empfohlen. 3D-Kulturen können auch auf 24- und 48-Well-Platten skaliert werden, indem die Aussaatdichte bei 400 Zellen / μL der 3D-Matrix beibehalten und die Matrixtröpfchengröße auf 25 μL bzw. 20 μL reduziert wird. ALI-Kulturen können auf 96-Well-Zellkultur-Inserts skaliert werden, indem jeder Einsatz mit 30 μL der Matrix beschichtet, 80.000 Zellen in 30 μL pro Einsatz plattiert und mit 150 μL basolateralen Medien pro Vertiefung gefüttert wird. Die Aussaatdichte sowie die Matrix- und Medienvolumina müssen entsprechend für andere Plattenformate skaliert und optimiert werden.
Eine Einschränkung dieses Protokolls besteht darin, dass die für die ALI-Beschichtung verwendeten Zellen ausreichend gereinigt sein müssen, um NKX2-1 + und SFTPC + 19,20, 21,23 zu sein, um iAT2-ALI zu bilden, und die ALI-Kulturbildung kann von Zeile zu Linie variieren. Darüber hinaus ermöglicht dieses Protokoll die Erweiterung und Generierung von AT2-only-Kulturen und bietet ein reduktionistisches Modellsystem, das auf einem einzigen alveolären Zelltyp basiert. Wichtig ist, dass andere relevante alveoläre Zelltypen, wie z.B. alveoläre Typ-1-Zellen, auf diesen Plattformen fehlten. Andere Gruppen hatten Erfolg bei der Kultivierung von primären menschlichen AT2s als Sphäroide oder organotypische Kulturen mit oder ohne Fibroblasten 1,14,15,16,17; Primäre menschliche AT2s neigen jedoch dazu, ihre Expression von Schlüsseltensiden zu verlieren, wenn sie in normaler 2D-Kultur ohne ALI-Bedingungen kultiviert werden26. Darüber hinaus haben jüngste Arbeiten gezeigt, dass iAT2s höhere proliferative Marker und niedrigere AT2-Reifungsmarker exprimieren als frische, unkultivierte menschliche primäre AT2s27. Trotz dieser Unterschiede zwischen iAT2s und frischen primären menschlichen AT2s fanden wir heraus, dass selbst kultivierte primäre AT2s transkriptomische Unterschiede zu frischen, unkultivierten primären AT2s27 aufwiesen, und folgerten daher, dass diese In-vitro-Modelle verschiedene Stärken und Einschränkungen für die Modellierung der In-vivo-Lungenbiologie aufweisen.
Die iAT2-Plattform kann angewendet werden, um genetische Mutationen von patientenabgeleiteten iPS-Zellen19,20 zu untersuchen. Das System könnte auch erheblich skaliert werden, um ein Arzneimittelscreening mit hohem Durchsatz zu ermöglichen. Darüber hinaus eignen sich iAT2 ALIs für Umwelteinflüsse wie virale oder bakterielle Infektionen oder die Exposition gegenüber Zigarettenrauch, E-Zigarettendampf oder anderen Aerosolen23. Zusammenfassend lässt sich sagen, dass dieses Protokoll zur Erzeugung von 3D- und 2D-ALI-Kulturen von iAT2s eine Langzeitkultur eines krankheitsrelevanten Zelltyps ermöglicht und eine physiologische, skalierbare Plattform bietet, die den Einsatz dieser Zellen in vielen Anwendungen ermöglicht.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Wir danken den Mitgliedern der Labors Wilson, Kotton und Hawkins herzlich für ihre hilfreichen Gespräche. Wir sind auch Greg Miller (CReM Laboratory Manager) und Marianne James (iPSC Core Manager) für ihre unschätzbare Unterstützung sehr dankbar. Wir danken Brian Tilton und dem BUMC Flow Cytometry Core für ihre technische Unterstützung bei der Zellsortierung (unterstützt durch den NIH-Zuschuss #1S10OD021587-01A1). Diese Arbeit wurde durch ein CJ Martin Early Career Fellowship des Australian National Health and Medical Research Council unterstützt, das an RBW vergeben wurde; NIH gewährt KMA F30HL147426; einen I.M. Rosenzweig Junior Investigator Award der Pulmonary Fibrosis Foundation und einen Integrated Pilot Grant Award des Boston University Clinical & Translational Science Institute (1UL1TR001430) an KDA; Schweizerischer Nationalfonds (P2ELP3_191217) an ABA; NIH gewährt DNK U01HL148692, U01HL134745, U01HL134766 und R01HL095993; und NIH-Zuschüsse U01TR001810, R01DK101510 und R01DK117940 an AAW; iPSC-Wartung, Banking und Sharing werden durch den NIH-Zuschuss NO1 75N92020C00005 unterstützt. Abbildung 1 wurde mit Biorender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 3-Isobutyl-1-methylxanthine (IBMX) | Sigma | I5879 | For CKDCI |
| 12 Well Cell Culture Plate | Corning | 3513 | Plates for culturing |
| 1-Thioglycerol (MTG) | M6145 | Sigma | For CKDCI |
| 2D Matrigel (matrix) - Matrigel hESC-Qualified Matrix | Corning | 8774552 | To coat ALI Transwells |
| 3D Matrigel (matrix) - Growth Factor Reduced Matrigel | Corning | 356230 | To grow iAT2 spheres in |
| 8-bromoadenosine 30,50-cyclic monophosphate sodium salt (cAMP) | Sigma | B7880 | For CKDCI |
| Ascorbic Acid | A4544 | Sigma | For CKDCI |
| B27 w/out retinoic acid | Life Technologies | 12587-010 | For CKDCI |
| Bovine Serum Albumin (BSA) (7.5%) | Thermo Fisher | 15260037 | For CKDCI |
| Calcein blue | Life Technologies | C1429 | For live/dead discrimination in flow cytometry |
| Calcein green | Life Technologies | C1430 | Optional visualisation of cells on cell culture insert |
| Cell culture inserts - Costar 6.5 mm Clear Transwells with 0.4 µm pore size | Millipore-Sigma | CLS3470-48EA | ALI transwells |
| CHIR99021 | Tocris | 4423 | For CKDCI |
| Dexamethasone | Sigma | D4902 | For CKDCI |
| Dispase (2 mg/mL) | Thermo Fisher | 354235 | To dissolve matrigel |
| Dulbecco's Modified Eagle Medium (DMEM) | Thermo Fisher | 11995 | To make trypsin inactivation media (10% FBS in DMEM) |
| Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12 (DMEM/F12) | Thermo Fisher | A4192002 | To wash |
| Dulbecco's phosphate buffered saline (PBS) | Thermo Fisher | 14190 | For flow cytometric analyses |
| Fetal bovine serum (FBS) (Hyclone charaterized) | GE Healthcare Life Sciences | SH30071.03 | To make trypsin inactivation media (10% FBS in DMEM) |
| Glutamax | Life Technologies | 35050-061 | For CKDCI |
| Ham's F-12 Nutrient Mixture (F12) | Cellgro | 10-080-CV | For CKDCI |
| Hemocytometer | Fisher | 02-671-6 | For cell counting |
| Invivogen Primocin 1 G (50 mg/mL) | Fisher Scientific | NC9392943 | For CKDCI |
| Iscove's Modified Dulbecco's Medium (IMDM) | Thermo Fisher | 12440053 | For CKDCI |
| Millicell ERS-2 Voltohmeter | Millipore | MERS00002 | To measure trans-epithlial electrical resistance |
| N2 supplement | Life Technologies | 17502-048 | For CKDCI |
| Recombinant human KGF | R&D Systems | 251-KG-010 | For CKDCI |
| Retinoic acid | Sigma | R2625 | For CKDCI |
| Trypan blue | Thermo Fisher | 15250061 | For cell count during passaging |
| Trypsin-EDTA (0.05%) | Gibco | 25-300-062 | To dissociate iAT2 spheres |
| Y-27632 dihydrochloride | Tocris | 1254 | Add to cells after passaging |
Referenzen
- Barkauskas, C. E., et al. Type 2 alveolar cells are stem cells in adult lung. Journal of Clinical Investigation. 123 (7), 3025-3036 (2013).
- Mason, R. J., Williams, M. C. Type II alveolar cell. Defender of the alveolus. American Review of Respiratory Disease. 115 (6), 81-91 (1977).
- Nogee, L. M., et al. A mutation in the surfactant protein C gene associated with familial interstitial lung disease. New England Journal of Medicine. 344 (8), 573-579 (2001).
- Nogee, L. M., et al. A mutation in the surfactant protein B gene responsible for fatal neonatal respiratory disease in multiple kindreds. Journal of Clinical Investigation. 93 (4), 1860-1863 (1994).
- Shulenin, S., et al. ABCA3 gene mutations in newborns with fatal surfactant deficiency. New England Journal of Medicine. 350 (13), 1296-1303 (2004).
- Nureki, S. I., et al. Expression of mutant Sftpc in murine alveolar epithelia drives spontaneous lung fibrosis. Journal of Clinical Investigation. 128 (9), 4008-4024 (2018).
- Katzen, J., et al. An SFTPC BRICHOS mutant links epithelial ER stress and spontaneous lung fibrosis. Journal of Clinical Investigation Insight. 4 (6), 126125 (2019).
- Mathis, C., et al. Human bronchial epithelial cells exposed in vitro to cigarette smoke at the air-liquid interface resemble bronchial epithelium from human smokers. American Journal of Physiology-Lung Cellular and Molecular Physiology. 304 (7), 489-503 (2013).
- Purkayastha, A., et al. Direct exposure to SARS-CoV-2 and cigarette Smoke increases infection severity and alters the stem cell-derived airway repair response. Cell Stem Cell. 27 (6), 869-875 (2020).
- Matrosovich, M. N., Matrosovich, T. Y., Gray, T., Roberts, N. A., Klenk, H. D. Human and avian influenza viruses target different cell types in cultures of human airway epithelium. Proceedings of the National Academy of Sciences. 101 (13), 4620-4624 (2004).
- Tollstadius, B. F., Silva, A. C. G. d., Pedralli, B. C. O., Valadares, M. C. Carbendazim induces death in alveolar epithelial cells: A comparison between submerged and at the air-liquid interface cell culture. Toxicology in Vitro. 58, 78-85 (2019).
- Winton, H. L., et al. Cell lines of pulmonary and non-pulmonary origin as tools to study the effects of house dust mite proteinases on the regulation of epithelial permeability. Clinical and Experimental Allergy. 28 (10), 1273-1285 (1998).
- Kanagaki, S., et al. Hydroxypropyl cyclodextrin improves amiodarone-induced aberrant lipid homeostasis of alveolar cells. American Journal of Respiratory Cell and Molecular Biology. 64 (4), 504-514 (2021).
- Sucre, J. M. S., et al. Successful establishment of primary type 2 alveolar epithelium with 3D organotypic co-culture. American Journal of Respiratory Cell and Molecular Biology. 59 (2), 158-166 (2018).
- Kobayashi, Y., et al. Persistence of a regeneration-associated, transitional alveolar epithelial cell state in pulmonary fibrosis. Nature Cell Biology. 22, 934-946 (2020).
- Choi, J., et al. Inflammatory signals induce AT2 cell-derived damage-associated transient progenitors that mediate alveolar regeneration. Cell Stem Cell. 27 (3), 366-382 (2020).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Katsura, H., et al. Human lung stem cell-based alveolospheres provide insights into SARS-CoV-2-mediated interferon responses and pneumocyte dysfunction. Cell Stem Cell. 27 (6), 890-904 (2020).
- Jacob, A., et al. Differentiation of human pluripotent stem cells into functional lung alveolar epithelial cells. Cell Stem Cell. 21 (4), 472-488 (2017).
- Alysandratos, K. -. D., et al. Patient-specific iPSCs carrying an SFTPC mutation reveal the intrinsic alveolar epithelial dysfunction at the inception of interstitial lung disease. Cell Reports. 36 (9), 109636 (2021).
- Hurley, K., et al. Reconstructed single-cell fate trajectories define lineage plasticity windows during differentiation of human PSC-derived distal lung progenitors. Cell Stem Cell. 26 (4), 593-608 (2020).
- Sun, Y. L., et al. Heterogeneity in human iPSC-derived alveolar epithelial type II cells revealed with ABCA3/SFTPC reporters. American Journal of Respiratory Cell and Molecular Biology. 65 (4), 442-460 (2021).
- Abo, K. M., et al. Human pluripotent stem cell-derived alveolar type 2 cells mature and respond to environmental exposures in air-liquid interface culture. Journal of Clinical Investigation Insight. 7 (6), (2022).
- Huang, J., et al. SARS-CoV-2 infection of pluripotent stem cell-derived human lung alveolar type 2 cells elicits a rapid epithelial-intrinsic inflammatory response. Cell Stem Cell. 27 (6), 962-973 (2020).
- Jacob, A., et al. Derivation of self-renewing lung alveolar epithelial type II cells from human pluripotent stem cells. Nature Protocols. 14 (12), 3303-3332 (2019).
- Beers, M. F., Moodley, Y. When is an alveolar type 2 cell an alveolar type 2 cell? A conundrum for lung stem cell biology and regenerative medicine. American Journal of Respiratory Cell and Molecular Biology. 57 (1), 18-27 (2017).
- Alysandratos, K. D., et al. Impact of cell culture on the transcriptomic programs of primary and iPSC-derived human alveolar type 2 cells. bioRxiv. , (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten