Method Article
인간 유도 만능 줄기 세포 유래 유형 2 폐포 상피 세포의 3D 구체 및 2D 공기-액체 계면 배양 생성
* 이 저자들은 동등하게 기여했습니다
요약
본 프로토콜은 인간 유도만능줄기세포 유래 제2형 폐포 상피유사세포(iAT2s)를 기술한다. 이들 세포는 3D 배양물에서 자가재생 구체로서 배양되거나 공기-액체 계면(ALI) 배양에 적응될 수 있다.
초록
폐에서 폐포 상피는 환경 자극으로부터의 물리적 장벽이며 항상성과 질병에 필수적인 역할을합니다. 제2형 폐포 상피세포(AT2s)는 원위 폐 상피의 교수적 전구세포이다. AT2s의 기능 장애 및 손상은 다양한 폐 질환으로 인해 발생할 수 있으며 이에 기여할 수 있습니다. 따라서 AT2 생물학에 대한 향상된 이해는 폐 생물학 및 질병을 이해하는 데 중요합니다. 그러나, 일차 인간 AT2는 일반적으로 분리하기가 어렵고 공급이 제한된다. 이러한 한계를 극복하기 위해, 인간 유도만능줄기세포(iPSC) 유래 제2형 폐포상피세포(iAT2s)는 생체내 폐 발달을 되풀이하는 지시된 분화 프로토콜을 통해 생성될 수 있다. iAT2는 피더가 없는 조건에서 성장하고, 전사체 프로그램을 인간 성인 일차 AT2와 공유하며, 계면활성제의 생산, 패키징 및 분비와 같은 AT2의 주요 기능을 수행합니다. 이 프로토콜은 3차원(3D) 배양물에서 직렬 패시징을 통해 자체 갱신 iAT2를 유지하거나 iAT2를 ALI(공기-액체 인터페이스) 배양에 적응시키는 방법을 자세히 설명합니다. iAT2s의 단일 세포 현탁액은 3D 가용화된 기저막 매트릭스(이하 "매트릭스"라고 함)에 도금하기 전에 생성되며, 여기서 이들은 단층 상피 구체로 자체 조립된다. 3D 배양물에서의 iAT2s는 2D ALI 배양물에서 계대 또는 플레이팅될 수 있도록 단일 세포 현탁액으로 연속적으로 해리될 수 있다. ALI 배양물에서 iAT2는 정점 표면이 공기에 노출된 편광 단층을 형성하여 이 플랫폼을 환경 노출에 쉽게 적용할 수 있도록 합니다. 따라서, 이 프로토콜은 iAT2s의 무진장 공급을 생성하며, SFTPCtdTomato 발현으로 표시된 AT2 프로그램을 유지하면서 15 계대에 걸쳐 입력 셀 당 1 x 1030 셀 이상을 생산한다. 생성된 세포는 유전자 돌연변이를 연구하거나, 환경 노출을 모델링하거나, 약물을 스크리닝하는데 적용될 수 있는 재현가능하고 관련성 있는 플랫폼을 나타낸다.
서문
폐에서기도와 폐포 상피 세포는 흡입 된 에어로졸을 통해 전염되는 병원균과 담배 연기와 같은 유해한 자극을 포함하여 흡입 된 환경 노출을 처음으로 경험합니다. 제2형 폐포 상피세포(AT2s)는 원위 폐 상피의 교양 전구 세포이기 때문에 폐 항상성을 유지하고, 폐포 표면 장력을 완화하기 위한 계면활성제를 생성하며, 흡입 노출 1,2에 선천적 면역 반응을 탑재하는 데 필수적입니다. 그러나, AT2 기능장애는 폐 손상 또는 SFTPC, SFTPB 및 ABCA3 3,4,5와 같은 AT2s에서 선택적으로 발현되는 유전자의 돌연변이로 인해 발생할 수 있다. 이러한 유전적 돌연변이를 연구하기 위한 이전의 접근법들은 마우스 모델(6) 또는 불멸화된 세포주(7)에 도입된 조작된, 돌연변이-함유 벡터에 의존해 왔다. 따라서 AT2가 건강과 질병에서 수행하는 역할을 더 깊이 이해하기 위해서는 생리적으로 관련된 세포 유형 및 생산적인 시험관 내 시스템에서 AT2에 대한 유전 적 및 환경 적 혼란의 영향을 모델링 할 수있는 플랫폼이 필요합니다.
공기 중 노출 모델링의 관점에서, 일차 기도 상피 세포의 공기-액체 계면(ALI) 배양은 담배 연기(8)에 대한 주요 분자 반응을 밝히고 기도 감염(9,10)을 모델링하기 위해 성공적으로 활용되었다. 폐포 상피에 대한 비교 가능한 ALI 배양 시스템, 질병의 감염 또는 손상의 주요 부위는 기도 상피 모델 시스템에 비해 훨씬 덜 발달되어 있습니다. 불멸화 세포주는 폐포 상피 11,12의 대리자로서 ALI에서 배양되었지만, 이들 세포주는 원발성 폐포 상피 세포(13)와 전사적으로 구별되며 ALI 12에서 계면활성제를 분비하거나 단단한 접합을 형성하는 능력과 같은 주요 세포 기계가 결여되어 있다. 일차 인간 AT2s는 섬유아세포1,14의 존재 하에 3D 구체에서 배양될 수 있지만, 현재까지 대부분의 배양물에서 노화되거나 세포 표현형을 잃는 그들의 경향 및 외래식 폐로부터의 제한된 접근성을 포함하여, 제한의 대상이 된다. 이러한 특성은 시험관 내 일차 AT2의 광범위한 채택에 장벽을 제시하지만, 일차 AT215,16,17,18의 확장을 위해 피더가없는 3D 문화를 최적화하는 데 최근 진전이 이루어졌습니다.
지시된 분화 프로토콜은 인간 유도 만능 줄기 세포 (iPSC) 유래 제2형 폐포 상피 세포 (iAT2s)19를 생성하기 위해 생체내 발달 이정표를 재구성하기 위해 개발되었다. iAT2s는 섬유아세포 피더의 부재 하에서, CHIR99021, KGF, 덱사메타손, cAMP, 및 3-이소부틸-1-메틸크산틴(IBMX)을 함유하는 정의된 배지에서 3D 무혈청 배양물에서 자가쇄구로서 성장하며, 섬유아세포 피더의 부재 하에서, >20계대 동안 배양될 수 있다. 또한, iAT2는 인간 성인 일차 AT2와 전사체 프로그램을 공유하고, 라멜라체를 형성하며, 계면활성제19,21,22를 생산 및 포장한다. 이 프로토콜은 세포를 단일 셀 현탁액에 해리시킴으로써 iAT2s의 직렬 패시징을 상세히 기술한다. 이 시점에서, iAT2s는 3D 배양물에서 추가로 재충전되고 확장되거나 2D ALI 배양물(23)에 플레이팅될 수 있다. 이들 방법은 항상성 및 질환(20,22)에서 AT2s의 내재적 생물학을 연구하고, 이전에 보여진 바와 같이, 확장 가능하고, 생리학적으로 관련된 플랫폼(23,24)에서 화합물 또는 자극의 효과를 조사하는데 사용될 수 있다.
프로토콜
인간 iPSC 라인의 분화를 수반하는 모든 실험은 보스턴 대학의 기관 검토 위원회(프로토콜 H33122)에 따라 수행되었다. iPSCs로 재 프로그래밍하기 위해 조달 된 진피 섬유 아세포는 워싱턴 대학 의과 대학의 인간 연구 보호 사무소의 승인하에 서면 동의하에 기증자로부터 얻어졌으며, 세인트 루이스, 미주리주 세인트 루이스. 재 프로그래밍 된 iPSC는 보스턴 대학의 재생 의학 센터와 보스턴 메디컬 센터, 보스턴, 매사추세츠에서 생성되었습니다.
1. 폐포권 해리
- 표 1에 언급된 조성물에 따라 완전한 무혈청 분화 배지(cSFDM)를 제조하였다.
- 표 2에 따라 제조된 cSFDM 베이스에서 CK+DCI 배지를 준비한다.
- 실험 요구에 따라 얼음 위에 2D(인간 배아 줄기 세포 한정) 및/또는 3D(성장 인자 감소) 매트릭스를 해동합니다.
- 모든 CK+ DCI 배지를 12-웰 플레이트에서 유도된 분화19로부터 유래된 폐포권을 함유하는 3D 매트릭스 액적으로부터 진공으로 피펫 또는 흡인 피펫을 사용하여 흡인한다.
- 액적 당 디스파제 1 mL (2 mg / mL)를 첨가하십시오. P1000 피펫을 사용하여 디스파제 내로 액적을 부드럽게 피펫팅한다. 37°C에서 1시간 동안 인큐베이션하고, 30분 후에 1회 상하로 피펫팅한다.
- 해리된 오가노이드(단계 1.5로부터)를 디스파제 내의 하나의 매트릭스 액적으로부터 15 mL 원뿔형 튜브로 옮긴다. 세척하려면 Iscove의 변형 둘베코 배지 10mL를 첨가하십시오 (IMDM, 재료 표 참조).
- 실온에서 5분 동안 300 x g 에서 원심분리한다. 진공 상태에서 피펫 또는 흡기 피펫을 사용하여 상층액을 흡인하여 가능한 한 적은 상청액을 남겨 둡니다.
참고: 남아있는 디스파아제는 세포가 후속적으로 시딩될 매트릭스를 용해시킬 수 있으므로 모든 디스파아제를 제거하는 것이 중요하다. 펠릿 위에 투명한 헤이즈가 보이면, 디스파아제는 매트릭스를 완전히 용해시키지 못하고, 더 많은 디스파아제가 37°C에서 또 다른 20-30분 동안 펠릿에 첨가될 수 있다. - 세포를 액적 당 0.05% 트립신 1 mL에 재현탁시키고 다시 12-웰 플레이트로 옮긴다. 37°C에서 12-15분 동안 인큐베이션한다. 현미경으로 해리를 관찰하십시오. 이 단계에서 세포를 과도하게 피펫팅하지 마십시오.
참고 : 배양이 끝나면 세포는 P1000 피펫으로 3-5 번 피펫팅 한 후 단일 세포 현탁액을 달성해야합니다. iAT2s를 ALI로 계대배양하기 위해(단계 3), 트립신화 시간은 최소화될 필요가 있고(최대 12분), 따라서 세포는 세포 배양 인서트 상에 플레이팅할 준비가 되었을 때 단세포 현탁액이 아닌 2-3-세포 덩어리에 있다. - 동일한 부피의 FBS 함유 배지 (DMEM에서 10 % ES 인증 FBS)로 트립신의 작용을 중단하십시오. 실온에서 5분 동안 300 x g 에서 원심분리한다.
- 세포를 10 mL의 IMDM으로 세척한다. 실온에서 5분 동안 300 x g 에서 원심분리한다.
- 세포를 계수를 위해 적절한 부피로 재현탁시킨 다음, 혈구분석기를 사용하여 세포를 계수한다( 표 참조).
참고: 400 세포/μL에 시딩된 하나의 합류형 50 μL 매트릭스 액적에서, 예상 수율은 액적 당 500,000 내지 1.5 x 106 세포이다. - iAT2 세포의 단일 세포 현탁액을 사용하여 3D 매트릭스에 도금(단계 2) 및/또는 ALI 배양을 위한 세포 배양 인서트에 도금(단계 3)하여 폐포권을 생성한다.
2.3D iAT2s의 도금
- 카운팅 후(단계 1.11), 3D 매트릭스(12웰 플레이트의 웰당 50-100μL의 3D 매트릭스 액적이 있는 매트릭스의 400 셀/μL)에서 재플레이트할 원하는 세포의 수를 결정한다. 세포를 실온에서 5분 동안 300 x g 에서 원심분리한다. 피펫을 사용하여 가능한 한 많은 상층액을 제거하십시오.
- 셀을 3D 행렬에 재현탁합니다. 필요한 경우 매트릭스가 중합되는 것을 방지하기 위해 얼음 위에 신속하게 재현탁하십시오 (따뜻할 때 발생).
- P200 피펫을 사용하여 웰당 하나의 3D 매트릭스 액적을 미리 예열된 12웰 플레이트에 분배합니다. 매트릭스 액적에 거품이 생기지 않도록 조심스럽게 피펫을 만듭니다. 여러 방울을 분배하는 동안 세포 현탁액이 침전되지 않도록하십시오.
- 플레이트를 37°C 인큐베이터에 20-30분 동안 두어 매트릭스 액적이 중합되도록 한다.
- 웰 당 1 mL의 CK+DCI + 10 μM의 Y-27632 배지 ( 물자의 표 참조)를 첨가하여 매트릭스 액적을 덮는다.
- 72시간 후, 배지를 10 μM의 Y-27632 없이 CK+DCI로 변경한다.
- 매체를 48-72시간마다 신선한 CK + DCI로 교체하십시오.
참고: iAT2는 일반적으로 세포주 및 도금 밀도에 따라 대략 10-14일마다 계대되어야 합니다.
3. iAT2를 ALI로 통과
- Dulbecco의 변형 이글 배지/영양 혼합물 F-12(DMEM/F12)에 있는 2D 매트릭스를 2D 매트릭스에 대한 제조업체의 지침에 따라 작업 용액으로 희석하여 사용 1시간 전에 새로 코팅된 6.5mm 세포 배양 인서트를 준비 합니다(재료 표 참조). 이어서, 6.5 mm 세포 배양 인서트 당 희석된 매트릭스 100 μL를 첨가하였다. 매트릭스가 37°C 인큐베이터에서 30분 동안 또는 실온에서 1시간 동안 중합되도록 허용한다.
- 진공 피펫 또는 흡기 피펫을 사용하여 세포 배양 인서트에서 여분의 매트릭스를 흡인하고 DMEM / F12로 한 번 헹구십시오. 세포를 추가하기 직전에이 세척을 흡인하십시오.
- 계수한 후, 배양 인서트에 원하는 수의 세포를 시드하는 데 필요한 세포의 수를 결정하십시오 (520,000 개의 살아있는 세포 / cm2, 6.5 mm 세포 배양 삽입물 당 172,000 개의 살아있는 세포와 동일). 세포를 실온에서 5분 동안 300 x g에서 원심분리한다. 가능한 한 많은 상청액을 제거하십시오.
- 세포를 세포 배양 인서트 당 100μL의 CK + DCI + 10 μM Y-27632로 시드하기 위해 적절한 부피로 재현탁시킨다(세포 현탁액은 1,720 세포/μL이어야 함). 세포 배양 인서트의 정점 구획에 100 μL를 첨가한다. 플레이트를 교차 패턴으로 부드럽게 교반하여 세포 배양 삽입물을 가로질러 세포의 균일한 분포를 보장하고, 이를 현미경으로 4x 객관적으로 확인함으로써 확인한다.
참고: 시딩 밀도는 매우 중요하며 6.5mm 세포 배양 인서트당 160,000-300,000개 세포 범위의 최적화가 필요할 수 있습니다. 칼세인 그린 ( 물질의 표 참조) 세포 투과성 염료는 세포에 첨가되고 시딩 후 세포를 시각화하기 위해 거꾸로 형광 현미경으로 볼 수 있습니다. - 500 μL의 CK+DCI + 10 μM의 Y-27632를 각 세포 배양 인서트의 기저측 구획에 첨가한다.
- 흡인물 정수리 CK + DCI + 10 μM의 Y-27632 배지를 48시간 시딩한 후 피펫을 사용하여 ALI ("에어리프트"로 알려짐)를 개시한다.
참고: 이 시점에서 셀은 100% 합류해야 합니다. 세포가 100% 합류하지 않은 경우, 단계 3.7-3.8은 여전히 지시된 시점에서 수행되어야 한다; 합류 세포 단일층은 형성하는데 더 오래 걸릴 수 있다. - 72시간 후에 Y-27632 배지의 기저측성 CK+DCI+10 μM을 10 μM Y-27632가 없는 CK+DCI로 변경한다.
참고 : 정점 측에 매체의 "누출"이있는 경우 최소한이어야합니다. 그러나 처음 며칠 동안 이런 일이 발생하면 더 이상 누출이 없을 때까지 매일 정점 쪽을 계속 흡인하십시오. - 기저 측부 배지를 48-72 시간마다 신선한 CK + DCI로 교체하십시오.
참고: ALI 배양에 사용되는 iAT2는 도금 후 5-14일에 최대한으로 성숙됩니다. - 필요한 경우 더 장기간의 실험을 위해 최대 28 일 동안 도금 후 최대 28 일 동안 신중하게 모니터링하여 세포를 유지하십시오.
참고: 삽입물의 가장자리에서 떨어진 세포의 박리 또는 단층에 구멍 형성과 같은 ALI 실패의 가시적 징후는 배양에서 지나치게 연장 된 시간 후에 관찰 될 수 있으며,이 시점에서 ALI는 더 이상 실험에 사용할 수 없습니다.
결과
iAT2s를 단일 세포 현탁액으로 계대시킨 다음, ALI 배양을 위한 세포 배양 인서트 상에서 3D 매트릭스 또는 2D로 재충전하였다(그림 1). 단일 세포 해리 후, iAT2s를 유세포 분석기에 의해 분석하였다. 간략하게, 세포를 칼세인 블루 생존력 염료(1:1000)와 함께 포스페이트 완충 식염수(PBS)의 1% 태아 소 혈청(FBS)에 재현탁시키고, 유세포 분석기, 비단편, 단일항 및 tdTomato에 대한 게이팅을 분석하였다. 여기서, 일례로, SPC2 라인(SPC2-ST-B2 클론20)은 배양 중 시간에 따른 AT2 프로그램의 시각화 및 추적의 용이성을 위해 내인성 SFTPC 유전자좌를 표적으로 하는 tdTomato 리포터를 갖는다(도 2A). iAT2 SFTPC-tdTomato 발현은 구체로서 3D 매트릭스에서 격판될 때(도 2B) 및 세포 배양 인서트에 플레이팅될 때(도 2C) 유지되었다. 경상피 전기 저항(TEER)은 ALI 배양의 완전성을 결정하기 위해 측정될 수 있다(도 2D). TEER를 측정하기 위해, 전압옴계를 사용하였고( 표 재질 참조), 100 μL의 CK+ DCI 배지를 정점 챔버에 첨가하였다. 시딩된 세포의 부재 하에 마트리겔로 코팅된 세포 배양 인서트를 블랭크로서 처리하였다. 독서는 모든 우물의 세 곳에서 이루어졌습니다.

그림 1: 프로토콜 워크플로의 개략적인 표현. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
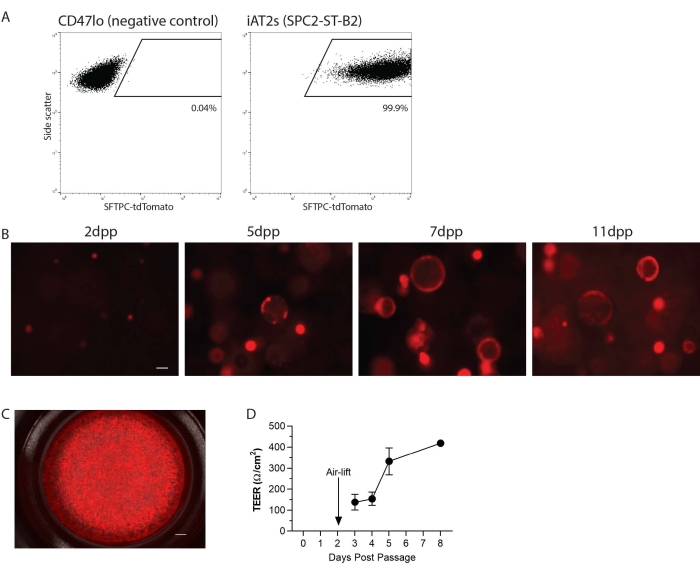
그림 2: 프로토콜의 대표적인 결과. (a) 3D로 배양된 인간 유도만능줄기세포 유래 제2형 폐포 상피유사세포(iAT2s)에서 SFTPC-tdTomato에 대한 대표적인 유세포분석 결과. 나타난 음성 대조군은 비폐 내배엽 (CD47lo)이다. (b) 계대 후 다양한 날(dpp)에서 3D로 배양된 iAT2s의 대표적인 살아있는 세포 이미징 (SFTPC-tdTomato, 스케일 바 = 50 μm). (c) 공기-액체 계면에서 플레이팅된 iAT2s의 대표적인 라이브 셀 이미징 (SFTPC-tdTomato, 스케일 바 = 500 nm). (d) 공기-액체 계면에 도금된 iAT2s의 대표적인 경상피 전기 저항. n = 3, 오류 막대는 표준 편차를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 시약 | 500 mL의 부피 | 최종 농도 |
| Iscove의 Modified Dulbecco's Medium (IMDM) | 375 mL | 75% |
| 햄의 F-12 영양 혼합물 (F12) | 125 mL | 25% |
| B-27 (RA 포함) 보충 교재 | 5 mL | 1% |
| N-2 보충 교재 | 2.5 mL | 0.50% |
| BSA (7.5% 주식) | 3.3 mL | 0.05% |
| 프리모신 (50 mg/mL 스톡) | 1 mL | 100 μg/mL |
| 글루타맥스 (100x 재고) | 5 mL | 1배 |
| 아스코르브산 (50 mg/mL 스톡) | 500 μL | 50 μg/mL |
| 1-티오글리세롤 (MTG) (IMDM 2 mL 중 26 μL로부터) | 1.5 mL | 4.5 x 10-4 엠 |
표 1: 완전한 무혈청 분화 배지(cSFDM)의 조성.
| 시약 | 최종 농도 |
| CHIR99021 | 3 μM |
| rhKGF | 10 ng/mL |
| 덱사메타손 | 50 nM |
| 8-브로모아데노신 30,50-사이클릭 모노포스페이트 나트륨염(cAMP) | 0.1 밀리지미터 |
| 3-이소부틸-1-메틸크산틴 (IBMX) | 0.1 밀리지미터 |
표 2: CK+DCI 매질의 조성물.
토론
AT2s는 폐 항상성을 유지하며, 이러한 주요 폐포 세포의 기능 장애는 다양한 폐 질환을 유발하고 유발할 수 있습니다. 일차 인간 AT2에 액세스하고 격리하는 것이 어렵기 때문에 iAT2가 생성됩니다. 다른 곳(25 )에 기술된 지시된 분화 방법 및 여기에 기술된 확장 및 세포 시딩을 적용함으로써, 임의의 개체로부터 생성된 iPSCs는 견고하게 자가-재생 iAT2s로 분화될 수 있고, 따라서 기본적인 생물의학 연구 발달 연구, 질병 모델링, 세포 기반 요법, 또는 약물 스크린을 포함하는 생물의학 연구를 위한 환자 특이적 세포를 제공한다. 본 프로토콜은 iAT2를 단일 세포 현탁액에 해리시키는 방법을 상세히 설명하며, 이는 세포 확장을 위한 폐포권을 생성하기 위해 3D 마트리겔에서 재충전되거나 추가 실험을 위해 2D ALI 배양물에서 재충전될 수 있다.
이 프로토콜에는 3D 및 ALI 문화권 모두에서 성공적인 패시징 및 리플레이팅을 보장하기 위한 몇 가지 중요한 단계가 있습니다. 과도한 피펫팅은 세포 생존력을 감소시킬 수 있으므로 기계적 분쇄를 최소화해야합니다. 또한, 3D 및 2D ALI 배양물 둘 다에서 iAT2s의 시딩 밀도는 매우 중요하다; 일반적으로 3D 배양의 경우 400 세포 / μL의 3D 마트리겔이 대부분의 iPSC 라인에 최적입니다. 그러나 100-500 cells/μL의 밀도 범위는 때때로 성공적이었으며 다른 세포주에 대해 밀도를 최적화해야 할 수도 있습니다. ALI 배양의 경우, 세포 배양 인서트 상의 iAT2s의 시딩 밀도를 최적화하는 것은 또한 시딩 후 48 h 후(즉, 공수 당일에) 세포의 합류 단일층을 달성하는 데 필수적이다. 일부 iAT2 라인은 삽입 당 더 많은 셀이 필요합니다. 따라서 문제 해결이 필요한 경우 24웰 세포 배양 인서트에 대해 160,000-300,000 세포/삽입물의 범위를 사용하는 것이 좋습니다. 3D 배양물은 또한 3D 매트릭스의 400 cells/μL에서 시딩 밀도를 유지하고 매트릭스 액적 크기를 각각 25 μL 및 20 μL로 감소시킴으로써 24웰 및 48웰 플레이트로 스케일링할 수 있다. ALI 배양물은 각 인서트를 매트릭스 30μL로 코팅하고, 인서트 당 30μL에 80,000개의 세포를 플레이팅하고, 웰당 150μL의 기저측성 배지로 공급함으로써 96웰 세포 배양 인서트로 스케일링할 수 있다. 시딩 밀도와 매트릭스 및 매체 부피는 다른 플레이트 형식에 따라 스케일링되고 최적화되어야 합니다.
이 프로토콜의 한계는 ALI 플레이팅에 사용되는 세포가 iAT2 ALI를 형성하기 위해 NKX2-1+ 및 SFTPC+19,20,21,23이 되도록 충분히 정제되어야 하고, ALI 배양 형성은 라인마다 다를 수 있다는 것이다. 또한, 이 프로토콜은 AT2 전용 배양물의 확장 및 생성을 허용하여, 단일 주요 폐포 세포 유형에 기초한 환원주의 모델 시스템을 제공한다. 중요하게도, 폐포 유형 1 세포와 같은 다른 관련 폐포 세포 유형이 이러한 플랫폼에서 누락되었다는 것입니다. 다른 그룹들은 섬유아세포가 있거나 없는 구상체 또는 유기형 배양물로서 일차 인간 AT2s를 배양하는 데 성공하였고 1,14,15,16,17; 그러나, 일차 인간 AT2s는 ALI 조건(26) 없이 정상 2D 배양물에서 배양될 때 주요 계면활성제의 발현을 잃는 경향이 있다. 더욱이, 최근의 연구는 iAT2가 신선하고 배양되지 않은 인간 일차 AT2s(27)보다 더 높은 증식 마커 및 더 낮은 AT2 성숙 마커를 발현한다는 것을 보여주었다. iAT2s와 신선한 일차 인간 AT2 사이의 이러한 차이에도 불구하고, 우리는 배양된 일차 AT2조차도 신선하고 배양되지 않은 일차 AT27로부터의 전사체 차이를 나타냈다는 것을 발견하였고, 따라서 이들 시험관내 모델은 생체내 폐 생물학 모델링을 위한 다양한 강점과 한계를 갖는다는 결론을 내렸다.
iAT2 플랫폼은 환자 유래 iPSCs19,20으로부터의 유전자 돌연변이를 연구하는데 적용될 수 있다. 이 시스템은 또한 높은 처리량의 약물 스크리닝을 수용하도록 실질적으로 확장될 수 있다. 또한, iAT2 ALI는 바이러스 또는 박테리아 감염 또는 담배 연기, 전자 담배 증기 또는 기타 에어로졸(23)에 대한 노출과 같은 환경 노출에 적합하다. 요약하면, iAT2s의 3D 및 2D ALI 배양물을 모두 생성하기 위한 이 프로토콜은 질병 관련 세포 유형의 장기 배양을 허용하고, 많은 애플리케이션에서 이들 세포의 사용을 가능하게 하는 생리학적, 확장 가능한 플랫폼을 제공한다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
윌슨, 코튼, 호킨스 연구소의 회원들에게 도움이 되는 토론에 진심으로 감사드립니다. 우리는 또한 Greg Miller (CReM 실험실 관리자)와 Marianne James (iPSC Core Manager)에게 귀중한 지원에 대해 매우 감사드립니다. 세포 분류에 대한 기술 지원을 해주신 Brian Tilton과 BUMC Flow Cytometry Core에 감사드립니다 (NIH 보조금 #1S10OD021587-01A1 지원). 이 작업은 RBW에 수여 된 호주 국립 건강 및 의학 연구위원회 (Australian National Health and Medical Research Council)의 CJ Martin Early Career Fellowship의 지원을 받았습니다. KMA에 NIH 그랜트 F30HL147426; 폐 섬유증 재단의 I.M. Rosenzweig 주니어 연구자 상과 보스턴 대학 임상 및 번역 과학 연구소 (1UL1TR001430)를 통해 KDA에 통합 파일럿 보조금 상; 스위스 국립 과학 재단 (P2ELP3_191217) - ABA; NIH는 DNK에 U01HL148692, U01HL134745, U01HL134766 및 R01HL095993을 부여합니다. NIH는 AAW에 수여되는 U01TR001810, R01DK101510 및 R01DK117940을 부여합니다. iPSC 유지 보수, 은행 업무 및 공유는 NIH 보조금 NO1 75N92020C00005에 의해 지원됩니다. 그림 1은 Biorender.com 를 사용하여 만든 것입니다.
자료
| Name | Company | Catalog Number | Comments |
| 3-Isobutyl-1-methylxanthine (IBMX) | Sigma | I5879 | For CKDCI |
| 12 Well Cell Culture Plate | Corning | 3513 | Plates for culturing |
| 1-Thioglycerol (MTG) | M6145 | Sigma | For CKDCI |
| 2D Matrigel (matrix) - Matrigel hESC-Qualified Matrix | Corning | 8774552 | To coat ALI Transwells |
| 3D Matrigel (matrix) - Growth Factor Reduced Matrigel | Corning | 356230 | To grow iAT2 spheres in |
| 8-bromoadenosine 30,50-cyclic monophosphate sodium salt (cAMP) | Sigma | B7880 | For CKDCI |
| Ascorbic Acid | A4544 | Sigma | For CKDCI |
| B27 w/out retinoic acid | Life Technologies | 12587-010 | For CKDCI |
| Bovine Serum Albumin (BSA) (7.5%) | Thermo Fisher | 15260037 | For CKDCI |
| Calcein blue | Life Technologies | C1429 | For live/dead discrimination in flow cytometry |
| Calcein green | Life Technologies | C1430 | Optional visualisation of cells on cell culture insert |
| Cell culture inserts - Costar 6.5 mm Clear Transwells with 0.4 µm pore size | Millipore-Sigma | CLS3470-48EA | ALI transwells |
| CHIR99021 | Tocris | 4423 | For CKDCI |
| Dexamethasone | Sigma | D4902 | For CKDCI |
| Dispase (2 mg/mL) | Thermo Fisher | 354235 | To dissolve matrigel |
| Dulbecco's Modified Eagle Medium (DMEM) | Thermo Fisher | 11995 | To make trypsin inactivation media (10% FBS in DMEM) |
| Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12 (DMEM/F12) | Thermo Fisher | A4192002 | To wash |
| Dulbecco's phosphate buffered saline (PBS) | Thermo Fisher | 14190 | For flow cytometric analyses |
| Fetal bovine serum (FBS) (Hyclone charaterized) | GE Healthcare Life Sciences | SH30071.03 | To make trypsin inactivation media (10% FBS in DMEM) |
| Glutamax | Life Technologies | 35050-061 | For CKDCI |
| Ham's F-12 Nutrient Mixture (F12) | Cellgro | 10-080-CV | For CKDCI |
| Hemocytometer | Fisher | 02-671-6 | For cell counting |
| Invivogen Primocin 1 G (50 mg/mL) | Fisher Scientific | NC9392943 | For CKDCI |
| Iscove's Modified Dulbecco's Medium (IMDM) | Thermo Fisher | 12440053 | For CKDCI |
| Millicell ERS-2 Voltohmeter | Millipore | MERS00002 | To measure trans-epithlial electrical resistance |
| N2 supplement | Life Technologies | 17502-048 | For CKDCI |
| Recombinant human KGF | R&D Systems | 251-KG-010 | For CKDCI |
| Retinoic acid | Sigma | R2625 | For CKDCI |
| Trypan blue | Thermo Fisher | 15250061 | For cell count during passaging |
| Trypsin-EDTA (0.05%) | Gibco | 25-300-062 | To dissociate iAT2 spheres |
| Y-27632 dihydrochloride | Tocris | 1254 | Add to cells after passaging |
참고문헌
- Barkauskas, C. E., et al. Type 2 alveolar cells are stem cells in adult lung. Journal of Clinical Investigation. 123 (7), 3025-3036 (2013).
- Mason, R. J., Williams, M. C. Type II alveolar cell. Defender of the alveolus. American Review of Respiratory Disease. 115 (6), 81-91 (1977).
- Nogee, L. M., et al. A mutation in the surfactant protein C gene associated with familial interstitial lung disease. New England Journal of Medicine. 344 (8), 573-579 (2001).
- Nogee, L. M., et al. A mutation in the surfactant protein B gene responsible for fatal neonatal respiratory disease in multiple kindreds. Journal of Clinical Investigation. 93 (4), 1860-1863 (1994).
- Shulenin, S., et al. ABCA3 gene mutations in newborns with fatal surfactant deficiency. New England Journal of Medicine. 350 (13), 1296-1303 (2004).
- Nureki, S. I., et al. Expression of mutant Sftpc in murine alveolar epithelia drives spontaneous lung fibrosis. Journal of Clinical Investigation. 128 (9), 4008-4024 (2018).
- Katzen, J., et al. An SFTPC BRICHOS mutant links epithelial ER stress and spontaneous lung fibrosis. Journal of Clinical Investigation Insight. 4 (6), 126125 (2019).
- Mathis, C., et al. Human bronchial epithelial cells exposed in vitro to cigarette smoke at the air-liquid interface resemble bronchial epithelium from human smokers. American Journal of Physiology-Lung Cellular and Molecular Physiology. 304 (7), 489-503 (2013).
- Purkayastha, A., et al. Direct exposure to SARS-CoV-2 and cigarette Smoke increases infection severity and alters the stem cell-derived airway repair response. Cell Stem Cell. 27 (6), 869-875 (2020).
- Matrosovich, M. N., Matrosovich, T. Y., Gray, T., Roberts, N. A., Klenk, H. D. Human and avian influenza viruses target different cell types in cultures of human airway epithelium. Proceedings of the National Academy of Sciences. 101 (13), 4620-4624 (2004).
- Tollstadius, B. F., Silva, A. C. G. d., Pedralli, B. C. O., Valadares, M. C. Carbendazim induces death in alveolar epithelial cells: A comparison between submerged and at the air-liquid interface cell culture. Toxicology in Vitro. 58, 78-85 (2019).
- Winton, H. L., et al. Cell lines of pulmonary and non-pulmonary origin as tools to study the effects of house dust mite proteinases on the regulation of epithelial permeability. Clinical and Experimental Allergy. 28 (10), 1273-1285 (1998).
- Kanagaki, S., et al. Hydroxypropyl cyclodextrin improves amiodarone-induced aberrant lipid homeostasis of alveolar cells. American Journal of Respiratory Cell and Molecular Biology. 64 (4), 504-514 (2021).
- Sucre, J. M. S., et al. Successful establishment of primary type 2 alveolar epithelium with 3D organotypic co-culture. American Journal of Respiratory Cell and Molecular Biology. 59 (2), 158-166 (2018).
- Kobayashi, Y., et al. Persistence of a regeneration-associated, transitional alveolar epithelial cell state in pulmonary fibrosis. Nature Cell Biology. 22, 934-946 (2020).
- Choi, J., et al. Inflammatory signals induce AT2 cell-derived damage-associated transient progenitors that mediate alveolar regeneration. Cell Stem Cell. 27 (3), 366-382 (2020).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Katsura, H., et al. Human lung stem cell-based alveolospheres provide insights into SARS-CoV-2-mediated interferon responses and pneumocyte dysfunction. Cell Stem Cell. 27 (6), 890-904 (2020).
- Jacob, A., et al. Differentiation of human pluripotent stem cells into functional lung alveolar epithelial cells. Cell Stem Cell. 21 (4), 472-488 (2017).
- Alysandratos, K. -. D., et al. Patient-specific iPSCs carrying an SFTPC mutation reveal the intrinsic alveolar epithelial dysfunction at the inception of interstitial lung disease. Cell Reports. 36 (9), 109636 (2021).
- Hurley, K., et al. Reconstructed single-cell fate trajectories define lineage plasticity windows during differentiation of human PSC-derived distal lung progenitors. Cell Stem Cell. 26 (4), 593-608 (2020).
- Sun, Y. L., et al. Heterogeneity in human iPSC-derived alveolar epithelial type II cells revealed with ABCA3/SFTPC reporters. American Journal of Respiratory Cell and Molecular Biology. 65 (4), 442-460 (2021).
- Abo, K. M., et al. Human pluripotent stem cell-derived alveolar type 2 cells mature and respond to environmental exposures in air-liquid interface culture. Journal of Clinical Investigation Insight. 7 (6), (2022).
- Huang, J., et al. SARS-CoV-2 infection of pluripotent stem cell-derived human lung alveolar type 2 cells elicits a rapid epithelial-intrinsic inflammatory response. Cell Stem Cell. 27 (6), 962-973 (2020).
- Jacob, A., et al. Derivation of self-renewing lung alveolar epithelial type II cells from human pluripotent stem cells. Nature Protocols. 14 (12), 3303-3332 (2019).
- Beers, M. F., Moodley, Y. When is an alveolar type 2 cell an alveolar type 2 cell? A conundrum for lung stem cell biology and regenerative medicine. American Journal of Respiratory Cell and Molecular Biology. 57 (1), 18-27 (2017).
- Alysandratos, K. D., et al. Impact of cell culture on the transcriptomic programs of primary and iPSC-derived human alveolar type 2 cells. bioRxiv. , (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유