Method Article
Gerando esferas 3D e culturas de interface ar-líquido 2D de células-tronco pluripotentes induzidas pelo homem
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O presente protocolo descreve células pluripotentes pluripotentes induzidas por células-tronco derivadas do tipo 2 (iAT2s). Essas células podem ser cultivadas como esferas de auto-renovação na cultura 3D ou adaptadas à cultura de interface ar-líquido (ALI).
Resumo
No pulmão, o epitélio alveolar é uma barreira física a partir de estímulos ambientais e desempenha um papel essencial na homeostase e na doença. As células epiteliais alveolares tipo 2 (AT2s) são os progenitores facultativos do epitélio pulmonar distal. Disfunção e lesão de AT2s podem resultar e contribuir para várias doenças pulmonares. A melhor compreensão da biologia AT2 é, portanto, fundamental para a compreensão da biologia pulmonar e das doenças; no entanto, os AT2 humanos primários são geralmente difíceis de isolar e limitados na oferta. Para superar essas limitações, as células-tronco pluripotentes induzidas pelo homem (iPSC) derivadas do tipo 2 das células epiteliais alveolares (iAT2s) podem ser geradas através de um protocolo de diferenciação direcionado que recapitula o desenvolvimento pulmonar vivo . Os iAT2s crescem em condições livres de alimentação, compartilham um programa transcriptômico com AT2s primários adultos humanos e executam funções-chave de AT2, como produção, embalagem e secreção de surfactante. Este protocolo detalha os métodos para manter iAT2s auto-renovador através da passagem serial na cultura tridimensional (3D) ou adaptando iAT2s à cultura de interface ar-líquido (ALI). Uma suspensão unicelular de iAT2s é gerada antes de chapeamento em matriz de membrana de porão solubilizada em 3D (doravante referida como "matriz"), onde se auto-montam em esferas epiteliais monocamadas. iAT2s na cultura 3D podem ser dissociados em série em suspensões unicelulares para serem passagens ou banhadas na cultura 2D ALI. Na cultura ALI, iAT2s formam uma monocamada polarizada com a superfície apical exposta ao ar, tornando esta plataforma prontamente favorável a exposições ambientais. Assim, este protocolo gera uma oferta inesgotável de iAT2s, produzindo mais de 1 x 1030 células por célula de entrada ao longo de 15 passagens, mantendo o programa AT2 indicado pela expressãoSFTPC tdTomato . As células resultantes representam uma plataforma reprodutível e relevante que pode ser aplicada para estudar mutações genéticas, modelar exposições ambientais ou drogas de tela.
Introdução
No pulmão, as vias aéreas e as células epiteliais alveolares são as primeiras a encontrar exposições ambientais inaladas, incluindo patógenos transmitidos por aerossóis inalados e estímulos nocivos, como a fumaça do cigarro. As células epiteliais alveolares tipo 2 (AT2s) são essenciais na manutenção da homeostase pulmonar, pois são os progenitores facultativos do epitélio pulmonar distal, produzem surfactantes para aliviar a tensão da superfície alveolar e montam a resposta imune inata às exposições inaladas 1,2. No entanto, a disfunção AT2 pode resultar de lesões pulmonares ou mutações em genes que são expressos seletivamente em AT2s, como SFTPC, SFTPB e ABCA3 3,4,5. Abordagens anteriores para estudar essas mutações genéticas se basearam em modelos de camundongos6 ou vetores projetados, contendo mutação introduzidos nas linhas celulares imortalizadas7. Portanto, plataformas que possam modelar os efeitos das perturbações genéticas e ambientais nos AT2s nos tipos celulares fisiologicamente relevantes e em um sistema in vitro produtivo são necessárias para entender melhor o papel que os AT2s desempenham na saúde e na doença.
Em termos de modelagem de exposições aéreas, culturas de interface ar-líquido (ALI) de células epiteliais das vias aéreas primárias foram utilizadas com sucesso para revelar as principais respostas moleculares à fumaçado cigarro 8 e ao modelo de infecção das vias aéreas 9,10. Um sistema de cultura ALI comparável para o epitélio alveolar, um local-chave de infecção ou lesão na doença, é muito menos desenvolvido em comparação com o sistema modelo epitelial das vias aéreas. As linhas celulares imortalizadas foram cultivadas na ALI como um proxy para o epitélio alveolar11,12, mas essas linhas celulares são transcritomicamente distintas das células epiteliais alveolares primárias13 e carecem de máquinas celulares chave, como a capacidade de secretar surfactantes ou formar junções apertadas no ALI12. Os AT2s humanos primários podem ser cultivados em esferas 3D na presença de fibroblastos 1,14, mas estão sujeitos a limitações, incluindo a acessibilidade limitada de pulmões explant e sua tendência a senesce ou perda de fenótipo celular na maioria das culturas até hoje. Essas características apresentam barreiras à adoção generalizada de estudos in vitro on-vitro primários AT2, embora tenham sido feitos progressos recentes na otimização das culturas 3D livres de alimentadores para a expansão dos AT2s primários 15,16,17,18.
Protocolos de diferenciação direcionados foram desenvolvidos para recapitular marcos in vivo de desenvolvimento para gerar células-tronco pluripotentes induzidas pelo homem (iPSC) derivadas células epiteliais tipo 2 (iAT2s)19. iAT2s crescem como esferas auto-renovadores na cultura livre de soro 3D em um meio definido contendo CHIR99021, KGF, dexammethasona, cAMP e 3-isobutyl-1-metilxanthine (IBMX), denominados "CK + DCI"19, na ausência de alimentadores de fibroblastos e podem ser cultivados por >20 passagens20,21. Além disso, os iAT2s compartilham um programa transcriptômico com AT2s primários adultos humanos, formam corpos lamelares e produzem e embalamsurfactantes 19,21,22. Este protocolo detalha a passagem serial de iAT2s, dissociando as células a uma suspensão de células únicas. Neste ponto, iAT2s podem ser replacados e expandidos ainda mais na cultura 3D ou banhados na cultura 2D ALI23. Esses métodos podem ser usados para estudar a biologia intrínseca de AT2s em homeostase e doença20,22 e para interrogar os efeitos de compostos ou estímulos em uma plataforma escalável e fisiologicamente relevante 23,24, como já foi mostrado anteriormente.
Protocolo
Todos os experimentos envolvendo a diferenciação das linhas humanas do iPSC foram realizados em conformidade com o Conselho de Revisão Institucional da Universidade de Boston (protocolo H33122). Os fibroblastos dérmicos, adquiridos para reprogramação para iPSCs, foram obtidos de um doador com consentimento por escrito, sob a aprovação do Escritório de Proteção à Pesquisa Humana da Faculdade de Medicina da Universidade de Washington, St. Louis, MO. IPSCs reprogramados foram gerados no Center for Regenerative Medicine da Boston University e Boston Medical Center, Boston, MA.
1. Dissociação da alveolofera
- Prepare mídias completas de diferenciação sem soro (cSFDM) conforme a composição mencionada na Tabela 1.
- Prepare a mídia CK + DCI na base cSFDM preparada de acordo com a Tabela 2.
- Descongelar matriz 2D (célula-tronco embrionária humana) e/ou matriz 3D (fator de crescimento reduzido) no gelo, conforme necessário para as necessidades experimentais.
- Aspire todos os meios CK + DCI utilizando uma pipeta ou pipeta aspirando com vácuo das gotículas de matriz 3D contendo alveolosferas, derivadas da diferenciaçãodirecionada 19, em uma placa de 12 poços.
- Adicione 1 mL de dispase (2 mg/mL) por gotícula. Pipeta suavemente a gota na despase usando uma pipeta P1000. Incubar a 37 °C por 1h, tubulação para cima e para baixo uma vez após 30 min.
- Transfira os organoides dissociados (a partir da etapa 1.5) de uma gotícula de matriz no dispase para um tubo cônico de 15 mL. Para lavar, adicione 10 mL do Meio Modificado de Dulbecco (IMDM) da Iscove.
- Centrifugar a 300 x g por 5 min a temperatura ambiente. Aspire o supernatante usando uma pipeta ou pipeta aspirada com vácuo, deixando o mínimo de supernanato possível.
NOTA: É importante remover toda a despase restante, pois qualquer desame restante pode dissolver a matriz em que as células serão posteriormente semeadas. Se uma névoa clara for vista acima da pelota, a dispase não dissolveu completamente a matriz, e mais despase pode ser adicionado à pelota por mais 20-30 min a 37 °C. - Resuspenque as células em 1 mL de 0,05% de trippsina por gotícula e transfira de volta para a placa de 12 poços. Incubar a 37 °C por 12-15 min. Observe a dissociação sob um microscópio. Evite sobre-tubulação das células nesta fase.
NOTA: No final da incubação, as células precisam obter uma suspensão de célula única após a tubulação 3-5 vezes com uma pipeta P1000. Para a passagem de iAT2s para ALI (Passo 3), o tempo de trypsinização precisa ser minimizado (máximo de 12 minutos), de modo que as células estejam em aglomerados de 2-3 células em vez de suspensão de célula única quando prontas para chapeamento na inserção da cultura celular. - Pare a ação de trypsin com um volume igual de meio contendo FBS (FBS habilitados para ES de 10% no DMEM). Centrifugar a 300 x g por 5 min a temperatura ambiente.
- Lave as células com 10 mL de IMDM. Centrifugar a 300 x g por 5 min a temperatura ambiente.
- Resuspende as células em um volume apropriado para contar e, em seguida, conte as células usando um hemótmetro (ver Tabela de Materiais).
NOTA: De uma gotícula de matriz confluente de 50 μL semeada a 400 células/μL, o rendimento esperado é de 500.000 a 1,5 x 106 células por gotícula. - Use a suspensão unicelular de células iAT2 para gerar alveolosferas, chapeando na matriz 3D (Passo 2) e/ou emplacando em pastilhas de cultura celular para a cultura ALI (Passo 3).
2.3D revestimento de iAT2s
- Após a contagem (Passo 1.11), determine o número de células desejadas para se repelido na matriz 3D (400 células/μL da matriz com 50-100 μL de gotículas de matriz 3D por poço de uma placa de 12 poços). Centrifugar as células a 300 x g por 5 min a temperatura ambiente. Remova o máximo de supernaspes possível usando uma pipeta.
- Resuspend as células na matriz 3D. Resuspenque-se rapidamente e no gelo, se necessário, para evitar que a matriz polimerize (que ocorre quando quente).
- Use uma pipeta P200 para dispensar uma gotícula de matriz 3D por poço em uma placa pré-aquecida de 12 poços. Pipeta cuidadosamente para evitar criar bolhas na gotícula da matriz. Não permita que a suspensão da célula se acomode enquanto dispensa várias gotículas.
- Coloque a placa em uma incubadora de 37 °C por 20-30 min para permitir que as gotículas de matriz polimerizem.
- Adicione 1 mL de CK + DCI + 10 μM de meio Y-27632 (ver Tabela de Materiais) por poço para cobrir a gotícula da matriz.
- Após 72 h, mude o médio para CK + DCI sem 10 μM de Y-27632.
- Substitua o meio por CK + DCI fresco a cada 48-72 h.
NOTA: os iAT2s normalmente precisarão ser passagemdos aproximadamente a cada 10-14 dias, dependendo da linha celular e densidade de revestimento.
3. Passagem de iAT2s para ALI
- Prepare a cultura celular de 6,5 mm recém-revestida de 6,5 mm inserindo 1 h antes do uso, diluindo a matriz 2D na mistura de médio/nutrientes de Dulbecco F-12 (DMEM/F12) para a solução de trabalho de acordo com as instruções do fabricante para a matriz 2D (ver Tabela de Materiais). Em seguida, adicione 100 μL da matriz diluída por inserção de cultura celular de 6,5 mm. Deixe a matriz polimerizar em uma incubadora de 37 °C por 30 minutos ou em temperatura ambiente por 1h.
- Aspire a matriz de excesso da cultura celular inserida usando uma pipeta ou pipeta aspirada com vácuo e enxágue uma vez com DMEM/F12. Aspire esta lavagem imediatamente antes de adicionar as células.
- Após a contagem, determine o número de células necessárias para semear o número desejado de células nas pastilhas de cultura (520.000 células vivas/cm2, equivalente a 172.000 células vivas por inserção de cultura celular de 6,5 mm). Centrifugar as células a 300 x g por 5 min a temperatura ambiente. Remova o máximo de supernaspeso possível.
- Resuspenque as células no volume apropriado para a semente com 100 μL de CK + DCI + 10 μM Y-27632 por inserção de cultura celular (a suspensão celular deve ser de 1.720 células/μL ). Adicione 100 μL ao compartimento apical da inserção de cultura celular. Agitar suavemente a placa em um padrão cruzado para garantir uma distribuição uniforme das células através da inserção da cultura celular, e confirmá-la verificando sob um microscópio no objetivo 4x.
NOTA: A densidade de semeadura é crítica e pode exigir otimização, variando de 160.000-300.000 células por inserção de cultura celular de 6,5 mm. O corante permeável celular calcein (ver Tabela de Materiais) pode ser adicionado às células e visto em um microscópio fluorescente invertido para visualizar as células após a semeadura. - Adicione 500 μL de CK + DCI + 10 μM de Y-27632 ao compartimento basolateral de cada inserção de cultura celular.
- Aspirado apical CK + DCI + 10 μM de Y-27632 médio 48 h após semeadura usando uma pipeta para iniciar ALI (conhecido como "air-lift").
NOTA: As células devem ser 100% confluentes neste momento. Se as células não forem 100% confluentes, as etapas 3.7-3.8 ainda devem ser realizadas nos pontos de tempo indicados; monocamadas de células confluentes podem levar mais tempo para se formar. - Altere o basolateral CK + DCI + 10 μM de Y-27632 médio após 72 h para CK + DCI sem 10 μM Y-27632.
NOTA: Deve haver mínimo, se houver, "vazamento" de médio para o lado apical. No entanto, se isso ocorrer nos primeiros dias, continue aspirando o lado apical diariamente até que não haja mais vazamentos. - Substitua o meio basolateral por CK + DCI fresco a cada 48-72 h.
NOTA: Os iAT2s usados nas culturas ALI são amadurecidos ao máximo de 5 a 14 dias após o revestimento. - Mantenha as células com monitoramento cuidadoso por até 28 dias após o revestimento, se necessário, para experimentação mais prolongada.
NOTA: Sinais visíveis de falha de ALI, como o peeling das células longe da borda da inserção ou formação de orifícios na monocamada, podem ser observados após um tempo sobrecarregado na cultura, momento em que o ALI não é mais utilizável para experimentos.
Resultados
Os iAT2s foram passagemdos para uma suspensão unicelular e, em seguida, repartidos em matriz 3D ou em 2D em inserções de cultura celular para cultura ALI (Figura 1). Após dissociação unicelular, os iAT2s foram analisados por citometria de fluxo. Resumidamente, as células resuspendidas em 1% de soro bovino fetal (FBS) em soro salino tamponado de fosfato (PBS) com corante de viabilidade azul calcein (1:1000) foram analisadas em um citômetro de fluxo, gating para não fragmentos, singlets e tdTomato. Aqui, como exemplo, está a linha SPC2 (SPC2-ST-B2 clone20), que tem um repórter tdTomato direcionado ao lócus endógeno SFTPC para facilitar a visualização e rastreamento do programa AT2 ao longo do tempo na cultura (Figura 2A). A expressão iAT2 SFTPC-tdTomato foi mantida quando repartida na matriz 3D como esferas (Figura 2B) e quando banhada em pastilhas de cultura celular (Figura 2C). A resistência elétrica trans epitelial (TEER) pode ser medida para determinar a integridade da cultura ALI (Figura 2D). Para medir o TEER, utilizou-se um voltohmômetro (ver Tabela de Materiais), com 100 μL de CK + DCI médio adicionado à câmara apical. As pastilhas de cultura celular revestidas com Matrigel na ausência de células semeadas foram tratadas como espaços em branco. As leituras foram feitas em três locais em cada poço.

Figura 1: Representação esquemática do fluxo de trabalho do protocolo. Clique aqui para ver uma versão maior desta figura.
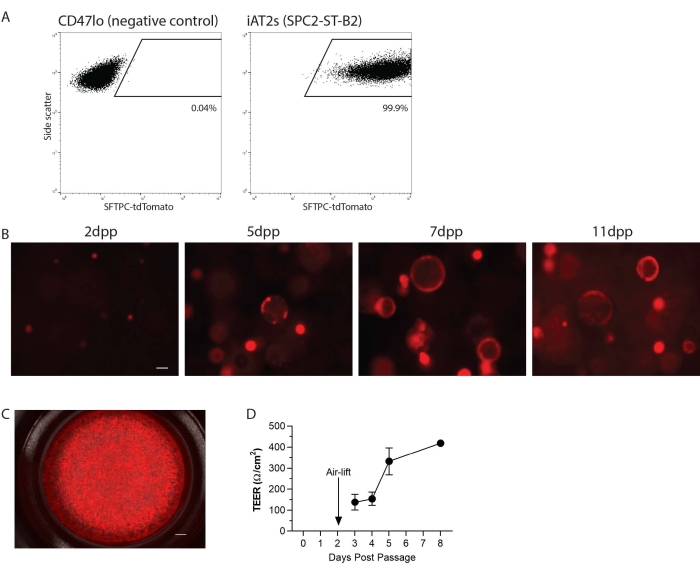
Figura 2: Resultados representativos do protocolo. (A) Resultados representativos de citometria de fluxo para SFTPC-tdTomato em células-tronco pluripotentes induzidas pelo homem pluripotentes tipo 2 células epiteliais (iAT2s) cultivadas em 3D. O controle negativo mostrado é o endodermia não pulmonar (CD47lo). (B) Imagem de células vivas representativas de iAT2s cultivadas em 3D em vários dias pós-passagem (dpp) (SFTPC-tdTomato, barra de escala = 50 μm). (C) Imagem de célula viva representativa de iAT2s banhados na interface ar-líquido (SFTPC-tdTomato, barra de escala = 500 nm). (D) Resistência elétrica trans-epitelial representativa de iAT2s banhados na interface ar-líquido. n = 3, as barras de erro indicam desvio padrão. Clique aqui para ver uma versão maior desta figura.
| Reagentes | Volume para 500 mL | Concentração final |
| Meio de Dulbecco Modificado de Iscove (IMDM) | 375 mL | 75% |
| Mistura de nutrientes F-12 do presunto (F12) | 125 mL | 25% |
| Suplemento B-27 (com RA) | 5 mL | 1% |
| Suplemento N-2 | 2,5 mL | 0.50% |
| BSA (7,5% de estoque) | 3,3 mL | 0.05% |
| Primocina (50 mg/mL de estoque) | 1 mL | 100 μg/mL |
| Glutamax (estoque de 100x) | 5 mL | 1x |
| Ácido ascórbico (50 mg/mL de estoque) | 500 μL | 50 μg/mL |
| 1-Thioglycerol (MTG) (a partir de 26 μL em 2 mL IMDM) | 1,5 mL | 4,5 x 10-4 M |
Tabela 1: Composição dos meios de diferenciação completos sem soro (cSFDM).
| Reagente | Concentração final |
| CHIR99021 | 3 μM |
| rhKGF | 10 ng/mL |
| Dexametasona | 50 nM |
| 8-bromoadenosine 30,50-cíclico monofosfato sal de sódio (cAMP) | 0,1 mM |
| 3-Isobutyl-1-metilxantina (IBMX) | 0,1 mM |
Tabela 2: Composições da mídia CK + DCI.
Discussão
Os AT2s mantêm a homeostase pulmonar, e a disfunção dessas células-chave alveolares pode causar e resultar de várias doenças pulmonares. Devido à dificuldade de acesso e isolamento dos AT2s humanos primários, são gerados iAT2s. Aplicando os métodos de diferenciação direcionados descritos em outros lugares25 e a expansão e a semeadura celular descritas aqui, os iPSCs gerados a partir de qualquer indivíduo podem ser diferenciados em iAT2s robustamente auto-renovador, fornecendo células específicas do paciente para pesquisas biomédicas, incluindo estudos básicos de desenvolvimento de pesquisas biomédicas, modelagem de doenças, terapias baseadas em células ou telas de drogas. O presente protocolo detalha um método para dissociar iAT2s a uma suspensão unicelular, que pode então ser replatado em Matrigel 3D para gerar alveolosferas para expansão celular ou repartido na cultura 2D ALI para outros experimentos.
O protocolo tem várias etapas críticas para garantir a aprovação e replação bem-sucedidas nas culturas 3D e ALI. A trituração mecânica deve ser minimizada, pois a tubulação excessiva pode diminuir a viabilidade celular. Além disso, a densidade de semeadura de iAT2s nas culturas 3D e 2D ALI é crítica; para a cultura 3D, em geral, 400 células/μL de 3D Matrigel é ideal para a maioria das linhas iPSC. No entanto, uma gama de densidades de 100-500 células/μL tem, por vezes, sido bem sucedida, e a otimização da densidade pode ser necessária para diferentes linhas celulares. Para a cultura ALI, otimizar a densidade de semeadura de iAT2s nas pastilhas de cultura celular também é essencial para alcançar uma monocamada confluente de células 48 h após a semeadura (ou seja, no dia do levantamento de ar). Algumas linhas iAT2 requerem mais células por inserção; assim, se for necessária uma solução de problemas, recomenda-se uma faixa de 160.000-300.000 células/inserções para inserções de cultura celular de 24 poços. As culturas 3D também podem ser dimensionadas para placas de 24 e 48 poços mantendo a densidade de semeadura em 400 células/μL de matriz 3D e reduzindo o tamanho da gotícula matriz para 25 μL e 20 μL, respectivamente. As culturas ALI podem ser dimensionadas para inserções de cultura celular de 96 poços, revestindo cada inserção com 30 μL da matriz, emplacando 80.000 células em 30 μL por inserção, e alimentando-se com 150 μL de mídia basolateral por poço. A densidade de semeadura e os volumes de matriz e mídia precisam ser dimensionados e otimizados de acordo para outros formatos de placas.
Uma limitação deste protocolo é que as células utilizadas para o revestimento ALI devem ser suficientemente purificadas para serem NKX2-1+ e SFTPC+19,20,21,23 para formar ALIs iAT2, e a formação da cultura ALI pode variar de linha para linha. Além disso, este protocolo permite a expansão e geração de culturas somente AT2, fornecendo um sistema de modelo reducionista baseado em um único tipo de célula alveolar chave. É importante ressaltar que outros tipos relevantes de células alveolares, como células alveolares tipo 1, estavam faltando nessas plataformas. Outros grupos tiveram sucesso em cultivar AT2s humanos primários como esferoides ou culturas organotípicas com ou sem fibroblastos 1,14,15,16,17; no entanto, os AT2s humanos primários tendem a perder sua expressão de surfactantes-chave quando cultivados na cultura 2D normal sem condiçõesALI 26. Além disso, trabalhos recentes mostraram que os iAT2s expressam marcadores proliferativos mais elevados e marcadores de maturação AT2 mais baixos do que os AT2s primários humanos frescos e nãoculturadosAT2s 27. Apesar dessas diferenças entre iAT2s e AT2s humanos primários frescos, descobrimos que mesmo os AT2 primários cultivados apresentaram diferenças transcriômicas em relação aos AT2sprimários frescos e não cultivados 27, e assim concluem que esses modelos in vitro têm vários pontos fortes e limitações para modelagem in vivo da biologia pulmonar.
A plataforma iAT2 pode ser aplicada para estudar mutações genéticas de iPSCs derivados do paciente 19,20. O sistema também poderia ser substancialmente dimensionado para acomodar a triagem de medicamentos de alto rendimento. Além disso, as ALIs iAT2 são adequadas para exposições ambientais, como infecção viral ou bacteriana ou exposição à fumaça de cigarro, vapor de cigarro eletrônico ou outros aerossóis23. Em resumo, este protocolo para gerar culturas 3D e 2D ALI do iAT2s permite a cultura de longo prazo de um tipo celular relevante para a doença e fornece uma plataforma fisiológica e escalável que permite o uso dessas células em muitas aplicações.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos sinceramente aos membros dos laboratórios Wilson, Kotton e Hawkins por suas discussões úteis. Também somos muito gratos a Greg Miller (Gerente de Laboratório da CReM) e Marianne James (gerente de núcleo do iPSC) por seu suporte inestimável. Agradecemos a Brian Tilton e ao Núcleo de Citometria de Fluxo bumc por sua assistência técnica com classificação celular (apoiada pela concessão do NIH #1S10OD021587-01A1). Este trabalho foi apoiado por uma Bolsa CJ Martin de Início de Carreira do Conselho Nacional australiano de Saúde e Pesquisa Médica concedido à RBW; NiH conceder F30HL147426 à KMA; um Prêmio I.M. Rosenzweig Junior Investigator da The Pulmonary Fibrosis Foundation e um Prêmio De Subvenção Piloto Integrado através do Boston University Clinical & Translational Science Institute (1UL1TR001430) para kda; Fundação Nacional de Ciência suíça (P2ELP3_191217) para ABA; NIH concede U01HL148692, U01HL134745, U01HL134766 e R01HL095993 à DNK; e o NIH concede U01TR001810, R01DK101510 e R01DK117940 concedido à AAW; A manutenção, o setor bancário e o compartilhamento do iPSC são suportados pela concessão nº 1 75N92020C00005. A Figura 1 foi criada usando Biorender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| 3-Isobutyl-1-methylxanthine (IBMX) | Sigma | I5879 | For CKDCI |
| 12 Well Cell Culture Plate | Corning | 3513 | Plates for culturing |
| 1-Thioglycerol (MTG) | M6145 | Sigma | For CKDCI |
| 2D Matrigel (matrix) - Matrigel hESC-Qualified Matrix | Corning | 8774552 | To coat ALI Transwells |
| 3D Matrigel (matrix) - Growth Factor Reduced Matrigel | Corning | 356230 | To grow iAT2 spheres in |
| 8-bromoadenosine 30,50-cyclic monophosphate sodium salt (cAMP) | Sigma | B7880 | For CKDCI |
| Ascorbic Acid | A4544 | Sigma | For CKDCI |
| B27 w/out retinoic acid | Life Technologies | 12587-010 | For CKDCI |
| Bovine Serum Albumin (BSA) (7.5%) | Thermo Fisher | 15260037 | For CKDCI |
| Calcein blue | Life Technologies | C1429 | For live/dead discrimination in flow cytometry |
| Calcein green | Life Technologies | C1430 | Optional visualisation of cells on cell culture insert |
| Cell culture inserts - Costar 6.5 mm Clear Transwells with 0.4 µm pore size | Millipore-Sigma | CLS3470-48EA | ALI transwells |
| CHIR99021 | Tocris | 4423 | For CKDCI |
| Dexamethasone | Sigma | D4902 | For CKDCI |
| Dispase (2 mg/mL) | Thermo Fisher | 354235 | To dissolve matrigel |
| Dulbecco's Modified Eagle Medium (DMEM) | Thermo Fisher | 11995 | To make trypsin inactivation media (10% FBS in DMEM) |
| Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12 (DMEM/F12) | Thermo Fisher | A4192002 | To wash |
| Dulbecco's phosphate buffered saline (PBS) | Thermo Fisher | 14190 | For flow cytometric analyses |
| Fetal bovine serum (FBS) (Hyclone charaterized) | GE Healthcare Life Sciences | SH30071.03 | To make trypsin inactivation media (10% FBS in DMEM) |
| Glutamax | Life Technologies | 35050-061 | For CKDCI |
| Ham's F-12 Nutrient Mixture (F12) | Cellgro | 10-080-CV | For CKDCI |
| Hemocytometer | Fisher | 02-671-6 | For cell counting |
| Invivogen Primocin 1 G (50 mg/mL) | Fisher Scientific | NC9392943 | For CKDCI |
| Iscove's Modified Dulbecco's Medium (IMDM) | Thermo Fisher | 12440053 | For CKDCI |
| Millicell ERS-2 Voltohmeter | Millipore | MERS00002 | To measure trans-epithlial electrical resistance |
| N2 supplement | Life Technologies | 17502-048 | For CKDCI |
| Recombinant human KGF | R&D Systems | 251-KG-010 | For CKDCI |
| Retinoic acid | Sigma | R2625 | For CKDCI |
| Trypan blue | Thermo Fisher | 15250061 | For cell count during passaging |
| Trypsin-EDTA (0.05%) | Gibco | 25-300-062 | To dissociate iAT2 spheres |
| Y-27632 dihydrochloride | Tocris | 1254 | Add to cells after passaging |
Referências
- Barkauskas, C. E., et al. Type 2 alveolar cells are stem cells in adult lung. Journal of Clinical Investigation. 123 (7), 3025-3036 (2013).
- Mason, R. J., Williams, M. C. Type II alveolar cell. Defender of the alveolus. American Review of Respiratory Disease. 115 (6), 81-91 (1977).
- Nogee, L. M., et al. A mutation in the surfactant protein C gene associated with familial interstitial lung disease. New England Journal of Medicine. 344 (8), 573-579 (2001).
- Nogee, L. M., et al. A mutation in the surfactant protein B gene responsible for fatal neonatal respiratory disease in multiple kindreds. Journal of Clinical Investigation. 93 (4), 1860-1863 (1994).
- Shulenin, S., et al. ABCA3 gene mutations in newborns with fatal surfactant deficiency. New England Journal of Medicine. 350 (13), 1296-1303 (2004).
- Nureki, S. I., et al. Expression of mutant Sftpc in murine alveolar epithelia drives spontaneous lung fibrosis. Journal of Clinical Investigation. 128 (9), 4008-4024 (2018).
- Katzen, J., et al. An SFTPC BRICHOS mutant links epithelial ER stress and spontaneous lung fibrosis. Journal of Clinical Investigation Insight. 4 (6), 126125 (2019).
- Mathis, C., et al. Human bronchial epithelial cells exposed in vitro to cigarette smoke at the air-liquid interface resemble bronchial epithelium from human smokers. American Journal of Physiology-Lung Cellular and Molecular Physiology. 304 (7), 489-503 (2013).
- Purkayastha, A., et al. Direct exposure to SARS-CoV-2 and cigarette Smoke increases infection severity and alters the stem cell-derived airway repair response. Cell Stem Cell. 27 (6), 869-875 (2020).
- Matrosovich, M. N., Matrosovich, T. Y., Gray, T., Roberts, N. A., Klenk, H. D. Human and avian influenza viruses target different cell types in cultures of human airway epithelium. Proceedings of the National Academy of Sciences. 101 (13), 4620-4624 (2004).
- Tollstadius, B. F., Silva, A. C. G. d., Pedralli, B. C. O., Valadares, M. C. Carbendazim induces death in alveolar epithelial cells: A comparison between submerged and at the air-liquid interface cell culture. Toxicology in Vitro. 58, 78-85 (2019).
- Winton, H. L., et al. Cell lines of pulmonary and non-pulmonary origin as tools to study the effects of house dust mite proteinases on the regulation of epithelial permeability. Clinical and Experimental Allergy. 28 (10), 1273-1285 (1998).
- Kanagaki, S., et al. Hydroxypropyl cyclodextrin improves amiodarone-induced aberrant lipid homeostasis of alveolar cells. American Journal of Respiratory Cell and Molecular Biology. 64 (4), 504-514 (2021).
- Sucre, J. M. S., et al. Successful establishment of primary type 2 alveolar epithelium with 3D organotypic co-culture. American Journal of Respiratory Cell and Molecular Biology. 59 (2), 158-166 (2018).
- Kobayashi, Y., et al. Persistence of a regeneration-associated, transitional alveolar epithelial cell state in pulmonary fibrosis. Nature Cell Biology. 22, 934-946 (2020).
- Choi, J., et al. Inflammatory signals induce AT2 cell-derived damage-associated transient progenitors that mediate alveolar regeneration. Cell Stem Cell. 27 (3), 366-382 (2020).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Katsura, H., et al. Human lung stem cell-based alveolospheres provide insights into SARS-CoV-2-mediated interferon responses and pneumocyte dysfunction. Cell Stem Cell. 27 (6), 890-904 (2020).
- Jacob, A., et al. Differentiation of human pluripotent stem cells into functional lung alveolar epithelial cells. Cell Stem Cell. 21 (4), 472-488 (2017).
- Alysandratos, K. -. D., et al. Patient-specific iPSCs carrying an SFTPC mutation reveal the intrinsic alveolar epithelial dysfunction at the inception of interstitial lung disease. Cell Reports. 36 (9), 109636 (2021).
- Hurley, K., et al. Reconstructed single-cell fate trajectories define lineage plasticity windows during differentiation of human PSC-derived distal lung progenitors. Cell Stem Cell. 26 (4), 593-608 (2020).
- Sun, Y. L., et al. Heterogeneity in human iPSC-derived alveolar epithelial type II cells revealed with ABCA3/SFTPC reporters. American Journal of Respiratory Cell and Molecular Biology. 65 (4), 442-460 (2021).
- Abo, K. M., et al. Human pluripotent stem cell-derived alveolar type 2 cells mature and respond to environmental exposures in air-liquid interface culture. Journal of Clinical Investigation Insight. 7 (6), (2022).
- Huang, J., et al. SARS-CoV-2 infection of pluripotent stem cell-derived human lung alveolar type 2 cells elicits a rapid epithelial-intrinsic inflammatory response. Cell Stem Cell. 27 (6), 962-973 (2020).
- Jacob, A., et al. Derivation of self-renewing lung alveolar epithelial type II cells from human pluripotent stem cells. Nature Protocols. 14 (12), 3303-3332 (2019).
- Beers, M. F., Moodley, Y. When is an alveolar type 2 cell an alveolar type 2 cell? A conundrum for lung stem cell biology and regenerative medicine. American Journal of Respiratory Cell and Molecular Biology. 57 (1), 18-27 (2017).
- Alysandratos, K. D., et al. Impact of cell culture on the transcriptomic programs of primary and iPSC-derived human alveolar type 2 cells. bioRxiv. , (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados