Method Article
Kuantum Noktaları Aracılı İmmüno-Etiketleme ve ardından İletim Elektron Mikroskobu ile Kalpteki Bir Proteinin Hücre Altı Lokalizasyonunu Görselleştirme
Bu Makalede
Özet
Mevcut protokol, kuantum noktaları kullanarak kalp dokusu bölümlerindeki bir proteini immüno-etiketleme yöntemini açıklamaktadır. Bu teknik, herhangi bir proteinin hücre altı lokalizasyonunu ve ekspresyonunu ultrayapısal düzeyde görselleştirmek için yararlı bir araç sağlar.
Özet
Hücre altı lokalizasyon, uygun fonksiyonu tanımlamak ve belirli bir proteinin moleküler mekanizmalarını belirlemek için kritik öneme sahiptir. Proteinlerin hücre altı lokalizasyonunu belirlemek için çeşitli kalitatif ve kantitatif teknikler kullanılır. Bir proteinin hücre altı lokalizasyonunu belirlemede ortaya çıkan tekniklerden biri, bir proteinin kuantum noktaları (QD) aracılı immünoetiketlemesi ve ardından bunları iletim elektron mikroskobu (TEM) ile görüntülemektir. QD, kristalin yapının ve yüksek elektron yoğunluğunun ikili özelliğine sahip yarı iletken bir nanokristaldir, bu da onları elektron mikroskobuna uygulanabilir kılar. Bu güncel yöntem, Sigma 1 reseptörü (Sigmar1) proteininin hücre altı lokalizasyonunu kalp dokusunda ultrayapısal düzeyde QD-TEM kullanarak görselleştirmiştir. Vahşi tip bir fareden kalp dokusu bölümlerinin küçük küpleri% 3 glutaraldehit içinde sabitlendi, daha sonra kemikleştirildi, uranil asetat ile boyandı, ardından etanol ve aseton ile sıralı dehidrasyon yapıldı. Bu susuz kalp dokusu kesitleri düşük viskoziteli epoksi reçinelere gömüldü, 500 nm kalınlığında ince kesitler halinde kesildi, ızgaraya kondu ve daha sonra% 5 sodyum metaperiodat ile antijen maskesi çıkarıldı, ardından artık aldehitlerin glisin ile söndürülmesi sağlandı. Dokular bloke edildi, bunu primer antikor, biyotinile sekonder antikor ve streptavidin-konjuge QD'de sıralı inkübasyon izledi. Bu lekeli kesitler leke kurutuldu ve TEM kullanılarak yüksek büyütmede görüntülendi. QD-TEM tekniği, Sigmar1 proteininin hücre altı lokalizasyonunun kalpteki ultrayapısal düzeyde görselleştirilmesine izin verdi. Bu teknikler, herhangi bir organ sisteminde herhangi bir proteinin varlığını ve hücre altı lokalizasyonunu görselleştirmek için kullanılabilir.
Giriş
İnsan vücudu, çok sayıda vücut fonksiyonundan sorumlu birçok proteinden oluşur. Proteinlerin işlevi büyük ölçüde organ ve hücresel organellerdeki lokalizasyonlarına bağlıdır. Hücre altı fraksiyonasyon, immünofloresan ve deterjan aracılı protein ekstraksiyonu dahil olmak üzere çeşitli teknikler, proteinin hücre altı lokalizasyonunu belirlemek için yaygın olarak kullanılmaktadır 1,2. İmmünofloresan boya kullanan mikroskopi bu teknikler arasında en çok kullanılan yöntemdir. Bununla birlikte, bu teknikte kullanılan floresan boyalar daha az kararlıdır ve fotobeyazlatmaya eğilimlidir3. Diğer teknikler, proteinleri elektron yoğun, ağır metaller (altın, ferritin) veya kuantum noktaları nanokristalleri ile immünoetiketlemek ve ardından iletim elektron mikroskobu (TEM) 4,5 kullanarak görselleştirmek suretiyle proteini ultrayapısal düzeyde görselleştirmek için yüksek çözünürlüklü mikroskopiyi içeriyordu.
QD, biyolojik sistemlerde büyük önem taşıyan kontrol edilebilir fotolüminesans özelliklerine sahip yarı iletken metal bileşiklerinden oluşan yarı iletken bir nanokristaldir3. QD nanokristalleri, uygun stabilitelerini ve işlevlerini sağlamak için nanokristallerin oluşumunda bir nanokristalin kapsüllendiği bir çekirdek kabuğu formatında yapılır. Yaygın olarak kullanılan çekirdek-kabuk nanokristalleri kombinasyonu CdSe / ZnS, CdSe / CdS CdSe / ZnSe, CdTe / CdS, CdTe / ZnS ve CdTe / CdS / ZnS (çekirdek / kabuk / kabuk) 3'tür. Bu nanokristal kombinasyonları arasında, CdSe / ZnS ve CdSe / CdS en güçlü şekilde incelenir ve sıklıkla ikincil antikor konjugatları 3,6 olarak kullanılır. Bu QD nanopartikülleri ayrıca geleneksel floroforlardan farklı uyarma ve emisyon spektrumlarına sahip floresan özelliklere sahiptir. QD, geleneksel floroforlara kıyasla daha yüksek floresan kuantum verimleri sergilemek için elektronların kütle değerlik bandından uyarılmasını kullanır. Yarı iletken metallerin nanokristal düzenlemesi, QD aracılı etiketlemeyi fotobeyazlatmaya karşı daha kararlı ve dirençli hale getirir6. Ek olarak, QD'deki nanokristal çekirdek ve kristal yapısı, farklı boyutlardaki QD'nin çok çeşitli absorpsiyon spektrumlarına ve çok dar emisyon zirvelerine sahip olmasını sağlar7. Dahası, bu QD parçacıkları yüksek elektron yoğunluğu verecek kadar büyüktür, bu da onları iletim elektron mikroskobu 5,8,9 dahil olmak üzere yüksek çözünürlüklü mikroskopi tekniklerinde yararlı kılar. Bu QD nanokristalleri ayrıca farklı floresan emisyon spektrumları ve şekilleri ile birden fazla boyutta ticari olarak temin edilebilir, bu da onları çoklu antikorlarla etiketlemek için mükemmel bir aday haline getirir10,11.
QD teknolojisi, canlı hücre görüntülemede kullanım, hücredeki taşıma mekanizmalarının incelenmesi, proteinin difüzyon hareketinin membran taşınması, hücrelerin fonksiyonel heterojenliği ve hücre içi organelin işaretlenmesi dahil olmak üzere çoklu fonksiyonel özellikler nedeniyle biyolojik araştırmalarda büyük önem kazanmıştır 3,12,13,14,15,16 . QD ayrıca kanser dokularını hedeflemek ve tespit etmek, tümörün moleküler profilini ve bağışıklık durumunu karakterize etmek ve vitreus gövdesini ve epiretinal membranları görselleştirmek için moleküler tanıda yararlıdır 3,17,18. Ek olarak, QD, fotodinamik terapi ve oftalmik anomaliler yoluyla tümör malignitelerini tedavi etmek için tıbbi tedavilerde de kullanılabilir 3,17,18,19 gözlere ilaç vererek 3,17,18,19.
Bu son derece yararlı QD nanokristallerini kullanarak, bu çalışma Sigma 1 reseptörü (Sigmar1) adlı bir proteinin hücre altı lokalizasyonunu belirledi. Sigmar1, her yerde eksprese edilen çok görevli bir moleküler şaperon proteinidir. Sigmar1'in farklı doku ve organlardaki hücre altı lokalizasyonuna odaklanan kapsamlı çalışmalar, moleküler fonksiyon20'yi ortaya çıkaran hücre ve doku tipine özgü hücre altı lokalizasyonunu bildirmiştir. Farklı biyokimyasal yaklaşımlar kullanan farklı hücrelerde (nöronal, fotoreseptör ve bağışıklık hücreleri) ve dokularda (karaciğer ve beyin), çalışmalar Sigmar1'in endoplazmik retikulum (ER), mitokondri ile ilişkili ER membranı (MAM), nükleer zarf, plazma zarı, nükleoplazmik retikulum, çekirdek ve mitokondri üzerinde lokalizasyonunu bildirmiştir. Tüm bu çalışmalara rağmen, Sigmar1'in kalpteki hücre altı lokalizasyonu bilinmemektedir20. Bu nedenle, Sigmar1'in kalp dokusundaki hücre altı lokalizasyonu, QD aracılı immünoetiketleme ve ardından TEM görüntüleme kullanılarak belirlendi.
Protokol
Bu protokoldeki hayvan taşıma prosedürleri, Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu (Sekizinci Baskı, Ulusal Sağlık Enstitüleri, Bethesda, MD) ile uyumlu ve Louisiana Eyalet Üniversitesi Sağlık Bilimleri Merkezi-Shreveport Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanmıştır. Bu çalışmada FVB/N kökenli altı aylık erkek fareler kullanıldı. Fareler ticari kaynaklardan elde edilmiştir (bakınız Malzeme Tablosu). Kullanılan fareler, 12 saatlik bir açık-karanlık döngüsüne izin veren kafeslerde iyi düzenlenmiş bir ortamda barındırıldı, su ve düzenli bir chow diyeti ad libitum ile sağlandı ve NIH Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzuna göre bakıldı. Genel süreç Şekil 1'de gösterilmiştir.
1. Hayvan hazırlığı
- % 3 izofluran kullanarak fareleri anestezi altına alın. Orta karın bölgesinin üstündeki bölgede yatay bir kesi yaparak ve cildi çekerek göğsü açın. Dikkatlice, diğer organları delmeden göğüs boşluğunu açmak için başka bir kesi yapın21,22,23.
- Tam miyokard gevşemesini sağlamak için 2 dakika boyunca kardiyoplejik solüsyonda (50 mM KCl, PBS'de% 5 dekstroz, Ek Dosya 1'e bakınız) soğuk% 3 glutaraldehit kullanarak önce kalbi apekstengeçirin ve daha sonra sağ ventrikülü perfüze edin.
- Kalbi buz soğuk% 3 glutaraldehit kullanarak 0.1 M sodyum kakodilat tamponunda (pH 7.4, adım 2.1.1) 2 dakika daha perfüze edin. Yerçekimi basıncını kullanarak, fiksatifleri kalbe sokmak için 25 G 5/8 "iğne kullanın. Kalp fiksatif ile dolmaya başladıktan hemen sonra, kalbin tepesini kaldırın ve basıncı hafifletmek ve sıvıların boşalmasına izin vermek için altındaki damarları kalpten 1-2 mm'de kesin.
- Kalbi disseke edin, atriyum24'ü çıkarın ve ventrikülleri bir Petri kabında buz soğuk% 3 glutaraldehit / 0.1 M sodyum kakodilat içine bırakın. 30-60 dakikalık fiksasyondan sonra bir kelebek kesimi yapın ve% 3 glutaraldehit / kakodilat içeren bir Petri kabına yerleştirin (bkz. Glutaraldehit / kakodilat çözeltisindeyken 1mm3'lük küçük küpler halinde cerrahi bir bıçak kullanarak kalbi doğrayın.
- Disseke edilmiş kalp dokusunu 4 °C'de 24 saat boyunca glutaraldehit / kakodilat çözeltisine sabitleyin / batırın.
2. Kalp dokusu işleme
- 24 saatlik fiksasyondan sonra, dokuları 20 dakika boyunca 0.1 M sodyum kakodilat tamponunda yıkayın.
- Aşağıdaki adımları izleyerek 0,1 M kakodilat tamponu hazırlayın.
- 0.1 M sodyum kakodilat tamponu hazırlamak için, sodyum kakodilat (21.4 g) ve% 1 kalsiyum klorür çözeltisini (3 mL) 90 mL damıtılmış suda çözerek 1 M sodyum kakodilat tamponu stoğu hazırlayın. Damıtılmış suyu ekleyerek çözeltiyi 100 mL'ye yükseltin. Çözeltiyi iyice karıştırın ve çözünürü çözmek için gece boyunca bırakın.
- Daha sonra, 10 mL 1 M sodyum kakodilat stok çözeltisi alın ve 80 mL damıtılmış suya ekleyin. HCl kullanarak pH'ı 7,4'e ayarlayın ve damıtılmış su ekleyerek hacmi 100 mL'ye kadar yükseltin.
- Aşağıdaki adımları izleyerek 0,1 M kakodilat tamponu hazırlayın.
- Yıkamayı 0,1 M sodyum kakodilat tamponunda 20 dakika daha tekrarlayın. Dokuları sodyum kakodilat tamponundan çıkarın ve oda sıcaklığında 4 saat boyunca% 2 osmiyum tetroksit çözeltisine batırın. Bu işleme osmikasyon denir.
- Aşağıdaki adımları izleyerek% 2 Osmiyum tetroksit çözeltisi hazırlayın.
- % 2 Osmiyum tetroksit çözeltisi hazırlamak için,% 4 Osmiyum tetroksit çözeltisi, 4 mL ( Malzeme Tablosuna bakınız), 1 M sodyum kakodilat stok çözeltisi (0.8 mL) ve damıtılmış su (3.2 mL) alarak toplam 8 mL çözelti elde edin.
NOT: Tüm bu işlem ve bundan sonraki adımlar duman davlumbazında gerçekleştirilmelidir.
- % 2 Osmiyum tetroksit çözeltisi hazırlamak için,% 4 Osmiyum tetroksit çözeltisi, 4 mL ( Malzeme Tablosuna bakınız), 1 M sodyum kakodilat stok çözeltisi (0.8 mL) ve damıtılmış su (3.2 mL) alarak toplam 8 mL çözelti elde edin.
- Aşağıdaki adımları izleyerek% 2 Osmiyum tetroksit çözeltisi hazırlayın.
- Somikasyondan sonra, dokuları oda sıcaklığında 10 dakika boyunca% 2 sodyum asetat çözeltisine batırın.
- 20 mL damıtılmış suda 4 g sodyum asetat çözerek% 2 sodyum asetat çözeltisi hazırlayın.
- Daha sonra, dokuları oda sıcaklığında 1 saat boyunca% 2 uranil asetat çözeltisine batırın.
- 20 mL damıtılmış suda 4 g uranil asetat çözerek% 2 uranil asetat çözeltisi hazırlayın.
- Uranil asetat boyamasından sonra, dokuları Ek Dosya 1'de belirtilen sırayla derecelendirilmiş alkoller ve aseton yoluyla sırayla dehidre edin.
3. Kalp dokusu gömme
- Susuz kalan dokuları aşağıdaki adımları izleyerek düşük viskoziteli epoksi reçinesine gömün.
- Düşük viskoziteli epoksi reçine yapmak için, 50 mL'lik bir tüpte 10.24 mL vinil sikloheksen dioksit (ERL 4221) epoksi monomer, 6.74 mL polipropilen glikol diglisidil eter (DER 732 ) ve 30.05 mL nonenil süksinik anhidrit (NSA) (bkz. Süspansiyonu 2 dakika boyunca elle iyice karıştırın.
- 18 damla 2-dimetilaminoetanol (DMAE, Malzeme Tablosuna bakınız) epoksi hızlandırıcı ekleyin ve bileşenleri iyice karıştırmak için süspansiyonu karıştırın.
- Dokuları epoksi reçinesinde aşağıdaki karışım dizisinde emprenye edin.
- % 100 asetonu% 1: 1 reçine ile değiştirin: aseton süspansiyonu ve dokuları oda sıcaklığında 1 saat boyunca içine batırın.
- 1: 1 reçine: aseton süspansiyonunu 6: 1 reçine ile değiştirin: aseton süspansiyonu ve dokuları 3 saat boyunca içine batırın.
- Son olarak, 6: 1 reçineyi% 100 reçine süspansiyonu ile aseton süspansiyonu değiştirin ve dokuları oda sıcaklığında gece boyunca içine batırılmış halde bırakın.
- Dokuları 8 mm'lik mikro kalıplarda taze reçineye koyun ( Malzeme Tablosuna bakınız) ve gömülü dokuları gece boyunca 70 ° C'de kürleyin.
NOT: Reçinenin sert olduğundan ancak kürlendikten sonra kırılgan olmadığından emin olun.
4. Ultramikrotom kullanarak doku kesitleme
- Ultramikrotom üzerine monte etmeden önce reçine bloklarını dokuyla birlikte 1 mm'den büyük olmayacak şekilde kesin (bkz. Kalıbı ultramikrotomun parçalanmış koluna mümkün olduğunca hassas bir şekilde yerleştirin ve numune kalıbını elmas bıçağa doğru manuel olarak ilerletin.
- Bölümleri bir Histo bıçağı ile 500 nm (yarım mikron) kalınlığında kesin ( bkz. Malzeme Tablosu) ve EM döngü aletini kullanarak bunları alın ve bir cam slaytın üzerine yerleştirin.
- İlgi alanını bulmak için cam kaydırağı toluidin mavisi leke25 için sıcak bir plakaya yerleştirin.
- İlgi alanını bulduktan sonra, soluk altın ultra ince kesitler (100 nm) üretmek için Ultra 45° bıçak kullanın ( bkz. Bu ultra ince bölümleri 200 örgülü bakır ızgaranın donuk tarafına yerleştirin.
5. Ultra ince kalp bölümü boyama
- Bir aşındırma çözeltisi, yani% 5 sodyum metaperiodat çözeltisi kullanarak antijenin maskesini açarak boyamaya başlayın.
- Damıtılmış suda 500 μL% 5 sodyum metaperiodat çözeltisi ( Malzeme Tablosuna bakınız) hazırlayın.
NOT: Kullanmadan önce taze çözelti hazırlayın. - Temiz bir parafin filmi üzerine 20 μL sodyum metaperiodat çözeltisi koyun. Tamamen kurutulmuş ızgaraları, aşındırma çözeltisinin damlacığı üzerine doku kesitleri ile yerleştirin.
NOT: Izgaranın doku kesitli donuk tarafı, aşındırma çözeltisine doğru bakmalıdır. - Bölüm ızgarasını oda sıcaklığında 30 dakika boyunca çözelti üzerinde bırakın.
- Damıtılmış suda 500 μL% 5 sodyum metaperiodat çözeltisi ( Malzeme Tablosuna bakınız) hazırlayın.
- Kazınmış doku bölümünü 60 sn boyunca bir damla damıtılmış su damlacığı üzerine yerleştirerek yıkayın.
- Kesit ızgaralarını oda sıcaklığında 10 dakika boyunca 0,05 M glisin çözeltisi damlacığı üzerine yerleştirerek artık aldehitleri bloke edin. Artık glisin çözeltisini çıkarmak için ızgaranın kenarlarını filtre kağıdına dökün.
- 1 mL 1x PBS'de (pH 7.4) 3.75 mg glisin çözerek 0.05 M glisin çözeltisi hazırlayın ( Malzeme Tablosuna bakınız).
- Bölüm ızgaralarını oda sıcaklığında 25 dakika boyunca 10-20 μL blokaj çözeltisine yerleştirin.
NOT: Bloke edici çözelti bileşimi: 200 μL'lik bir son hacim yapmak için 2 μL% 1 normal keçi serumu (NGS) + 20 μL% 1 BSA (son konsantrasyon: % 10) + 178 μL 1x PBS (pH 7.4). - Izgara kenarlarını filtre kağıdına boyayın ve ızgara bölümünü oda sıcaklığında 10 dakika boyunca koşullandırmak üzere antikor seyreltici üzerine yerleştirin.
- Izgara kesitlerini primer antikor ile (bu durumda Sigmar1, bakınız Malzeme Tablosu; antikor seyrelticide 1:10 seyreltilmiş) nemlendirilmiş bir odada 1 saat 30 dakika boyunca inkübe edin.
- Izgarayı kurutun ve ızgara bölümlerini her biri 5 dakika boyunca iki kez antikor seyreltici ile yıkayın.
- Izgara kesitlerini biyotinile sekonder antikor ile inkübe edin (bu durumda, biyotinile keçi anti-tavşan poliklonal sekonder antikoru, bakınız Malzeme Tablosu; antikor seyrelticide 1:10 seyreltilmiş) nemlendirilmiş bir odada 1 saat boyunca.
- Izgarayı kurutun ve ızgara bölümlerini her biri 5 dakika boyunca iki kez antikor seyreltici ile yıkayın.
- Izgara kesitlerini ticari olarak temin edilebilen streptavidin konjuge QD'de (QD655nm, bakınız Malzeme Tablosu; antikor seyrelticide seyreltilmiş 1:10) oda sıcaklığında nemlendirilmiş bir odada 1 saat boyunca inkübe edin. Odayı alüminyum folyo ile kaplayarak ışığa maruz kalmayı önleyin.
- Filtre kağıdı kullanarak ızgara kenarlarını kurutun ve ızgara bölümlerini 2 dakika boyunca su damlacıkları üzerine yerleştirerek yıkayın.
- Izgaranın kenarlarını kuruması için lekeleyin.
6. İletim Elektron Mikroskobu (TEM) görüntüleme
- Ultra ince kesitleri bakır ızgaralar üzerine bir numune dörtlüsü tutucusuna yerleştirin ve elektron ışınındaki ızgaraların seçimine izin verecek şekilde kelepçeleyin.
- Numune tutucuyu mikroskop kolonuna yerleştirin ve gonyometreyi boşaltmak için pompa anahtarını devreye sokun, ardından numune tutucunun mikroskop sütununa tam olarak yerleştirilmesi (bkz.
- Görüntü gözlemi için ışını üretmeden önce voltajı 80 kV'a ayarlayın.
- İstediğiniz alana iyi odaklanın, yüksek hızlı bir dijital kamera kullanarak görüntüyü yakalayın ve dosyayı .tif formatında kaydedin.
NOT: Bu çalışmada görüntü yakalamak için mikroskop ayarı, 80 kV'luk voltajı veya yüksek gerilim voltajını ve 20.000x'lik bir büyütmeyi hızlandırıyordu.
Sonuçlar
Mevcut QD-TEM metodolojisi, yetişkin fare ultra ince kalp bölümlerinde anti-Sigmar1 hedefli QD etiketlemesi yaparak Sigmar1'in varlığını ve hücre altı kalp bölmelerindeki lokalizasyonunu görselleştirdi. QD-TEM görüntüleri ile mitokondriyal membranlar (iç ve dış), lizozomlar ve endoplazmik retikulum / sarkoplazmik retikulum (ER / SR) membran-mitokondriyal arayüz (Şekil 2A, B) üzerinde elektron yoğun anti-Sigmar1 etiketli QD gösterilmiştir. Ek olarak, kalp bölümleri ayrıca anti-Sigmar1 tavşan primer antikoru için bir İzotip kontrolü olarak tavşan IgG ve QD ile etiketlenmiştir (Şekil 2C, D). Bu nedenle, QD-TEM görüntüleme, endojen Sigmar1'in lokalizasyonunu ve çoğunlukla lizozomlar ve mitokondriyal membranlar üzerindeki zenginleştirmesini vurgulamıştır.
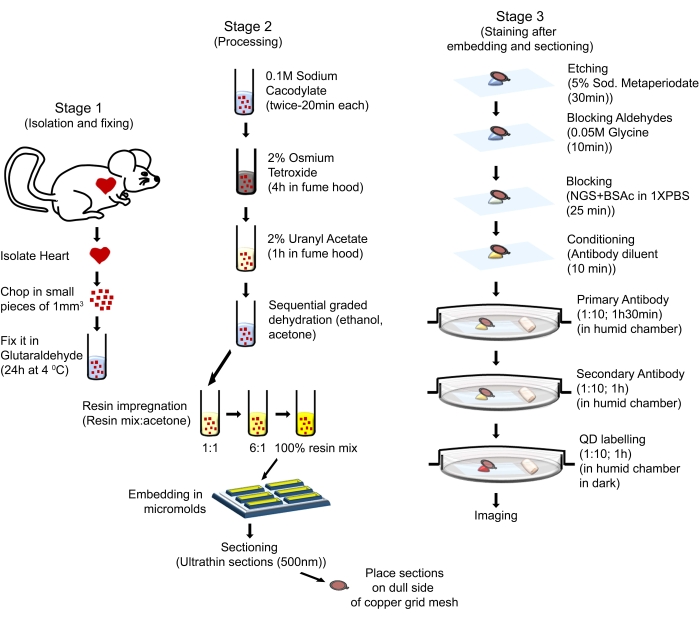
Şekil 1: QD-TEM'i gerçekleştirmek için kullanılan sıralı adımları ve prosedürleri gösteren şematik çizim. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
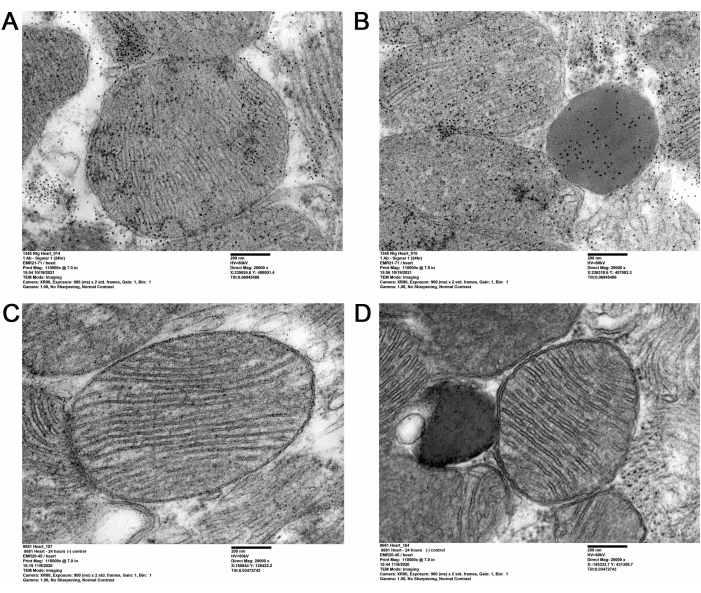
Şekil 2: Yetişkin farelerin kalp dokularında Sigmar1 immüno-etiketli QD . (A,B) Mitokondri (dış ve iç zar), mitokondri ile ilişkili endoplazmik retikulum (ER) / sarkoplazmik retikulum (SR) membranları ve lizozomlar üzerinde Sigmar1 etiketli QD'yi gösteren temsili TEMSILI TEM görüntüleri. (C,D) QD'ler ve tavşan IgG ile etiketlenmiş izotip kontrolünün kalp bölümlerinin TEM görüntüsü. Ölçek çubuğu: 200 nm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Dosya 1: PBS ve doku dehidrasyonu için kullanılan diğer çözeltilerin bileşimi. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Bu çalışmada, QD aracılı immünoetiketleme, Sigmar1'in hücre altı lokalizasyonunu belirgin bir şekilde göstermek için kullanılmıştır. QD kullanılarak, Sigmar1'in mitokondriyal membran, özellikle de iç mitokondriyal membran üzerindeki lokalizasyonu kalp dokusunda tasvir edilmiştir. Ek olarak, Sigmar1'in ayrıca Şekil 2A-D'de gösterildiği gibi sarkoplazmik / endoplazmik retikulum (S / ER) ve ultrayapısal düzeyde lizozomlar üzerinde yerleştiği bulunmuştur.
Bu protokoldeki kritik bir adım, glutaraldehit fiksasyonu ve somikasyonundan sonra antijenin maskesini kaldırmak için yüksek konsantrasyonlu sodyum metaperiodat çözeltisi kullanan aşındırma veya antijen maskesini kaldırma adımıdır. Bu protokol, oda sıcaklığında 30 dakika boyunca yüksek konsantrasyonda (% 5) sodyum metaperiodat içeren tek bir tedavi kullandı. Sodyum metaperiodat inkübasyonu için daha uzun süreli veya daha yüksek bir konsantrasyon, yapıların toplanmasına, organeller için membran tanımının kaybına neden olacağından ve bölümde deliklere neden olacağından, proteinin veya yapının görselleştirilmesini zorlaştıracağından bu adımda ekstra özen gösterilmesi gerekmektedir. Alternatif olarak,% 5 metaperiodat yerine, 30 dakika boyunca iki adımda daha düşük bir konsantrasyonda (% 3) metaperiodat çözeltisi de kullanılabilir. Çalışmalar, bu seçeneğin, bir adımlı 30 dakikalık inkübasyon için% 5 metaperiodat çözeltisi ile benzer sonuçlar sergilediğini göstermiştir. Bununla birlikte, iki kez 30 dakikalık inkübasyon için% 3'lük bir metaperiodat çözeltisi, proses üzerinde daha iyi kontrol sağlar26,27,28. Başlangıçta, bu protokol 30 dakika boyunca% 10 metaperiodat çözeltisi ile bölümlerin inkübasyonunu kullandı. Bununla birlikte, bu konsantrasyon tarafından doku bölümünde oluşturulan çok fazla perforasyon nedeniyle, metaperiodat çözeltisinin son konsantrasyonu ve inkübasyon süresi azaltıldı ve 30 dakika boyunca% 5'e optimize edildi.
Başka bir adım, glutaraldehit ile fiksasyon süresinin optimizasyonunu gerektiriyordu. Dokuların yetersiz fiksasyonu yetersiz QD etiketlemesine neden olurken, dokuların aşırı fiksasyonu daha yüksek spesifik olmayan etiketlemeye neden olur. Bu nedenle, proteinlerin uygun ve spesifik etiketlenmesi için optimal bir doku fiksasyon seviyesinin belirlenmesinde ve titre edilmesinde dikkatli bir şekilde düşünülmelidir. Kalp dokularının kullanıldığı bu yöntemde, glutaraldehit ile fiksasyon süresi, zaman noktaları olarak 24 saat ve 48 saat kullanılarak titre edildi. Her iki zaman noktası için sabitlenen bölümlerin boyama görüntülerine dayanarak, 24 saat boyunca sabitlenen bölümlerin daha iyi sonuçlar verdiği bulunmuştur. Bugüne kadar, QD nanokristalleri 525, 565, 585, 605, 655 ve 705 nm11,29 dahil olmak üzere birçok boyutta mevcuttur. Bu QD'lerin her birinin kendi emisyon spektrumları vardır ve farklı dalga boylarında floresan yayar. Ek olarak, farklı boyutlardaki bu ticari olarak temin edilebilen QD'ler farklı şekiller gösterir; örneğin, QD 525, 565 ve 585 farklı boyutlarda neredeyse küreseldir, oysa QD 605, 655 ve 705 düzensiz dikdörtgen şeklindedir. Bu farklı QD nanokristallerinden QD 525, 565 ve 655 birbirlerinden11,29 kolayca ayırt edilebilir. Emisyon spektrumlarındaki ve şekillerindeki bu farklılıklar, QD'yi proteinlerin çoklu etiketlenmesi ve floresan ve elektron mikroskobu ile görselleştirilmesi için mükemmel bir aday haline getirmektedir. Bu çalışmada, ticari olarak temin edilebilen bir QD, QD 655, lekeli bölümlerdeki spesifik olmayan herhangi bir arka plandan ayırt etmek için Sigmar1 proteinini etiketlemek için kullanılmıştır.
Yüksek çözünürlüklü mikroskopide protein etiketleme için QD'nin bir başka karşılığı da immünogold parçacığıdır. İmmünogold parçacıkları geleneksel olarak yüksek çözünürlüklü mikroskopi için proteinleri etiketlemek için kullanılır. Bu altın parçacıkları oldukça elektron yoğundur ve QD nanokristallerine kıyasla kolayca tanımlanabilir. Bununla birlikte, QD, dokularda daha iyi penetrasyon, daha yüksek stabilite ve raf ömrü ve ultrayapısal bileşenlerin daha iyi tutulması ile daha iyi verimlilik sergiler ve bu da onları protein etiketlemesi için daha iyi bir aday haline getirir 4,5. QD ayrıca hem ışık hem de elektron mikroskobu ile tespit edilmek için benzersiz bir yeteneğe sahiptir ve bu da immünogold etiketleme10 üzerindeki değerine katkıda bulunur.
Bu QD aracılı immünoetiketlemenin bir sınırlaması, işleme sırasında osmiyum tetroksit kullanılmasıdır. Osmiyum tetroksit, aksi takdirde daha az elektron yoğun ve daha az kontrastlı biyolojik membran yapılarının elektron yoğunluğunu, iletkenliğini ve kontrastını arttırmak için kullanılır 5,30. Bununla birlikte, osmiyum tetroksit kullanımı anında ve geri dönüşümsüz olarak numunenin QD6 ile etiketlendiğinde floresan oluşturma özelliğini yok eder. Bu, floresan mikroskopide QD kullanımını sınırlar. Ozmiyum tetroksit kullanımını ihmal eden alternatif bir yaklaşım, floresan özelliklerinin korunmasında ve dolayısıyla QD aracılı immünoetiketlemenin ikili uygulanmasında avantajlı olacaktır. TEM'in yeni modellerinden bazıları, malzemelerin temel bileşiminin tanımlanmasına izin veren Enerji Dağıtıcı X-Işını Analizi (EDX) sistemini bağlama seçeneğine sahiptir. Çalışmanın bir diğer sınırlaması, bir örneklemin temel haritalanmasının olmaması ve EDX kullanılarak görüntü analizidir. Bu nedenle, gelecekteki çalışmalar, element bileşimini analiz etmek için QD spektrumlarının EDX analizine odaklanmalıdır.
Proteinlerin QD etiketlemesi son zamanlarda çok dikkat çekmiştir. QD, hem biyolojik araştırmalarda hem de tıbbi terapötiklerde çeşitli uygulamalar ve avantajlar sunmaktadır. QD ayrıca polidentat ligand ile sarılırsa, kuantum verimini koruyarak artan stabilite sergiler. Ayrıca, QD'nin bu biyo-elverişli ajanlarla kapsüllenmesi, dokulardaki biyoyararlanımını da arttırır ve tümörlerin saptanmasında, canlı hücre görüntülemesinde, ilaç dağıtımında ve doku görüntülemede potansiyel uygulama için iyi bir aday olmasını sağlar 3,31,32.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma Ulusal Sağlık Enstitüleri hibeleri tarafından desteklenmiştir: R01HL145753, R01HL145753-01S1, R01HL145753-03S1 ve R01HL152723; LSUHSC-S CCDS Finish Line Ödülü, COVID-19 Araştırma Ödülü ve MSB'ye LARC Araştırma Ödülü; LSUHSC-S Malcolm Feist Kardiyovasküler ve AHA CSA'ya Doktora Sonrası Bursu (20POST35210789); ve LSUHSC-S Malcolm Feist RA'ya Doktora Öncesi Bursu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 200 Mesh copper grid | Ted Pella | G200HH | |
| 6-month-old male mice with FVB/N background | Jackson Laboratory, Bar Harbor, ME | ||
| Acetone 100% | Fisher Chemicals | A949 | |
| Antibody diluent | Dako | S3022 | |
| anti-Sigmar1 antibody | Cell Signaling | 61994S | |
| Biotinylated goat anti-rabbit IgG antibody | Sigma Aldrich | B7389 | |
| BSAc (10%) | Electron Microscopy Sciences | 25557 | |
| Calcium chloride | Sigma Aldrich | C7902 | |
| Cytoseal Xyl | Thermo fisher | 8312-4 | |
| DER 732C36AA10:C33 | Electron Microscopy Sciences | 13010 | |
| Dextrose | Sigma Aldrich | G7528 | |
| Diamond Knife | Diatome | Histo; Ultra 450 | |
| DMAE | Electron Microscopy Sciences | 13300 | |
| Electron microscope | JEOL | JEOL-1400 Flash | |
| ERL 4221 | Electron Microscopy Sciences | 15004 | |
| Ethanol 100% | Fisher Chemicals | A405P | |
| Glutaraldehyde 3% | Electron Microscopy Sciences | 16538-15 | |
| Glycine | Alfa Aesar | A13816 | |
| Hydrochloric acid | Fisher Scientific | SA56 | |
| Micromolds | Ted Pella | 10505 | |
| Microtome | Leica Microsystem | EM UC7 | |
| Normal goat serum | Invitrogen | PCN5000 | |
| NSA | Electron Microscopy Sciences | 19050 | |
| Osmium tetroxide | Electron Microscopy Sciences | 19150 | |
| Parafilm | Genesse Scientific | 16-101 | |
| Potassium Chloride | Sigma Aldrich | P5655 | |
| Potassium Phosphate monobasic | Sigma Aldrich | 71640 | |
| Qdot 655 Streptavidin Conjugate | Invitrogen | Q10121MP | |
| Sodium Acetate | Fisher Scientific | BP334 | |
| Sodium Cacodylate | Electron Microscopy Sciences | 12300 | |
| Sodium Chloride | Fisher Scientific | BP358 | |
| Sodium metaperiodate | Sigma Aldrich | 71859 | |
| Sodium Phosphate dibasic | Sigma Aldrich | P9541 | |
| Surgical blade (size 10) | Aspen surgical | 371110 | |
| TEM image software | AMT-V700 | AMT TEM imaging systems | |
| TEM imaging camera | XR80 TEM series | AMT TEM imaging systems | |
| Toluidine Blue O solution (0.5%) | Fisher Scientic | S25612 | |
| Uranyl acetate | Polysciences | 21447 |
Referanslar
- Lidke, D. S., Lidke, K. A. Advances in high-resolution imaging - techniques for three-dimensional imaging of cellular structures. Journal of Cell Science. 125 (11), 2571-2580 (2012).
- de Duve, C. Tissue fraction-past and present. The Journal of Cell Biology. 50 (1), 20 (1971).
- Pleskova, S., Mikheeva, E., Gornostaeva, E., Saquib, Q., Faisal, M., Al-Khedhairy, A. A., Alatar, A. A. . Cellular and Molecular Toxicology of Nanoparticles. , 323-334 (2018).
- Mayhew, T. M., Mühlfeld, C., Vanhecke, D., Ochs, M. A review of recent methods for efficiently quantifying immunogold and other nanoparticles using TEM sections through cells, tissues and organs. Annals of Anatomy - Anatomischer Anzeiger. 191 (2), 153-170 (2009).
- Kuipers, J., de Boer, P., Giepmans, B. N. G. Scanning EM of non-heavy metal stained biosamples: Large-field of view, high contrast and highly efficient immunolabeling. Experimental Cell Research. 337 (2), 202-207 (2015).
- Deerinck, T. J. The application of fluorescent quantum dots to confocal, multiphoton, and electron microscopic imaging. Toxicologic Pathology. 36 (1), 112-116 (2008).
- Nisman, R., Dellaire, G., Ren, Y., Li, R., Bazett-Jones, D. P. Application of quantum dots as probes for correlative fluorescence, conventional, and energy-filtered transmission electron microscopy. Journal of Histochemistry & Cytochemistry. 52 (1), 13-18 (2004).
- Michalet, X., et al. Quantum dots for live cells, in vivo imaging, and diagnostics. Science. 307 (5709), 538-544 (2005).
- Killingsworth, M. C., Bobryshev, Y. V. Correlative light- and electron microscopy using quantum dot nanoparticles. Journal of Visualized Experiments. (114), e54307 (2016).
- Deerinck, T. J., Giepmans, B. N. G., Smarr, B. L., Martone, M. E., Ellisman, M. H., Bruchez, M. P., Hotz, C. Z., Ellisman, M. H. . Quantum Dots: Applications in Biology. , 43-53 (2007).
- Giepmans, B. N. G., Deerinck, T. J., Smarr, B. L., Jones, Y. Z., Ellisman, M. H. Correlated light and electron microscopic imaging of multiple endogenous proteins using Quantum dots. Nature Methods. 2 (10), 743-749 (2005).
- Lidke, D. S., et al. Quantum dot ligands provide new insights into erbB/HER receptor-mediated signal transduction. Nature Biotechnology. 22 (2), 198-203 (2004).
- Pleskova, S. N., et al. Differences in the functional activity of human neutrophilic granulocytes in their interactions with semiconductor quantum dots. Morfologiia. 135 (3), 47-49 (2009).
- Crane, J., Haggie, P., Verkman, A. Quantum dot single molecule tracking reveals a wide range of diffusive motions of membrane transport proteins. Proceedings of SPIE. 7189, (2009).
- Hanaki, K. -. i., et al. Semiconductor quantum dot/albumin complex is a long-life and highly photostable endosome marker. Biochemical and Biophysical Research Communications. 302 (3), 496-501 (2003).
- Lim, Y. T., et al. . Selection of quantum dot wavelengths for biomedical assays and imaging. 2, 50-64 (2003).
- Gao, X., Cui, Y., Levenson, R. M., Chung, L. W. K., Nie, S. In vivo cancer targeting and imaging with semiconductor quantum dots. Nature Biotechnology. 22 (8), 969-976 (2004).
- Åkerman, M. E., Chan, W. C. W., Laakkonen, P., Bhatia, S. N., Ruoslahti, E. Nanocrystal targeting in vivo. Proceedings of the National Academy of Sciences. 99 (20), 12617-12621 (2002).
- Sarwat, S. A. -. O. X., Stapleton, F., Willcox, M., Roy, M. A. -. O. Quantum dots in ophthalmology: A literature review. Current Eye Research. 44 (10), 1037-1046 (2019).
- Aishwarya, R., Abdullah, C. S., Morshed, M., Remex, N. S., Bhuiyan, M. S. Sigmar1's molecular, cellular, and biological functions in regulating cellular pathophysiology. Frontiers in Physiology. 12, 705575 (2021).
- Bohne, B., Harding, G. . Processing the mouse temporal bone for gross, cellular and subcellular evaluation poster. , (2004).
- Roszkowski, M. . The effects of acute stress on Apold1 gene expression and blood-brain barrier permeability. , (2014).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio-protocol. 11 (5), 3988 (2021).
- Jones, W. K., et al. Ablation of the murine alpha myosin heavy chain gene leads to dosage effects and functional deficits in the heart. Journal of Clinical Investigation. 98 (8), 1906-1917 (1996).
- Hunter, E. E. . Practical Electron Microscopy: A Beginner's Illustrated Guide. , (1993).
- Morris, R. E., Ciraolo, G. M. A universal post-embedding protocol for immunogold labelling of osmium-fixed, epoxy resin-embedded tissue. Journal of Electron Microscopy. 46 (4), 315-319 (1997).
- Brorson, S. H. Deplasticizing or etching of epoxy sections with different concentrations of sodium ethoxide to enhance the immunogold labeling. Micron. 32 (2), 101-105 (2001).
- Lobo, M. V. T., et al. Ultrastructural Staining with Sodium Metaperiodate and Sodium Borohydride. Journal of Histochemistry & Cytochemistry. 50 (1), 11-19 (2002).
- Bruchez, M., Moronne, M., Gin, P., Weiss, S., Alivisatos, A. P. Semiconductor nanocrystals as fluorescent biological labels. Science. 281 (5385), 2013-2016 (1998).
- Tapia, J. C., et al. High-contrast en bloc staining of neuronal tissue for field emission scanning electron microscopy. Nature Protocols. 7 (2), 193-206 (2012).
- Smith, A. M., Duan, H., Mohs, A. M., Nie, S. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Advanced Drug Delivery Reviews. 60 (11), 1226-1240 (2008).
- Gour, A., Ramteke, S., Jain, N. K. Pharmaceutical applications of quantum dots. AAPS PharmSciTech. 22 (7), 233 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır