Method Article
Визуализация субклеточной локализации белка в сердце с помощью иммуномаркировки, опосредованной квантовыми точками, с последующей просвечивающей электронной микроскопией
В этой статье
Резюме
Настоящий протокол описывает способ иммуномаркировки белка в участках сердечной ткани с использованием квантовых точек. Этот метод предоставляет полезный инструмент для визуализации субклеточной локализации и экспрессии любого белка на ультраструктурном уровне.
Аннотация
Субклеточная локализация имеет решающее значение для определения правильной функции и определения молекулярных механизмов конкретного белка. Для определения субклеточной локализации белков используется несколько качественных и количественных методик. Одним из новых методов определения субклеточной локализации белка является опосредованная квантовыми точками (QD) иммуномаркировка белка с последующей их визуализацией с помощью просвечивающей электронной микроскопии (ТЭМ). QD представляет собой полупроводниковый нанокристалл с двойным свойством кристаллической структуры и высокой электронной плотностью, что делает их применимыми к электронной микроскопии. Этот современный метод визуализировал субклеточную локализацию белка рецептора Sigma 1 (Sigmar1) с использованием QD-TEM в сердечной ткани на ультраструктурном уровне. Небольшие кубики участков сердечной ткани у мыши дикого типа фиксировали в 3% глутаральдегиде, впоследствии осмикали, окрашивали уранилацетатом с последующим последовательным обезвоживанием этанолом и ацетоном. Эти обезвоженные участки сердечной ткани внедряли в низковязкие эпоксидные смолы, разрезали на тонкие срезы толщиной 500 нм, наносили на сетку, а затем подвергали антигенному демаскированию 5% метапериодатом натрия с последующим гашением остаточных альдегидов глицином. Ткани блокировали, за чем следовала последовательная инкубация в первичном антителе, биотинилированном вторичном антителе и стрептавидин-конъюгированном QD. Эти окрашенные участки были высушены пятнами и визуализированы при большом увеличении с использованием TEM. Методика QD-TEM позволила визуализировать субклеточную локализацию белка Sigmar1 на ультраструктурном уровне в сердце. Эти методы могут быть использованы для визуализации присутствия любого белка и субклеточной локализации в любой системе органов.
Введение
Человеческий организм состоит из множества белков, ответственных за многочисленные функции организма. Функция белков во многом зависит от их локализации в органе и клеточных органеллах. Несколько методов, включая субклеточное фракционирование, иммунофлуоресценцию и экстракцию белка, опосредованной детергентами, обычно используются для определения субклеточной локализации белка 1,2. Микроскопия с использованием иммунофлуоресцентного красителя является наиболее широко используемым методом среди этих методов. Однако флуоресцентные красители, используемые в этой технике, менее стабильны и склонны к фотоотбеливанию3. Другие методы включали микроскопию с высоким разрешением для визуализации белка на ультраструктурном уровне путем иммуномаркировки белков электронно-плотными, тяжелыми металлами (золото, ферритин) или нанокристаллами квантовых точек с последующей визуализацией их с использованием просвечивающей электронной микроскопии (ТЭМ)4,5.
QD представляет собой полупроводниковый нанокристалл, состоящий из полупроводниковых металлических соединений с контролируемыми свойствами фотолюминесценции, имеющими большое значение в биологических системах3. Нанокристаллы QD изготавливаются в формате ядро-оболочка, где нанокристалл инкапсулируется при образовании нанокристаллов для обеспечения их надлежащей стабильности и функционирования. Обычно используется комбинация нанокристаллов ядра и оболочки: CdSe/ZnS, CdSe/CdSe/ZnSe, CdTe/CdS, CdTe/ZnS и CdTe/CdS/ZnS (ядро/оболочка/оболочка)3. Среди этих нанокристаллических комбинаций наиболее активно изучаются CdSe/ZnS и CdSe/CdS и часто используются в качестве вторичных конъюгатов антител 3,6. Эти наночастицы QD также обладают флуоресцентными свойствами с другими спектрами возбуждения и излучения, чем традиционные флуорофоры. QD использует возбуждение электронов из объемной валентной зоны для демонстрации более высоких квантовых выходов флуоресценции по сравнению с традиционными флуорофорами. Нанокристаллическое расположение полупроводниковых металлов делает QD-опосредованную маркировку более стабильной и устойчивой к фотоотбеливанию6. Кроме того, нанокристаллическое ядро в QD и его кристаллическая структура позволяют QD различных размеров иметь широкий диапазон спектров поглощения и очень узкие пикиизлучения 7. Кроме того, эти частицы QD достаточно велики, чтобы дать высокую электронную плотность, что делает их полезными в методах микроскопии с высоким разрешением, включая просвечивающую электронную микроскопию 5,8,9. Эти нанокристаллы QD также коммерчески доступны в нескольких размерах с различными спектрами и формами флуоресцентного излучения, что делает их отличным кандидатом для маркировки несколькими антителами10,11.
Технология QD привлекла большое значение в биологических исследованиях благодаря множеству функциональных свойств, включая использование в визуализации живых клеток, изучение транспортных механизмов в клетке, мембранный транспорт диффузионного движения белка, функциональную гетерогенность клеток и маркировку внутриклеточных органелл 3,12,13,14,15,16 . QD также полезен в молекулярной диагностике для нацеливания и обнаружения раковых тканей, характеристики молекулярного профиля опухоли и иммунного статуса, а также визуализации стекловидного тела и эпиретинальных мембран 3,17,18. Кроме того, QD также может использоваться в медицинской терапии для лечения злокачественных опухолей с помощью фотодинамической терапии и офтальмологических аномалий путем доставки лекарств в глаза 3,17,18,19.
Используя эти очень полезные нанокристаллы QD, настоящее исследование определило субклеточную локализацию белка под названием рецептор Sigma 1 (Sigmar1). Sigmar1 представляет собой повсеместно экспрессируемый многозадачный молекулярный белок-шаперон. Обширные исследования, посвященные субклеточной локализации Sigmar1 в различных тканях и органах, сообщили о специфической субклеточной локализации клеточного и тканевого типа, вызывающей молекулярную функцию20. В различных клетках (нейронных, фоторецепторных и иммунных клетках) и тканях (печени и мозга) с использованием различных биохимических подходов в исследованиях сообщалось о локализации Sigmar1 на эндоплазматическом ретикулуме (ER), митохондрий-ассоциированной мембране ER (MAM), ядерной оболочке, плазматической мембране, нуклеоплазматическом ретикулуме, ядре и митохондриях. Несмотря на все эти исследования, субклеточная локализация Sigmar1 в сердце оставалась неизвестной20. Поэтому субклеточную локализацию Sigmar1 в сердечной ткани определяли с помощью QD-опосредованной иммуномаркировки с последующей визуализацией ТЭМ.
протокол
Процедуры обращения с животными в этом протоколе соответствовали Руководству по уходу за лабораторными животными и их использованию (восьмое издание, Национальные институты здравоохранения, Бетесда, штат Мэриленд) и были одобрены Комитетом по уходу за животными и их использованию Центра медицинских наук Университета штата Луизиана в Шривпорте. Шестимесячные самцы мышей с фоном FVB / N были использованы для настоящего исследования. Мыши были получены из коммерческих источников (см. Таблицу материалов). Используемые мыши были размещены в хорошо регулируемой среде в клетках, допускающих 12-часовой светло-темный цикл, обеспечены водой и регулярной диетой чау ad libitum, и за ними ухаживали в соответствии с Руководством NIH по уходу и использованию лабораторных животных. Общий процесс проиллюстрирован на рисунке 1.
1. Подготовка животных
- Обезболивают мышей, используя 3% изофлурана. Откройте грудную клетку, сделав горизонтальный разрез в области выше среднего живота и потянув за кожу. Осторожно сделайте еще один разрез, чтобы открыть грудную полость без прокола каких-либо других органов 21,22,23.
- Перфузируйте 24 сердца через вершину сначала, а затем правый желудочек с использованием холодного 3% глутаральдегида в кардиоплегическом растворе (50 мМ KCl, 5% декстрозы в PBS, см. Дополнительный файл 1) в течение 2 мин для обеспечения полного расслабления миокарда.
- Перфузируют сердце с помощью ледяного 3% глутаральдегида в 0,1 М буфера какодилата натрия (рН 7,4, стадия 2.1.1) еще 2 мин. Используя гравитационное давление, используйте иглу 25 G 5/8", чтобы ввести фиксаторы в сердце. Сразу после того, как сердце начнет наполняться фиксирующим средством, поднимите верхушку сердца и перережьте сосуды под ним на расстоянии 1-2 мм от сердца, чтобы снять давление и дать жидкостям стекать.
- Рассекните сердце, удалите предсердия24 и опустите желудочки в ледяной 3% глутаровый альдегид / 0,1 М какодилата натрия в чашке Петри. Сделайте нарезку бабочкой после 30-60 мин фиксации и поместите ее в чашку Петри, содержащую 3% глутаральдегида/какодилата (см. Таблицу материалов). Нарежьте сердце хирургическим лезвием небольшими кубиками по 1мм3 , пока оно находится в растворе глутаральдегида/какодилата.
- Зафиксируйте/погрузите рассеченную ткань сердца в раствор глутаральдегида/какодилата в течение 24 ч при 4 °C.
2. Обработка сердечной ткани
- После 24 ч фиксации промыть ткани в 0,1 М буфера какодилата натрия в течение 20 мин.
- Подготовьте 0,1 М какодилатного буфера, выполнив следующие действия.
- Для получения 0,1 М буфера какодилата натрия готовят запас 1 М буфера какодилата натрия путем растворения какодилата натрия (21,4 г) и 1% раствора хлорида кальция (3 мл) в 90 мл дистиллированной воды. Обомите раствор до 100 мл, добавив дистиллированную воду. Хорошо перемешайте раствор и оставьте на ночь, чтобы растворить растворенное вещество.
- Далее берут 10 мл 1 М раствора какодилата натрия и добавляют его в 80 мл дистиллированной воды. Отрегулируйте рН до 7,4 с помощью HCl и объежите его до 100 мл, добавив дистиллированную воду.
- Подготовьте 0,1 М какодилатного буфера, выполнив следующие действия.
- Повторите промывку в 0,1 М буфера какодилата натрия еще 20 мин. Удалить ткани из буфера какодилата натрия и погрузить их в 2% раствор тетроксида осмия на 4 ч при комнатной температуре. Этот процесс называется осмикацией.
- Приготовьте 2% раствор тетроксида осмия, выполнив следующие действия.
- Для приготовления 2% раствора тетроксида осмия берут 4% раствор тетроксида осмия, 4 мл (см. Таблицу материалов), 1 М раствора какодилата натрия (0,8 мл) и дистиллированную воду (3,2 мл), чтобы получить в общей сложности 8 мл раствора.
ПРИМЕЧАНИЕ: Весь этот процесс и шаги, вытекающие из этого, должны выполняться в вытяжном шкафу.
- Для приготовления 2% раствора тетроксида осмия берут 4% раствор тетроксида осмия, 4 мл (см. Таблицу материалов), 1 М раствора какодилата натрия (0,8 мл) и дистиллированную воду (3,2 мл), чтобы получить в общей сложности 8 мл раствора.
- Приготовьте 2% раствор тетроксида осмия, выполнив следующие действия.
- После осмикации погружают ткани в 2% раствор ацетата натрия на 10 мин при комнатной температуре.
- Готовят 2% раствор ацетата натрия, растворяя 4 г ацетата натрия в 20 мл дистиллированной воды.
- Далее погружают ткани в 2% раствор уранилацетата в течение 1 ч при комнатной температуре.
- Готовят 2% раствор уранилацетата, растворяя 4 г уранилацетата в 20 мл дистиллированной воды.
- После окрашивания уранилацетата обезвоживают ткани последовательно через градуированные спирты и ацетон в порядке, указанном в дополнительном файле 1.
3. Встраивание сердечной ткани
- Встраивайте обезвоженные ткани в эпоксидную смолу с низкой вязкостью, следуя приведенным ниже шагам.
- Для получения эпоксидной смолы с низкой вязкостью смешайте 10,24 мл эпоксидного мономера диоксида винилциклогексена (ERL 4221), 6,74 мл диглицидилового эфира полипропиленгликоля (DER 732) и 30,05 мл неэнилсутарного ангидрида (NSA) (см. Таблицу материалов) в трубке объемом 50 мл. Хорошо перемешайте суспензию вручную в течение 2 мин.
- Добавьте 18 капель эпоксидного ускорителя 2-диметиламиноэтанола (DMAE, см. Таблицу материалов) и перемешайте суспензию, чтобы тщательно перемешать компоненты.
- Пропитать ткани эпоксидной смолой в следующей последовательности смеси.
- Заменить 100% ацетон смолой 1:1: суспензией ацетона и погрузить в нее ткани на 1 ч при комнатной температуре.
- Заменить смолу 1:1: ацетоновую суспензию на смолу 6:1: ацетоновую суспензию и погрузить в нее ткани на 3 ч.
- Наконец, замените смолу 6:1: ацетоновую суспензию на 100% смоляную суспензию и оставьте ткани погруженными в нее на ночь при комнатной температуре.
- Поместите ткани в свежую смолу в 8 мм микроформах (см. Таблицу материалов) и отверждайте внедренные ткани при 70 °C в течение ночи.
ПРИМЕЧАНИЕ: Убедитесь, что смола твердая, но не хрупкая после отверждения.
4. Сечение тканей с помощью ультрамикротома
- Обрежьте смоляные блоки тканью не более чем на 1 мм перед установкой на ультрамикротом (см. Таблицу материалов). Поместите форму как можно точнее в сегментированную руку ультрамикротома и вручную переместите образец формы к алмазному ножу.
- Вырежьте срезы толщиной 500 нм (полмикрона) ножом Histo (см. Таблицу материалов) и с помощью инструмента EM loop возьмите их и поместите на стеклянную горку.
- Поместите стеклянную горку на конфорку для толуидинового синего пятна25 , чтобы найти интересующую область.
- Найдя интересующую область, используйте нож Ultra 45° (см. Таблицу материалов) для получения ультратонких срезов бледного золота (100 нм). Поместите эти ультратонкие секции на тусклую сторону медной сетки из 200 ячеек.
5. Ультратонкое окрашивание участка сердца
- Начните окрашивание с демаскирования антигена с помощью травильного раствора, т.е. 5% раствора метапериодата натрия.
- Готовят 500 мкл 5% раствора метапериодата натрия (см. Таблицу материалов) в дистиллированной воде.
ПРИМЕЧАНИЕ: Подготовьте свежий раствор перед использованием. - Нанесите 20 мкл раствора метапериодата натрия на чистую парафиновую пленку. Поместите полностью высушенные сетки с участками ткани на каплю травильного раствора.
ПРИМЕЧАНИЕ: Тусклая сторона сетки с участком ткани должна быть обращена к раствору для травления. - Оставьте сетку секций на растворе на 30 мин при комнатной температуре.
- Готовят 500 мкл 5% раствора метапериодата натрия (см. Таблицу материалов) в дистиллированной воде.
- Промыть вытравленный участок ткани, поместив его на каплю дистиллированной воды на 60 с.
- Блокируют остаточные альдегиды, помещая сетки секций на каплю 0,05 М раствора глицина в течение 10 мин при комнатной температуре. Промокните края сетки на фильтровальной бумаге, чтобы удалить остаточный раствор глицина.
- Готовят 0,05 М раствора глицина (см. Таблицу материалов), растворяя 3,75 мг глицина в 1 мл 1x PBS (рН 7,4).
- Поместите сетки секций в 10-20 мкл блокирующего раствора на 25 мин при комнатной температуре.
ПРИМЕЧАНИЕ: Состав блокирующего раствора: 2 мкл 1% нормальной козьей сыворотки (NGS) + 20 мкл 1% BSA (конечная концентрация: 10%) + 178 мкл 1x PBS (рН 7,4) для получения конечного объема 200 мкл. - Промокните края сетки на фильтровальной бумаге и поместите срез сетки на разбавитель антител для кондиционирования при комнатной температуре в течение 10 мин.
- Инкубируют срезы сетки с первичным антителом (Sigmar1 в данном случае см. Таблицу материалов; разводят 1:10 в разбавителе антител) в течение 1 ч 30 мин в увлажненной камере.
- Промокните сетку и промыть участки сетки разбавителем антител дважды по 5 мин каждая.
- Инкубируют срезы сетки с биотинилированным вторичным антителом (в данном случае биотинилированным козьим анти-кроликом поликлональным вторичным антителом, см. Таблицу материалов; разбавляют 1:10 в разбавителе антител) в течение 1 ч в увлажненной камере.
- Промокните сетку и промыть участки сетки разбавителем антител дважды по 5 мин каждая.
- Инкубируют срезы сетки в коммерчески доступном стрептавидин-конъюгированном QD (QD655 нм, см. Таблицу материалов; разбавляют 1:10 в разбавителе антител) в течение 1 ч в увлажненной камере при комнатной температуре. Предотвратите воздействие света, покрыв камеру алюминиевой фольгой.
- Промокните края сетки фильтровальной бумагой и промойте участки сетки, поместив их на капли воды на 2 мин.
- Промокните края сетки, чтобы высохнуть.
6. Визуализация просвечивающей электронной микроскопии (TEM)
- Поместите ультратонкие срезы на медные решетки в держатель квартета образцов и зажмите их в положении, позволяющем выбрать сетки в электронном пучке.
- Вставьте держатель образца в колонку микроскопа и задействуйте переключатель насоса для эвакуации гониометра, после чего следует полное введение держателя образца в колонку микроскопа (см. Таблицу материалов).
- Установите напряжение на 80 кВ перед генерацией луча для наблюдения изображения.
- Хорошо сфокусируйтесь на нужной области, захватите изображение с помощью высокоскоростной цифровой камеры и сохраните файл в .tif формате.
ПРИМЕЧАНИЕ: Настройка микроскопа для захвата изображения в этом исследовании заключалась в ускорении напряжения или напряжения высокого напряжения 80 кВ и увеличении в 20 000 раз.
Результаты
Настоящая методология QD-TEM визуализировала присутствие Sigmar1 и его локализацию на субклеточных сердечных компартментах путем выполнения анти-Sigmar1 таргетной QD маркировки на ультратонких участках сердца взрослой мыши. Электронно-плотный анти-Sigmar1, меченый QD на митохондриальных мембранах (внутренних и наружных), лизосомах и эндоплазматическом ретикулуме / саркоплазматическом ретикулуме (ER / SR) мембранно-митохондриальном интерфейсе (рисунок 2A, B), были проиллюстрированы изображениями QD-TEM. Кроме того, участки сердца также были помечены IgG и QD кролика в качестве контроля изотипа для первичного антитела кролика против Sigmar1 (рисунок 2C, D). Поэтому визуализация QD-TEM подчеркнула локализацию эндогенного Sigmar1 и его обогащение в основном на лизосомах и митохондриальных мембранах.
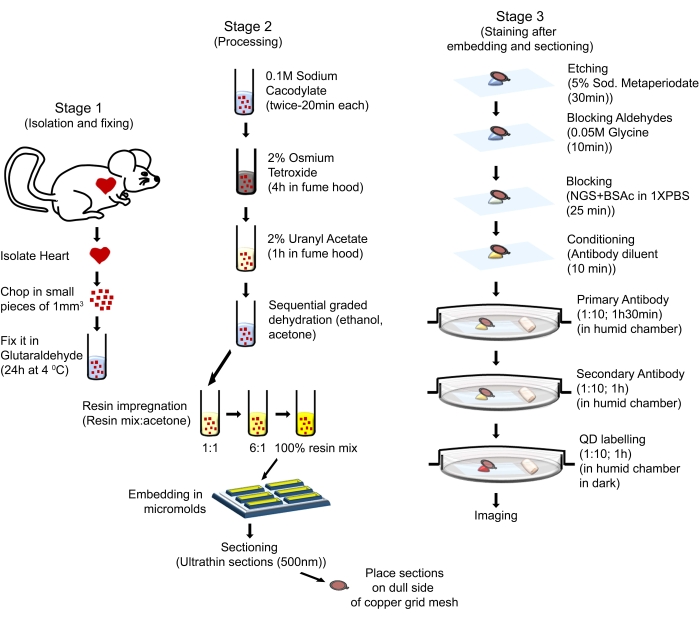
Рисунок 1: Схематическая иллюстрация, показывающая последовательные шаги и процедуры, используемые для выполнения QD-TEM. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
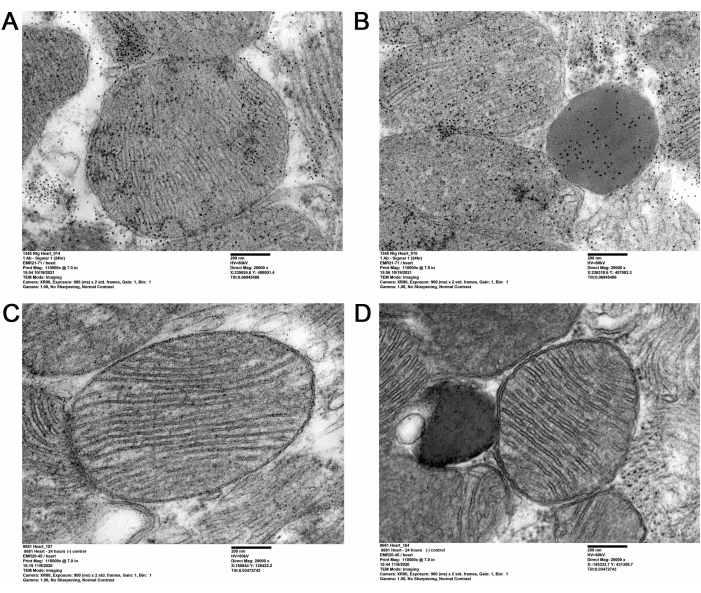
Рисунок 2: Sigmar1 иммуномаркированный QD в тканях сердца взрослых мышей. (A,B) Репрезентативные изображения TEM, показывающие Sigmar1, меченый QD на митохондриях (наружной и внутренней мембране), митохондриях-ассоциированных эндоплазматических ретикулумных (ER) / саркоплазматических ретикулумных (SR) мембранах и лизосомах. (С,Г) TEM изображение сердечных участков изотипа контроля, помеченных QDs и кроликом IgG. Шкала шкалы: 200 нм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл 1: Состав PBS и других растворов, используемых для обезвоживания тканей. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
В настоящем исследовании QD-опосредованное иммуномаркирование использовалось для отчетливого показа субклеточной локализации Sigmar1. Используя QD, локализация Sigmar1 на митохондриальной мембране, особенно на внутренней митохондриальной мембране, была изображена в сердечной ткани. Кроме того, было также обнаружено, что Sigmar1 расположен на саркоплазматическом/эндоплазматическом ретикулуме (S/ER) и лизосомах на ультраструктурном уровне, как показано на рисунке 2A-D.
Критическим шагом в этом протоколе является этап травления или демаскации антигена с использованием высококонцентрированного раствора метапериодата натрия для разоблачения антигена после фиксации и осмикации глутаральдегида. В этом протоколе применяли однократную обработку с высокой концентрацией (5%) метапериодата натрия в течение 30 мин при комнатной температуре. На этом этапе необходима дополнительная осторожность, поскольку более длительная или более высокая концентрация инкубации метапериодата натрия приведет к агрегации структур, потере определения мембраны для органелл и вызовет перфорацию в секции, что затруднит визуализацию белка или структуры. Альтернативно, более низкая концентрация (3%) раствора метапериодата в два этапа в течение 30 мин также может быть использована вместо 5% метапериодата. Исследования показали, что этот вариант демонстрирует аналогичные результаты, как и при использовании 5% раствора метапериодата для одноэтапной 30-минутной инкубации. Однако 3% раствор метапериодата в течение 30 мин инкубации в течение двух раз обеспечивает лучший контроль над процессом 26,27,28. Первоначально в этом протоколе использовалась инкубация срезов с 10% раствором метапериодата в течение 30 мин. Однако из-за слишком большого количества перфораций, созданных в тканевом сечении этой концентрацией, конечная концентрация и продолжительность инкубации раствора метапериодата были уменьшены и оптимизированы до 5% в течение 30 мин.
Еще один шаг требовал оптимизации времени фиксации глутаровым альдегидом. Неоптимальная фиксация тканей приводит к неадекватной маркировке QD, тогда как чрезмерная фиксация тканей приводит к более высокой неспецифической маркировке. Поэтому необходимо тщательно рассмотреть вопрос об определении и титровании оптимального уровня фиксации тканей для правильной и специфической маркировки белков. В этом методе с использованием тканей сердца время фиксации глутаровым альдегидом титровали с использованием 24 ч и 48 ч в качестве временных точек. Основываясь на изображениях окрашивания секций, зафиксированных для обеих временных точек, было обнаружено, что участки, зафиксированные в течение 24 часов, отображали лучшие результаты. На сегодняшний день нанокристаллы QD доступны в нескольких размерах, включая 525, 565, 585, 605, 655 и 705 нм11,29. Каждый из этих QD имеет свои собственные спектры излучения и излучает флуоресценцию на разных длинах волн. Кроме того, эти коммерчески доступные QD разных размеров отображают различные формы; например, QD 525, 565 и 585 практически сферические с различными размерами, тогда как QD 605, 655 и 705 имеют неправильную продолговатую форму. Из этих различных нанокристаллов QD QD 525, 565 и 655 легко отличить друг от друга11,29. Эти различия в спектрах излучения и формах делают QD отличным кандидатом для мультимаркировки белков и визуализации с помощью флуоресценции и электронной микроскопии. В этом исследовании коммерчески доступный QD, QD 655, был использован для маркировки белка Sigmar1, чтобы отличить его от любого неспецифического фона в окрашенных участках.
Другим аналогом QD для маркировки белка в микроскопии с высоким разрешением является частица иммунозолотого. Частицы иммунозолотого традиционно используются для маркировки белков для микроскопии с высоким разрешением. Эти частицы золота обладают высокой электронной плотностью и легко идентифицируются по сравнению с нанокристаллами QD. Тем не менее, QD демонстрирует лучшую эффективность с лучшим проникновением в ткани, более высокой стабильностью и сроком годности, а также лучшим удержанием ультраструктурных компонентов, что делает их лучшим кандидатом для маркировки белка 4,5. QD также обладает уникальной способностью обнаруживаться как световой, так и электронной микроскопией, что повышает его ценность по сравнению с маркировкой иммунозолотого10.
Одним из ограничений этого QD-опосредованного иммуномаркировки является использование тетроксида осмия во время обработки. Тетроксид осмия используется для увеличения электронной плотности, проводимости и контрастности менее электронно-плотных и менее контрастных биологических мембранных структур 5,30. Однако использование тетроксида осмия мгновенно и необратимо разрушает свойство образца создавать флуоресценцию при маркировке QD6. Это ограничивает использование QD в флуоресцентной микроскопии. Альтернативный подход, исключающий использование тетроксида осмия, будет выгоден для сохранения флуоресцентных свойств и, следовательно, двойного применения QD-опосредованного иммуномаркировки. Некоторые из новых моделей ТЕА имеют возможность подключения системы энергодисперсионного рентгеновского анализа (EDX), которая позволяет идентифицировать элементный состав материалов. Другим ограничением исследования является отсутствие элементного отображения образца и анализа изображений с использованием EDX. Поэтому будущие исследования должны быть сосредоточены на EDX-анализе спектров QD для анализа элементного состава.
QD маркировка белков получила большое внимание в последнее время. QD предлагает несколько применений и преимуществ как в биологических исследованиях, так и в медицинской терапии. QD, дополнительно обернутый полидентатным лигандом, демонстрирует повышенную стабильность, поддерживая квантовый выход. Кроме того, инкапсуляция QD с этими био-благоприятными агентами также увеличивает его биодоступность в тканях, что делает его хорошим кандидатом для потенциального применения при обнаружении опухолей, визуализации живых клеток, доставке лекарств и визуализации тканей 3,31,32.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана грантами Национальных институтов здравоохранения: R01HL145753, R01HL145753-01S1, R01HL145753-03S1 и R01HL152723; LSUHSC-S CCDS Finish Line Award, COVID-19 Research Award и LARC Research Award для MSB; LSUHSC-S Малкольм Фейст Сердечно-сосудистая и AHA Постдокторская стипендия CSA (20POST35210789); и LSUHSC-S Малкольм Фейст Преддокторская стипендия в РА.
Материалы
| Name | Company | Catalog Number | Comments |
| 200 Mesh copper grid | Ted Pella | G200HH | |
| 6-month-old male mice with FVB/N background | Jackson Laboratory, Bar Harbor, ME | ||
| Acetone 100% | Fisher Chemicals | A949 | |
| Antibody diluent | Dako | S3022 | |
| anti-Sigmar1 antibody | Cell Signaling | 61994S | |
| Biotinylated goat anti-rabbit IgG antibody | Sigma Aldrich | B7389 | |
| BSAc (10%) | Electron Microscopy Sciences | 25557 | |
| Calcium chloride | Sigma Aldrich | C7902 | |
| Cytoseal Xyl | Thermo fisher | 8312-4 | |
| DER 732C36AA10:C33 | Electron Microscopy Sciences | 13010 | |
| Dextrose | Sigma Aldrich | G7528 | |
| Diamond Knife | Diatome | Histo; Ultra 450 | |
| DMAE | Electron Microscopy Sciences | 13300 | |
| Electron microscope | JEOL | JEOL-1400 Flash | |
| ERL 4221 | Electron Microscopy Sciences | 15004 | |
| Ethanol 100% | Fisher Chemicals | A405P | |
| Glutaraldehyde 3% | Electron Microscopy Sciences | 16538-15 | |
| Glycine | Alfa Aesar | A13816 | |
| Hydrochloric acid | Fisher Scientific | SA56 | |
| Micromolds | Ted Pella | 10505 | |
| Microtome | Leica Microsystem | EM UC7 | |
| Normal goat serum | Invitrogen | PCN5000 | |
| NSA | Electron Microscopy Sciences | 19050 | |
| Osmium tetroxide | Electron Microscopy Sciences | 19150 | |
| Parafilm | Genesse Scientific | 16-101 | |
| Potassium Chloride | Sigma Aldrich | P5655 | |
| Potassium Phosphate monobasic | Sigma Aldrich | 71640 | |
| Qdot 655 Streptavidin Conjugate | Invitrogen | Q10121MP | |
| Sodium Acetate | Fisher Scientific | BP334 | |
| Sodium Cacodylate | Electron Microscopy Sciences | 12300 | |
| Sodium Chloride | Fisher Scientific | BP358 | |
| Sodium metaperiodate | Sigma Aldrich | 71859 | |
| Sodium Phosphate dibasic | Sigma Aldrich | P9541 | |
| Surgical blade (size 10) | Aspen surgical | 371110 | |
| TEM image software | AMT-V700 | AMT TEM imaging systems | |
| TEM imaging camera | XR80 TEM series | AMT TEM imaging systems | |
| Toluidine Blue O solution (0.5%) | Fisher Scientic | S25612 | |
| Uranyl acetate | Polysciences | 21447 |
Ссылки
- Lidke, D. S., Lidke, K. A. Advances in high-resolution imaging - techniques for three-dimensional imaging of cellular structures. Journal of Cell Science. 125 (11), 2571-2580 (2012).
- de Duve, C. Tissue fraction-past and present. The Journal of Cell Biology. 50 (1), 20 (1971).
- Pleskova, S., Mikheeva, E., Gornostaeva, E., Saquib, Q., Faisal, M., Al-Khedhairy, A. A., Alatar, A. A. . Cellular and Molecular Toxicology of Nanoparticles. , 323-334 (2018).
- Mayhew, T. M., Mühlfeld, C., Vanhecke, D., Ochs, M. A review of recent methods for efficiently quantifying immunogold and other nanoparticles using TEM sections through cells, tissues and organs. Annals of Anatomy - Anatomischer Anzeiger. 191 (2), 153-170 (2009).
- Kuipers, J., de Boer, P., Giepmans, B. N. G. Scanning EM of non-heavy metal stained biosamples: Large-field of view, high contrast and highly efficient immunolabeling. Experimental Cell Research. 337 (2), 202-207 (2015).
- Deerinck, T. J. The application of fluorescent quantum dots to confocal, multiphoton, and electron microscopic imaging. Toxicologic Pathology. 36 (1), 112-116 (2008).
- Nisman, R., Dellaire, G., Ren, Y., Li, R., Bazett-Jones, D. P. Application of quantum dots as probes for correlative fluorescence, conventional, and energy-filtered transmission electron microscopy. Journal of Histochemistry & Cytochemistry. 52 (1), 13-18 (2004).
- Michalet, X., et al. Quantum dots for live cells, in vivo imaging, and diagnostics. Science. 307 (5709), 538-544 (2005).
- Killingsworth, M. C., Bobryshev, Y. V. Correlative light- and electron microscopy using quantum dot nanoparticles. Journal of Visualized Experiments. (114), e54307 (2016).
- Deerinck, T. J., Giepmans, B. N. G., Smarr, B. L., Martone, M. E., Ellisman, M. H., Bruchez, M. P., Hotz, C. Z., Ellisman, M. H. . Quantum Dots: Applications in Biology. , 43-53 (2007).
- Giepmans, B. N. G., Deerinck, T. J., Smarr, B. L., Jones, Y. Z., Ellisman, M. H. Correlated light and electron microscopic imaging of multiple endogenous proteins using Quantum dots. Nature Methods. 2 (10), 743-749 (2005).
- Lidke, D. S., et al. Quantum dot ligands provide new insights into erbB/HER receptor-mediated signal transduction. Nature Biotechnology. 22 (2), 198-203 (2004).
- Pleskova, S. N., et al. Differences in the functional activity of human neutrophilic granulocytes in their interactions with semiconductor quantum dots. Morfologiia. 135 (3), 47-49 (2009).
- Crane, J., Haggie, P., Verkman, A. Quantum dot single molecule tracking reveals a wide range of diffusive motions of membrane transport proteins. Proceedings of SPIE. 7189, (2009).
- Hanaki, K. -. i., et al. Semiconductor quantum dot/albumin complex is a long-life and highly photostable endosome marker. Biochemical and Biophysical Research Communications. 302 (3), 496-501 (2003).
- Lim, Y. T., et al. . Selection of quantum dot wavelengths for biomedical assays and imaging. 2, 50-64 (2003).
- Gao, X., Cui, Y., Levenson, R. M., Chung, L. W. K., Nie, S. In vivo cancer targeting and imaging with semiconductor quantum dots. Nature Biotechnology. 22 (8), 969-976 (2004).
- Åkerman, M. E., Chan, W. C. W., Laakkonen, P., Bhatia, S. N., Ruoslahti, E. Nanocrystal targeting in vivo. Proceedings of the National Academy of Sciences. 99 (20), 12617-12621 (2002).
- Sarwat, S. A. -. O. X., Stapleton, F., Willcox, M., Roy, M. A. -. O. Quantum dots in ophthalmology: A literature review. Current Eye Research. 44 (10), 1037-1046 (2019).
- Aishwarya, R., Abdullah, C. S., Morshed, M., Remex, N. S., Bhuiyan, M. S. Sigmar1's molecular, cellular, and biological functions in regulating cellular pathophysiology. Frontiers in Physiology. 12, 705575 (2021).
- Bohne, B., Harding, G. . Processing the mouse temporal bone for gross, cellular and subcellular evaluation poster. , (2004).
- Roszkowski, M. . The effects of acute stress on Apold1 gene expression and blood-brain barrier permeability. , (2014).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio-protocol. 11 (5), 3988 (2021).
- Jones, W. K., et al. Ablation of the murine alpha myosin heavy chain gene leads to dosage effects and functional deficits in the heart. Journal of Clinical Investigation. 98 (8), 1906-1917 (1996).
- Hunter, E. E. . Practical Electron Microscopy: A Beginner's Illustrated Guide. , (1993).
- Morris, R. E., Ciraolo, G. M. A universal post-embedding protocol for immunogold labelling of osmium-fixed, epoxy resin-embedded tissue. Journal of Electron Microscopy. 46 (4), 315-319 (1997).
- Brorson, S. H. Deplasticizing or etching of epoxy sections with different concentrations of sodium ethoxide to enhance the immunogold labeling. Micron. 32 (2), 101-105 (2001).
- Lobo, M. V. T., et al. Ultrastructural Staining with Sodium Metaperiodate and Sodium Borohydride. Journal of Histochemistry & Cytochemistry. 50 (1), 11-19 (2002).
- Bruchez, M., Moronne, M., Gin, P., Weiss, S., Alivisatos, A. P. Semiconductor nanocrystals as fluorescent biological labels. Science. 281 (5385), 2013-2016 (1998).
- Tapia, J. C., et al. High-contrast en bloc staining of neuronal tissue for field emission scanning electron microscopy. Nature Protocols. 7 (2), 193-206 (2012).
- Smith, A. M., Duan, H., Mohs, A. M., Nie, S. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Advanced Drug Delivery Reviews. 60 (11), 1226-1240 (2008).
- Gour, A., Ramteke, S., Jain, N. K. Pharmaceutical applications of quantum dots. AAPS PharmSciTech. 22 (7), 233 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены