Method Article
Visualizando a Localização Subcelular de uma Proteína no Coração usando Imunomarcação Mediada por Pontos Quânticos seguida de Microscopia Eletrônica de Transmissão
Neste Artigo
Resumo
O presente protocolo descreve um método de imunomarcação de uma proteína nas seções do tecido cardíaco usando pontos quânticos. Esta técnica fornece uma ferramenta útil para visualizar a localização e expressão subcelular de qualquer proteína no nível ultraestrutural.
Resumo
A localização subcelular é fundamental para delinear a função adequada e determinar os mecanismos moleculares de uma determinada proteína. Várias técnicas qualitativas e quantitativas são usadas para determinar a localização subcelular de proteínas. Uma das técnicas emergentes na determinação da localização subcelular de uma proteína é a imunomarcação mediada por pontos quânticos (QD) de uma proteína, seguida de imagens com microscopia eletrônica de transmissão (MET). QD é um nanocristal semicondutor com uma dupla propriedade de estrutura cristalina e alta densidade eletrônica, o que os torna aplicáveis à microscopia eletrônica. Este método atual visualizou a localização subcelular da proteína do receptor Sigma 1 (Sigmar1) usando QD-TEM no tecido cardíaco em nível ultraestrutural. Pequenos cubos das seções de tecido cardíaco de um camundongo do tipo selvagem foram fixados em glutaraldeído a 3%, posteriormente osmicados, corados com acetato de uranila, seguidos de desidratação sequencial com etanol e acetona. Essas seções de tecido cardíaco desidratado foram embutidas em resinas epóxi de baixa viscosidade, cortadas em seções finas de 500 nm de espessura, colocadas na grade e, posteriormente, submetidas ao desmascaramento de antígeno com metaperiodato de sódio a 5%, seguido de têmpera dos aldeídos residuais com glicina. Os tecidos foram bloqueados, seguidos de incubação sequencial em anticorpo primário, anticorpo secundário biotinilado e QD conjugado com estreptavidina. Essas seções coradas foram secas e fotografadas em alta ampliação usando MET. A técnica QD-TEM permitiu a visualização da localização subcelular da proteína Sigmar1 no nível ultraestrutural do coração. Essas técnicas podem ser usadas para visualizar a presença de qualquer proteína e localização subcelular em qualquer sistema de órgãos.
Introdução
O corpo humano é composto por muitas proteínas responsáveis por inúmeras funções corporais. A função das proteínas depende em grande parte da sua localização no órgão e nas organelas celulares. Várias técnicas, incluindo fracionamento subcelular, imunofluorescência e extração proteica mediada por detergente, são comumente utilizadas para determinar a localização subcelular da proteína 1,2. A microscopia com corante imunofluorescente é o método mais utilizado entre essas técnicas. No entanto, os corantes fluorescentes utilizados nesta técnica são menos estáveis e propensos ao fotobranqueamento3. Outras técnicas envolveram microscopia de alta resolução para visualizar a proteína em um nível ultraestrutural por imunomarcação de proteínas com nanocristais densos em elétrons, metais pesados (ouro, ferritina) ou pontos quânticos e seguida de visualizá-las usando microscopia eletrônica de transmissão (MET)4,5.
O QD é um nanocristal semicondutor composto por compostos metálicos semicondutores com propriedades de fotoluminescência controláveis, possuindo um grande significado em sistemas biológicos3. Os nanocristais QD são feitos em um formato de núcleo-casca onde um nanocristal é encapsulado na formação de nanocristais para garantir sua estabilidade e funcionamento adequados. A combinação de nanocristais núcleo-casca comumente usada é CdSe/ZnS, CdSe/CdS CdSe/ZnSe, CdTe/CdS, CdTe/ZnS e CdTe/CdS/ZnS (core/shell/shell)3. Dentre essas combinações de nanocristais, CdSe/ZnS e CdSe/CdS são mais vigorosamente estudadas e frequentemente utilizadas como conjugados secundários de anticorpos 3,6. Essas nanopartículas QD também possuem propriedades fluorescentes com diferentes espectros de excitação e emissão do que os fluoróforos tradicionais. O QD emprega a excitação de elétrons da banda de valência a granel para exibir maiores rendimentos quânticos de fluorescência em comparação com os fluoróforos tradicionais. O arranjo de nanocristais de metais semicondutores torna a marcação mediada por QD mais estável e resistente ao fotobranqueamento6. Além disso, o núcleo de nanocristal no QD e sua estrutura cristalina permitem que o QD de diferentes tamanhos tenha uma ampla gama de espectros de absorção e picos de emissão muito estreitos7. Além disso, essas partículas QD são grandes o suficiente para produzir alta densidade eletrônica, tornando-as úteis em técnicas de microscopia de alta resolução, incluindo microscopia eletrônica de transmissão 5,8,9. Esses nanocristais QD também estão comercialmente disponíveis em múltiplos tamanhos com diferentes espectros e formas de emissão de fluorescência, tornando-os um ótimo candidato para marcação com múltiplos anticorpos10,11.
A tecnologia QD atraiu grande importância na pesquisa biológica devido a múltiplas propriedades funcionais, incluindo o uso em imagens de células vivas, o estudo dos mecanismos de transporte na célula, o transporte por membrana do movimento de difusão da proteína, a heterogeneidade funcional das células e a marcação da organela intracelular 3,12,13,14,15,16 . A QD também é útil no diagnóstico molecular para direcionar e detectar tecidos cancerígenos, caracterizar o perfil molecular e o estado imunológico do tumor e visualizar o corpo vítreo e as membranas epirretinianas 3,17,18. Além disso, a QD também pode ser utilizada em terapias médicas para o tratamento de neoplasias malignas tumorais por meio de terapia fotodinâmica e anomalias oftálmicas, mediante a administração de medicamentos aos olhos 3,17,18,19.
Usando esses nanocristais QD altamente úteis, o presente estudo determinou a localização subcelular de uma proteína chamada receptor Sigma 1 (Sigmar1). Sigmar1 é uma proteína de chaperona molecular multitarefa expressa de forma onipresente. Estudos extensivos com foco na localização subcelular de Sigmar1 em diferentes tecidos e órgãos relataram uma localização subcelular específica do tipo celular e tecidual provocando função molecular20. Em diferentes células (células neuronais, fotorreceptoras e imunes) e tecidos (fígado e cérebro) usando diferentes abordagens bioquímicas, estudos relataram a localização de Sigmar1 no retículo endoplasmático (RE), membrana ER associada a mitocôndrias (MAM), envelope nuclear, membrana plasmática, retículo nucleoplasmático, núcleo e mitocôndrias. Apesar de todos esses estudos, a localização subcelular de Sigmar1 no coração permaneceu desconhecida20. Portanto, a localização subcelular de Sigmar1 no tecido cardíaco foi determinada usando o imunomarcador mediado por QD seguido de imagem TEM.
Protocolo
Os procedimentos de manuseio de animais neste protocolo estavam em conformidade com o Guia para o Cuidado e Uso de Animais de Laboratório (Oitava Edição, National Institutes of Health, Bethesda, MD) e foram aprovados pelo Comitê de Cuidados e Uso de Animais do Centro de Ciências da Saúde da Louisiana State University-Shreveport. Camundongos machos de seis meses de idade, com fundo FVB/N, foram utilizados para o presente estudo. Os camundongos foram obtidos de fontes comerciais (ver Tabela de Materiais). Os ratos utilizados foram alojados em um ambiente bem regulado em gaiolas que permitem um ciclo claro-escuro de 12 horas, providas de água e uma dieta regular de ração ad libitum, e foram cuidados de acordo com o NIH Guide for the Care and Use of the Laboratory Animals. O processo geral é ilustrado na Figura 1.
1. Preparação animal
- Anestesiar os ratos usando isoflurano a 3%. Abra o peito fazendo uma incisão horizontal na região acima do abdômen médio e puxando a pele. Cuidadosamente, faça outra incisão para abrir a cavidade torácica sem perfurar nenhum outro órgão21,22,23.
- Perfundir24 o coração através do ápice primeiro e, em seguida, o ventrículo direito usando glutaraldeído frio a 3% em solução cardioplégica (50 mM KCl, dextrose a 5% em PBS, ver Arquivo Suplementar 1) por 2 minutos para garantir o relaxamento miocárdico completo.
- Perfundir o coração usando glutaraldeído gelado a 3% em 0,1 M de tampão de cacodilato de sódio (pH 7,4, etapa 2.1,1) por mais 2 min. Usando a pressão da gravidade, use uma agulha de 25 G 5/8" para introduzir os fixadores no coração. Imediatamente após o coração começar a se encher com o fixador, levante o ápice do coração e corte os vasos por baixo a 1-2 mm do coração para aliviar a pressão e permitir que os líquidos drenem.
- Dissecar o coração, remover os átrios24 e soltar os ventrículos em glutaraldeído gelado a 3%/cacodilato de sódio 0,1 M em uma placa de Petri. Faça uma borboleta cortada após 30-60 min de fixação e coloque-a em uma placa de Petri contendo 3% de glutaraldeído/cacodilato (ver Tabela de Materiais). Pique o coração usando uma lâmina cirúrgica em pequenos cubos de 1 mm3 enquanto estiver em solução de glutaraldeído/cacodilato.
- Fixar/imergir o tecido cardíaco dissecado em solução de glutaraldeído/cacodilato durante 24 h a 4 °C.
2. Processamento do tecido cardíaco
- Após 24 h de fixação, lavar os tecidos em 0,1 M de tampão de cacodilato de sódio por 20 min.
- Prepare o buffer de cacodilato 0,1 M seguindo as etapas abaixo.
- Para preparar o tampão de cacodilato de sódio 0,1 M, prepare um estoque de 1 M de tampão de cacodilato de sódio dissolvendo o cacodilato de sódio (21,4 g) e de solução de cloreto de cálcio a 1% (3 mL) em 90 mL de água destilada. Aumente o volume da solução para 100 ml adicionando a água destilada. Mexa bem a solução e deixe-a durante a noite para dissolver o soluto.
- Em seguida, pegue 10 mL de solução de calodilato de sódio 1 M e adicione-o a 80 mL de água destilada. Ajuste o pH para 7,4 usando HCl e volume-o até 100 mL adicionando água destilada.
- Prepare o buffer de cacodilato 0,1 M seguindo as etapas abaixo.
- Repetir a lavagem em tampão de cacodilato de sódio 0,1 M por mais 20 min. Remova os tecidos do tampão de cacodilato de sódio e mergulhe-os em solução de tetróxido de ósmio a 2% por 4 h à temperatura ambiente. Esse processo é chamado de osmicação.
- Prepare a solução de tetróxido de ósmio a 2% seguindo os passos abaixo.
- Para preparar uma solução de tetróxido de ósmio a 2%, tome solução de tetróxido de ósmio a 4%, 4 mL (ver Tabela de Materiais), 1 M de solução de calodilato de sódio (0,8 mL) e água destilada (3,2 mL) para fazer um total de 8 mL de solução.
NOTA: Todo este processo e as etapas a partir daqui devem ser realizadas no exaustor.
- Para preparar uma solução de tetróxido de ósmio a 2%, tome solução de tetróxido de ósmio a 4%, 4 mL (ver Tabela de Materiais), 1 M de solução de calodilato de sódio (0,8 mL) e água destilada (3,2 mL) para fazer um total de 8 mL de solução.
- Prepare a solução de tetróxido de ósmio a 2% seguindo os passos abaixo.
- Após a osmicação, imergir os tecidos em solução de acetato de sódio a 2% por 10 min à temperatura ambiente.
- Preparar solução de acetato de sódio a 2% dissolvendo 4 g de acetato de sódio em 20 mL de água destilada.
- Em seguida, mergulhe os tecidos em solução de acetato de uranilo a 2% por 1 h à temperatura ambiente.
- Preparar solução de acetato de uranilo a 2% dissolvendo 4 g de acetato de uranilo em 20 mL de água destilada.
- Após a coloração com acetato de uranila, desidratar os tecidos sequencialmente através dos álcoois graduados e acetona na ordem mencionada no Arquivo Suplementar 1.
3. Incorporação de tecido cardíaco
- Incorpore os tecidos desidratados em resina epóxi de baixa viscosidade seguindo os passos abaixo.
- Para fazer resina epóxi de baixa viscosidade, misture 10,24 mL de monômero epóxi de dióxido de ciclohexeno de vinil (ERL 4221), 6,74 mL de éter diglicidílico de polipropilenoglicol (DER 732) e 30,05 mL de anidrido succínico nonenilo (NSA) (ver Tabela de Materiais) em um tubo de 50 mL. Mexa bem a suspensão à mão durante 2 minutos.
- Adicione 18 gotas de acelerador epóxi de 2-dimetilaminoetanol (DMAE, ver Tabela de Materiais) e agite a suspensão para misturar bem os componentes.
- Impregnar os tecidos em resina epóxi na seguinte sequência de mistura.
- Substitua a acetona 100% por resina: suspensão de acetona 1:1 e mergulhe os tecidos nela por 1 h à temperatura ambiente.
- Substitua a resina 1:1: suspensão de acetona por resina 6:1: suspensão de acetona e mergulhe os tecidos nela por 3 h.
- Finalmente, substitua a suspensão de resina: acetona 6:1 por suspensão de 100% de resina e deixe os tecidos imersos nela durante a noite à temperatura ambiente.
- Colocar os tecidos em resina fresca em micromoldes de 8 mm (ver Tabela de Materiais) e curar os tecidos incorporados a 70 °C durante a noite.
NOTA: Certifique-se de que a resina é dura, mas não quebradiça após a cura.
4. Secção de tecidos usando um ultramicrótomo
- Apare os blocos de resina com o tecido para não mais de 1 mm antes de montar no ultramicrótomo (ver Tabela de Materiais). Coloque o molde com a maior precisão possível no braço segmentado do ultramicrótomo e avance manualmente o molde de amostra em direção à faca de diamante.
- Corte as seções a uma espessura de 500 nm (meio mícron) com uma faca Histo (consulte Tabela de Materiais) e, usando a ferramenta de loop EM, pegue-as e coloque-as em uma lâmina de vidro.
- Coloque a lâmina de vidro em uma placa quente para a mancha azul de toluidina25 para encontrar a área de interesse.
- Depois de encontrar a área de interesse, use uma faca Ultra 45° (ver Tabela de Materiais) para produzir seções ultrafinas de ouro pálido (100 nm). Coloque essas seções ultrafinas no lado opaco de uma grade de cobre de malha 200.
5. Coloração ultrafina da seção cardíaca
- Inicie a coloração desmascarando o antígeno usando uma solução de gravura, ou seja, solução de metaperiodato de sódio a 5%.
- Preparar 500 μL de solução de metaperiodato de sódio a 5% (ver Tabela de Materiais) em água destilada.
NOTA: Prepare a solução fresca antes de utilizar. - Coloque 20 μL de solução de metaperiodato de sódio sobre uma película de parafina limpa. Coloque as grades completamente secas com seções de tecido na gota da solução de gravura.
NOTA: O lado opaco da grade com a seção de tecido deve estar voltado para a solução de gravura. - Deixe a grelha de secção sobre a solução durante 30 minutos à temperatura ambiente.
- Preparar 500 μL de solução de metaperiodato de sódio a 5% (ver Tabela de Materiais) em água destilada.
- Lave a seção de tecido gravada colocando-a em uma gota de água destilada por 60 s.
- Bloquear os aldeídos residuais colocando as grelhas de secção numa gotícula de solução de glicina 0,05 M durante 10 minutos à temperatura ambiente. Coloque as bordas da grade no papel de filtro para remover a solução residual de glicina.
- Preparar solução de glicina 0,05 M (ver Tabela de Materiais) dissolvendo 3,75 mg de glicina em 1 ml de 1x PBS (pH 7,4).
- Coloque as grades de seção em 10-20 μL de solução de bloqueio por 25 min à temperatura ambiente.
NOTA: Composição da solução de bloqueio: 2 μL de soro de cabra normal a 1% (NGS) + 20 μL de BSA a 1% (concentração final: 10%) + 178 μL de 1x PBS (pH 7,4) para fazer um volume final de 200 μL. - Limpe as bordas da grade no papel de filtro e coloque a seção da grade no diluente de anticorpos para condicionamento à temperatura ambiente por 10 min.
- Incubar as secções da grelha com anticorpos primários (Sigmar1 neste caso, ver Tabela de Materiais; diluído 1:10 em diluente de anticorpos) durante 1 h 30 min numa câmara umidificado.
- Seque a grade e lave as seções da grade com diluente de anticorpos duas vezes por 5 minutos cada.
- Incubar as secções da grelha com anticorpo secundário biotinilado (neste caso, anticorpo secundário policlonal biotinilado de cabra anti-coelho, ver Tabela de Materiais; diluído 1:10 em diluente de anticorpos) durante 1 h numa câmara humidificada.
- Seque a grade e lave as seções da grade com diluente de anticorpos duas vezes por 5 minutos cada.
- Incubar as secções da grelha em QD conjugado com treptavidina comercialmente disponível (QD655nm, ver Tabela de Materiais; diluído 1:10 em diluente de anticorpos) durante 1 h numa câmara humidificada à temperatura ambiente. Evite a exposição à luz cobrindo a câmara com papel alumínio.
- Seque as bordas da grade usando papel de filtro e lave as seções da grade colocando-as em gotículas de água por 2 min.
- Limpe as bordas da grade para secar.
6. Imagem por microscopia eletrônica de transmissão (MET)
- Coloque as seções ultrafinas em grades de cobre em um suporte de quarteto de espécimes e prenda-as em uma posição que permita a seleção de grades no feixe de elétrons.
- Inserir o suporte do provete na coluna do microscópio e engatar o interruptor da bomba para evacuar o goniómetro, seguido da inserção completa do suporte do espécime na coluna do microscópio (ver Tabela de Materiais).
- Ajuste a tensão para 80 kV antes de gerar o feixe para observação da imagem.
- Concentre-se bem na área desejada, capture a imagem usando uma câmera digital de alta velocidade e salve o arquivo no formato .tif.
NOTA: A configuração do microscópio para capturar a imagem neste estudo foi a tensão de aceleração ou tensão de alta tensão de 80 kV e uma ampliação de 20.000x.
Resultados
A presente metodologia QD-TEM visualizou a presença de Sigmar1 e sua localização nos compartimentos cardíacos subcelulares através da realização de marcação QD direcionada anti-Sigmar1 em seções cardíacas ultrafinas de camundongos adultos. O anti-Sigmar1 denso em elétrons marcado com QD nas membranas mitocondriais (interna e externa), lisossomos e na interface membrana-mitocondrial do retículo endoplasmático/retículo sarcoplasmático (ER/SR) (Figura 2A,B) foram ilustrados pelas imagens QD-TEM. Além disso, cortes cardíacos também foram marcados com IgG e QD de coelho como um controle isotipo para o anticorpo primário anti-coelho anti-Sigmar1 (Figura 2C,D). Portanto, a imagem QD-TEM destacou a localização do Sigmar1 endógeno e seu enriquecimento principalmente nos lisossomos e nas membranas mitocondriais.
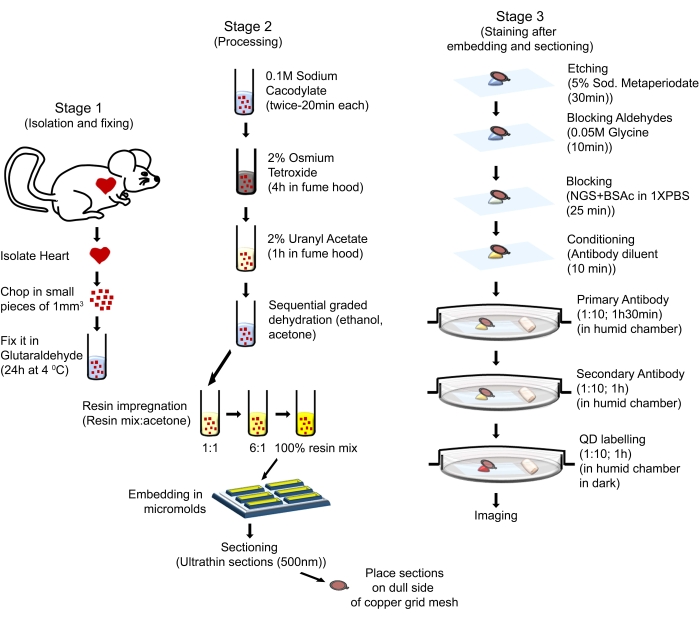
Figura 1: Ilustração esquemática mostrando as etapas e procedimentos sequenciais usados para executar o QD-TEM. Clique aqui para ver uma versão maior desta figura.
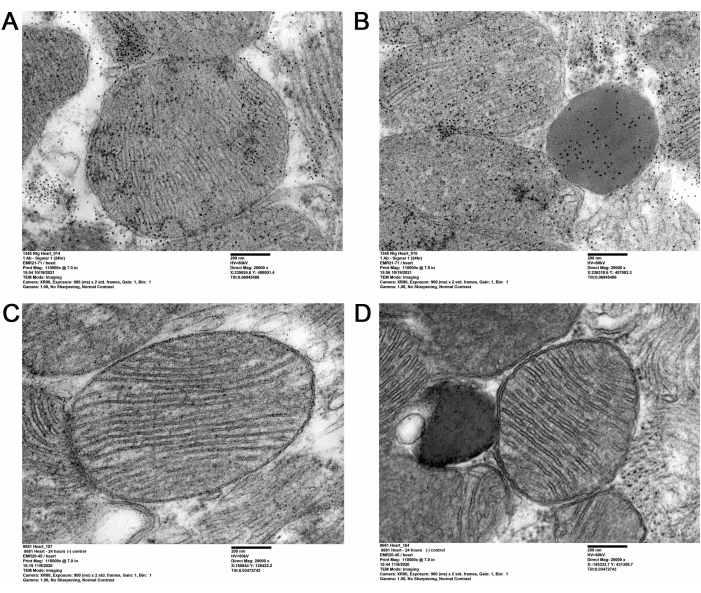
Figura 2: QD imunomarcado com Sigmar1 em tecidos cardíacos de camundongos adultos. (A,B) Imagens representativas de MET mostrando QD marcado com Sigmar1 em mitocôndrias (membrana externa e interna), retículo endoplasmático (RE) associado a mitocôndrias / retículo sarcoplasmático (SR) membranas e lisossomos. (C,D) Imagem MET das seções cardíacas do controle isotipo marcadas com QDs e IgG de coelho. Barra de escala: 200 nm. Por favor, clique aqui para ver uma versão maior desta figura.
Arquivo Suplementar 1: Composição do PBS e outras soluções utilizadas para desidratação tecidual. Clique aqui para baixar este arquivo.
Discussão
No presente estudo, a imunomarcação mediada por QD foi utilizada para mostrar distintamente a localização subcelular de Sigmar1. Usando QD, a localização de Sigmar1 na membrana mitocondrial, especialmente a membrana mitocondrial interna, foi representada no tecido cardíaco. Além disso, Sigmar1 também se mostrou localizado no retículo sarcoplasmático/endoplasmático (S/RE) e lisossomos no nível ultraestrutural, como mostra a Figura 2A-D.
Uma etapa crítica neste protocolo é a etapa de gravação ou desmascaramento de antígeno usando solução de metaperiodato de sódio altamente concentrada para desmascarar o antígeno após fixação e osmicação de glutaraldeído. Este protocolo utilizou um único tratamento com alta concentração (5%) de metaperiodato de sódio por 30 min à temperatura ambiente. Cuidados extras são necessários nesta etapa, pois uma duração mais longa ou maior concentração para a incubação do metaperiodato de sódio resultará em agregação de estruturas, perda de definição de membrana para as organelas e causará perfurações na seção, dificultando a visualização da proteína ou da estrutura. Alternativamente, uma concentração mais baixa de (3%) de solução de metaperiodato em duas etapas por 30 minutos também pode ser usada em vez de metaperiodato a 5%. Estudos mostraram que esta opção apresenta resultados semelhantes aos da solução de metaperiodato a 5% para incubação de 30 minutos em uma etapa. No entanto, uma solução de metaperiodato a 3% por 30 min de incubação por duas vezes proporciona melhor controle sobre o processo26,27,28. Inicialmente, este protocolo utilizou a incubação dos cortes com solução de metaperiodato a 10% por 30 min. No entanto, devido ao excesso de perfurações criadas na seção tecidual por essa concentração, a concentração final e a duração da incubação da solução de metaperiodato foram reduzidas e otimizadas para 5% por 30 min.
Outro passo exigiu a otimização do tempo de fixação com glutaraldeído. A fixação subótima dos tecidos resulta em marcação inadequada da QD, enquanto a fixação excessiva dos tecidos resulta em maior marcação inespecífica. Portanto, uma consideração cuidadosa deve ser dada na determinação e titulação de um nível ótimo de fixação tecidual para a marcação adequada e específica das proteínas. Neste método utilizando tecidos cardíacos, o tempo de fixação com glutaraldeído foi titulado utilizando 24 h e 48 h como pontos de tempo. Com base nas imagens de coloração das seções fixadas para ambos os momentos, verificou-se que as seções fixadas por 24 horas apresentaram melhores resultados. Até o momento, os nanocristais QD estão disponíveis em vários tamanhos, incluindo 525, 565, 585, 605, 655 e 705 nm11,29. Cada um desses QD tem seus próprios espectros de emissão e emite fluorescência em diferentes comprimentos de onda. Além disso, esses QDs comercialmente disponíveis de diferentes tamanhos exibem diferentes formas; por exemplo, QD 525, 565 e 585 são virtualmente esféricos com tamanhos diferentes, enquanto QD 605, 655 e 705 são irregulares de forma oblonga. Desses diferentes nanocristais QD, QD 525, 565 e 655 são facilmente distinguíveis um do outro11,29. Essas diferenças nos espectros e formas de emissão tornam o QD um ótimo candidato para multimarcação de proteínas e visualização por fluorescência e microscopia eletrônica. Neste estudo, um QD comercialmente disponível, QD 655, foi usado para rotular a proteína Sigmar1 para distingui-la de qualquer fundo inespecífico nas seções coradas.
Outra contrapartida do QD para marcação de proteínas em microscopia de alta resolução é a partícula de imunoouro. As partículas de imunoouro são tradicionalmente usadas para rotular proteínas para microscopia de alta resolução. Essas partículas de ouro são altamente densas em elétrons e facilmente identificáveis em comparação com os nanocristais QD. No entanto, a QD apresenta melhor eficiência com melhor penetração nos tecidos, maior estabilidade e prazo de validade, e melhor retenção de componentes ultraestruturais, tornando-os um melhor candidato para a marcação de proteínas 4,5. O QD também tem uma capacidade única de ser detectado por microscopia óptica e eletrônica, o que aumenta seu valor sobre a marcação imunodourada10.
Uma limitação dessa imunomarcação mediada por QD é o uso de tetróxido de ósmio durante o processamento. O tetróxido de ósmio é usado para aumentar a densidade eletrônica, a condutividade e o contraste de estruturas de membrana biológica menos densas em elétrons e menos contrastantes 5,30. No entanto, o uso de tetróxido de ósmio instantaneamente e irreversivelmente destrói a propriedade do espécime de criar fluorescência quando marcado com QD6. Isso limita o uso de QD na microscopia de fluorescência. Uma abordagem alternativa omitindo o uso de tetróxido de ósmio será vantajosa na retenção das propriedades fluorescentes e, portanto, na dupla aplicação de imunomarcação mediada por QD. Alguns dos modelos mais recentes de MET têm a opção de anexar o sistema de Análise de Raios X por Energia Dispersiva (EDX) que permite a identificação da composição elementar dos materiais. Outra limitação do estudo é a falta de mapeamento elementar de uma amostra e análise de imagem utilizando EDX. Portanto, estudos futuros devem se concentrar na análise EDX dos espectros QD para analisar a composição elementar.
A marcação QD de proteínas ganhou muita atenção nos últimos tempos. O QD oferece várias aplicações e vantagens tanto na pesquisa biológica quanto na terapêutica médica. O QD sendo adicionalmente envolto com ligante polidentado exibe maior estabilidade, mantendo o rendimento quântico. Além disso, o encapsulamento da QD com esses agentes biofavoráveis também aumenta sua biodisponibilidade nos tecidos, tornando-a uma boa candidata para potencial aplicação na detecção de tumores, imagens de células vivas, liberação de medicamentos e imagens de tecidos 3,31,32.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelos subsídios do National Institutes of Health: R01HL145753, R01HL145753-01S1, R01HL145753-03S1 e R01HL152723; Prêmio de Linha de Chegada LSUHSC-S CCDS, Prêmio de Pesquisa COVID-19 e Prêmio de Pesquisa LARC para MSB; LSUHSC-S Malcolm Feist Cardiovascular e AHA Bolsa de Pós-Doutorado para CSA (20POST35210789); e LSUHSC-S Malcolm Feist Bolsa de Pré-doutorado para RA.
Materiais
| Name | Company | Catalog Number | Comments |
| 200 Mesh copper grid | Ted Pella | G200HH | |
| 6-month-old male mice with FVB/N background | Jackson Laboratory, Bar Harbor, ME | ||
| Acetone 100% | Fisher Chemicals | A949 | |
| Antibody diluent | Dako | S3022 | |
| anti-Sigmar1 antibody | Cell Signaling | 61994S | |
| Biotinylated goat anti-rabbit IgG antibody | Sigma Aldrich | B7389 | |
| BSAc (10%) | Electron Microscopy Sciences | 25557 | |
| Calcium chloride | Sigma Aldrich | C7902 | |
| Cytoseal Xyl | Thermo fisher | 8312-4 | |
| DER 732C36AA10:C33 | Electron Microscopy Sciences | 13010 | |
| Dextrose | Sigma Aldrich | G7528 | |
| Diamond Knife | Diatome | Histo; Ultra 450 | |
| DMAE | Electron Microscopy Sciences | 13300 | |
| Electron microscope | JEOL | JEOL-1400 Flash | |
| ERL 4221 | Electron Microscopy Sciences | 15004 | |
| Ethanol 100% | Fisher Chemicals | A405P | |
| Glutaraldehyde 3% | Electron Microscopy Sciences | 16538-15 | |
| Glycine | Alfa Aesar | A13816 | |
| Hydrochloric acid | Fisher Scientific | SA56 | |
| Micromolds | Ted Pella | 10505 | |
| Microtome | Leica Microsystem | EM UC7 | |
| Normal goat serum | Invitrogen | PCN5000 | |
| NSA | Electron Microscopy Sciences | 19050 | |
| Osmium tetroxide | Electron Microscopy Sciences | 19150 | |
| Parafilm | Genesse Scientific | 16-101 | |
| Potassium Chloride | Sigma Aldrich | P5655 | |
| Potassium Phosphate monobasic | Sigma Aldrich | 71640 | |
| Qdot 655 Streptavidin Conjugate | Invitrogen | Q10121MP | |
| Sodium Acetate | Fisher Scientific | BP334 | |
| Sodium Cacodylate | Electron Microscopy Sciences | 12300 | |
| Sodium Chloride | Fisher Scientific | BP358 | |
| Sodium metaperiodate | Sigma Aldrich | 71859 | |
| Sodium Phosphate dibasic | Sigma Aldrich | P9541 | |
| Surgical blade (size 10) | Aspen surgical | 371110 | |
| TEM image software | AMT-V700 | AMT TEM imaging systems | |
| TEM imaging camera | XR80 TEM series | AMT TEM imaging systems | |
| Toluidine Blue O solution (0.5%) | Fisher Scientic | S25612 | |
| Uranyl acetate | Polysciences | 21447 |
Referências
- Lidke, D. S., Lidke, K. A. Advances in high-resolution imaging - techniques for three-dimensional imaging of cellular structures. Journal of Cell Science. 125 (11), 2571-2580 (2012).
- de Duve, C. Tissue fraction-past and present. The Journal of Cell Biology. 50 (1), 20 (1971).
- Pleskova, S., Mikheeva, E., Gornostaeva, E., Saquib, Q., Faisal, M., Al-Khedhairy, A. A., Alatar, A. A. . Cellular and Molecular Toxicology of Nanoparticles. , 323-334 (2018).
- Mayhew, T. M., Mühlfeld, C., Vanhecke, D., Ochs, M. A review of recent methods for efficiently quantifying immunogold and other nanoparticles using TEM sections through cells, tissues and organs. Annals of Anatomy - Anatomischer Anzeiger. 191 (2), 153-170 (2009).
- Kuipers, J., de Boer, P., Giepmans, B. N. G. Scanning EM of non-heavy metal stained biosamples: Large-field of view, high contrast and highly efficient immunolabeling. Experimental Cell Research. 337 (2), 202-207 (2015).
- Deerinck, T. J. The application of fluorescent quantum dots to confocal, multiphoton, and electron microscopic imaging. Toxicologic Pathology. 36 (1), 112-116 (2008).
- Nisman, R., Dellaire, G., Ren, Y., Li, R., Bazett-Jones, D. P. Application of quantum dots as probes for correlative fluorescence, conventional, and energy-filtered transmission electron microscopy. Journal of Histochemistry & Cytochemistry. 52 (1), 13-18 (2004).
- Michalet, X., et al. Quantum dots for live cells, in vivo imaging, and diagnostics. Science. 307 (5709), 538-544 (2005).
- Killingsworth, M. C., Bobryshev, Y. V. Correlative light- and electron microscopy using quantum dot nanoparticles. Journal of Visualized Experiments. (114), e54307 (2016).
- Deerinck, T. J., Giepmans, B. N. G., Smarr, B. L., Martone, M. E., Ellisman, M. H., Bruchez, M. P., Hotz, C. Z., Ellisman, M. H. . Quantum Dots: Applications in Biology. , 43-53 (2007).
- Giepmans, B. N. G., Deerinck, T. J., Smarr, B. L., Jones, Y. Z., Ellisman, M. H. Correlated light and electron microscopic imaging of multiple endogenous proteins using Quantum dots. Nature Methods. 2 (10), 743-749 (2005).
- Lidke, D. S., et al. Quantum dot ligands provide new insights into erbB/HER receptor-mediated signal transduction. Nature Biotechnology. 22 (2), 198-203 (2004).
- Pleskova, S. N., et al. Differences in the functional activity of human neutrophilic granulocytes in their interactions with semiconductor quantum dots. Morfologiia. 135 (3), 47-49 (2009).
- Crane, J., Haggie, P., Verkman, A. Quantum dot single molecule tracking reveals a wide range of diffusive motions of membrane transport proteins. Proceedings of SPIE. 7189, (2009).
- Hanaki, K. -. i., et al. Semiconductor quantum dot/albumin complex is a long-life and highly photostable endosome marker. Biochemical and Biophysical Research Communications. 302 (3), 496-501 (2003).
- Lim, Y. T., et al. . Selection of quantum dot wavelengths for biomedical assays and imaging. 2, 50-64 (2003).
- Gao, X., Cui, Y., Levenson, R. M., Chung, L. W. K., Nie, S. In vivo cancer targeting and imaging with semiconductor quantum dots. Nature Biotechnology. 22 (8), 969-976 (2004).
- Åkerman, M. E., Chan, W. C. W., Laakkonen, P., Bhatia, S. N., Ruoslahti, E. Nanocrystal targeting in vivo. Proceedings of the National Academy of Sciences. 99 (20), 12617-12621 (2002).
- Sarwat, S. A. -. O. X., Stapleton, F., Willcox, M., Roy, M. A. -. O. Quantum dots in ophthalmology: A literature review. Current Eye Research. 44 (10), 1037-1046 (2019).
- Aishwarya, R., Abdullah, C. S., Morshed, M., Remex, N. S., Bhuiyan, M. S. Sigmar1's molecular, cellular, and biological functions in regulating cellular pathophysiology. Frontiers in Physiology. 12, 705575 (2021).
- Bohne, B., Harding, G. . Processing the mouse temporal bone for gross, cellular and subcellular evaluation poster. , (2004).
- Roszkowski, M. . The effects of acute stress on Apold1 gene expression and blood-brain barrier permeability. , (2014).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio-protocol. 11 (5), 3988 (2021).
- Jones, W. K., et al. Ablation of the murine alpha myosin heavy chain gene leads to dosage effects and functional deficits in the heart. Journal of Clinical Investigation. 98 (8), 1906-1917 (1996).
- Hunter, E. E. . Practical Electron Microscopy: A Beginner's Illustrated Guide. , (1993).
- Morris, R. E., Ciraolo, G. M. A universal post-embedding protocol for immunogold labelling of osmium-fixed, epoxy resin-embedded tissue. Journal of Electron Microscopy. 46 (4), 315-319 (1997).
- Brorson, S. H. Deplasticizing or etching of epoxy sections with different concentrations of sodium ethoxide to enhance the immunogold labeling. Micron. 32 (2), 101-105 (2001).
- Lobo, M. V. T., et al. Ultrastructural Staining with Sodium Metaperiodate and Sodium Borohydride. Journal of Histochemistry & Cytochemistry. 50 (1), 11-19 (2002).
- Bruchez, M., Moronne, M., Gin, P., Weiss, S., Alivisatos, A. P. Semiconductor nanocrystals as fluorescent biological labels. Science. 281 (5385), 2013-2016 (1998).
- Tapia, J. C., et al. High-contrast en bloc staining of neuronal tissue for field emission scanning electron microscopy. Nature Protocols. 7 (2), 193-206 (2012).
- Smith, A. M., Duan, H., Mohs, A. M., Nie, S. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Advanced Drug Delivery Reviews. 60 (11), 1226-1240 (2008).
- Gour, A., Ramteke, S., Jain, N. K. Pharmaceutical applications of quantum dots. AAPS PharmSciTech. 22 (7), 233 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados