Method Article
Floresan Boyut Dışlama Kromatografisi ile Membran Protein Kalitesinin Hızlı Değerlendirilmesi
Bu Makalede
Özet
Bu protokol, aşağı akış fonksiyonel ve yapısal analizi için kalitelerini değerlendirmek üzere membran proteinleri üzerinde floresan boyut dışlama kromatografisi (FSEC) gerçekleştirmeye yönelik bir prosedürü açıklamaktadır. Deterjanda çözünür ve deterjansız koşullar altında çeşitli G-protein kuplajlı reseptörler (GPCR'ler) için toplanan temsili FSEC sonuçları sunulmuştur.
Özet
Membran proteini yapısal aydınlatması ve biyofiziksel karakterizasyonu sırasında, membrandan ekstraksiyondan sonra toplanmamış olanı bulmak için farklı etiketler, kesmeler, delesyonlar, füzyon ortağı eklemeleri ve stabilize edici mutasyonlar içeren çok sayıda protein yapısının denenmesi yaygındır. Ayrıca, membran proteini için en stabilize edici koşulu sağlayan deterjan, katkı maddesi, ligand veya polimeri belirlemek için tampon taraması önemli bir uygulamadır. Membran protein kalitesinin floresan boyut dışlama kromatografisi ile erken karakterizasyonu, protein saflaştırma gereksinimi olmadan farklı yapıları veya koşulları değerlendirmek ve sıralamak için güçlü bir araç sağlar ve bu araç aynı zamanda numune gereksinimini en aza indirir. Membran proteinleri, genellikle GFP etiketi veya benzeri bir etiketle ifade edilerek floresan olarak etiketlenmelidir. Protein doğrudan tüm hücrelerden çözünür ve daha sonra santrifüjleme ile kabaca açıklığa kavuşturulabilir; Daha sonra, protein bir boyut dışlama sütunundan geçirilir ve bir floresan izi toplanır. Burada, FSEC ve GPCR hedefleri üzerindeki temsili FSEC verilerini çalıştırmak için bir yöntem sfengosin-1-fosfat reseptörü (S1PR1) ve serotonin reseptörü (5HT2A R) sunulmaktadır.
Giriş
Jel filtrasyon kromatografisi olarak da bilinen boyut dışlama kromatografisi (SEC), protein bilimi1'de yaygın olarak kullanılır. SEC sırasında, proteinler, protein boyutunun ve şekil2'nin bir fonksiyonu olan hidrodinamik yarıçaplarına göre ayrılır. Kısacası, bu ayırma, akış altındaki protein numunelerinin, moleküler bir elek görevi gören gözenekli boncuklardan oluşan paketlenmiş bir yatağa uygulanmasıyla elde edilir. Kullanılan boncuklar genellikle proteinlerin boncukların gözeneklerine girmesine veya dışlanmasına izin vermek için tanımlanmış gözenek boyutları aralığına sahip çapraz bağlı agarozdur 3,4,5,6,7. Daha küçük hidrodinamik yarıçapa sahip proteinler gözenekler içinde daha fazla zaman harcarlar ve bu nedenle paketlenmiş yataktan daha yavaş bir oranda akarlar, oysa daha büyük proteinler boncukların dışında (hariç tutulan hacim) daha fazla zaman harcar ve paketlenmiş yataktan daha hızlı bir oranda hareket eder. SEC, bir hazırlayıcı sütun kullanıldığında protein saflaştırma adımı olarak kullanılabilir1. Analitik bir sütun kullanıldığında, protein kalitesini ve özelliklerini analiz etmek için SEC kullanılabilir2. Örneğin, bir numunede bulunabilecek ve düşük kaliteli proteini gösteren protein agregaları çok büyük olma eğilimindedir, yani sadece hariç tutulan hacimde hareket ederler ve bu nedenle en erken noktada kolondan salınırlar; Bu birime Void veya Void Volume sütunu adı verilir. Ayrıca, kolonu kalibre etmek için moleküler ağırlık standartları kullanılabilir ve bu da ilgilenilen proteinin tahmini moleküler ağırlığının standart bir eğriden interpolasyona tabi tutulmasına izin verir.
Tipik olarak, 280 nm'deki protein emilimi, protein elüsyonunu bir boyut dışlama sütunundan izlemek için kullanılır. Bu, SEC'in bir analiz aracı olarak kullanımını, ilgilenilen protein, örneğin protein saflaştırmanın son adımında, kirletici proteinlerden büyük ölçüde arındırılana kadar kısıtlar. Bununla birlikte, floresan SEC (FSEC), floresan olarak etiketlenmiş ilgi çekici bir protein kullanır. Bu nedenle, bir floresan sinyali, ilgilenilen proteinin diğer proteinlerin ve hatta ham karışımların varlığında elüsyonunu spesifik olarak izlemek için kullanılabilir 8,9. Ayrıca, floresan sinyalleri oldukça hassas olduğundan, son derece düşük protein miktarlarına sahip numuneler üzerinde başarılı analizler yapılabilir. İlgilenilen protein genellikle ekspresyon yapısına yeşil bir floresan proteini (GFP) veya geliştirilmiş GFP (eGFP) etiketi eklenerek floresan olarak etiketlenir. Floresan sinyali daha sonra 395 nm veya 488 nm'de uyarma ile izlenebilir ve floresan emisyonunu GFP veya eGFP için sırasıyla 509 nm veya 507 nm'de tespit edebilir.
Bir SEC sütunundan protein elüsyonunu izlemek için bir floresan sinyali kullanmanın yararı, FSEC'i, ekspresyon seviyeleri çözünür proteinlere kıyasla özellikle zayıf olduğunda membran protein örneklerini analiz etmek için değerli bir araç haline getirir. En önemlisi, membran proteinlerinin kalitesi ve özellikleri, ilk11,12 saflaştırma işlemini optimize etmeye gerek kalmadan ham lizatlardan çözündükten sonra doğrudan analiz edilebilir. Bu nedenlerden dolayı, FSEC, membran proteininin çözeltideki davranışını iyileştirmek için gerekli olabilecek farklı faktörleri araştırırken, membran protein kalitesini hızlı bir şekilde analiz etmek için kullanılabilir. Örneğin, membran13,14'ten ekstraksiyondan sonra toplanmamış olanı bulmak için farklı etiketler, kesmeler, delesyonlar, füzyon ortağı eklemeleri ve stabilize edici mutasyonlar içeren çok sayıda yapının denenmesi yaygındır. Ayrıca, membran proteini için en stabilize edici koşulu sağlayan deterjan, katkı maddesi, ligand veya polimeri belirlemek için tampon taraması, protein saflaştırması veya biyofiziksel tahliller veya yapısal karakterizasyon gibi aşağı akış kullanımları için stabilite sağlamak için en iyi tampon bileşimini tanımlayabilir.
Bu nedenle, FSEC yönteminin genel amacı, ilgilenilen bir hedef membran proteini için bir SEC sütun elüsyon profili toplamaktır. Ayrıca, floresan kullanıldığından, bu SEC izi, herhangi bir uzun saflaştırmadan önce yapıların ve koşulların optimizasyonunda mümkün olan en erken noktada toplanır. FSEC izi, farklı tampon koşullarına veya membran proteini yapılarına sahip bir membran proteininin saflaştırılmasının başarı olasılığını değerlendirmek için karşılaştırmalı bir araç olarak kullanılabilir. Bu şekilde, FSEC profillerinin toplanması, diğer analiz yöntemleri için gerekli saf protein miktarlarını üretmek için çaba harcamadan önce optimum yapı tasarımına ve tampon bileşimine ulaşmak için hızlı bir yinelemeli süreç olarak kullanılabilir.
Protokol
1. FSEC için deterjan ve tampon hazırlama
- Bir deterjan stok çözeltisi hazırlayın.
- 20 mL'lik bir stok çözeltisi hazırlamak için, 4 g dodesil maltosid (DDM) tozu ve 0.4 g kolesteril hemisuksinat (CHS) tozu tartın ve laboratuvar sınıfı damıtılmışH2O ile 20 mL'ye çıkarın.
- Tüm bileşenleri ekledikten sonra, bileşenler tamamen çözünene kadar 4 ° C'de uçtan uca ters çevirme ile karıştırın. 4 °C'de gece boyunca uçtan uca karıştırma yapılması önerilir.
- Aliquot ve deterjan stoklarını kullanıma kadar -20 ° C'de saklayın. Stoğun hemen kullanılması gerekiyorsa, deterjan stoğunu buz üzerinde saklayın.
NOT: Bu çalışmada kullanılan standart deterjan stoğu %20 (w/v) DDM ve %2 (w/v) CHS karışımıdır ( bakınız Malzeme Tablosu). Farklı deterjanlar kullanılabilir (örneğin, lauril maltoz neopentil glikol; LMNG) veya stiren-maleik asit (SMA) gibi polimerlerle deterjansız ekstraksiyon kullanımı test edilebilir. Test edilecek deney koşullarını tasarlarken buna karar verilmelidir.
- Bir çözündürme tamponu hazırlayın.
- Bir beherde 100 mM HEPES, 200 mM NaCl, %20 (v/v) gliserol ve 1x proteaz inhibitörü kokteyli (bakınız Malzeme Tablosu) nihai konsantrasyonu elde etmek için bileşenlerin doğru ağırlığını veya hacmini birleştirerek bir çözündürme tamponu hazırlayın.
NOT: Bu çalışmada, beş numunenin işlenmesi için 50 mL çözünürleştirme tamponunun hazırlanması yeterliydi. - Beher'e 0,7 hacimli (örneğin, 50 mL tampon yapıyorsanız 35 mL) laboratuvar sınıfı damıtılmışH2O ekleyin.
- Manyetik bir karıştırıcı üzerinde karıştırın ve bir pH metre kullanarak, konsantre NaOH'nin damla damla eklenmesiyle tampon pH'ını 7,5'e ayarlayın.
- Bir ölçüm silindiri kullanarak, tamponu laboratuvar sınıfı damıtılmışH2O ile gereken son hacme kadar doldurun.
- Bir beherde 100 mM HEPES, 200 mM NaCl, %20 (v/v) gliserol ve 1x proteaz inhibitörü kokteyli (bakınız Malzeme Tablosu) nihai konsantrasyonu elde etmek için bileşenlerin doğru ağırlığını veya hacmini birleştirerek bir çözündürme tamponu hazırlayın.
- SEC çalışma arabelleğini hazırlayın.
- Bir beherde 100 mM HEPES, 150 mM NaCl ve %10 (v/v) gliserol nihai konsantrasyonu elde etmek için bileşenlerin doğru ağırlığını veya hacmini birleştirerek SEC çalışma arabelleğini hazırlayın.
NOT: Bu çalışmada, beş numuneyi çalıştırmak için 600 mL SEC tamponunun hazırlanması yeterliydi. - Beher'e 0,7 hacim (örneğin, 600 mL tampon yapıyorsanız 420 mL) laboratuvar sınıfı damıtılmışH2O ekleyin.
- Manyetik bir karıştırıcı üzerinde karıştırın ve bir pH metre kullanarak, konsantre NaOH'nin damla damla eklenmesiyle tampon pH'ını 7,5'e ayarlayın.
- Bir ölçüm silindiri kullanarak, tamponu laboratuvar sınıfı damıtılmışH2O ile gereken son hacme kadar doldurun.
- SEC tamponunu bir vakum altında şişe üstü 0,45 μm gözenekli filtreden geçirin (bkz.
- Tampon filtreden geçtikten sonra, çalkalandığında daha fazla kabarcık görünmeyene kadar vakum altında bırakarak gazını giderin.
- 1. adımda hazırlanan deterjan stoğunun gerekli hacmini ekleyerek SEC tamponuna %0,03 (w/v) DDM ve %0,003 (w/v) CHS nihai konsantrasyonu ekleyin (örneğin, 600 mL SEC tamponu yapıyorsanız 0,9 mL).
- Kullanmadan önce tamponu önceden soğutun.
NOT: Test edilen koşullara bağlı olarak farklı tamponlar kullanılabilir. Örneğin, farklı deterjanların ilgilenilen protein üzerindeki etkisini test ediyorsanız, proteini çözündürmek için kullanılanla aynı deterjana sahip bir tamponun ideal olarak yapılması gerekir. Deterjansız koşullar SMA ile test ediliyorsa, deterjan SEC tamponundan tamamen çıkarılmalıdır. Ancak, deterjan taraması için protokol değişiklikleri hakkında daha fazla ayrıntı için tartışma bölümüne bakın.
- Bir beherde 100 mM HEPES, 150 mM NaCl ve %10 (v/v) gliserol nihai konsantrasyonu elde etmek için bileşenlerin doğru ağırlığını veya hacmini birleştirerek SEC çalışma arabelleğini hazırlayın.
2. FSEC için numune hazırlama
- Hücre topaklarını hazırlayın.
NOT: Tahlilin başlangıç noktası, ilgili GFP etiketli (veya diğer floresan olarak etiketlenmiş) proteinin süspansiyon hücresi ekspresyon kültüründen hücre peletinin toplanmasıdır. Hasat için kesin zamanlamalar ve koşullar, ifade edilen proteine, kullanılan hücre hattına, içinde yetiştirilen hücrelerin koşullarına ve protein ekspresyonunun indüklendiği yönteme bağlı olacaktır. Bu ayrıntılar bu protokolün kapsamı dışındadır. Bu çalışmada, test edilecek durum başına 0.5-1 g Sf21 hücre peleti kullanıldı, bu da enfeksiyondan 2-3 gün sonra 25-50 mL kültüre karşılık gelen, yaklaşık 4 x 106 canlı hücre / mL'lik bir P2 bakülovirüs seyreltmesinin 1:20 seyreltilmesi. Burada açıklanan protokolün test edildiğini ve diğer ökaryotik hücre hatlarından (örneğin, HEK293E) benzer ıslak hücre topakları ağırlıklarıyla eşit derecede iyi çalıştığı tespit edildiğini lütfen unutmayın.- Süspansiyon kültürlerinden gelen hücreler hasat edilmeye hazır olduğunda, 25-50 mL kültür alikotlarını 50 mL konik tüplere aktarın.
- Tüpleri dengeleyin ve hücreleri pelet etmek için oda sıcaklığında 15 dakika boyunca 2.000 x g'de bir salınımlı kovada (Malzeme Tablosuna bakınız) bir tezgah üstü santrifüj kullanın.
- Kültür süpernatantını yavaşça devirerek çıkarın ve atın veya hücre peleti özellikle gevşekse pipet dolgulu 50 mL'lik bir pipet kullanın.
- Hücreler analiz için hemen kullanılacaksa, hücre peletini buzun üzerine yerleştirin ve doğrudan adım 5'e geçin. Hücreler daha sonraki bir aşamada kullanılmak üzere kaydedilecekse, hücreleri -80 ° C'ye yerleştirerek dondurun.
- Hücre peleti -80 ° C'de depolanmışsa, oda sıcaklığında 15 dakika boyunca veya numune artık donmayana kadar inkübe ederek hızla çözün. Bu adımı izleyerek numuneyi hemen buza taşıyın.
- Numuneyi yeniden askıya alın ve çözündürün.
- Hücre peletine 2 mL çözündürme tamponu (adım 1.2) ekleyin.
- Homojen hale gelene kadar 15-30 dakika boyunca 4 °C'de uçtan uca ters çevirme ile inkübe edin.
- %1 DDM/%0,1 CHS nihai konsantrasyonu için önceden karıştırılmış deterjan stoğu (adım 1.1) (örneğin, %20 DDM/%2 CHS stoğunun 100 μL'si) ekleyin.
- 4 °C'de uçtan uca ters çevirme ile 30 dakika bekletin.
NOT: İstenirse, birden fazla koşul paralel olarak test edilebilir. Aynı anda işlenebilecek paralel örneklerin sayısı, SEC denemesini çalıştırmak için kullanılabilir sisteme bağlı olacaktır. Burada açıklanan kurulumda, aynı anda en fazla beş numuneyi işlemek mümkündü.
- Düşük hızlı bir santrifüjleme adımı gerçekleştirin.
- Numuneyi önceden soğutulmuş (4 °C) bir tezgah üstü santrifüjde, 15 dakika boyunca 2.000 x g'de bir salınımlı kovada santrifüjleyin.
- Yüksek hızlı bir santrifüjleme adımı gerçekleştirin.
- 5 mL'lik bir şırıngaya tutturulmuş kör uçlu bir iğne kullanarak, peletin düşük hızlı dönüşten rahatsız edilmemesine dikkat ederek, süpernatantı düşük hızlı santrifüjlemeden ultra santrifüjleme tüplerine (örneğin, 0,5-2 mL tüpler) dikkatlice aktarın.
- Tüp çiftlerini 0,05 g içinde dengeleyin ve sabit açılı ultra santrifüjleme rotoruna yerleştirin ( bkz.
- 4 °C'de 250.000 x g'de 30 dakika boyunca santrifüj.
3. Boyut dışlama kromatografisi (SEC)
- Hızlı protein sıvı kromatografisi (FPLC) sistemini hazırlayın ve sütunu dengeleyin.
- Sistemi, üreticinin talimatlarını izleyerek hazırlayın (bkz. Malzeme Tablosu), örneğin, sistemi SEC tamponuyla doldurarak ve hava pompalarını temizleyerek.
- SEC sütununu FPLC'ye bağlayarak kolona hava girmemesini sağlayın. Bu, FPLC sisteminin akış yolu ile damladan damlaya bağlantı gerçekleştirmek için suyla dolu bir şırınga (kolonun dibine tutturulmuş) ile SEC kolonuna geri basınç uygulanarak gerçekleştirilir.
- SEC kolonunu, önce laboratuvar sınıfı damıtılmış ve filtrelenmişH2O'nun 1,5 sütun hacminde (24 mL'lik bir sütun için 36 mL), ardından kolon için önerilen akış hızında ve basınçta 1,5 sütun hacimli SEC tamponunda yıkayarak önceden dengeleyin (bkz.
NOT: Bu çalışmada FSEC gerçekleştirmek için kullanılan FPLC sistemi soğuk bir ortamdaydı ve beş konumlu bir döngü valfi ve altı konumlu bir plaka fraksiyon toplayıcısı takılıydı. Bu kurulum, beş örneğin yüklenmesine ve çalıştırmalar arasında el ile müdahale gerektirmeden otomatik bir şekilde aynı sütundan aşağıya sırayla çalıştırılmasına olanak tanır. SEC deneylerini yürütmek için, 10-600 kDa'lık moleküler ağırlık aralığındaki proteinlerin çözülmesine izin veren bir reçine içeren ticari olarak temin edilebilen önceden paketlenmiş 24 mL'lik bir sütun kullanıldı (bkz. İlgilenilen protein özellikle büyükse, bunun yerine alternatif bir sütun matrisi kullanılabilir ve bunun yerine proteinlerin moleküler ağırlıkta 5.000 kDa'ya kadar ayrılmasına izin verilir. Deterjan/lipit miselinin varlığının, kullanılan protein ve deterjana bağlı olarak membran proteininin toplam boyutunu >150 kDa artıracağını lütfen unutmayın.
- Örneği sütuna uygulayın ve SEC denemesini çalıştırın.
- Şırıngaya tutturulmuş kör uçlu bir iğne kullanarak süpernatantı yüksek hızlı santrifüjleme adımından 1 mL'lik bir şırıngaya aktarın. Bu, peletleri rahatsız etmeden santrifüj tüpünden numune geri kazanımına olanak tanır.
- Örnek döngüyü yüklenecek şekilde ayarlayın. Şırıngadan yükleme portuna 600-700 μL numune enjekte ederek 500 μL'lik bir numune döngüsünü aşırı doldurun. Kullanılan sisteme bağlı olarak, bu yükleme adımı, hata yapılmadığından emin olmak için yönteme programlanabilir.
- Yöntem sırasında, numuneyi döngüden sütuna, kolon için önerilen akış hızında ve basınçta 4 mL SEC tamponu ile boşaltarak enjekte edin (bkz.
- Arabelleğin 1,5 sütun hacmi (24 mL'lik bir sütun için 36 mL) geçene kadar sütunu aynı akış hızında çalıştırın.
- Sütun hacminin 0,25'inde (24 mL'lik bir sütun için 6 mL), 90 fraksiyon toplamak için 0,2 mL fraksiyon toplamaya başlayın.
NOT: Kolonun boşluk hacminin 0,3 sütun hacmi olması beklendiğinden, bundan hemen önce fraksiyonların toplanmasına başlanması, boşluk hacminde bulunan herhangi bir protein de dahil olmak üzere tüm proteinin elüsyonunun izlenmesini sağlar.
4. Floresan iz toplama ve analizi
- Numuneleri fraksiyon toplayıcıdan (adım 3.2.5) 96 delikli bir plakaya aktarın ve floresan sinyalini okuyun.
- Bir floresan okuması yapmadan önce, toplanan örnekleri seyreltin. Çok kanallı pipet kullanarak, 90 μL laboratuvar sınıfı damıtılmışH2O'yu bir rezervuardan opak düz tabanlı 96 delikli bir plakanın her bir kuyucuğuna aktarın ( bkz.
- Kesirler adım 3.2.5 sırasında 96 delikli bir blokta toplandıysa, SEC fraksiyonlarının 10 μL'sini bloktan opak düz tabanlı 96 delikli plakaya aktarmak için çok kanallı bir pipet kullanın ve yukarı ve aşağı pipetleme yaparak karıştırın. Aksi takdirde, SEC fraksiyonları adım 3.2.5 sırasında ayrı ayrı tüplere toplandıysa, her fraksiyonun 10 μL'sini opak düz tabanlı 96 delikli plakaya birer birer aktarın ve numuneleri karıştırmak için her seferinde yukarı ve aşağı pipetleyin.
- Opak düz tabanlı 96 delikli plakayı plaka okuyucuya yerleştirin ve floresanı ölçün. GFP floresan etiketse (burada kullanılır), uyarımı mümkün olduğunca 488 nm'ye yakın ayarlayın ve floresan emisyonunu mümkün olduğunca 507 nm'ye yakın tespit edin.
NOT: Floresan okumasını almadan önce gereken seyreltme, ekspresyon kültüründe bulunan toplam protein miktarına ve kullanılan plaka okuyucunun hassasiyetine bağlı olacaktır. Bu çalışmada gösterilen örneklerde, örnekler suda 10 kat seyreltilmiştir. Bir başlangıç noktası için bir öneri olarak, fraksiyonlar tespit edilmeden önce suda veya tamponda 5-10 kat seyreltilmelidir. Kaydedilen FSEC iz sinyali özellikle düşükse, bunun yerine daha küçük seyreltmeler veya hatta seyreltilmemiş bir numune kullanılabilir. Bu çalışmada tespit için kullanılan cihaz, 488 nm'de uyarma yapabilen ve 507 nm'de floresan emisyonunu tespit edebilen bir plaka okuyucuydu ( bkz.
- FSEC izlerini çizin.
- Verileri plaka okuyucudan ham biçimde (ham metin veya virgülle ayrılmış değerler dosyası) dışa aktarın. Bu ham veriler, FSEC izinin Y ekseninde çizilecektir.
- X ekseni için, her kesirin toplandığı hacmi hesaplayın. İlk kuyunun, fraksiyonasyon gecikmesini hesaba katmak için ilk fraksiyonun toplandığı elüsyon hacmi olması gerekir (bu örnekte 6 mL). Bundan sonraki kesirler, toplanan fraksiyon hacmi (bu örnekte 0,2 mL) kadar sırayla artmalıdır.
- X ekseni ve Y ekseni verileri hesaplandıktan sonra, her bir kuyucuktaki floresan sinyalini sütundan yayıldığı hacme göre çizmek için verileri kopyalayıp grafik yazılımına yapıştırın (bkz.
NOT: Şekil 1'de , FSEC denemesini çalıştırmak için gereken adımların şematik bir gösterimi gösterilmektedir.
- FSEC izlerini analiz edin.
- Boşluk hacmindeki protein elüsyonu miktarını değerlendirin (24 mL'lik bir sütun için yaklaşık 8 mL), bu da proteinin boyut olarak çok büyük olduğunu ve muhtemelen açılmış / toplanmış olduğunu gösterir.
- Katlanmış proteini gösteren daha sonraki zirvelerde salınan protein miktarını değerlendirin. Bunun, protein boyutuna bağlı olarak (bir deterjan / lipit miseli ile ilişkili olduğunda) 24 mL'lik bir sütun için 10 mL ile 16 mL arasında olması beklenir. Tepe şekline çok dikkat edin, özellikle de 3-4 mL'den daha büyük (24 mL'lik bir sütun için) geniş veya bölünmüş bir tepe noktasıysa, bu bir polidispers numuneyi gösterir.
- Monomer pikinde kaydedilen maksimum sinyali boşluk pikindeki maksimum sinyale bölerek monomerik tepe yüksekliği ile boşluk tepe yüksekliği arasındaki oranı hesaplayın.
NOT: Bu değer, monodispersite indeksini temsil eder ve protein kalitesinin nicel bir ölçümüne izin verir; Daha büyük değerler mümkün olan en iyi kaliteyi gösterirken, 1'in altındaki değerler, katlanmış proteinden daha fazla toplanmış proteine sahip oldukları için sorunlu numuneleri gösterir. - Birden fazla FSEC çalıştırması karşılaştırılacaksa ve en önemli özellik her durumda monomer miktarıysa, izleri plaka okuyucu (örneğin, RFU) tarafından kaydedilen ham sinyal olarak çizin.
NOT: Katlanmamış proteine kıyasla monomer miktarının karşılaştırılması daha önemliyse, sinyal, izdeki minimum ve maksimum okumalar kullanılarak toplam sinyalin bir yüzdesine normalleştirilmelidir, bu da izler arasındaki agregalanmış ve monomerik protein arasındaki orandaki farklılıkları vurgulayacaktır.
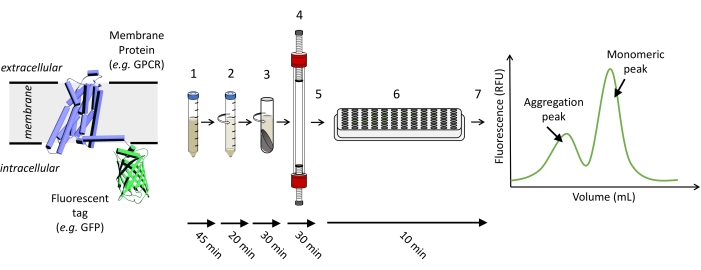
Şekil 1: FSEC denemesini çalıştırmak için gereken adımların şematik gösterimi. (1) İlgilenilen floresan etiketli proteini eksprese eden hücreler çözünür. (2) Ham çözünürlük önce düşük hızlı bir spin ile açıklığa kavuşturulur, ardından (3) yüksek hızlı bir spin ile açıklığa kavuşturulur. (4) Arıtılmış örnek süpernatant yüklenir ve uygun bir SEC sütununda çalıştırılır ve (5) kesirler toplanır. (6) Fraksiyonların örnekleri 96 delikli bir plakaya aktarılır ve (7) FSEC izini çizmek için bir plaka okuyucu kullanılarak bir GFP-floresan sinyali tespit edilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Sonuçlar
İlk olarak, bu çalışmada kullanılan plaka okuyucu için eGFP tespitinin dinamik aralığı ve alt sınırları araştırılmıştır. Bilinen konsantrasyonda saflaştırılmış bir eGFP standardı, 50 μL'lik bir nihai hacimde 50 ng·μL−1, 25 ng·μL−1, 12.5 ng·μL−1, 6.25 ng·μL−1, 3.125 ng·μL−1, 1.5625 ng·μL−1, 0.78125 ng·μL−1 ve 0.390625 ng·μL−1'e seyreltildi ve floresan 488 nm'lik bir uyarma ve 507 nm'lik bir emisyon kullanılarak okundu (Şekil 2 ). Bu deney, plaka okuyucunun kuyu başına 30 ng eGFP etiketli proteinin daha düşük bir tespit sınırına ve sinyal doygunluğundan önce kuyu başına 500 ng'ye kadar eGFP etiketli proteinin dinamik aralığına sahip olduğunu göstermiştir. Alt sınır için değeri kullanarak ve protein elüsyonunun sütun hacminin 0.33'ü ile sınırlı olduğunu varsayarsak, saptanabilir bir FSEC sinyalinin gözlemlenebilmesi için SEC kolon yüklemesi için 1.28 μg kadar az eGFP etiketli protein gereklidir.
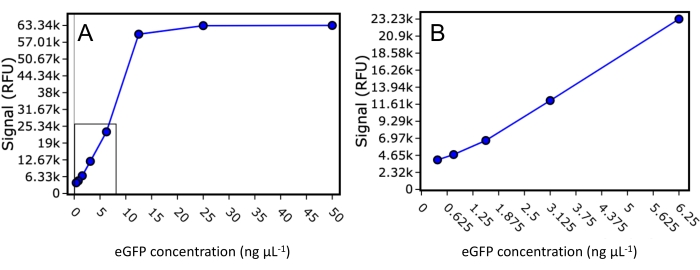
Resim 2: eGFP standart eğrisi. 50 ng·μL−1, 25 ng·μL−1, 12,5 ng·μL−1, 6,25 ng·μL−1, 3,125 ng·μL−1, 1,5625 ng·μL−1, 0,78125 ve 0,390625 ng·μL−1'e seyreltilmiş saflaştırılmış eGFP standardı için floresan sinyalinin saçılma grafiği. (A) Doymuş sinyale sahip olanlar da dahil olmak üzere tüm seyreltmeler görüntülenir. (B) Yalnızca plaka okuyucunun dinamik aralığına giren standartları içeren yakınlaştırılmış bir dağılım grafiği. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
İkinci olarak, bu çalışma için kullanılan 24 mL'lik kolon moleküler ağırlık standartları ile kalibre edilmiştir. FSEC analizi için kullanılanla aynı tampon ve çalışma koşulları kullanılarak, moleküler ağırlık standartları mavi dekstran (>2.000 kDa), ferritin (440 kDa), aldolaz (158 kDa), konalbümin (75 kDa) ve ovalbümin (43 kDa) ayrı ayrı enjekte edildi ve kolondan geçirildi ve elüpsiyon izleri 280 nm emilimde toplandı. Kaydedilen elüsyon hacimleri sırasıyla 8.9 mL, 12.4 mL, 15.2 mL, 16.9 mL ve 18 mL idi. Bu elüsyon hacimleri Kav'a (Denklem 1) dönüştürüldüğünde ve log moleküler ağırlıklarına karşı çizildiğinde, standart bir eğri uygun olabilir. Bu, bu çalışmada test edilen GPCR'lerin moleküler ağırlığının standart eğrinin enterpolasyonu ile tahmin edilmesine izin vermiştir (Şekil 3). Örneğin, deterjan DDM'sinde çözündükten sonra GPCR serotonin reseptörü 2A'nın (5HT2A R) FSEC izi, 13.4 mL'lik bir elüsyon hacmini göstermiştir. Bu 5HT2AR elüsyon hacmi, ferritin ve aldolaz için kaydedilen elüsyon hacimleri arasına düşer ve yaklaşık 300 kDa'lık tahmini bir moleküler ağırlık sağlar. Bu çalışmada kullanılan 5HT2AR yapısı yaklaşık 50 kDa'dır (eGFP etiketi dahil), yani 5HT2AR'nin monomerik olduğu varsayılırsa, DDM deterjan / lipit miseline 250 kDa moleküler ağırlık atfedilebilir. Elüsyon hacimlerinin dönüşümü için denklem aşağıdaki gibidir (Denklem 1):
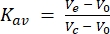 (Denklem 1)
(Denklem 1)
burada V e toplama hacmi, V 0 sütun boşluğu hacmi ve Vc toplam sütun hacmidir.
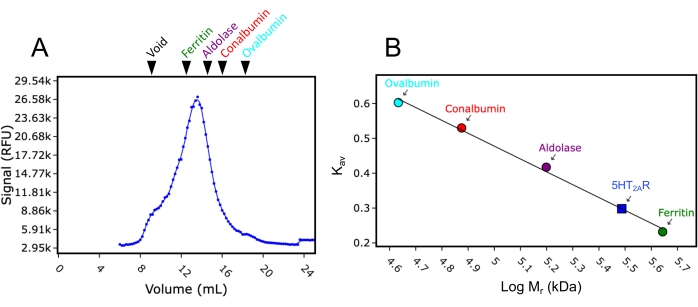
Şekil 3: Moleküler ağırlık standartlarını kullanarak SEC sütununun kalibrasyon eğrisi. (A) DDM'de çözünen 5HT 2A R'nin temsilibir FSEC izi, moleküler ağırlık standartlarının göreceli elüsyon pozisyonları mavi dekstran (Void), ferritin, aldolaz, konalbümin ve ovalbümin işaretlidir. Ferritin, aldolaz, konalbümin ve ovalbümin sırasıyla yeşil, mor, kırmızı ve camgöbeği renklidir. (B) Günlük moleküler ağırlığa (Mr) karşı çizilen Kav'a (Denklem 1) dönüştürüldükten sonra standartların elüsyon konumlarını kullanan moleküler ağırlık kalibrasyon eğrisi. DDM'deki 5HT2AR'nin Mr'si, Kav kullanılarak eğriden interpolasyona tabi tutulmuştur ve eğri üzerinde (mavi kare) görüntülenir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
FSEC daha sonra GPCR sfengosin-1-fosfat reseptörünün (S1PR1) kalitesini ve özelliklerini değerlendirmek için kullanıldı15. GFP etiketli insan S1PR 1'i eksprese eden böcek hücreleri, protokolde açıklandığı gibi FSEC için işlenmiştir (Şekil 1).
İlk olarak, DDM ve LMNG deterjanlarının SMA ile deterjansız ekstraksiyona karşı test edilmesiyle optimum membran ekstraksiyon koşulları araştırılmıştır (Şekil 4A). Monodispersite indeksi, protein numunesinin kalitesini ve boşluktaki protein arasındaki oranı (~ 8 mL kolon tutma) monodisperse numuneye (14-15 mL kolon tutma) kıyasla değerlendirmek için kullanıldı. LMNG'de çözünen numune, daha iyi bir monomer tepe şekli ve daha düşük bir protein agrega zirvesi ile üstün bir FSEC profili sergiledi, bu da LMNG'de çözünme ve saflaştırmanın bu membran proteini için en stabilize edici koşullar olduğunu gösterdi. Buna karşılık, DDM'de çözünen numune, numunedeki polidispersiteyi gösteren daha büyük bir agrega zirvesi ve daha geniş bir monomerik tepe noktası ile nispeten daha zayıf bir FSEC profiline sahipti.
İkinci olarak, ligand ilavesinin FSEC profili üzerindeki etkisi, çözünme sırasında numuneye sfengosin-1-fosfat (S1P) eklenerek araştırılmıştır. Bu örnekte, çözünürlük reaktifi olarak DDM kullanılmış ve S1P'nin varlığı ve yokluğunda S1PR1'in FSEC izleri karşılaştırılmıştır (Şekil 4B). S1P varlığında çözünen numune, azaltılmış agregasyon ile üstün bir FSEC izi göstermiştir. Bu, bir ligand varlığında saflaştırmanın, çözeltideki reseptörü stabilize ederek protein numune kalitesini iyileştirmek için avantajlı olduğunu, ancak sonuçların proteinin doğru bir şekilde katlandığını ve ligand bağlanması için yetkin olduğunu öne sürdüğü için protein aktivitesinin vekil bir belirteci olarak da avantajlı olduğunu göstermiştir.
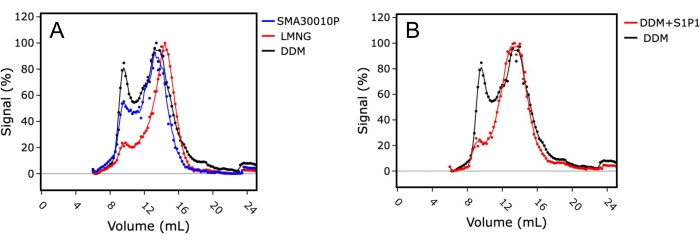
Şekil 4: FSEC, optimum membran ekstraksiyon koşullarını ve ligand bağlanmasını gösteren ham bir S1PR 1 ekstraktı kullanıyor. (A) Stiren-maleik asit kopolimerinde (SMA; mavi), lauril maltoz neopentil glikolde (LMNG; kırmızı) veya dodesil maltosid (DDM; siyah) içinde çözünen S1PR1'in FSEC izlerinin karşılaştırılması. (B) Agonist sfengosin-1-fosfatın (S1P) varlığında (kırmızı) veya yokluğunda (siyah) DDM'de çözünen S1PR1'in FSEC izlerinin karşılaştırılması. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
FSEC ayrıca farklı koşullar altında 5HT2AR'nin uzun vadeli stabilitesini araştırmak için de kullanılmıştır. GFP etiketli insan 5HT2AR, deterjan (DDM) veya SMA polimerindeki böcek hücresi zarlarından çözündü ve FSEC tarafından 4 ° C'de veya oda sıcaklığında depolandıktan sonra birkaç zaman noktasında analiz edildi (Şekil 5). Birkaç günlük inkübasyonun ardından, DDM'deki5HT 2AR, her iki sıcaklıkta da monomerik tepe yüksekliğinde önemli bir düşüş gösterdi ve toplam pikte önemli artışlar gözlendi. Buna karşılık, SMA lipit parçacığındaki (SMALP)5HT 2AR, deney boyunca monomerik tepe yüksekliğinde önemli bir düşüş göstermedi, bu da SMALP'deki proteinin elverişsiz sıcaklıklarda bile daha uzun süre sabit kaldığını gösterdi. Bu, bağlanma deneylerinin başarılı bir şekilde tamamlanması için numunenin uzun bir süre boyunca stabil ve aktif olması gereken yüzey plazmon rezonansı (SPR) deneyleri gibi aşağı akış biyofiziksel uygulamaları için protein preparatları göz önüne alındığında önemli olabilir.
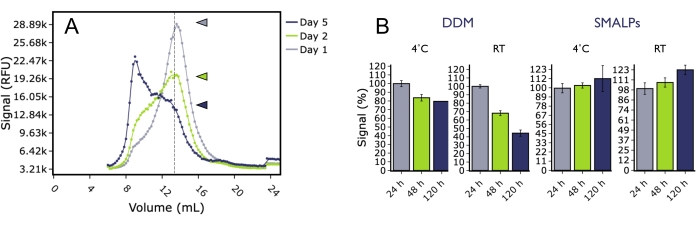
Şekil 5: FSEC tarafından analiz edildiği gibi, DDM veya SMALP kullanılarak membrandan ekstrakte edilen 5HT2AR'nin kalitesi üzerindeki zaman ve sıcaklığın etkisi. (A) DDM'de çözünen ve oda sıcaklığında 1 gün (gri), 2 gün (yeşil) veya 5 gün (mavi) boyunca saklanan 5HT 2A R'nin temsili FSEC izleri. (B) 4 °C (mavi) veya RT'de (yeşil) depolanan DDM numuneleri için normalleştirilmiş monomerik tepe yüksekliğinin histogramları, 4 °C (gri) veya RT'de (siyah) depolanan SMALP numunelerine kıyasla. Hata çubukları SEM'i temsil eder. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tartışmalar
Burada sunulan FSEC ile durum taraması için genel sistematik yaklaşımlar, membran proteinlerinin üretimi için çözünürlük ve saflaştırma parametrelerinin hızlı bir şekilde optimize edilmesini sağlar. Bu, kararlı ve fonksiyonel olarak aktif membran proteinlerinin biyofiziksel ve yapısal çalışmalar için hızla üretilebileceği anlamına gelir. Ayrıca, FSEC, membran protein laboratuvarlarında zaten mevcut olan laboratuvar ekipmanı kullanılarak çalıştırılabilir ve bu nedenle, tahlilleri yürütmek için uzman bir cihazın satın alınmasına gerek yoktur.
Kritik adımlar
Deterjandaki hücrelerden çözünme noktası ile numunenin SEC sütunundan geçirildiği nokta (adım 2.1.5-3.2.5) arasında geçen süre zaman açısından kritiktir ve bu adımlar arasında duraklama olmamalıdır. Tüm adımlar 4 ° C'de veya buz üzerinde gerçekleştirilmeli ve bu adımları gerçekleştirmek için harcanan süre mümkün olduğunca az tutulmalıdır. Bu zaman ve sıcaklık kısıtlamaları, herhangi bir potansiyel açılma veya bozulmadan önce membran proteini için FSEC profilini kaydetmek için gereklidir. Membran proteini çözündükten sonra, 4 ° C'de bile açılma, toplanma ve bozulma riski daha yüksektir. İdeal olarak, FSEC izlerinin karşılaştırılacağı herhangi bir numune, çözünürlük adımından sonra aynı süre içinde SEC sütunundan aşağı doğru geçmelidir. Uygulamada, özellikle numuneler tek bir sütundan sırayla geçirilirse, bu zordur, ancak birbirlerinden 3 saat içinde beş adede kadar SEC izi toplamak mümkündür ve bu zaman diliminde önemli bir bozulma olmamalıdır.
Sorun giderme
FSEC deneyi gerçekleştirilirken, düşük floresan sinyali varsa veya hiç yoksa, ilgilenilen membran proteininin seçilen hücre hattını ifade etmemiş olması, seçilen hücre hattının çok düşük ekspresyonuna sahip olması veya seçilen deterjanda çözünmemiş olması mümkündür. Floresan sinyalini toplamadan ve FSEC izini kaydetmeden önce numuneler seyreltilirse, basit bir ilk adım, SEC fraksiyonlarının daha düşük bir seyreltmesini denemek veya seyreltmemek olacaktır. Bu hala yorumlanabilir bir FSEC izi vermezse, proteinin ekspresyonu ve çözünürlüğü kontrol edilmelidir.
Protein ekspresyonunun analizi, adım 2.2.2'den sonra numunenin floresansının kontrol edilmesiyle sağlanabilir. Bu numuneden çok düşük bir floresan sinyali varsa veya hiç yoksa, (örneğin, arka plana çok yakın bir sinyal), muhtemelen protein ekspresyonunda bir sorun vardır. Membran proteininin ekspresyon seviyelerini iyileştirmek için, alternatif bir hücre hattına geçmek veya büyüme koşullarını ayarlamak, ekspresyon indüksiyonu ve indüksiyon / enfeksiyon / transfeksiyon ile hasat arasındaki süre gibi adımlar atılabilir. Bununla birlikte, özellikle zayıf protein ekspresyonu, kararsız bir membran proteinini ve dolayısıyla zayıf bir yapı seçimini gösterebilir.
İfade kontrol edilmişse ve FSEC'den önce arka planın üzerinde net bir floresan sinyali varsa, çözünürlük verimliliği, adım 2.2.2'den sonraki numuneye (toplam protein) kıyasla, adım 2.4.3'ten (çözünür membran proteini) sonra numunenin kalan floresan sinyali ölçülerek kontrol edilebilir. Çözünürlük verimliliğinin% 20 -% 30 olması yaygındır ve yine de membran proteininin başarılı bir şekilde analiz edilmesine ve saflaştırılmasına izin verir. Bununla birlikte, çözünürlük verimliliği% 20'den azsa, çözünürlük için farklı bir deterjan veya farklı çözünürlük koşulları gerekebilir. Çözünürlüğü iyileştirme girişimleri başarılı olmazsa, bu özellikle kararsız bir membran proteinine ve dolayısıyla zayıf bir yapı seçimine işaret edebilir.
FSEC izinde çok geç salınım zirvesi gözlenirse (örneğin, 18-24 mL), bu, floresan proteininin beklenenden çok daha düşük bir protein moleküler ağırlığına sahip olduğunu gösterir. Bu, ilgilenilen membran proteininin parçalanmasından kaynaklanabilir ve bu da "serbest" GFP ile sonuçlanır. Jel içi GFP floresan kullanılarak çözünürleştirmeden önce ve sonra proteinin bozulmamış olup olmadığı kontrol edilmelidir. İlgilenilen proteinin bozunduğu veya proteolize olduğu görülüyorsa, proteaz inhibitörü miktarı iki kat ila dört kat arttırılabilir. Bununla birlikte, çözünmeden önce bile proteazlara veya bozulmuş proteine karşı yüksek hassasiyet, özellikle kararsız bir proteini ve dolayısıyla zayıf bir yapı seçimini gösterebilir.
FSEC'in modifikasyonları ve diğer uygulamaları
Genellikle, FSEC'de kullanılan floresan etiket, bu protokolde açıklandığı gibi GFP veya eGFP'dir. Bununla birlikte, birçok farklı floresan protein etiketi mevcuttur. Kullanılacak floresan etiketinin seçimi, seçilen floresan etiketi için floresan sinyalini kaydetmek için doğru uyarma ve emisyon parametrelerini elde edebilen bir plaka okuyucuya ve farklı çevre koşullarında kuantum veriminde çok az değişiklik olan veya hiç değişiklik olmayan bir florofora sahip olmaya bağlıdır. Ayrıca, FSEC floresan proteinlerle sınırlı değildir, aynı zamanda floresan boya ile etiketlenmiş bir proteinle eşit derecede iyi çalışabilir. Örneğin, histidin etiketli membran protein yapılarına olumlu bir şekilde bağlanacak bir NTA boyası kullanılabilir. Ayrıca, floresan boya ile kimyasal olarak etiketlenmiş ve ilgilenilen membran proteinini bağlamak için spesifik olan floresan olarak etiketlenmiş bir antikor veya membran proteini yapısına dahil edilen bir saflaştırma etiketi, dolaylı olarak FSEC için bir hedefi etiketleyebilir.
FSEC kullanarak deterjan taraması yaparken, SEC sütununu çalıştırmak için kullanılan tamponun, proteinin çözündüğü eşleşen deterjanı içermesi gerekip gerekmediği veya tüm çalışmalarda standart bir deterjan kullanılması gerekip gerekmediği konusunda bir seçim yapılabilir. Tüm deney boyunca eşleşen deterjanla gerçekleştirilirse, proteinin davranışının daha doğru bir temsili elde edilecektir. Bununla birlikte, her çalıştırma gerçekleştirilmeden önce kolonun yeni bir deterjanla yeniden dengelenmesi gerekiyorsa, zaman alıcı ve deterjan israfı olabilir. Ayrıca, deterjan taramasının temel amacı izleri karşılaştırmak olduğundan, koşullar ideal olmasa bile eğilimler izlerde kalacaktır. Böylece, proteinin ilgili deterjanda çözündüğü, ancak kolonun tüm çalışmalarda (örneğin, DDM)11 tek bir deterjanla standart bir tamponda çalıştırıldığı ve zamandan ve deterjan sarf malzemelerinden tasarruf edebileceği bir uzlaşmaya varılabilir.
Kullanılan FLPC ekipmanı değiştirilerek, FSEC protokolünün verimi önemli ölçüde artırılabilir ve numune gereksinimi en aza indirilebilir. Örneğin, bir FPLC veya HPLC sistemi bir otomatik numune alma cihazı, daha küçük yatak hacimli bir analitik sütun (3,2 mL analitik SEC sütunu gibi) ve sürekli FSEC izlerini doğrudan kolondan izlemek için bir sıralı floresan dedektörü ile donatılabilir. Ortaya çıkan kurulum, daha kısa sürede daha fazla FSEC çalışmasının gerçekleştirilmesine izin verecek ve manuel çizim adımını kaldıracak, böylece daha kısa bir zaman diliminde daha fazla sayıda koşulun test edilmesine izin verecektir. Ayrıca, her çalıştırma için daha az numunenin hazırlanması ve FSEC sütununa yüklenmesi gerekeceğinden, numune gereksinimi daha da azaltılacaktır. Bu, ifade kültürlerini plaka tabanlı bir formata indirgemek için olanaklar açacaktır, çünkü analiz için çok az materyal gerekecektir.
FSEC'in diğer yöntemlere kıyasla güçlü ve zayıf yönleri
FSEC'in bir dezavantajı, membran proteini yapılarının floresan etiketini tanıtmak için tasarlanması gerektiğidir ve girişte, etiketin yerleştirilmesinin ilgili membran proteininin işlevine veya katlanmasına müdahale edebileceği küçük bir olasılık vardır. Ek olarak, FSEC protokolü, burada açıklandığı gibi, proteinlerin ham bir karışımı olan hücre lizatı varlığında bir membran proteininin özelliklerini izler. Bir membran proteininin bu ortamdaki davranışı, ilgilenilen membran proteininin diğer proteinlerden tamamen izole edildiğinde saflaştırma sonunda hazırlayıcı bir SEC sütununa tabi tutulmasından farklı olabilir. Ayrıca, FSEC, protein kalitesinin biraz kalitatif bir ölçüsünü sağlar. Bununla birlikte, FSEC izini protokolün 4.3.3 adımında açıklandığı gibi bir monodispersite indeksine dönüştürerek, protein kalitesinin nicel bir ölçüsü elde edilebilir.
FSEC, membran protein yapılarının, çözünme koşullarının ve saflaştırma tamponu bileşiminin erken analizinde kullanılabilecek tek yöntem değildir. Alternatif yaklaşımların FSEC'e göre hem avantajları hem de dezavantajları vardır. Örneğin, florofor bazlı termostabilite testleri, özellikle boya 7-dietilamino-3-(4′-maleimidilfenil)-4-metilkumarin (CPM)16,17 kullanımı mevcuttur. Bu yöntemin avantajı, protein kalitesinin kalitatif bir ölçüsünü sağlayan FSEC'den farklı olarak, termostabilite testlerinin göreceli bir erime sıcaklığı şeklinde nicel bir ölçüm sağlamasıdır. Ayrıca, protein yapısına floresan etiketi eklemeye gerek yoktur. Bununla birlikte, termostabilite testlerinin FSEC ile karşılaştırıldığında dezavantajları, saflaştırılmış proteinin kullanılması gerektiği ve tahlilin, katlanmış proteindeki doğal sistein kalıntılarının avantajlı konumlarına dayandığı için tüm protein yapılarıyla uyumlu olmamasıdır.
Hem FSEC hem de florofor bazlı termostabilite testleriyle benzerlikleri olan bir başka yöntem, bir membran proteininin sıcaklık duyarlılığını ölçen bir testtir. Bu tahlilde, proteine farklı sıcaklıklarda meydan okunur ve santrifüjlemeden sonra çözelti içinde kalan protein tespit edilir. Bu yöntemdeki algılama, çözelti18'deki floresan, bir SDS-PAGE jel bandı19'un floresansı veya bir batı lekesi20'deki sinyal yoğunluğunun ölçülmesi de dahil olmak üzere çeşitli şekillerde gerçekleştirilmiştir. Bununla birlikte, bu yaklaşımların önemli bir dezavantajı, tahlilin çok emek yoğun olması ve sonuçlarda yüksek gürültüye eğilimli olmasıdır, çünkü her bir sıcaklık noktası bağımsız olarak toplanmalıdır.
Son olarak, membran protein kalitesini FSEC'e benzer şekilde değerlendirmek için birkaç gelişmiş biyofiziksel teknik kullanılabilir, örneğin, akış kaynaklı dağılım analizi21, mikro ölçekli termoforez22 veya SPR. Çok güçlü yaklaşımlara rağmen, bu yöntemlerin dezavantajı, analizleri yürütmek için son derece uzmanlaşmış araçların gerekliliğidir.
Sonuç olarak, FSEC, membran proteini üretim kampanyalarında kullanım için paha biçilmez bir araç sağlar ve tek seçenek olmasa da, yukarıda listelendiği gibi diğer yöntemlere göre birkaç belirgin avantaja sahiptir. Sonuçların ortogonal testlerle çapraz doğrulanması her zaman tavsiye edilir ve yukarıda tartışılan yöntemlerin hiçbiri birbirini karşılıklı olarak dışlamaz.
Açıklamalar
Peak Proteinleri, bir ücret karşılığında protein ekspresyonu, saflaştırma, kütle spektrometresi ve yapısal belirleme sağlayan sözleşmeli bir araştırma kuruluşudur.
Teşekkürler
Tüm Peak Proteins ekibinin yardım ve desteğine teşekkür ederiz. Hücre bilimi ekibinden, böcek hücresi ekspresyonundaki değerli görüşleri ve rehberliği için Ian Hampton'a teşekkür etmek istiyoruz. Mark Abbott'a bu projeyi sürdürmek için gereken kaynakları ve fırsatı sağladığı için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL and 5 mL plastic syringes | Generic | - | Syringes for transfer of samples |
| 10x EDTA Free Protease inhibitor cocktail | Abcam | ab201111 | Protease inhibitors |
| 15 mL tubes | Generic | - | 15 mL tubes for pellet preparation and solubilisation |
| 2 mL ultra-centrifuge tubes | Beckman Coulter | 344625 | Tubes for ultra-centrifuge rotor |
| 50 mL tubes | Generic | - | 50 mL tubes for cell harvest |
| 96 deep-well blocks | Greiner | 15922302 | For collecting 0.2 mL SEC fractions |
| ÄKTA V9-L loop valve | Cytiva | 29011358 | 5 posiiton loop valve for the ÄKTA FPLC system |
| ÄKTA F9-C fraction collector | Cytiva | 29027743 | 6 position plate fraction collector for the ÄKTA FPLC system |
| ÄKTA pure 25 L | Cytiva | 29018224 | FPLC system for running the experiment |
| Benchtop centrifuge (e.g. Fisherbrand GT4 3L) | Fisher Scientific | 15828722 | Centrifuge for low-speed spin |
| Blunt end filling needles | Generic | - | For transfer of samples |
| Bottle top vacuum filter | Corning | 10005490 | Bottle top vacuum filter for filtering SEC buffers |
| Cholesteryl hemisuccinate (CHS) | Generon | CH210-5GM | Additive for detergent solubilisation |
| Disposable multichannel reseviour | Generic | - | Resevior for addition of water or buffer to 96-well micro-plate |
| Dodecyl maltoside (DDM) | Glycon | D97002-C-25g | Detergent for solubilisation |
| eGFP protein standards | BioVision | K815-100 | eGFP standards for fluorescent calibration curve |
| Glycerol | Thermo Scientific | 11443297 | Glycerol for buffer preparation |
| HEPES | Thermo Scientific | 10411451 | HEPES for buffer preparation |
| High molecular weight SEC calibration standards kit | Cytiva | 28403842 | Molecular weight calibration kit for SEC |
| Lauryl maltose neopentylglycol (LMNG) | Generon | NB-19-0055-5G | Detergent for solubilisation |
| Low molecular weight SEC calibration standards kit | Cytiva | 28403841 | Molecular weight calibration kit for SEC |
| MLA-130 ultra-centrifuge rotor | Beckman Coulter | 367114 | Rotor for ultracentrifuge that fits 2 mL capacity tubes |
| Opaque 96-well flat-bottom micro-plate | Corning | 10656853 | 96-well for reading fluorescent signal in plate reader |
| Optima MAX-XP ultra-centrifuge | Beckman Coulter | 393315 | Centrifuge for high-speed spin |
| pH meter | Generic | - | For adjusting the pH of buffers during preparation |
| Prism | GraphPad | - | Graphing software for plotting traces |
| Rotary mixer | Fisher Scientific | 12027144 | Mixer for end over end mixing in the cold |
| Sodium chloride | Fisher Scientific | 10316943 | Sodium chloride for buffer preparation |
| Sodium hydroxide | Fisher Scientific | 10488790 | Sodium hydroxide for buffer preparation |
| Spectramax ID3 Plate Reader | Molecular Devices | 735-0391 | Micro-plate reader capable of reading fluorescence |
| Stirrer plate | Generic | - | For stirring buffers during preparation |
| Styrene maleic acid (SMA) | Orbiscope | SMALP 300 | Polymer for detergent free extraction |
| Superdex 200 Increase 10/300 GL | Cytiva | 28990944 | SEC column for running the experiment. The bed volume of this column is 24 mL. The recommended flow rate for this column in 0.9 ml/min (in water at 4 °C). The maximum pressure limit for this column is 5 MPa. |
| Vacuum pump | Sartorius | 16694-2-50-06 | For filtering and degassing buffers |
Referanslar
- Burgess, R. R. A brief practical review of size exclusion chromatography: Rules of thumb, limitations, and troubleshooting. Protein Expression and Purification. 150, 81-85 (2018).
- Erickson, H. P. Size and shape of protein molecules at the nanometer level determined by sedimentation, gel filtration, and electron microscopy. Biological Procedures Online. 11 (1), 32-51 (2009).
- Lathe, G. H., Ruthven, C. R. J. The separation of substances and estimation of their relative molecular sizes by the use of columns of starch in water. Biochemical Journal. 62 (4), 665-674 (1956).
- Lathe, G. H., Ruthven, C. R. The separation of substances on the basis of their molecular weights, using columns of starch and water. Biochemical Journal. 60 (4), (1955).
- Polson, A. Fractionation of protein mixtures on columns of granulated agar. Biochimica et Biophysica Acta. 50 (3), 565-567 (1961).
- Hjertén, S., Mosbach, R. 34;Molecular-sieve" chromatography of proteins on columns of cross-linked polyacrylamide. Analytical Biochemistry. 3 (2), 109-118 (1962).
- Porath, J., Flodin, P. Gel filtration: A method for desalting and group separation. Nature. 183 (4676), 1657-1659 (1959).
- Kawate, T., Gouaux, E. Fluorescence-detection size-exclusion chromatography for precrystallization screening of integral membrane proteins. Structure. 14 (4), 673-681 (2006).
- Hattori, M., Hibbs, R. E., Gouaux, E. A Fluorescence-detection size-exclusion chromatography-based thermostability assay for membrane protein precrystallization screening. Structure. 20 (8), 1293-1299 (2012).
- Shimomura, O., Johnson, F. H., Saiga, Y. Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. Journal of Cellular and Comparative Physiology. 59 (3), 223-239 (1962).
- Drew, D., et al. GFP-based optimization scheme for the overexpression and purification of eukaryotic membrane proteins in Saccharomyces cerevisiae. Nature Protocols. 3 (5), 784-798 (2008).
- Newstead, S., Kim, H., von Heijne, G., Iwata, S., Drew, D. High-throughput fluorescent-based optimization of eukaryotic membrane protein overexpression and purification in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences of the United States of America. 104 (35), 13936-13941 (2007).
- Vaidehi, N., Grisshammer, R., Tate, C. G. How can mutations thermostabilize G-protein-coupled receptors. Trends in Pharmacological Sciences. 37 (1), 37-46 (2016).
- Hardy, D., Bill, R. M., Jawhari, A., Rothnie, A. J. Overcoming bottlenecks in the membrane protein structural biology pipeline. Biochemical Society Transactions. 44 (3), 838-844 (2016).
- Hanson, M. A., et al. Crystal structure of a lipid G protein-coupled receptor. Science. 335 (6070), 851-855 (2012).
- Alexandrov, A. I., Mileni, M., Chien, E. Y. T., Hanson, M. A., Stevens, R. C. Microscale fluorescent thermal stability assay for membrane proteins. Structure. 16 (3), 351-359 (2008).
- Harborne, S. P. D., King, M. S., Kunji, E. R. S. Thermostability assays: A generic and versatile tool for studying the functional and structural properties of membrane proteins in detergents. Biophysical Journal. 118 (4), 105-121 (2020).
- Nji, E., Chatzikyriakidou, Y., Landreh, M., Drew, D. An engineered thermal-shift screen reveals specific lipid preferences of eukaryotic and prokaryotic membrane proteins. Nature Communications. 9 (1), 4253 (2018).
- Harborne, S. P. D., et al. IMPROvER: The Integral Membrane Protein Stability Selector. Scientific Reports. 10 (1), 15165 (2020).
- Ashok, Y., Nanekar, R., Jaakola, V. -. P. Defining thermostability of membrane proteins by western blotting. Protein Engineering Design and Selection. 28 (12), 539-542 (2015).
- Pedersen, M. E., Østergaard, J., Jensen, H. Flow-induced dispersion analysis (FIDA) for protein quantification and characterization. Methods Mol Biol. 1972, 109-123 (2019).
- Wienken, C. J., Baaske, P., Rothbauer, U., Braun, D., Duhr, S. Protein-binding assays in biological liquids using microscale thermophoresis. Nature Communications. 1 (1), 100 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır