Method Article
Schnelle Beurteilung der Qualität von Membranproteinen durch Fluoreszenzgrößenausschlusschromatographie
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt ein Verfahren zur Durchführung einer Fluoreszenzgrößenausschlusschromatographie (FSEC) an Membranproteinen, um deren Qualität für die nachgeschaltete Funktions- und Strukturanalyse zu bewerten. Repräsentative FSEC-Ergebnisse, die für mehrere G-Protein-gekoppelte Rezeptoren (GPCRs) unter waschmittelsolubilisierten und waschmittelfreien Bedingungen gesammelt wurden, werden vorgestellt.
Zusammenfassung
Bei der Strukturaufklärung von Membranproteinen und der biophysikalischen Charakterisierung ist es üblich, zahlreiche Proteinkonstrukte zu testen, die unterschiedliche Markierungen, Verkürzungen, Deletionen, Fusionspartner-Insertionen und stabilisierende Mutationen enthalten, um eines zu finden, das nach der Extraktion aus der Membran nicht aggregiert wird. Darüber hinaus ist das Pufferscreening zur Bestimmung des Detergens, Additivs, Liganden oder Polymers, das die stabilisierendste Bedingung für das Membranprotein bietet, eine wichtige Praxis. Die frühe Charakterisierung der Membranproteinqualität durch Fluoreszenzgrößenausschlusschromatographie bietet ein leistungsfähiges Werkzeug zur Bewertung und Einstufung verschiedener Konstrukte oder Bedingungen, ohne dass eine Proteinreinigung erforderlich ist, und dieses Werkzeug minimiert auch den Probenbedarf. Die Membranproteine müssen fluoreszierend markiert werden, üblicherweise durch Expression mit einem GFP-Tag oder ähnlichem. Das Protein kann direkt aus ganzen Zellen solubilisiert und dann durch Zentrifugation grob geklärt werden; Anschließend wird das Protein über eine Größenausschlusssäule geleitet und eine fluoreszierende Spur gesammelt. Hier werden eine Methode zur Durchführung von FSEC- und repräsentativen FSEC-Daten zu den GPCR-Zielen Sphingosin-1-phosphat-Rezeptor (S1PR1) und Serotoninrezeptor (5HT2AR) vorgestellt.
Einleitung
Die Größenausschlusschromatographie (SEC), auch bekannt als Gelfiltrationschromatographie, wird häufig in der Proteinwissenschaft1 verwendet. Während der SEC werden Proteine basierend auf ihrem hydrodynamischen Radius getrennt, der eine Funktion der Proteingröße und -formist 2. Kurz gesagt, diese Trennung wird erreicht, indem die Proteinproben im Fluss auf ein gepacktes Bett aus porösen Kügelchen aufgetragen werden, die als Molekularsieb fungieren. Bei den verwendeten Kügelchen handelt es sich häufig um vernetzte Agarose mit einem definierten Bereich von Porengrößen, damit Proteine entweder in die Poren der Kügelchen 3,4,5,6,7 eindringen oder aus ihnen ausgeschlossen werden können. Proteine mit kleineren hydrodynamischen Radien verbringen einen größeren Teil der Zeit in den Poren und fließen daher langsamer durch das Festbett, während größere Proteine einen größeren Teil der Zeit außerhalb der Kügelchen verbringen (das ausgeschlossene Volumen) und sich schneller durch das Festbett bewegen. SEC kann als Proteinreinigungsschritt verwendet werden, wenn eine präparative Säule1 verwendet wird. Wenn eine analytische Säule verwendet wird, kann SEC verwendet werden, um die Proteinqualität und -eigenschaftenzu analysieren 2. Beispielsweise sind Proteinaggregate, die in einer Probe vorhanden sein können und auf Protein von schlechter Qualität hinweisen, in der Regel sehr groß, was bedeutet, dass sie sich nur im ausgeschlossenen Volumen bewegen und daher am frühesten Punkt aus der Säule eluiert werden. Dieses Volume wird als Column Void oder Void Volume bezeichnet. Darüber hinaus können Molekulargewichtsstandards verwendet werden, um die Säule zu kalibrieren, so dass ein geschätztes Molekulargewicht des interessierenden Proteins aus einer Standardkurve interpoliert werden kann.
Typischerweise wird die Proteinabsorption bei 280 nm verwendet, um die Proteinelution aus einer Größenausschlusssäule zu überwachen. Dies schränkt die Verwendung von SEC als Analysewerkzeug ein, bis das interessierende Protein weitgehend frei von kontaminierenden Proteinen ist, z. B. im letzten Schritt der Proteinreinigung. Die fluoreszierende SEC (FSEC) verwendet jedoch ein Protein von Interesse, das fluoreszenzmarkiert ist. Daher kann ein Fluoreszenzsignal verwendet werden, um die Elution des interessierenden Proteins in Gegenwart anderer Proteine oder sogar Rohgemische 8,9 spezifisch zu überwachen. Da Fluoreszenzsignale hochempfindlich sind, können außerdem erfolgreiche Analysen an Proben mit extrem geringen Proteinmengen durchgeführt werden. Das interessierende Protein wird oft fluoreszenzmarkiert, indem ein grün fluoreszierendes Protein (GFP) oder ein verstärktes GFP (eGFP) in das Expressionskonstrukt aufgenommen wird. Das Fluoreszenzsignal kann dann durch Anregung bei 395 nm oder 488 nm und Detektion der Fluoreszenzemission bei 509 nm oder 507 nm für GFP bzw. eGFP10 überwacht werden.
Der Vorteil der Verwendung eines Fluoreszenzsignals zur Überwachung der Proteinelution aus einer SEC-Säule macht FSEC zu einem wertvollen Werkzeug für die Analyse von Membranproteinproben, wenn die Expressionsniveaus im Vergleich zu löslichen Proteinen besonders schlecht sind. Entscheidend ist, dass die Qualität und die Eigenschaften von Membranproteinen direkt nach der Solubilisierung aus Rohlysaten analysiert werden können, ohne dass zuerst der Reinigungsprozess optimiert werdenmuss 11,12. Aus diesen Gründen kann FSEC verwendet werden, um die Qualität des Membranproteins schnell zu analysieren und gleichzeitig die verschiedenen Faktoren zu untersuchen, die erforderlich sein können, um das Verhalten des Membranproteins in Lösung zu verbessern. Zum Beispiel ist es üblich, zahlreiche Konstrukte zu testen, die unterschiedliche Tags, Verkürzungen, Deletionen, Fusionspartner-Insertionen und stabilisierende Mutationen enthalten, um eines zu finden, das nach der Extraktion aus der Membran13,14 nicht aggregiert wird. Darüber hinaus kann das Pufferscreening zur Bestimmung des Detergens, Additivs, Liganden oder Polymers, das die stabilisierendste Bedingung für das Membranprotein bietet, die beste Pufferzusammensetzung für die Proteinreinigung oder für die Bereitstellung von Stabilität für nachgeschaltete Anwendungen, wie z. B. biophysikalische Assays oder strukturelle Charakterisierung, definieren.
Das übergeordnete Ziel der FSEC-Methode besteht daher darin, ein Elutionsprofil der SEC-Säule für ein interessierendes Zielmembranprotein zu erstellen. Darüber hinaus wird diese SEC-Spur durch die Verwendung von Fluoreszenz zum frühestmöglichen Zeitpunkt bei der Optimierung der Konstrukte und Bedingungen vor einer langwierigen Reinigung erfasst. Die FSEC-Spur kann als Vergleichswerkzeug verwendet werden, um die Erfolgswahrscheinlichkeit der Aufreinigung eines Membranproteins mit unterschiedlichen Pufferbedingungen oder Membranproteinkonstrukten zu beurteilen. Auf diese Weise kann die Sammlung von FSEC-Profilen als schneller iterativer Prozess verwendet werden, um zu einem optimalen Konstruktdesign und einer optimalen Pufferzusammensetzung zu gelangen, bevor der Aufwand für die Erzeugung der für andere Analysemethoden erforderlichen Mengen an reinem Protein erforderlich ist.
Protokoll
1. Detergens- und Pufferaufbereitung für FSEC
- Bereiten Sie eine Waschmittellösung vor.
- Zur Herstellung einer 20-ml-Stammlösung werden 4 g Dodecylmaltosid (DDM)-Pulver und 0,4 g Cholesterylhemisuccinat-Pulver (CHS) abgewogen und mit destilliertem H2O in Laborqualität auf 20 ml gebracht.
- Nach Zugabe aller Komponenten mit Ende-über-Ende-Inversion bei 4 °C mischen, bis die Komponenten vollständig löslich sind. Es wird empfohlen, über Nacht bei 4 °C zu mischen.
- Aliquotieren und lagern Sie die Waschmittelvorräte bis zur Verwendung bei −20 °C. Wenn die Brühe sofort verwendet werden muss, lagern Sie die Waschmittelbrühe auf Eis.
ANMERKUNG: Das Standard-Waschmittelmaterial, das in dieser Arbeit verwendet wurde, war eine Mischung aus 20 % (w/v) DDM und 2 % (w/v) CHS (siehe Materialtabelle). Es können verschiedene Detergenzien verwendet werden (z. B. Laurylmaltose, Neopentylglykol; LMNG) oder die Verwendung der waschmittelfreien Extraktion mit Polymeren wie Styrol-Maleinsäure (SMA) getestet werden. Dies muss bei der Gestaltung der zu testenden Versuchsbedingungen entschieden werden.
- Bereiten Sie einen Solubilisierungspuffer vor.
- Bereiten Sie einen Solubilisierungspuffer vor, indem Sie das richtige Gewicht oder Volumen der Komponenten kombinieren, um eine Endkonzentration von 100 mM HEPES, 200 mM NaCl, 20 % (v/v) Glycerin und 1x Proteasehemmer-Cocktail (siehe Materialtabelle) in einem Becherglas zu erreichen.
HINWEIS: In der vorliegenden Studie war die Herstellung von 50 ml Solubilisierungspuffer ausreichend für die Verarbeitung von fünf Proben. - Geben Sie ein Volumen von 0,7 (z. B. 35 ml bei Herstellung von 50 ml Puffer) destilliertes H2O in Laborqualität in das Becherglas.
- Mischen Sie auf einem Magnetrührer und stellen Sie den pH-Wert des Puffers mit einem pH-Meter auf 7,5 ein, indem Sie konzentriertes NaOH tropfenweise hinzufügen.
- Füllen Sie den Puffer mit einem Messzylinder mit destilliertem H2O in Laborqualität auf das gewünschte Endvolumen auf.
- Bereiten Sie einen Solubilisierungspuffer vor, indem Sie das richtige Gewicht oder Volumen der Komponenten kombinieren, um eine Endkonzentration von 100 mM HEPES, 200 mM NaCl, 20 % (v/v) Glycerin und 1x Proteasehemmer-Cocktail (siehe Materialtabelle) in einem Becherglas zu erreichen.
- Bereiten Sie den SEC-Laufpuffer vor.
- Bereiten Sie den SEC-Laufpuffer vor, indem Sie das richtige Gewicht oder Volumen der Komponenten kombinieren, um eine Endkonzentration von 100 mM HEPES, 150 mM NaCl und 10% (v/v) Glycerin in einem Becherglas zu erreichen.
HINWEIS: In der vorliegenden Studie war die Herstellung von 600 ml SEC-Puffer ausreichend, um fünf Proben durchzuführen. - Geben Sie ein Volumen von 0,7 (z. B. 420 ml bei Herstellung von 600 ml Puffer) destilliertes H2O in Laborqualität in das Becherglas.
- Mischen Sie auf einem Magnetrührer und stellen Sie den pH-Wert des Puffers mit einem pH-Meter auf 7,5 ein, indem Sie konzentriertes NaOH tropfenweise hinzufügen.
- Füllen Sie den Puffer mit einem Messzylinder mit destilliertem H2O in Laborqualität auf das gewünschte Endvolumen auf.
- Filtern Sie den SEC-Puffer durch einen 0,45-μm-Porenfilter mit Flaschenverschluss unter Vakuum (siehe Materialtabelle).
- Sobald der Puffer den Filter passiert hat, entgasen Sie ihn, indem Sie ihn unter dem Vakuum belassen, bis beim Schütteln keine Blasen mehr auftreten.
- Fügen Sie dem SEC-Puffer eine Endkonzentration von 0,03 % (w/v) DDM und 0,003 % (w/v) CHS hinzu, indem Sie das erforderliche Volumen des in Schritt 1 hergestellten Waschmittelmaterials hinzufügen (z. B. 0,9 ml bei Herstellung von 600 ml SEC-Puffer).
- Kühlen Sie den Puffer vor Gebrauch vor.
HINWEIS: Je nach den getesteten Bedingungen können unterschiedliche Puffer verwendet werden. Wenn beispielsweise die Wirkung verschiedener Detergenzien auf das interessierende Protein getestet wird, müsste idealerweise ein Puffer mit demselben Detergens hergestellt werden, der zur Solubilisierung des Proteins verwendet wird. Bei der Prüfung von waschmittelfreien Bedingungen mit SMA sollte das Waschmittel vollständig aus dem SEC-Puffer weggelassen werden. Im Diskussionsabschnitt finden Sie jedoch weitere Informationen zu Protokolländerungen für das Waschmittel-Screening.
- Bereiten Sie den SEC-Laufpuffer vor, indem Sie das richtige Gewicht oder Volumen der Komponenten kombinieren, um eine Endkonzentration von 100 mM HEPES, 150 mM NaCl und 10% (v/v) Glycerin in einem Becherglas zu erreichen.
2. Probenvorbereitung für FSEC
- Bereiten Sie die Zellpellets vor.
HINWEIS: Der Ausgangspunkt für den Assay ist die Ernte des Zellpellets aus einer Suspensionszellexpressionskultur des GFP-markierten (oder anderen fluoreszenzmarkierten) Proteins von Interesse. Die genauen Zeitpunkte und Bedingungen für die Ernte hängen von dem exprimierten Protein, der verwendeten Zelllinie, den Bedingungen, unter denen die Zellen gezüchtet wurden, und der Methode ab, mit der die Proteinexpression induziert wurde. Diese Angaben gehen über den Rahmen dieses Protokolls hinaus. In dieser Studie wurden 0,5-1 g Sf21-Zellpellet pro zu testender Bedingung verwendet, was 25-50 ml Kultur 2-3 Tage nach der Infektion mit ungefähr 4 x 106 lebensfähigen Zellen/ml einer 1:20-Verdünnung des P2-Baculovirus entspricht. Bitte beachten Sie, dass das hier beschriebene Protokoll getestet wurde und mit ähnlichen Nassgewichten von Zellpellets aus anderen eukaryotischen Zelllinien (z. B. HEK293E) gleichermaßen gut funktioniert.- Wenn die Zellen aus den Suspensionskulturen zur Ernte bereit sind, werden 25-50 ml Kulturaliquote in konische 50-ml-Röhrchen überführt.
- Gleichen Sie die Röhrchen aus und verwenden Sie eine Tischzentrifuge in einem ausschwenkbaren Eimer (siehe Materialtabelle) bei 2.000 x g für 15 Minuten bei Raumtemperatur, um die Zellen zu pelletieren.
- Entfernen Sie den Kulturüberstand und entsorgen Sie ihn, indem Sie ihn vorsichtig wegkippen, oder verwenden Sie eine 50-ml-Pipette mit einem Pipettenfüller, wenn das Zellpellet besonders locker ist.
- Wenn die Zellen sofort für die Analyse verwendet werden, legen Sie das Zellpellet auf Eis und fahren Sie direkt mit Schritt 5 fort. Wenn die Zellen für eine spätere Verwendung aufbewahrt werden sollen, frieren Sie die Zellen ein, indem Sie sie bei -80 °C platzieren.
- Wenn das Zellpellet bei -80 °C gelagert wurde, tauen Sie es schnell auf, indem Sie es 15 Minuten lang bei Raumtemperatur inkubieren oder bis die Probe nicht mehr gefroren ist. Bewegen Sie die Probe nach diesem Schritt sofort auf Eis.
- Resuspendieren und solubilisieren Sie die Probe.
- 2 ml des Solubilisierungspuffers (Schritt 1.2) werden in das Zellpellet gegeben.
- Inkubation mit Ende-über-Ende-Inversion bei 4 °C für 15-30 min, bis eine homogene Masse entsteht.
- Fügen Sie vorgemischtes Waschmittelmaterial (Schritt 1.1) hinzu (z. B. 100 μl 20 % DDM/2 % CHS-Material) für eine Endkonzentration von 1 % DDM/0,1 % CHS.
- 30 min mit Ende-über-End-Inversion bei 4 °C solubilisieren.
HINWEIS: Falls gewünscht, können mehrere Bedingungen parallel getestet werden. Die Anzahl der parallelen Proben, die gleichzeitig verarbeitet werden können, hängt vom verfügbaren System für die Durchführung des SEC-Experiments ab. In dem hier beschriebenen Aufbau war es möglich, bis zu fünf Proben gleichzeitig zu verarbeiten.
- Führen Sie einen Zentrifugationsschritt mit niedriger Geschwindigkeit durch.
- Zentrifugieren Sie die Probe in einer vorgekühlten (4 °C) Tischzentrifuge in einem ausschwenkbaren Eimer bei 2.000 x g für 15 Minuten.
- Führen Sie einen Hochgeschwindigkeits-Zentrifugationsschritt durch.
- Übertragen Sie den Überstand vorsichtig aus der Zentrifugation mit niedriger Geschwindigkeit in Ultrazentrifugationsröhrchen (z. B. 0,5-2-ml-Röhrchen), indem Sie eine Nadel mit stumpfem Ende verwenden, die an einer 5-ml-Spritze befestigt ist, wobei darauf zu achten ist, dass das Pellet nicht durch den Schleudergang mit niedriger Geschwindigkeit gestört wird.
- Balancieren Sie die Röhrchenpaare auf 0,05 g genau aus und legen Sie sie in einen Ultrazentrifugationsrotor mit festem Winkel (siehe Materialtabelle).
- Zentrifugieren bei 4 °C für 30 min bei 250.000 x g.
3. Größenausschlusschromatographie (SEC)
- Bereiten Sie das schnelle Proteinflüssigkeitschromatographiesystem (FPLC) vor und äquilibrieren Sie die Säule.
- Bereiten Sie das System gemäß den Anweisungen des Herstellers vor (siehe Materialtabelle), z. B. indem Sie das System mit SEC-Puffer füllen und die Pumpen mit Luft spülen.
- Schließen Sie die SEC-Säule an die FPLC an, um sicherzustellen, dass keine Luft in die Säule eindringt. Dies wird erreicht, indem mit einer mit Wasser gefüllten Spritze (die am Boden der Säule angebracht ist) Gegendruck auf die SEC-Säule ausgeübt wird, um eine Tropfen-zu-Tropfen-Verbindung mit dem Strömungsweg des FPLC-Systems herzustellen.
- Die SEC-Säule wird voräquilibriert, indem sie zuerst in 1,5 Säulenvolumina (36 ml für eine 24-ml-Säule) destilliertem und filtriertem H2O in Laborqualität gewaschen wird, gefolgt von 1,5 Säulenvolumina SEC-Puffer bei der empfohlenen Durchflussrate und dem empfohlenen Druck für die Säule (siehe Materialtabelle).
HINWEIS: Das FPLC-System, das in dieser Studie zur Durchführung von FSEC verwendet wurde, befand sich in einer kalten Umgebung und hatte ein Fünf-Positionen-Schleifenventil und einen Sechs-Positionen-Plattenfraktionssammler eingebaut. Dieser Aufbau ermöglicht es, fünf Proben automatisiert zu laden und nacheinander über dieselbe Säule zu laufen, ohne dass zwischen den Läufen ein manueller Eingriff erforderlich ist. Für die Durchführung der SEC-Experimente wurde eine kommerziell erhältliche vorverpackte 24-ml-Säule verwendet (siehe Materialtabelle), die ein Harz enthielt, mit dem Proteine im Molekulargewichtsbereich von 10-600 kDa aufgelöst werden konnten. Wenn das interessierende Protein besonders groß ist, könnte stattdessen eine alternative Säulenmatrix verwendet werden, die die Trennung von Proteinen mit einem Molekulargewicht von bis zu 5.000 kDa ermöglicht. Bitte beachten Sie, dass das Vorhandensein von Detergenzien-/Lipidmizellen die Gesamtgröße des Membranproteins um >150 kDa erhöht, abhängig vom verwendeten Protein und Detergenzien.
- Wenden Sie das Beispiel auf die Spalte an, und führen Sie das SEC-Experiment aus.
- Übertragen Sie den Überstand aus dem Hochgeschwindigkeits-Zentrifugationsschritt auf eine 1-ml-Spritze mit einer stumpfen Nadel, die an der Spritze befestigt ist. Dies ermöglicht die Probenrückgewinnung aus dem Zentrifugenröhrchen, ohne das Pellet zu stören.
- Legen Sie die Sample-Schleife auf "Load" fest. Überfüllen Sie eine 500-μl-Probenschleife, indem Sie 600-700 μl der Probe aus der Spritze in die Ladeöffnung injizieren. Je nach verwendetem System kann dieser Ladeschritt in die Methode einprogrammiert werden, um sicherzustellen, dass keine Fehler gemacht werden.
- Während des Verfahrens injizieren Sie die Probe aus der Schleife in die Säule, indem Sie sie mit 4 ml SEC-Puffer bei der empfohlenen Durchflussrate und dem empfohlenen Druck für die Säule entleeren (siehe Materialtabelle).
- Lassen Sie die Säule mit der gleichen Durchflussrate laufen, bis 1,5 Säulenvolumina (36 ml für eine 24-ml-Säule) des Puffers abgeflossen sind.
- Beginnen Sie bei 0,25 des Säulenvolumens (6 ml für eine 24-ml-Säule) mit dem Sammeln von 0,2 ml-Fraktionen, um 90 Fraktionen zu sammeln.
HINWEIS: Da das Hohlraumvolumen der Säule voraussichtlich 0,3 Spaltenvolumina beträgt, wird durch den Beginn der Sammlung von Fraktionen unmittelbar davor sichergestellt, dass die Elution des gesamten Proteins überwacht wird, einschließlich aller im Hohlraumvolumen vorhandenen Proteine.
4. Erfassung und Analyse von Fluoreszenzspuren
- Übertragen Sie die Proben aus dem Fraktionskollektor (Schritt 3.2.5) auf eine 96-Well-Platte und lesen Sie das Fluoreszenzsignal ab.
- Bevor Sie eine Fluoreszenzmessung durchführen, verdünnen Sie die gesammelten Proben. Mit einer Mehrkanalpipette werden 90 μl destilliertes H2O in Laborqualität aus einem Reservoir in jede Vertiefung einer undurchsichtigen 96-Well-Platte mit flachem Boden überführt (siehe Materialtabelle).
- Wenn in Schritt 3.2.5 Fraktionen in einem 96-Well-Block gesammelt wurden, verwenden Sie eine Mehrkanalpipette, um 10 μl der SEC-Fraktionen aus dem Block auf die undurchsichtige 96-Well-Platte mit flachem Boden zu übertragen, und mischen Sie durch Auf- und Abpipettieren. Andernfalls, wenn SEC-Fraktionen in Schritt 3.2.5 in einzelnen Röhrchen gesammelt wurden, werden nacheinander 10 μl jeder Fraktion auf die undurchsichtige 96-Well-Platte mit flachem Boden übertragen und jedes Mal auf und ab pipettiert, um die Proben zu mischen.
- Legen Sie die undurchsichtige 96-Well-Platte mit flachem Boden in den Plattenleser und messen Sie die Fluoreszenz. Wenn GFP die Fluoreszenzmarkierung ist (hier verwendet), stellen Sie die Anregung so nah wie möglich an 488 nm ein und detektieren Sie die Fluoreszenzemission so nahe wie möglich an 507 nm.
HINWEIS: Die Verdünnung, die vor der Fluoreszenzmessung erforderlich ist, hängt von der Gesamtmenge des interessierenden Proteins in der Expressionskultur und der Empfindlichkeit des verwendeten Plattenlesegeräts ab. In den in dieser Studie gezeigten Beispielen wurden die Proben 10-fach in Wasser verdünnt. Als Anregung für einen Ausgangspunkt sollten die Fraktionen vor dem Nachweis 5-10-fach in Wasser oder Puffer verdünnt werden. Wenn das aufgezeichnete FSEC-Spurensignal besonders niedrig ist, können stattdessen kleinere Verdünnungen oder sogar eine unverdünnte Probe verwendet werden. Das Gerät, das in dieser Studie für die Detektion verwendet wurde, war ein Plattenleser, der in der Lage war, bei 488 nm anzuregen und die Fluoreszenzemission bei 507 nm zu detektieren (siehe Materialtabelle).
- Zeichnen Sie die FSEC-Ablaufverfolgungen.
- Exportieren Sie die Daten aus dem Plattenlesegerät in ein Rohformat (Rohtext oder eine Datei mit durch Trennzeichen getrennten Werten). Diese Rohdaten werden auf der Y-Achse der FSEC-Spur dargestellt.
- Berechnen Sie für die X-Achse das Volumen, bei dem jede Fraktion gesammelt wurde. Die erste Vertiefung muss das Elutionsvolumen sein, bei dem die erste Fraktion gesammelt wurde, um die Fraktionierungsverzögerung (in diesem Beispiel 6 ml) zu berücksichtigen. Die Fraktionen danach müssen nacheinander um das gesammelte Fraktionsvolumen (in diesem Beispiel 0,2 ml) zunehmen.
- Nachdem die Daten der X- und Y-Achse berechnet wurden, kopieren Sie die Daten und fügen Sie sie in die Grafiksoftware ein (siehe Materialtabelle), um das Fluoreszenzsignal in jeder Vertiefung gegen das Volumen darzustellen, mit dem es aus der Säule eluiert wurde.
HINWEIS: Abbildung 1 zeigt eine schematische Darstellung der Schritte, die zum Ausführen eines FSEC-Experiments erforderlich sind.
- Analysieren Sie die FSEC-Ablaufverfolgungen.
- Beurteilen Sie die Menge der Proteinelution am Hohlraumvolumen (ca. 8 ml für eine 24-ml-Säule), was darauf hinweist, dass das Protein sehr groß ist und wahrscheinlich entfaltet/aggregiert ist.
- Beurteilen Sie die Menge an Proteinfreisetzung in späteren Peaks, die auf gefaltetes Protein hindeuten. Es wird erwartet, dass dies zwischen 10 ml und 16 ml für eine 24-ml-Säule liegt, abhängig von der Proteingröße (wenn sie mit einer Detergens-/Lipidmizelle verbunden ist). Achten Sie genau auf die Peakform, insbesondere wenn es sich um einen breiten oder geteilten Peak handelt, der sich über mehr als 3-4 ml erstreckt (für eine 24-ml-Säule), da dies auf eine polydisperse Probe hinweist.
- Berechnen Sie das Verhältnis zwischen der monomeren Peakhöhe und der Void-Peakhöhe, indem Sie das maximale Signal, das in der Monomerspitze aufgezeichnet wurde, durch das maximale Signal in der Hohlraumspitze dividieren.
HINWEIS: Dieser Wert stellt den Monodispersitätsindex dar und ermöglicht ein quantitatives Maß für die Proteinqualität. Größere Werte deuten auf die bestmögliche Qualität hin, während Werte unter 1 auf problematische Proben hinweisen, da sie mehr aggregiertes Protein als gefaltetes Protein enthalten. - Wenn mehrere FSEC-Läufe verglichen werden sollen und das wichtigste Merkmal jeweils die Monomermenge ist, zeichnen Sie die Leiterbahnen als das vom Plattenleser (z. B. RFU) aufgezeichnete Rohsignal auf.
HINWEIS: Wenn ein Vergleich der Monomermenge im Vergleich zum ungefalteten Protein wichtiger ist, muss das Signal auf einen Prozentsatz des Gesamtsignals normalisiert werden, wobei die minimalen und maximalen Messwerte in der Spur verwendet werden, wodurch die Unterschiede im Verhältnis zwischen aggregiertem und monomerem Protein zwischen den Spuren hervorgehoben werden.
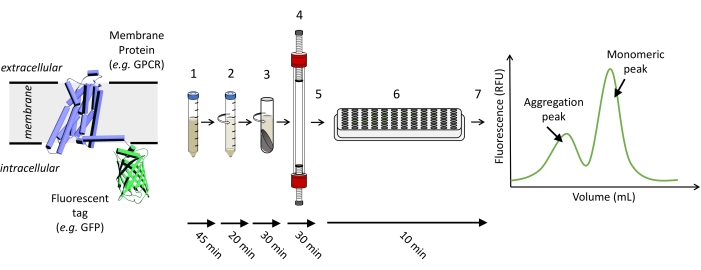
Abbildung 1: Schematische Darstellung der Schritte, die zur Durchführung eines FSEC-Experiments erforderlich sind. (1) Zellen, die das interessierende fluoreszenzmarkierte Protein exprimieren, werden solubilisiert. (2) Die grobe Solubilisierung wird zuerst mit einem Spin mit niedriger Geschwindigkeit geklärt, gefolgt von (3) einem Spin mit hoher Geschwindigkeit. (4) Der geklärte Probenüberstand wird geladen und auf einer geeigneten SEC-Säule ausgeführt, und (5) die Fraktionen werden gesammelt. (6) Proben der Fraktionen werden auf eine 96-Well-Platte übertragen, und ein GFP-Fluoreszenzsignal wird unter Verwendung eines Plattenlesers detektiert, um (7) die FSEC-Spur aufzuzeichnen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
Zunächst wurden der Dynamikbereich und die unteren Grenzen der eGFP-Detektion für den in dieser Studie verwendeten Plattenleser untersucht. Ein gereinigter eGFP-Standard bekannter Konzentration wurde in einem Endvolumen von 50 μl auf 50 ng·μL−1, 25 ng·μL−1, 12,5 ng·μL−1, 6,25 ng·μL−1, 3,125 ng·μL−1, 1,5625 ng·μL−1, 0,78125 ng·μL−1 und 0,390625 ng·μL−1 verdünnt, und die Fluoreszenz wurde mit einer Anregung von 488 nm und einer Emission von 507 nm abgelesen (Abbildung 2 ). Dieses Experiment zeigte, dass der Plattenleser eine untere Nachweisgrenze von 30 ng eGFP-markiertem Protein pro Well und einen dynamischen Bereich von bis zu 500 ng eGFP-markiertem Protein pro Well vor der Signalsättigung aufwies. Unter Verwendung des Wertes für die untere Grenze und unter der Annahme, dass die Proteinelution auf 0,33 des Säulenvolumens begrenzt ist, sind für die SEC-Säulenbeladung nur 1,28 μg des interessierenden eGFP-markierten Proteins erforderlich, damit ein nachweisbares FSEC-Signal beobachtet werden kann.
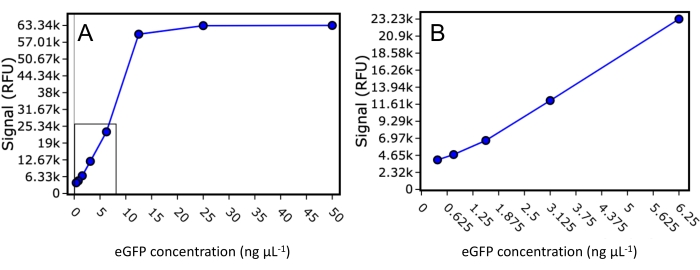
Abbildung 2: eGFP-Standardkurve. Streudiagramm des Fluoreszenzsignals für gereinigten eGFP-Standard, verdünnt auf 50 ng·μL−1, 25 ng·μL−1, 12,5 ng·μL−1, 6,25 ng·μL−1, 3,125 ng·μL−1, 1,5625 ng·μL−1, 0,78125 und 0,390625 ng·μL−1. (A) Alle Verdünnungen werden angezeigt, einschließlich derjenigen mit dem gesättigten Signal. (B) Ein vergrößertes Streudiagramm, das nur die Standards enthält, die in den Dynamikbereich des Plattenlesegeräts fallen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Zweitens wurde die für diese Studie verwendete 24-ml-Säule mit Molekulargewichtsstandards kalibriert. Unter Verwendung der gleichen Puffer- und Betriebsbedingungen wie für die FSEC-Analyse wurden die Molekulargewichtsstandards blaues Dextran (>2.000 kDa), Ferritin (440 kDa), Aldolase (158 kDa), Conalbumin (75 kDa) und Ovalbumin (43 kDa) einzeln injiziert und durch die Säule geleitet, und die Elutionsspuren wurden bei einer Absorption von 280 nm gesammelt. Die aufgezeichneten Elutionsvolumina betrugen 8,9 ml, 12,4 ml, 15,2 ml, 16,9 ml bzw. 18 ml. Wenn diese Elutionsvolumina in Kav umgerechnet (Gleichung 1) und gegen logarithmische Molekulargewichte aufgetragen wurden, konnte eine Standardkurve angepasst werden. Dadurch konnte das Molekulargewicht der in dieser Studie getesteten GPCRs durch Interpolation der Standardkurve geschätzt werden (Abbildung 3). Zum Beispiel zeigte die FSEC-Spur des GPCR-Serotoninrezeptors 2A (5HT2AR) nach Solubilisierung im Detergens DDM ein Elutionsvolumen von 13,4 ml an. Dieses 5HT2AR-Elutionsvolumen liegt zwischen den für Ferritin und Aldolase aufgezeichneten Elutionsvolumina und liefert ein geschätztes Molekulargewicht von etwa 300 kDa. Das in dieser Studie verwendete 5HT 2A R-Konstrukt beträgt ungefähr 50 kDa (einschließlich des eGFP-Tags), was bedeutet, dass, wenn angenommen wird, dass 5HT2AR monomer ist,250kDa Molekulargewicht auf die DDM-Detergens-/Lipidmizelle zurückzuführen sind. Die Gleichung für die Umrechnung von Elutionsvolumina lautet wie folgt (Gleichung 1):
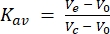 (Gleichung 1)
(Gleichung 1)
wobei V e das Elutionsvolumen, V 0 das Säulenhohlraumvolumen und Vc das gesamte Säulenvolumen ist.
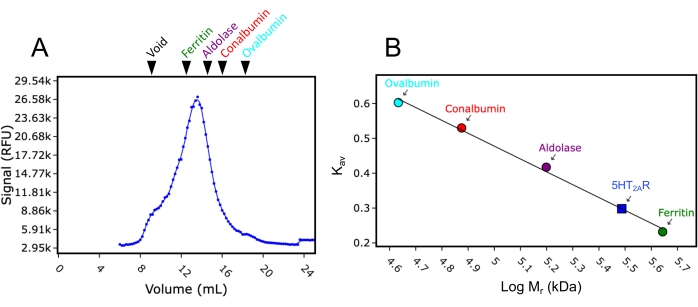
Abbildung 3: Kalibrierkurve der SEC-Säule unter Verwendung von Molekulargewichtsstandards. (A) Eine repräsentative FSEC-Spur von 5HT2AR, die in DDM solubilisiert ist, wobei die relativen Elutionspositionen der Molekulargewichtsstandards blaues Dextran (Void), Ferritin, Aldolase, Conalbumin und Ovalbumin markiert sind. Ferritin, Aldolase, Conalbumin und Ovalbumin sind in Grün, Lila, Rot bzw. Cyan gefärbt. (B) Die Kalibrierkurve des Molekulargewichts unter Verwendung der Elutionspositionen der Standards nach der Umrechnung in Kav (Gleichung 1), aufgetragen gegen das logarithmische Molekulargewicht (Mr). Das Mr von 5HT2AR in DDM wurde mit Kav aus der Kurve interpoliert und wird auf der Kurve (blaues Quadrat) angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
FSEC wurde dann verwendet, um die Qualität und Eigenschaften des GPCR-Sphingosin-1-Phosphat-Rezeptors (S1PR1)15 zu bewerten. Insektenzellen, die GFP-markiertes humanes S1PR 1 exprimierten, wurden wie im Protokoll beschrieben für FSEC verarbeitet (Abbildung 1).
Zunächst wurden die optimalen Bedingungen für die Membranextraktion untersucht, indem die Detergenzien DDM und LMNG gegen die waschmittelfreie Extraktion mit SMA getestet wurden (Abbildung 4A). Der Monodispersitätsindex wurde verwendet, um die Qualität der Proteinprobe und das Verhältnis zwischen dem Protein im Hohlraum (~8 ml Säulenretention) im Vergleich zur monodispersen Probe (14-15 ml Säulenretention) zu bewerten. Die in LMNG solubilisierte Probe zeigte ein überlegenes FSEC-Profil mit einer besseren Monomerpeakform und einem niedrigeren Proteinaggregatpeak, was darauf hindeutet, dass die Solubilisierung und Aufreinigung in LMNG die stabilisierendsten Bedingungen für dieses Membranprotein waren. Im Gegensatz dazu hatte die in DDM solubilisierte Probe ein relativ schlechteres FSEC-Profil mit einem größeren aggregierten Peak und einem breiteren monomeren Peak, was auf eine Polydispersität in der Probe hinweist.
Zweitens wurde die Wirkung der Ligandenaddition auf das FSEC-Profil durch Zugabe von Sphingosin-1-phosphat (S1P) zur Probe während der Solubilisierung untersucht. In diesem Fall wurde DDM als Solubilisierungsreagenz verwendet, und die FSEC-Spuren von S1PR1 in Gegenwart und Abwesenheit von S1P wurden verglichen (Abbildung 4B). Die in Gegenwart von S1P solubilisierte Probe zeigte eine überlegene FSEC-Spur mit reduzierter Aggregation. Dies deutete darauf hin, dass die Aufreinigung in Gegenwart eines Liganden vorteilhaft war, um die Proteinprobenqualität durch Stabilisierung des Rezeptors in Lösung zu verbessern, aber auch als Surrogatmarker für die Proteinaktivität vorteilhaft war, da die Ergebnisse darauf hindeuteten, dass das Protein korrekt gefaltet und für die Ligandenbindung geeignet war.
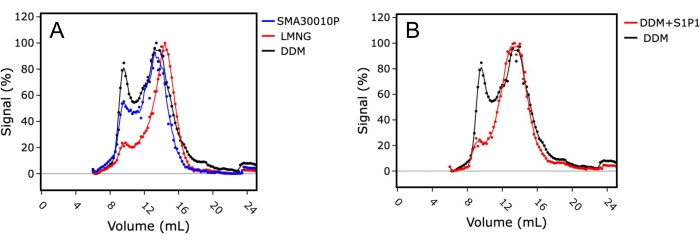
Abbildung 4: FSEC unter Verwendung eines Rohextrakts aus S1PR 1, der optimale Membranextraktionsbedingungen und Ligandenbindung anzeigt. (A) Vergleich der FSEC-Spuren von S1PR1, die in Styrol-Maleinsäure-Copolymer (SMA; blau), Laurylmaltose-Neopentylglykol (LMNG; rot) oder Dodecylmaltosid (DDM; schwarz) gelöst sind. (B) Vergleich der in DDM gelösten FSEC-Spuren von S1PR 1 in Gegenwart (rot) oder Abwesenheit (schwarz) des Agonisten Sphingosin-1-phosphat (S1P). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
FSEC wurde auch verwendet, um die Langzeitstabilität von 5HT2A Runter verschiedenen Bedingungen zu untersuchen. GFP-markiertes humanes 5HT2A Rwurde aus Insektenzellmembranen entweder in Detergens (DDM) oder SMA-Polymer solubilisiert und zu mehreren Zeitpunkten nach Lagerung bei 4 °C oder Raumtemperatur mittels FSEC analysiert (Abbildung 5). Nach mehrtägiger Inkubation zeigte 5HT2A Rin DDM einen signifikanten Abfall der monomeren Peakhöhe bei beiden Temperaturen, und es wurden signifikante Erhöhungen des aggregierten Peaks beobachtet. Im Gegensatz dazu zeigte 5HT2A Rin SMA-Lipidpartikeln (SMALP) im Verlauf des Experiments keinen signifikanten Abfall der monomeren Peakhöhe, was darauf hindeutet, dass das Protein in SMALP auch bei ungünstigen Temperaturen länger stabil blieb. Dies kann wichtig sein, wenn Proteinpräparate für nachgeschaltete biophysikalische Anwendungen wie Oberflächenplasmonenresonanz-Experimente (SPR) in Betracht gezogen werden, bei denen die Probe über einen langen Zeitraum stabil und aktiv sein muss, um die Bindungsexperimente erfolgreich abzuschließen.
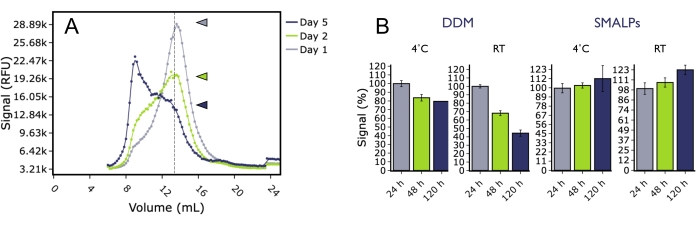
Abbildung 5: Einfluss von Zeit und Temperatur auf die Qualität von 5HT 2A R, das entweder mit DDM oder SMALP aus der Membran extrahiert wurde, analysiert durch FSEC. (A) Repräsentative FSEC-Spuren von 5HT2AR, die in DDM solubilisiert und bei Raumtemperatur für 1 Tag (grau), 2 Tage (grün) oder 5 Tage (blau) gelagert wurden. (B) Histogramme der normalisierten monomeren Peakhöhe für DDM-Proben, die bei 4 °C (blau) oder RT (grün) gelagert wurden, im Vergleich zu SMALP-Proben, die bei 4 °C (grau) oder RT (schwarz) gelagert wurden. Fehlerbalken sind repräsentativ für das REM. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die hier vorgestellten generischen systematischen Ansätze für das Condition Screening mit FSEC ermöglichen die schnelle Optimierung von Solubilisierungs- und Aufreinigungsparametern für die Herstellung von Membranproteinen. Das bedeutet, dass stabile und funktionell aktive Membranproteine für biophysikalische und strukturelle Studien schnell hergestellt werden können. Darüber hinaus kann FSEC mit Laborgeräten durchgeführt werden, die wahrscheinlich bereits in Membranproteinlabors vorhanden sind, so dass der Kauf eines Spezialinstruments für die Durchführung der Assays nicht erforderlich ist.
Kritische Schritte
Die Zeit, die zwischen dem Punkt der Solubilisierung von Zellen in Detergenzien und dem Punkt, an dem die Probe durch die SEC-Säule geleitet wird (Schritte 2.1.5-3.2.5), benötigt wird, ist zeitkritisch, und zwischen diesen Schritten dürfen keine Pausen liegen. Alle Schritte sollten bei 4 °C oder auf Eis durchgeführt werden, und die Zeit, die für die Durchführung dieser Schritte benötigt wird, muss so gering wie möglich gehalten werden. Diese Zeit- und Temperaturbeschränkungen sind notwendig, um das FSEC-Profil für das Membranprotein vor einer möglichen Entfaltung oder einem möglichen Abbau aufzuzeichnen. Nach der Solubilisierung des Membranproteins besteht bereits bei 4 °C ein größeres Risiko der Entfaltung, Aggregation und des Abbaus. Idealerweise sollten alle Proben, für die die FSEC-Spuren verglichen werden sollen, die SEC-Säule in der gleichen Zeitspanne nach dem Solubilisierungsschritt passieren. In der Praxis ist dies schwierig, insbesondere wenn die Proben nacheinander über eine einzelne Säule geleitet werden, aber es ist möglich, innerhalb von 3 Stunden bis zu fünf SEC-Spuren zu sammeln, und in diesem Zeitrahmen sollte es keine signifikante Verschlechterung geben.
Fehlerbehebung
Wenn bei der Durchführung des FSEC-Experiments ein geringes oder kein Fluoreszenzsignal vorhanden ist, ist es möglich, dass das interessierende Membranprotein die gewählte Zelllinie nicht exprimiert hat, eine sehr geringe Expression der gewählten Zelllinie aufweist oder nicht in dem gewählten Detergens solubilisiert wurde. Wenn die Proben vor dem Sammeln des Fluoreszenzsignals und der Aufzeichnung der FSEC-Spur verdünnt wurden, wäre ein einfacher erster Schritt, eine niedrigere Verdünnung oder keine Verdünnung der SEC-Fraktionen zu versuchen. Wenn dies immer noch keine interpretierbare FSEC-Spur ergibt, sollte die Expression und Solubilisierung des Proteins überprüft werden.
Die Analyse der Proteinexpression kann erreicht werden, indem die Fluoreszenz der Probe nach Schritt 2.2.2 überprüft wird. Wenn es ein sehr niedriges oder kein Fluoreszenzsignal von dieser Probe gibt (z. B. ein Signal sehr nahe am Hintergrund), liegt wahrscheinlich ein Problem mit der Proteinexpression vor. Es können Schritte unternommen werden, um die Expressionsniveaus des Membranproteins zu verbessern, wie z. B. das Umschalten auf eine alternative Zelllinie oder die Anpassung der Wachstumsbedingungen, der Induktion der Expression und der Zeit zwischen der Induktion/Infektion/Transfektion und der Ernte. Eine besonders schlechte Proteinexpression kann jedoch auf ein instabiles Membranprotein und damit auf eine schlechte Konstruktwahl hindeuten.
Wenn die Expression überprüft wurde und vor der FSEC ein deutliches Fluoreszenzsignal über dem Hintergrund vorhanden ist, kann die Solubilisierungseffizienz überprüft werden, indem das verbleibende Fluoreszenzsignal der Probe nach Schritt 2.4.3 (lösliches Membranprotein) im Vergleich zur Probe nach Schritt 2.2.2 (Gesamtprotein) gemessen wird. Es ist üblich, dass die Solubilisierungseffizienz 20% -30% beträgt und dennoch die erfolgreiche Analyse und Reinigung des Membranproteins ermöglicht. Wenn die Solubilisierungseffizienz jedoch weniger als 20% beträgt, kann ein anderes Detergens für die Solubilisierung oder andere Solubilisierungsbedingungen erforderlich sein. Wenn Versuche, die Solubilisierung zu verbessern, nicht erfolgreich sind, kann dies auf ein besonders instabiles Membranprotein und damit auf eine schlechte Konstruktwahl hindeuten.
Wenn ein sehr später eluierender Peak in der FSEC-Spur beobachtet wird (z. B. 18-24 ml), deutet dies darauf hin, dass das fluoreszierende Protein ein viel niedrigeres Proteinmolekulargewicht als erwartet aufweist. Dies kann dadurch verursacht werden, dass das interessierende Membranprotein abgebaut wird, was zu "freiem" GFP führt. Man sollte überprüfen, ob das Protein vor und nach der Solubilisierung intakt ist, indem man In-Gel-GFP-Fluoreszenz verwendet. Wenn das interessierende Protein abgebaut oder proteolysiert zu werden scheint, kann die Menge des Proteasehemmers um das Zwei- bis Vierfache erhöht werden. Eine hohe Empfindlichkeit gegenüber Proteasen oder abgebauten Proteinen bereits vor der Solubilisierung kann jedoch auf ein besonders instabiles Protein und damit auf eine schlechte Konstruktwahl hinweisen.
Modifikationen und weitere Anwendungen von FSEC
Im Allgemeinen ist der Fluoreszenz-Tag, der in FSEC verwendet wird, GFP oder eGFP, wie in diesem Protokoll beschrieben. Es sind jedoch viele verschiedene fluoreszierende Protein-Tags verfügbar. Die Wahl des zu verwendenden Fluoreszenz-Tags hängt davon ab, ob ein Plattenleser vorhanden ist, der die richtigen Anregungs- und Emissionsparameter erreichen kann, um das Fluoreszenzsignal für den ausgewählten Fluoreszenz-Tag aufzuzeichnen, und ob ein Fluorophor mit geringer bis gar keiner Änderung der Quantenausbeute unter verschiedenen Umgebungsbedingungen vorhanden ist. Darüber hinaus ist FSEC nicht auf fluoreszierende Proteine beschränkt, sondern kann auch mit einem Protein, das mit einem Fluoreszenzfarbstoff markiert wurde, genauso gut funktionieren. Zum Beispiel könnte ein NTA-Farbstoff verwendet werden, der günstig an Histidin-markierte Membranproteinkonstrukte binden würde. Darüber hinaus könnte entweder ein fluoreszenzmarkierter Antikörper, der chemisch mit einem Fluoreszenzfarbstoff markiert ist und spezifisch für die Bindung des interessierenden Membranproteins ist, oder ein im Membranproteinkonstrukt enthaltener Aufreinigungstag indirekt ein Ziel für FSEC markieren.
Bei der Durchführung eines Detergenzien-Screenings mit FSEC kann gewählt werden, ob der Puffer, der zum Ausführen der SEC-Säule verwendet wird, das passende Detergens enthalten soll, in dem das Protein solubilisiert wurde, oder ob ein Standarddetergens für alle Durchläufe verwendet werden soll. Eine genauere Darstellung des Verhaltens des Proteins erhält man, wenn das gesamte Experiment durchgehend mit dem passenden Detergens durchgeführt wird. Es kann jedoch zeitaufwändig und waschmittelverschwenderisch sein, wenn die Säule vor jedem Durchlauf in einem neuen Waschmittel wieder ausbalanciert werden muss. Da der Hauptzweck des Waschmittel-Screenings darin besteht, Spuren zu vergleichen, bleiben die Trends in den Spuren erhalten, auch wenn die Bedingungen nicht ideal sind. Somit kann ein Kompromiss erreicht werden, bei dem das Protein in dem betreffenden Detergens solubilisiert wird, die Säule jedoch in einem Standardpuffer mit einem einzigen Detergens über alle Durchläufe (z. B. DDM)11 betrieben wird, was Zeit und Waschmittelverbrauchsmaterialien sparen kann.
Durch Modifikation der verwendeten FLPC-Geräte kann der Durchsatz des FSEC-Protokolls erheblich erhöht und der Probenbedarf minimiert werden. Beispielsweise könnte ein FPLC- oder HPLC-System mit einem Autosampler, einer Analysesäule mit kleinerem Bettvolumen (z. B. einer analytischen 3,2-ml-SEC-Säule) und einem Inline-Fluoreszenzdetektor zur Überwachung kontinuierlicher FSEC-Spuren direkt von der Säule ausgestattet sein. Der daraus resultierende Aufbau würde es ermöglichen, mehr FSEC-Läufe in kürzerer Zeit durchzuführen und den manuellen Plotschritt zu eliminieren, wodurch eine größere Anzahl von Bedingungen in einem kürzeren Zeitrahmen getestet werden könnte. Darüber hinaus würde der Probenbedarf weiter reduziert, da für jeden Durchlauf weniger Proben vorbereitet und auf die FSEC-Säule geladen werden müssten. Dies würde Möglichkeiten eröffnen, die Ausdruckskulturen auf ein plattenbasiertes Format zu reduzieren, da so wenig Material für die Analyse benötigt würde.
Stärken und Schwächen des FSEC im Vergleich zu anderen Methoden
Ein Nachteil von FSEC besteht darin, dass die Membranproteinkonstrukte so konstruiert werden müssen, dass sie die fluoreszierende Markierung einführen, und bei der Einführung besteht eine geringe Wahrscheinlichkeit, dass die Platzierung der Markierung die Funktion oder Faltung des interessierenden Membranproteins beeinträchtigen könnte. Darüber hinaus überwacht das FSEC-Protokoll, wie hier beschrieben, die Eigenschaften eines Membranproteins in Gegenwart von Zelllysat, bei dem es sich um ein Rohgemisch von Proteinen handelt. Das Verhalten eines Membranproteins in dieser Umgebung kann anders sein, als wenn das interessierende Membranprotein am Ende der Reinigung einer präparativen SEC-Säule unterzogen wird, wenn es vollständig von anderen Proteinen isoliert ist. Darüber hinaus liefert FSEC ein gewisses qualitatives Maß für die Proteinqualität. Durch die Umwandlung der FSEC-Spur in einen Monodispersitätsindex, wie in Schritt 4.3.3 des Protokolls beschrieben, kann jedoch ein quantitatives Maß für die Proteinqualität erhalten werden.
FSEC ist nicht die einzige Methode, die bei der frühen Analyse von Membranproteinkonstrukten, Solubilisierungsbedingungen und der Zusammensetzung des Reinigungspuffers verwendet werden kann. Die alternativen Ansätze haben sowohl Vor- als auch Nachteile gegenüber FSEC. Beispielsweise gibt es Fluorophor-basierte Thermostabilitätsassays, insbesondere die Verwendung des Farbstoffs 7-Diethylamino-3-(4′-maleimidylphenyl)-4-methylcumarin (CPM)16,17. Der Vorteil dieser Methode besteht darin, dass Thermostabilitätsassays im Gegensatz zu FSEC, die ein qualitatives Maß für die Proteinqualität liefern, ein quantitatives Maß in Form einer relativen Schmelztemperatur liefern. Darüber hinaus ist es nicht erforderlich, eine fluoreszierende Markierung in das Proteinkonstrukt einzubringen. Die Nachteile von Thermostabilitäts-Assays im Vergleich zu FSEC bestehen jedoch darin, dass gereinigtes Protein verwendet werden muss und dass der Assay nicht mit allen Proteinkonstrukten kompatibel ist, da er auf den vorteilhaften Positionen nativer Cysteinreste im gefalteten Protein beruht.
Eine weitere Methode, die Ähnlichkeiten mit FSEC- und Fluorophor-basierten Thermostabilitätstests aufweist, ist ein Assay, der die Temperaturempfindlichkeit eines Membranproteins misst. In diesem Assay wird das Protein mit unterschiedlichen Temperaturen herausgefordert und das Protein, das nach der Zentrifugation in Lösung verbleibt, wird nachgewiesen. Die Detektion in diesem Verfahren wurde auf verschiedene Weise durchgeführt, einschließlich der Messung der Fluoreszenz in Lösung18, der Fluoreszenz einer SDS-PAGE-Gelbande19 oder der Signalintensität in einem Western Blot20. Ein wesentlicher Nachteil dieser Ansätze ist jedoch, dass der Assay sehr arbeitsintensiv und anfällig für hohes Rauschen in den Ergebnissen ist, da jeder einzelne Temperaturpunkt unabhängig erfasst werden muss.
Schließlich können mehrere fortgeschrittenere biophysikalische Techniken verwendet werden, um die Qualität von Membranproteinen in ähnlicher Weise wie bei der FSEC zu bewerten, z. B. die strömungsinduzierte Dispersionsanalyse21, die mikroskalige Thermophorese22 oder die SPR. Obwohl es sich um sehr leistungsfähige Ansätze handelt, besteht der Nachteil dieser Methoden darin, dass hochspezialisierte Instrumente erforderlich sind, um die Analysen durchzuführen.
Zusammenfassend lässt sich sagen, dass FSEC ein unschätzbares Werkzeug für den Einsatz in Kampagnen zur Herstellung von Membranproteinen darstellt, und obwohl es nicht die einzige Option ist, hat es mehrere deutliche Vorteile gegenüber anderen Methoden, wie oben aufgeführt. Die Kreuzvalidierung der Ergebnisse durch orthogonale Assays wird immer empfohlen, und keine der oben diskutierten Methoden schließt sich gegenseitig aus.
Offenlegungen
Peak Proteins ist ein Auftragsforschungsinstitut, das gegen eine Gebühr Proteinexpression, Aufreinigung, Massenspektrometrie und Strukturbestimmung anbietet.
Danksagungen
Wir möchten uns für die Hilfe und Unterstützung des gesamten Peak Proteins-Teams bedanken. Vom Zellwissenschaftsteam möchten wir Ian Hampton für seine wertvollen Einblicke und Anleitungen zur Expression von Insektenzellen danken. Wir möchten uns bei Mark Abbott für die Bereitstellung der Ressourcen und der Möglichkeit bedanken, dieses Projekt zu verfolgen.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL and 5 mL plastic syringes | Generic | - | Syringes for transfer of samples |
| 10x EDTA Free Protease inhibitor cocktail | Abcam | ab201111 | Protease inhibitors |
| 15 mL tubes | Generic | - | 15 mL tubes for pellet preparation and solubilisation |
| 2 mL ultra-centrifuge tubes | Beckman Coulter | 344625 | Tubes for ultra-centrifuge rotor |
| 50 mL tubes | Generic | - | 50 mL tubes for cell harvest |
| 96 deep-well blocks | Greiner | 15922302 | For collecting 0.2 mL SEC fractions |
| ÄKTA V9-L loop valve | Cytiva | 29011358 | 5 posiiton loop valve for the ÄKTA FPLC system |
| ÄKTA F9-C fraction collector | Cytiva | 29027743 | 6 position plate fraction collector for the ÄKTA FPLC system |
| ÄKTA pure 25 L | Cytiva | 29018224 | FPLC system for running the experiment |
| Benchtop centrifuge (e.g. Fisherbrand GT4 3L) | Fisher Scientific | 15828722 | Centrifuge for low-speed spin |
| Blunt end filling needles | Generic | - | For transfer of samples |
| Bottle top vacuum filter | Corning | 10005490 | Bottle top vacuum filter for filtering SEC buffers |
| Cholesteryl hemisuccinate (CHS) | Generon | CH210-5GM | Additive for detergent solubilisation |
| Disposable multichannel reseviour | Generic | - | Resevior for addition of water or buffer to 96-well micro-plate |
| Dodecyl maltoside (DDM) | Glycon | D97002-C-25g | Detergent for solubilisation |
| eGFP protein standards | BioVision | K815-100 | eGFP standards for fluorescent calibration curve |
| Glycerol | Thermo Scientific | 11443297 | Glycerol for buffer preparation |
| HEPES | Thermo Scientific | 10411451 | HEPES for buffer preparation |
| High molecular weight SEC calibration standards kit | Cytiva | 28403842 | Molecular weight calibration kit for SEC |
| Lauryl maltose neopentylglycol (LMNG) | Generon | NB-19-0055-5G | Detergent for solubilisation |
| Low molecular weight SEC calibration standards kit | Cytiva | 28403841 | Molecular weight calibration kit for SEC |
| MLA-130 ultra-centrifuge rotor | Beckman Coulter | 367114 | Rotor for ultracentrifuge that fits 2 mL capacity tubes |
| Opaque 96-well flat-bottom micro-plate | Corning | 10656853 | 96-well for reading fluorescent signal in plate reader |
| Optima MAX-XP ultra-centrifuge | Beckman Coulter | 393315 | Centrifuge for high-speed spin |
| pH meter | Generic | - | For adjusting the pH of buffers during preparation |
| Prism | GraphPad | - | Graphing software for plotting traces |
| Rotary mixer | Fisher Scientific | 12027144 | Mixer for end over end mixing in the cold |
| Sodium chloride | Fisher Scientific | 10316943 | Sodium chloride for buffer preparation |
| Sodium hydroxide | Fisher Scientific | 10488790 | Sodium hydroxide for buffer preparation |
| Spectramax ID3 Plate Reader | Molecular Devices | 735-0391 | Micro-plate reader capable of reading fluorescence |
| Stirrer plate | Generic | - | For stirring buffers during preparation |
| Styrene maleic acid (SMA) | Orbiscope | SMALP 300 | Polymer for detergent free extraction |
| Superdex 200 Increase 10/300 GL | Cytiva | 28990944 | SEC column for running the experiment. The bed volume of this column is 24 mL. The recommended flow rate for this column in 0.9 ml/min (in water at 4 °C). The maximum pressure limit for this column is 5 MPa. |
| Vacuum pump | Sartorius | 16694-2-50-06 | For filtering and degassing buffers |
Referenzen
- Burgess, R. R. A brief practical review of size exclusion chromatography: Rules of thumb, limitations, and troubleshooting. Protein Expression and Purification. 150, 81-85 (2018).
- Erickson, H. P. Size and shape of protein molecules at the nanometer level determined by sedimentation, gel filtration, and electron microscopy. Biological Procedures Online. 11 (1), 32-51 (2009).
- Lathe, G. H., Ruthven, C. R. J. The separation of substances and estimation of their relative molecular sizes by the use of columns of starch in water. Biochemical Journal. 62 (4), 665-674 (1956).
- Lathe, G. H., Ruthven, C. R. The separation of substances on the basis of their molecular weights, using columns of starch and water. Biochemical Journal. 60 (4), (1955).
- Polson, A. Fractionation of protein mixtures on columns of granulated agar. Biochimica et Biophysica Acta. 50 (3), 565-567 (1961).
- Hjertén, S., Mosbach, R. 34;Molecular-sieve" chromatography of proteins on columns of cross-linked polyacrylamide. Analytical Biochemistry. 3 (2), 109-118 (1962).
- Porath, J., Flodin, P. Gel filtration: A method for desalting and group separation. Nature. 183 (4676), 1657-1659 (1959).
- Kawate, T., Gouaux, E. Fluorescence-detection size-exclusion chromatography for precrystallization screening of integral membrane proteins. Structure. 14 (4), 673-681 (2006).
- Hattori, M., Hibbs, R. E., Gouaux, E. A Fluorescence-detection size-exclusion chromatography-based thermostability assay for membrane protein precrystallization screening. Structure. 20 (8), 1293-1299 (2012).
- Shimomura, O., Johnson, F. H., Saiga, Y. Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. Journal of Cellular and Comparative Physiology. 59 (3), 223-239 (1962).
- Drew, D., et al. GFP-based optimization scheme for the overexpression and purification of eukaryotic membrane proteins in Saccharomyces cerevisiae. Nature Protocols. 3 (5), 784-798 (2008).
- Newstead, S., Kim, H., von Heijne, G., Iwata, S., Drew, D. High-throughput fluorescent-based optimization of eukaryotic membrane protein overexpression and purification in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences of the United States of America. 104 (35), 13936-13941 (2007).
- Vaidehi, N., Grisshammer, R., Tate, C. G. How can mutations thermostabilize G-protein-coupled receptors. Trends in Pharmacological Sciences. 37 (1), 37-46 (2016).
- Hardy, D., Bill, R. M., Jawhari, A., Rothnie, A. J. Overcoming bottlenecks in the membrane protein structural biology pipeline. Biochemical Society Transactions. 44 (3), 838-844 (2016).
- Hanson, M. A., et al. Crystal structure of a lipid G protein-coupled receptor. Science. 335 (6070), 851-855 (2012).
- Alexandrov, A. I., Mileni, M., Chien, E. Y. T., Hanson, M. A., Stevens, R. C. Microscale fluorescent thermal stability assay for membrane proteins. Structure. 16 (3), 351-359 (2008).
- Harborne, S. P. D., King, M. S., Kunji, E. R. S. Thermostability assays: A generic and versatile tool for studying the functional and structural properties of membrane proteins in detergents. Biophysical Journal. 118 (4), 105-121 (2020).
- Nji, E., Chatzikyriakidou, Y., Landreh, M., Drew, D. An engineered thermal-shift screen reveals specific lipid preferences of eukaryotic and prokaryotic membrane proteins. Nature Communications. 9 (1), 4253 (2018).
- Harborne, S. P. D., et al. IMPROvER: The Integral Membrane Protein Stability Selector. Scientific Reports. 10 (1), 15165 (2020).
- Ashok, Y., Nanekar, R., Jaakola, V. -. P. Defining thermostability of membrane proteins by western blotting. Protein Engineering Design and Selection. 28 (12), 539-542 (2015).
- Pedersen, M. E., Østergaard, J., Jensen, H. Flow-induced dispersion analysis (FIDA) for protein quantification and characterization. Methods Mol Biol. 1972, 109-123 (2019).
- Wienken, C. J., Baaske, P., Rothbauer, U., Braun, D., Duhr, S. Protein-binding assays in biological liquids using microscale thermophoresis. Nature Communications. 1 (1), 100 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten