Method Article
Valutazione rapida della qualità delle proteine di membrana mediante cromatografia fluorescente di esclusione dimensionale
In questo articolo
Riepilogo
Il presente protocollo descrive una procedura per eseguire la cromatografia fluorescente ad esclusione dimensionale (FSEC) su proteine di membrana per valutarne la qualità per l'analisi funzionale e strutturale a valle. Vengono presentati i risultati rappresentativi FSEC raccolti per diversi recettori accoppiati a proteine G (GPCR) in condizioni solubilizzate con detergente e senza detergenti.
Abstract
Durante la delucidazione strutturale delle proteine di membrana e la caratterizzazione biofisica, è comune sperimentare numerosi costrutti proteici contenenti diversi tag, troncamenti, delezioni, inserzioni di partner di fusione e mutazioni stabilizzanti per trovarne uno che non sia aggregato dopo l'estrazione dalla membrana. Inoltre, lo screening tampone per determinare il detergente, l'additivo, il legante o il polimero che fornisce la condizione più stabilizzante per la proteina di membrana è una pratica importante. La caratterizzazione precoce della qualità delle proteine di membrana mediante cromatografia fluorescente ad esclusione dimensionale fornisce un potente strumento per valutare e classificare diversi costrutti o condizioni senza la necessità di purificazione delle proteine, e questo strumento riduce anche al minimo il fabbisogno del campione. Le proteine di membrana devono essere marcate in modo fluorescente, comunemente esprimendole con un tag GFP o simile. La proteina può essere solubilizzata direttamente da cellule intere e poi grossolanamente chiarificata mediante centrifugazione; Successivamente, la proteina viene passata lungo una colonna di esclusione dimensionale e viene raccolta una traccia fluorescente. Qui viene presentato un metodo per eseguire FSEC e dati FSEC rappresentativi sul recettore GPCR della sfingosina-1-fosfato (S1PR1) e sul recettore della serotonina (5HT2AR).
Introduzione
La cromatografia ad esclusione dimensionale (SEC), nota anche come cromatografia a filtrazione su gel, è comunemente usata nella scienza delle proteine1. Durante la SEC, le proteine vengono separate in base al loro raggio idrodinamico, che è una funzione della dimensione e della forma della proteina2. In breve, questa separazione si ottiene applicando i campioni proteici sotto flusso a un letto impacchettato di perle porose che fungono da setaccio molecolare. Le perle utilizzate sono spesso agarosio reticolato con una gamma definita di dimensioni dei pori per consentire alle proteine di entrare o essere escluse dai pori delle perle 3,4,5,6,7. Le proteine con raggi idrodinamici più piccoli trascorrono una percentuale maggiore di tempo all'interno dei pori e, quindi, fluiscono attraverso il letto impacchettato a una velocità più lenta, mentre le proteine più grandi trascorrono una percentuale maggiore di tempo al di fuori delle perle (il volume escluso) e si muovono attraverso il letto impacchettato ad un ritmo più veloce. SEC può essere utilizzato come fase di purificazione delle proteine quando viene utilizzata una colonna preparativa1. Quando viene utilizzata una colonna analitica, SEC può essere utilizzato per analizzare la qualità e le proprietà delle proteine2. Ad esempio, gli aggregati proteici che possono essere presenti in un campione e indicare proteine di scarsa qualità tendono ad essere molto grandi, il che significa che viaggiano solo nel volume escluso e, quindi, vengono eluiti dalla colonna nel punto più precoce; Questo volume viene definito colonna void o void volume. Inoltre, gli standard di peso molecolare possono essere utilizzati per calibrare la colonna, consentendo di interpolare un peso molecolare stimato della proteina di interesse da una curva standard.
Tipicamente, l'assorbanza proteica a 280 nm viene utilizzata per monitorare l'eluizione proteica da una colonna di esclusione dimensionale. Ciò limita l'uso di SEC come strumento di analisi fino a quando la proteina di interesse non è in gran parte priva di proteine contaminanti, ad esempio, nell'ultima fase della purificazione delle proteine. Tuttavia, la SEC fluorescente (FSEC) utilizza una proteina di interesse che è marcata con fluorescenza. Pertanto, un segnale fluorescente può essere utilizzato per monitorare specificamente l'eluizione della proteina di interesse in presenza di altre proteine o anche miscele grezze 8,9. Inoltre, poiché i segnali fluorescenti sono altamente sensibili, è possibile eseguire analisi di successo su campioni con quantità proteiche estremamente basse. La proteina di interesse è spesso marcata in modo fluorescente includendo una proteina fluorescente verde (GFP) o un tag GFP potenziato (eGFP) nel costrutto di espressione. Il segnale fluorescente può quindi essere monitorato mediante eccitazione a 395 nm o 488 nm e rilevando l'emissione fluorescente a 509 nm o 507 nm per GFP o eGFP, rispettivamente10.
Il vantaggio di utilizzare un segnale fluorescente per monitorare l'eluizione delle proteine da una colonna SEC rende FSEC uno strumento prezioso per analizzare campioni di proteine di membrana quando i livelli di espressione sono particolarmente scarsi rispetto alle proteine solubili. Fondamentalmente, la qualità e le proprietà delle proteine di membrana possono essere analizzate direttamente dopo la solubilizzazione da lisati grezzi senza la necessità di ottimizzare il processo di purificazione prima11,12. Per questi motivi, FSEC può essere utilizzato per analizzare rapidamente la qualità delle proteine di membrana mentre si esplorano i diversi fattori che possono essere necessari per migliorare il comportamento della proteina di membrana in soluzione. Ad esempio, è comune provare numerosi costrutti contenenti diversi tag, troncamenti, delezioni, inserzioni di partner di fusione e mutazioni stabilizzanti per trovarne uno che non sia aggregato dopo l'estrazione dalla membrana13,14. Inoltre, lo screening tampone per determinare il detergente, l'additivo, il legante o il polimero che fornisce la condizione più stabilizzante per la proteina di membrana può definire la migliore composizione tampone per la purificazione delle proteine o per fornire stabilità per usi a valle, come saggi biofisici o caratterizzazione strutturale.
Pertanto, l'obiettivo generale del metodo FSEC è quello di raccogliere un profilo di eluizione della colonna SEC per una proteina di membrana bersaglio di interesse. Inoltre, poiché viene utilizzata la fluorescenza, questa traccia SEC viene raccolta il prima possibile nell'ottimizzazione dei costrutti e delle condizioni prima di qualsiasi lunga purificazione. La traccia FSEC può essere utilizzata come strumento comparativo per giudicare la probabilità di successo della purificazione di una proteina di membrana con diverse condizioni tampone o costrutti proteici di membrana. In questo modo, la raccolta dei profili FSEC può essere utilizzata come un rapido processo iterativo per arrivare alla progettazione ottimale del costrutto e alla composizione del buffer prima di spendere sforzi generando le quantità di proteine pure necessarie per altri metodi di analisi.
Protocollo
1. Preparazione detergente e tampone per FSEC
- Preparare una soluzione di brodo detergente.
- Per preparare una soluzione madre da 20 ml, pesare 4 g di dodecilmaltoside (DDM) in polvere e 0,4 g di colesteril emisuccinato (CHS) in polvere, e portarla a 20 ml con H2O distillato in laboratorio.
- Dopo aver aggiunto tutti i componenti, mescolare con inversione end-over-end a 4 °C fino a completa solubilizzazione dei componenti. Si raccomanda una miscelazione end-over-end durante la notte a 4 °C.
- Aliquote e conservare le scorte di detergenti a -20 °C fino all'uso. Se il brodo deve essere utilizzato immediatamente, conservare il brodo di detersivo su ghiaccio.
NOTA: Lo stock di detergente standard utilizzato in questo lavoro era una miscela CHS al 20% (p/v) DDM e al 2% (p/v) (vedi Tabella dei materiali). Possono essere utilizzati diversi detergenti (ad esempio, lauryl maltose neopentyl glycol; LMNG), o l'uso di estrazione senza detergenti con polimeri come l'acido stirene-maleico (SMA) può essere testato. Questo deve essere deciso quando si progettano le condizioni sperimentali da testare.
- Preparare un tampone di solubilizzazione.
- Preparare un tampone di solubilizzazione combinando il peso o il volume corretti dei componenti per ottenere una concentrazione finale di 100 mM HEPES, 200 mM NaCl, 20 % (v/v) glicerolo e 1x cocktail inibitore della proteasi (vedere Tabella dei materiali) in un becher.
NOTA: Nel presente studio, la preparazione di 50 ml di tampone di solubilizzazione è stata sufficiente per il trattamento di cinque campioni. - Aggiungere un volume di 0,7 (ad esempio, 35 ml se si producono 50 ml di tampone) di H2O distillato di laboratorio al becher.
- Mescolare su un agitatore magnetico e, utilizzando un pHmetro, regolare il pH del tampone a 7,5 aggiungendo NaOH concentrato a goccia.
- Utilizzando un cilindro graduato, rabboccare il buffer fino al volume finale richiesto con H2O distillato di laboratorio.
- Preparare un tampone di solubilizzazione combinando il peso o il volume corretti dei componenti per ottenere una concentrazione finale di 100 mM HEPES, 200 mM NaCl, 20 % (v/v) glicerolo e 1x cocktail inibitore della proteasi (vedere Tabella dei materiali) in un becher.
- Preparare il buffer di esecuzione SEC.
- Preparare il buffer di corsa SEC combinando il peso o il volume corretti dei componenti per ottenere una concentrazione finale di 100 mM HEPES, 150 mM NaCl e 10% (v/v) di glicerolo in un becher.
NOTA: Nel presente studio, la preparazione di 600 ml di tampone SEC era sufficiente per eseguire cinque campioni. - Aggiungere un volume di 0,7 (ad esempio, 420 ml se si producono 600 ml di tampone) di H2O distillato di laboratorio al becher.
- Mescolare su un agitatore magnetico e, utilizzando un pHmetro, regolare il pH del tampone a 7,5 aggiungendo NaOH concentrato a goccia.
- Utilizzando un cilindro graduato, rabboccare il buffer fino al volume finale richiesto con H2O distillato di laboratorio.
- Filtrare il tampone SEC attraverso un filtro a pori da 0,45 μm con tappo di bottiglia sotto vuoto (vedere la tabella dei materiali).
- Una volta che il tampone è passato attraverso il filtro, degassarlo lasciandolo sotto il vuoto fino a quando non appaiono più bolle quando viene scosso.
- Aggiungere una concentrazione finale dello 0,03% (p/v) DDM e 0,003% (p/v) CHS al tampone SEC aggiungendo il volume richiesto dello stock di detergente preparato nella fase 1 (ad esempio, 0,9 mL se si producono 600 mL di tampone SEC).
- Pre-raffreddare il buffer prima dell'uso.
NOTA: è possibile utilizzare buffer diversi a seconda delle condizioni testate. Ad esempio, se si verifica l'effetto di diversi detergenti sulla proteina di interesse, è idealmente necessario realizzare un tampone con lo stesso detergente utilizzato per solubilizzare la proteina. Se si verificano condizioni prive di detergenti con SMA, il detergente deve essere completamente omesso dal buffer SEC. Tuttavia, vedere la sezione di discussione per ulteriori dettagli sulle modifiche al protocollo per lo screening dei detergenti.
- Preparare il buffer di corsa SEC combinando il peso o il volume corretti dei componenti per ottenere una concentrazione finale di 100 mM HEPES, 150 mM NaCl e 10% (v/v) di glicerolo in un becher.
2. Preparazione del campione per FSEC
- Preparare i pellet cellulari.
NOTA: Il punto di partenza per il test è la raccolta del pellet cellulare da una coltura di espressione cellulare in sospensione della proteina di interesse marcata con GFP (o altra etichetta fluorescente). I tempi e le condizioni esatte per la raccolta dipenderanno dalla proteina espressa, dalla linea cellulare utilizzata, dalle condizioni in cui sono state coltivate le cellule e dal metodo con cui è stata indotta l'espressione proteica. Questi dettagli esulano dallo scopo di questo protocollo. In questo studio, sono stati utilizzati 0,5-1 g di pellet cellulare Sf21 per condizione da testare, corrispondenti a 25-50 ml di coltura 2-3 giorni dopo l'infezione con circa 4 x 106 cellule vitali / ml di una diluizione 1:20 di baculovirus P2. Si noti che il protocollo qui descritto è stato testato e ha dimostrato di funzionare altrettanto bene con pesi umidi simili di pellet cellulari di altre linee di cellule eucariotiche (ad esempio, HEK293E).- Quando le cellule delle colture in sospensione sono pronte per la raccolta, trasferire aliquote di coltura da 25-50 ml in tubi conici da 50 ml.
- Controbilanciare i tubi e utilizzare una centrifuga da banco in un secchio estraibile (vedi Tabella dei materiali) a 2.000 x g per 15 minuti a temperatura ambiente per pellettare le celle.
- Rimuovere e scartare il surnatante di coltura rovesciandolo delicatamente, oppure utilizzare un pipet da 50 ml con un riempitivo per pipett se il pellet cellulare è particolarmente sciolto.
- Se le celle verranno utilizzate immediatamente per l'analisi, posizionare il pellet di cella sul ghiaccio e procedere direttamente al passaggio 5. Se le celle devono essere conservate per essere utilizzate in una fase successiva, congelarle ponendole a -80 °C.
- Se il pellet cellulare è stato conservato a -80 °C, scongelarlo rapidamente incubandolo a temperatura ambiente per 15 minuti o fino a quando il campione non è più congelato. Spostare immediatamente il campione sul ghiaccio dopo questo passaggio.
- Risospendere e solubilizzare il campione.
- Aggiungere 2 mL del tampone di solubilizzazione (fase 1.2) al pellet cellulare.
- Incubare con inversione end-over-end a 4 °C per 15-30 minuti fino ad omogeneità.
- Aggiungere il materiale di detergente premiscelato (fase 1.1) (ad esempio, 100 μL di 20% DDM/2% CHS) per una concentrazione finale di 1% DDM/0,1% CHS.
- Solubilizzare per 30 minuti con inversione end-over-end a 4 °C.
NOTA: se lo desidera, è possibile testare più condizioni in parallelo. Il numero di campioni paralleli che possono essere elaborati contemporaneamente dipenderà dal sistema disponibile per l'esecuzione dell'esperimento SEC. Nella configurazione qui descritta, era possibile elaborare fino a cinque campioni alla volta.
- Eseguire una fase di centrifugazione a bassa velocità.
- Centrifugare il campione in una centrifuga da banco pre-raffreddata (4 °C) in un secchio estraibile a 2.000 x g per 15 minuti.
- Eseguire una fase di centrifugazione ad alta velocità.
- Trasferire con cautela il surnatante dalla centrifugazione a bassa velocità ai tubi di ultracentrifugazione (ad esempio, tubi da 0,5-2 ml) utilizzando un ago smussato collegato a una siringa da 5 ml, facendo attenzione a non disturbare il pellet dalla rotazione a bassa velocità.
- Bilanciare le coppie di tubi con un'approssimazione di 0,05 g e metterli in un rotore di ultracentrifugazione ad angolo fisso (vedere la tabella dei materiali).
- Centrifugare a 4 °C per 30 minuti a 250.000 x g.
3. Cromatografia ad esclusione dimensionale (SEC)
- Preparare il sistema di cromatografia liquida a proteine veloci (FPLC) ed equilibrare la colonna.
- Preparare il sistema seguendo le istruzioni del produttore (vedere Tabella dei materiali), ad esempio, riempiendo il sistema con tampone SEC e spurgando le pompe d'aria.
- Collegare la colonna SEC all'FPLC, assicurandosi che l'aria non entri nella colonna. Ciò si ottiene applicando una contropressione alla colonna SEC con una siringa riempita d'acqua (attaccata al fondo della colonna) per eseguire una connessione drop-to-drop con il percorso del flusso del sistema FPLC.
- Pre-equilibrare la colonna SEC lavandola prima in volumi di 1,5 colonne (36 mL per una colonna da 24 ml) di H2O distillato e filtrato di laboratorio, seguito da volumi di 1,5 colonne di tampone SEC alla portata e alla pressione raccomandate per la colonna (vedere Tabella dei materiali).
NOTA: Il sistema FPLC utilizzato in questo studio per eseguire FSEC era in un ambiente freddo e aveva una valvola ad anello a cinque posizioni e un collettore di frazione a piastre a sei posizioni montato. Questa configurazione consente di caricare cinque campioni ed eseguirli sequenzialmente lungo la stessa colonna in modo automatizzato senza richiedere un intervento manuale tra le esecuzioni. Per eseguire gli esperimenti SEC, è stata utilizzata una colonna preconfezionata da 24 mL disponibile in commercio (vedi Tabella dei materiali), che conteneva una resina che consentiva di risolvere proteine nell'intervallo di peso molecolare di 10-600 kDa. Se la proteina di interesse è particolarmente grande, si potrebbe invece utilizzare una matrice di colonna alternativa, che consente la separazione di proteine fino a 5.000 kDa in peso molecolare. Si prega di notare che la presenza di micelle detergenti/lipidiche aumenterà la dimensione complessiva della proteina di membrana di >150 kDa, a seconda della proteina e del detergente utilizzato.
- Applicare l'esempio alla colonna ed eseguire l'esperimento SEC.
- Trasferire il surnatante dalla fase di centrifugazione ad alta velocità a una siringa da 1 mL utilizzando un ago smussato collegato alla siringa. Ciò consente il recupero del campione dal tubo della centrifuga senza disturbare il pellet.
- Impostare il ciclo di esempio su load. Riempire eccessivamente un circuito di campionamento da 500 μL iniettando 600-700 μL del campione dalla siringa nella porta di carico. A seconda del sistema utilizzato, questa fase di caricamento può essere programmata nel metodo per garantire che non vengano commessi errori.
- Durante il metodo, iniettare il campione dal circuito nella colonna svuotandolo con 4 mL di tampone SEC alla portata e alla pressione raccomandate per la colonna (vedere Tabella dei materiali).
- Far scorrere la colonna alla stessa portata fino a quando non vengono trasmessi 1,5 volumi di colonna (36 ml per una colonna da 24 ml) del buffer.
- A 0,25 del volume della colonna (6 ml per una colonna da 24 ml), iniziare a raccogliere frazioni da 0,2 ml per raccogliere 90 frazioni.
NOTA: Poiché il volume vuoto della colonna dovrebbe essere di 0,3 volumi di colonna, iniziare la raccolta delle frazioni immediatamente prima di questo assicura che l'eluizione di tutte le proteine sia monitorata, comprese le proteine presenti nel volume del vuoto.
4. Raccolta e analisi di tracce fluorescenti
- Trasferire i campioni dal collettore di frazioni (passo 3.2.5) a una piastra da 96 pozzetti e leggere il segnale fluorescente.
- Prima di eseguire una lettura a fluorescenza, diluire i campioni raccolti. Utilizzando una pipetta multicanale, trasferire 90 μL di H2O distillato in laboratorio da un serbatoio a ciascun pozzetto di una piastra opaca a fondo piatto a 96 pozzetti (vedere Tabella dei materiali).
- Se le frazioni sono state raccolte in un blocco da 96 pozzetti durante la fase 3.2.5, utilizzare una pipetta multicanale per trasferire 10 μL delle frazioni SEC dal blocco alla piastra opaca a fondo piatto a 96 pozzetti e miscelare mediante pipettaggio su e giù. Altrimenti, se le frazioni SEC sono state raccolte in singoli tubi durante la fase 3.2.5, trasferire 10 μL di ciascuna frazione alla piastra opaca a fondo piatto a 96 pozzetti uno per uno, pipettando su e giù ogni volta per mescolare i campioni.
- Posizionare la piastra opaca a fondo piatto a 96 pozzetti nel lettore di piastre e misurare la fluorescenza. Se GFP è l'etichetta fluorescente (utilizzata qui), impostare l'eccitazione il più vicino possibile a 488 nm e rilevare l'emissione fluorescente il più vicino possibile a 507 nm.
NOTA: La diluizione necessaria prima di effettuare la lettura della fluorescenza dipenderà dalla quantità totale di proteine di interesse presenti nella coltura di espressione e dalla sensibilità del lettore di piastre utilizzato. Negli esempi mostrati in questo studio, i campioni sono stati diluiti 10 volte in acqua. Come suggerimento per un punto di partenza, le frazioni dovrebbero essere diluite 5-10 volte in acqua o tampone prima del rilevamento. Se il segnale di traccia FSEC registrato è particolarmente basso, è possibile utilizzare diluizioni più piccole o anche un campione non diluito. Il dispositivo utilizzato per il rilevamento in questo studio era un lettore di piastre in grado di eccitare a 488 nm e rilevare l'emissione fluorescente a 507 nm (vedi tabella dei materiali).
- Tracciare le tracce di FSEC.
- Esportare i dati dal lettore di lastre in un formato raw (testo grezzo o un file con valori delimitati da virgole). Questi dati grezzi verranno tracciati sull'asse Y della traccia FSEC.
- Per l'asse X, calcolare il volume al quale è stata raccolta ogni frazione. Il primo pozzetto deve essere il volume di eluizione al quale è stata raccolta la prima frazione per tenere conto del ritardo di frazionamento (6 mL in questo esempio). Le frazioni successive devono aumentare sequenzialmente del volume della frazione raccolta (0,2 ml in questo esempio).
- Una volta calcolati i dati dell'asse X e dell'asse Y, copiare e incollare i dati nel software grafico (vedere Tabella dei materiali) per tracciare il segnale fluorescente in ciascun pozzetto rispetto al volume al quale è stato eluito dalla colonna.
Nota : la Figura 1 mostra una rappresentazione schematica dei passaggi necessari per eseguire un esperimento FSEC.
- Analizzare le tracce di FSEC.
- Valutare la quantità di eluizione proteica al volume vuoto (circa 8 ml per una colonna di 24 ml), che indica che la proteina è di dimensioni molto grandi ed è probabilmente dispiegata/aggregata.
- Valutare la quantità di proteine eluite in eventuali picchi successivi, che indicano proteine ripiegate. Questo dovrebbe essere compreso tra 10 ml e 16 ml per una colonna di 24 ml a seconda della dimensione della proteina (quando associata a una micella detergente / lipidica). Prestare molta attenzione alla forma del picco, in particolare se si tratta di un picco ampio o diviso che si estende su un picco superiore a 3-4 ml (per una colonna di 24 ml), poiché ciò indica un campione polidisperso.
- Calcola il rapporto tra l'altezza del picco monomerico e l'altezza del picco del vuoto dividendo il segnale massimo registrato nel picco del monomero per il segnale massimo nel picco del vuoto.
NOTA: Questo valore rappresenta l'indice di monodispersità e permette una misura quantitativa della qualità delle proteine; Valori più grandi indicano la migliore qualità possibile, mentre valori inferiori a 1 indicano campioni problematici, in quanto hanno più proteine aggregate rispetto alle proteine ripiegate. - Se devono essere confrontati più cicli FSEC e la caratteristica più importante è la quantità di monomero in ciascun caso, tracciare le tracce come segnale grezzo registrato dal lettore di piastre (ad esempio, RFU).
NOTA: Se un confronto tra la quantità di monomero rispetto alla proteina non ripiegata è più importante, il segnale deve essere normalizzato a una percentuale del segnale totale utilizzando le letture minima e massima nella traccia, che accentuerà le differenze nel rapporto tra proteine aggregate e monomeriche tra le tracce.
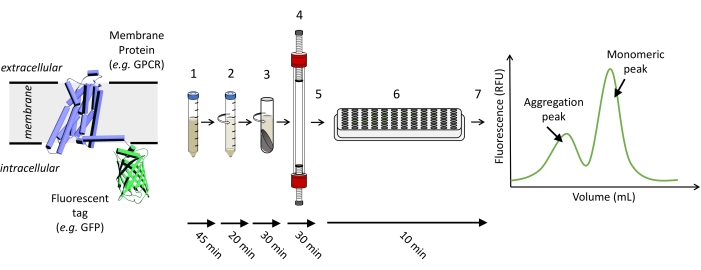
Figura 1: Rappresentazione schematica dei passaggi necessari per eseguire un esperimento FSEC. (1) Le cellule che esprimono la proteina di interesse marcata con fluorescenza vengono solubilizzate. (2) La solubilizzazione grezza viene chiarita prima con uno spin a bassa velocità, seguito da (3) uno spin ad alta velocità. (4) Il surnatante campione chiarificato viene caricato ed eseguito su una colonna SEC appropriata e (5) le frazioni vengono raccolte. (6) I campioni delle frazioni vengono trasferiti su una piastra da 96 pozzetti e viene rilevato un segnale fluorescente GFP utilizzando un lettore di piastre per (7) tracciare la traccia FSEC. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risultati
In primo luogo, sono stati studiati la gamma dinamica e i limiti inferiori di rilevamento eGFP per il lettore di piastre utilizzato in questo studio. Uno standard eGFP purificato di concentrazione nota è stato diluito in un volume finale di 50 μL a 50 ng·μL−1, 25 ng·μL−1, 12,5 ng·μL−1, 6,25 ng·μL−1, 3,125 ng·μL−1, 1,5625 ng·μL−1, 0,78125 ng·μL−1 e 0,390625 ng·μL−1, e la fluorescenza è stata letta utilizzando un'eccitazione di 488 nm e un'emissione di 507 nm (Figura 2 ). Questo esperimento ha indicato che il lettore di piastre aveva un limite di rilevamento inferiore di 30 ng di proteina marcata con eGFP per pozzetto e un intervallo dinamico fino a 500 ng di proteina marcata con eGFP per pozzetto prima della saturazione del segnale. Utilizzando il valore per il limite inferiore e supponendo che l'eluizione proteica sia limitata a 0,33 del volume della colonna, sono necessari solo 1,28 μg di proteina di interesse marcata con eGFP per il carico della colonna SEC affinché venga osservato un segnale FSEC rilevabile.
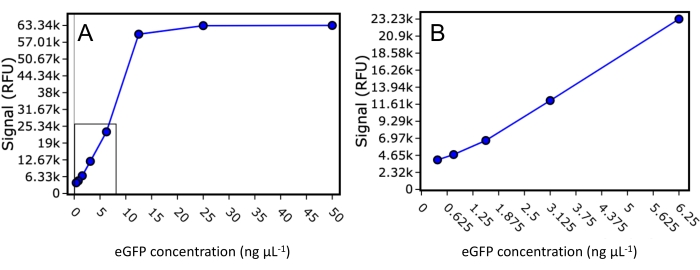
Figura 2: curva standard eGFP. Grafico a dispersione del segnale fluorescente per lo standard eGFP purificato diluito a 50 ng·μL−1, 25 ng·μL−1, 12,5 ng·μL−1, 6,25 ng·μL−1, 3,125 ng·μL−1, 1,5625 ng·μL−1, 0,78125 e 0,390625 ng·μL−1. (A) Vengono visualizzate tutte le diluizioni, comprese quelle con il segnale saturo. (B) Un grafico a dispersione ingrandito che include solo gli standard che rientrano nella gamma dinamica del lettore di piastre. Fare clic qui per visualizzare una versione ingrandita di questa figura.
In secondo luogo, la colonna da 24 mL utilizzata per questo studio è stata calibrata con standard di peso molecolare. Utilizzando le stesse condizioni tampone e di funzionamento utilizzate per l'analisi FSEC, gli standard di peso molecolare destrano blu (>2.000 kDa), ferritina (440 kDa), aldolasi (158 kDa), conalbumina (75 kDa) e ovalbumina (43 kDa) sono stati iniettati singolarmente e fatti passare attraverso la colonna, e le tracce di eluizione sono state raccolte ad assorbimento di 280 nm. I volumi di eluizione registrati sono stati rispettivamente di 8,9 ml, 12,4 ml, 15,2 ml, 16,9 ml e 18 ml. Quando questi volumi di eluizione sono stati convertiti in Kav (equazione 1) e tracciati rispetto ai pesi molecolari logaritmici, una curva standard potrebbe essere adatta. Ciò ha permesso di stimare il peso molecolare dei GPCR testati in questo studio mediante interpolazione della curva standard (Figura 3). Ad esempio, la traccia FSEC del recettore della serotonina GPCR 2A (5HT2AR) dopo la solubilizzazione nel detergente DDM ha indicato un volume di eluizione di 13,4 ml. Questo volume di eluizione 5HT2AR rientra tra i volumi di eluizione registrati per ferritina e aldolasi e fornisce un peso molecolare stimato di circa 300 kDa. Il costrutto 5HT 2A R utilizzato in questo studio è di circa 50 kDa (incluso il tag eGFP), il che significa che se si assume che 5HT2AR sia monomerico,250kDa di peso molecolare potrebbero essere attribuiti alla micella detergente / lipidica DDM. L'equazione per la conversione dei volumi di eluizione è la seguente (equazione 1):
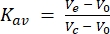 (Equazione 1)
(Equazione 1)
dove V e è il volume di eluizione, V 0 è il volume vuoto della colonna e V c è il volume totale della colonna.
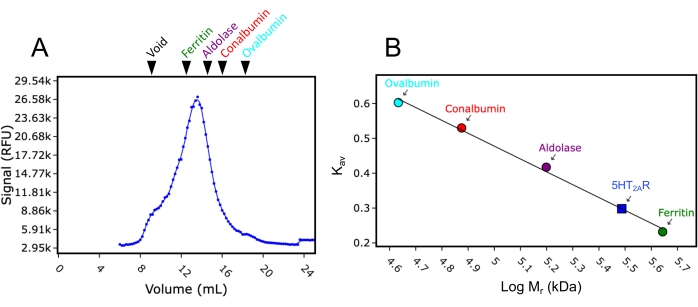
Figura 3: Curva di calibrazione della colonna SEC utilizzando standard di peso molecolare. (A) Una traccia rappresentativa FSEC di 5HT2AR solubilizzata in DDM, con marcate le posizioni di eluizione relative degli standard di peso molecolare destrano blu (Void), ferritina, aldolasi, conalbumina e ovalbumina. Ferritina, aldolasi, conalbumina e ovalbumina sono colorati rispettivamente in verde, viola, rosso e ciano. (B) La curva di calibrazione del peso molecolare utilizzando le posizioni di eluizione delle norme dopo la conversione in Kav (equazione 1) tracciate rispetto al peso molecolare logaritmico (Mr). L'Mr di 5HT2AR in DDM è stato interpolato dalla curva usando Kav e viene visualizzato sulla curva (quadrato blu). Fare clic qui per visualizzare una versione ingrandita di questa figura.
FSEC è stato quindi utilizzato per valutare la qualità e le proprietà del recettore GPCR sfingosina-1-fosfato (S1PR1) 15. Le cellule di insetti che esprimono S1PR 1 umano marcato con GFPsono state elaborate per FSEC come descritto nel protocollo (Figura 1).
In primo luogo, le condizioni ottimali di estrazione a membrana sono state esplorate testando i detergenti DDM e LMNG contro l'estrazione senza detergente con SMA (Figura 4A). L'indice di monodispersità è stato utilizzato per valutare la qualità del campione proteico e il rapporto tra la proteina nel vuoto (~8 mL di ritenzione della colonna) rispetto al campione monodisperso (14-15 mL di ritenzione della colonna). Il campione solubilizzato in LMNG ha mostrato un profilo FSEC superiore con una migliore forma del picco del monomero e un picco aggregato proteico inferiore, indicando che la solubilizzazione e la purificazione in LMNG erano le condizioni più stabilizzanti per questa proteina di membrana. Al contrario, il campione solubilizzato in DDM aveva un profilo FSEC relativamente più scarso, con un picco aggregato più grande e un picco monomerico più ampio, indicando la polidispersità nel campione.
In secondo luogo, l'effetto dell'aggiunta di ligando sul profilo FSEC è stato studiato aggiungendo sfingosina-1-fosfato (S1P) al campione durante la solubilizzazione. In questo caso, DDM è stato utilizzato come reagente di solubilizzazione e sono state confrontate le tracce FSEC di S1PR1 in presenza e assenza di S1P (Figura 4B). Il campione solubilizzato in presenza di S1P ha mostrato una traccia FSEC superiore con aggregazione ridotta. Ciò indicava che la purificazione in presenza di un ligando era vantaggiosa per migliorare la qualità del campione proteico stabilizzando il recettore in soluzione, ma era anche vantaggiosa anche come marker surrogato dell'attività proteica, poiché i risultati suggerivano che la proteina era correttamente piegata e competente per il legame del ligando.
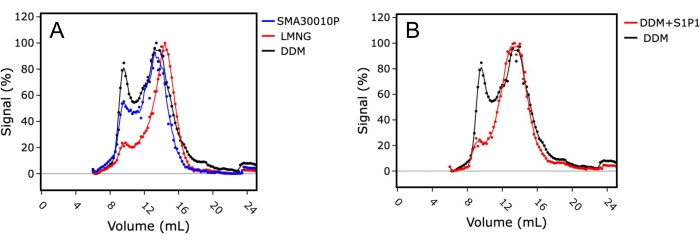
Figura 4: FSEC utilizzando un estratto grezzo di S1PR 1 che indica le condizioni ottimali di estrazione della membrana e il legame del ligando. (A) Confronto delle tracce FSEC di S1PR1 solubilizzato in copolimero di acido stirene-maleico (SMA; blu), lauril maltosio neopentil glicole (LMNG; rosso) o dodecilmaltoside (DDM; nero). (B) Confronto delle tracce FSEC di S1PR 1 solubilizzato in DDM in presenza (rosso) o assenza (nero) dell'agonista sfingosina-1-fosfato (S1P). Fare clic qui per visualizzare una versione ingrandita di questa figura.
FSEC è stato utilizzato anche per studiare la stabilità a lungo termine di 5HT2AR in diverse condizioni. 5HT 2A R umano marcato con GFP è stato solubilizzato da membrane cellulari di insetti in detergente (DDM) o polimeroSMAe analizzato da FSEC in diversi punti temporali dopo la conservazione a 4 °C o a temperatura ambiente (Figura 5). Dopo diversi giorni di incubazione, 5HT2AR nel DDM ha mostrato un calo significativo dell'altezza del picco monomerico a entrambe le temperature e sono stati osservati aumenti significativi del picco aggregato. Al contrario, 5HT2AR nella particella lipidica SMA (SMALP) non ha mostrato un calo significativo dell'altezza del picco monomerico nel corso dell'esperimento, indicando che la proteina in SMALP è rimasta stabile più a lungo, anche a temperature sfavorevoli. Ciò può essere importante quando si considerano preparati proteici per applicazioni biofisiche a valle, come gli esperimenti di risonanza plasmonica di superficie (SPR) per i quali è richiesto che il campione sia stabile e attivo per un lungo periodo di tempo per il completamento positivo degli esperimenti di legame.
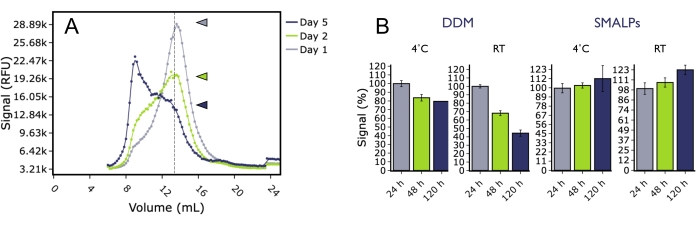
Figura 5: Effetto del tempo e della temperatura sulla qualità di 5HT 2A R estratto dalla membrana utilizzando DDM o SMALP, come analizzato da FSEC. (A) Tracce rappresentative FSEC di 5HT2AR solubilizzato in DDM e conservato a temperatura ambiente per 1 giorno (grigio), 2 giorni (verde) o 5 giorni (blu). (B) Istogrammi dell'altezza del picco monomerico normalizzato per i campioni DDM conservati a 4 °C (blu) o RT (verde) rispetto ai campioni SMALP conservati a 4 °C (grigio) o RT (nero). Le barre di errore sono rappresentative del SEM. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Gli approcci sistematici generici per lo screening delle condizioni con FSEC qui presentati consentono la rapida ottimizzazione dei parametri di solubilizzazione e purificazione per la produzione di proteine di membrana. Ciò significa che proteine di membrana stabili e funzionalmente attive possono essere rapidamente prodotte per studi biofisici e strutturali. Inoltre, FSEC può essere eseguito utilizzando apparecchiature di laboratorio che sono probabilmente già in atto nei laboratori di proteine di membrana e, pertanto, non vi è alcun requisito per l'acquisto di uno strumento specializzato per l'esecuzione dei test.
Passaggi critici
Il tempo impiegato tra il punto di solubilizzazione dalle cellule nel detergente al punto in cui il campione viene passato lungo la colonna SEC (fasi 2.1.5-3.2.5) è critico in termini di tempo e non ci devono essere pause tra queste fasi. Tutte le fasi devono essere eseguite a 4 °C o su ghiaccio e il tempo necessario per eseguire queste fasi deve essere ridotto al minimo possibile. Questi vincoli di tempo e temperatura sono necessari per registrare il profilo FSEC per la proteina di membrana prima di qualsiasi potenziale dispiegamento o degradazione. Dopo che la proteina di membrana è stata solubilizzata, c'è un rischio maggiore di sviluppo, aggregazione e degradazione, anche a 4 °C. Idealmente, tutti i campioni per i quali le tracce FSEC devono essere confrontate dovrebbero passare la colonna SEC nello stesso periodo di tempo dopo la fase di solubilizzazione. In pratica, questo è difficile, in particolare se i campioni vengono passati sequenzialmente lungo una singola colonna, ma è possibile raccogliere fino a cinque tracce SEC entro 3 ore l'una dall'altra, e in questo lasso di tempo, non dovrebbe esserci un degrado significativo.
Risoluzione dei problemi
Se, eseguendo l'esperimento FSEC, c'è un segnale fluorescente basso o assente, è possibile che la proteina di membrana di interesse non abbia espresso la linea cellulare scelta, abbia un'espressione molto bassa della linea cellulare scelta o non sia stata solubilizzata nel detergente scelto. Se i campioni sono stati diluiti prima di raccogliere il segnale di fluorescenza e registrare la traccia FSEC, un semplice primo passo sarebbe quello di provare una diluizione inferiore o nessuna diluizione delle frazioni SEC. Se questo ancora non produce una traccia FSEC interpretabile, l'espressione e la solubilizzazione della proteina devono essere controllate.
L'analisi dell'espressione proteica può essere ottenuta controllando la fluorescenza del campione dopo la fase 2.2.2. Se c'è un segnale fluorescente molto basso o assente da questo campione (ad esempio, un segnale molto vicino allo sfondo), c'è probabilmente un problema con l'espressione proteica. Possono essere prese misure per migliorare i livelli di espressione della proteina di membrana, come il passaggio a una linea cellulare alternativa o la regolazione delle condizioni di crescita, l'induzione dell'espressione e il tempo tra l'induzione / infezione / trasfezione e il raccolto. Tuttavia, un'espressione proteica particolarmente scarsa può indicare una proteina di membrana instabile e, quindi, una scelta di costrutto scadente.
Se l'espressione è stata controllata e vi è un chiaro segnale fluorescente sopra lo sfondo prima di FSEC, l'efficienza di solubilizzazione può essere verificata misurando il segnale fluorescente rimanente del campione dopo la fase 2.4.3 (proteina solubile di membrana) rispetto al campione dopo la fase 2.2.2 (proteina totale). È comune che l'efficienza di solubilizzazione sia del 20% -30% e consenta comunque l'analisi e la purificazione di successo della proteina di membrana. Tuttavia, se l'efficienza di solubilizzazione è inferiore al 20%, può essere necessario un detergente diverso per la solubilizzazione o condizioni di solubilizzazione diverse. Se i tentativi di migliorare la solubilizzazione non hanno successo, questo può indicare una proteina di membrana particolarmente instabile e, quindi, una cattiva scelta di costrutto.
Se si osserva un picco di eluizione molto tardiva nella traccia FSEC (ad esempio, 18-24 ml), ciò indica che la proteina fluorescente ha un peso molecolare della proteina molto inferiore al previsto. Ciò può essere causato dalla degradazione della proteina di membrana di interesse, con conseguente GFP "libera". Si dovrebbe verificare se la proteina è intatta prima e dopo la solubilizzazione utilizzando la fluorescenza GFP in gel. Se la proteina di interesse sembra degradarsi o essere proteolizzata, la quantità di inibitore della proteasi può essere aumentata da due a quattro volte. Tuttavia, un'elevata sensibilità alle proteasi o alle proteine degradate anche prima della solubilizzazione può indicare una proteina particolarmente instabile e, quindi, una scelta di costrutto scadente.
Modifiche e ulteriori applicazioni di FSEC
Comunemente, il tag fluorescente utilizzato in FSEC è GFP o eGFP, come descritto in questo protocollo. Tuttavia, sono disponibili molti diversi tag proteici fluorescenti. La scelta del tag fluorescente da utilizzare dipende dall'avere un lettore di piastre in grado di raggiungere i corretti parametri di eccitazione ed emissione per registrare il segnale fluorescente per il tag fluorescente selezionato e avere un fluoroforo con poca o nessuna variazione nella resa quantica in diverse condizioni ambientali. Inoltre, FSEC non è limitato alle proteine fluorescenti, ma può anche funzionare altrettanto bene con una proteina che è stata etichettata con un colorante fluorescente. Ad esempio, potrebbe essere utilizzato un colorante NTA, che si legherebbe favorevolmente ai costrutti proteici di membrana marcati con istidina. Inoltre, un anticorpo marcato chimicamente con un colorante fluorescente e specifico per legare la proteina di membrana di interesse o un tag di purificazione incluso nel costrutto proteico di membrana potrebbe etichettare indirettamente un bersaglio per FSEC.
Quando si esegue lo screening dei detergenti utilizzando FSEC, è possibile scegliere se il tampone utilizzato per eseguire la colonna SEC debba contenere il detergente corrispondente in cui la proteina è stata solubilizzata o se utilizzare un detergente standard in tutte le rotture. Una rappresentazione più accurata del comportamento della proteina sarà ottenuta se l'intero esperimento viene eseguito con il detergente corrispondente in tutto. Tuttavia, può richiedere molto tempo e sprecare il detersivo se la colonna deve essere riequilibrata in un nuovo detergente prima di ogni corsa. Inoltre, poiché lo scopo principale dello screening dei detergenti è quello di confrontare le tracce, le tendenze rimarranno nelle tracce anche se le condizioni non sono ideali. Pertanto, è possibile raggiungere un compromesso in base al quale la proteina viene solubilizzata nel detergente di interesse, ma la colonna viene eseguita in un tampone standard con un singolo detergente in tutte le serie (ad esempio, DDM)11, il che può far risparmiare tempo e materiali di consumo detergenti.
Modificando l'apparecchiatura FLPC utilizzata, il throughput del protocollo FSEC può essere notevolmente aumentato e il requisito del campione può essere ridotto al minimo. Ad esempio, un sistema FPLC o HPLC potrebbe essere dotato di un autocampionatore, una colonna analitica del volume del letto più piccola (come una colonna SEC analitica da 3,2 ml) e un rilevatore fluorescente in linea per il monitoraggio continuo di tracce FSEC direttamente dalla colonna. La configurazione risultante consentirebbe di eseguire più esecuzioni di FSEC in un periodo di tempo più breve e di rimuovere la fase di plottaggio manuale, consentendo così di testare un numero maggiore di condizioni in un lasso di tempo più breve. Inoltre, il requisito di campionamento sarebbe ulteriormente ridotto, in quanto un numero inferiore di campioni dovrebbe essere preparato e caricato sulla colonna FSEC per ogni esecuzione. Ciò aprirebbe la possibilità di ridurre le colture di espressione a un formato basato su lastre, in quanto sarebbe necessario poco materiale per l'analisi.
Punti di forza e di debolezza del FSEC rispetto ad altri metodi
Uno svantaggio di FSEC è che i costrutti proteici di membrana devono essere progettati per introdurre l'etichetta fluorescente e, al momento dell'introduzione, c'è una piccola possibilità che il posizionamento dell'etichetta possa interferire con la funzione o il ripiegamento della proteina di membrana di interesse. Inoltre, il protocollo FSEC, come descritto qui, monitora le caratteristiche di una proteina di membrana in presenza di lisato cellulare, che è una miscela grezza di proteine. Il comportamento di una proteina di membrana in questo ambiente può essere diverso rispetto a quando la proteina di membrana di interesse è sottoposta a una colonna SEC preparativa alla fine della purificazione quando completamente isolata da altre proteine. Inoltre, FSEC fornisce una misura in qualche modo qualitativa della qualità delle proteine. Tuttavia, convertendo la traccia FSEC in un indice di monodispersità, come descritto nella fase 4.3.3 del protocollo, è possibile ottenere una misura quantitativa della qualità delle proteine.
FSEC non è l'unico metodo che può essere utilizzato nell'analisi precoce dei costrutti proteici di membrana, delle condizioni di solubilizzazione e della composizione del tampone di purificazione. Gli approcci alternativi presentano sia vantaggi che svantaggi rispetto a FSEC. Ad esempio, esistono saggi di termostabilità basati sul fluoroforo, in particolare l'uso del colorante 7-dietilammino-3-(4′-maleimidilfenil)-4-metilcumarina (CPM)16,17. Il vantaggio di questo metodo è che, a differenza di FSEC, che fornisce una misura qualitativa della qualità delle proteine, i saggi di termostabilità forniscono una misura quantitativa sotto forma di temperatura di fusione relativa. Inoltre, non vi è alcun obbligo di introdurre un tag fluorescente sul costrutto proteico. Tuttavia, gli svantaggi dei saggi di termostabilità rispetto a FSEC sono che devono essere utilizzate proteine purificate e che il test non è compatibile con tutti i costrutti proteici, in quanto si basa sulle posizioni vantaggiose dei residui nativi di cisteina nella proteina ripiegata.
Un altro metodo che ha somiglianze sia con i saggi di termostabilità FSEC che con quelli basati su fluorofori è un test che misura la sensibilità alla temperatura di una proteina di membrana. In questo test, la proteina viene sfidata con temperature diverse e viene rilevata la proteina che rimane in soluzione dopo la centrifugazione. Il rilevamento in questo metodo è stato condotto in diversi modi, tra cui la misurazione della fluorescenza nella soluzione18, la fluorescenza di una banda di gel SDS-PAGE19 o l'intensità del segnale in un western blot20. Tuttavia, uno svantaggio significativo di questi approcci è che il test è molto laborioso e soggetto a rumore elevato nei risultati, poiché ogni singolo punto di temperatura deve essere raccolto in modo indipendente.
Infine, diverse tecniche biofisiche più avanzate possono essere utilizzate per valutare la qualità delle proteine di membrana in modo simile a FSEC, ad esempio l'analisi della dispersione indotta dal flusso21, la termoforesi su microscala22 o SPR. Sebbene siano approcci molto potenti, lo svantaggio di questi metodi è la necessità di strumenti altamente specializzati per eseguire le analisi.
In conclusione, FSEC fornisce uno strumento inestimabile da utilizzare nelle campagne di produzione di proteine di membrana e, sebbene non sia l'unica opzione, presenta diversi vantaggi distinti rispetto ad altri metodi, come sopra elencati. La convalida incrociata dei risultati mediante saggi ortogonali è sempre raccomandata e nessuno dei metodi discussi sopra si esclude a vicenda.
Divulgazioni
Peak Proteins è un'organizzazione di ricerca a contratto che fornisce espressione proteica, purificazione, spettrometria di massa e determinazione strutturale a pagamento.
Riconoscimenti
Vorremmo riconoscere l'aiuto e il supporto di tutto il team di Peak Proteins. Dal team di scienze cellulari, vorremmo ringraziare Ian Hampton per le sue preziose intuizioni e indicazioni nell'espressione delle cellule degli insetti. Vorremmo ringraziare Mark Abbott per aver fornito le risorse e l'opportunità di perseguire questo progetto.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL and 5 mL plastic syringes | Generic | - | Syringes for transfer of samples |
| 10x EDTA Free Protease inhibitor cocktail | Abcam | ab201111 | Protease inhibitors |
| 15 mL tubes | Generic | - | 15 mL tubes for pellet preparation and solubilisation |
| 2 mL ultra-centrifuge tubes | Beckman Coulter | 344625 | Tubes for ultra-centrifuge rotor |
| 50 mL tubes | Generic | - | 50 mL tubes for cell harvest |
| 96 deep-well blocks | Greiner | 15922302 | For collecting 0.2 mL SEC fractions |
| ÄKTA V9-L loop valve | Cytiva | 29011358 | 5 posiiton loop valve for the ÄKTA FPLC system |
| ÄKTA F9-C fraction collector | Cytiva | 29027743 | 6 position plate fraction collector for the ÄKTA FPLC system |
| ÄKTA pure 25 L | Cytiva | 29018224 | FPLC system for running the experiment |
| Benchtop centrifuge (e.g. Fisherbrand GT4 3L) | Fisher Scientific | 15828722 | Centrifuge for low-speed spin |
| Blunt end filling needles | Generic | - | For transfer of samples |
| Bottle top vacuum filter | Corning | 10005490 | Bottle top vacuum filter for filtering SEC buffers |
| Cholesteryl hemisuccinate (CHS) | Generon | CH210-5GM | Additive for detergent solubilisation |
| Disposable multichannel reseviour | Generic | - | Resevior for addition of water or buffer to 96-well micro-plate |
| Dodecyl maltoside (DDM) | Glycon | D97002-C-25g | Detergent for solubilisation |
| eGFP protein standards | BioVision | K815-100 | eGFP standards for fluorescent calibration curve |
| Glycerol | Thermo Scientific | 11443297 | Glycerol for buffer preparation |
| HEPES | Thermo Scientific | 10411451 | HEPES for buffer preparation |
| High molecular weight SEC calibration standards kit | Cytiva | 28403842 | Molecular weight calibration kit for SEC |
| Lauryl maltose neopentylglycol (LMNG) | Generon | NB-19-0055-5G | Detergent for solubilisation |
| Low molecular weight SEC calibration standards kit | Cytiva | 28403841 | Molecular weight calibration kit for SEC |
| MLA-130 ultra-centrifuge rotor | Beckman Coulter | 367114 | Rotor for ultracentrifuge that fits 2 mL capacity tubes |
| Opaque 96-well flat-bottom micro-plate | Corning | 10656853 | 96-well for reading fluorescent signal in plate reader |
| Optima MAX-XP ultra-centrifuge | Beckman Coulter | 393315 | Centrifuge for high-speed spin |
| pH meter | Generic | - | For adjusting the pH of buffers during preparation |
| Prism | GraphPad | - | Graphing software for plotting traces |
| Rotary mixer | Fisher Scientific | 12027144 | Mixer for end over end mixing in the cold |
| Sodium chloride | Fisher Scientific | 10316943 | Sodium chloride for buffer preparation |
| Sodium hydroxide | Fisher Scientific | 10488790 | Sodium hydroxide for buffer preparation |
| Spectramax ID3 Plate Reader | Molecular Devices | 735-0391 | Micro-plate reader capable of reading fluorescence |
| Stirrer plate | Generic | - | For stirring buffers during preparation |
| Styrene maleic acid (SMA) | Orbiscope | SMALP 300 | Polymer for detergent free extraction |
| Superdex 200 Increase 10/300 GL | Cytiva | 28990944 | SEC column for running the experiment. The bed volume of this column is 24 mL. The recommended flow rate for this column in 0.9 ml/min (in water at 4 °C). The maximum pressure limit for this column is 5 MPa. |
| Vacuum pump | Sartorius | 16694-2-50-06 | For filtering and degassing buffers |
Riferimenti
- Burgess, R. R. A brief practical review of size exclusion chromatography: Rules of thumb, limitations, and troubleshooting. Protein Expression and Purification. 150, 81-85 (2018).
- Erickson, H. P. Size and shape of protein molecules at the nanometer level determined by sedimentation, gel filtration, and electron microscopy. Biological Procedures Online. 11 (1), 32-51 (2009).
- Lathe, G. H., Ruthven, C. R. J. The separation of substances and estimation of their relative molecular sizes by the use of columns of starch in water. Biochemical Journal. 62 (4), 665-674 (1956).
- Lathe, G. H., Ruthven, C. R. The separation of substances on the basis of their molecular weights, using columns of starch and water. Biochemical Journal. 60 (4), (1955).
- Polson, A. Fractionation of protein mixtures on columns of granulated agar. Biochimica et Biophysica Acta. 50 (3), 565-567 (1961).
- Hjertén, S., Mosbach, R. 34;Molecular-sieve" chromatography of proteins on columns of cross-linked polyacrylamide. Analytical Biochemistry. 3 (2), 109-118 (1962).
- Porath, J., Flodin, P. Gel filtration: A method for desalting and group separation. Nature. 183 (4676), 1657-1659 (1959).
- Kawate, T., Gouaux, E. Fluorescence-detection size-exclusion chromatography for precrystallization screening of integral membrane proteins. Structure. 14 (4), 673-681 (2006).
- Hattori, M., Hibbs, R. E., Gouaux, E. A Fluorescence-detection size-exclusion chromatography-based thermostability assay for membrane protein precrystallization screening. Structure. 20 (8), 1293-1299 (2012).
- Shimomura, O., Johnson, F. H., Saiga, Y. Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. Journal of Cellular and Comparative Physiology. 59 (3), 223-239 (1962).
- Drew, D., et al. GFP-based optimization scheme for the overexpression and purification of eukaryotic membrane proteins in Saccharomyces cerevisiae. Nature Protocols. 3 (5), 784-798 (2008).
- Newstead, S., Kim, H., von Heijne, G., Iwata, S., Drew, D. High-throughput fluorescent-based optimization of eukaryotic membrane protein overexpression and purification in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences of the United States of America. 104 (35), 13936-13941 (2007).
- Vaidehi, N., Grisshammer, R., Tate, C. G. How can mutations thermostabilize G-protein-coupled receptors. Trends in Pharmacological Sciences. 37 (1), 37-46 (2016).
- Hardy, D., Bill, R. M., Jawhari, A., Rothnie, A. J. Overcoming bottlenecks in the membrane protein structural biology pipeline. Biochemical Society Transactions. 44 (3), 838-844 (2016).
- Hanson, M. A., et al. Crystal structure of a lipid G protein-coupled receptor. Science. 335 (6070), 851-855 (2012).
- Alexandrov, A. I., Mileni, M., Chien, E. Y. T., Hanson, M. A., Stevens, R. C. Microscale fluorescent thermal stability assay for membrane proteins. Structure. 16 (3), 351-359 (2008).
- Harborne, S. P. D., King, M. S., Kunji, E. R. S. Thermostability assays: A generic and versatile tool for studying the functional and structural properties of membrane proteins in detergents. Biophysical Journal. 118 (4), 105-121 (2020).
- Nji, E., Chatzikyriakidou, Y., Landreh, M., Drew, D. An engineered thermal-shift screen reveals specific lipid preferences of eukaryotic and prokaryotic membrane proteins. Nature Communications. 9 (1), 4253 (2018).
- Harborne, S. P. D., et al. IMPROvER: The Integral Membrane Protein Stability Selector. Scientific Reports. 10 (1), 15165 (2020).
- Ashok, Y., Nanekar, R., Jaakola, V. -. P. Defining thermostability of membrane proteins by western blotting. Protein Engineering Design and Selection. 28 (12), 539-542 (2015).
- Pedersen, M. E., Østergaard, J., Jensen, H. Flow-induced dispersion analysis (FIDA) for protein quantification and characterization. Methods Mol Biol. 1972, 109-123 (2019).
- Wienken, C. J., Baaske, P., Rothbauer, U., Braun, D., Duhr, S. Protein-binding assays in biological liquids using microscale thermophoresis. Nature Communications. 1 (1), 100 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon