Method Article
형광 크기 배제 크로마토그래피를 통한 멤브레인 단백질 품질의 신속한 평가
요약
본 프로토콜은 다운스트림 기능 및 구조 분석을 위한 품질을 평가하기 위해 막 단백질에 대해 형광 크기 배제 크로마토그래피(FSEC)를 수행하는 절차를 설명합니다. 세제 가용화 및 세제가 없는 조건에서 여러 G-단백질 결합 수용체(GPCR)에 대해 수집된 대표적인 FSEC 결과가 제시됩니다.
초록
막 단백질 구조 규명 및 생물물리학적 특성 분석 중에 다양한 태그, 절단, 결실, 융합 파트너 삽입 및 안정화 돌연변이를 포함하는 수많은 단백질 구조를 시험하여 막에서 추출한 후 응집되지 않는 것을 찾는 것이 일반적입니다. 또한, 막 단백질에 대해 가장 안정화 조건을 제공하는 세제, 첨가제, 리간드 또는 중합체를 결정하기 위한 완충액 스크리닝은 중요한 관행이다. 형광 크기 배제 크로마토그래피를 통한 막 단백질 품질의 조기 특성 분석은 단백질 정제 없이 다양한 구조 또는 조건을 평가하고 순위를 매길 수 있는 강력한 도구를 제공하며, 이 도구는 샘플 요구 사항도 최소화합니다. 막 단백질은 일반적으로 GFP 태그 또는 이와 유사한 것으로 발현하여 형광 태그를 지정해야 합니다. 단백질은 전체 세포에서 직접 가용화한 다음 원심분리에 의해 조잡하게 정화될 수 있습니다. 그 후, 단백질은 크기 배제 컬럼으로 전달되고 형광 트레이스가 수집됩니다. 여기서는 스핑고신-1 인산 수용체(S1PR1)와 세로토닌 수용체(5HT2AR)를 표적으로 하는 GPCR에 대한 FSEC 및 대표적인 FSEC 데이터를 실행하는 방법을 제시한다.
서문
겔 여과 크로마토그래피라고도 하는 크기 배제 크로마토그래피(SEC)는 단백질 과학 분야에서 일반적으로 사용됩니다1. SEC 동안, 단백질은 단백질 크기와 모양의 함수인 유체역학적 반경에 기초하여 분리된다2. 간단히 말해서, 이 분리는 분자체 역할을 하는 다공성 비드의 패킹된 베드에 유동 중인 단백질 샘플을 적용함으로써 달성됩니다. 사용되는 비드는 종종 단백질이 비드의 공극 3,4,5,6,7의 공극에 들어가거나 배제될 수 있도록 하기 위해 정의된 범위의 공극 크기를 갖는 가교결합된 아가로오스이다. 유체역학적 반경이 더 작은 단백질은 기공 내에서 더 많은 시간을 소비하므로 더 느린 속도로 충전층을 통과하는 반면, 더 큰 단백질은 비드 외부(제외된 부피) 외부에서 더 많은 시간을 보내고 더 빠른 속도로 충전층을 통과합니다. SEC는 분취 컬럼이 사용될 때 단백질 정제 단계로서 사용될 수 있다1. 분석 컬럼을 사용하는 경우, SEC는 단백질 품질 및 특성을 분석하는데 사용될 수 있다2. 예를 들어, 샘플에 존재할 수 있고 품질이 좋지 않은 단백질을 나타내는 단백질 응집체는 매우 큰 경향이 있으며, 이는 제외된 부피로만 이동하므로 가장 빠른 시점에 컬럼에서 용리됩니다. 이 볼륨을 Column Void 또는 Void 볼륨이라고 합니다. 또한 분자량 표준물질을 사용하여 컬럼을 보정할 수 있으므로 관심 단백질의 추정 분자량을 표준 곡선에서 보간할 수 있습니다.
전형적으로, 280 nm에서의 단백질 흡광도는 크기 배제 컬럼으로부터 단백질 용출을 모니터링하기 위해 사용된다. 이는 예를 들어 단백질 정제의 마지막 단계에서 관심 단백질이 오염된 단백질로부터 거의 제거될 때까지 SEC를 분석 도구로 사용하는 것을 제한합니다. 그러나 형광 SEC(FSEC)는 형광 표지된 관심 단백질을 사용합니다. 그러므로, 형광 신호는 다른 단백질 또는 심지어 미정제 혼합물의 존재 하에서 관심있는 단백질의 용출을 특이적으로 모니터링하기 위해 사용될 수 있다 8,9. 또한 형광 신호는 매우 민감하기 때문에 단백질 양이 매우 적은 시료에서 성공적인 분석을 수행할 수 있습니다. 관심있는 단백질은 종종 발현 작제물에 녹색 형광 단백질 (GFP) 또는 강화 GFP (eGFP) 태그를 포함시킴으로써 형광 표지된다. 이어서, 형광 신호는 395 nm 또는 488 nm에서의 여기(excitation)에 의해 모니터링될 수 있고, GFP 또는 eGFP에 대해 각각 509 nm 또는 507 nm에서의 형광 방출을 검출함으로써 모니터링될 수 있다(10).
형광 신호를 사용하여 SEC 컬럼에서 단백질 용출을 모니터링함으로써 얻을 수 있는 이점 덕분에 FSEC는 수용성 단백질에 비해 발현 수준이 특히 낮을 때 막 단백질 시료를 분석하는 데 유용한 도구입니다. 결정적으로, 막 단백질의 품질과 특성은 먼저 정제 공정을 최적화할 필요 없이 원유 용해물에서 가용화한 직후에 분석할 수 있습니다11,12. 이러한 이유로 FSEC는 용액 내 막 단백질의 거동을 개선하는 데 필요할 수 있는 다양한 요인을 탐색하면서 막 단백질 품질을 신속하게 분석하는 데 사용할 수 있습니다. 예를 들어, 상이한 태그, 절단, 결실, 융합 파트너 삽입 및 안정화 돌연변이를 함유하는 수많은 구축물을 시험하여 멤브레인으로부터 추출한 후 응집되지 않은 것을 찾는 것이 일반적이다13,14. 또한, 막 단백질에 가장 안정화 조건을 제공하는 세제, 첨가제, 리간드 또는 중합체를 결정하기 위한 완충액 스크리닝은 단백질 정제를 위한 최상의 완충액 조성물을 정의하거나 생물물리학적 분석 또는 구조적 특성화와 같은 다운스트림 용도를 위한 안정성을 제공할 수 있다.
따라서 FSEC 분석법의 전반적인 목표는 관심 대상 막 단백질에 대한 SEC 컬럼 용출 프로파일을 수집하는 것입니다. 또한, 형광이 사용됨에 따라, 이 SEC 트레이스는 긴 정제 전에 구조 및 조건의 최적화에서 가능한 한 빠른 시점에 수집됩니다. FSEC trace는 다양한 완충액 조건 또는 막 단백질 구성물을 사용하여 막 단백질을 정제하는 데 성공할 가능성을 판단하기 위한 비교 도구로 사용할 수 있습니다. 이러한 방식으로 FSEC 프로파일 수집은 다른 분석 방법에 필요한 양의 순수 단백질을 생성하는 데 노력을 기울이기 전에 최적의 구조 설계 및 버퍼 조성에 도달하기 위한 빠른 반복 프로세스로 사용될 수 있습니다.
프로토콜
1. FSEC용 세제 및 완충제 준비
- 세제 원액을 준비하십시오.
- 20mL 원액을 준비하기 위해 도데실 말토사이드(DDM) 분말 4g과 콜레스테릴 헤미숙시네이트(CHS) 분말 0.4g을 칭량하여 실험실 등급 증류H2O로 20mL로 만듭니다.
- 모든 성분을 첨가한 후, 성분이 완전히 용해될 때까지 4°C에서 종단 반전으로 혼합합니다. 4 °C에서 하룻밤 동안 혼합하는 것이 좋습니다.
- 사용할 때까지 세제 스톡을 -20°C에서 분취하여 보관하십시오. 육수를 즉시 사용해야 하는 경우 세제를 얼음에 보관하십시오.
알림: 이 작업에 사용된 표준 세제 스톡은 20%(w/v) DDM 및 2%(w/v) CHS 혼합물이었습니다( 재료 표 참조). 상이한 세제(예를 들어, 라우릴 말토스 네오펜틸 글리콜; LMNG) 또는 스티렌-말레산(SMA)과 같은 폴리머를 사용한 세제 없는 추출의 사용을 테스트할 수 있습니다. 이것은 테스트할 실험 조건을 설계할 때 결정되어야 합니다.
- 가용화 완충액을 준비한다.
- 비커에서 100mM HEPES, 200mM NaCl, 20%(v/v) 글리세롤 및 1x 프로테아제 억제제 칵테일( 재료 표 참조)의 최종 농도를 달성하기 위해 성분의 정확한 중량 또는 부피를 조합하여 가용화 완충액을 준비합니다.
참고: 본 연구에서, 50 mL의 가용화 완충액의 제조는 5개의 샘플을 처리하기에 충분하였다. - 0.7 부피 (예를 들어, 50 mL의 완충액을 만드는 경우 35 mL)의 실험실 등급 증류된H2O를 비커에 첨가한다.
- 마그네틱 교반기 상에서 혼합하고, pH 미터를 이용하여, 농축 NaOH를 적가하여 완충액 pH를 7.5로 조정한다.
- 측정 실린더를 사용하여 실험실 등급의 증류된H2O로 완충액을 최종적으로 필요한 부피까지 보충합니다.
- 비커에서 100mM HEPES, 200mM NaCl, 20%(v/v) 글리세롤 및 1x 프로테아제 억제제 칵테일( 재료 표 참조)의 최종 농도를 달성하기 위해 성분의 정확한 중량 또는 부피를 조합하여 가용화 완충액을 준비합니다.
- SEC 실행 버퍼를 준비합니다.
- 비커에서 100mM HEPES, 150mM NaCl 및 10%(v/v) 글리세롤의 최종 농도를 달성하기 위해 구성 요소의 정확한 중량 또는 부피를 결합하여 SEC 실행 버퍼를 준비합니다.
참고: 본 연구에서는 600mL의 SEC 버퍼를 준비하는 것만으로도 5개의 샘플을 실행하기에 충분했습니다. - 0.7 부피(예를 들어, 600 mL의 완충액을 만드는 경우 420 mL)의 실험실 등급 증류된H2O를 비커에 첨가한다.
- 마그네틱 교반기 상에서 혼합하고, pH 미터를 이용하여, 농축 NaOH를 적가하여 완충액 pH를 7.5로 조정한다.
- 측정 실린더를 사용하여 실험실 등급의 증류된H2O로 완충액을 최종적으로 필요한 부피까지 보충합니다.
- 진공 상태에서 병 상단 0.45μm 공극 필터를 통해 SEC 버퍼를 필터링합니다( 재료 표 참조).
- 버퍼가 필터를 통과하면 흔들 때 더 이상 기포가 나타나지 않을 때까지 진공 상태로 두어 가스를 제거합니다.
- 0.03단계에서 준비한 세제 스톡의 필요한 부피를 추가하여 0.003%(w/v) DDM 및 0.003%(w/v) CHS의 최종 농도를 SEC 버퍼에 추가합니다(예: 0.9mL의 SEC 버퍼를 만드는 경우 600mL).
- 사용하기 전에 버퍼를 미리 식히십시오.
참고: 테스트한 조건에 따라 다른 버퍼를 사용할 수 있습니다. 예를 들어, 관심 단백질에 대한 다른 세제의 효과를 테스트하는 경우 단백질을 가용화하는 데 사용되는 것과 동일한 세제를 사용하는 완충액을 만드는 것이 이상적입니다. SMA로 세제가 없는 상태를 테스트하는 경우 SEC 버퍼에서 세제를 완전히 생략해야 합니다. 그러나 세제 스크리닝을 위한 프로토콜 수정에 대한 자세한 내용은 토론 섹션을 참조하십시오.
- 비커에서 100mM HEPES, 150mM NaCl 및 10%(v/v) 글리세롤의 최종 농도를 달성하기 위해 구성 요소의 정확한 중량 또는 부피를 결합하여 SEC 실행 버퍼를 준비합니다.
2. FSEC를 위한 시료 전처리
- 세포 펠릿을 준비합니다.
참고: 분석의 시작점은 관심 있는 GFP 태그(또는 기타 형광 표지) 단백질의 현탁액 세포 발현 배양물에서 세포 펠릿을 수확하는 것입니다. 수확을 위한 정확한 시기와 조건은 발현되는 단백질, 사용되는 세포주, 성장한 세포의 조건 및 단백질 발현이 유도된 방법에 따라 달라집니다. 이러한 세부 정보는 이 프로토콜의 범위를 벗어납니다. 이 연구에서는 P2 바큘로바이러스의 1:20 희석액의 약 4 x 106 생존 세포/mL로 감염 2-3일 후 25-50mL의 배양물에 해당하는 테스트 조건당 21-20g의 Sf20 세포 펠릿을 사용했습니다. 여기에 설명된 프로토콜은 테스트를 거쳐 다른 진핵 세포주(예: HEK293E)의 유사한 습식 중량의 세포 펠릿에서도 동일하게 잘 작동하는 것으로 밝혀졌습니다.- 현탁 배양액의 세포를 수확할 준비가 되면 25-50mL 배양 분취액을 50mL 원뿔형 튜브로 옮깁니다.
- 튜브의 균형을 맞추고 실온에서 15분 동안 2,000 x g의 스윙 아웃 버킷(재료 표 참조)에 탁상용 원심분리기를 사용하여 세포를 펠릿화합니다.
- 배양 상층액을 부드럽게 기울여 제거하고 버리거나, 세포 펠릿이 특히 느슨한 경우 피펫 필러와 함께 50mL 피펫을 사용합니다.
- 세포를 분석에 즉시 사용할 경우 세포 펠릿을 얼음 위에 놓고 5단계로 바로 진행합니다. 세포가 나중 단계에서 사용하기 위해 저장되어야 하는 경우, 세포를 -80°C에 두어 동결시킨다.
- 세포 펠릿이 -80°C에서 보관된 경우 실온에서 15분 동안 또는 샘플이 더 이상 얼지 않을 때까지 배양하여 빠르게 해동합니다. 이 단계에 따라 샘플을 즉시 얼음으로 옮깁니다.
- 샘플을 재현탁하고 가용화합니다.
- 2mL의 가용화 완충액(단계 1.2)을 세포 펠릿에 추가합니다.
- 균질해질 때까지 4°C에서 15-30분 동안 end-over-end 반전으로 배양합니다.
- 최종 농도가 1% DDM/0.1% CHS가 되도록 미리 혼합된 세제 스톡(1.1단계)(예: 100% DDM/2% CHS 스톡의 2μL)을 추가합니다.
- 4°C에서 종단 반전으로 30분 동안 가용화합니다.
알림: 원하는 경우 여러 조건을 병렬로 테스트할 수 있습니다. 한 번에 처리할 수 있는 병렬 샘플의 수는 SEC 실험을 실행하는 데 사용할 수 있는 시스템에 따라 다릅니다. 여기에 설명된 설정에서는 한 번에 최대 5개의 샘플을 처리할 수 있었습니다.
- 저속 원심분리 단계를 수행합니다.
- 샘플을 2,000 x g 의 스윙 아웃 버킷에서 사전 냉각된(4°C) 탁상형 원심분리기에서 15분 동안 원심분리합니다.
- 고속 원심분리 단계를 수행합니다.
- 5mL 주사기에 부착된 무딘 끝 바늘을 사용하여 저속 원심분리에서 초원심분리 튜브(예: 0.5-2mL 튜브)로 상층액을 조심스럽게 옮기고 저속 스핀에서 펠릿을 방해하지 않도록 주의합니다.
- 튜브 쌍의 균형을 0.05g 이내로 맞추고 고정각 초원심분리 로터에 넣습니다( 재료 표 참조).
- 250,000 x g에서 30분 동안 4°C에서 원심분리합니다.
3. 크기 배제 크로마토그래피(SEC)
- 고속 단백질 액체 크로마토그래피(FPLC) 시스템을 준비하고 컬럼을 평형화합니다.
- 예를 들어 제조업체의 지침에 따라 시스템을 준비합니다( 재료 표 참조). 예를 들어ample, 시스템에 SEC 버퍼를 채우고 펌프 공기를 제거합니다.
- SEC 컬럼을 FPLC에 연결하여 컬럼에 공기가 들어가지 않도록 합니다. 이는 FPLC 시스템의 유동 경로와 드롭 투 드롭 연결을 수행하기 위해 물로 채워진 주사기(컬럼 하단에 부착됨)로 SEC 컬럼에 배압을 가함으로써 달성됩니다.
- 실험실 등급의 증류 및 여과된H2O의 1.5 컬럼 부피(24mL 컬럼의 경우 36mL)에서 먼저 세척한 다음, 컬럼에 대한 권장 유속 및 압력으로 1.5 컬럼 부피의 SEC 버퍼로 세척하여 SEC 컬럼을 사전 평형화합니다( 재료 표 참조).
참고: FSEC를 수행하기 위해 이 연구에 사용된 FPLC 시스템은 추운 환경에 있었고 5위치 루프 밸브와 6위치 플레이트 분획 수집기가 장착되어 있었습니다. 이 설정을 사용하면 5개의 샘플을 로드하고 실행 사이에 수동 개입 없이 자동화된 방식으로 동일한 컬럼 아래로 순차적으로 실행할 수 있습니다. SEC 실험을 실행하기 위해 상업적으로 이용 가능한 사전 충전된 24mL 컬럼을 사용했으며( 재료 표 참조), 여기에는 10-600kDa의 분자량 범위의 단백질을 분해할 수 있는 수지가 포함되어 있습니다. 관심 단백질이 특히 큰 경우 대체 컬럼 매트릭스를 대신 사용하여 분자량이 최대 5,000kDa인 단백질을 분리할 수 있습니다. 세제/지질 미셀의 존재는 사용된 단백질과 세제에 따라 막 단백질의 전체 크기를 >150kDa 증가시킵니다.
- 컬럼에 샘플을 적용하고 SEC 실험을 실행합니다.
- 주사기에 부착된 무딘 끝 바늘을 사용하여 고속 원심분리 단계에서 상청액을 1mL 주사기로 옮깁니다. 이를 통해 펠릿을 방해하지 않고 원심분리기 튜브에서 샘플을 회수할 수 있습니다.
- 샘플 루프를 로드하도록 설정합니다. 주사기에서 600-700 μL의 샘플을 로딩 포트로 주입하여 500 μL 샘플 루프를 오버필합니다. 사용하는 시스템에 따라 이 로딩 단계를 방법에 프로그래밍하여 실수가 없도록 할 수 있습니다.
- 분석법 중에 컬럼의 권장 유속과 압력으로 4mL의 SEC 버퍼로 비우는 방식으로 루프의 샘플을 컬럼에 주입합니다( 재료 표 참조).
- 1.5 컬럼 부피(24 mL 컬럼의 경우 36 mL)의 버퍼가 통과할 때까지 동일한 유속으로 컬럼을 실행합니다.
- 컬럼 부피의 0.25(24mL 컬럼의 경우 6mL)에서 90개의 분획을 수집하기 위해 0.2mL 분획 수집을 시작합니다.
참고: 컬럼의 공극 부피는 0.3 컬럼 부피가 될 것으로 예상되므로, 그 직전에 분획 수집을 시작하면 공극 부피에 존재하는 모든 단백질을 포함하여 모든 단백질의 용출이 모니터링됩니다.
4. 형광 추적 수집 및 분석
- 분획 수집기(단계 3.2.5)에서 샘플을 96웰 플레이트로 옮기고 형광 신호를 판독합니다.
- 형광 판독을 하기 전에 수집된 샘플을 희석하십시오. 멀티-채널 피펫을 이용하여, 90 μL의 실험실 등급의 증류된H2O를 저장소로부터 불투명한 평평한 바닥 96-웰 플레이트의 각각의 웰로 옮긴다( 재료의 표 참조).
- 3.2.5 단계 동안 분획을 96웰 블록으로 수집한 경우 다중 채널 피펫을 사용하여 블록에서 SEC 분획 10μL를 불투명 평평한 바닥 96웰 플레이트로 옮기고 위아래로 피펫팅하여 혼합합니다. 그렇지 않은 경우, SEC 분획이 3.2.5 단계 동안 개별 튜브에 수집되는 경우, 각 분획의 10 μL을 불투명 평평한 바닥 96-웰 플레이트에 하나씩 옮기고, 샘플을 혼합하기 위해 매번 위아래로 피펫팅합니다.
- 불투명한 평평한 바닥 96웰 플레이트를 플레이트 판독기에 넣고 형광을 측정합니다. GFP가 형광 라벨(여기에 사용됨)인 경우 여기를 가능한 한 488nm에 가깝게 설정하고 형광 방출을 가능한 한 507nm에 가깝게 감지합니다.
참고: 형광 판독을 수행하기 전에 필요한 희석은 발현 배양에 존재하는 관심 단백질의 총량과 사용 중인 플레이트 리더의 민감도에 따라 달라집니다. 이 연구에서 제시된 예에서, 샘플을 물에 10배 희석하였다. 출발점에 대한 제안으로, 분획은 검출 전에 물이나 완충액에 5-10배 희석해야 합니다. 기록된 FSEC 미량 신호가 특히 낮은 경우 더 작은 희석액 또는 희석되지 않은 시료를 대신 사용할 수 있습니다. 이 연구에서 검출에 사용된 장치는 488nm에서 여기가 가능하고 507nm에서 형광 방출을 감지할 수 있는 플레이트 리더였습니다( 재료 표 참조).
- FSEC 추적을 플로팅합니다.
- 플레이트 리더의 데이터를 원시 형식(원시 텍스트 또는 쉼표로 구분된 값 파일)으로 내보냅니다. 이러한 원시 데이터는 FSEC 추적의 Y축에 그려집니다.
- X축의 경우 각 분수가 수집된 부피를 계산합니다. 첫 번째 웰은 분획 지연을 설명하기 위해 첫 번째 분획이 수집된 용리 부피여야 합니다(이 예에서는 6mL). 이 이후의 분획은 수집된 분획 부피(이 예에서는 0.2mL)만큼 순차적으로 증가해야 합니다.
- X축 및 Y축 데이터가 계산되면 데이터를 복사하여 그래프 소프트웨어( 재료 표 참조)에 붙여넣어 각 웰의 형광 신호를 컬럼에서 용리된 부피에 대해 플로팅합니다.
참고: 그림 1 은 FSEC 실험을 실행하는 데 필요한 단계를 개략적으로 나타낸 것입니다.
- FSEC 추적을 분석합니다.
- 공극 부피(24mL 컬럼의 경우 약 8mL)에서 단백질 용리량을 평가하며, 이는 단백질의 크기가 매우 크고 펼쳐지거나 응집될 가능성이 있음을 나타냅니다.
- 접힌 단백질을 나타내는 이후 피크에서 용리되는 단백질의 양을 평가합니다. 이것은 단백질 크기(세제/지질 미셀과 관련된 경우)에 따라 24mL 컬럼의 경우 10mL에서 16mL 사이일 것으로 예상됩니다. 특히 3-4 mL(24 mL 컬럼의 경우)보다 크거나 넓은 피크인 경우 피크 모양에 세심한 주의를 기울이십시오.
- 단량체 피크에 기록된 최대 신호를 공극 피크의 최대 신호로 나누어 단량체 피크 높이와 공극 피크 높이 사이의 비율을 계산합니다.
참고: 이 값은 단분산 지수를 나타내며 단백질 품질을 정량적으로 측정할 수 있습니다. 값이 클수록 최상의 품질을 나타내는 반면, 1보다 작은 값은 접힌 단백질보다 응집된 단백질이 더 많기 때문에 문제가 있는 샘플을 나타냅니다. - 여러 FSEC 실행을 비교해야 하고 가장 중요한 특징이 각 경우의 단량체의 양인 경우 트레이스를 플레이트 리더(예: RFU)에 의해 기록된 원시 신호로 플로팅합니다.
참고: 풀린 단백질과 비교한 단량체의 양을 비교하는 것이 더 중요한 경우, 신호는 백분율로 정규화되어야 합니다.tage 트레이스의 최소 및 최대 판독값을 사용하여 전체 신호의 백분율로 변환해야 하며, 이는 트레이스 사이의 응집된 단백질과 단량체 단백질 간의 비율 차이를 강조합니다.
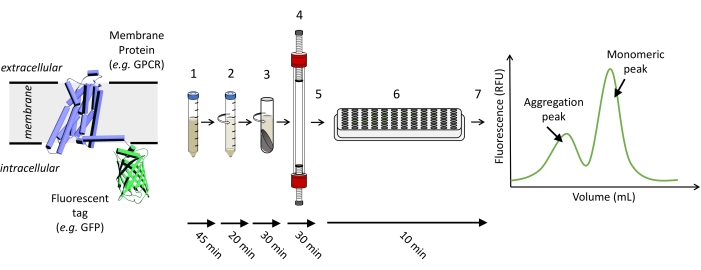
그림 1: FSEC 실험을 실행하는 데 필요한 단계를 개략적으로 보여줍니다. (1) 형광 태그가 부착된 관심 단백질을 발현하는 세포가 가용화됩니다. (2) 미정제 가용화는 먼저 저속 스핀으로 정화 된 다음 (3) 고속 스핀으로 명확 해집니다. (4) 정화된 샘플 상청액을 로드하여 적절한 SEC 컬럼에서 실행하고, (5) 분획을 수집합니다. (6) 분획 샘플을 96웰 플레이트로 옮기고 플레이트 리더를 사용하여 GFP-형광 신호를 검출하여 (7) FSEC 트레이스를 플로팅합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
먼저, 본 연구에 사용된 플레이트 리더에 대한 eGFP 검출의 다이내믹 레인지와 하한을 조사하였다. 알려진 농도의 정제된 eGFP 표준물질을 50 μL 최종 부피에서 50 ng·μL-1, 25 ng·μL-1, 12.5 ng·μL-1, 6.25 ng·μL-1, 3.125 ng·μL-1, 1.5625 ng·μL-1, 0.78125 ng·μL-1 및 0.390625 ng·μL-1로 희석하고, 488 nm의 여기와 507 nm의 방출을 사용하여 형광을 판독하였다(도 2 ). 이 실험은 플레이트 리더가 신호 포화 전에 웰당 30ng의 eGFP 표지 단백질의 낮은 검출 한계와 웰당 최대 500ng의 eGFP 표지 단백질의 동적 범위를 가졌음을 나타냅니다. 하한 값을 사용하고 단백질 용리가 컬럼 부피의 0.33으로 제한된다고 가정하면, 검출 가능한 FSEC 신호를 관찰하기 위해 SEC 컬럼 로딩에 관심 있는 eGFP 표지 단백질의 최소 1.28μg이 필요합니다.
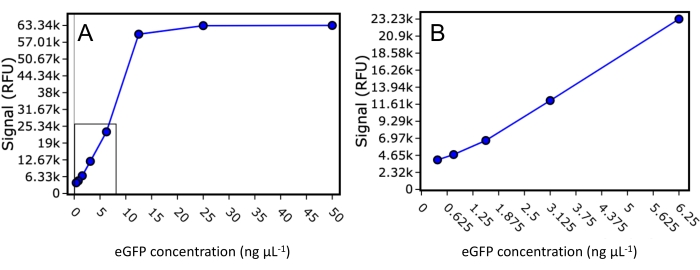
그림 2: eGFP 표준 곡선. 50 ng·μL-1, 25 ng·μL-1, 12.5 ng·μL-1, 6.25 ng·μL-1, 3.125 ng·μL-1, 1.5625 ng·μL-1, 0.78125 및 0.390625 ng·μL-1로 희석된 정제된 eGFP 표준물질에 대한 형광 신호의 산란 그래프. (A) 포화 신호가 있는 희석액을 포함하여 모든 희석액이 표시됩니다. (B) 플레이트 리더의 다이내믹 레인지에 속하는 표준만 포함하는 확대된 산란 그래프. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
둘째, 이 연구에 사용된 24mL 컬럼을 분자량 표준물질로 보정했습니다. FSEC 분석에 사용된 것과 동일한 완충액 및 실행 조건을 사용하여 분자량 표준물질 블루 덱스트란(>2,000 kDa), 페리틴(440 kDa), 알돌라제(158 kDa), 콘알부민(75 kDa) 및 오브알부민(43 kDa)을 개별적으로 주입하고 컬럼을 통과시켜 280nm 흡수에서 용출 흔적을 수집했습니다. 기록된 용출 부피는 각각 8.9mL, 12.4mL, 15.2mL, 16.9mL 및 18mL였습니다. 이러한 용출 부피를Kav (식 1)로 변환하고 로그 분자량에 대해 플로팅하면 표준 곡선이 적합할 수 있습니다. 이를 통해 이 연구에서 테스트한 GPCR의 분자량을 표준 곡선의 보간법으로 추정할 수 있었습니다(그림 3). 예를 들어, 세정제 DDM에 가용화한 후의 세로토닌 수용체 2A(5HT2AR)의 FSEC 트레이스는 13.4 mL의 용출 부피를 나타내었다. 이 5HT2AR 용출 부피는 페리틴과 알돌라아제에 대해 기록된 용출 부피 사이에 있으며 약 300kDa의 추정 분자량을 제공합니다. 이 연구에 사용된 5HT2AR 구조는 약 50kDa(eGFP 태그 포함)이며, 이는 5HT2AR이 단량체로 가정되는 경우 250kDa의 분자량이 DDM 세제/지질 미셀에 기인할 수 있음을 의미합니다. 용출량 변환식은 다음과 같습니다(방정식 1).
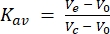 (식 1)
(식 1)
여기서, Ve는 용출 부피이고, V0는 컬럼 공극 부피이고, Vc는 총 컬럼 부피이다.
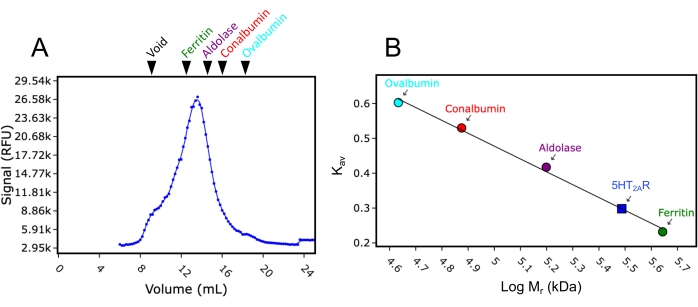
그림 3: 분자량 표준물질을 사용한 SEC 컬럼의 검량선. (A) DDM에서 가용화된 5HT2AR의 대표적인 FSEC 미량으로, 분자량 표준물 블루 덱스트란(Void), 페리틴, 알돌라제, 콘알부민 및 오브알부민의 상대적 용출 위치가 표시되어 있습니다. 페리틴, 알돌라아제, 콘알부민 및 오브알부민은 각각 녹색, 보라색, 빨간색 및 청록색으로 착색됩니다. (b) 표준물질의 용출 위치를 이용하여 분자량 보정 곡선을Kav(수학식 1)로 변환한 후 로그 분자량(Mr)에 대하여 플롯팅한다. DDM에서5HT2AR의Mr을Kav를 사용하여 곡선으로부터 보간하고 곡선 상에 표시한다(파란색 사각형). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그런 다음 FSEC를 사용하여 GPCR 스핑고신-1-인산염 수용체(S1PR1)15의 품질과 특성을 평가했습니다. GFP-태깅된 인간 S1PR 1을 발현하는 곤충 세포는 프로토콜에 기술된 바와 같이 FSEC에 대해 처리되었다(도 1).
첫째, SMA를 사용한 세제 없는 추출에 대해 세제 DDM 및 LMNG를 테스트하여 최적의 막 추출 조건을 탐색했습니다(그림 4A). 단분산 지수는 단백질 샘플의 품질과 단분산 샘플(14-15mL 컬럼 머무름)과 비교하여 공극 내 단백질(~8mL 컬럼 머무름)의 비율을 평가하는 데 사용되었습니다. LMNG에서 가용화된 샘플은 더 나은 단량체 피크 모양과 더 낮은 단백질 응집체 피크를 갖는 우수한 FSEC 프로파일을 나타내었으며, 이는 LMNG에서의 가용화 및 정제가 이 막 단백질에 대한 가장 안정화 조건임을 나타냅니다. 대조적으로, DDM에서 가용화된 샘플은 상대적으로 더 열악한 FSEC 프로파일을 가지며, 더 큰 응집체 피크와 더 넓은 단량체 피크를 가지며, 이는 샘플의 다분산성을 나타냅니다.
둘째, FSEC 프로파일에 대한 리간드 첨가의 영향은 가용화 동안 샘플에 스핑고신-1-포스페이트(S1P)를 첨가하여 조사되었습니다. 이 예에서, DDM을 가용화 시약으로 사용하였고, S1P의 존재 유무 하에서 S1PR1 의 FSEC 트레이스를 비교하였다(도 4B). S1P의 존재 하에서 가용화된 샘플은 감소된 응집과 함께 우수한 FSEC 트레이스를 나타내었다. 이는 리간드의 존재 하에서의 정제가 용액 중의 수용체를 안정화시킴으로써 단백질 샘플 품질을 향상시키는 데 유리할 뿐만 아니라 단백질이 올바르게 접히고 리간드 결합에 적합하다는 것을 시사하는 결과로서 단백질 활성의 대리 마커로서도 유리하다는 것을 나타냅니다.
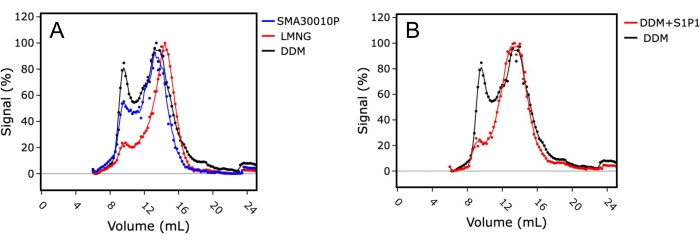
도 4: S1PR1의 조추출물을 이용한 FSEC는 최적의 막 추출 조건 및 리간드 결합을 나타낸다. (A) 스티렌-말레산 코폴리머(SMA; 청색), 라우릴 말토스 네오펜틸 글리콜(LMNG; 적색) 또는 도데실 말토시드(DDM; 흑색)에서 가용화된 S1PR1의 FSEC 미량 비교. (B) 작용제 스핑고신-1-포스페이트(S1P)의 존재(빨간색) 또는 부재(검은색)에서 DDM에 가용화된 S1PR1의 FSEC 흔적 비교. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
FSEC는 또한 상이한 조건하에서5HT2AR의 장기 안정성을 조사하기 위해 사용되었다. GFP 태그가 부착된 인간 5HT 2A R을 곤충 세포막에서 세제(DDM) 또는SMA폴리머로 가용화하고 4°C 또는 실온에서 보관한 후 여러 시점에서 FSEC로 분석했습니다(그림 5). 수일간의 인큐베이션 후, DDM 중의 5HT2AR은 어느 온도에서든 단량체 피크 높이의 현저한 감소를 나타내었고, 응집체 피크의 현저한 증가가 관찰되었다. 대조적으로, SMA 지질 입자 (SMALP)의 5HT2AR은 실험 과정에서 단량체 피크 높이의 현저한 감소를 나타내지 않았으며, 이는 SMALP의 단백질이 불리한 온도에서도 더 오랫동안 안정적으로 유지되었음을 나타냅니다. 이는 결합 실험의 성공적인 완료를 위해 장기간에 걸쳐 샘플이 안정적이고 활성이어야 하는 표면 플라즈몬 공명(SPR) 실험과 같은 다운스트림 생물물리학 응용 분야를 위한 단백질 준비를 고려할 때 중요할 수 있습니다.
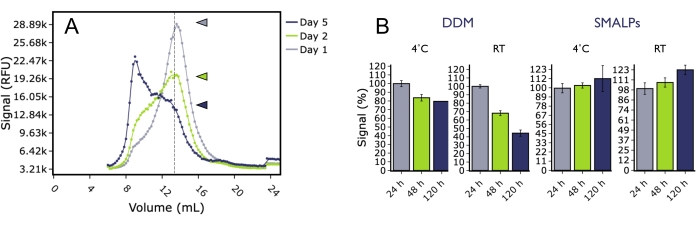
그림 5: FSEC에서 분석한 DDM 또는 SMALP를 사용하여 멤브레인에서 추출한 5HT 2A R의 품질에 대한 시간 및 온도의 영향. (A) DDM에 가용화되고 실온에서 1일(회색), 2일(녹색) 또는 5일(파란색) 동안 보관된 5HT2AR의 대표적인 FSEC 흔적. (B) 4°C(회색) 또는 RT(검은색)에서 저장된 SMALP 샘플과 비교하여 4°C(파란색) 또는 RT(녹색)에서 저장된 DDM 샘플에 대한 정규화된 단량체 피크 높이의 히스토그램. 오차 막대는 SEM을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에 제시된 FSEC를 사용한 상태 스크리닝을 위한 일반적인 체계적인 접근 방식을 통해 막 단백질 생산을 위한 가용화 및 정제 파라미터를 빠르게 최적화할 수 있습니다. 이는 생물물리학 및 구조 연구를 위해 안정적이고 기능적으로 활성인 막 단백질을 신속하게 생산할 수 있음을 의미합니다. 또한 FSEC는 막 단백질 실험실에 이미 설치되어 있는 실험실 장비를 사용하여 실행할 수 있으므로 분석을 실행하기 위한 전문 기기를 구입할 필요가 없습니다.
중요 단계
세제의 셀에서 가용화 시점부터 샘플이 SEC 컬럼으로 전달되는 시점(2.1.5-3.2.5단계) 사이에 걸리는 시간은 시간이 중요하며 이러한 단계 사이에 일시 중지가 없어야 합니다. 모든 단계는 4°C 또는 얼음 위에서 수행해야 하며 이러한 단계를 수행하는 데 걸리는 시간을 가능한 한 최소로 유지해야 합니다. 이러한 시간 및 온도 제약은 잠재적인 풀림 또는 분해 전에 막 단백질에 대한 FSEC 프로파일을 기록하는 데 필요합니다. 막 단백질이 가용화된 후에는 4°C에서도 풀림, 응집 및 분해의 위험이 더 커집니다. 이상적으로, FSEC 트레이스를 비교할 모든 샘플은 가용화 단계 후 동일한 시간 내에 SEC 컬럼을 통과해야 합니다. 실제로, 특히 샘플이 단일 컬럼 아래로 순차적으로 전달되는 경우에는 어렵지만, 서로 3시간 이내에 최대 5개의 SEC 트레이스를 수집할 수 있으며, 이 기간 동안 심각한 성능 저하가 없어야 합니다.
문제 해결
FSEC 실험을 수행할 때 형광 신호가 낮거나 없는 경우, 관심 있는 막 단백질이 선택한 세포주를 발현하지 않았거나, 선택한 세포주의 발현이 매우 낮거나, 선택한 세제에 용해되지 않았을 수 있습니다. 형광 신호를 수집하고 FSEC 트레이스를 기록하기 전에 샘플을 희석한 경우, 간단한 첫 번째 단계는 SEC 분획을 더 낮게 희석하거나 희석하지 않는 것입니다. 그래도 해석 가능한 FSEC 흔적이 나오지 않으면 단백질의 발현 및 가용화를 확인해야 합니다.
단백질 발현의 분석은 2.2.2 단계 후에 샘플의 형광을 확인함으로써 달성 될 수 있습니다. 이 샘플에서 형광 신호가 매우 낮거나 전혀 없는 경우(예: 배경에 매우 가까운 신호) 단백질 발현에 문제가 있을 수 있습니다. 대체 세포주로 전환하거나 성장 조건, 발현 유도 및 유도/감염/형질감염과 수확 사이의 시간을 조정하는 것과 같이 막 단백질의 발현 수준을 개선하기 위한 단계를 수행할 수 있습니다. 그러나 특히 불량한 단백질 발현은 불안정한 막 단백질을 나타낼 수 있으며, 따라서 불량한 구조 선택을 나타낼 수 있습니다.
발현이 확인되었고 FSEC 이전의 배경 위에 명확한 형광 신호가 있는 경우, 2.2.2 단계 이후의 시료(총 단백질)와 비교하여 2.4.3 단계 이후의 시료(가용성 막 단백질)의 잔여 형광 신호를 측정하여 가용화 효율을 확인할 수 있습니다. 가용화 효율은 20%-30%이고 여전히 막 단백질의 성공적인 분석 및 정제를 허용하는 것이 일반적입니다. 그러나, 가용화 효율이 20% 미만인 경우, 가용화를 위한 상이한 세제 또는 상이한 가용화 조건이 요구될 수 있다. 가용화를 개선하려는 시도가 성공적이지 않은 경우, 이는 특히 불안정한 막 단백질을 나타낼 수 있으며, 따라서 불량한 구조 선택을 나타낼 수 있습니다.
FSEC 트레이스(예: 18-24mL)에서 매우 늦은 용리 피크가 관찰되는 경우, 이는 형광 단백질의 단백질 분자량이 예상보다 훨씬 낮다는 것을 나타냅니다. 이는 관심 있는 막 단백질이 분해되어 "유리" GFP가 발생하기 때문에 발생할 수 있습니다. 겔 내 GFP 형광을 사용하여 가용화 전후에 단백질이 손상되지 않았는지 확인해야 합니다. 관심있는 단백질이 분해되거나 단백질 분해되는 것으로 보이는 경우, 프로테아제 억제제의 양은 2 배에서 4 배로 증가 할 수 있습니다. 그러나, 가용화 전에도 프로테아제 또는 분해된 단백질에 대한 높은 민감성은 특히 불안정한 단백질을 나타낼 수 있으며, 따라서 불량한 작제물 선택을 나타낼 수 있다.
FSEC의 수정 및 추가 적용
일반적으로 FSEC에서 사용되는 형광 태그는 이 프로토콜에 설명된 대로 GFP 또는 eGFP입니다. 그러나 다양한 형광 단백질 태그를 사용할 수 있습니다. 사용할 형광 태그의 선택은 선택한 형광 태그에 대한 형광 신호를 기록하기 위해 올바른 여기 및 방출 파라미터를 달성할 수 있는 플레이트 리더와 다양한 환경 조건에서 양자 수율의 변화가 거의 또는 전혀 없는 형광단을 갖는 플레이트 리더에 따라 달라집니다. 또한 FSEC는 형광 단백질에만 국한되지 않고 형광 염료로 표지된 단백질과도 동일하게 작동할 수 있습니다. 예를 들어, NTA 염료를 사용할 수 있으며, 이는 히스티딘 태그가 부착된 막 단백질 구축물에 유리하게 결합합니다. 또한, 형광 염료로 화학적으로 표지되고 관심 있는 막 단백질에 특이적으로 표지된 형광 표지된 항체 또는 막 단백질 구조체에 포함된 정제 태그는 FSEC에 대한 표적을 간접적으로 표지할 수 있습니다.
FSEC를 사용하여 세제 스크리닝을 수행할 때 SEC 컬럼을 실행하는 데 사용되는 완충액에 단백질이 용해된 일치하는 세제를 포함해야 하는지 또는 모든 실행에서 표준 세제를 사용해야 하는지 여부를 선택할 수 있습니다. 단백질의 거동에 대한 보다 정확한 표현은 전체 실험이 전체적으로 일치하는 세제로 수행되는 경우 얻을 수 있습니다. 그러나 각 실행을 수행하기 전에 컬럼을 새 세제로 다시 평형화해야 하는 경우 시간이 많이 걸리고 세제 낭비가 될 수 있습니다. 또한 세제 스크리닝의 주요 목적은 흔적을 비교하는 것이므로 조건이 이상적이지 않더라도 추세는 흔적에 남아 있습니다. 따라서, 단백질이 관심 세제에 용해되지만 컬럼은 모든 실행(예: DDM)11에 걸쳐 단일 세제를 사용하여 표준 버퍼에서 실행되어 시간과 세제 소모품을 절약할 수 있는 절충안에 도달할 수 있습니다.
사용되는 FLPC 장비를 수정하면 FSEC 프로토콜의 처리량을 크게 늘리고 시료 요구 사항을 최소화할 수 있습니다. 예를 들어, FPLC 또는 HPLC 시스템에는 자동 시료 주입기, 더 작은 베드 부피 분석 컬럼(예: 3.2mL 분석 SEC 컬럼) 및 컬럼에서 직접 연속 FSEC 트레이스를 모니터링하기 위한 인라인 형광 검출기가 장착될 수 있습니다. 그 결과 설정을 통해 더 짧은 시간에 더 많은 FSEC 실행을 수행할 수 있고 수동 플로팅 단계를 제거할 수 있으므로 더 짧은 시간 내에 더 많은 조건을 테스트할 수 있습니다. 또한 각 실행에 대해 더 적은 수의 샘플을 준비하고 FSEC 컬럼에 로드해야 하므로 샘플 요구 사항이 더욱 줄어듭니다. 이것은 분석에 필요한 재료가 거의 없기 때문에 발현 배양을 플레이트 기반 형식으로 줄일 수 있는 가능성을 열어줍니다.
다른 방법과 비교한 FSEC의 강점과 약점
FSEC의 단점은 형광 표지를 도입하기 위해 막 단백질 구조를 설계해야 하며, 도입 시 표지의 배치가 관심 있는 막 단백질의 기능이나 접힘을 방해할 가능성이 적다는 것입니다. 또한, 여기에 설명된 FSEC 프로토콜은 단백질의 조잡한 혼합물인 세포 용해물의 존재 하에서 막 단백질의 특성을 모니터링합니다. 이러한 환경에서 막 단백질의 거동은 관심 있는 막 단백질이 다른 단백질과 완전히 분리될 때 정제 종료 시 분취용 SEC 컬럼을 거치는 경우와 다를 수 있습니다. 또한 FSEC는 단백질 품질에 대한 어느 정도 정성적 척도를 제공합니다. 그러나, 프로토콜의 단계 4.3.3에 기술된 바와 같이, FSEC 트레이스를 단분산 지수로 변환함으로써, 단백질 품질의 정량적 측정이 얻어질 수 있다.
FSEC는 막 단백질 구조체, 가용화 조건 및 정제 완충액 조성의 초기 분석에 사용할 수 있는 유일한 방법이 아닙니다. 대체 접근 방식은 FSEC에 비해 장점과 단점이 있습니다. 예를 들어, 형광단 기반 열안정성 분석, 특히 염료 7-디에틸아미노-3-(4′-말레이미딜페닐)-4-메틸쿠마린(CPM)16,17의 사용이 존재합니다. 이 방법의 장점은 단백질 품질의 정성적 측정을 제공하는 FSEC와 달리 열 안정성 분석은 상대 용융 온도의 형태로 정량적 측정을 제공한다는 것입니다. 또한, 단백질 구조체에 형광 태그를 도입할 필요가 없습니다. 그러나 FSEC와 비교한 열안정성 분석의 단점은 정제된 단백질을 사용해야 하고 분석이 접힌 단백질에서 천연 시스테인 잔기의 유리한 위치에 의존하기 때문에 모든 단백질 구성물과 호환되지 않는다는 것입니다.
FSEC 및 형광단 기반 열안정성 분석과 유사한 또 다른 방법은 막 단백질의 온도 민감도를 측정하는 분석법입니다. 이 분석에서 단백질은 다른 온도로 도전되고 원심분리 후 용액에 남아 있는 단백질이 검출됩니다. 이 방법에서의 검출은 용액중의 형광, SDS-PAGE 겔 밴드(19)의 형광, 또는 웨스턴 블롯(20)에서의 신호 강도를 측정하는 것을 포함하는 여러 방법으로 수행되었다. 그러나 이러한 접근 방식의 중요한 단점은 각 개별 온도 지점을 독립적으로 수집해야 하기 때문에 분석이 매우 노동 집약적이고 결과에서 높은 노이즈가 발생하기 쉽다는 것입니다.
마지막으로, FSEC와 유사한 방식으로 막 단백질 품질을 평가하기 위해 몇 가지 더 진보된 생물물리학 기술을 사용할 수 있습니다(예: 유동 유도 분산 분석(flow-induced dispersion analysis)21, 마이크로스케일 열영동(microscale thermophoresis)22 또는 SPR. 매우 강력한 접근 방식이지만 이러한 방법의 단점은 분석을 실행하기 위해 고도로 전문화된 기기가 필요하다는 것입니다.
결론적으로, FSEC는 멤브레인 단백질 생산 캠페인에 사용할 수 있는 매우 중요한 도구를 제공하며, 유일한 옵션은 아니지만 위에 나열된 다른 방법에 비해 몇 가지 뚜렷한 이점이 있습니다. 직교 분석에 의한 결과의 교차 검증은 항상 권장되며 위에서 논의한 방법 중 어느 것도 서로 배타적이지 않습니다.
공개
Peak Proteins는 단백질 발현, 정제, 질량 분석 및 구조 측정을 유료로 제공하는 계약 연구 기관입니다.
감사의 말
Peak Proteins 팀 전체의 도움과 지원에 감사드립니다. 세포 과학 팀에서 곤충 세포 발현에 대한 귀중한 통찰력과 지침을 제공한 Ian Hampton에게 감사를 표합니다. 이 프로젝트를 추진할 수 있는 자원과 기회를 제공한 Mark Abbott에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 mL and 5 mL plastic syringes | Generic | - | Syringes for transfer of samples |
| 10x EDTA Free Protease inhibitor cocktail | Abcam | ab201111 | Protease inhibitors |
| 15 mL tubes | Generic | - | 15 mL tubes for pellet preparation and solubilisation |
| 2 mL ultra-centrifuge tubes | Beckman Coulter | 344625 | Tubes for ultra-centrifuge rotor |
| 50 mL tubes | Generic | - | 50 mL tubes for cell harvest |
| 96 deep-well blocks | Greiner | 15922302 | For collecting 0.2 mL SEC fractions |
| ÄKTA V9-L loop valve | Cytiva | 29011358 | 5 posiiton loop valve for the ÄKTA FPLC system |
| ÄKTA F9-C fraction collector | Cytiva | 29027743 | 6 position plate fraction collector for the ÄKTA FPLC system |
| ÄKTA pure 25 L | Cytiva | 29018224 | FPLC system for running the experiment |
| Benchtop centrifuge (e.g. Fisherbrand GT4 3L) | Fisher Scientific | 15828722 | Centrifuge for low-speed spin |
| Blunt end filling needles | Generic | - | For transfer of samples |
| Bottle top vacuum filter | Corning | 10005490 | Bottle top vacuum filter for filtering SEC buffers |
| Cholesteryl hemisuccinate (CHS) | Generon | CH210-5GM | Additive for detergent solubilisation |
| Disposable multichannel reseviour | Generic | - | Resevior for addition of water or buffer to 96-well micro-plate |
| Dodecyl maltoside (DDM) | Glycon | D97002-C-25g | Detergent for solubilisation |
| eGFP protein standards | BioVision | K815-100 | eGFP standards for fluorescent calibration curve |
| Glycerol | Thermo Scientific | 11443297 | Glycerol for buffer preparation |
| HEPES | Thermo Scientific | 10411451 | HEPES for buffer preparation |
| High molecular weight SEC calibration standards kit | Cytiva | 28403842 | Molecular weight calibration kit for SEC |
| Lauryl maltose neopentylglycol (LMNG) | Generon | NB-19-0055-5G | Detergent for solubilisation |
| Low molecular weight SEC calibration standards kit | Cytiva | 28403841 | Molecular weight calibration kit for SEC |
| MLA-130 ultra-centrifuge rotor | Beckman Coulter | 367114 | Rotor for ultracentrifuge that fits 2 mL capacity tubes |
| Opaque 96-well flat-bottom micro-plate | Corning | 10656853 | 96-well for reading fluorescent signal in plate reader |
| Optima MAX-XP ultra-centrifuge | Beckman Coulter | 393315 | Centrifuge for high-speed spin |
| pH meter | Generic | - | For adjusting the pH of buffers during preparation |
| Prism | GraphPad | - | Graphing software for plotting traces |
| Rotary mixer | Fisher Scientific | 12027144 | Mixer for end over end mixing in the cold |
| Sodium chloride | Fisher Scientific | 10316943 | Sodium chloride for buffer preparation |
| Sodium hydroxide | Fisher Scientific | 10488790 | Sodium hydroxide for buffer preparation |
| Spectramax ID3 Plate Reader | Molecular Devices | 735-0391 | Micro-plate reader capable of reading fluorescence |
| Stirrer plate | Generic | - | For stirring buffers during preparation |
| Styrene maleic acid (SMA) | Orbiscope | SMALP 300 | Polymer for detergent free extraction |
| Superdex 200 Increase 10/300 GL | Cytiva | 28990944 | SEC column for running the experiment. The bed volume of this column is 24 mL. The recommended flow rate for this column in 0.9 ml/min (in water at 4 °C). The maximum pressure limit for this column is 5 MPa. |
| Vacuum pump | Sartorius | 16694-2-50-06 | For filtering and degassing buffers |
참고문헌
- Burgess, R. R. A brief practical review of size exclusion chromatography: Rules of thumb, limitations, and troubleshooting. Protein Expression and Purification. 150, 81-85 (2018).
- Erickson, H. P. Size and shape of protein molecules at the nanometer level determined by sedimentation, gel filtration, and electron microscopy. Biological Procedures Online. 11 (1), 32-51 (2009).
- Lathe, G. H., Ruthven, C. R. J. The separation of substances and estimation of their relative molecular sizes by the use of columns of starch in water. Biochemical Journal. 62 (4), 665-674 (1956).
- Lathe, G. H., Ruthven, C. R. The separation of substances on the basis of their molecular weights, using columns of starch and water. Biochemical Journal. 60 (4), (1955).
- Polson, A. Fractionation of protein mixtures on columns of granulated agar. Biochimica et Biophysica Acta. 50 (3), 565-567 (1961).
- Hjertén, S., Mosbach, R. 34;Molecular-sieve" chromatography of proteins on columns of cross-linked polyacrylamide. Analytical Biochemistry. 3 (2), 109-118 (1962).
- Porath, J., Flodin, P. Gel filtration: A method for desalting and group separation. Nature. 183 (4676), 1657-1659 (1959).
- Kawate, T., Gouaux, E. Fluorescence-detection size-exclusion chromatography for precrystallization screening of integral membrane proteins. Structure. 14 (4), 673-681 (2006).
- Hattori, M., Hibbs, R. E., Gouaux, E. A Fluorescence-detection size-exclusion chromatography-based thermostability assay for membrane protein precrystallization screening. Structure. 20 (8), 1293-1299 (2012).
- Shimomura, O., Johnson, F. H., Saiga, Y. Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. Journal of Cellular and Comparative Physiology. 59 (3), 223-239 (1962).
- Drew, D., et al. GFP-based optimization scheme for the overexpression and purification of eukaryotic membrane proteins in Saccharomyces cerevisiae. Nature Protocols. 3 (5), 784-798 (2008).
- Newstead, S., Kim, H., von Heijne, G., Iwata, S., Drew, D. High-throughput fluorescent-based optimization of eukaryotic membrane protein overexpression and purification in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences of the United States of America. 104 (35), 13936-13941 (2007).
- Vaidehi, N., Grisshammer, R., Tate, C. G. How can mutations thermostabilize G-protein-coupled receptors. Trends in Pharmacological Sciences. 37 (1), 37-46 (2016).
- Hardy, D., Bill, R. M., Jawhari, A., Rothnie, A. J. Overcoming bottlenecks in the membrane protein structural biology pipeline. Biochemical Society Transactions. 44 (3), 838-844 (2016).
- Hanson, M. A., et al. Crystal structure of a lipid G protein-coupled receptor. Science. 335 (6070), 851-855 (2012).
- Alexandrov, A. I., Mileni, M., Chien, E. Y. T., Hanson, M. A., Stevens, R. C. Microscale fluorescent thermal stability assay for membrane proteins. Structure. 16 (3), 351-359 (2008).
- Harborne, S. P. D., King, M. S., Kunji, E. R. S. Thermostability assays: A generic and versatile tool for studying the functional and structural properties of membrane proteins in detergents. Biophysical Journal. 118 (4), 105-121 (2020).
- Nji, E., Chatzikyriakidou, Y., Landreh, M., Drew, D. An engineered thermal-shift screen reveals specific lipid preferences of eukaryotic and prokaryotic membrane proteins. Nature Communications. 9 (1), 4253 (2018).
- Harborne, S. P. D., et al. IMPROvER: The Integral Membrane Protein Stability Selector. Scientific Reports. 10 (1), 15165 (2020).
- Ashok, Y., Nanekar, R., Jaakola, V. -. P. Defining thermostability of membrane proteins by western blotting. Protein Engineering Design and Selection. 28 (12), 539-542 (2015).
- Pedersen, M. E., Østergaard, J., Jensen, H. Flow-induced dispersion analysis (FIDA) for protein quantification and characterization. Methods Mol Biol. 1972, 109-123 (2019).
- Wienken, C. J., Baaske, P., Rothbauer, U., Braun, D., Duhr, S. Protein-binding assays in biological liquids using microscale thermophoresis. Nature Communications. 1 (1), 100 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유