Method Article
İskelet Kası Yağ İnfiltrasyonunun Decellularizasyona Dayalı Miktar Tayini
Bu Makalede
Özet
Bu çalışma, sağlam kas hacmi yoluyla kas içi yağ dokusu (IMAT) birikiminin görselleştirilmesi ve ölçülmesinin yanı sıra IMAT'ı oluşturan bireysel adipositlerin ölçümlerinin ölçülmesi için hücreden arındırmaya dayalı metodolojileri açıklamaktadır.
Özet
Yağ infiltrasyonu, iskelet kasındaki miyolifler arasında adiposit birikimidir ve birçok miyopati, metabolik bozukluk ve distrofinin belirgin bir özelliğidir. Klinik olarak insan popülasyonlarında yağ infiltrasyonu, bilgisayarlı tomografi (BT), manyetik rezonans görüntüleme (MRI) ve ultrason (US) dahil olmak üzere noninvaziv yöntemler kullanılarak değerlendirilir. Bazı çalışmalarda fare kasındaki yağ infiltrasyonunu ölçmek için BT veya MRI kullanılmış olsa da, maliyetler ve yetersiz uzamsal çözünürlük zor olmaya devam etmektedir. Diğer küçük hayvan yöntemleri, bireysel adipositleri görselleştirmek için histolojiyi kullanır; Bununla birlikte, bu metodoloji heterojen patolojide örnekleme yanlılığından muzdariptir. Bu protokol, yağ infiltrasyonunu sağlam fare kası boyunca ve hücreden arındırma kullanarak bireysel adipositler düzeyinde kapsamlı bir şekilde kalitatif olarak görüntülemek ve kantitatif olarak ölçmek için metodolojiyi açıklar. Protokol belirli kaslar veya belirli türlerle sınırlı değildir ve insan biyopsisine kadar genişletilebilir. Ek olarak, standart laboratuvar ekipmanı ile çok az maliyetle brüt kalitatif ve kantitatif değerlendirmeler yapılabilir ve bu da bu prosedürü araştırma laboratuvarları arasında daha erişilebilir hale getirir.
Giriş
İskelet kası içindeki miyolifler arasında adipositlerin birikmesi, tip 2 diyabetten sarkopeniye ve kas-iskelet sistemi yaralanmasınakadar farklı durumların belirgin bir özelliğidir 1,2,3,4,5,6,7. Bu intramüsküler yağ dokusunun (IMAT) kapsamlı bir şekilde değerlendirilmesi, bu durumların patogenezini anlamak için kritik öneme sahiptir, çünkü IMAT birikimi insülin direnci 3,8,9,10 ve zayıf iskelet kası fonksiyonu 11,12,13,14,15 ile güçlü bir şekilde ilişkilidir . Her ne kadar bu çağrışımlar onlarca yıldır dikkat çekiyor olsa da, IMAT ile ilişkili mekanizmalar ve IMAT'in kökeni hala yoğun bir araştırma alanı olmaya devam ediyor. Bunun nedeni kısmen, iskelet kası yağ infiltrasyonunu değerlendiren çalışmaların çoğunun, mekanik araştırmaların sınırlı olduğu insanlarda gerçekleştirilmiş olmasıdır16,17. Bununla birlikte, daha yakın zamanlarda, fareler de dahil olmak üzere küçük hayvan modelleri, IMAT gelişiminin ve sinyalizasyonunun hücresel düzenlemesini belirlemeye yardımcı olmak için kullanılmıştır18,19,20. Bu çalışma, iskelet kası yağ infiltrasyonunu niteliksel olarak görselleştirmek ve ölçmek için küçük hayvan modelleriyle kullanım için yeni bir araç sağlamayı amaçlamaktadır.
İnsan popülasyonlarında klinik olarak yağ infiltrasyonu, bilgisayarlı tomografi (BT)6,21, manyetik rezonans görüntüleme (MRI)16,17,22,23 ve ultrason (US)17,24 dahil olmak üzere invaziv olmayan yöntemler kullanılarak değerlendirilir. Bu görüntüleme teknikleri tipik olarak bir kasta tanımlanmış bir ilgi alanını (ROI) tanımlar ve bu bölge içinde görüntü dilimleri elde eder, ancak kapsamlı yaklaşımlar da kullanılmıştır25,26,27. Bu görüntü dilimleri, nitel derecelendirmeye6 tabi tutulur ve piksel eşiklemesi28 ile ölçülür. Benzer yaklaşımlar daha önce hayvanlarda da kullanılmıştır 29,30; Bununla birlikte, maliyetlidirler ve küçük hayvan görüntüleme sistemlerine erişim gerektirirler. BT ve MRG kullanımı yoluyla uzamsal çözünürlük de önemli bir sorun teşkil etmektedir, çünkü bunlar bir voksel içindeki iskelet kası liflerinden IMAT adipositlerini tanımlayamamaktadır ve bunun yerine öncelikle kas bölgelerinin ve öncelikle IMAT bölgelerinin öznel olarak ayrılmasına dayanmaktadır31,32. Bu nedenle, yağ veya kas dokusunun doğru bir şekilde tanımlanamaması, bu dokuların temsili miktarlarının yanlış ölçülmesini de sağlar.
Bu sınırlamalar nedeniyle, küçük hayvan modellerinde iskelet kası yağ infiltrasyonunu değerlendirmek için mevcut teknikler en yaygın olarak ucuz ve erişilebilir bir alternatif olarak histolojiye dayanmaktadır33,34. Hematoksilen ve eozin (H&E), yağ kırmızısı O (ORO) ve perilipin gibi adiposit belirteçleri için immün boyama dahil olmak üzere standart boyama prosedürleri, kas içinde yağ infiltrasyonu içeren adipositlerin basit bir şekilde saptanmasına ve görselleştirilmesine izin verir. Bununla birlikte, histoloji yaklaşımları nadiren kapsamlıdır ve tipik olarak, IMAT kalitatif veya kantitatif değerlendirmesi tek bir bölüm34 ile sınırlıdır. Lipid ekstraksiyonu, toplam kas lipidlerini ölçmek için de kullanılmıştır35; ancak bu teknik, intramiyosellüler lipid (IMCL) ve intramüsküler yağ dokusu (IMAT) depoları arasında ayrım yapamaz36. Özetle, kastaki yağın görselleştirilmesi ve ölçülmesi için mevcut metodolojiler, finansal maliyetler veya IMAT'ın spesifik tespiti ile sınırlı kalmaktadır.
Burada, iskelet kası yağ infiltrasyonunu hem kalitatif görselleştirme hem de çok ölçekli niceleme ile değerlendirmek için ayrıntılı bir yöntem açıklıyoruz. Bu metodoloji, IMCL de dahil olmak üzere miyoselüler yapıları ortadan kaldıran, ancak daha büyük IMAT adiposit türevi lipid damlacıklarını sağlam tutan basit bir hücre giderme tekniği kullanır. Bu tekniğin özgüllüğünün doğrulanması, hücre dışı bırakma ile IMCL'nin tükenmesini göstermek için lipid ekstraksiyonu, hücre dışı bırakma ile IMAT modelinin kalıcılığını göstermek için μCT ve hücre dışı bırakma ile tanımlananlara kıyasla IMAT lipid damlacıklarının benzer boyut dağılımını göstermek için histoloji dahil olmak üzere37 yayınlanmıştır. Hücrelerden arındırıldıktan sonra, kaslar, paternin kalitatif olarak görselleştirilmesi ve yağ infiltrasyonunun derecesi ve/veya tek tek IMAT lipid damlacıklarının kantitatif görüntülenmesi için yağda çözünen boyalarla boyanabilir. Boyalar daha sonra izopropanol ile ekstrakte edilebilir ve elde edilen çözeltinin optik yoğunluğu (OD), IMAT lipid hacmini tahmin etmek için kullanılabilir. Bu tekniğin sıkı bir şekilde doğrulanması başka bir yerde yayınlanmıştır37. Bu makale, bu metodolojiyi fare kaslarıyla kullanmak için ayrıntılı bir protokol sağlar ve bu yöntemin diğer türlerden veya diğer dokulardan gelen kaslar gibi diğer uygulamalarda benimsenmesini desteklemek için sorun giderme ipuçları sağlar.
Protokol
Farelerin bakımı ve kurban edilmesi, Ulusal Sağlık Enstitüleri Laboratuvar Hayvanlarının Kullanımı ve Bakımı Kılavuzu'na uygun olarak gerçekleştirildi. Tüm çalışmalar, St. Louis Tıp Fakültesi'ndeki Washington Üniversitesi'ndeki Hayvan Çalışmaları Komitesi tarafından onaylandı. Bu protokolde yer alan örnek görüntüleri oluşturmak için 2-3 aylık erkek C57BL/6J fareler (Malzeme Tablosuna bakınız) kullanıldı. Aşağıda açıklanan tüm adımlar oda sıcaklığında gerçekleştirilir.
1. Kas hücresizleştirme
- Fosfat tamponlu salin (PBS) içinde% 1 w / v sodyum dodesil sülfat (SDS; Malzeme Tablosuna bakınız) çözeltisi hazırlayın. Çözeltiyi tamamen karışana kadar karıştırın.
NOT:% 1 SDS toplu olarak hazırlanabilir ve oda sıcaklığında 1 ay saklanabilir. - İlgilenilen kas(lar)ı daha önce tarif edildiği gibi inceleyin38,39.
- Saçı ve cildi %70 etanol solüsyonu ile ıslatarak ilgilenilen kasları açığa çıkarın, ardından yaklaşık 2 cm'lik bir transkutanöz kesi yapın ve ardından kaplama derisini forseps ve yaylı makasla çıkarın.
NOT: Burada ilgilenilen kas(lar) tibialis anterior (TA), ekstansör digitorum longus (EDL) ve diyaframı içerir. Bazı kaslar, diğer kasların diseksiyonunu gerektiren diğer kas sisteminin derinliklerinde yer alabilir (örneğin, EDL'nin diseksiyonu TA'nın çıkarılmasını gerektirir). - Kasın tüm boyutunun elde edildiğinden ve kenarların pürüzsüz olduğundan emin olmak için keskin makas veya bıçaklar kullanarak ilgilenilen kas(lar)ı inceleyin ( Malzeme Tablosuna bakın).
NOT: Bu, görselleştirmeyi iyileştirmek için ideal olarak bir diseksiyon mikroskobu altında yapılır. - Kemik parçaları veya pürüzlü kenarlar olmadığından emin olmak için kasları inceleyin, ardından gerektiğinde bunları keskin bir makasla kesin.
- Analitik bir terazi kullanarak kası tartın ve ağırlığı kaydedin.
- Saçı ve cildi %70 etanol solüsyonu ile ıslatarak ilgilenilen kasları açığa çıkarın, ardından yaklaşık 2 cm'lik bir transkutanöz kesi yapın ve ardından kaplama derisini forseps ve yaylı makasla çıkarın.
- Diseke kası, miligram ağırlık başına en az 0.1 mL% 1 SDS'ye yerleştirin; 6, 12 veya 24 oyuklu plakalar sırasıyla diyafram, TA ve EDL fare kasları için iyi çalışır. Tipik hacimler 6, 12 ve 24 oyuklu plakalar için sırasıyla 6 mL, 3 mL ve 1.5 mL'dir.
NOT: SDS solüsyonu bazen kasların deforme olmasına neden olur, bu nedenle ilk daldırmada kasın düz/uzatılmış olduğundan emin olun. - Kuyu plakasını (veya diğer kapları) 50-80 Hz'e ayarlanmış sallanan bir çalkalayıcıya yerleştirin.
- SDS çözümünü periyodik olarak görsel olarak inceleyin. Çözelti bulanıklaştığında, çözeltiyi bir pipetle çıkarın (kası aspire etmemeye dikkat edin) ve eşit hacimde taze% 1 SDS ile değiştirin. Çözüm 24 saat boyunca berrak kaldığında, hücreden arındırma tamamlanır.
NOT: Solüsyon değişiklikleri için gereken sıklık, kas boyutuna ve ilk solüsyon hacmine göre değişir. TA gibi daha büyük kaslar birkaç saat içinde yeni SDS'ye ihtiyaç duyar ve EDL gibi daha küçük kaslar orijinal çözümde bir gecede gidebilir. - Son SDS solüsyonunu bir pipetle (kası aspire etmemeye dikkat ederek) hücrelerden arındırılmış kaslardan çıkarın ve eşit hacimde PBS ile değiştirin.
- Hücrelerden arındırılmış kasları diseksiyon mikroskobu altında görsel olarak inceleyin ve kasa yapışmış kıl veya kalıntıları çıkarmak için forseps ve makas kullanın.
NOT: Ayrıca, bu adımda hücreden arındırılmış kasın netliğine dikkat edin. Hücreden arındırılmış kas tamamen şeffaf değilse ve SDS çözeltisi 24 saat boyunca bulanıklıkta artmazsa, hücreden arındırma verimli olmamıştır. Bu, kalitatif ve kantitatif değerlendirmelerde bir artefakt oluşturur ve bu nedenle, deneysel kaslara geçmeden önce uygulama örneklerinde hücreden arındırma her zaman optimize edilmelidir. - PBS'yi dikkatlice çıkarın, eşit hacimde% 3.7 formaldehit veya% 4 paraformaldehit çözeltisi ile değiştirin ve plakayı 24 saat boyunca sallanan çalkalayıcıya geri koyun.
NOT: Formaldehit çözeltisinin hücrelerden arındırılmış kası tamamen kapladığından emin olun, aksi takdirde lekelenme düzensiz olacaktır.
2. IMAT'in Yağ Kırmızısı O ile Görselleştirilmesi
- Bir ORO çözeltisi hazırlayın.
- Bir stok çözeltisi oluşturmak için 0.5 g ORO tozunu ( Malzeme Tablosuna bakınız) 100 mL izopropanol içinde çözün.
NOT: Tamamen çözünmesi için çözeltiye hafif ısı ekleyin. Bu stok oda sıcaklığında 1 ay saklanabilir. - En az 0.1 mL / mg kas ağırlığı hacmi kullanarak tüm kaslar için gerekli çalışma solüsyonunu elde etmek için ORO stok solüsyonunu ve deiyonize suyu 60:40 oranında birleştirin. Tipik hacimler 6, 12 ve 24 oyuklu plakalar için sırasıyla 6 mL, 3 mL ve 1.5 mL'dir.
NOT: Karıştırmadan önce stok çözeltiyi inceleyin. Stok çözeltisi önemli miktarda partikül içeriyorsa, taze stok yapın. - Partikülün yerleşmesini sağlamak için çalışma solüsyonunu 10 dakika boyunca örtün.
- Çalışma solüsyonunu 40 μm'lik bir ağdan ve ardından 0.22 μm'lik bir şırınga filtresinden süzün.
NOT: 0.22 μm şırınga filtresi hızla tıkanır ve çalışma solüsyonu kolayca geçmezse değiştirilmelidir.
- Bir stok çözeltisi oluşturmak için 0.5 g ORO tozunu ( Malzeme Tablosuna bakınız) 100 mL izopropanol içinde çözün.
- Formaldehit veya paraformaldehit çözeltisini çıkarın ve hücrelerden arındırılmış kasları eşit hacimde PBS'nin üç çözelti değişikliği ile yıkayın.
- PBS'yi eşit hacimde% 60 izopropanol çözeltisi ile değiştirin ve 5 dakika boyunca sallanan bir çalkalayıcı üzerinde inkübe edin.
- % 60 izopropanol çözeltisini ORO çalışma çözeltisi ile değiştirin ve sallanan çalkalayıcı üzerinde 10 dakika inkübe edin.
NOT: ORO çalışma solüsyonunun hücreden arındırılmış kası tamamen kapladığından emin olun, aksi takdirde lekelenme düzensiz olacaktır. - ORO çalışma solüsyonunu eşit hacimde% 1 SDS ile değiştirin. SDS çözümünü periyodik olarak görsel olarak inceleyin. Solüsyon gözle görülür şekilde pembeleştiğinde, solüsyonu bir pipetle çıkarın (kası aspire etmemeye dikkat edin) ve taze% 1 SDS ile değiştirin.
- Çözelti 24 saat boyunca berrak kaldığında,% 1 SDS'yi PBS ile değiştirin ve lekeli kası 4x büyütmede diseksiyon / stereo mikroskop altında inceleyin. Kasın dışına yapışmış belirgin kalıntıları veya partikülleri temizleyin. Bu kapsamlıysa, hücreden arındırılmış kas, döküntüleri/partikülü çıkarmak için bir temizleme dokusu üzerinde hafifçe yuvarlanabilir.
- Boyama tatmin ediciyse (saydam bir matriste yüzen parlak kırmızı küreler), stereo mikroskoba bağlı bir kamera kullanarak istediğiniz gibi boyamanın görüntülerini elde edin (bkz.
NOT: Diseksiyon mikroskobunun takılı bir kamerası yoksa, göz merceğinden fotoğraf çekmek için bir telefon kamerası kullanılabilir.
3. IMAT lipid damlacıklarının BODIPY ile görselleştirilmesi
NOT: Konfokal görüntüleme en çok EDL veya diyafram (~2 mm kalınlık) gibi ince kaslarda etkilidir. Alternatif olarak, TA gibi karşılaştırılabilir kalınlıktaki kas şeritleri kullanılabilir.
- En az 0.1 mL/mg kas ağırlığında bir çalışma çözeltisi hacmi elde etmek için PBS'de 1:200'lük bir floresan BODIPY 493/503 çözeltisi ( Malzeme Tablosuna bakınız) hazırlayın. Tipik hacimler 6, 12 ve 24 oyuklu plakalar için sırasıyla 6 mL, 3 mL ve 1.5 mL'dir.
- Formaldehit, paraformaldehit veya% 1 SDS'yi çıkarın ve hücrelerden arındırılmış kasları eşit hacimde PBS'nin üç çözelti değişikliği ile yıkayın.
- PBS'yi BODIPY çalışma solüsyonu ile değiştirin ve sallanan çalkalayıcı üzerinde 20 dakika inkübe edin.
- Hücrelerden arındırılmış kasları, eşit hacimde PBS'nin üç çözelti değişikliği ile yıkayın.
- Kası, mevcut bir konfokal mikroskopla uyumlu şeffaf tabanlı bir kaba yerleştirin. İdeal olarak, çanak, kasın üzerine deforme etmeden bir lamel yerleştirmek için girintili bir tabana sahip olacaktır (bkz.
- 488 lazeri kullanarak standart bir konfokal mikroskopla (Malzeme Tablosuna bakın) görüntü yığınları elde edin. Bir EDL için tipik yığın boyutları, 10 μm dilim kalınlığına sahip 0,5-1 mm'dir ve yığın başına 50-100 görüntü verir.
NOT: Toplam lipid hacmini, toplam IMAT lipid damlacıklarının sayısını ve en yakın komşu kümelenme indeksini ölçmek için, görüntü kaydı için bir miktar örtüşme bırakmaya dikkat ederek tüm kas hacmi boyunca görüntü oluşturun. Ortalama lipid damlacık hacmini ölçmek için bir yığın yeterli olabilir. - İstenirse, IMAT dağılımının tamamlayıcı bir tüm kas görüntüsü için kasları bölüm 2'ye göre ORO ile boyayın.
NOT: BODIPY floresan olduğundan, ORO görüntüleri elde edildiğinde ışık mikroskobu altında görülmeyecektir.
4. Lipid ekstraksiyonu ile toplam lipid hacminin tahmini
- Görüntü elde edildikten sonra, kasları 96 oyuklu bir plakanın ayrı oyuklarında 200 μL izopropanole aktarın veya kas sığamayacak kadar büyükse kuyuyu/hacmi uyarlayın.
- Plakaya vurarak, çözeltiyi yukarı ve aşağı pipetleyerek ve/veya mikroskop altında hücreden arındırılmış kasta kırmızı/floresan küreler görülmeyene kadar kası bir pipet ucuyla mekanik olarak ezerek çözeltiyi çalkalayın.
NOT: En iyi güvenilirlik için tüm kaslara aynı dokunma, pipetleme ve ezme kombinasyonu uygulayın. Ayrıca, izopropanol hızla buharlaşacağından, kılavuz çekme, pipetleme ve ezme için harcanan süreyi sınırlamaya dikkat edin. - Çözeltiyi her bir kuyucukta yukarı ve aşağı pipetleyerek karıştırın, ardından 75 μL'yi plakanın iki temiz kuyusuna aktarın.
- Plakayı örtün ve bir spektrofotometre veya plaka okuyucu kullanarak yinelenen 75 μL'lik kuyucukların absorbansını okuyun. Yapı ORO ile boyanmışsa, çözeltiyi 500 nm'de okuyun; BODIPY 493/503 ile boyanmışsa, plakayı 493 nm'de okuyun.
NOT: Yapı hem BODIPY hem de ORO ile boyanmışsa, plakanın 500 nm'de okunması önerilir, çünkü 500 nm'lik okumalar yalnızca ORO ve ORO artı BODIPY ile boyanmış yapılar arasında benzer sonuçlar verir. - Numuneler arasındaki boyut farklılıklarını düzeltmek istenirse, absorbans okumasını kasın kaydedilen ağırlığına bölün.
5. Konfokal görüntülerden IMAT lipid damlacık ölçümlerinin ölçülmesi
NOT: Bu bölüm, ImageJ sürüm 1.47 ( Malzeme Tablosuna bakın) veya sonraki bir sürümüne ve temel ImageJ becerilerine40 erişim gerektirir.
- ImageJ'de konfokal yığınları açın.
NOT: Farklı konfokal mikroskoplar, konfokal görüntüleri farklı formatlarda kaydedebilir. ImageJ, yığınları41 açmak için Fiji gibi ek bir eklenti veya varyant gerektirebilir. Kullanılan algoritmalar ImageJ yazılım paketinin bir parçasıdır. - BODIPY pozitif pikselleri tanımlamak için ImageJ'de bir eşik algoritması çalıştırın. Bu, geçerli görüntüyü ikili görüntüye dönüştürür.
- Görüntü > Eşiği Ayarla'yı seçerek eşik kullanıcı arabirimini açın > Eşiği Ayarla. Kullanıcı arabiriminde, eşik türü olarak Modlararası'yı seçin ve Koyu arka planın seçili olduğundan emin olun. Başka bir seçeneğin seçilmesine gerek yoktur. Ardından Uygula'ya tıklayın.
- Yığını ikiliye dönüştürmek için bir iletişim kutusu açılır. Aşağıdaki seçeneklerin seçili olduğundan emin olun: Yöntem: Modlararası; Arka plan: Karanlık. Her görüntü ve siyah arka plan (ikili maskeler) için eşiği hesaplayın. Bu, beyazın BODIPY pozitif pikselleri ve siyahın BODIPY negatif pikselleri gösterdiği bir ikili yığın oluşturur.
NOT: Modlar arası eşik algoritması tüm kullanıcılar için en iyi seçim olmayabilir. ImageJ'in yerleşik eşik seçeneklerinin öznel incelemesi, BODIPY pozitif ve negatif pikselleri ayırmak için en uygun algoritmanın seçilmesine yardımcı olur.
- Dokunan lipid damlacıklarını ayırmak için ImageJ'de Watershed algoritmasını çalıştırın. İkili > Havza> İşlem'i seçin. Yığındaki tüm görüntülerin işlenmesi gerekip gerekmediğini soran bir iletişim kutusu açılır. Evet'i seçin. Bu, daha geniş düz beyaz alanları bölen ince siyah çizgiler ekler.
- ImageJ'deki Parçacıkları Analiz Et algoritması ile yatırım getirilerini belirleyin.
- Analiz Et > Parçacıkları Analiz Et'i seçin. Seçim ayarlarını yapmak için bir iletişim kutusu açılır.
NOT: Boyut aralığının seçilmesi, lipid damlacık ROI'lerinin en iyi tahminini elde etmek için kritik öneme sahiptir. Alt sınır, IMAT'tan türetilen lipid damlacıkları (arka plan artefaktları) olamayacak kadar küçük olan bölgeleri ortadan kaldırır ve üst sınır, tek bir IMAT'tan türetilen lipid damlacıkları olamayacak kadar büyük olan bölgeleri (Watershed algoritması tarafından ayrılmamış lipit damlacıklarına dokunmak) ortadan kaldırır. - Bu değerleri ayarlamak için, orijinal görüntüyü açın ve Oval aracını kullanarak görünümdeki en küçük ve en büyük lipit damlacığının ana hatlarını çizin. Ardından, "t" yazarak bu şekilleri ROI yöneticisine ekleyin. Analiz Et'i ve ardından Ölçümleri Ayarla'yı seçin. Ayarların seçilmesi için bir iletişim kutusu açılır.
- Yalnızca alan'ı işaretleyin ve Tamam'a tıklayın. Ardından, ROI Yöneticisi'nden Ölç'ü seçin. Bu Sonuçlar penceresindeki iki alan ölçüsünü Parçacıkları Analiz Et'te boyut aralığı olarak kullanın.
- Yöneticiye Ekle'nin işaretli olduğundan emin olun. Başka seçeneğe gerek yoktur.
- Analiz Et > Parçacıkları Analiz Et'i seçin. Seçim ayarlarını yapmak için bir iletişim kutusu açılır.
- ROI Yöneticisi'nde Tümünü Göster'i işaretleyerek ROI'leri konfokal yığının üzerine yerleştirin. Her yığın dilimini ayrı ayrı incelemek için kaydırma çubuğunu kullanın ve Oval aracını (ImageJ araç çubuğunda bulunur) kullanarak eksik bölgeleri elle ekleyin.
- ROI ölçümlerinin çıktısını alın. Analiz Et > Ölçümleri Ayarla'yı seçin ve Alan, Centroid, Elipse sığdır ve Yığın konumu'nu seçin. Tamam'a tıklayın. Ardından, ROI Yöneticisi'nden Ölç'ü seçin. Sonuçlar tablosundaki veriler seçilebilir ve daha fazla analiz için Matlab veya Excel'e kopyalanabilir.
- Refine.m Matlab kodu37 veya benzer bir algoritma kullanarak her yığındaki ROI'leri tek bir ROI'ye daraltın.
NOT: Bu adım, 5.2-5.4 arasındaki adımlar, bitişik dilimlerdeki aynı lipid damlacığını farklı ROI'ler olarak tanımladığı için gereklidir. Bununla birlikte, ROI'ler alternatif olarak yalnızca elle tanımlanabilir veya Matlab'a olan ihtiyacı önlemek için yinelenen ROI'ler ImageJ'de elle ortadan kaldırılabilir. - Matlab veya Excel kullanarak ROI'deki özet istatistikleri elde edin.
- Toplam lipid damlacıkları sayısını, toplam ROI sayısı olarak tahmin edin.
- Şeklin derinliğinin elipsin ana ve küçük eksenlerinin ortalaması olduğunu varsayarak, lipid damlacık hacmini her 2D ROI'ye takılan elipsin hacmi olarak tahmin edin.
- Bireysel tahmini lipid damlacık hacimlerinin toplamı olan toplam lipid hacmini tahmin edin.
Sonuçlar
İskelet kası yağ infiltrasyonunun kalitatif görselleştirilmesi
Uygun şekilde hücrelerden arındırılmış kaslar beyaz ve yarı saydamdır (bölüm 1; Şekil 1). IMAT'ı görselleştirmek için hücrelerden arındırılmış kaslar ORO ile boyandığında (bölüm 2), IMAT lipid damlacıkları berrak kas yapılarında kırmızı küreler halinde görülür (Şekil 1). Sağlıklı fare arka bacak kasları, çok az veya hiç kırmızı ORO pozitif lipid ile kanıtlanan çok az doğal IMAT'a sahiptir (Şekil 1A). Karşılaştırıldığında, arka bacak kaslarına kardiyotoksin enjekte edildi (CTX; Şekil 1B) veya gliserol (GLY; Şekil 1C) Hücresizleştirmeden 14 gün önce, daha önce belirtildiği gibi GLY'ye kıyasla CTX'i takiben daha büyük bir IMAT konsantrasyonu ile daha yüksek bir IMAT birikimine sahiptir37.
Eksik hücre giderme, ilk SDS tedavisinden hemen sonra veya ORO boyamanın yarı opak, açık pembe lifler olarak yıkanmasından sonra tanımlanabilir (Şekil 2B ile Şekil 2A karşılaştırıldığında). ORO'nun eksik klincesi, ORO'nun yıkanmasından sonra, farklı lif çizgileri yerine pembe veya kırmızı tek tip bir arka plan olarak tanımlanabilir (Şekil 2C). Şekil 2A,B ayrıca, hücreden arındırılmış kasın dışında bir lipit damlacıkları kümesi olan epimüsküler yağ (yıldız) içerir. Şekil 2C ayrıca, hücrelerin giderilmesi sırasında kasların yayılmaması durumunda meydana gelebilecek kas katlanmasını da göstermektedir. Eksik decellularizasyon, eksik ORO klerensi ve rezidüel epimüsküler yağ, ekstrakte edilen lipidin (OD) değerini yapay olarak arttırır, ancak bir artefakt olarak kabul edilirse, yağ infiltrasyonunun kalitatif değerlendirmesini mutlaka engellemez.
İskelet kası yağ infiltrasyonunun kantitatif görüntülenmesi
BODIPY floresan etiketli lipid damlacıkları, bireysel lipid damlacık ölçümlerinin ve dağılımının daha ayrıntılı bir değerlendirmesi için konfokal mikroskopi ile görüntülenebilir (Şekil 3). Bu işlem, Matlab kodu37 dahil olmak üzere daha önce açıklandığı gibi yarı otomatiktir. İyi BODIPY boyama, düzlemde görüntülendiğinde komşu şekillerden ayrılan parlak eliptik şekillerle sonuçlanır (Şekil 3A). Eşikleme ve şekil segmentasyonu, her lipid damlacığı için ROI oluşturmak için iyi bir ilk geçiş sağlar (Şekil 3B), ancak hataları düzeltmek için manuel düzenlemeler gerekir. En yaygın hata, dokunun derinliklerinde bulunan ve bu nedenle herhangi bir dilimde parlak olmayan lipid damlacıklarıdır (Şekil 3B; pembe çift oklar). Bu, ImageJ'deki Oval aracı kullanılarak ROI'leri elle ekleyerek giderilebilir (Şekil 3C). İkincisi, bir grup lipid damlacığını tek bir ROI olarak tanımlamaktır (Şekil 3B; kırmızı yıldız). Bu, orijinal yatırım getirisini silerek ve birden çok yeni yatırım getirisi ile değiştirerek düzeltilebilir (Şekil 3D). Son olarak, tek bir lipit damlacığı birden çok dilimde benzersiz bir yatırım getirisi olarak tanımlanır, bu nedenle yinelenen yatırım getirilerinin tek bir yatırım getirisinde birleştirilmesi gerekir (Şekil 3E; mavi ok). Bu, Matlab gibi bir veri işleme aracı kullanılarak en kolay şekilde yapılır, ancak en büyük yatırım getirisini belirleyerek ve geri kalanını silerek elle de yapılabilir. C57BL6/J ve 129Sv faredeki her metrik için ortalama değerler Biltz ve ark.37'de bulunabilir.
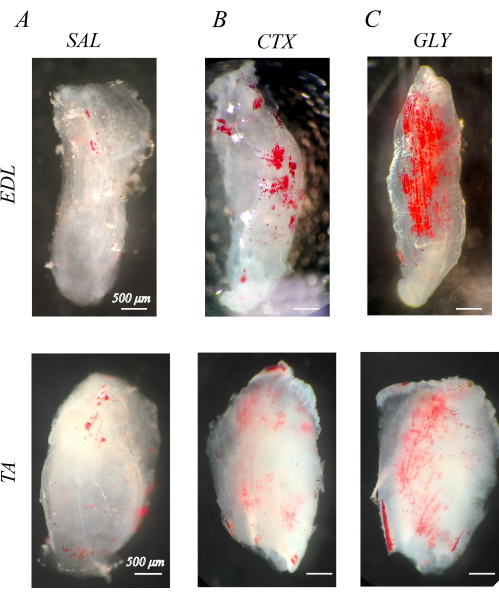
Şekil 1: Örnek yağ kırmızısı O (ORO) hücresi decellularize kasların boyanması. Enjeksiyondan 14 gün sonra salin (SAL), kardiyotoksin (CTX) veya gliserol (GLY) ile ORO lekeli kaslar. Fare ekstansör digitorum longus (EDL) ve tibialis anterior (TA) kasları, SAL tedavisi (A) ile çok az IMAT'a (kırmızı küreler) sahiptir, ancak CTX (B) ve GLY (C) tedavisine yanıt olarak IMAT biriktirir. Şeffaf beyaz bir kas arka planında farklı ORO pozitif lipid damlacıkları ile kanıtlanan tam bir hücreden arındırma ve ORO yıkanması vardır. Ölçek çubukları = 500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
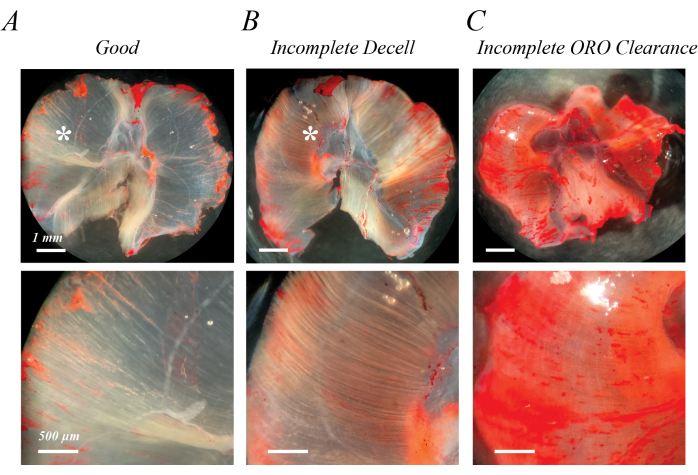
Şekil 2: Kötü ORO boyama sonuçlarına örnekler. Eksik hücre giderme veya eksik ORO açıklığı, yarı opak pembe/kırmızı bir arka plana yol açar. Tamamen hücreden arındırılmış fare diyafram kasının (A) şeffaf beyaz arka planı ile karşılaştırıldığında, eksik hücre dışı hücre dışı bırakma, açık pembe / kırmızı fiber izleri (B) ile karakterize edilir ve eksik ORO klirensi, dağınık pembe / kırmızı bir arka plan (C) ile karakterize edilir. Ölçek çubukları: üst paneller = 1 mm; Alt paneller = 500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
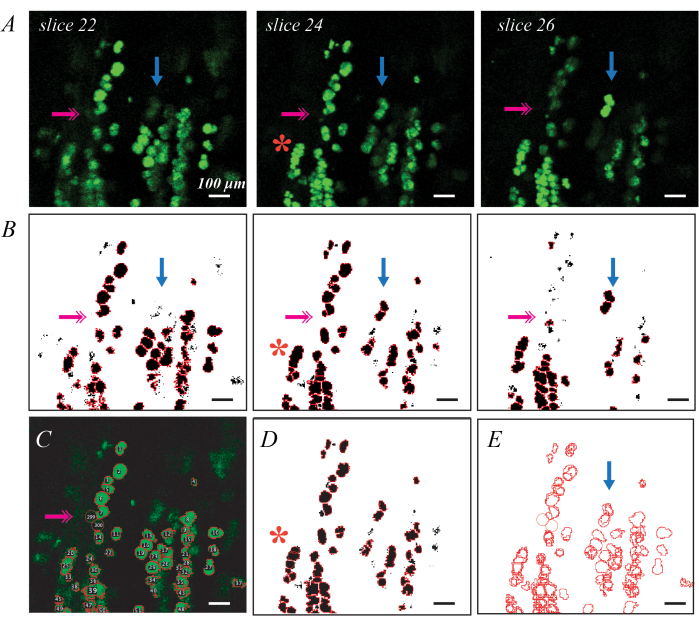
Şekil 3: Floresan BODIPY boyama ve konfokal mikroskopi ile bireysel lipid damlacığı tanımlama örnekleri Konfokal mikroskopi kullanılarak hücreden arındırılmış kaslarda bireysel BODIPY boyalı lipid damlacıkları tanımlanabilir ve ölçülebilir. Konfokal bir yığın boyunca tek tek dilimler, düzlemdeki lipit damlacıklarını parlak yeşil elipsler olarak ve düzlemden çıkan lipid damlacıklarını daha soluk şekiller (A; mavi oklar) olarak gösterir. Havza nesnesi segmentasyonu ve ROI tanımlaması ile birlikte eşikleme, BODIPY lekeli ROI'leri (B) haritalayabilir. Eşikleme, elle tanımlamayı gerektiren bazı daha sönük lipid damlacıklarını (B; pembe çift ok) gözden kaçırabilir (C). Havza segmentasyonu, birkaç lipid damlacığını bir arada gruplandırabilir (B; kırmızı yıldız), bu da ROI'nin silinmesini ve elle yeniden tahmin edilmesini gerektirir (D). Aynı lipid damlacığı, yinelenen ROI'leri silmek için görüntü kaydı (E) gerektiren birden çok dilimde tanımlanır. Ölçek çubukları = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu makale, kas içi yağ dokusu (IMAT) gelişimi ve patolojik genişlemenin patogenezini daha iyi anlamak için uygulanabilecek küçük hayvan modellerinde iskelet kası yağ infiltrasyonunu kalitatif olarak görselleştirme ve ölçme yöntemlerini açıklamaktadır. Tüm kas hücreden arındırma ve yağda çözünen boyamanın kullanılması, tüm kaslarda IMAT varlığını kapsamlı bir şekilde değerlendirmek için uygun maliyetli, tekrarlanabilir ve basit bir metodoloji sağlar.
Bu protokolün temeli, kasın SDS ile hücreden arındırılmasının, IMCL'nin küçük lipid damlacıkları da dahil olmak üzere miyoliflerin hücresel bileşenlerini uzaklaştırması, ancak intramiyoselüler adipositlerdeki büyük lipid damlacıklarını yedeklemesidir. SDS, matrisleri hücreden arındırmak için doku mühendisliğindeyaygın olarak 42 kullanılmıştır. Yağ ve iskelet kası gibi dokular tipik olarak kalıntı adiposit lipidini çıkarmak için ek mekanik ayrışma ve/veya alkol ekstraksiyonu gerektirir42,43. Bunun nedeninin, SDS ile hücre çözmenin IMCL'yi ortadan kaldırırken, adipositlerdeki büyük lipid damlacığını koruduğunu daha önce göstermiştik37. μCT ile osmiyum tetroksit ile boyanmış sağlam kasların hücreden arındırma öncesi ve sonrası görüntülenmesi, IMAT'ın uzamsal modelinin hücreden arındırma tarafından bozulmadığını doğruladı. Ayrıca, ihmal edilebilir IMAT ile hücreden arındırılmış bir kasta kas içi trigliserit miktarı, sağlam kas değerlerinin ~%5'i idi ve IMCL'nin çıkarılmasını doğruladı. Bu nedenle, bu metodoloji IMAT lipid damlacıklarını yarı saydam bir kas matriksi aracılığıyla orijinal anatomik dağılımlarında tutar.
Uygun hücre çözme, bu protokoldeki en kritik adımdır. Hücre çözme tamamlanmamışsa, IMAT lipid damlacıklarının görselleştirilmesi zor olacak ve artık IMCL, ORO veya BODIPY ile yüksek arka plan lekelenmesine neden olacaktır (Şekil 2). Deneyimsiz kullanıcılar tarafından yapılan yaygın hatalar, kas başına (her bir kuyucuk içinde) yetersiz SDS kapsamıdır, öyle ki her kas SDS solüsyonunda tamamen kaplanmaz, hücreden arındırma sırasında solüsyonu çalkalamak için bir rocker kullanmamak ve solüsyon değişikliklerini yeterince sık yapmamaktır. Bu yazıda, birim kas kütlesi başına gereken SDS miktarını önerdik, ancak her kasın kendine özgü bir geometrisi olduğundan, kullanıcının yine de kasların tamamen solüsyonlarla kaplandığından emin olması gerekecektir. Kullanıcıların ayrıca, hücre gidermenin tamamlandığından emin olmak için çözümleri serbestçe (günde iki defaya kadar) değiştirmeleri önerilir. IMAT lipid damlacıklarının kaliteli boyanması, 4 gün kadar süren SDS tedavisinden sonra elde edilmiştir. Yüksek kaliteli ORO boyama sonuçları için yeterli fiksasyon ve ORO solüsyonu hazırlığı da önemlidir. Yukarıda tarif edilen SDS tedavisine benzer şekilde, her kas örneği için% 3.7 formaldehit çözeltisinin yeterli kapsamı gereklidir. Kas fiksatiften çok erken çıkarılırsa, lipit damlacıkları sadece ORO ile zayıf bir şekilde lekelenir. Toplam 1-2 saat yeterli olmalıdır, ancak fiksatifin kasın merkezine nüfuz etmesini ve tüm lipit damlacıklarını tamamen sabitlemesini sağlamak için gece boyunca fiksasyon önerilir. ORO boyama ile ilgili ek bir zorluk, alkol konsantrasyonu% 60'a düştüğünde bir partikülün oluşmaya başlamasıdır. Bu partikül yüzeye yerleşebilir ve kas sınırında sıkışabilir. Bunu önlemenin en iyi yolu, her boyama için yeni bir çalışma solüsyonu yapmak ve hem 40 gözenekli μm hem de 0,22 μm filtreler kullanmaktır. Ardından, külbütör ile ajitasyonun sürdürülmesi ve boyama süresinin 10 dakika ile sınırlandırılması, oluşan partikülün çökmesini önlemeye yardımcı olacaktır. Sorun devam ederse, yeni bir ORO stok çözümü yapmak yardımcı olabilir. Hücresellikten arındırılmış kas yüzeyine bir miktar artefakt yapışmış kalırsa, bu artefaktı çıkarmak için bir stereo mikroskop, forseps ve cerrahi makas kullanılabilir. Artefaktların ortadan kaldırılmaması, kasların görüntü kalitesini etkileyecek ve OD okumasına hazırlanırken lipid ekstraksiyon kısmı sırasında IMAT içeriğini abartacaktır.
Genel olarak, bu teknik basittir ve iskelet kası yağ infiltrasyonunu görselleştirmek ve ölçmek için altın standart yöntemlere göre çeşitli avantajlar sunar. İnsanlarda ve bazen hayvan modellerinde yaygın olarak kullanılan BT, MRI ve US gibi noninvaziv teknikler sınırlı uzamsal çözünürlüğe sahiptir ve lipid damlacıklarını kas liflerinden ayırt edemez. Bu nedenle, ara sinyal yoğunluğuna sahip bir piksel veya voksel "kas" veya "yağ" olarak atanırken, gerçekte muhtemelen miyoliflerin ve adipositlerin bir karışımıdır. Daha yaygın olarak, hayvan kasında yağ infiltrasyonu histoloji ile, en sık olarak kas kriyoseksiyonlarında ORO ile değerlendirilir. Bununla birlikte, bu tipik olarak yalnızca tek bir temsili bölümde gerçekleştirilir ve bölüm üzerindeki lipit saçılımı nedeniyle ölçülmesi zordur. Buna karşılık, hücreden arındırılmış bir kasın tamamının ORO boyaması, bozulmamış morfoloji ile benzer maliyet ve çabalarla IMAT'ın kapsamlı bir değerlendirmesini sağlar. Ayrıca, görselleştirmeyi geliştirmenin yanı sıra, hücreden arındırmanın ORO boyama, lipid ekstraksiyonu ile yağ infiltrasyonunun ölçülmesini sağlar. Yağ infiltrasyonunun özelliklerine daha derin bir dalış için, konfokal mikroskopi ile birlikte bir floresan leke olan BODIPY kullanılabilir. Bu, 3 boyutlu manzarayı haritalamak için tek tek IMAT lipid damlacıklarının yeniden yapılandırılmasını sağlar, bu da kasın uzunluğu boyunca kesitler analiz edilmediği sürece histoloji ile mümkün değildir. Konfokal mikroskop standart laboratuvar ekipmanı olmasa da, bir üniversite veya endüstri ortamında küçük hayvan MRI veya BT'den daha erişilebilir olması daha olasıdır. Ayrıca, bu sürecin çoğu otomatikleştirilebilir ve sıralı histolojiye kıyasla zaman maliyetini azaltır. Konfokal mikroskoptaki ayarların optimize edilmesi, BODIPY boyama için ek bir husustur. Bunlar her mikroskop için benzersizdir. Kritik değer, kasın uzak yüzeyindeki lipid damlacıklarını tespit edecek kadar yüksek olması ve aynı zamanda yakın taraftaki lipid damlacıklarından gelen sinyali doyurmaması gereken lazer yoğunluğudur. Bu nedenle, konfokal mikroskopi ile BODIPY boyamanın kullanılmasının, EDL veya diyafram dahil olmak üzere daha ince kaslar için en uygun olduğu önerilmektedir.
Bu yaklaşımın bazı sınırlamaları tartışmayı hak eder. İlk olarak, bu tekniğin burada sunulan farelerde yaralanma modellerinin (kardiyotoksin ve gliserol) ötesinde geniş bir uygulanabilirliğe sahip olması beklenirken, yeni uygulamalar (örneğin, mdx modeli) optimizasyon gerektirebilir, çünkü kasın boyutu ve bileşimi (örneğin, fibroz) hücreselleşmeyi etkileyebilir, SDS konsantrasyonunun veya inkübasyon sürelerinin artmasını gerektirebilir. Değişmiş kas kütlesine sahip diğer hastalık modelleri, daha anlamlı bir sonuç ölçüsü sağlamak için mutlak lipid miktarını veya kas hacmine göre lipit yüzdesini belirlemek için hem mutlak hem de normalleştirilmiş (kas kütlesine) yağ infiltrasyonu ölçümlerinin analizini gerektirecektir. Ayrıca, bu tekniğin daha büyük hayvan modellerine ve insan biyopsilerine geniş çapta uygulanabilir olması beklenmektedir, ancak bu, her yeni uygulama için optimizasyon gerektirebilir. İkincisi, bu stratejide, tüm kas bu teste adanmalıdır ve başka bir patolojik özelliği değerlendirmek için kullanılamaz. IMAT'taki longitudinal değişiklikleri değerlendirmeyi amaçlayan çalışmalara noninvaziv görüntüleme teknikleri ile daha iyi hizmet verilirken, birincil amacı kası başka amaçlar için (histoloji, kantitatif polimeraz zincir reaksiyonu, western blotting) gerektiren çalışmalara histolojik değerlendirme daha iyi hizmet vermektedir, çünkü donmuş kasın geri kalanı diğer tahlillere tahsis edilebilir. Bununla birlikte, bu tahlil, koşu bandı koşusu veya ex vivo kasılma testi gibi in vivo testlerle eşleştirmek için çok uygundur, çünkü bu önlemler hücreden arındırmadanönce yapılabilir 44. Üçüncüsü, konfokal mikroskopi ile BODIPY boyasının kullanılması, lipid damlacıklarının yüksek çözünürlüklü görselleştirilmesini ve miktar tayinini sağlasa da, hücre zarı çıkarıldığı ve endojen adiposit proteinleri kaybolduğu için lipid damlacıklarını tek tek adipositler olarak kesin olarak tanımlayamaz. Olgunlaşmamış adipositleri veya "kahverengi/bej" fenotipini temsil eden multiloküler adipositler, çoklu lipid damlacıkları olarak tanımlanabilir. Son olarak, protokol daha önce donmuş kas üzerinde iyi çalışmaz. Bu sınırlamalar muhtemelen insan biyopsileri için en derin olanıdır, çünkü tüm biyopsi hücreden arındırılabilirken, biyopsideki IMAT'ın uzamsal dağılımının histolojik bir dilimden daha fazla tüm kası temsil etmesi muhtemel değildir. Bununla birlikte, bu teknik, dondurulmamış biyopsi işleme koşullarına nispeten duyarsız olduğundan (örneğin, PBS'de buz üzerinde saatler), biyopsi daha sonra, bireysel lipid damlacıklarının daha iyi bir şekilde çözülmesini sağlayacak olan hücreselsizleştirme için bir kısım da dahil olmak üzere çeşitli tahliller için bölünebilir.
Sonuç olarak, iskelet kası yağ infiltrasyonunun kalitatif ve kantitatif analizi için yeni bir yöntem, hücreden arındırılmış yapıların tutulan lipidinin boyanması ve görüntülenmesi ile geliştirilmiştir. Bu metodoloji, kas içindeki üç boyutlu yağ infiltrasyonunun kapsamlı bir şekilde görüntülenmesini ve ORO boyama ile hızlı, ucuz nicelemeyi mümkün kıldığı için altın standart yaklaşımlara göre iyileştirmeler sunar. Daha ayrıntılı ölçümler için, ikinci bir yağda çözünen BODIPY boyası, konfokal mikroskopi ile görüntülendiği gibi, lipid damlacık sayısının, hacminin ve dağılım modelinin daha ayrıntılı bir miktarını sağlar. Birlikte, bu önlemler araştırmacılara, örnekleme veya pahalı noninvaziv görüntüleme olmadan bireysel lipid damlacıkları düzeyinde iskelet kası yağ infiltrasyonunu hassas bir şekilde ölçmenin bir yolunu sağlar.
Açıklamalar
Yazarların ifşa edecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma R01AR075773 to GAM tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 µm Syringe Filter | Fisher Scientific | SLGP033RS | |
| 1 mL LuerLock Syringes | Fisher Scientific | 14823434 | |
| 12 mm Coverslips | Fisher Scientific | 12545F | |
| 12 well plates | Fisher Scientific | 08-772-29 | |
| 24 well plates | Fisher Scientific | 08-772-1H | |
| 2-Propanol (Isopropanol) | Sigma Aldrich | I9516 | 0.5 mg/mL stock solution can be stored at room temperature for 1 month. Working solution must be made fresh. |
| 37% Formaldehyde Solution | Sigma Aldrich | 8187081000 | |
| 40 µm Mesh Filter | Fisher Scientific | 87711 | |
| 6 well plates | Fisher Scientific | 08-772-1B | |
| 96 well plates | Fisher Scientific | 08-772-2C | |
| BODIPY 493/503 | Fisher Scientific | D-3922 | |
| C57BL/6J Mice | Jackson Laboratory | 000664 | |
| Confocal Imaging Dish | VWR | 734-2905 | |
| Confocal Microscope | Leica | TCS SPEII | |
| Dissecting/stereo Microscope | Zeiss | 4107009123001000 | |
| Dissection scissors | Fine Science Tools | 14060-09 | |
| Dumont #5 forceps | Fine Science Tools | 11254-20 | |
| Ethanol | Fisher Scientific | 033361.K2 | |
| ImageJ | NIH | ||
| Matlab | Mathworks | ||
| Oil Red O Powder | Sigma Aldrich | O0625 | |
| Plate reader | Bio-tek | Synergy II | |
| Rocker/Shaker | Reliable Scientific | 55D | |
| Sodium Dodecyl Sulfate (SDS) | Sigma Aldrich | L3771 | 1% Solution can be stored at room temperature for 1 month |
| Transfer pipettes | Fisher Scientific | 137119D | |
| Vannas spring scissors | Fine Science Tools | 15000-00 |
Referanslar
- Delmonico, M. J., et al. Longitudinal study of muscle strength, quality, and adipose tissue infiltration. The American Journal of Clinical Nutrition. 90 (6), 1579-1585 (2009).
- Goodpaster, B. H., et al. Obesity, regional body fat distribution, and the metabolic syndrome in older men and women. Archives of Internal Medicine. 165 (7), 777-783 (2005).
- Freda, P. U., et al. Lower visceral and subcutaneous but higher intermuscular adipose tissue depots in patients with growth hormone and insulin-like growth factor I excess due to acromegaly. The Journal of Clinical Endocrinology and Metabolism. 93 (6), 2334-2343 (2008).
- Garg, A., Peshock, R. M., Fleckenstein, J. L. Adipose tissue distribution pattern in patients with familial partial lipodystrophy (Dunnigan variety). The Journal of Clinical Endocrinology and Metabolism. 84 (1), 170-174 (1999).
- Gorgey, A. S., Dudley, G. A. Skeletal muscle atrophy and increased intramuscular fat after incomplete spinal cord injury. Spinal Cord. 45 (4), 304-309 (2007).
- Goutallier, D., Postel, J. M., Bernageau, J., Lavau, L., Voisin, M. C. Fatty muscle degeneration in cuff ruptures. Pre- and postoperative evaluation by CT scan. Clinical Orthopaedics and Related Research. (304), 78-83 (1994).
- Liu, W., Liu, Y., Lai, X., Kuang, S. Intramuscular adipose is derived from a non-Pax3 lineage and required for efficient regeneration of skeletal muscles. Developmental Biology. 361 (1), 27-38 (2012).
- Goodpaster, B. H., Thaete, F. L., Kelley, D. E. Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. The American Journal of Clinical Nutrition. 71 (4), 885-892 (2000).
- Elder, C. P., Apple, D. F., Bickel, C. S., Meyer, R. A., Dudley, G. A. Intramuscular fat and glucose tolerance after spinal cord injury-a cross-sectional study. Spinal Cord. 42 (12), 711-716 (2004).
- Albu, J. B., et al. Independent association of insulin resistance with larger amounts of intermuscular adipose tissue and a greater acute insulin response to glucose in African American than in white nondiabetic women. The American Journal of Clinical Nutrition. 82 (6), 1210-1217 (2005).
- Tuttle, L. J., Sinacore, D. R., Mueller, M. J. Intermuscular adipose tissue is muscle specific and associated with poor functional performance. Journal of Aging Research. 2012, 172957(2012).
- Gerber, C., Schneeberger, A. G., Hoppeler, H., Meyer, D. C. Correlation of atrophy and fatty infiltration on strength and integrity of rotator cuff repairs: a study in thirteen patients. Journal of Shoulder and Elbow Surgery. 16 (6), 691-696 (2007).
- Hilton, T. N., Tuttle, L. J., Bohnert, K. L., Mueller, M. J., Sinacore, D. R. Excessive adipose tissue infiltration in skeletal muscle in individuals with obesity, diabetes mellitus, and peripheral neuropathy: association with performance and function. Physical Therapy. 88 (11), 1336-1344 (2008).
- Gaeta, M., et al. Muscle fat-fraction and mapping in Duchenne muscular dystrophy: evaluation of disease distribution and correlation with clinical assessments. Preliminary experience. Skeletal Radiology. 41 (8), 955-961 (2012).
- Buford, T. W., et al. Age-related differences in lower extremity tissue compartments and associations with physical function in older adults. Experimental Gerontology. 47 (1), 38-44 (2012).
- Addona, J., et al. Estimating 3D supraspinatus intramuscular fatty infiltration in older adults: a pilot study. Acta Radiologica. , 2841851221139597(2022).
- Crook, J., et al. Comparison of multifidus muscle intramuscular fat by ultrasound echo intensity and fat-water based MR images in individuals with chronic low back pain. Musculoskeletal Science & Practice. 63, 102717(2023).
- Lee, C., et al. Beige FAPs transplantation improves muscle quality and shoulder function after massive rotator cuff tears. Journal of Orthopaedic Research. 38 (5), 1159-1166 (2020).
- Lee, C., et al. Beige fibro-adipogenic progenitor transplantation reduces muscle degeneration and improves function in a mouse model of delayed repair of rotator cuff tears. Journal of Shoulder and Elbow Surgery. 29 (4), 719-727 (2020).
- Kopinke, D., Roberson, E. C., Reiter, J. F. Ciliary hedgehog signaling restricts injury-induced adipogenesis. Cell. 170 (2), 340-351 (2017).
- Overend, T. J., Cunningham, D. A., Paterson, D. H., Lefcoe, M. S. Thigh composition in young and elderly men determined by computed tomography. Clinical Physiology. 12 (6), 629-640 (1992).
- Li, W., et al. Progression and variation of fatty infiltration of the thigh muscles in Duchenne muscular dystrophy, a muscle magnetic resonance imaging study. Neuromuscular Disorders. 25 (5), 375-380 (2015).
- Davis, D. L., et al. Supraspinatus fatty infiltration on MRI among older adults receiving physical therapy as initial management for clinically suspected rotator cuff tear: A pilot study. Journal of Clinical Imaging Science. 12, 66(2022).
- Salaffi, F., et al. Ultrasound and magnetic resonance imaging as diagnostic tools for sarcopenia in immune-mediated rheumatic diseases (IMRDs). La Radiologia Medica. 127 (11), 1277-1291 (2022).
- Gallagher, D., et al. Adipose tissue in muscle: a novel depot similar in size to visceral adipose tissue. The American Journal of Clinical Nutrition. 81 (4), 903-910 (2005).
- Tuttle, L. J., Sinacore, D. R., Cade, W. T., Mueller, M. J. Lower physical activity is associated with higher intermuscular adipose tissue in people with type 2 diabetes and peripheral neuropathy. Physical Therapy. 91 (6), 923-930 (2011).
- Matsumura, N., et al. Quantitative assessment of fatty infiltration and muscle volume of the rotator cuff muscles using 3-dimensional 2-point Dixon magnetic resonance imaging. Journal of Shoulder and Elbow Surgery. 26 (10), 309-318 (2017).
- Cheuy, V. A., Hastings, M. K., Commean, P. K., Ward, S. R., Mueller, M. J. Intrinsic foot muscle deterioration is associated with metatarsophalangeal joint angle in people with diabetes and neuropathy. Clinical Biomechanics. 28 (9-10), 1055-1060 (2013).
- Samagh, S. P., et al. MRI quantification of fatty infiltration and muscle atrophy in a mouse model of rotator cuff tears. Journal of Orthopaedic Research. 31 (3), 421-426 (2013).
- Gerber, C., Meyer, D. C., Schneeberger, A. G., Hoppeler, H., von Rechenberg, B. Effect of tendon release and delayed repair on the structure of the muscles of the rotator cuff: an experimental study in sheep. The Journal of Bone and Joint Surgery. American Volume. 86 (9), 1973-1982 (2004).
- Goodpaster, B. H., Kelley, D. E., Thaete, F. L., He, J., Ross, R. Skeletal muscle attenuation determined by computed tomography is associated with skeletal muscle lipid content. Journal of Applied Physiology. 89 (1), 104-110 (2000).
- Torriani, M., et al. Lower leg muscle involvement in Duchenne muscular dystrophy: an MR imaging and spectroscopy study. Skeletal Radiology. 41 (4), 437-445 (2012).
- Kim, H. M., Galatz, L. M., Lim, C., Havlioglu, N., Thomopoulos, S. The effect of tear size and nerve injury on rotator cuff muscle fatty degeneration in a rodent animal model. Journal of Shoulder and Elbow Surgery. 21 (7), 847-858 (2012).
- Rowshan, K., et al. Development of fatty atrophy after neurologic and rotator cuff injuries in an animal model of rotator cuff pathology. The Journal of Bone and Joint Surgery. American Volume. 92 (13), 2270-2278 (2010).
- Li, B., et al. Skeletal muscle respiratory uncoupling prevents diet-induced obesity and insulin resistance in mice. Nature Medicine. 6 (10), 1115-1120 (2000).
- Goodpaster, B. H., Theriault, R., Watkins, S. C., Kelley, D. E. Intramuscular lipid content is increased in obesity and decreased by weight loss. Metabolism. 49 (4), 467-472 (2000).
- Biltz, N. K., Meyer, G. A. A novel method for the quantification of fatty infiltration in skeletal muscle. Skeletal Muscle. 7 (1), 1(2017).
- Hakim, C. H., Wasala, N. B., Duan, D. Evaluation of muscle function of the extensor digitorum longus muscle ex vivo and tibialis anterior muscle in situ in mice. Journal of Visualized Experiments. (72), 50183(2013).
- Moorwood, C., Liu, M., Tian, Z., Barton, E. R. Isometric and eccentric force generation assessment of skeletal muscles isolated from murine models of muscular dystrophies. Journal of Visualized Experiments. (71), e50036(2013).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Ungerleider, J. L., Johnson, T. D., Rao, N., Christman, K. L. Fabrication and characterization of injectable hydrogels derived from decellularized skeletal and cardiac muscle. Methods. 84, 53-59 (2015).
- Biltz, N. K., et al. Infiltration of intramuscular adipose tissue impairs skeletal muscle contraction. The Journal of Physiology. 598 (13), 2669-2683 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır