Method Article
골격근 지방 침윤의 탈세포화 기반 정량화
요약
본 연구는 온전한 근육 부피를 통해 근육 내 지방 조직(IMAT) 침착을 시각화 및 정량화하고 IMAT를 구성하는 개별 지방 세포의 메트릭을 정량화하기 위한 탈세포화 기반 방법론을 설명합니다.
초록
지방 침윤은 골격근의 근섬유 사이에 지방세포가 축적되는 것으로 많은 근육병증, 대사 장애 및 이영양증의 두드러진 특징입니다. 인간 집단에서 임상적으로 지방 침윤은 컴퓨터 단층 촬영(CT), 자기 공명 영상(MRI) 및 초음파(미국)를 포함한 비침습적 방법을 사용하여 평가됩니다. 일부 연구에서는 CT 또는 MRI를 사용하여 쥐 근육의 지방 침윤을 정량화했지만 비용과 불충분한 공간 해상도는 여전히 어려운 과제로 남아 있습니다. 다른 작은 동물 방법은 조직학을 사용하여 개별 지방 세포를 시각화합니다. 그러나 이 방법론은 이종 병리학에서 샘플링 편향으로 어려움을 겪습니다. 이 프로토콜은 탈세포화를 사용하여 온전한 마우스 근육 전체와 개별 지방 세포 수준에서 지방 침투를 종합적으로 보고 정량적으로 측정하는 방법론을 설명합니다. 프로토콜은 특정 근육이나 특정 종에 국한되지 않으며 인간 생검으로 확장될 수 있습니다. 또한 적은 비용으로 표준 실험실 장비를 사용하여 총 정성적 및 정량적 평가를 수행할 수 있으므로 연구 실험실 전체에서 이 절차에 더 쉽게 접근할 수 있습니다.
서문
골격근 내 근섬유 사이에 지방세포가 축적되는 것은 제2형 당뇨병에서 근감소증, 근골격계 손상에 이르기까지 이질적인 질환의 두드러진 특징이다 1,2,3,4,5,6,7. IMAT 침착은 인슐린 저항성 3,8,9,10 및 골격근 기능 저하 11,12,13,14,15와 밀접한 상관관계가 있기 때문에 이러한 근육 내 지방 조직(IMAT)에 대한 포괄적인 평가는 이러한 질환의 발병 기전을 이해하는 데 매우 중요합니다 . 이러한 연관성은 수십 년 동안 주목되어 왔지만, IMAT와 관련된 메커니즘 및 IMAT의 기원은 여전히 집중적인 연구 영역으로 남아 있습니다. 이는 부분적으로 골격근 지방 침윤을 평가하는 대부분의 연구가 기계론적 조사가 제한된 인간에서 수행되었기 때문입니다16,17. 그러나, 보다 최근에는 마우스를 포함한 작은 동물 모델이 IMAT 발달 및 신호전달의 세포 조절을 정확히 찾아내는 데 도움을 주기 위해 활용되고있다 18,19,20. 이 연구는 골격근 지방 침투를 정성적으로 시각화하고 정량화하기 위해 소동물 모델과 함께 사용할 수 있는 새로운 도구를 제공하는 것을 목표로 합니다.
인간 집단에서 임상적으로 지방 침윤은 컴퓨터 단층 촬영(CT)6,21, 자기 공명 영상(MRI)16,17,22,23 및 초음파(US)17,24를 포함한 비침습적 방법을 사용하여 평가됩니다. 이러한 이미징 기술은 전형적으로 근육에서 정의된 관심 영역(ROI)을 식별하고 해당 영역 내에서 이미지 슬라이스를 획득하지만, 포괄적인 접근법도 채택되어 왔다25,26,27. 이러한 이미지 슬라이스는 정성적 등급(qualitative grading)6을 거치고, 픽셀 임계값(pixel thresholding)28을 통해 정량화된다. 유사한 접근법은 이전에 동물에서 사용되었다 29,30; 그러나 비용이 많이 들고 소동물 이미징 시스템에 액세스해야 합니다. CT 및 MRI 사용을 통한 공간 해상도 또한 복셀 내의 골격근 섬유에서 IMAT 지방 세포를 묘사할 수 없고 대신 주로 근육 영역과 주로 IMAT 영역의 주관적인 분리에 의존하기 때문에 주요 문제를 제시합니다31,32. 따라서 지방이나 근육 조직을 정확하게 식별할 수 없기 때문에 이러한 조직의 대표 수량이 부정확합니다.
이러한 한계로 인해, 소동물 모델에서 골격근 지방 침투를 평가하는 현재의 기술은 가장 일반적으로 저렴하고 접근 가능한 대안으로서 조직학에 의존한다33,34. 헤마톡실린 및 에오신(H&E), 오일 레드 O(ORO) 및 페리리핀과 같은 지방 세포 마커에 대한 면역 염색을 포함한 표준 염색 절차를 통해 근육 내 지방 침투를 구성하는 지방 세포를 간단하게 검출하고 시각화할 수 있습니다. 그러나, 조직학적 접근법은 거의 포괄적이지 않으며, 전형적으로, IMAT 정성적 또는 정량적 평가는 단일 섹션(34)으로 제한된다. 지질 추출은 또한 총 근육 지질을 정량화하는 데 사용되었다35; 그러나, 이 기술은 근세포내 지질(IMCL)과 근육내 지방 조직(IMAT) 저장고를 구별하지 못한다(36). 요약하면, 근육의 지방을 시각화하고 정량화하는 현재의 방법론은 재정적 비용이나 IMAT의 특정 검출에 의해 제한되어 있습니다.
여기에서는 정성적 시각화 및 다중 스케일 정량화를 통해 골격근 지방 침윤을 평가하는 자세한 방법을 설명합니다. 이 방법론은 IMCL을 포함한 근세포 구조를 제거하지만 더 큰 IMAT 지방 세포 유래 지질 방울은 그대로 유지하는 간단한 탈세포화 기술을 사용합니다. 이 기법의 특이성에 대한 검증은 지질 추출을 사용하여 탈세포화와 함께 IMCL의 고갈을 보여주고, μCT를 사용하여 탈세포화로 IMAT 패터닝의 유지를 보여주고, 조직학을 사용하여 탈세포화로 식별된 것과 비교하여 IMAT 지질 방울의 유사한 크기 분포를 보여주는 것을 포함하여37로 발표되었습니다. 일단 탈세포화되면, 근육은 지용성 염료로 염색되어 패턴의 정성적 시각화 및 지방 침투 정도를 시각화할 수 있습니다 및/또는 개별 IMAT 지질 방울의 정량적 이미징. 염료는 이후에 이소프로판올로 추출할 수 있으며, 생성된 용액의 광학 밀도(OD)를 사용하여 IMAT 지질 부피를 추정할 수 있습니다. 이 기술에 대한 엄격한 검증은 다른 곳(37)에 발표되었다. 이 기사에서는 쥐 근육과 함께 이 방법론을 사용하기 위한 자세한 프로토콜을 제공하고 다른 종의 근육 또는 다른 조직의 근육과 같은 다른 응용 분야에서 이 방법을 채택하는 데 도움이 되는 문제 해결 팁을 제공합니다.
프로토콜
생쥐의 보살핌과 희생은 실험동물의 사용 및 관리를 위한 국립보건원(National Institutes of Health Guide)에 따라 수행되었습니다. 모든 연구는 세인트루이스 의과대학의 워싱턴 대학교 동물연구위원회의 승인을 받았다. 생후 2-3개월 된 수컷 C57BL/6J 마우스( 재료 표 참조)를 사용하여 이 프로토콜에 포함된 예시 이미지를 생성했습니다. 아래에 설명된 모든 단계는 실온에서 수행됩니다.
1. 근육 탈세포화
- 인산염 완충 식염수(PBS)에서 1% w/v 도데실 설페이트(SDS, 재료 표 참조) 용액을 준비합니다. 완전히 섞일 때까지 용액을 저어줍니다.
참고 : 1 % SDS는 대량으로 준비하여 실온에서 1 개월 동안 보관할 수 있습니다. - 앞서 설명한 대로 관심 근육을 해부합니다38,39.
- 70 % 에탄올 용액으로 머리카락과 피부를 적신 다음 약 2cm의 경피 절개 후 집게와 스프링 가위로 덮고있는 피부를 제거하여 관심 근육을 노출시킵니다.
참고: 여기서 관심 있는 근육에는 경골 전방(TA), 장신근(EDL) 및 횡격막이 포함됩니다. 일부 근육은 다른 근육 조직 깊숙이 자리 잡고 있어 다른 근육을 절개해야 할 수 있습니다(예: EDL을 절개하려면 TA를 제거해야 함). - 날카로운 가위나 칼날( 재료 표 참조)을 사용하여 관심 근육을 해부하여 근육의 전체 범위를 얻고 가장자리가 매끄러운지 확인합니다.
알림: 이것은 시각화를 개선하기 위해 해부 현미경으로 수행하는 것이 이상적입니다. - 근육을 검사하여 뼈 조각이나 울퉁불퉁한 가장자리가 포함되어 있지 않은지 확인한 다음 필요에 따라 날카로운 가위로 다듬습니다.
- 분석 저울을 사용하여 근육의 무게를 측정하고 무게를 기록합니다.
- 70 % 에탄올 용액으로 머리카락과 피부를 적신 다음 약 2cm의 경피 절개 후 집게와 스프링 가위로 덮고있는 피부를 제거하여 관심 근육을 노출시킵니다.
- 해개된 근육을 무게 밀리그램당 1% SDS의 최소 0.1mL에 넣습니다. 6웰, 12웰 또는 24웰 플레이트는 각각 다이어프램, TA 및 EDL 마우스 근육에 적합합니다. 일반적인 부피는 6웰, 12웰 및 24웰 플레이트에 대해 각각 6mL, 3mL 및 1.5mL입니다.
알림: SDS 용액은 때때로 근육을 변형시키므로 초기 침수 시 근육이 평평하거나 확장되었는지 확인하십시오. - 웰 플레이트(또는 다른 용기)를 50-80Hz로 설정된 흔들림 셰이커에 놓습니다.
- SDS 솔루션을 주기적으로 육안으로 검사합니다. 용액이 탁해지면 피펫으로 용액을 제거하고(근육을 흡인하지 않도록 주의) 동일한 양의 신선한 1% SDS로 교체합니다. 용액이 24시간 동안 투명하게 유지되면 탈셀룰라화가 완료됩니다.
알림: 용액 변경에 필요한 빈도는 근육 크기와 초기 용액 부피에 따라 다릅니다. TA와 같은 큰 근육은 몇 시간 내에 새로운 SDS가 필요하며 EDL과 같은 작은 근육은 원래 용액에서 하룻밤을 보낼 수 있습니다. - 피펫으로 탈세포화된 근육에서 최종 SDS 용액을 제거하고(근육을 흡인하지 않도록 주의) 동일한 양의 PBS로 교체합니다.
- 해부 현미경으로 탈세포화된 근육을 육안으로 검사하고 집게와 가위를 사용하여 근육에 붙은 머리카락이나 부스러기를 제거합니다.
참고: 또한 이 단계에서 탈세포화된 근육의 선명도에 유의하십시오. 탈세포화된 근육이 완전히 투명하지 않고 SDS 용액이 24시간 동안 탁하게 증가하지 않으면 탈세포화가 효율적이지 않습니다. 이는 정성적 및 정량적 평가에서 아티팩트를 생성하므로 실험 근육을 진행하기 전에 항상 연습 샘플에서 탈세포화를 최적화해야 합니다. - PBS를 조심스럽게 제거하고 동일한 부피의 포름알데히드 3.7% 또는 4% 파라포름알데히드 용액으로 교체한 다음 플레이트를 24시간 동안 흔들리는 셰이커에 다시 넣습니다.
알림: 포름알데히드 용액이 탈세포화된 근육을 완전히 덮고 있는지 확인하십시오., 그렇지 않으면 얼룩이 고르지 않을 것입니다.
2. 오일 레드 O를 사용한 IMAT의 시각화
- ORO의 용액을 준비합니다.
- 0.5g의 ORO 분말( 재료 표 참조)을 이소프로판올 100mL에 용해시켜 원액을 생성합니다.
알림: 용액에 부드러운 열을 가하여 완전히 녹입니다. 이 재고는 실온에서 1개월 동안 보관할 수 있습니다. - ORO 원액과 탈이온수를 60:40 비율로 결합하여 최소 0.1mL/mg 근육량의 부피를 사용하여 모든 근육에 필요한 작업 용액을 얻습니다. 일반적인 부피는 6웰, 12웰 및 24웰 플레이트에 대해 각각 6mL, 3mL 및 1.5mL입니다.
알림: 혼합하기 전에 원액을 검사하십시오. 원액에 상당한 미립자가 포함되어 있으면 새 육수를 만드십시오. - 미립자가 가라앉을 수 있도록 작업 용액을 10분 동안 덮습니다.
- 40μm 메쉬를 통해 작업 용액을 여과한 다음 0.22μm 주사기 필터를 통해 여과합니다.
알림: 0.22μm 주사기 필터가 빠르게 막히므로 작업 용액이 쉽게 밀려나지 않으면 교체해야 합니다.
- 0.5g의 ORO 분말( 재료 표 참조)을 이소프로판올 100mL에 용해시켜 원액을 생성합니다.
- 포름알데히드 또는 파라포름알데히드 용액을 제거하고 동일한 부피의 PBS의 세 가지 용액 변화로 탈세포화된 근육을 세척합니다.
- PBS를 동일한 부피의 60% 이소프로판올 용액으로 교체하고 흔들리는 셰이커에서 5분 동안 배양합니다.
- 60% 이소프로판올 용액을 ORO 작업 용액으로 교체하고 흔들 셰이커에서 10분 동안 배양합니다.
알림: ORO 작업 용액이 탈세포화된 근육을 완전히 덮는지 확인하십시오, 그렇지 않으면 얼룩이 고르지 않을 것입니다. - ORO 작업 용액을 동일한 부피의 1% SDS로 교체합니다. SDS 솔루션을 주기적으로 육안으로 검사합니다. 용액이 눈에 띄게 분홍색이 되면 피펫으로 용액을 제거하고(근육을 흡인하지 않도록 주의) 신선한 1% SDS로 교체합니다.
- 용액이 24시간 동안 투명하게 유지되면 1% SDS를 PBS로 교체하고 4배 배율로 해부/실체 현미경으로 염색된 근육을 검사합니다. 근육 외부에 붙어있는 명백한 부스러기나 미립자를 제거합니다. 이것이 광범위하다면, 탈세포화된 근육을 청소 티슈 위에서 부드럽게 굴려 파편/미립자를 제거할 수 있습니다.
- 염색이 만족스러우면(투명 매트릭스에 떠 있는 밝은 빨간색 구체) 실체 현미경에 부착된 카메라를 사용하여 원하는 대로 염색 이미지를 획득합니다( 재료 표 참조).
알림: 해부 현미경에 카메라가 부착되어 있지 않은 경우 휴대폰 카메라를 사용하여 접안렌즈를 통해 사진을 찍을 수 있습니다.
3. BODIPY를 사용한 IMAT 지질 방울의 시각화
참고: 컨포칼 이미징은 EDL 또는 다이어프램(~2mm 두께)과 같은 얇은 근육에 가장 효과적입니다. 대안적으로, TA와 같은 비슷한 두께의 근육 스트립을 사용할 수 있습니다.
- PBS에서 형광 BODIPY 493/503의 1:200 용액( 재료 표 참조)을 준비하여 최소 0.1mL/mg 근육량의 작업 용액 부피를 얻습니다. 일반적인 부피는 6웰, 12웰 및 24웰 플레이트에 대해 각각 6mL, 3mL 및 1.5mL입니다.
- 포름알데히드, 파라포름알데히드 또는 1% SDS를 제거하고 동일한 양의 PBS의 세 가지 용액 변화로 탈세포화된 근육을 세척합니다.
- PBS를 BODIPY 작업 용액으로 교체하고 흔들 셰이커에서 20분 동안 배양합니다.
- 동일한 부피의 PBS의 세 가지 용액 변화로 탈세포화된 근육을 세척합니다.
- 사용 가능한 컨포칼 현미경과 호환되는 바닥이 투명한 용기에 근육을 넣습니다. 이상적으로, 접시에는 변형되지 않고 근육 위에 커버슬립을 놓을 수 있도록 오목한 바닥이 있어야 합니다( 재료 표 참조).
- 488 레이저를 사용하여 표준 컨포칼 현미경( 재료 표 참조)으로 이미지 스택을 얻습니다. EDL의 일반적인 스택 크기는 0.5-1mm이고 슬라이스 두께는 10μm이며 스택당 50-100개의 이미지를 생성합니다.
참고: 총 지질 부피, IMAT 지질 방울의 총 수 및 클러스터링의 최근접 이웃 지수를 정량화하기 위해 전체 근육 부피를 통해 이미지를 생성하고 이미지 정합을 위해 일부 겹치는 부분을 남겨 둡니다. 평균 지질 방울 부피를 정량화하려면 한 스택으로 충분할 수 있습니다. - 원하는 경우 섹션 2에 따라 ORO로 근육을 염색하여 IMAT 분포의 무료 전체 근육 이미지를 얻습니다.
참고: BODIPY는 형광등이기 때문에 ORO 이미지를 획득할 때 광학 현미경으로 볼 수 없습니다.
4. 지질 추출에 의한 총 지질 부피 추정
- 이미지 획득 후 근육을 96웰 플레이트의 개별 웰에서 200μL의 이소프로판올로 옮기거나 근육이 너무 커서 맞지 않는 경우 웰/부피를 조정합니다.
- 플레이트를 두드리고, 용액을 위아래로 피펫팅하고, 현미경으로 탈세포화된 근육에 적색/형광 구체가 보이지 않을 때까지 피펫 팁으로 근육을 기계적으로 분쇄하여 용액을 교반합니다.
알림: 최상의 신뢰성을 위해 모든 근육을 동일한 탭핑, 피펫팅 및 분쇄 조합으로 치료하십시오. 또한 이소프로판올이 빠르게 증발하므로 두드리고, 피펫팅하고, 분쇄하는 데 소요되는 시간을 제한하도록 주의하십시오. - 위아래로 피펫팅하여 각 웰의 용액을 혼합한 다음 75μL를 플레이트의 깨끗한 웰 2개로 옮깁니다.
- 플레이트를 덮고 분광 광도계 또는 플레이트 리더를 사용하여 복제된 75μL 웰의 흡광도를 판독합니다. 구조체가 ORO로 염색된 경우 500nm에서 용액을 판독합니다. BODIPY 493/503으로 염색된 경우 493nm에서 플레이트를 판독합니다.
참고: 작제물이 BODIPY와 ORO로 모두 염색된 경우, 500nm 판독은 ORO로만 염색된 작제물과 ORO와 BODIPY로 염색된 작제 간에 유사한 결과를 제공하므로 500nm에서 플레이트를 판독하는 것이 좋습니다. - 샘플 간의 크기 차이를 보정하기 위해 원하는 경우 흡광도 판독값을 기록된 근육 무게로 나눕니다.
5. 공초점 이미지에서 IMAT 지질 액적 지표 정량화
참고: 이 섹션에서는 ImageJ 버전 1.47( 자료 표 참조) 이상 및 기본 ImageJ 기술40에 액세스해야 합니다.
- ImageJ에서 공초점 스택을 엽니다.
알림: 다른 컨포칼 현미경은 컨포칼 이미지를 다른 형식으로 저장할 수 있습니다. ImageJ는 스택(41)을 열기 위해 피지와 같은 추가적인 플러그인 또는 변형을 필요로 할 수 있다. 사용된 알고리즘은 ImageJ 소프트웨어 패키지의 일부입니다. - ImageJ에서 임계값 알고리즘을 실행하여 BODIPY 양의 픽셀을 식별합니다. 이렇게 하면 현재 이미지가 이진 이미지로 변환됩니다.
- Image > Adjust > Threshold를 선택하여 임계값 사용자 인터페이스를 엽니다. 사용자 인터페이스에서 임계값 적용 유형으로 Intermodes(인터모드)를 선택하고 어두운 배경(Dark background)이 선택되어 있는지 확인합니다. 다른 옵션은 선택할 필요가 없습니다. 그런 다음 적용을 클릭합니다.
- 스택을 이진으로 변환할 수 있는 대화 상자가 열립니다. 다음 옵션이 선택되어 있는지 확인하십시오. 방법: Intermodes; 배경: 어두운. 각 이미지와 검은색 배경(이진 마스크)에 대한 임계값을 계산합니다. 이렇게 하면 흰색은 BODIPY 양수 픽셀을 나타내고 검은색은 BODIPY 음수 픽셀을 나타내는 이진 스택이 생성됩니다.
참고: Intermodes 임계값 설정 알고리즘은 모든 사용자에게 최선의 선택이 아닐 수 있습니다. ImageJ의 내장 임계값 옵션에 대한 주관적인 검사는 BODIPY 포지티브 및 네거티브 픽셀을 분리하기 위한 최적의 알고리즘을 선택하는 데 도움이 됩니다.
- ImageJ에서 Watershed 알고리즘을 실행하여 접촉하는 지질 방울을 분리합니다. Process > Binary > Watershed(이진 유역)를 선택합니다. 스택의 모든 이미지를 처리해야 하는지 여부를 묻는 대화 상자가 열립니다. 예를 선택합니다. 이렇게 하면 흰색의 더 넓은 영역을 나누는 얇은 검은색 선이 추가됩니다.
- ImageJ의 파티클 분석 알고리즘을 사용하여 ROI를 식별합니다.
- 분석(Analyze) > 입자 분석(Analyze Particles)을 선택합니다. 선택 설정을 지정할 수 있는 대화상자가 열립니다.
참고: 크기 범위를 선택하는 것은 지질 액적 ROI를 가장 잘 추정하는 데 중요합니다. 하한은 IMAT 유래 지질 방울(배경 아티팩트)이 되기에는 너무 작을 수 있는 영역을 제거하고, 상한은 단일 IMAT 유래 지질 방울이 되기에는 너무 클 가능성이 있는 영역(Watershed 알고리즘으로 분리되지 않은 지질 방울 건짐)을 제거합니다. - 이 값을 설정하려면 원본 이미지를 열고 타원형 도구를 사용하여 보기에서 가장 작은 지질 방울과 가장 큰 지질 방울의 윤곽을 그립니다. 그런 다음, "t"를 입력하여 이러한 형상을 ROI 매니저에 추가합니다. Analyze(분석)를 선택한 다음 Set Measurements(측정 설정)를 선택합니다. 설정을 선택할 수 있는 대화 상자가 열립니다.
- Area only( 영역 만)를 선택하고 OK(확인)를 클릭합니다. 그런 다음 ROI 관리자에서 측정 을 선택합니다. 이 결과 창의 두 영역 측정값을 파티클 분석의 크기 범위로 사용합니다.
- Add to Manager(관리자에 추가)가 선택되어 있는지 확인합니다. 다른 옵션은 필요하지 않습니다.
- 분석(Analyze) > 입자 분석(Analyze Particles)을 선택합니다. 선택 설정을 지정할 수 있는 대화상자가 열립니다.
- ROI Manager에서 Show All 을 선택하여 공초점 스택에 ROI를 오버레이합니다. 슬라이더 막대를 사용하여 각 스택 조각을 개별적으로 검사하고 [타원형 도구](ImageJ 도구 모음에 있음)를 사용하여 누락된 영역을 직접 추가합니다.
- ROI 측정값을 출력합니다. 분석(Analyze) > 측정 설정(Set Measurements )을 선택하고 영역(Area), 중심(Centroid), 타원 맞춤(Fit ellipse ) 및 스택 위치(Stack position)를 선택합니다. 확인을 클릭합니다. 그런 다음 ROI 관리자에서 측정 을 선택합니다. 결과 테이블의 데이터를 선택하고 추가 분석을 위해 Matlab 또는 Excel로 복사할 수 있습니다.
- Refine.m Matlab 코드37 또는 유사한 알고리즘을 사용하여 각 스택의 ROI를 단일 ROI로 구체화합니다.
참고: 이 단계는 5.2-5.4단계에서 인접한 슬라이스에서 동일한 지질 방울을 고유한 ROI로 식별하기 때문에 필요합니다. 그러나 ROI는 수작업으로만 식별하거나 ImageJ에서 중복된 ROI를 수동으로 제거하여 Matlab을 사용할 필요가 없습니다. - Matlab 또는 Excel을 사용하여 ROI의 요약 통계량을 구합니다.
- 총 지질 방울 수를 총 ROI 수로 추정합니다.
- 형상의 깊이가 타원의 장축과 단축의 평균이라고 가정하고, 각 2D ROI에 피팅된 타원의 부피로 지질 액적 부피를 추정합니다.
- 개별 추정 지질 방울 부피의 합인 총 지질 부피를 추정합니다.
결과
골격근 지방 침윤의 정성적 시각화
적절하게 탈세포화된 근육은 흰색이고 반투명하다(섹션 1; 그림 1). IMAT를 시각화하기 위해 탈세포화된 근육을 ORO로 염색하면(섹션 2), IMAT 지질 방울이 투명한 근육 구조 내에서 빨간색 구체로 나타납니다(그림 1). 건강한 쥐의 뒷다리 근육은 자연적인 IMAT가 거의 없으며, 이는 적색 ORO 양성 지질이 거의 또는 전혀 없는 것으로 입증되었습니다(그림 1A). 이에 비해 뒷다리 근육에는 카디오톡신(CTX; 그림 1B) 또는 글리세롤(GLY; 그림 1C) 탈세포화 14일 전에는 IMAT의 축적이 증가하며, 앞서 언급한 바와 같이 GLY에 비해 CTX 후 IMAT의 농도가 더 높습니다37.
불완전한 탈세포화는 초기 SDS 처리 직후 또는 ORO 염색 세척 후 반불투명한 연분홍색 섬유로 식별할 수 있습니다(그림 2B와 그림 2A). ORO의 불완전한 클리어런스는 ORO 세척 후 뚜렷한 섬유 선이 아닌 분홍색 또는 빨간색의 균일한 배경으로 식별될 수 있습니다(그림 2C). 그림 2A,B에는 또한 탈세포화된 근육 외부의 지질 방울 덩어리인 근외 지방(별표)이 포함되어 있습니다. 그림 2C는 또한 탈세포화 중에 근육이 펼쳐지지 않을 경우 발생할 수 있는 근육 접힘을 보여줍니다. 불완전한 탈세포화, 불완전한 ORO 제거 및 잔류 근육 외 지방은 모두 추출된 지질의 (OD)를 인위적으로 증가시키지만, 인공물로 인식되는 경우 지방 침투의 정성적 평가를 반드시 방해하지는 않습니다.
골격근 지방 침윤의 정량적 이미징
BODIPY 형광 표지 지질 방울은 개별 지질 방울 메트릭 및 분포를 보다 자세히 평가하기 위해 컨포칼 현미경을 통해 이미징할 수 있습니다(그림 3). 이 프로세스는 앞에서 설명한 대로 Matlab 코드37을 포함하여 반자동화되어 있습니다. BODIPY 염색이 좋으면 평면에서 이미지화할 때 인접한 모양과 구분되는 밝은 타원형 모양이 생성됩니다(그림 3A). 임계값 설정 및 형상 분할은 각 지질 방울에 대한 ROI를 생성하기 위한 좋은 첫 번째 단계를 제공하지만(그림 3B), 오류를 수정하려면 수동 편집이 필요합니다. 가장 흔한 오류는 조직 깊숙이 있는 지질 방울로, 따라서 어떤 절편에서도 밝지 않습니다(그림 3B, 분홍색 이중 화살표). 이 문제는 ImageJ의 Oval 도구를 사용하여 ROI를 직접 추가하면 해결할 수 있습니다(그림 3C). 두 번째는 지질 방울 그룹을 단일 ROI로 식별하는 것입니다(그림 3B, 빨간색 별표). 이 문제는 원래 ROI를 삭제하고 여러 개의 새로운 ROI로 대체하여 해결할 수 있습니다(그림 3D). 마지막으로, 단일 지질 방울은 여러 절편에서 고유한 ROI로 식별되므로 중복된 ROI를 단일 ROI로 통합해야 합니다(그림 3E, 파란색 화살표). 이 작업은 Matlab과 같은 데이터 처리 도구를 사용하여 가장 쉽게 수행할 수 있지만 가장 큰 ROI를 식별하고 나머지를 삭제하여 수동으로 수행할 수도 있습니다. C57BL6/J 및 129Sv 마우스의 각 메트릭에 대한 평균값은 Biltz et al.37에서 찾을 수 있습니다.
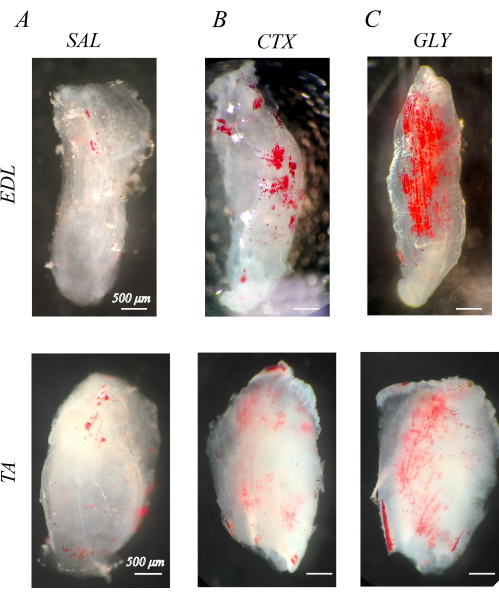
그림 1: 탈세포화된 근육의 오일 레드 O(ORO) 염색의 예. 식염수(SAL), 카디오톡신(CTX) 또는 글리세롤(GLY) 주사 후 14일 동안 ORO 염색 근육. 생쥐 신근 장성근(EDL)과 경골 전방근(TA)은 SAL 치료(A)에서는 IMAT(적색 구체)가 거의 없지만 CTX(B) 및 GLI(C) 치료에는 IMAT가 축적됩니다. 투명한 백색 근육 배경에 뚜렷한 ORO 양성 지질 방울이 있는 완전한 탈세포화 및 ORO 세척이 있습니다. 스케일 바 = 500 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
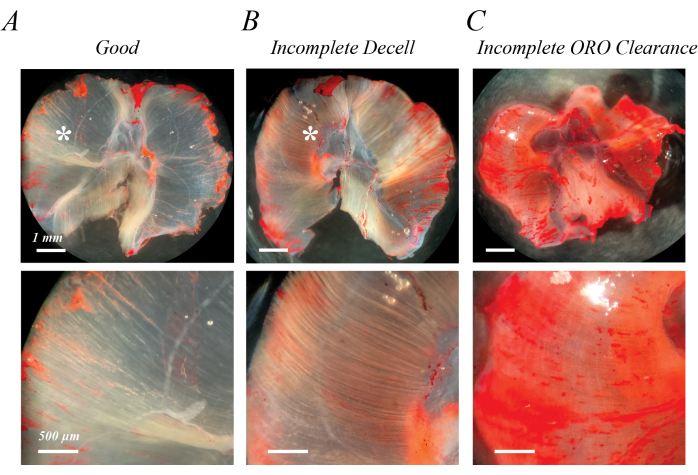
그림 2: 불량한 ORO 염색 결과의 예. 불완전한 탈셀룰라화 또는 불완전한 ORO 클리어런스는 반불투명한 분홍색/빨간색 배경으로 이어집니다. 완전히 탈세포화된 마우스 다이어프램 근육(A)의 투명한 흰색 배경과 비교할 때, 불완전한 탈세포화는 밝은 분홍색/빨간색 섬유 트랙(B)이 특징이며, 불완전한 ORO 클리어런스는 확산된 분홍색/빨간색 배경(C)이 특징입니다. 눈금 막대: 상부 패널 = 1mm; 하단 패널 = 500μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
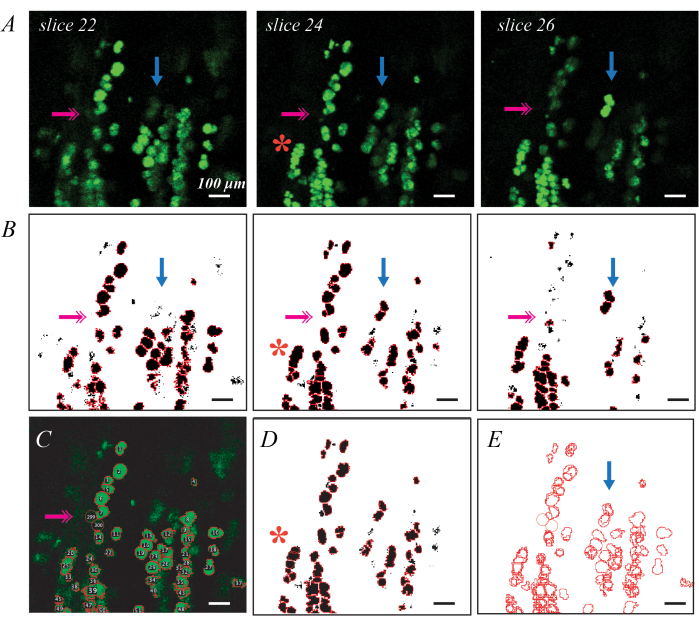
그림 3: 형광 BODIPY 염색 및 공초점 현미경을 사용한 개별 지질 방울 식별의 예 공초점 현미경을 사용하여 탈세포화된 근육에서 개별 BODIPY 염색 지질 방울을 식별하고 정량화할 수 있습니다. 공초점 스택을 통한 개별 슬라이스는 평면의 지질 방울을 밝은 녹색 타원으로 표시하고 평면 외부의 지질 방울을 더 희미한 모양으로 표시합니다(A, 파란색 화살표). 유역 객체 분할 및 ROI 식별과 결합된 임계값 설정은 BODIPY 염색 ROI(B)를 매핑할 수 있습니다. 임계값 설정은 일부 희미한 지질 방울(B, 분홍색 이중 화살표)을 놓칠 수 있으므로 손으로 식별해야 합니다(C). 유역 분할은 여러 지질 방울을 함께 그룹화할 수 있으며(B, 빨간색 별표), ROI를 삭제하고 수동으로 재추정해야 합니다(D). 동일한 지질 방울이 여러 슬라이스에서 식별되므로 중복 ROI를 삭제하기 위해 이미지 정합(E)이 필요합니다. 스케일 바 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 원고는 근육 내 지방 조직(IMAT) 발달 및 병리학적 확장의 발병 기전을 더 잘 이해하는 데 적용할 수 있는 소동물 모델에서 골격근 지방 침윤을 정성적으로 시각화하고 정량화하는 방법을 설명합니다. 전체 근육 탈세포화 및 지용성 염색을 사용하면 전체 근육에서 IMAT의 존재를 종합적으로 평가할 수 있는 비용 효율적이고 재현 가능하며 간단한 방법론을 사용할 수 있습니다.
이 프로토콜의 기초는 SDS를 사용한 근육의 탈세포화가 IMCL의 작은 지질 방울을 포함하여 근섬유의 세포 성분을 제거하지만 intramycellular 지방 세포의 큰 지질 방울을 보존한다는 것입니다. SDS는 기질을 탈세포화하기 위해 조직 공학에서광범위하게 사용되었습니다 42. 지방 및 골격근과 같은 조직은 일반적으로 잔류 지방 세포 지질42,43을 제거하기 위해 추가적인 기계적 해리 및/또는 알코올 추출이 필요합니다. 우리는 이전에 SDS를 사용한 탈세포화가 IMCL을 제거하는 동안 지방 세포37에서 큰 지질 방울을 보존하기 때문에 이를 보여주었습니다. μCT를 사용한 오스뮴 테트라록사이드로 염색된 온전한 근육의 탈세포화 전후 이미징을 통해 IMAT의 공간 패턴이 탈세포화에 의해 방해받지 않는 것을 확인했습니다. 또한, 무시할 수 있는 IMAT를 가진 탈세포화된 근육의 근육 내 트리글리세라이드 정량화는 온전한 근육 값의 ~5%였으며, IMCL의 제거를 검증했습니다. 따라서 이 방법론은 반투명 근육 매트릭스를 통해 IMAT 지질 방울을 원래의 해부학적 분포로 유지합니다.
적절한 탈세포화는 이 프로토콜에서 가장 중요한 단계입니다. 탈셀룰라화가 불완전하면 IMAT 지질 방울을 시각화하기 어렵고 잔류 IMCL로 인해 ORO 또는 BODIPY로 높은 백그라운드 염색이 발생합니다(그림 2). 경험이 부족한 사용자의 일반적인 오류는 각 근육이 SDS 용액으로 완전히 덮여 있지 않고 탈세포 화 중에 용액을 교반하기 위해 로커를 사용하지 않고 용액 변경을 충분히 자주 수행하지 않는 것과 같이 근육 당 (각 웰 내) SDS 적용 범위가 부적절하다는 것입니다. 이 원고에서는 단위 근육 질량당 필요한 SDS의 양을 권장했지만 각 근육은 고유한 형상을 가지고 있기 때문에 사용자는 여전히 근육이 솔루션으로 완전히 덮여 있는지 확인해야 합니다. 또한 사용자는 탈셀룰라화가 완료되었는지 확인하기 위해 용액을 자유롭게(하루에 두 번까지) 교체하는 것이 좋습니다. IMAT 지질 방울의 우수한 품질 염색은 SDS 처리 4일 후에 달성되었습니다. 고품질 ORO 염색 결과를 위해서는 적절한 고정과 ORO 용액 준비도 중요합니다. 위에서 설명한 SDS 처리와 유사하게, 각 근육 샘플에 대해 3.7% 포름알데히드 용액의 적절한 적용이 필요합니다. 고정제에서 근육을 너무 일찍 제거하면 지질 방울이 ORO로 약하게 얼룩지게 됩니다. 총 1-2시간이면 충분하지만 고정제가 근육 중앙까지 침투하여 모든 지질 방울을 완전히 고정할 수 있도록 밤새 고정하는 것이 좋습니다. ORO 염색의 또 다른 문제는 알코올 농도가 60%로 감소하면 미립자가 형성되기 시작한다는 것입니다. 이 미립자는 표면에 가라앉아 근육 경계에 달라붙을 수 있습니다. 이를 방지하는 가장 좋은 방법은 각 염색에 대해 새로운 작업 용액을 만들고 40 mesh μm 및 0.22 μm 필터를 모두 사용하는 것입니다. 그런 다음 로커로 교반을 유지하고 염색 시간을 10분으로 제한하면 형성되는 미립자가 침전되는 것을 방지하는 데 도움이 됩니다. 문제가 지속되면 새로운 ORO 스톡 솔루션을 만드는 것이 도움이 될 수 있습니다. 일부 인공물이 탈세포화된 근육 표면에 붙어 있는 경우 실체 현미경, 겸자 및 수술용 가위를 사용하여 이 인공물을 제거할 수 있습니다. 아티팩트를 제거하지 못하면 근육의 이미지 품질에 영향을 미치고 OD 판독을 준비하기 위해 지질 추출 부분에서 IMAT 함량을 과대 평가합니다.
전반적으로, 이 기법은 간단하며, 골격근 지방 침투를 시각화하고 정량화하기 위한 골드 스탠다드 방법에 비해 몇 가지 이점을 제공합니다. CT, MRI 및 미국과 같은 비침습적 기술은 인간과 때로는 동물 모델에서 광범위하게 사용되며 공간 해상도가 제한되어 있으며 지질 방울과 근육 섬유를 구별할 수 없습니다. 따라서 중간 신호 강도의 픽셀 또는 복셀은 "근육" 또는 "지방"으로 할당되지만 실제로는 근섬유와 지방 세포의 혼합일 가능성이 높습니다. 더 일반적으로, 동물 근육의 지방 침윤은 조직학에 의해 평가되며, 가장 빈번하게 근육 동결 절개술에서 ORO에 의해 평가됩니다. 그러나 이는 일반적으로 단일 대표 절편에서만 수행되며 절편에 지질이 산란되어 정량화하기 어렵습니다. 대조적으로, 전체 탈세포화된 근육의 ORO 염색은 온전한 형태와 유사한 비용과 노력으로 IMAT에 대한 포괄적인 평가를 제공합니다. 또한, 시각화를 향상시키는 것 외에도 탈세포화의 ORO 염색을 통해 지질 추출에 의한 지방 침투의 정량화를 가능하게 합니다. 지방 침투의 특징에 대해 더 자세히 알아보려면 형광 염색제인 BODIPY를 컨포칼 현미경과 함께 사용할 수 있습니다. 이를 통해 개별 IMAT 지질 방울을 재구성하여 3D 지형을 매핑할 수 있으며, 이는 근육 길이에 걸쳐 절편을 분석하지 않는 한 조직학으로는 불가능합니다. 컨포칼 현미경은 표준 실험실 장비는 아니지만 소동물 MRI 또는 CT보다 대학이나 산업 환경에서 더 쉽게 접근할 수 있습니다. 또한 이 과정의 상당 부분을 자동화할 수 있어 순차 조직학에 비해 시간 비용을 줄일 수 있습니다. 컨포칼 현미경의 설정을 최적화하는 것은 BODIPY 염색에 대한 추가 고려 사항입니다. 이는 각 현미경마다 고유합니다. 임계값은 레이저 강도로, 근육의 먼 표면에 있는 지질 방울을 감지할 수 있을 만큼 충분히 높아야 하며 가까운 쪽의 지질 방울의 신호를 포화시키지 않아야 합니다. 이 때문에 컨포칼 현미경과 함께 BODIPY 염색을 사용하는 것이 EDL 또는 횡격막을 포함한 얇은 근육에 가장 적합하다는 것이 좋습니다.
이 접근 방식의 몇 가지 제한 사항에 대해 논의해야 합니다. 첫째, 이 기술은 여기에 제시된 마우스의 부상 모델(카디오톡신 및 글리세롤)을 넘어 광범위한 적용 가능성을 가질 것으로 예상되지만, 근육의 크기와 구성(예: 섬유증)이 탈세포화에 영향을 미칠 수 있어 증가된 SDS 농도 또는 배양 시간이 필요하기 때문에 새로운 응용 프로그램(예: mdx 모델)에는 최적화가 필요할 수 있습니다. 근육량이 변경된 다른 질병 모델도 보다 의미 있는 결과 측정을 제공하기 위해 지질의 절대량 또는 근육량에 대한 지질의 백분율을 결정하기 위해 지방 침윤의 절대 및 정규화된(근육량) 측정치를 모두 분석해야 합니다. 또한 이 기술은 더 큰 동물 모델 및 인간 생검에 광범위하게 적용될 것으로 예상되지만 각각의 새로운 응용 분야에 대한 최적화가 필요할 수 있습니다. 둘째, 이 전략에서는 전체 근육이 이 분석에 전념해야 하며 다른 병리학적 특징을 평가하는 데 사용할 수 없습니다. IMAT의 종단적 변화를 평가하는 것을 목표로 하는 연구는 비침습적 이미징 기술을 사용하는 것이 더 좋으며, 동결된 근육의 나머지 부분을 다른 분석에 할당할 수 있으므로 다른 목적(조직학, 정량적 중합효소 연쇄 반응, 웨스턴 블로팅)을 위해 근육이 필요한 주요 목적의 연구는 조직학적 평가가 더 좋습니다. 그러나, 이러한 분석은 트레드밀 달리기, 또는 생체외 수축 테스트와 같은 생체내 테스트와 쌍을 이루기에 매우 적합한데, 이는 이들 측정이 탈세포화(44) 전에 이루어질 수 있기 때문이다. 셋째, 컨포칼 현미경과 함께 BODIPY 염색을 사용하면 지질 방울의 고해상도 시각화 및 정량화가 가능하지만, 세포막이 제거되고 내인성 지방 세포 단백질이 손실되기 때문에 지질 방울을 개별 지방 세포로 결정적으로 식별할 수 없습니다. 미성숙 지방세포 또는 "갈색/베이지색" 표현형을 나타내는 다기관 지방세포는 다중 지질 방울로 식별될 수 있습니다. 마지막으로, 프로토콜은 이전에 얼어붙은 근육에 잘 작동하지 않습니다. 이러한 한계는 전체 생검을 탈세포화할 수 있지만 생검에서 IMAT의 공간적 분포가 조직학적 절편보다 전체 근육을 더 잘 대표할 가능성이 높지 않기 때문에 인간 생검에서 가장 심각할 수 있습니다. 그러나 이 기술은 냉동되지 않은 생검 처리 조건(예: PBS의 얼음 위에서 몇 시간)에 상대적으로 둔감하기 때문에 생검은 나중에 개별 지질 방울의 더 나은 분해능을 제공하는 탈세포화를 위한 부분을 포함하여 다양한 분석을 위해 분할될 수 있습니다.
결론적으로, 골격근 지방 침투의 정성적 및 정량적 분석을 위한 새로운 방법은 탈세포화된 구축물의 잔류 지질을 염색하고 이미징함으로써 개발되었습니다. 이 방법론은 근육 내 3차원 지방 침투에 대한 포괄적인 이미징과 ORO 염색을 통한 빠르고 저렴한 정량화를 가능하게 한다는 점에서 골드 스탠다드 접근법에 비해 개선된 기능을 제공합니다. 보다 자세한 측정을 위해 두 번째 지용성 BODIPY 염색은 컨포칼 현미경으로 이미지화한 지질 액적 수, 부피 및 분포 패턴에 대한 보다 자세한 정량화를 제공합니다. 이러한 측정은 연구자들에게 샘플링이나 값비싼 비침습적 이미징 없이 개별 지질 방울 수준에서 골격근 지방 침투를 정확하게 측정할 수 있는 방법을 제공합니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 작업은 R01AR075773 to GAM의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.22 µm Syringe Filter | Fisher Scientific | SLGP033RS | |
| 1 mL LuerLock Syringes | Fisher Scientific | 14823434 | |
| 12 mm Coverslips | Fisher Scientific | 12545F | |
| 12 well plates | Fisher Scientific | 08-772-29 | |
| 24 well plates | Fisher Scientific | 08-772-1H | |
| 2-Propanol (Isopropanol) | Sigma Aldrich | I9516 | 0.5 mg/mL stock solution can be stored at room temperature for 1 month. Working solution must be made fresh. |
| 37% Formaldehyde Solution | Sigma Aldrich | 8187081000 | |
| 40 µm Mesh Filter | Fisher Scientific | 87711 | |
| 6 well plates | Fisher Scientific | 08-772-1B | |
| 96 well plates | Fisher Scientific | 08-772-2C | |
| BODIPY 493/503 | Fisher Scientific | D-3922 | |
| C57BL/6J Mice | Jackson Laboratory | 000664 | |
| Confocal Imaging Dish | VWR | 734-2905 | |
| Confocal Microscope | Leica | TCS SPEII | |
| Dissecting/stereo Microscope | Zeiss | 4107009123001000 | |
| Dissection scissors | Fine Science Tools | 14060-09 | |
| Dumont #5 forceps | Fine Science Tools | 11254-20 | |
| Ethanol | Fisher Scientific | 033361.K2 | |
| ImageJ | NIH | ||
| Matlab | Mathworks | ||
| Oil Red O Powder | Sigma Aldrich | O0625 | |
| Plate reader | Bio-tek | Synergy II | |
| Rocker/Shaker | Reliable Scientific | 55D | |
| Sodium Dodecyl Sulfate (SDS) | Sigma Aldrich | L3771 | 1% Solution can be stored at room temperature for 1 month |
| Transfer pipettes | Fisher Scientific | 137119D | |
| Vannas spring scissors | Fine Science Tools | 15000-00 |
참고문헌
- Delmonico, M. J., et al. Longitudinal study of muscle strength, quality, and adipose tissue infiltration. The American Journal of Clinical Nutrition. 90 (6), 1579-1585 (2009).
- Goodpaster, B. H., et al. Obesity, regional body fat distribution, and the metabolic syndrome in older men and women. Archives of Internal Medicine. 165 (7), 777-783 (2005).
- Freda, P. U., et al. Lower visceral and subcutaneous but higher intermuscular adipose tissue depots in patients with growth hormone and insulin-like growth factor I excess due to acromegaly. The Journal of Clinical Endocrinology and Metabolism. 93 (6), 2334-2343 (2008).
- Garg, A., Peshock, R. M., Fleckenstein, J. L. Adipose tissue distribution pattern in patients with familial partial lipodystrophy (Dunnigan variety). The Journal of Clinical Endocrinology and Metabolism. 84 (1), 170-174 (1999).
- Gorgey, A. S., Dudley, G. A. Skeletal muscle atrophy and increased intramuscular fat after incomplete spinal cord injury. Spinal Cord. 45 (4), 304-309 (2007).
- Goutallier, D., Postel, J. M., Bernageau, J., Lavau, L., Voisin, M. C. Fatty muscle degeneration in cuff ruptures. Pre- and postoperative evaluation by CT scan. Clinical Orthopaedics and Related Research. (304), 78-83 (1994).
- Liu, W., Liu, Y., Lai, X., Kuang, S. Intramuscular adipose is derived from a non-Pax3 lineage and required for efficient regeneration of skeletal muscles. Developmental Biology. 361 (1), 27-38 (2012).
- Goodpaster, B. H., Thaete, F. L., Kelley, D. E. Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. The American Journal of Clinical Nutrition. 71 (4), 885-892 (2000).
- Elder, C. P., Apple, D. F., Bickel, C. S., Meyer, R. A., Dudley, G. A. Intramuscular fat and glucose tolerance after spinal cord injury-a cross-sectional study. Spinal Cord. 42 (12), 711-716 (2004).
- Albu, J. B., et al. Independent association of insulin resistance with larger amounts of intermuscular adipose tissue and a greater acute insulin response to glucose in African American than in white nondiabetic women. The American Journal of Clinical Nutrition. 82 (6), 1210-1217 (2005).
- Tuttle, L. J., Sinacore, D. R., Mueller, M. J. Intermuscular adipose tissue is muscle specific and associated with poor functional performance. Journal of Aging Research. 2012, 172957(2012).
- Gerber, C., Schneeberger, A. G., Hoppeler, H., Meyer, D. C. Correlation of atrophy and fatty infiltration on strength and integrity of rotator cuff repairs: a study in thirteen patients. Journal of Shoulder and Elbow Surgery. 16 (6), 691-696 (2007).
- Hilton, T. N., Tuttle, L. J., Bohnert, K. L., Mueller, M. J., Sinacore, D. R. Excessive adipose tissue infiltration in skeletal muscle in individuals with obesity, diabetes mellitus, and peripheral neuropathy: association with performance and function. Physical Therapy. 88 (11), 1336-1344 (2008).
- Gaeta, M., et al. Muscle fat-fraction and mapping in Duchenne muscular dystrophy: evaluation of disease distribution and correlation with clinical assessments. Preliminary experience. Skeletal Radiology. 41 (8), 955-961 (2012).
- Buford, T. W., et al. Age-related differences in lower extremity tissue compartments and associations with physical function in older adults. Experimental Gerontology. 47 (1), 38-44 (2012).
- Addona, J., et al. Estimating 3D supraspinatus intramuscular fatty infiltration in older adults: a pilot study. Acta Radiologica. , 2841851221139597(2022).
- Crook, J., et al. Comparison of multifidus muscle intramuscular fat by ultrasound echo intensity and fat-water based MR images in individuals with chronic low back pain. Musculoskeletal Science & Practice. 63, 102717(2023).
- Lee, C., et al. Beige FAPs transplantation improves muscle quality and shoulder function after massive rotator cuff tears. Journal of Orthopaedic Research. 38 (5), 1159-1166 (2020).
- Lee, C., et al. Beige fibro-adipogenic progenitor transplantation reduces muscle degeneration and improves function in a mouse model of delayed repair of rotator cuff tears. Journal of Shoulder and Elbow Surgery. 29 (4), 719-727 (2020).
- Kopinke, D., Roberson, E. C., Reiter, J. F. Ciliary hedgehog signaling restricts injury-induced adipogenesis. Cell. 170 (2), 340-351 (2017).
- Overend, T. J., Cunningham, D. A., Paterson, D. H., Lefcoe, M. S. Thigh composition in young and elderly men determined by computed tomography. Clinical Physiology. 12 (6), 629-640 (1992).
- Li, W., et al. Progression and variation of fatty infiltration of the thigh muscles in Duchenne muscular dystrophy, a muscle magnetic resonance imaging study. Neuromuscular Disorders. 25 (5), 375-380 (2015).
- Davis, D. L., et al. Supraspinatus fatty infiltration on MRI among older adults receiving physical therapy as initial management for clinically suspected rotator cuff tear: A pilot study. Journal of Clinical Imaging Science. 12, 66(2022).
- Salaffi, F., et al. Ultrasound and magnetic resonance imaging as diagnostic tools for sarcopenia in immune-mediated rheumatic diseases (IMRDs). La Radiologia Medica. 127 (11), 1277-1291 (2022).
- Gallagher, D., et al. Adipose tissue in muscle: a novel depot similar in size to visceral adipose tissue. The American Journal of Clinical Nutrition. 81 (4), 903-910 (2005).
- Tuttle, L. J., Sinacore, D. R., Cade, W. T., Mueller, M. J. Lower physical activity is associated with higher intermuscular adipose tissue in people with type 2 diabetes and peripheral neuropathy. Physical Therapy. 91 (6), 923-930 (2011).
- Matsumura, N., et al. Quantitative assessment of fatty infiltration and muscle volume of the rotator cuff muscles using 3-dimensional 2-point Dixon magnetic resonance imaging. Journal of Shoulder and Elbow Surgery. 26 (10), 309-318 (2017).
- Cheuy, V. A., Hastings, M. K., Commean, P. K., Ward, S. R., Mueller, M. J. Intrinsic foot muscle deterioration is associated with metatarsophalangeal joint angle in people with diabetes and neuropathy. Clinical Biomechanics. 28 (9-10), 1055-1060 (2013).
- Samagh, S. P., et al. MRI quantification of fatty infiltration and muscle atrophy in a mouse model of rotator cuff tears. Journal of Orthopaedic Research. 31 (3), 421-426 (2013).
- Gerber, C., Meyer, D. C., Schneeberger, A. G., Hoppeler, H., von Rechenberg, B. Effect of tendon release and delayed repair on the structure of the muscles of the rotator cuff: an experimental study in sheep. The Journal of Bone and Joint Surgery. American Volume. 86 (9), 1973-1982 (2004).
- Goodpaster, B. H., Kelley, D. E., Thaete, F. L., He, J., Ross, R. Skeletal muscle attenuation determined by computed tomography is associated with skeletal muscle lipid content. Journal of Applied Physiology. 89 (1), 104-110 (2000).
- Torriani, M., et al. Lower leg muscle involvement in Duchenne muscular dystrophy: an MR imaging and spectroscopy study. Skeletal Radiology. 41 (4), 437-445 (2012).
- Kim, H. M., Galatz, L. M., Lim, C., Havlioglu, N., Thomopoulos, S. The effect of tear size and nerve injury on rotator cuff muscle fatty degeneration in a rodent animal model. Journal of Shoulder and Elbow Surgery. 21 (7), 847-858 (2012).
- Rowshan, K., et al. Development of fatty atrophy after neurologic and rotator cuff injuries in an animal model of rotator cuff pathology. The Journal of Bone and Joint Surgery. American Volume. 92 (13), 2270-2278 (2010).
- Li, B., et al. Skeletal muscle respiratory uncoupling prevents diet-induced obesity and insulin resistance in mice. Nature Medicine. 6 (10), 1115-1120 (2000).
- Goodpaster, B. H., Theriault, R., Watkins, S. C., Kelley, D. E. Intramuscular lipid content is increased in obesity and decreased by weight loss. Metabolism. 49 (4), 467-472 (2000).
- Biltz, N. K., Meyer, G. A. A novel method for the quantification of fatty infiltration in skeletal muscle. Skeletal Muscle. 7 (1), 1(2017).
- Hakim, C. H., Wasala, N. B., Duan, D. Evaluation of muscle function of the extensor digitorum longus muscle ex vivo and tibialis anterior muscle in situ in mice. Journal of Visualized Experiments. (72), 50183(2013).
- Moorwood, C., Liu, M., Tian, Z., Barton, E. R. Isometric and eccentric force generation assessment of skeletal muscles isolated from murine models of muscular dystrophies. Journal of Visualized Experiments. (71), e50036(2013).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Ungerleider, J. L., Johnson, T. D., Rao, N., Christman, K. L. Fabrication and characterization of injectable hydrogels derived from decellularized skeletal and cardiac muscle. Methods. 84, 53-59 (2015).
- Biltz, N. K., et al. Infiltration of intramuscular adipose tissue impairs skeletal muscle contraction. The Journal of Physiology. 598 (13), 2669-2683 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유