Method Article
Quantification basée sur la décellularisation de l’infiltration graisseuse des muscles squelettiques
Dans cet article
Résumé
La présente étude décrit des méthodologies basées sur la décellularisation pour visualiser et quantifier le dépôt de tissu adipeux intramusculaire (IMAT) à travers le volume musculaire intact, ainsi que la quantification des mesures des adipocytes individuels qui composent l’IMAT.
Résumé
L’infiltration graisseuse est l’accumulation d’adipocytes entre les myofibres dans le muscle squelettique et est une caractéristique importante de nombreuses myopathies, troubles métaboliques et dystrophies. Cliniquement, dans les populations humaines, l’infiltration graisseuse est évaluée à l’aide de méthodes non invasives, notamment la tomodensitométrie (TDM), l’imagerie par résonance magnétique (IRM) et l’échographie (US). Bien que certaines études aient utilisé la tomodensitométrie ou l’IRM pour quantifier l’infiltration graisseuse dans les muscles de souris, les coûts et la résolution spatiale insuffisante restent difficiles. D’autres méthodes pour petits animaux utilisent l’histologie pour visualiser les adipocytes individuels ; Cependant, cette méthodologie souffre d’un biais d’échantillonnage dans les pathologies hétérogènes. Ce protocole décrit la méthodologie permettant de visualiser qualitativement et de mesurer quantitativement l’infiltration graisseuse de manière exhaustive dans le muscle intact de la souris et au niveau des adipocytes individuels en utilisant la décellularisation. Le protocole n’est pas limité à des muscles spécifiques ou à des espèces spécifiques et peut être étendu à la biopsie humaine. De plus, des évaluations qualitatives et quantitatives brutes peuvent être effectuées avec un équipement de laboratoire standard à faible coût, ce qui rend cette procédure plus accessible dans tous les laboratoires de recherche.
Introduction
L’accumulation d’adipocytes entre les myofibres dans le muscle squelettique est une caractéristique importante de conditions disparates, du diabète de type 2 à la sarcopénie en passant par les lésions musculo-squelettiques 1,2,3,4,5,6,7. Une évaluation complète de ce tissu adipeux intramusculaire (IMAT) est essentielle pour comprendre la pathogenèse de ces conditions, car le dépôt d’IMAT est fortement corrélé à la résistance à l’insuline 3,8,9,10 et à une mauvaise fonction des muscles squelettiques 11,12,13,14,15 . Bien que ces associations soient notées depuis des décennies, les mécanismes associés et l’origine de l’IMAT restent un domaine de recherche intense. Cela s’explique en partie par le fait que la plupart des études évaluant l’infiltration graisseuse des muscles squelettiques ont été réalisées chez l’homme, où les investigations mécanistiques sont limitées16,17. Cependant, plus récemment, de petits modèles animaux, y compris des souris, ont été utilisés pour aider à déterminer la régulation cellulaire du développement et de la signalisation IMAT18,19,20. Ce travail vise à fournir un nouvel outil à utiliser avec des modèles de petits animaux pour visualiser et quantifier qualitativement l’infiltration graisseuse des muscles squelettiques.
Cliniquement, dans les populations humaines, l’infiltration graisseuse est évaluée à l’aide de méthodes non invasives, notamment la tomodensitométrie (TDM)6,21, l’imagerie par résonance magnétique (IRM)16,17,22,23 et l’échographie (US)17,24. Ces techniques d’imagerie identifient généralement une région d’intérêt définie (ROI) dans un muscle et acquièrent des tranches d’image dans cette région, bien que des approches globales aient également été utilisées25,26,27. Ces tranches d’image sont soumises à un classement qualitatif6 et quantifiées via un seuillage de pixels28. Des approches similaires ont déjà été utilisées chez les animaux29,30 ; Cependant, ils sont coûteux et nécessitent l’accès à des systèmes d’imagerie pour petits animaux. La résolution spatiale via l’utilisation de la tomodensitométrie et de l’IRM présente également un problème majeur, car ils sont incapables de délimiter les adipocytes IMAT des fibres musculaires squelettiques au sein d’un voxel et s’appuient plutôt sur la séparation subjective des régions principalement musculaires et principalement des régions IMAT31,32. En tant que tel, l’incapacité d’identifier avec précision les tissus adipeux ou musculaires présente également une quantification inexacte des quantités représentatives de ces tissus.
En raison de ces limitations, les techniques actuelles d’évaluation de l’infiltration graisseuse des muscles squelettiques dans les modèles de petits animaux reposent le plus souvent sur l’histologie comme alternative peu coûteuse et accessible33,34. Les procédures de coloration standard, y compris l’hématoxyline et l’éosine (H&E), l’huile rouge O (ORO) et l’immunomarquage pour les marqueurs adipocytaires tels que la périlipine, permettent une détection et une visualisation simples des adipocytes comprenant une infiltration graisseuse dans le muscle. Cependant, les approches histologiques sont rarement exhaustives et, en général, l’évaluation qualitative ou quantitative de l’IMAT se limite à une seule section34. L’extraction lipidique a également été utilisée pour quantifier les lipides musculaires totaux35 ; cependant, cette technique ne permet pas de faire la distinction entre les réserves de lipides intramyocellulaires (IMCL) et de tissu adipeux intramusculaire (IMAT)36. En résumé, les méthodologies actuelles pour visualiser et quantifier la graisse dans le muscle restent limitées soit par les coûts financiers, soit par la détection spécifique de l’IMAT.
Nous décrivons ici une méthode détaillée d’évaluation de l’infiltration graisseuse des muscles squelettiques à la fois par visualisation qualitative et par quantification multi-échelle. Cette méthodologie utilise une technique de décellularisation simple qui élimine les structures myocellulaires, y compris l’IMCL, mais conserve intactes les plus grosses gouttelettes lipidiques dérivées des adipocytes IMAT. La validation de la spécificité de cette technique a été publiée37, y compris l’utilisation de l’extraction lipidique pour montrer l’épuisement de l’IMCL avec la décellularisation, de la μCT pour montrer la rétention de la structure IMAT avec la décellularisation, et de l’histologie pour montrer la distribution de taille similaire des gouttelettes lipidiques IMAT par rapport à celles identifiées avec la décellularisation. Une fois décellularisés, les muscles peuvent être colorés avec des colorants liposolubles pour une visualisation qualitative du motif et de l’étendue de l’infiltration graisseuse et/ou une imagerie quantitative des gouttelettes lipidiques IMAT individuelles. Les colorants peuvent ensuite être extraits avec de l’isopropanol, et la densité optique (OD) de la solution résultante peut être utilisée pour estimer le volume lipidique IMAT. La validation rigoureuse de cette technique a été publiée ailleurs37. Cet article fournit un protocole détaillé pour utiliser cette méthodologie avec des muscles de souris et fournit des conseils de dépannage pour soutenir l’adoption de cette méthode dans d’autres applications, telles que les muscles d’autres espèces ou d’autres tissus.
Protocole
Les soins et le sacrifice des souris ont été effectués conformément au Guide des National Institutes of Health pour l’utilisation et les soins des animaux de laboratoire. Tous les travaux ont été approuvés par le Comité d’études animales de l’Université de Washington à la St. Louis School of Medicine. Des souris mâles C57BL/6J âgées de 2 à 3 mois (voir le tableau des matériaux) ont été utilisées pour générer les exemples d’images inclus dans ce protocole. Toutes les étapes décrites ci-dessous sont effectuées à température ambiante.
1. Décellularisation musculaire
- Préparer une solution de dodécylsulfate de sodium (SDS) à 1 % p/v ; voir le tableau des matériaux) dans une solution saline tamponnée au phosphate (PBS). Remuez la solution jusqu’à ce qu’elle soit complètement mélangée.
REMARQUE : La FDS à 1 % peut être préparée en vrac et conservée à température ambiante pendant 1 mois. - Disséquer le(s) muscle(s) d’intérêt comme décrit précédemment38,39.
- Exposez les muscles d’intérêt en mouillant les cheveux et la peau avec une solution d’éthanol à 70%, puis en faisant une incision transcutanée d’environ 2 cm, puis en enlevant la peau de couverture avec des pinces et des ciseaux à ressort.
REMARQUE : Le ou les muscles d’intérêt ici comprennent le tibial antérieur (TA), le long extenseur des doigts (EDL) et le diaphragme. Certains muscles peuvent se trouver profondément dans d’autres muscles, ce qui nécessite la dissection d’autres muscles (p. ex., la dissection de l’EDL nécessite l’ablation de l’AT). - Disséquez le(s) muscle(s) d’intérêt à l’aide de ciseaux ou de lames tranchants (voir le tableau des matériaux) pour vous assurer que toute l’étendue du muscle est obtenue et que les bords sont lisses.
REMARQUE : Cela se fait idéalement sous un microscope à dissection pour améliorer la visualisation. - Inspectez les muscles pour vous assurer qu’il n’y a pas d’éclats d’os ou de bords déchiquetés, puis coupez-les avec des ciseaux bien aiguisés au besoin.
- Pesez le muscle à l’aide d’une balance analytique et notez le poids.
- Exposez les muscles d’intérêt en mouillant les cheveux et la peau avec une solution d’éthanol à 70%, puis en faisant une incision transcutanée d’environ 2 cm, puis en enlevant la peau de couverture avec des pinces et des ciseaux à ressort.
- Placer le muscle disséqué dans au moins 0,1 mL de SDS à 1 % par milligramme de poids ; Les plaques à 6, 12 ou 24 puits fonctionnent bien pour les muscles de souris diaphragme, TA et EDL, respectivement. Les volumes typiques sont de 6 mL, 3 mL et 1,5 mL pour les plaques à 6, 12 et 24 puits, respectivement.
REMARQUE : La solution SDS provoquera parfois une déformation des muscles, alors assurez-vous que le muscle est plat/étendu lors de l’immersion initiale. - Placez la plaque de puits (ou d’autres récipients) sur un vibrateur à bascule réglé sur 50-80 Hz.
- Inspectez visuellement la solution SDS périodiquement. Lorsque la solution devient trouble, retirez la solution à l’aide d’une pipette (en prenant soin de ne pas aspirer le muscle) et remplacez-la par un volume égal de SDS frais à 1 %. Lorsque la solution reste claire pendant 24 h, la décellularisation est terminée.
REMARQUE : La fréquence requise pour les changements de solution varie en fonction de la taille des muscles et du volume initial de la solution. Les muscles plus gros comme l’AT ont besoin d’un nouveau SDS en quelques heures, et les muscles plus petits comme l’EDL peuvent passer la nuit dans la solution d’origine. - Retirez la solution finale de SDS des muscles décellularisés à l’aide d’une pipette (en prenant soin de ne pas aspirer le muscle) et remplacez-la par un volume égal de PBS.
- Inspectez visuellement les muscles décellularisés à l’aide d’un microscope à dissection et utilisez une pince et des ciseaux pour enlever les poils ou les débris collés au muscle.
REMARQUE : Notez également la clarté du muscle décellularisé dans cette étape. Si le muscle décellularisé n’est pas totalement transparent et que la solution SDS n’augmente pas en turbidité sur 24 h, la décellularisation n’a pas été efficace. Cela crée un artefact dans les évaluations qualitatives et quantitatives, et donc la décellularisation doit toujours être optimisée sur des échantillons d’entraînement avant de procéder à des muscles expérimentaux. - Retirez délicatement le PBS, remplacez-le par un volume égal de solution de formaldéhyde à 3,7 % ou de paraformaldéhyde à 4 % et remettez la plaque dans l’agitateur à bascule pendant 24 h.
REMARQUE : Assurez-vous que la solution de formaldéhyde recouvre entièrement le muscle décellularisé, sinon la coloration sera inégale.
2. Visualisation de l’IMAT avec l’huile rouge O
- Préparez une solution d’ORO.
- Dissoudre 0,5 g de poudre d’ORO (voir le tableau des matériaux) dans 100 mL d’isopropanol pour obtenir une solution mère.
REMARQUE : Ajoutez une chaleur douce à la solution pour la dissoudre complètement. Ce bouillon peut être conservé à température ambiante pendant 1 mois. - Combinez la solution mère ORO et l’eau déminéralisée dans un rapport de 60 :40 pour obtenir la solution de travail nécessaire pour tous les muscles en utilisant un volume d’au moins 0,1 mL / mg de poids musculaire. Les volumes typiques sont de 6 mL, 3 mL et 1,5 mL pour les plaques à 6, 12 et 24 puits, respectivement.
REMARQUE : Inspectez la solution mère avant de mélanger. Si la solution mère contient beaucoup de particules, préparez un nouveau bouillon. - Couvrez la solution de travail pendant 10 minutes pour permettre aux particules de se déposer.
- Filtrez la solution de travail à travers une maille de 40 μm, suivie d’un filtre pour seringue de 0,22 μm.
REMARQUE : Le filtre de la seringue de 0,22 μm se bouche rapidement et doit être remplacé si la solution de travail ne passe pas facilement.
- Dissoudre 0,5 g de poudre d’ORO (voir le tableau des matériaux) dans 100 mL d’isopropanol pour obtenir une solution mère.
- Retirez la solution de formaldéhyde ou de paraformaldéhyde et lavez les muscles décellularisés avec trois changements de solution d’un volume égal de PBS.
- Remplacez le PBS par un volume égal de solution d’isopropanol à 60 % et incubez sur un agitateur à bascule pendant 5 min.
- Remplacez la solution d’isopropanol à 60 % par une solution de travail ORO et incubez sur l’agitateur à bascule pendant 10 min.
REMARQUE : Assurez-vous que la solution de travail ORO recouvre entièrement le muscle décellularisé, sinon la coloration sera inégale. - Remplacez la solution de travail ORO par un volume égal de 1 % de SDS. Inspectez visuellement la solution SDS périodiquement. Lorsque la solution devient visiblement rose, retirez la solution à l’aide d’une pipette (en prenant soin de ne pas aspirer le muscle) et remplacez-la par du SDS frais à 1 %.
- Lorsque la solution reste claire pendant 24 h, remplacez la SDS à 1 % par du PBS et inspectez le muscle coloré sous un microscope à dissection/stéréomicroscope à grossissement 4x. Retirez tous les débris ou particules évidents collés à l’extérieur du muscle. S’il s’agit d’une activité importante, le muscle décellularisé peut être roulé doucement sur un mouchoir en papier pour éliminer les débris/particules.
- Si la coloration est satisfaisante (sphères rouge vif flottant dans une matrice transparente), acquérir des images de la coloration à volonté à l’aide d’une caméra fixée au stéréomicroscope (voir le tableau des matériaux).
REMARQUE : Si le microscope à dissection n’est pas équipé d’une caméra, l’appareil photo d’un téléphone peut être utilisé pour prendre des photos à travers l’oculaire.
3. Visualisation des gouttelettes lipidiques IMAT avec BODIPY
REMARQUE : L’imagerie confocale est plus efficace avec des muscles minces comme l’EDL ou le diaphragme (~2 mm d’épaisseur). Alternativement, des bandes de muscles d’épaisseur comparable comme le TA pourraient être utilisées.
- Préparer une solution à 1 :200 de BODIPY 493/503 fluorescent (voir tableau des matériaux) dans du PBS pour obtenir un volume de solution de travail d’au moins 0,1 mL/mg de poids musculaire. Les volumes typiques sont de 6 mL, 3 mL et 1,5 mL pour les plaques à 6, 12 et 24 puits, respectivement.
- Retirez le formaldéhyde, le paraformaldéhyde ou le SDS à 1 % et lavez les muscles décellularisés avec trois changements de solution d’un volume égal de PBS.
- Remplacez le PBS par la solution de travail BODIPY et incubez sur l’agitateur à bascule pendant 20 min.
- Lavez les muscles décellularisés avec trois changements de solution d’un volume égal de PBS.
- Placez le muscle dans un récipient à fond transparent compatible avec un microscope confocal disponible. Idéalement, le plat aura un fond encastré pour placer une lamelle sur le muscle sans le déformer (voir Tableau des matériaux).
- Obtenir des empilements d’images à l’aide d’un microscope confocal standard (voir Tableau des matériaux) à l’aide du laser 488. Les tailles d’empilement typiques pour un EDL sont de 0,5 à 1 mm avec une épaisseur de tranche de 10 μm, ce qui donne 50 à 100 images par pile.
REMARQUE : Pour quantifier le volume lipidique total, le nombre total de gouttelettes lipidiques IMAT et l’indice de regroupement le plus proche, imagez tout le volume musculaire, en prenant soin de laisser un certain chevauchement pour l’enregistrement de l’image. Pour quantifier le volume moyen de gouttelettes lipidiques, une seule pile peut suffire. - Si vous le souhaitez, colorez les muscles avec de l’ORO, conformément à la section 2, pour obtenir une image complémentaire du muscle entier de la distribution IMAT.
REMARQUE : Parce que BODIPY est fluorescent, il ne sera pas visible au microscope optique lors de l’acquisition d’images d’ORO.
4. Estimation du volume lipidique total par extraction lipidique
- Après l’acquisition de l’image, transférez les muscles à 200 μL d’isopropanol dans des puits individuels d’une plaque à 96 puits, ou adaptez le puits/volume si le muscle est trop gros pour s’adapter.
- Agitez la solution en tapotant la plaque, en pipetant la solution de haut en bas et/ou en écrasant mécaniquement le muscle avec une pointe de pipette jusqu’à ce qu’aucune sphère rouge/fluorescente ne puisse être vue dans le muscle décellularisé au microscope.
REMARQUE : Traitez tous les muscles avec la même combinaison de tapotement, de pipetage et d’écrasement pour une meilleure fiabilité. Veillez également à limiter le temps passé à tapoter, à pipeter et à broyer, car l’isopropanol s’évaporera rapidement. - Mélangez la solution dans chaque puits en pipetant de haut en bas, puis transférez 75 μL dans deux puits propres de la plaque.
- Recouvrez la plaque et lisez l’absorbance des puits de 75 μL dupliqués à l’aide d’un spectrophotomètre ou d’un lecteur de plaques. Si la construction a été colorée avec de l’ORO, lisez la solution à 500 nm ; s’il a été coloré avec BODIPY 493/503, lisez la plaque à 493 nm.
REMARQUE : Si la construction a été colorée à la fois avec BODIPY et ORO, il est recommandé de lire la plaque à 500 nm, car les lectures de 500 nm donnent des résultats similaires entre les constructions colorées avec ORO uniquement et ORO plus BODIPY. - Divisez la lecture de l’absorbance par le poids enregistré du muscle si vous le souhaitez pour corriger les différences de taille entre les échantillons.
5. Quantification des métriques des gouttelettes lipidiques IMAT à partir d’images confocales
REMARQUE : Cette section nécessite l’accès à la version 1.47 d’ImageJ (voir le tableau des matériaux) ou une version ultérieure et des compétences de base d’ImageJ40.
- Ouvrez des piles confocales dans ImageJ.
REMARQUE : Différents microscopes confocaux peuvent enregistrer des images confocaux dans différents formats. ImageJ peut nécessiter un plugin ou une variante supplémentaire, tel que Fiji, pour ouvrir les piles41. Les algorithmes utilisés font partie du progiciel ImageJ. - Exécutez un algorithme de seuillage dans ImageJ pour identifier les pixels positifs BODIPY. Cela convertit l’image actuelle en une image binaire.
- Ouvrez l’interface utilisateur du seuil en sélectionnant Image > Ajuster > seuil. Dans l’interface utilisateur, sélectionnez Intermodes comme type de seuillage et assurez-vous que l’arrière-plan sombre est sélectionné. Aucune autre option n’a besoin d’être sélectionnée. Cliquez ensuite sur Appliquer.
- Une boîte de dialogue s’ouvre pour convertir la pile en binaire. Assurez-vous que les options suivantes sont sélectionnées : Méthode : Intermodes ; Arrière-plan : Sombre. Calculez le seuil pour chaque image et fond noir (des masques binaires). Cela génère une pile binaire, où le blanc indique les pixels positifs BODIPY et le noir indique les pixels négatifs BODIPY.
REMARQUE : L’algorithme de seuillage Intermodes n’est peut-être pas le meilleur choix pour tous les utilisateurs. L’inspection subjective des options de seuillage intégrées d’ImageJ permet de sélectionner l’algorithme optimal pour séparer les pixels positifs et négatifs BODIPY.
- Exécutez l’algorithme Watershed dans ImageJ pour séparer les gouttelettes lipidiques qui se touchent. Sélectionnez Traiter > binaire > bassin versant. Une boîte de dialogue s’ouvre et vous demande si toutes les images de la pile doivent être traitées. Sélectionnez Oui. Cela ajoute de fines lignes noires divisant de plus grandes zones de blanc uni.
- Identifiez les ROI à l’aide de l’algorithme Analyze Particles (Analyser les particules) dans ImageJ.
- Sélectionnez Analyser > Analyser les particules. Une boîte de dialogue s’ouvre pour définir les paramètres de sélection.
REMARQUE : La sélection de la plage de taille est essentielle pour obtenir la meilleure estimation des retours sur investissement des gouttelettes lipidiques. La borne inférieure élimine les régions qui sont probablement trop petites pour être des gouttelettes lipidiques dérivées de l’IMAT (artefact d’arrière-plan), et la limite supérieure élimine les régions qui sont probablement trop grandes pour être des gouttelettes lipidiques dérivées d’un seul IMAT (touchant des gouttelettes lipidiques qui n’ont pas été séparées par l’algorithme Watershed). - Pour définir ces valeurs, ouvrez l’image d’origine et tracez le contour de la plus petite et de la plus grande gouttelette lipidique visible à l’aide de l’outil Ovale. Ensuite, ajoutez ces formes au gestionnaire de ROI en tapant « t ». Sélectionnez Analyser, puis Définir les mesures. Une boîte de dialogue s’ouvre pour la sélection des paramètres.
- Cochez Zone uniquement et cliquez sur OK. Ensuite, sélectionnez Mesurer dans le gestionnaire de retour sur investissement. Utilisez les deux mesures de surface de cette fenêtre Résultats comme plage de tailles dans Analyser les particules.
- Assurez-vous que l’option Ajouter au gestionnaire est cochée. Aucune autre option n’est nécessaire.
- Sélectionnez Analyser > Analyser les particules. Une boîte de dialogue s’ouvre pour définir les paramètres de sélection.
- Superposez les ROI sur la pile confocale en cochant Afficher tout dans le gestionnaire de retour sur investissement. Utilisez la barre de défilement pour inspecter chaque tranche de pile individuellement et ajoutez les régions manquantes à la main à l’aide de l’outil Ovale (situé dans la barre d’outils ImageJ).
- Générez les mesures de retour sur investissement. Sélectionnez Analyser > Définir les mesures , puis sélectionnez Zone, Centroïde, Ajuster l’ellipse et Position de la pile. Cliquez sur OK. Ensuite, sélectionnez Mesurer dans le gestionnaire de retour sur investissement. Les données du tableau Résultats peuvent être sélectionnées et copiées dans Matlab ou Excel pour une analyse plus approfondie.
- Affinez les ROI de chaque pile en un seul retour sur investissement à l’aide du code Matlab37 de Refine.m ou d’un algorithme similaire.
REMARQUE : Cette étape est requise car les étapes 5.2 à 5.4 permettent d’identifier la même gouttelette lipidique dans des tranches adjacentes comme des ROI distincts. Cependant, les ROI peuvent également être identifiés à la main uniquement, ou les ROI en double peuvent être éliminés à la main dans ImageJ pour éviter d’avoir besoin de Matlab. - Obtenez les statistiques récapitulatives dans le ROI à l’aide de Matlab ou d’Excel.
- Estimez le nombre total de gouttelettes lipidiques comme le nombre total de ROI.
- Estimez le volume des gouttelettes lipidiques comme le volume de l’ellipse ajusté à chaque ROI 2D, en supposant que la profondeur de la forme est la moyenne des axes majeur et mineur de l’ellipse.
- Estimez le volume total de lipides, qui est la somme des volumes de gouttelettes lipidiques estimés individuellement.
Résultats
Visualisation qualitative de l’infiltration graisseuse des muscles squelettiques
Les muscles correctement décellularisés sont blancs et semi-transparents (section 1 ; Graphique 1). Lorsque les muscles décellularisés sont colorés avec de l’ORO pour visualiser l’IMAT (section 2), les gouttelettes lipidiques IMAT sont apparentes dans les structures musculaires claires sous forme de sphères rouges (Figure 1). Les muscles sains des membres postérieurs de souris ont peu d’IMAT naturel, mis en évidence par peu ou pas de lipides rouges positifs à l’ORO (Figure 1A). En comparaison, les muscles des membres postérieurs auxquels on a injecté de la cardiotoxine (CTX ; Graphique 1B) ou du glycérol (GLY ; Graphique 1C) 14 jours avant la décellularisation, on observe une accumulation accrue d’IMAT, avec une concentration plus élevée d’IMAT après CTX par rapport à GLY, comme indiqué précédemment37.
Une décellularisation incomplète peut être identifiée immédiatement après le traitement initial de la SDS ou après le lavage de la coloration ORO par des fibres semi-opaques de rose pâle (figure 2B par rapport à la figure 2A). À la suite d’un délavage de l’ORO, il est possible d’identifier un dégagement incomplet de l’ORO sous la forme d’un fond uniforme rose ou rouge, plutôt que de lignes de fibres distinctes (figure 2C). La figure 2A,B contient également du tissu adipeux épimusculaire (astérisques), un amas de gouttelettes lipidiques à l’extérieur du muscle décellularisé. La figure 2C montre également le pliage musculaire qui peut se produire si les muscles ne sont pas étalés pendant la décellularisation. La décellularisation incomplète, la clairance incomplète de l’ORO et le tissu adipeux épimusculaire résiduel augmentent tous artificiellement la (DO) du lipide extrait, mais n’entravent pas nécessairement l’évaluation qualitative de l’infiltration graisseuse s’ils sont reconnus comme un artefact.
Imagerie quantitative de l’infiltration graisseuse des muscles squelettiques
Les gouttelettes lipidiques marquées par fluorescence BODIPY peuvent être imagées par microscopie confocale pour une évaluation plus détaillée des paramètres et de la distribution des gouttelettes lipidiques individuelles (Figure 3). Ce processus est semi-automatisé, comme décrit précédemment, y compris le code Matlab37. Une bonne coloration BODIPY permet d’obtenir des formes elliptiques brillantes délimitées des formes voisines lorsqu’elles sont imagées dans le plan (Figure 3A). Le seuillage et la segmentation de la forme constituent un bon premier passage pour générer des retours sur investissement pour chaque gouttelette lipidique (Figure 3B), mais des modifications manuelles sont nécessaires pour corriger les erreurs. L’erreur la plus répandue concerne les gouttelettes lipidiques qui sont profondément dans les tissus et qui ne sont donc pas brillantes sur les tranches (figure 3B ; doubles flèches roses). Il est possible de remédier à ce problème en ajoutant des ROI à la main à l’aide de l’outil Ovale d’ImageJ (Figure 3C). La seconde consiste à identifier un groupe de gouttelettes lipidiques comme un seul ROI (Figure 3B ; astérisque rouge). Ce problème peut être corrigé en supprimant et en remplaçant le retour sur investissement d’origine par plusieurs nouveaux retours sur investissement (Figure 3D). Enfin, une seule gouttelette lipidique est identifiée comme un ROI unique en plusieurs tranches, de sorte que les ROI dupliqués doivent être consolidés en un seul ROI (Figure 3E ; flèche bleue). Cela se fait plus facilement à l’aide d’un outil de traitement de données tel que Matlab, mais peut également être fait à la main en identifiant le plus grand retour sur investissement et en supprimant le reste. Les valeurs moyennes de chaque métrique dans les souris C57BL6/J et 129Sv peuvent être trouvées dans Biltz et al.37.
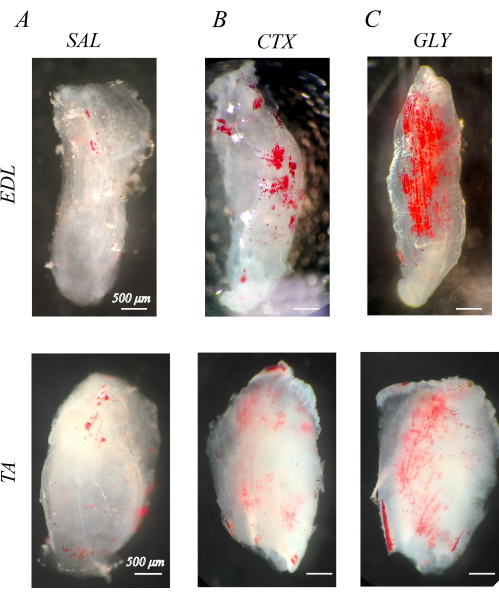
Figure 1 : Exemple de coloration de l’O rouge à l’huile (ORO) des muscles décellularisés. Muscles colorés par l’ORO 14 jours après l’injection d’une solution saline (SAL), d’une cardiotoxine (CTX) ou d’un glycérol (GLY). Les muscles extenseurs des doigts (EDL) et tibiaux antérieurs (TA) de souris ont peu d’IMAT (sphères rouges) avec le traitement SAL (A), mais accumulent l’IMAT en réponse au traitement CTX (B) et GLY (C). Il y a une décellularisation complète et un lavage de l’ORO, mis en évidence par des gouttelettes lipidiques positives distinctes dans un fond musculaire blanc transparent. Barres d’échelle = 500 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
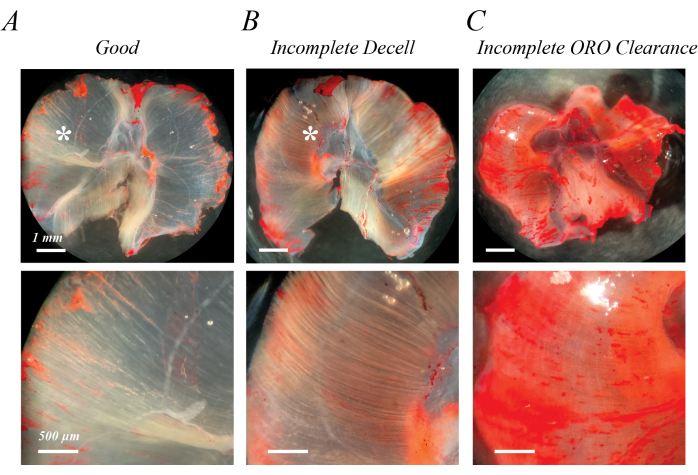
Figure 2 : Exemples de mauvais résultats de coloration ORO. Une décellularisation incomplète ou une clairance ORO incomplète conduit à un fond rose/rouge semi-opaque. Par rapport au fond blanc transparent du muscle diaphragme de souris entièrement décellularisé (A), la décellularisation incomplète est caractérisée par des traces de fibres rose clair/rouge (B), et la clairance ORO incomplète est caractérisée par un fond rose/rouge diffus (C). Barres d’échelle : panneaux supérieurs = 1 mm ; Panneaux inférieurs = 500 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
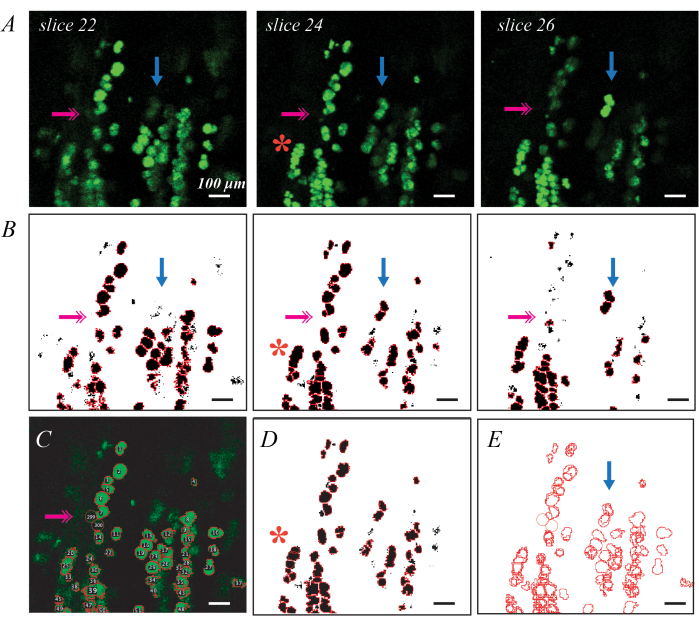
Figure 3 : Exemples d’identification individuelle de gouttelettes lipidiques par coloration fluorescente BODIPY et microscopie confocale Les gouttelettes lipidiques individuelles colorées par BODIPY peuvent être identifiées et quantifiées dans les muscles décellularisés à l’aide de la microscopie confocale. Les coupes individuelles à travers une pile confocale montrent des gouttelettes lipidiques dans le plan sous forme d’ellipses vert vif, et des gouttelettes lipidiques hors du plan sous forme de formes plus faibles (A ; flèches bleues). Le seuillage, combiné à la segmentation des objets des bassins versants et à l’identification du retour sur investissement, permet de cartographier les retours sur investissement colorés par BODIPY (B). Le seuillage peut manquer certaines gouttelettes lipidiques plus faibles (B ; double flèche rose), nécessitant une identification à la main (C). La segmentation des bassins versants peut regrouper plusieurs gouttelettes lipidiques (B ; astérisque rouge), ce qui nécessite la suppression du retour sur investissement et une réestimation manuelle (D). La même gouttelette lipidique est identifiée en plusieurs tranches, ce qui nécessite un enregistrement d’image (E) pour supprimer les ROI en double. Barres d’échelle = 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Ce manuscrit décrit des méthodes permettant de visualiser et de quantifier qualitativement l’infiltration graisseuse des muscles squelettiques dans de petits modèles animaux qui peuvent être appliquées à une meilleure compréhension de la pathogenèse du développement et de l’expansion pathologique du tissu adipeux intramusculaire (IMAT). L’utilisation de la décellularisation du muscle entier et de la coloration liposoluble permet d’utiliser une méthodologie économique, reproductible et simple pour évaluer de manière exhaustive la présence d’IMAT dans des muscles entiers.
La base de ce protocole est que la décellularisation du muscle avec SDS élimine les composants cellulaires des myofibres, y compris les petites gouttelettes lipidiques de l’IMCL, mais épargne les grosses gouttelettes lipidiques dans les adipocytes intramyocellulaires. Le SDS a été largement utilisé42 dans l’ingénierie tissulaire pour décellulariser les matrices. Les tissus tels que les muscles adipeux et squelettiques nécessitent généralement une dissociation mécanique supplémentaire et/ou une extraction à l’alcool pour éliminer le lipide adipocytaire résiduel42,43. Nous avons déjà montré que c’est parce que si la décellularisation avec SDS élimine l’IMCL, elle épargne la grosse gouttelette lipidique dans les adipocytes37. L’imagerie d’un muscle intact coloré à l’osmium tétroxyde avant et après la décellularisation avec μCT a vérifié que le modèle spatial de l’IMAT n’était pas perturbé par la décellularisation. De plus, la quantification intramusculaire des triglycérides dans un muscle décellularisé avec un IMAT négligeable était de ~5% des valeurs musculaires intactes, vérifiant l’élimination de l’IMCL. Par conséquent, cette méthodologie retient les gouttelettes lipidiques IMAT dans leur distribution anatomique d’origine à travers une matrice musculaire semi-transparente.
Une décellularisation correcte est l’étape la plus critique de ce protocole. Si la décellularisation est incomplète, les gouttelettes lipidiques IMAT seront difficiles à visualiser et l’IMCL résiduel provoquera une coloration de fond élevée avec ORO ou BODIPY (Figure 2). Les erreurs courantes commises par les utilisateurs inexpérimentés sont une couverture SDS inadéquate par muscle (à l’intérieur de chaque puits), de sorte que chaque muscle n’est pas complètement recouvert de solution SDS, l’absence d’utilisation d’une bascule pour agiter la solution pendant la décellularisation et le fait de ne pas effectuer de changements de solution assez fréquemment. Dans ce manuscrit, nous avons recommandé la quantité de SDS nécessaire par unité de masse musculaire, mais l’utilisateur devra toujours s’assurer que les muscles sont complètement recouverts de solutions, car chaque muscle a une géométrie unique. Il est également recommandé aux utilisateurs de changer généreusement les solutions (jusqu’à deux fois par jour) pour s’assurer que la décellularisation est complète. Une coloration de bonne qualité des gouttelettes lipidiques IMAT a été obtenue après jusqu’à 4 jours de traitement par SDS. Pour obtenir des résultats de coloration ORO de haute qualité, une fixation adéquate et une préparation de la solution ORO sont également importantes. Comme pour le traitement SDS décrit ci-dessus, une couverture adéquate de la solution de formaldéhyde à 3,7 % pour chaque échantillon musculaire est nécessaire. Si le muscle est retiré du fixateur trop tôt, les gouttelettes lipidiques ne se coloreront que faiblement avec l’ORO. Un total de 1 à 2 heures devrait suffire, mais une fixation de nuit est recommandée pour s’assurer que le fixateur pénètre au centre du muscle et fixe complètement toutes les gouttelettes lipidiques. Un défi supplémentaire avec la coloration ORO est que lorsque la concentration d’alcool est réduite à 60%, une particule commence à se former. Cette particule peut se déposer à la surface et se coincer à la frontière du muscle. La meilleure façon d’éviter cela est de créer une nouvelle solution de travail pour chaque coloration et d’utiliser des filtres de 40 μm et de 0,22 μm. Ensuite, en maintenant l’agitation avec la bascule et en limitant le temps de coloration à 10 minutes, vous éviterez que les particules qui se forment ne se déposent. Si le problème persiste, il peut être utile de préparer une nouvelle solution mère d’ORO. Si un artefact reste collé à la surface musculaire décellularée, un stéréomicroscope, une pince et des ciseaux chirurgicaux peuvent être utilisés pour retirer cet artefact. Le fait de ne pas éliminer les artefacts aura un impact sur la qualité de l’image des muscles et surestimera le contenu IMAT pendant la partie d’extraction des lipides en vue de la lecture de la DA.
Dans l’ensemble, cette technique est simple et offre plusieurs avantages par rapport aux méthodes de référence pour visualiser et quantifier l’infiltration graisseuse des muscles squelettiques. Les techniques non invasives, telles que la tomodensitométrie, l’IRM et l’échographie américaine, qui sont largement utilisées chez l’homme et parfois dans des modèles animaux, ont une résolution spatiale limitée et sont incapables de distinguer les gouttelettes lipidiques des fibres musculaires. Ainsi, un pixel ou un voxel d’intensité de signal intermédiaire est attribué comme « muscle » ou « graisse », alors qu’en réalité, il s’agit probablement d’un mélange de myofibres et d’adipocytes. Plus fréquemment, l’infiltration graisseuse dans le muscle animal est évaluée par histologie, le plus souvent par ORO dans les cryocoupes musculaires. Cependant, cela n’est généralement effectué que dans une seule section représentative et est difficile à quantifier en raison de la dispersion des lipides sur la section. En revanche, la coloration ORO d’un muscle décellularisé entier fournit une évaluation complète de l’IMAT avec des coûts et des efforts similaires à ceux d’une morphologie intacte. De plus, en plus d’améliorer la visualisation, la coloration ORO de la décellularisation permet de quantifier l’infiltration graisseuse par extraction lipidique. Pour une analyse plus approfondie des caractéristiques de l’infiltration graisseuse, une coloration fluorescente, BODIPY, peut être utilisée en conjonction avec la microscopie confocale. Cela permet de reconstruire des gouttelettes lipidiques IMAT individuelles pour cartographier le paysage 3D, ce qui n’est pas possible avec l’histologie à moins que des coupes ne soient analysées sur toute la longueur du muscle. Bien qu’un microscope confocal ne soit pas un équipement de laboratoire standard, il est plus susceptible d’être accessible dans un milieu universitaire ou industriel que l’IRM ou la tomodensitométrie pour petits animaux. De plus, une grande partie de ce processus peut être automatisée, ce qui réduit le coût en temps par rapport à l’histologie séquentielle. L’optimisation des réglages du microscope confocal est une considération supplémentaire pour la coloration BODIPY. Ceux-ci sont uniques à chaque microscope. La valeur critique est l’intensité du laser, qui doit être suffisamment élevée pour détecter les gouttelettes lipidiques sur la surface distante du muscle tout en ne saturant pas le signal des gouttelettes lipidiques du côté proche. Pour cette raison, il est suggéré que l’utilisation de la coloration BODIPY avec microscopie confocale est mieux adaptée aux muscles plus fins, y compris l’EDL ou le diaphragme.
Plusieurs limites de cette approche méritent d’être discutées. Tout d’abord, bien que l’on s’attende à ce que cette technique ait une large applicabilité au-delà des modèles de lésions (cardiotoxine et glycérol) chez la souris présentés ici, de nouvelles applications (par exemple, le modèle mdx) peuvent nécessiter une optimisation, car la taille et la composition du muscle (par exemple, la fibrose) pourraient affecter la décellularisation, nécessitant une concentration accrue de SDS ou des temps d’incubation. D’autres modèles de maladies avec une masse musculaire altérée nécessiteraient également une analyse des mesures absolues et normalisées (à la masse musculaire) de l’infiltration graisseuse pour déterminer la quantité absolue de lipides ou le pourcentage de lipides par rapport au volume musculaire afin de fournir une mesure de résultat plus significative. De plus, cette technique devrait être largement applicable à des modèles animaux de plus grande taille et à des biopsies humaines, mais cela peut nécessiter une optimisation pour chaque nouvelle application. Deuxièmement, dans cette stratégie, l’ensemble du muscle doit être dédié à ce test et ne peut pas être utilisé pour évaluer une autre caractéristique pathologique. Les études qui visent à évaluer les changements longitudinaux de l’IMAT sont mieux servies par des techniques d’imagerie non invasives et les études dont l’objectif principal nécessite le muscle à d’autres fins (histologie, réaction en chaîne quantitative par polymérase, transfert Western) sont mieux servies par une évaluation histologique, car le reste du muscle congelé peut être affecté à d’autres tests. Cependant, ce test est bien adapté pour être associé à des tests in vivo, tels que la course sur tapis roulant, ou des tests contractiles ex vivo , car ces mesures peuvent être effectuées avant la décellularisation44. Troisièmement, bien que l’utilisation de la coloration BODIPY avec la microscopie confocale permette une visualisation et une quantification à haute résolution des gouttelettes lipidiques, elle ne peut pas identifier de manière concluante les gouttelettes lipidiques comme des adipocytes individuels, car la membrane cellulaire est retirée et les protéines adipocytaires endogènes sont perdues. Les adipocytes multiloculaires, représentant des adipocytes immatures ou un phénotype « brun/beige », peuvent être identifiés comme des gouttelettes lipidiques multiples. Enfin, le protocole ne fonctionne pas bien sur du muscle préalablement gelé. Ces limites sont probablement les plus profondes pour les biopsies humaines, car si la biopsie entière peut être décellularisée, la distribution spatiale de l’IMAT dans la biopsie n’est pas susceptible d’être plus représentative de l’ensemble du muscle qu’une coupe histologique. Cependant, étant donné que cette technique est relativement insensible aux conditions de manipulation de la biopsie non congelée (p. ex., des heures sur la glace dans le PBS), la biopsie pourrait être divisée plus tard pour divers essais, y compris une partie pour la décellularisation, ce qui permettrait une meilleure résolution des gouttelettes lipidiques individuelles.
En conclusion, une nouvelle méthode d’analyse qualitative et quantitative de l’infiltration graisseuse des muscles squelettiques a été développée en colorant et en imageant les lipides retenus de constructions décellularisées. Cette méthodologie offre des améliorations par rapport aux approches de référence, en ce sens qu’elle permet une imagerie complète de l’infiltration graisseuse tridimensionnelle dans le muscle et une quantification rapide et peu coûteuse avec la coloration ORO. Pour des mesures plus détaillées, une deuxième coloration liposoluble de BODIPY fournit une quantification plus détaillée du nombre, du volume et du modèle de distribution des gouttelettes lipidiques, telles qu’elles sont imagées par microscopie confocale. Ensemble, ces mesures fournissent aux chercheurs un moyen de mesurer avec précision l’infiltration graisseuse des muscles squelettiques au niveau des gouttelettes lipidiques individuelles sans échantillonnage ni imagerie non invasive coûteuse.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce travail a été soutenu par R01AR075773 au GAM.
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 µm Syringe Filter | Fisher Scientific | SLGP033RS | |
| 1 mL LuerLock Syringes | Fisher Scientific | 14823434 | |
| 12 mm Coverslips | Fisher Scientific | 12545F | |
| 12 well plates | Fisher Scientific | 08-772-29 | |
| 24 well plates | Fisher Scientific | 08-772-1H | |
| 2-Propanol (Isopropanol) | Sigma Aldrich | I9516 | 0.5 mg/mL stock solution can be stored at room temperature for 1 month. Working solution must be made fresh. |
| 37% Formaldehyde Solution | Sigma Aldrich | 8187081000 | |
| 40 µm Mesh Filter | Fisher Scientific | 87711 | |
| 6 well plates | Fisher Scientific | 08-772-1B | |
| 96 well plates | Fisher Scientific | 08-772-2C | |
| BODIPY 493/503 | Fisher Scientific | D-3922 | |
| C57BL/6J Mice | Jackson Laboratory | 000664 | |
| Confocal Imaging Dish | VWR | 734-2905 | |
| Confocal Microscope | Leica | TCS SPEII | |
| Dissecting/stereo Microscope | Zeiss | 4107009123001000 | |
| Dissection scissors | Fine Science Tools | 14060-09 | |
| Dumont #5 forceps | Fine Science Tools | 11254-20 | |
| Ethanol | Fisher Scientific | 033361.K2 | |
| ImageJ | NIH | ||
| Matlab | Mathworks | ||
| Oil Red O Powder | Sigma Aldrich | O0625 | |
| Plate reader | Bio-tek | Synergy II | |
| Rocker/Shaker | Reliable Scientific | 55D | |
| Sodium Dodecyl Sulfate (SDS) | Sigma Aldrich | L3771 | 1% Solution can be stored at room temperature for 1 month |
| Transfer pipettes | Fisher Scientific | 137119D | |
| Vannas spring scissors | Fine Science Tools | 15000-00 |
Références
- Delmonico, M. J., et al. Longitudinal study of muscle strength, quality, and adipose tissue infiltration. The American Journal of Clinical Nutrition. 90 (6), 1579-1585 (2009).
- Goodpaster, B. H., et al. Obesity, regional body fat distribution, and the metabolic syndrome in older men and women. Archives of Internal Medicine. 165 (7), 777-783 (2005).
- Freda, P. U., et al. Lower visceral and subcutaneous but higher intermuscular adipose tissue depots in patients with growth hormone and insulin-like growth factor I excess due to acromegaly. The Journal of Clinical Endocrinology and Metabolism. 93 (6), 2334-2343 (2008).
- Garg, A., Peshock, R. M., Fleckenstein, J. L. Adipose tissue distribution pattern in patients with familial partial lipodystrophy (Dunnigan variety). The Journal of Clinical Endocrinology and Metabolism. 84 (1), 170-174 (1999).
- Gorgey, A. S., Dudley, G. A. Skeletal muscle atrophy and increased intramuscular fat after incomplete spinal cord injury. Spinal Cord. 45 (4), 304-309 (2007).
- Goutallier, D., Postel, J. M., Bernageau, J., Lavau, L., Voisin, M. C. Fatty muscle degeneration in cuff ruptures. Pre- and postoperative evaluation by CT scan. Clinical Orthopaedics and Related Research. (304), 78-83 (1994).
- Liu, W., Liu, Y., Lai, X., Kuang, S. Intramuscular adipose is derived from a non-Pax3 lineage and required for efficient regeneration of skeletal muscles. Developmental Biology. 361 (1), 27-38 (2012).
- Goodpaster, B. H., Thaete, F. L., Kelley, D. E. Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. The American Journal of Clinical Nutrition. 71 (4), 885-892 (2000).
- Elder, C. P., Apple, D. F., Bickel, C. S., Meyer, R. A., Dudley, G. A. Intramuscular fat and glucose tolerance after spinal cord injury-a cross-sectional study. Spinal Cord. 42 (12), 711-716 (2004).
- Albu, J. B., et al. Independent association of insulin resistance with larger amounts of intermuscular adipose tissue and a greater acute insulin response to glucose in African American than in white nondiabetic women. The American Journal of Clinical Nutrition. 82 (6), 1210-1217 (2005).
- Tuttle, L. J., Sinacore, D. R., Mueller, M. J. Intermuscular adipose tissue is muscle specific and associated with poor functional performance. Journal of Aging Research. 2012, 172957(2012).
- Gerber, C., Schneeberger, A. G., Hoppeler, H., Meyer, D. C. Correlation of atrophy and fatty infiltration on strength and integrity of rotator cuff repairs: a study in thirteen patients. Journal of Shoulder and Elbow Surgery. 16 (6), 691-696 (2007).
- Hilton, T. N., Tuttle, L. J., Bohnert, K. L., Mueller, M. J., Sinacore, D. R. Excessive adipose tissue infiltration in skeletal muscle in individuals with obesity, diabetes mellitus, and peripheral neuropathy: association with performance and function. Physical Therapy. 88 (11), 1336-1344 (2008).
- Gaeta, M., et al. Muscle fat-fraction and mapping in Duchenne muscular dystrophy: evaluation of disease distribution and correlation with clinical assessments. Preliminary experience. Skeletal Radiology. 41 (8), 955-961 (2012).
- Buford, T. W., et al. Age-related differences in lower extremity tissue compartments and associations with physical function in older adults. Experimental Gerontology. 47 (1), 38-44 (2012).
- Addona, J., et al. Estimating 3D supraspinatus intramuscular fatty infiltration in older adults: a pilot study. Acta Radiologica. , 2841851221139597(2022).
- Crook, J., et al. Comparison of multifidus muscle intramuscular fat by ultrasound echo intensity and fat-water based MR images in individuals with chronic low back pain. Musculoskeletal Science & Practice. 63, 102717(2023).
- Lee, C., et al. Beige FAPs transplantation improves muscle quality and shoulder function after massive rotator cuff tears. Journal of Orthopaedic Research. 38 (5), 1159-1166 (2020).
- Lee, C., et al. Beige fibro-adipogenic progenitor transplantation reduces muscle degeneration and improves function in a mouse model of delayed repair of rotator cuff tears. Journal of Shoulder and Elbow Surgery. 29 (4), 719-727 (2020).
- Kopinke, D., Roberson, E. C., Reiter, J. F. Ciliary hedgehog signaling restricts injury-induced adipogenesis. Cell. 170 (2), 340-351 (2017).
- Overend, T. J., Cunningham, D. A., Paterson, D. H., Lefcoe, M. S. Thigh composition in young and elderly men determined by computed tomography. Clinical Physiology. 12 (6), 629-640 (1992).
- Li, W., et al. Progression and variation of fatty infiltration of the thigh muscles in Duchenne muscular dystrophy, a muscle magnetic resonance imaging study. Neuromuscular Disorders. 25 (5), 375-380 (2015).
- Davis, D. L., et al. Supraspinatus fatty infiltration on MRI among older adults receiving physical therapy as initial management for clinically suspected rotator cuff tear: A pilot study. Journal of Clinical Imaging Science. 12, 66(2022).
- Salaffi, F., et al. Ultrasound and magnetic resonance imaging as diagnostic tools for sarcopenia in immune-mediated rheumatic diseases (IMRDs). La Radiologia Medica. 127 (11), 1277-1291 (2022).
- Gallagher, D., et al. Adipose tissue in muscle: a novel depot similar in size to visceral adipose tissue. The American Journal of Clinical Nutrition. 81 (4), 903-910 (2005).
- Tuttle, L. J., Sinacore, D. R., Cade, W. T., Mueller, M. J. Lower physical activity is associated with higher intermuscular adipose tissue in people with type 2 diabetes and peripheral neuropathy. Physical Therapy. 91 (6), 923-930 (2011).
- Matsumura, N., et al. Quantitative assessment of fatty infiltration and muscle volume of the rotator cuff muscles using 3-dimensional 2-point Dixon magnetic resonance imaging. Journal of Shoulder and Elbow Surgery. 26 (10), 309-318 (2017).
- Cheuy, V. A., Hastings, M. K., Commean, P. K., Ward, S. R., Mueller, M. J. Intrinsic foot muscle deterioration is associated with metatarsophalangeal joint angle in people with diabetes and neuropathy. Clinical Biomechanics. 28 (9-10), 1055-1060 (2013).
- Samagh, S. P., et al. MRI quantification of fatty infiltration and muscle atrophy in a mouse model of rotator cuff tears. Journal of Orthopaedic Research. 31 (3), 421-426 (2013).
- Gerber, C., Meyer, D. C., Schneeberger, A. G., Hoppeler, H., von Rechenberg, B. Effect of tendon release and delayed repair on the structure of the muscles of the rotator cuff: an experimental study in sheep. The Journal of Bone and Joint Surgery. American Volume. 86 (9), 1973-1982 (2004).
- Goodpaster, B. H., Kelley, D. E., Thaete, F. L., He, J., Ross, R. Skeletal muscle attenuation determined by computed tomography is associated with skeletal muscle lipid content. Journal of Applied Physiology. 89 (1), 104-110 (2000).
- Torriani, M., et al. Lower leg muscle involvement in Duchenne muscular dystrophy: an MR imaging and spectroscopy study. Skeletal Radiology. 41 (4), 437-445 (2012).
- Kim, H. M., Galatz, L. M., Lim, C., Havlioglu, N., Thomopoulos, S. The effect of tear size and nerve injury on rotator cuff muscle fatty degeneration in a rodent animal model. Journal of Shoulder and Elbow Surgery. 21 (7), 847-858 (2012).
- Rowshan, K., et al. Development of fatty atrophy after neurologic and rotator cuff injuries in an animal model of rotator cuff pathology. The Journal of Bone and Joint Surgery. American Volume. 92 (13), 2270-2278 (2010).
- Li, B., et al. Skeletal muscle respiratory uncoupling prevents diet-induced obesity and insulin resistance in mice. Nature Medicine. 6 (10), 1115-1120 (2000).
- Goodpaster, B. H., Theriault, R., Watkins, S. C., Kelley, D. E. Intramuscular lipid content is increased in obesity and decreased by weight loss. Metabolism. 49 (4), 467-472 (2000).
- Biltz, N. K., Meyer, G. A. A novel method for the quantification of fatty infiltration in skeletal muscle. Skeletal Muscle. 7 (1), 1(2017).
- Hakim, C. H., Wasala, N. B., Duan, D. Evaluation of muscle function of the extensor digitorum longus muscle ex vivo and tibialis anterior muscle in situ in mice. Journal of Visualized Experiments. (72), 50183(2013).
- Moorwood, C., Liu, M., Tian, Z., Barton, E. R. Isometric and eccentric force generation assessment of skeletal muscles isolated from murine models of muscular dystrophies. Journal of Visualized Experiments. (71), e50036(2013).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Ungerleider, J. L., Johnson, T. D., Rao, N., Christman, K. L. Fabrication and characterization of injectable hydrogels derived from decellularized skeletal and cardiac muscle. Methods. 84, 53-59 (2015).
- Biltz, N. K., et al. Infiltration of intramuscular adipose tissue impairs skeletal muscle contraction. The Journal of Physiology. 598 (13), 2669-2683 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon