Method Article
Zebra Balığı Embriyolarında Optogenetik Sinyal Aktivasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Sinyal yollarının optogenetik manipülasyonu, gelişim, rejenerasyon, homeostaz ve hastalıkta sinyalleşmenin nasıl çözüldüğünü araştırmak için güçlü bir strateji olabilir. Bu protokol, erken zebra balığı embriyosunda ışık-oksijen-voltaj algılama alanı tabanlı Nodal ve kemik morfojenik protein (BMP) sinyal aktivatörlerinin kullanılması için pratik yönergeler sağlar.
Özet
Sinyal yolları, gelişim, rejenerasyon, homeostaz ve hastalık dahil olmak üzere temel biyolojik süreçleri düzenler. Sinyalleşmenin bu geniş kapsamlı bağlamlarda nasıl yorumlandığını anlamak için sinyallemeyi deneysel olarak manipüle etme yöntemleri gereklidir. Moleküler optogenetik araçlar, yüksek derecede uzay-zamansal kontrol ile sinyal yolu aktivitesinin tersine çevrilebilir, ayarlanabilir manipülasyonlarını sağlayabilir ve in vitro, ex vivo ve in vivo olarak uygulanmıştır. Bu araçlar, mavi ışık homojenleştirici ışık-oksijen-voltaj algılama (LOV) alanı gibi ışığa duyarlı protein alanlarını, sinyalleme üzerinde ışığa bağlı deneysel kontrol sağlamak için sinyal efektörleri ile birleştirir. Bu protokol, optik olarak erişilebilir erken zebra balığı embriyosunda LOV tabanlı kemik morfogenetik proteini (BMP) ve Nodal sinyal aktivatörleri bOpto-BMP ve bOpto-Nodal'ın kullanımı için pratik kılavuzlar sağlar. İki kontrol deneyini açıklar: Uygun deney koşullarını belirlemek için hızlı bir fenotip testi ve sinyallemeyi doğrudan değerlendirmek için bir immünofloresan testi. Birlikte, bu kontrol deneyleri, erken zebra balığı embriyolarında optogenetik araçları kullanmak için bir boru hattı oluşturmaya yardımcı olabilir. Bu stratejiler, sinyalleşmenin gelişim, sağlık ve fizyolojideki rollerini araştırmak için güçlü bir platform sağlar.
Giriş
Sinyal yolları, hücrelerin çevrelerine yanıt vermelerine ve doku ve organizma çapında ölçeklerde aktiviteleri koordine etmelerine olanak tanır. Embriyonik gelişim için çok önemli olan sinyaller arasında TGF-beta süper aile üyeleri kemik morfogenetik proteini (BMP) ve Nodal 1,2,3 bulunur. Embriyogenez sırasında, bu sinyaller ve diğerleri tarafından düzenlenen yollar, çeşitli doku ve organların düzgün bir şekilde gelişmesini ve arayüz oluşturmasını sağlamak için gen ekspresyonunu ve ek süreçleri kontrol ederek vücut planını şekillendirir. Doğum kusurları ve kanser de dahil olmak üzere patolojiler, sinyalleşme veya sinyalleşmeye verilen tepkiler bozulduğunda ortaya çıkabilir 4,5,6,7. Sinyalizasyonla ilgili titiz araştırmalara rağmen, seviyelerin ve dinamiklerin çeşitli bağlamlarda nasıl çözüldüğü hakkında keşfedilecek çok daha fazla şey var 8,9,10,11, özellikle geliştirme sırasında 12,13,14,15,16,17,18,19.
Sinyalleşmenin nasıl çözüldüğünü anlamak için ideal bir deney, sinyal seviyelerini, zamanlamayı ve/veya dinamikleri - yüksek derecede uzamsal ve zamansal kontrol ile - manipüle etmek ve sonuçları değerlendirmek olacaktır. Örneğin, gelişmekte olan dokuları modellemek için hassas uzamsal sinyal gradyanları önerilmektedir20,21. Sinyal gradyan uzamsal dağılımlarını değiştirmek, bu hipotezi test etmeye yardımcı olacaktır22. Ek olarak, çeşitli hücresel tepkiler oluşturmada sinyal dinamiklerinin önemi daha net hale geliyor: Aynı sinyal yolu, hücrelere sinyal frekansına bağlı olarak farklılaşma veya çoğalma talimatı verebilir, örneğin 9,23. Sinyal dinamiğinin kolayca manipüle edilebileceği deneysel paradigmalar, dinamikler ve hücre kaderi kararları arasındaki ilişkiyi araştırmak için değerli olacaktır8,12,13,14,15.
Tarihsel olarak, gelişimsel bağlamlarda sinyalleşmeyi manipüle etmek için birden fazla yöntem kullanılmış ve bu da temel keşiflereyol açmıştır 1,2,3. Sinyalleşme, fonksiyon kaybı mutantları, ektopik inhibitör ekspresyonu veya antagonist ilaçlar kullanılarak bloke edilebilir. Sinyallemeyi aktive etme yöntemleri arasında agonist ilaçlar, rekombinant ligandlar, ligandların veya yapısal olarak aktif reseptörlerin ektopik ekspresyonu ve yol inhibitörü fonksiyon kaybı mutantları bulunur. Bu yöntemler, deneysel kontrolün sürekliliği boyunca değişir. Örneğin, mutantlar ve ektopik ekspresyon sürekliliğin balyoz tarafına düşebilir: Bu yaklaşımlarla, yol aktivitesindeki dramatik, sistemik değişiklikler erken ölüme neden olabilir ve daha sonraki aşamalarda araştırmaları engelleyebilir veya zamanla çözülmesi zor olan pleiotropik etkilere neden olabilir. Ek olarak, seviye veya süre gibi bir seferde bir sinyal özelliğini bağımsız olarak manipüle etmek genellikle zordur. Sürekliliğin diğer ucuna doğru, numuneleri ilaçlara veya zamansal ve bazen uzamsal kontrole sahip rekombinant proteinlere maruz bırakan mikroakışkan cihazlar gibi bazı yöntemlerdaha hassas deneysel kontrol sunar 18,24,25 veya benzer faydalar sağlayabilen ısı şoku ile indüklenebilir ve dokuya özgü promotörler dahil olmak üzere genetik yöntemler16,26,27. Ancak, bu yöntemlerin yürütülmesi zor olabilir, geri döndürülemeyebilir, nispeten yavaş kinetiklere veya düşük çözünürlüğe sahip olabilir ve bazı model sistemlerde kullanılamayabilir.
Moleküler optogenetik yaklaşımlar bu araç setine güçlü bir katkı sağlar. Bu yaklaşımlar,sinyal 8,12,13,14,15 dahil olmak üzere biyolojik süreçleri manipüle etmek için farklı ışık dalga boylarına yanıt veren proteinleri kullanır ve hücre kültüründen bütün hayvanlara kadar çeşitli sistemlerde kullanılmak üzere onlarca yıldır geliştirilmiştir12,13,28. Tarihsel yaklaşımlarla karşılaştırıldığında, moleküler optogenetik genellikle biyolojik süreçler üzerinde daha yüksek derecede uzay-zamansal kontrol sunabilir: Optogenetik sistemlerdeki kontrolör ışıktır ve ışık dalga boyu, yoğunluğu, süresi ve maruz kalma sıklığının kontrolü nispeten basittir. Konfokal ve iki fotonlu mikroskoplar gibi gelişmiş sistemlerle, hücre altı aralıkta uzamsal kontrol mümkündür 29,30,31. Sinyalleri optogenetik olarak manipüle etmek için araçlar geliştirilmiş ve Johnson ve ark.22, Čapek ve ark.32, Krishnamurthy ve ark.33 ve Huang ve ark.34'te açıklananlar dahil olmak üzere çeşitli sistemlerde uygulanmıştır. Örneğin, optogenetiğin sağladığı uzamsal kontrolden yararlanan bu strateji, yakın zamanda Drosophila embriyolarında bir sinyal gradyanını değiştirmek için kullanıldı ve sinek embriyogenezinin bu gradyandaki değişikliklere şaşırtıcı derecede sağlam olduğunu gösterdi22. Optogenetik sinyal aktivatörlerinin tersine çevrilebilirliği ve hızlı açma/kapama kinetiği, onları sinyal dinamikleri 8,12,13,14,15,34,35,36'nın kodunun çözülmesini araştırmak için çekici araçlar haline getirmiştir.
Erken zebra balığı embriyosu, optogenetik çalışmalar için çok uygun bir in vivo sistemdir, çünkü dışarıdan döllenmiş, şeffaf, mikroskopi dostu ve genetik olarak izlenebilirdir. Işığa maruz kalmanın annenin dışında gelişen embriyolara verilmesi daha kolaydır, ışık opak olmayan dokularına nüfuz edebilir ve bunlara erişebilir, canlı zebra balığı embriyoları görüntülemeyi iyi tolere eder (şeffaf olmanın yanı sıra) ve mevcut genetik yöntemler, yararlı transgeniklerin geliştirilmesine ek olarak, yıkım ve aşırı ekspresyon deneyleri için basit fırsatlar sağlar37.
Son zamanlarda, mavi ışığa maruz kalan zebra balığı embriyolarında BMP38 ve Nodal39 sinyalini aktive etmek için optogenetik araçlar geliştirilmiştir (Şekil 1). Bu araçları bOpto-BMP ve bOpto-Nodal (mavi ışıkla aktive edilen b ve optogenetik için Opto) olarak adlandırıyoruz. bOpto-BMP/Nodal, benzer yol aktivasyon mekanizmalarına dayanmaktadır. BMP veya Nodal ligandlarının ilgili reseptör serin-treonin kinazlarına bağlanması, sinyal efektörlerinin fosforilasyonuna yol açan reseptör kinaz alanı etkileşimlerini yönlendirir (BMP için Smad1/5/9 ve Nodal için Smad2/3). Fosforile sinyal efektörleri daha sonra çekirdeğe translokasyon yapar ve hedef gen ekspresyonunudüzenler 3 (Şekil 1A, D). Bu reseptör kinaz etkileşimleri, reseptör kinazların ışığa duyarlı dimerize edici proteinlere bağlanmasıyla ışığa duyarlı hale getirilebilir: Işığa maruz kaldığında, bu kimerik proteinler dimerize olmalı ve reseptör kinaz alanlarının etkileşime girmesine ve sinyalleşmeyi aktive etmesine neden olmalıdır (Şekil 1B, C, E, F). Önemli olarak, endojen reseptörlerin aksine, bOpto-BMP / Nodal, liganddan bağımsız aktivite sağlayan hücre dışı ligand bağlama alanları içermez (Şekil 1C, F). Bu optogenetik aktivasyon stratejisi ilk olarak reseptör tirozin kinazlar40,41,42 ile sağlanmış ve daha sonra reseptör serin-treonin kinazlara uygulanmıştır.
bOpto-BMP/Nodal, Vaucheria fridiga AUREO43,44 alglerinden mavi ışığa duyarlı (~450 nm) homodimerize edici ışık-oksijen-voltaj algılama (LOV) alanını kullanır. Bu yapılar, bir LOV alanına kaynaşmış BMP veya Nodal reseptör kinaz alanlarını takip eden bir membran hedefleme miristoilasyon motifinden oluşur (Şekil 1B, E). Mavi ışığa maruz kalma, ilgili Smad fosforilasyonuna ve yol aktivasyonuna yol açan reseptör kinaz alanı etkileşimlerine neden olan LOV homodimerizasyonuna neden olmalıdır (Şekil 1C, F). bOpto-BMP için, Acvr1l (Alk8 olarak da bilinir) ve BMPR1aa'dan (Alk3 olarak da bilinir) tip I reseptör kinaz alanları ve BMPR2a'dan tip II reseptör kinaz alanı ile yapıların bir kombinasyonunun sinyal38'i en iyi şekilde aktive ettiği bulunmuştur (Addgene #207614, #207615 ve #207616). BOpto-Nodal için, Acvr1ba'dan tip I reseptör kinaz alanı ve Acvr2ba'dan tip II reseptör kinaz alanı ile yapıların bir kombinasyonu kullanılır39.
bOpto-BMP/Nodal, tek hücreli aşamada mRNA enjekte edilerek erken zebra balığı embriyolarına dahil edildi ve Nodal yorumunda39 sinyal süresinin rolünü araştırmak, zebra balıklarının Nodal45'e yanıt verme yeteneğini neden kaybettiğini belirlemek ve BMP hedef genlerinin farklı BMP sinyal seviyelerine nasıl tepki verdiğini incelemek içinkullanıldı 38. Bu araçların gelecekteki çeşitli araştırmalarda faydalı olmaya devam etmesi muhtemeldir. Bununla birlikte, optogenetik sinyal aktivatörlerinin gücü aynı zamanda zayıflıklarıdır: ışığa duyarlı numuneler, yanlışlıkla ektopik sinyal aktivitesini önlemek için dikkatli bir şekilde tedavi edilmelidir. Oda ışığına veya güneş ışığına maruz kalmak bOpto-BMP/Nodal'ı etkinleştirebilir.
Bu protokol, erken zebra balığı embriyolarında mRNA kodlu LOV tabanlı BMP ve Nodal aktivatörlerin kullanılması için pratik öneriler sunar. Tek tip ışığa maruz kalmayı ve sıcaklığı kontrol etmek için bir ışık kutusu oluşturmak için bir stratejiyi detaylandırarak başlar (Şekil 2, Ek Dosya 1, Ek Dosya 2, Ek Dosya 3, Ek Dosya 4, Ek Dosya 5, Ek Dosya 6, Ek Dosya 7, Ek Dosya 8). Daha sonra, bir optogenetik sinyal aktivatörünün beklendiği gibi davranıp davranmadığını, yani yalnızca ışığa maruz kaldığında yol aktivitesini aktive edip etmediğini belirleyen iki temel kontrol deneyini açıklar (Şekil 3). İlk kontrol testi, ışığa maruz kalan ve maruz kalmayan embriyolarda döllenmeden bir gün sonra fenotiplerin incelenmesini içerir (Şekil 3A). mRNA enjekte edilen ışığa maruz kalan embriyolar, ancak maruz kalmayan embriyolar fenoskopi BMP veya Nodal aşırı ekspresyonu olmalıdır (Şekil 4A,B; Özellikle BMP fenotipleri bu zaman noktasında açıkça ayırt edilebilir46). Bu tahlil, hızlı bir aktivite okuması sağlar. İkinci kontrol tahlilinde, fenotiplerin spesifik olarak aşırı BMP veya Nodal sinyallemeden kaynaklanıp kaynaklanmadığını belirlemek ve sinyal seviyelerindeki değişikliği doğrudan gözlemlemek için, fosforile sinyal efektörlerini tespit etmek için immünofloresan boyama kullanılır (sırasıyla pSmad1/5/9 veya pSmad2/3) geç blastula / erken gastrulasyon evresi civarında 20 dakikalık bir ışığa maruz kaldıktan sonra, sinyal aktivitesi iyi tanımlandığında12, 16,17,47,48,49,50 (Şekil 3B ve Şekil 4C). (Hem bOpto-BMP38 hem de bOpto-Nodal39 için uzamsal olarak lokalize aktivasyon gösterilmiş olmasına rağmen, bu protokolün yalnızca tek tip ışığa maruz kalma ve sinyal aktivasyon stratejilerini tanımladığını unutmayın.) İdeal yerel deney koşullarını belirlemek için belirli araştırma sorularına bOpto-BMP/Nodal uygulamadan önce bu kontrol deneylerinin yapılması tavsiye edilir.
Protokol
Zebra balığı araştırma protokolleri, Ulusal Sağlık Enstitüleri'ndeki NICHD Hayvan Bakımı ve Kullanımı Komitesi tarafından gözden geçirildi ve onaylandı (ASP 21-008). Tüm zebra balığı çalışmaları, Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'na uygun olarak gerçekleştirilmiştir.
1. Bir ışık kutusu inşa etmek
- Işığa maruz kalmayı ve sıcaklığı kontrol etmek için, ışık kaynağı olarak ışık yayan diyot (LED) mikroplaka aydınlatıcı kullanan bir ışık kutusu oluşturun (Şekil 2A, Malzeme Tablosu, Ek Dosya 1, Ek Dosya 2). Bu özelleştirilebilir aydınlatıcı, birden fazla dalga boyu üzerinde dinamik, programlanabilir kontrol sağlar.
NOT: Bir ışık kutusu oluşturmak için birçok olası strateji vardır ve alternatif bir yaklaşım daha uygun olabilir (bkz. örneğin, Gerhardt ve ark.51, Bugaj ve ark.52, Kumar ve Khammash 53 ve https://www.optobase.org/materials/'da daha fazlası). - Işık kutusuna aşağıdaki özellikleri ekleyin: Sıcaklık kontrolü (zebra balığı embriyoları için 28 °C idealdir), istenmeyen ışığın hariç tutulması (örneğin, oda ışığı ve güneş ışığı), hedef alanı kaplayan mavi ışığın düzgün bir şekilde iletilmesi (örneğin, 6 oyuklu plaka) ve ışık yoğunluğu ve maruz kalma dinamikleri üzerinde kontrol.
NOT: bOpto-BMP/Nodal mavi ışıkla aktive edilir, ancak bazı optogenetik araçlar diğer dalga boylarına yanıt verir. Optogenetik araç için uygun dalga boyunu kullanın. - Bir inkübatörün üstünden (Şekil 2B) LED çıkış merceğinden biraz daha geniş bir delik açın.
- İnkübatörün üst kısmında delme ile tahrip olacak hiçbir elektrikli bileşen bulunmadığından emin olun (Malzeme Tablosu). Bu, inkübatör üreticisine başvurarak ve doğrudan sorarak tespit edilebilir.
- İnkübatörün üst panelinde mevcut bir delik varsa, delik boyutunu 1,25 inç'e çıkarmak için bir kademeli matkap kullanın. Aksi takdirde, çardaklı 1,25 inçlik bir delik testeresi kullanın.
- Işık kaynağını engelleyen dahili paneller varsa, ışık konisinin engellenmediğinden emin olmak için uygun delik boyutunu delin (Şekil 2A). Paneller tipik olarak ince sacdan yapılır, bu nedenle hasarı önlemek için düşük hızlar ve metal matkap uçları kullanın (kobalt matkap ucu önerilir).
- LED mikroplaka aydınlatıcıyı inkübatörün üstüne sabitlemek için bir LED tutucu oluşturun (Şekil 2C, Ek Dosya 3, Ek Dosya 4, Ek Dosya 5, Ek Dosya 6, Ek Dosya 7, Ek Dosya 8).
- M3 vidaları kullanarak dört adet M3 küp ayırıcıyı dikey braket parçasına monte edin.
- İki yan braketi, dikey braketin küp ayırıcılarının soluna ve sağına takın. Yan braketlerde kalan deliğe başka bir küp ayırıcı monte edin.
- Dikey braket parçasını M6 vidaları kullanarak LED mikroplaka aydınlatıcı tertibatına (Malzeme Tablosu) monte edin. LED lens contasını LED sistem lensinin üzerine yerleştirin.
- Monte edilen parçaları inkübatör paneli montajına, ardından dikey ve yan braketlerdeki M3 ayırıcılarına monte edin. İnkübatör contasını inkübatörün üstündeki deliğin üzerine yerleştirin.
- İnkübatör panel montajını inkübatör contasının üzerine yerleştirin, conta ve panel açıklıklarının inkübatörün deliği ile eş merkezli olduğundan emin olun. 8 numaralı vidaları kullanarak paneli inkübatörün üstüne monte edin. Bu contanın ışık geçirmez olduğundan emin olun.
- İnkübatörün üst rafına 6 oyuklu bir plaka yerleştirin. Işık huzmesinin plakayı düzgün bir şekilde kaplayıp kaplamadığını belirleyin (Şekil 2A). Işık kapsamını görselleştirmek için bir kağıt yaprağı kullanın.
- Plakanın tamamı kirişle kaplanmamışsa, rafı aşağı doğru hareket ettirerek LED ile plaka arasındaki mesafeyi artırın. Burada açıklanan sistem için, LED ile raf arasında ~14 inç yeterlidir.
- Işınım seviyesini ve uzamsal tekdüzeliği belirlemek için bir ışık ölçer kullanın (Malzeme Tablosu).
- İstenmeyen güneş ışığına ve oda ışığına maruz kalmayı önlemek için, kuvöz kapısının ışık geçirmez olduğundan emin olmak için hava sıyırma özelliğini kullanın (Şekil 2A).
- Zebra balığı embriyoları 28 °C'de sağlam bir şekilde gelişir54. Işık kutusunun 28 °C tuttuğunu sağlamak için bir hafıza kartı termometresi kullanın.
2. Enjeksiyon için mRNA üretilmesi
NOT: pCS2+, bOpto-BMP yapıları38 ve bOpto-Nodal yapıları39 için vektör omurgasıdır. Bu vektör ampisilin dirençlidir. bOpto-BMP üç yapıdan oluşur (Şekil 1B): BMPR1aa-LOV (Addgene # 207614): LOV'a kaynaşmış tip I BMPR1aa reseptörünün (Alk3 olarak da bilinir) varsayılan kinaz alanı; Acvr1l-LOV (Addgene # 207615): LOV'a kaynaşmış tip I Acvr1l reseptörünün (Alk8 olarak da bilinir) varsayılan kinaz alanı; ve BMPR2a-LOV (Addgene # 207616): Tip II BMPR2a reseptörünün varsayılan kinaz alanı ve LOV'a kaynaşmış C-terminal alanını takip eder. bOpto-Nodal iki yapıdan oluşur (Şekil 1E): Acvr1ba-LOV: LOV'a kaynaşmış tip I Acvr1ba reseptörünün (Acvr1b olarak da bilinir) varsayılan kinaz alanı; Acvr2ba-LOV: Tip II Acvr2ba reseptörünün (Acvr2b olarak da bilinir) varsayılan kinaz alanı, LOV'a kaynaşmıştır.
- Plazmitleri doğrusallaştırmak için, NotI kısıtlama enzimi kullanarak NotI kısıtlama enzimi kullanarak 2-5 μg arasında sindirim 37 °C'de 1-3 saat (Malzeme Tablosu).
NOT: Plazmidi PCR şablonu olarak kullanarak doğrusallaştırılmış DNA oluşturmak da mümkündür. - Standart bir kolon bazlı saflaştırma kiti (Malzeme Tablosu) kullanarak DNA'yı saflaştırın.
- Doğrusallaştırılmış şablondan (Malzeme Tablosu) RNA'yı kopyalamak için mMessage mMachine kiti gibi bir in vitro SP6 transkripsiyon kiti kullanın. Daha yüksek verim sağlamak için üreticinin tavsiyelerine göre iki reaksiyon ayarlayın.
- Standart bir kolon tabanlı RNA temizleme kiti (Malzeme Tablosu) kullanarak RNA'yı saflaştırın. Çökeltme yoluyla arıtmak da mümkündür.
3. mRNA'nın enjekte edilmesi
- Enjeksiyonlardan en az 1 gün önce, enjeksiyon kapları ve agaroz kaplı 6 oyuklu plakalar yapın.
- Zebra balığı embriyo ortamında ve agaroz tamamen eriyene kadar mikrodalgada 200 mL% 1 agaroz hazırlayın. Herhangi bir standart zebra balığı embriyo ortamı kabul edilebilir olmalıdır; Bununla birlikte, diğer uygulamalarda aşağı akış görüntülemeyi etkileyebileceğinden, metilen mavisini embriyo ortamından hariç tutun.
- Erimiş agarozu dikkatlice 100 mm x 15 mm plastik petri kaplarına dökün. Bulaşıkları yarıya kadar doldurun.
- Bir enjeksiyon kabı kalıbını embriyo ortamı ile durulayın ve erimiş agarozun üzerine nazikçe yerleştirin, kalıp ile agaroz arasında kabarcık sıkışmadığından emin olun. Kolay yerleştirme ve geri alma için kalıbın arkasında bir çıkıntı yapmak için bant kullanın.
- Kalıp erimiş agaroz içinde yüzmelidir. Kalıp batarsa, erimiş agarozdan dikkatlice çıkarın ve 3.1.3 adımını tekrarlayın.
- Agaroz katılaştıktan sonra, kalıbı nazikçe çıkarmak için tırnağı kullanın. Bu, çanağı 4 °C'ye yerleştirerek hızlandırılabilir.
- İmmünofloresan deneyleri için dekoryonlu embriyolarla çalışıyorsanız, agaroz kaplı 6 oyuklu plakalar yapın.
- 6 oyuklu bir plakanın her bir oyuğunun dibini kaplayacak kadar erimiş agarozu aktarmak için tek kullanımlık 10 mL'lik bir plastik pipet kullanın.
- Enjeksiyon kaplarını ve 6 oyuklu plakaları 4 °C'de saklayın. Hemen kullanılabilir veya agaroz kuruyana veya kontamine olana kadar (genellikle 2-3 hafta) saklanabilirler.
- İmmünofloresan deneyleri için dekoryonlu embriyolarla çalışıyorsanız alevli cam pipet uçları hazırlayın.
- Bir cam pipetin ucunu bir Bunsen brülör alevine sokun ve kenarlar pürüzsüz olana kadar sürekli döndürün. Dekoryonlu embriyolar pipetin ucuna rahatça sığmalıdır. Açıklığın embriyo çapının altına düşmesine izin vermeyin.
- Mikroenjeksiyon iğneleri satın alın veya çekin (Malzeme Tablosu). Değiştirme gerekmesi durumunda enjeksiyon gününde ekstra iğnelerin hazır bulundurulması tavsiye edilir.
- Enjeksiyonlardan bir gün önce, zebra balığı yetiştiricilerini enstitünün standart çalışma prosedürlerine (SOP'ler) göre kurun. Erkekleri ve dişileri ayrı tutun.
- 28 °C'yi korumak için ışık kutusu sıcaklık regülatörünü açın. Işık kutusu sıcaklığının 28 °C'de kalmasını sağlamak için, bir hafıza kartı termometresi (Malzeme Tablosu) kullanarak sıcaklığı izleyin.
- mRNA enjeksiyon karışım(lar)ını hazırlayın. Her yapının eşmolar miktarlarını enjekte edin. Hangi miktarın enjekte edileceğini ampirik olarak belirlemek gerekir.
- bOpto-BMP transkript boyutları aşağıdaki gibidir:
Acvr1l-LOV = 2007 nükleotidler (nt)
BMPR1aa-LOV = 1983 nt
BMPR2a-LOV = 3409 nt - Eşmolar miktarları enjekte etmek için, BMPR1aa'dan 1.01 kat daha fazla Acvr1l yapısı enjekte edin; BMPR1.72aa'dan 2a yapısının 1 katını enjekte edin.
- bOpto-Nodal transkript boyutları aşağıdaki gibidir:
Acvr1ba-LOV ve Acvr2ba-LOV'un her ikisi de 1962 nt'dir. - Eşmolar miktarları enjekte etmek için, her yapıdan aynı miktarda enjekte edin.
- Bir yolu hedefleyen tüm mRNA'ları tek bir enjeksiyon karışımında birleştirerek eşmolar enjeksiyon karışımları hazırlayın. İsterseniz fenol kırmızısı enjeksiyon izleyici ekleyin. Şekil 4'te gösterilen veriler için, her bir bOpto-Nodal yapısının (Acvr1ba-LOV ve Acvr2ba-LOV) 15 pg'si kullanıldı ve bOpto-BMP için 7.8 pg Acvr1l-LOV ve BMPR1aa-LOV ve 13.4 pg BMPR2a-LOV kullanıldı.
- Enjeksiyon karışımlarını -20 °C'de saklayın. Enjeksiyon karışımının optimal konsantrasyonu belirlendikten sonra, 5-10 μL'lik alikotlar yapın ve -20 °C veya -80 °C'de saklayın.
- Enjeksiyon günü
- Bir fenotipleme testi yapıyorsanız (Şekil 3A), laboratuvarınızın SOP'sine göre tek hücreli aşamada koryon yoluyla doğrudan hücrenin merkezine enjekte edin. Koryon, embriyoları çevresel stres faktörlerinden korur ve parçalanmış embriyoları kontrol altında tutar. Bu, parçalanmış embriyoların doğru miktar tayini için puanlama sırasında yararlıdır (Şekil 4A, B).
- Bir immünofloresan testi yapılırsa (Şekil 3B), embriyoların sonunda görüntüleme için dekoryona tabi tutulması gerekecektir (Şekil 4C). Bu nedenle, tek hücreli aşamada doğrudan dekoryonlu embriyo hücresinin merkezine enjekte edin (dekoryonlama protokolü için Rogers ve ark.55'e bakınız). Alternatif olarak, embriyolar fiksasyondan sonra manuel olarak dekoryona tabi tutulabilir, ancak bu pronaz ile dekoryondan daha zahmetlidir.
- Dekoryonlu embriyoları işlemek için alevli cam pipetler kullanın (adım 3.1.10). Dekoryonlu embriyoları, embriyoların parçalanmasına neden olacak şekilde havaya veya plastiğe maruz bırakmamaya dikkat edin. Dekoryonlu embriyoları nazikçe tutun.
- Aşama ilerlemesini değerlendirmek için vekil olarak enjekte edilmemiş embriyolardan fazladan bir tabak hazırlayın (bkz. adım 4.3.5). Vekil embriyoların aynı deneysel embriyo grubundan olduğundan emin olun, böylece tüm embriyolar aynı anda aynı ebeveynlerden döllenmiştir. Bu, fazın ilgili olduğu ancak fenotipleme testi için gereksiz olduğu immünofloresan testi için yararlıdır.
- Hem fenotipleme hem de immünofloresan tahlilleri için aşağıdaki koşulları kullanın: 1) enjekte edilmemiş, maruz kalmamış, 2) enjekte edilmemiş, ışığa maruz kalmış, 3) enjekte edilmiş, maruz kalmamış, 4) enjekte edilmiş, ışığa maruz kalmış. Koşul başına en az 30 embriyo seçin. Optimal embriyo sağlığı için, 6 oyuklu bir plakada oyuk başına 30'dan fazla embriyo inkübe etmeyin.
- Enjeksiyondan sonra, embriyoları etiketli Petri kaplarına veya agaroz kaplı 6 oyuklu plakalara (dekoryonlu embriyolar için) aktarın ve 28 ° C'de inkübe edin. Embriyolar henüz ışığa duyarlı değildir. Enjekte edilen embriyolara döllenmeden 1.5 saat sonra (hpf) ışığa duyarlıymış gibi davranın.
4. Işığa maruz kalma deneyi
NOT: 450 W/m45 ışınımla ~2 nm ışığa maruz kalmak, bariz fototoksisite olmadan bOpto-BMP/ Nodal'ı sağlam bir şekilde etkinleştirir (ışık ölçer bilgileri için Malzeme Tablosuna bakın). Optogenetik olarak aktive edilmiş sinyalizasyon seviyesi, ışınım değerleri38 değiştirilerek ayarlanabilir. Bununla birlikte, fototoksisitenin daha yüksek ışınımlarda değerlendirilmesi gerekecektir.
- Zamana duyarlı adım. 4 ila 16 hücreli aşamada, yaklaşık 1.5 hpf, döllenmemiş ve sağlıksız embriyoları çıkarın. Her kuyucukta aynı sayıda embriyo olmasını sağlamak için gerekirse yeniden dağıtın (en fazla 30).
NOT: Bu adımı 4 ila 16 hücreli aşamada gerçekleştirmek önemlidir, çünkü enjekte edilen mRNA proteine çevrilirken embriyolar ışığa duyarlı hale gelecektir. Embriyoların 1.5 hpf'den önce ışığa önemli ölçüde duyarlı olduğuna dair kanıt gözlemlemedik. 1.5 hpf'den sonra embriyoları değerlendirirken yanlışlıkla fotoaktivasyonu en aza indirmek için, kırmızı ışıklar kullanın veya mikroskop aşamaları dahil olmak üzere ışık kaynaklarını LOV-dimerize edici mavi dalga boylarını bloke eden kırmızı jel filtre kağıdı ile örtün (Malzeme Tablosu).- Koşullar ve deneyler arasında tarafsız dağılımlar sağlamak için embriyoları tutarlı bir şekilde değerlendirin.
- Fenotipleme testi için, 1.5 hpf'den başlayarak aşağıdaki 1 günlük ışığa maruz kalma protokolünü kullanın (Şekil 3A).
- Açıkta olmayan kontrol plakasını alüminyum folyoya sarın. Bu plak hem enjekte edilmemiş hem de enjekte edilmiş embriyoları içermelidir. Plakanın tamamen kaplandığından emin olun ve folyoya yırtık bulaştırmamaya dikkat edin. Bu plakayı 28 °C ışık kutusunun alt rafına yerleştirin (Şekil 2A).
- Açıkta kalan plakayı 28 °C ışık kutusunun üst rafına yerleştirin (Şekil 2A). Embriyo ortamının buharlaşmasını önlemek için kapağın çanak üzerinde olduğundan emin olun. Mavi ışığı açın (45 W/m2'lik bir ışınım, sinyali sağlam bir şekilde etkinleştirir).
- Yanlışlıkla oda ışığına maruz kalmamak için ışık kutusu kapağını kapatın. İstenirse, kapıyı kapatmadan önce ışık kutusunun içine bir hafıza kartı termometresi ekleyin. Döllenmeden sonraki 1 günde fenotip skorlaması yapılana kadar kapıyı açmayın (dpf; bkz. adım 5.1).
- İmmünofloresan testi için, embriyoları yaklaşık% 40 epiboli56 (~ 6 hpf) ile başlayarak 20 dakika boyunca mavi ışığa maruz bırakın ve ışığa maruz kaldıktan hemen sonra, maruz kalmayan kontrollerle birlikte sabitleyin (Şekil 3B). %40 epibolide 20 dakikalık mavi ışığa maruz kalma, sinyalleşmeyi tekrarlanabilir şekilde etkinleştirir.
- Yaklaşık 1.5 hpf, hem açıkta kalan hem de maruz kalmayan bulaşıkları alüminyum folyoya ayrı ayrı sarın. Bulaşıkların tamamen kaplandığından emin olun ve folyoya gözyaşı bulaştırmamaya dikkat edin. Proxy çanağını ambalajsız bırakın. Sarılmış tabakları ve ambalajsız proxy kabını 28 °C ışık kutusuna yerleştirin (Şekil 2A). LED'i henüz açmayın.
- Birden fazla mRNA miktarı test ediliyorsa, maruz kalmayan durum için, farklı miktarlarda enjekte edilen embriyoları, sonraki fiksasyon sırasında yanlışlıkla ışığa maruz kalmayı en aza indirmeye yardımcı olacak ayrı ayrı agaroz kaplı 6 oyuklu plakalara sıralayın.
- Yanlışlıkla oda ışığına maruz kalmamak için ışık kutusu kapağını kapatın.
- Formaldehit stoğunu 1x fosfat tamponlu salin (PBS) içinde %4'e seyreltin ve 1 mL'yi önceden etiketlenmiş 2 mL yuvarlak tabanlı mikrosantrifüj tüplerine, koşul başına bir tüpe ayırın. 4 °C'de saklayın.
- 5 hpf civarında, enjekte edilmemiş embriyoları içeren vekil kabı çıkarın ve bir diseksiyon kapsamı kullanarak gelişim aşamasını değerlendirin. Vekil embriyoların evresi, sarılmış tabaklardaki ışığa duyarlı embriyoların evresini yansıtmalıdır.
- Sarılmış bulaşıkları da çıkarın, böylece tüm yemekler aynı sıcaklığa sahip olur. Vekil embriyolar% 40 epiboliye (~ 6 hpf) ulaşana kadar tekrarlayın. Embriyogenez ilerlemesi sıcaklığa duyarlıdır54; Bu nedenle, bulaşıklar inkübatörün dışında ne kadar uzun süre kalırsa, embriyoların% 40 epiboliye ulaşması o kadar uzun sürer.
- Vekil embriyolar% 40 epiboliye ulaştığında, açıkta kalan tabağı açın ve ışık kutusunun üst rafına yerleştirin (Şekil 2A). Açıkta kalan tabak(lar)ı sarılı bırakın ve alt rafa yerleştirin. Hemen mavi ışığı açın, kapıyı kapatın ve 20 dakikalık bir zamanlayıcı ayarlayın (45 W/m2'lik bir ışınım, sinyalizasyonu sağlam bir şekilde etkinleştirir).
- Sabitlemeye hazırlanmak için mümkün olduğunca fazla oda ışığını ortadan kaldırın (panjurları kapatın, tepe ışıklarını kapatın, ekranları kapatın, vb.). Formaldehit içeren tüplerin uygun şekilde etiketlendiğinden emin olun. Sabitlemeden hemen önce, formaldehit içeren tüpleri 4 °C'den çıkarın ve ışık kutusunun yanına yerleştirin.
- Zamana ve ışığa duyarlı adım. 20 dakikalık ışığa maruz kalmanın sonunda hızlı hareket etmeye hazır olun. 20 dakika sonra, ışık kutusu kapağını açın ve açıkta olmayan kabı çıkarın.
- Işığa duyarlı embriyoları hızlı ama nazikçe hazırlanan% 4 formaldehit tüpüne aktarmak için alevli bir cam pipet ucu kullanın.
- İstenmeyen ışığa maruz kalmayı önlemek için ışığa duyarlı embriyoların transfer süresini (<45 s) en aza indirin. Pipette hava kabarcığı olmadığından emin olun. Havaya maruz kalma, dekoryonlu embriyoları yok edecektir.
- Embriyoları formaldehite atmak için cam pipet ucunu formaldehite batırın ve embriyoların sıvıya batmasına izin verin. Embriyoları ucun ucunda tutarak formaldehite aktarılan embriyo ortamı miktarını en aza indirin.
- Embriyolar transfer edildikten sonra, pipeti aynı kuyucuğa geri koyun ve sıkışmış embriyoları çıkarmak için yukarı ve aşağı pipetleyin. Bu, birden fazla koşuldan gelen embriyoların yanlışlıkla tek bir tüpte bitmesini önler.
- Açıkta kalmamış, enjekte edilmemiş embriyolar ve ardından açıkta kalan embriyolar (enjekte edilmiş ve enjekte edilmemiş) için hemen 4.3.11-4.3.13 adımlarını tekrarlayın.
- Sabit embriyoları gece boyunca 4 °C'de saklayın.
5. Deney değerlendirmesi
- Fenotip skorlaması ve görüntüleme
- 1 dpf'de, ideal olarak 24-32 hpf arasında, bir diseksiyon kapsamı kullanarak fenotipleri değerlendirmek ve bir puanlama tablosu oluşturmak için ışık kutusundan embriyoları çıkarın. Bu deneysel son noktadır; Yanlışlıkla fotoaktivasyon artık bir endişe kaynağı değil.
- Kolaylık sağlamak için hala koryondayken embriyoları puanlayın. Birden fazla açıdan görüntülemek için embriyoları hareket ettirmek için bir pipet veya prob kullanın.
- Aşırı BMP sinyali yaşayan embriyolar, Kishimoto ve ark.'da ayrıntılı olarak açıklandığı gibi değişen derecelerde şiddette ventralize edilecektir. 199746 (Şekil 4A, sol panel). Aşırı Nodal sinyal yaşayan embriyolar, aşırı mezendoderm ile ilgili bir dizi gelişimsel kusura sahip olacaktır (Şekil 4A, sağ panel)1,3,47,57,58,59,60. Genellikle 1 dpf tarafından parçalanırlar.
- Her embriyoyu her koşulda puanlayın (Şekil 4B). Her oyuktaki tüm embriyoların genel bir görüntüsünü elde edin. İstenirse, metilselüloz içinde bireysel temsili embriyoları dekoriyonat ve görüntüleyin (Şekil 4A).
- İmmünofloresan boyama ve görüntüleme
- Embriyoları gece boyunca 4 °C'de %4 formaldehit içinde inkübe ettikten sonra formaldehiti çıkarın ve 3-5x Tween20 (PBST) ile 1x fosfat tamponlu salin ile yıkayın. PBST'yi çıkarın ve% 100 metanol ekleyin.
- Tüpleri kapatın ve artık PBST ve metanolü karıştırmak için hafifçe ters çevirin. 2 kez metanol ile yıkayın ve -20 °C'de en az 2 saatten yıllara kadar saklayın.
- pSmad1/5/9 (BMP) immünofloresan protokolü için bakınız Rogers ve ark.38. pSmad2/3 (Nodal) immünofloresan protokolü için van Boxtel ve ark.17 ve Rogers ve ark.47'ye bakınız.
- Optik kesit alabilen bir mikroskop (örneğin, konfokal veya ışık tabakası mikroskobu) kullanarak immün boyalı embriyoları görüntüleyin. Doygunluktan kaçının ve aynı antikorla boyanmış tüm numuneler arasında aynı görüntüleme koşullarını koruyun.
- İmmünofloresan boyamanın tamamlanmasından sonraki 5 gün içinde görüntü, çünkü floresan zamanla solabilir.
Sonuçlar
Burada açıklanan iki kontrol deneyinin amacı, bOpto-BMP/Nodal'ın, beklendiği gibi, ışık yokluğunda sinyalleşmeyi etkilemeden mavi ışığa maruz kalmaya yanıt olarak ilgili yollarını aktive edip etmediğini belirlemektir. İlgilendiğiniz araştırma sorularına bOpto-BMP/Nodal uygulamadan önce laboratuvarınızda uygun deneysel iş akışını oluşturmak için bu denetimleri kullanın.
Fenotipleme testi sadece 2 gün içinde tamamlanabilir ve sinyal aktivitesi ve fototoksisite için yararlı bir gösterge sağlar (Şekil 3A). Enjekte edilen, mavi ışığa maruz kalan embriyolar, aşırı BMP sinyalini fenoskopi ile fleoskopi yapmalıdır (ventralizasyon46; Şekil 4A, sol panel) veya Nodal sinyalleme (ekstra mezendoderm 1,3,47,57,58,59,60 ile ilgili gelişimsel kusurlar (Şekil 4A, sağ panel)). Enjekte edilirse, ışığa maruz kalan embriyolar afenotiktir, mRNA'nın kalitesini test edin ve daha fazla enjekte etmeyi düşünün ve parlak ışığa sürekli maruz kalmayı sağlamak için ışığa maruz kalma stratejisini iki kez kontrol edin (45 W /m2 ışınımlı ~ 450 nm ışık, sinyali güçlü bir şekilde etkinleştirmelidir). Buna karşılık, enjekte edilmiş, maruz kalmamış embriyolar, enjekte edilmemiş kardeşlerle aynı görünmelidir. Enjekte edilirse, maruz kalmayan embriyolar fenotipler sergiler, enjekte edilen mRNA miktarını azaltır ve maruz kalmayan embriyoların ışığa maruz kalmaktan korunmasını sağlamak için deney kurulumunu yeniden değerlendirir. Şekil 4B'de gösterilen veriler, uygun mRNA miktarları ve maruz kalma koşulları ile tipik fenotipleme deneylerinden elde edilen sonuçları göstermektedir: enjekte edilen, ışığa maruz kalan embriyolarda güçlü sinyal aktivitesi belirgindir ve enjekte edilmiş, maruz kalmamış embriyoların sadece küçük bir kısmı fenotipler sergiler.
Fenotipleme testi ayrıca fototoksisiteyi değerlendirmek için bir fırsat sağlar. Fototoksisite ihmal edilebilir düzeydeyse, enjekte edilmemiş, ışığa maruz kalan embriyolar, enjekte edilmemiş, maruz kalmamış embriyolara benzer şekilde vahşi tip görünmelidir. Enjekte edilmemiş, ışığa maruz kalan embriyolarda kusurlar varsa, ancak enjekte edilmemiş, maruz kalmamış embriyolarda yoksa, ışık ışınımını azaltmayı düşünün. 45 W/m2'lik bir ışınım, belirgin fototoksisite olmadan sinyalleşmeyi sağlam bir şekilde etkinleştirir. Şekil 4B'de gösterilen veriler, enjekte edilmemiş, ışığa maruz kalmış ve enjekte edilmemiş, maruz kalmamış embriyolar arasında ihmal edilebilir fototoksisiteyi gösteren hiçbir fark göstermemektedir.
İmmünofloresan deneyleri, fenotipleme testine (2 gün) kıyasla daha fazla zaman ve çaba (~ 1 hafta) gerektirse de, immünofloresan boyama, sinyal yolu aktivitesinin doğrudan okunmasını sağlar ve brüt morfoloji tarafından yansıtılmayabilecek ince sinyal değişikliklerini ortaya çıkarabilir. İmmünofloresan, bOpto-Nodal'a verilen yanıtları değerlendirmek için özellikle önemlidir, çünkü aşırı Nodal sinyali, aşırı BMP sinyalininkarakteristik özelliği olan spesifik ventralizasyon fenotiplerinin aksine, genellikle embriyoların 1 dpf tarafından parçalanmasına neden olur - ki bu birçok nedene sahip olabilir 46 (Şekil 4A). Enjekte edilen, mavi ışığa maruz kalan embriyolar, enjekte edilmemiş, ışığa maruz kalan embriyolara kıyasla Smad1/5/9 veya Smad2/3 fosforilasyonunda homojen bir artış göstermelidir. Seviyeler artırılmazsa veya yalnızca zayıf bir şekilde artarsa, mRNA'nın kalitesini test edin ve daha fazla enjekte etmeyi düşünün ve ışığa maruz kalma stratejisini iki kez kontrol edin. 45 W/m2 yaklaşık %40 epiboli ışınımına sahip mavi ışığa 20 dakikalık bir maruz kalma, sinyalleşmeyi güçlü bir şekilde etkinleştirmelidir. pSmad boyaması homojen değilse, mRNA'yı hücrenin merkezine (yumurta sarısı yerine) enjekte etmeyi deneyin, bu da daha düzgün mRNA dağılımına neden olabilir.
Enjekte edilmiş, maruz kalmamış embriyolar, enjekte edilmemiş embriyolarla karşılaştırılabilir pSmad seviyelerine sahip olmalıdır. Anekdot olarak, bOpto-Nodal ile bOpto-BMP'den daha sızdıran Smad fosforilasyonu gözlemledik. Enjekte edilen, maruz kalmayan embriyolarda pSmad seviyeleri artarsa, enjekte edilen mRNA miktarını azaltın. Ek olarak, 1) maruz kalmamış embriyoların yanlışlıkla ışığa maruz kalmadığından ve 2) fiksasyon sırasında ışığa maruz kalmanın minimum düzeyde olduğundan emin olmak için deney kurulumunu yeniden değerlendirin. Sabitleme adımı sırasında, ışık kutusundan çıkarılması ile formaldehite daldırma arasında 45 saniyeden fazla geçmemesine izin vermek çok önemlidir. Ek olarak, bu adım sırasında panjurları kapatarak, beyaz ışık kaynaklarını kapatarak, kırmızı ışıklar kullanarak veya beyaz ışık kaynaklarını mavi ışığı engelleyen jel filtre kağıdı ile kaplayarak oda ışığına ve güneş ışığına maruz kalmayı en aza indirin (Malzeme Tablosu).
Şekil 4C'deki veriler, uygun mRNA miktarları ve ışığa maruz kalma koşulları ile tipik immünofloresan boyama deneylerinden elde edilen sonuçları göstermektedir: pSmad seviyeleri, enjekte edilmemiş ve maruz kalmamış embriyolarda benzerken, enjekte edilmiş, ışığa maruz kalan embriyolar daha yüksek seviyelerde Smad fosforilasyonu sergiler.
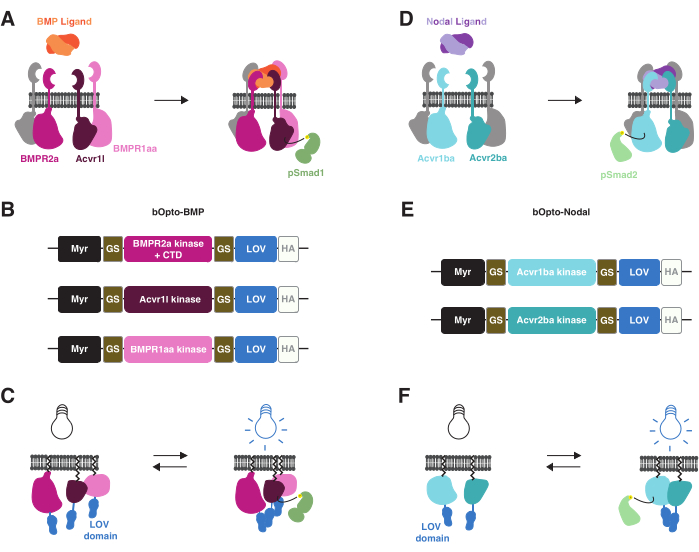
Şekil 1: bOpto-BMP ve -Nodal sinyal aktivasyon stratejisi . (A) Endojen BMP sinyal yolu, BMP ligand bağlanması ile aktive edilir, bu da bir tip I / II reseptör kompleksinin oluşumuna, Smad1 / 5/9'un fosforilasyonuna ve BMP hedef genlerinin ekspresyonuna yol açar. Tip I reseptörleri BMPR1aa ve Acvr1l, sırasıyla Alk3 ve Alk8 olarak da bilinir. BMPR2a, tip II bir reseptördür. (B) bOpto-BMP yapıları38. BMPR1aa ve Acvr1l'den varsayılan kinaz alanları LOV ile kaynaştırılır; BMPR2a-LOV füzyonu, varsayılan kinaz alanını ve reseptör C-terminal alanını (CTD) içerir. Tüm füzyonlar, bir miristoilasyon motifi (Myr) ile membran hedeflidir. Etki alanları, glisin-serin (GS) bağlayıcıları ile ayrılır. Yapılar CTD'de bir HA epitop etiketi ile etiketlenir. Üç yapının bu kombinasyonunun BMP sinyalini en iyi şekilde aktive ettiği bulundu. (C) bOpto-BMP aracılı BMP sinyal aktivasyonu. Mavi ışığa maruz kaldığında, karmaşık oluşumu ve sinyal aktivasyonunu tetiklediği düşünülen LOV alanları dimerize olur. (D) Endojen Nodal sinyal yolu, Nodal ligand bağlanması ile aktive edilir, bu da bir tip I / II reseptör kompleksinin oluşumuna, Smad2 / 3'ün fosforilasyonuna ve Nodal hedef genlerin ekspresyonuna yol açar. Tip I reseptörü Acvr1ba ve tip II reseptörü Acvr2ba, sırasıyla Acvr1b ve Acvr2b olarak da bilinir. (E) bOpto-Nodal yapıları39. Acvr1ba ve Acvr2ba'dan varsayılan kinaz alanları LOV ile kaynaştırılır. Tüm füzyonlar, bir miristoilasyon motifi (Myr) ile membran hedeflidir. Etki alanları GS bağlayıcıları ile ayrılır. Yapılar CTD'de bir HA epitop etiketi ile etiketlenir. (F) bOpto-Nodal aracılı Nodal sinyal aktivasyonu. Mavi ışığa maruz kaldığında, karmaşık oluşumu ve sinyal aktivasyonunu tetiklediği düşünülen LOV alanları dimerize olur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
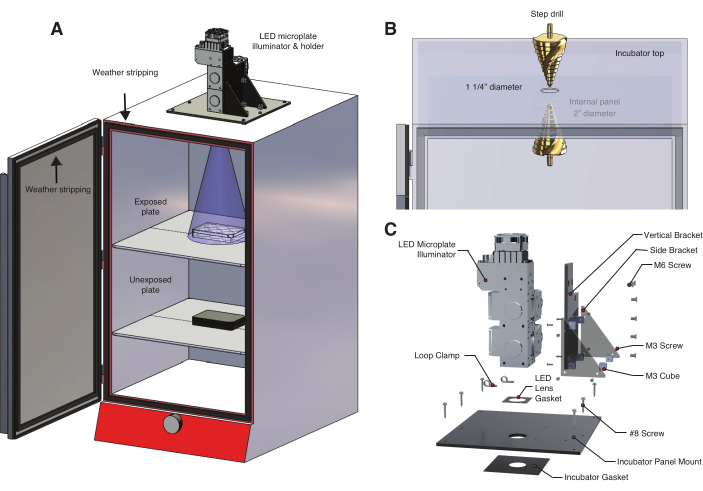
Şekil 2: Optogenetik deneyler için sıcaklık kontrollü ışık kutusu . (A) Bir LED mikro plaka aydınlatıcı, özel yapım bir LED tutucu kullanılarak bir inkübatörün üstüne monte edilir. İlk raftaki 6 oyuklu bir plakadaki zebra balığı embriyoları, inkübatörün tepesine açılan bir delikten ışığa maruz bırakılır. Alt raf, alüminyum folyo ile sarılmış 6 oyuklu bir plakada ikinci bir maruz kalmamış kontrol embriyosu seti tutar. İnkübatör kapısı, oda ışığına veya güneş ışığına yanlışlıkla maruz kalmayı önlemek için hava sıyırma ile kaplanmıştır. (B) Bir kademeli matkap kullanarak inkübatörde bir delik oluşturma prosedürünün detayı. Burada kullanılan inkübatör modeli, ikinci, daha büyük bir delik açılmasını gerektiren bir iç panele sahiptir (Malzeme Tablosu). (C) Üç dalga boylu bir aydınlatma sistemi için tasarlanmış özel LED tutucunun detayı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
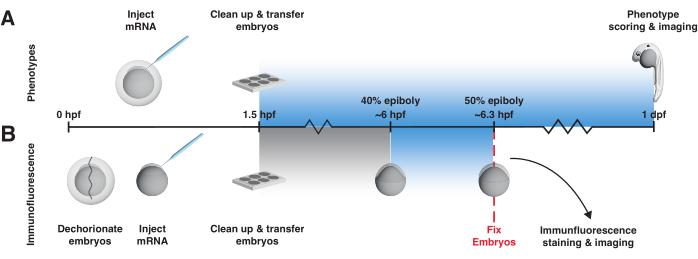
Şekil 3: bOpto-BMP/Nodal deney iş akışı. BOpto-BMP / Nodal aktivitesini test etmek için fenotip testi ve pSmad immünofloresan boyama. Embriyolara tek hücreli aşamada mRNA enjekte edilir ve döllenmeden en geç 1,5 saat sonra (hpf) bir ışık kutusuna aktarılır. (A) Fenotip tahlili. Enjekte edilen embriyolar ve enjekte edilmeyen kardeşler karanlıkta yetiştirilir veya 1.5 hpf'den başlayarak döllenmeden 1 gün sonrasına (dpf) kadar tek tip mavi ışığa maruz bırakılır. Optogenetik sinyal aktivitesi, aşırı yol aktivitesi ile tutarlı fenotipler için embriyoların puanlanmasıyla değerlendirilebilir. (B) pSmad immünofloresan boyama. Enjekte edilen embriyolar ve enjekte edilmeyen kardeşler karanlıkta% 40 epiboliye (~ 6 hpf) kadar yetiştirilir. Enjekte edilen embriyoların yarısı ve enjekte edilmeyen embriyoların yarısı daha sonra 20 dakika boyunca tek tip mavi ışığa maruz bırakılır. Maruz kaldıktan sonra, tüm embriyolar sabitlenir ve pSmad için immünofloresan boyamaya tabi tutulur. Yüksek pSmad1/5/9 veya pSmad2/3 seviyeleri, sırasıyla BMP veya Nodal sinyalizasyonunun optogenetik aktivasyonunu yansıtır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
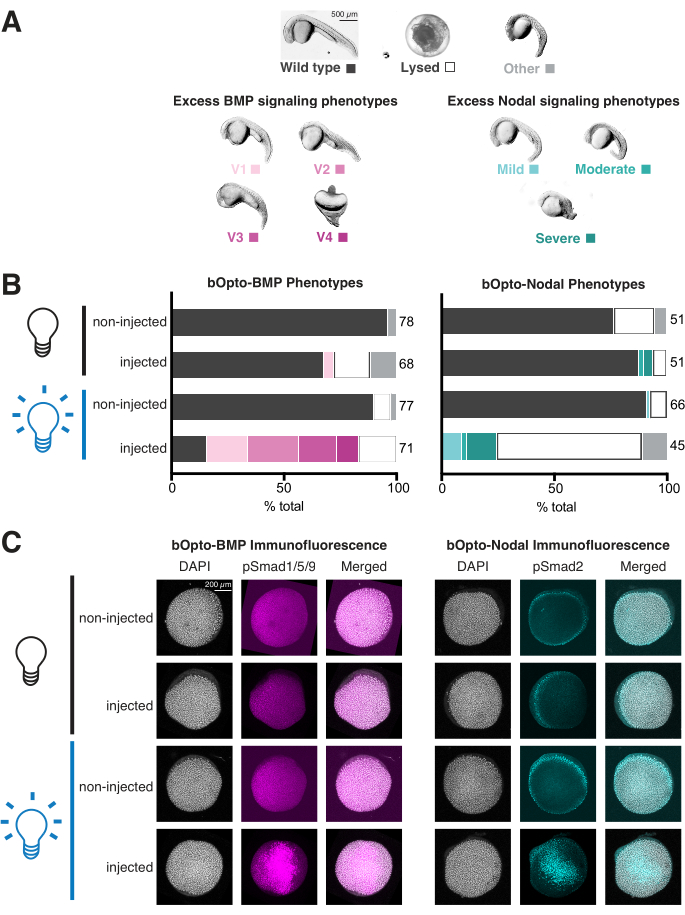
Şekil 4: Zebra balığı embriyolarında ışıkla aktive olan sinyal tepkilerinin değerlendirilmesi. Zebra balığı embriyoları, bOpto-BMP/Nodal kodlayan mRNA ile tek hücre aşamasında enjekte edildi. (A) Embriyolar ya karanlıkta yetiştirildi ya da döllenmeden 1.5 saat sonra (hpf) başlayarak tek tip mavi ışığa maruz bırakıldı. Fenotipler döllenmeden 1 gün sonra (dpf) skorlandı. Temsili fenotipler gösterilmiştir. Aşırı BMP sinyali ventralizasyona (sol panel) yol açarken, aşırı Nodal sinyal ekstra mezendoderm (sağ panel) ile ilişkili gelişimsel kusurlara neden olur. Ölçek çubuğu = 500 μm. (B) Fenotip ölçümü. Enjekte edilen embriyolar ve enjekte edilmeyen kardeşler, 1.5 hpf'den (siyah ampul) başlayarak karanlıkta yetiştirildi. Enjekte edilen embriyoların yarısı ve enjekte edilmeyen embriyoların yarısı tek tip mavi ışığa (mavi ampul) maruz bırakıldı. (C) Enjekte edilen embriyolar ve enjekte edilmeyen kardeşler, 1.5 hpf'den (siyah ampul) başlayarak karanlıkta yetiştirildi. % 40 epibolide (~ 6 hpf), enjekte edilen embriyoların yarısı ve enjekte edilmeyen embriyoların yarısı tek tip mavi ışığa (mavi ampul) maruz bırakıldı. 20 dakika sonra, tüm embriyolar sabitlendi ve fosforile Smad1/5/9 veya Smad2/3 için immünofloresan boyamaya tabi tutuldu. Daha yüksek pSmad yoğunlukları, sırasıyla artmış BMP / Nodal sinyalini gösterir. Ölçek çubuğu = 200 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Dosya 1: Işık kutusu tam montajı. Tam ışık kutusu düzeneğinin 3D görünümünü gösteren 3D PDF dosyası. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 2: Işık kutusu patladı görünümü. Patlatılmış ışık kutusu düzeneğinin 3D görünümünü gösteren 3D PDF dosyası. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 3: Büyük ışık contası. CAD çizim dosyası (. DWG formatı) bir lazer kesici kullanarak LED tutucu için büyük ışık contasını imal etmek için. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 4: Küçük ışık contası. CAD çizim dosyası (. DWG formatı) bir lazer kesici kullanarak LED tutucu için küçük ışık contasını imal etmek için. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 5: Akrilik platform tabanı. CAD çizim dosyası (. DWG formatı) bir lazer kesici kullanarak LED tutucu akrilik platform tabanını imal etmek için. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 6: Akrilik platform dikey. CAD çizim dosyası (. DWG formatı) bir lazer kesici kullanarak LED tutucu akrilik platformu dikey olarak imal etmek için. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 7: Akrilik destek solda. CAD çizim dosyası (. DWG formatı) bir lazer kesici kullanarak LED tutucu akrilik sol desteğini imal etmek için. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 8: Akrilik destek hakkı. CAD çizim dosyası (. DWG formatı) bir lazer kesici kullanarak LED tutucu akrilik sağ desteğini imal etmek için. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
mRNA enjeksiyonu, zebra balığı embriyolarına bOpto-BMP/Nodal vermek için mevcut stratejidir. Bu yöntemin birkaç dezavantajı vardır. İlk olarak, uygun mRNA miktarı laboratuvarlar arasında değişir. Kullanılan miktar, ışığa maruz kalarak sinyalleşmeyi sağlam bir şekilde etkinleştirmek için yeterli olmalıdır, ancak yanlışlıkla karanlık aktivasyon olmadan. Optimal mRNA seviyelerini bulmak için birkaç miktarı test etmek iyi bir fikirdir ve bir kez kurulduktan sonra, aynı miktarda mRNA'yı tekrarlanabilir bir şekilde eklemek için bir ana karışımın alikotlarını oluşturun. İkincisi, enjekte edilen mRNA'nın eşit olmayan dağılımı, eşit olmayan sinyal aktivasyonuna yol açabilir. Hücrenin merkezine (yumurta sarısına değil) enjekte edilmesinin mRNA dağılımını bile desteklediği düşünülmektedir. Son olarak, enjekte edilen mRNA zamanla bozulduğundan, bu yaklaşım daha yaşlı embriyolarda yapılan deneyler için uygun olmayabilir. Gelecekte, bu problemler, maternal veya ilaca bağlı bir promotör ile her yerde bOpto-BMP / Nodal eksprese eden transgenik zebra balığı hatları ile ele alınabilir. Potansiyel olarak ışığa duyarlı yetişkin zebra balığı ile çalışmak bu bağlamda zor olsa da, optogenetik araçları barındıran zebra balığı 61,62 ve Drosophila 22,34,35,63 transgenikler başarıyla geliştirilmiştir.
İstenmeyen fotoaktivasyondan kaçınmak, optogenetik araçlarla ilgili genel bir zorluktur. Basitlik için, 1.5 hpf'den daha eski enjekte edilen embriyoları ışığa duyarlı olarak tedavi edin. Yanlışlıkla ışığa maruz kalma, genellikle plakaları veya tabakları alüminyum folyo ile sararak önlenebilir. Bununla birlikte, 1.5 hpf'den daha eski canlı embriyoların görsel gözlemini gerektiren deneyler için, kırmızı ışık kaynaklarını kullanmak veya beyaz ışık kaynaklarını LOV-dimerize dalga boylarını bloke eden ucuz jel filtre kağıdı ile kaplamak mümkündür (Malzeme Tablosu).
Burada açıklanan ışık kutusu, ışık ışınımı seviyeleri, dinamikleri ve dalga boyları üzerinde hassas kontrol gerektiren özel uygulamalar için tasarlanmıştır (Şekil 2). Bu ışık kutusunun diğer faydaları arasında tek tip ışığa maruz kalma, ihmal edilebilir yanlışlıkla numune ısıtması, birden fazla 6 oyuklu plaka için geniş alan ve uzun ömürlü, spektral olarak iyi karakterize edilmiş ışık kaynakları yer alır. Bununla birlikte, araştırma uygulamasına bağlı olarak farklı ışığa maruz kalma stratejileri tercih edilebilir. Birçok laboratuvar, inkübatörlerin LED şeritlerle kaplanması, LED panellerin numunelerin üzerine asılması veya LED'lerin kültür kabı kapaklarına dahil edilmesi dahil olmak üzere daha küçük ayak izlerine sahip daha basit ve daha uygun maliyetli tek tip ışığa maruz kalma sistemleri geliştirmiştir 32,38,39,40,64,65,66. Daha da önemlisi, bu protokolde kullanılan ışık kutusu, kullanıcıların bireysel kuyuları bağımsız olarak düzenlemesine (Bugaj ve ark.52'nin aksine) veya ışığa maruz kalma üzerinde uzamsal kontrol sağlamasına izin vermez. Uzamsal olarak lokalize optogenetik aktivasyon, sırasıyla SPIM veya konfokal sistemlerde lazerler kullanılarak bOpto-BMP38 ve bOpto-Nodal39 ile gösterilmiştir ve ayrıca çeşitli model sistemlerde diğer birçok optogenetik strateji ile gerçekleştirilmiştir (Rogers ve Müller12'de tartışılmıştır). Hatta bazı yaklaşımlar hücre altı uzamsal çözünürlüğeulaşmıştır 29,30,31. Mekansal olarak lokalize ışığa maruz kalma sistemlerinin uygulanması bu protokolün kapsamı dışında olsa da, dijital mikro ayna cihazları veya maskeleme yaklaşımları gibi özel ekipmanlarla bOpto-BMP/Nodal ile mekansal aktivasyon deneyleri teorik olarak mümkündür. Okuyucular, bir ışığa maruz kalma stratejisine başlamadan önce optogenetik deneyler için DIY ışık kutuları hakkındaki kapsamlı literatürü keşfetmeye teşvik edilir (bkz. örneğin, Gerhardt ve ark.51, Bugaj ve ark.52, Kumar ve Khammash 53 ve https://www.optobase.org/materials/'da daha fazlası).
Moleküler optogenetik stratejiler, mutantlar, ektopik gen ekspresyonu, rekombinant proteinler ve ilaçlar gibi tarihsel yaklaşımlara kıyasla genellikle biyolojik süreçler üzerinde daha yüksek derecede uzay-zamansal kontrol sunar. Optogenetik yaklaşımların faydalarıyla ilgilenen okuyucular, zebra balığı ve diğer organizmalarda bulunan diğer yayınlanmış araçları keşfedebilir. Bunlar, ek sinyal yollarını 32,65,67,68 manipüle etmek, gen ekspresyonunu 61,64,66,69,70,71 düzenlemek, protein lokalizasyonunudeğiştirmek 31,72 ve apoptozu aktive etmek için araçlar içerir 62. Bu araçlar ve diğerleri, moleküler optogenetik yaklaşımları için küratörlüğünde bir web kaynağı olan OptoBase'de uygun bir şekilde kataloglanmıştır28. Yeni optogenetik araçlar oluşturmak için ilham alanlar için, kaynak aynı zamanda yeşil, kırmızı ve yakın kızılötesi dalga boylarına yanıt veren ışığa duyarlı proteinler de dahil olmak üzere çok çeşitli stratejilerde kullanılan ışığa duyarlı proteinlerin yararlı tanımlarını da içeriyor. Bilim camiasının moleküler optogenetik yaklaşımların tam potansiyelini gerçekleştirmesi için heyecanlıyız.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Bu protokolün finansmanı NICHD Intramural Programı tarafından KWR'ye (ZIA HD009002-01) sağlanmıştır. Aydınlatıcı geri bildirimleri için Jeff Farrell ve laboratuvarına, mükemmel teknik destek için Will Anderson'a, protokolü stres testi için Leanne Iannucci'ye ve zebra balığını sağlıklı tutmak için sıkı çalışmaları için NIH Shared Zebrafish tesisine teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Building a light box & Light exposure protocol | |||
| #8 x 1" Hex Self-drilling Screw | McMaster-Carr | 99663A222 | 1.4.5 |
| Digital Optical Power and Energy Meter | ThorLabs | PM100D | 1.7 4 |
| Incubator (142 liters) | Boekel Scientific | 139400 | 1.3.1 |
| Incubator Panel Mount (1/4" thick cast black acrylic) | Custom part / Piedmont Plastics | Incubator_panel | 1.4.4 |
| Large HSS Spiral Groove Step Drill Bit | CO-Z | SDB0001TA | 1.3.2 |
| LED lens gasket, Incubator gasket; 1/32" thick black silicone | McMaster-Carr | 5812T12 | 1.4.3 1.4.4 |
| LED microplate illuminator | Prizmatix | NA | 1.1 1.4.3 |
| M3 10mm Cube Standoff | Newark Eletronics | 005.60.533 | 1.4.1 |
| M3 x 10mm 316SS Flat Head Screw | McMaster-Carr | 91801A156 | 1.4.1 |
| M6 x 10mm 316SS Flat Head Screw | McMaster-Carr | 91801A305 | 1.4.3 |
| Memory card thermometer | Fisherbrand | 15-081-111 | 1.9 3.2.1 |
| Microscope Slide Power Meter Sensor Head (150 mW) | ThorLabs | S170C | 1.7 4 |
| Red gel filter paper #E106 | Rosco / B&H Foto & Electronics | 110084014805-E106 | 4.2.1 |
| Side Brackets (1/4" thick cast black acrylic) | Custom part / Piedmont Plastics | Side_bracket | 1.4.2 |
| Vertical Bracket (1/4" thick cast black acrylic) | Custom part / Piedmont Plastics | Vertical_bracket | 1.4.1 |
| Weather stripping: Light duty EPDM foam, 1/2" wd 1/4" tk | McMaster-Carr | 8694K12 | 1.8 |
| Generating mRNA | |||
| EZNA MicroElute Cycle Pure Kit | Omega | D6293-02 | 2.4 |
| GeneJET Miniprep Kit (250 rxns) | Thermo Scientific | K0503 | 2.2 |
| Microsample incubator (Hybex) | SciGene | 1057-30-0 | 2 |
| Microsample incubator 1.5 ml tube block (Hybex) | SciGene | 1057-34-0 | 2 |
| Nanodrop One Spectrophotometer | Thermo Scientific | ND-ONE-W | 2.4 |
| NotI-HF restriction enzyme | New England Biolabs (NEB) | R3189L | 2.1 |
| pCS2-Opto-Alk3 | Addgene | 207614 | 2 |
| pCS2-Opto-Alk8 | Addgene | 207615 | 2 |
| pCS2-Opto-BMPR2a | Addgene | 207616 | 2 |
| RNeasy Mini Kit (250 rxns) | Qiagen | 74106 | 2.3 |
| Injecting mRNA | |||
| Agarose (UltraPure) | Invitrogen / Thermo Fisher | 16500500 | 3.1.1 |
| 250 ml glass beakers | Fisherbrand | FB100250 | 3.3.2 |
| 6-well dishes (case of 50) | Falcon | 08 772 1B | 3.1.6 |
| B-8A ball joint | Narishige | B-8A | 3.3 |
| Back pressure unit (microinjection rig component) | Applied Scientific Instrumentation (ASI) | BPU | 3.3 |
| Foot switch (microinjection rig component) | Applied Scientific Instrumentation (ASI) | FWS | 3.3 |
| GJ-1 magnetic stand | Narishige | GJ-1 | 3.3 |
| Glass capillaries (4 in, OD 1 mm, filament) | World Precision Instruments | 1B100F-4 | 3.1.11 |
| Glass petri dish bottoms (for dechorionating) | Pyrex | 08-748A | 3.3.2 |
| Glass pipettes (5 3/4" with wide tip) | Kimble-Chase | 63A53WT | 3.1.9 |
| Injection dish molds | Adaptive Science Tools | tu1 | 3.1.3 |
| IP iron plate | Narishige | IP | 3.3 |
| M-152 micromanipulator | Narishige | M-152 | 3.3 |
| Micro pipette holder kit (microinjection rig component) | Applied Scientific Instrumentation (ASI) | MIMPH-MPIP-Kit | 3.3 |
| Micrometers | Meiji Techno America | MA285 | 3.3 |
| MPPI-2 pressure injector (microinjection rig component) | Applied Scientific Instrumentation (ASI) | MPPI-3 | 3.3 |
| Needle puller | World Precision Instruments | PUL-1000 | 3.1.11 |
| Petri dishes (100 mm x 15 mm, case of 500) | Falcon | 08-757-100D | 3.1.2 |
| Pipettor (10 ml, green) | Bel-Art | F37898-0000 | 3.3 |
| Pronase | Roche | 11459643001 | 3.3.2 |
| Squeeze bottles (500 ml) | Nalgene / Thermo Scientific | 2402-0500 | 3.3 |
Referanslar
- Jones, W. D., Mullins, M. C. Cell signaling pathways controlling an axis organizing center in the zebrafish. Current Topics in Developmental Biology. 150, 149-209 (2022).
- Hill, C. S. Establishment and interpretation of NODAL and BMP signaling gradients in early vertebrate development. Current Topics in Developmental Biology. 149, 311-340 (2022).
- Zinski, J., Tajer, B., Mullins, M. C. TGF-β Family Signaling in Early Vertebrate Development. Cold Spring Harbor Perspectives in Biology. 10 (6), a033274 (2018).
- Shore, E. M., Kaplan, F. S. Inherited human diseases of heterotopic bone formation. Nature Reviews. Rheumatology. 6 (9), 518-527 (2010).
- Hebron, K. E., Hernandez, E. R., Yohe, M. E. The RASopathies: from pathogenetics to therapeutics. Disease Models & Mechanisms. 15 (2), dmm049107 (2022).
- Grant, M. G., Patterson, V. L., Grimes, D. T., Burdine, R. D. Modeling Syndromic Congenital Heart Defects in Zebrafish. Current Topics in Developmental Biology. 124, 1-40 (2017).
- Nusse, R., Clevers, H. Wnt/beta-Catenin Signaling, Disease, and Emerging Therapeutic Modalities. Cell. 169 (6), 985-999 (2017).
- Farahani, P. E., Reed, E. H., Underhill, E. J., Aoki, K., Toettcher, J. E. Signaling, Deconstructed: Using Optogenetics to Dissect and Direct Information Flow in Biological Systems. Annual Review of Biomedical Engineering. 23, 61-87 (2021).
- Purvis, J. E., Lahav, G. Encoding and decoding cellular information through signaling dynamics. Cell. 152 (5), 945-956 (2013).
- Wibisana, J. N., Okada, M. Encoding and decoding NF-kappaB nuclear dynamics. Current Opinion in Cell Biology. 77, 102103 (2022).
- Friedel, L., Loewer, A. The guardian's choice: how p53 enables context-specific decision-making in individual cells. TheFEBS Journal. 289 (1), 40-52 (2022).
- Rogers, K. W., Müller, P. Optogenetic approaches to investigate spatiotemporal signaling during development. Current Topics in Developmental Biology. 137, 37-77 (2020).
- Johnson, H. E., Toettcher, J. E. Illuminating developmental biology with cellular optogenetics. Current Opinion in Biotechnology. 52, 42-48 (2018).
- Bosman, S. L., Sonnen, K. F. Signaling oscillations in embryonic development. Current Topics in Developmental Biology. 149, 341-372 (2022).
- Li, P., Elowitz, M. B. Communication codes in developmental signaling pathways. Development. 146 (12), dev170977 (2019).
- Tucker, J. A., Mintzer, K. A., Mullins, M. C. The BMP signaling gradient patterns dorsoventral tissues in a temporally progressive manner along the anteroposterior axis. Developmental Cell. 14 (1), 108-119 (2008).
- van Boxtel, A. L., et al. A temporal window for signal activation dictates the dimensions of a Nodal signaling domain. Developmental Cell. 35 (2), 175-185 (2015).
- Sorre, B., Warmflash, A., Brivanlou, A. H., Siggia, E. D. Encoding of temporal signals by the TGF-β pathway and implications for embryonic patterning. Developmental Cell. 30 (3), 334-342 (2014).
- Economou, A. D., Hill, C. S. Temporal dynamics in the formation and interpretation of Nodal and BMP morphogen gradients. Current Topics in Developmental Biology. 137, 363-389 (2020).
- Rogers, K. W., Schier, A. F. Morphogen gradients: from generation to interpretation. Annual Review of Cell and Developmental Biology. 27, 377-407 (2011).
- Barkai, N., Shilo, B. Z. Robust generation and decoding of morphogen gradients. Cold Spring Harbor Perspectives in Biology. 1 (5), a001990 (2009).
- Johnson, H. E., Djabrayan, N. J. V., Shvartsman, S. Y., Toettcher, J. E. Optogenetic Rescue of a Patterning Mutant. Current Biology. 30 (17), 3414-3424 (2020).
- Imayoshi, I., et al. Oscillatory control of factors determining multipotency and fate in mouse neural progenitors. Science. 342 (6163), 1203-1208 (2013).
- Lin, B., et al. Synthetic spatially graded Rac activation drives cell polarization and movement. Proceedings of the National Academy of Sciences of the United States of America. 109 (52), E3668-E3677 (2012).
- Cui, K. W., et al. Spatially controlled stem cell differentiation via morphogen gradients: A comparison of static and dynamic microfluidic platforms. Journal of Vacuum Science & Technology. A, Vaccum, Surfaces, and Films. 38 (3), 033205 (2020).
- Faden, F., Mielke, S., Lange, D., Dissmeyer, N. Generic tools for conditionally altering protein abundance and phenotypes on demand. Biological Chemistry. 395 (7-8), 737-762 (2014).
- Shoji, W., Sato-Maeda, M. Application of heat shock promoter in transgenic zebrafish. Development, Growth & Differentiation. 50 (6), 401-406 (2008).
- Kolar, K., Knobloch, C., Stork, H., Znidaric, M., Weber, W. OptoBase: A web platform for molecular optogenetics. ACS Synthetic Biology. 7 (7), 1825-1828 (2018).
- Benedetti, L., et al. Light-activated protein interaction with high spatial subcellular confinement. Proceedings of the National Academy of Sciences of the United States of America. 115 (10), E2238-E2245 (2018).
- Krueger, D., De Renzis, S. Optogenetic Methods to Control Tissue Mechanics in Drosophila. Methods in Molecular Biology. 2540, 269-283 (2022).
- Buckley, C. E. Optogenetic Control of Subcellular Protein Location and Signaling in Vertebrate Embryos. Methods in Molecular Biology. 1920, 143-162 (2019).
- Čapek, D., et al. Light-activated Frizzled7 reveals a permissive role of non-canonical wnt signaling in mesendoderm cell migration. Elife. 8, e42093 (2019).
- Krishnamurthy, V. V., et al. Reversible optogenetic control of kinase activity during differentiation and embryonic development. Development. 143 (21), 4085-4094 (2016).
- Huang, A., Amourda, C., Zhang, S., Tolwinski, N. S., Saunders, T. E. Decoding temporal interpretation of the morphogen Bicoid in the early Drosophila embryo. Elife. 6, e26258 (2017).
- Johnson, H. E., Toettcher, J. E. Signaling dynamics control cell fate in the early Drosophila embryo. Developmental Cell. 48 (3), 361.e3-370.e3 (2019).
- Aoki, K., et al. Stochastic ERK activation induced by noise and cell-to-cell propagation regulates cell density-dependent proliferation. Molecular Cell. 52 (4), 529-540 (2013).
- Chow, R. W., Vermot, J. The rise of photoresponsive protein technologies applications in vivo: a spotlight on zebrafish developmental and cell biology. F1000Research. , (2017).
- Rogers, K. W., ElGamacy, M., Jordan, B. M., Müller, P. Optogenetic investigation of BMP target gene expression diversity. Elife. 9, e58641 (2020).
- Sako, K., et al. Optogenetic control of Nodal signaling reveals a temporal pattern of Nodal signaling regulating cell fate specification during gastrulation. Cell Reports. 16 (3), 866-877 (2016).
- Grusch, M., et al. Spatio-temporally precise activation of engineered receptor tyrosine kinases by light. The EMBO Journal. 33 (15), 1713-1726 (2014).
- Crossman, S. H., Janovjak, H. Light-activated receptor tyrosine kinases: Designs and applications. Current Opinion in Pharmacology. 63, 102197 (2022).
- Kainrath, S., Janovjak, H. Design and Application of Light-Regulated Receptor Tyrosine Kinases. Methods in Molecular Biology. 2173, 233-246 (2020).
- Takahashi, F., et al. AUREOCHROME, a photoreceptor required for photomorphogenesis in stramenopiles. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19625-19630 (2007).
- Toyooka, T., Hisatomi, O., Takahashi, F., Kataoka, H., Terazima, M. Photoreactions of aureochrome-1. Biophysical Journal. 100 (11), 2801-2809 (2011).
- Vopalensky, P., Pralow, S., Vastenhouw, N. L. Reduced expression of the Nodal co-receptor Oep causes loss of mesendodermal competence in zebrafish. Development. 145 (5), dev.158832 (2018).
- Kishimoto, Y., Lee, K. H., Zon, L., Hammerschmidt, M., Schulte-Merker, S. The molecular nature of zebrafish swirl: BMP2 function is essential during early dorsoventral patterning. Development. 124 (22), 4457-4466 (1997).
- Rogers, K. W., et al. Nodal patterning without Lefty inhibitory feedback is functional but fragile. Elife. 6, e28785 (2017).
- Dubrulle, J., et al. Response to Nodal morphogen gradient is determined by the kinetics of target gene induction. Elife. 4, e05042 (2015).
- Harvey, S. A., Smith, J. C. Visualisation and quantification of morphogen gradient formation in the zebrafish. PLoS Biology. 7 (5), e1000101 (2009).
- Zinski, J., Tuazon, F., Huang, Y., Mullins, M., Umulis, D. Imaging and Quantification of P-Smad1/5 in Zebrafish Blastula and Gastrula Embryos. Methods in Molecular Biology. 1891, 135-154 (2019).
- Gerhardt, K. P., Castillo-Hair, S. M., Tabor, J. J. DIY optogenetics: Building, programming, and using the Light Plate Apparatus. Methods in Enzymology. 624, 197-226 (2019).
- Bugaj, L. J., Lim, W. A. High-throughput multicolor optogenetics in microwell plates. Nature Protocols. 14 (7), 2205-2228 (2019).
- Kumar, S., Khammash, M. Platforms for Optogenetic Stimulation and Feedback Control. Frontiers in Bioengineering and Biotechnology. 10, 918917 (2022).
- Urushibata, H., et al. Control of Developmental Speed in Zebrafish Embryos Using Different Incubation Temperatures. Zebrafish. 18 (5), 316-325 (2021).
- Rogers, K. W., Bläßle, A., Schier, A. F., Müller, P. Measuring protein stability in living zebrafish embryos using fluorescence decay after photoconversion (FDAP). Journal of Visualized Experiments. (95), e52266 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Feldman, B., et al. Zebrafish organizer development and germ-layer formation require nodal-related signals. Nature. 395 (6698), 181-185 (1998).
- Shimizu, T., et al. Cooperative roles of Bozozok/Dharma and Nodal-related proteins in the formation of the dorsal organizer in zebrafish. Mechanisms of Development. 91 (1-2), 293-303 (2000).
- Rebagliati, M. R., Toyama, R., Fricke, C., Haffter, P., Dawid, I. B. Zebrafish nodal-related genes are implicated in axial patterning and establishing left-right asymmetry. Developmental Biology. 199 (2), 261-272 (1998).
- Gritsman, K., Talbot, W. S., Schier, A. F. Nodal signaling patterns the organizer. Development. 127 (5), 921-932 (2000).
- LaBelle, J., et al. TAEL 2.0: An Improved Optogenetic Expression System for Zebrafish. Zebrafish. 18 (1), 20-28 (2021).
- Mruk, K., Ciepla, P., Piza, P. A., Alnaqib, M. A., Chen, J. K. Targeted cell ablation in zebrafish using optogenetic transcriptional control. Development. 147 (12), dev183640 (2020).
- Johnson, H. E., et al. The spatiotemporal limits of developmental Erk signaling. Developmental Cell. 40 (2), 185-192 (2017).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Patel, A. L., et al. Optimizing photoswitchable MEK. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25756-25763 (2019).
- LaBelle, J., Woo, S. Light-Induced GFP Expression in Zebrafish Embryos using the Optogenetic TAEL/C120 System. Journal of Visualized Experiments. (174), e62818 (2021).
- Kainrath, S., Stadler, M., Reichhart, E., Distel, M., Janovjak, H. Green-light-induced inactivation of receptor signaling using cobalamin-binding domains. Angewandte Chemie. 56 (16), 4608-4611 (2017).
- Benman, W., et al. Temperature-responsive optogenetic probes of cell signaling. Nat Chem Biol. 18 (2), 152-160 (2022).
- Reade, A., et al. TAEL: a zebrafish-optimized optogenetic gene expression system with fine spatial and temporal control. Development. 144 (2), 345-355 (2017).
- Putri, R. R., Chen, L. Spatiotemporal control of zebrafish (Danio rerio) gene expression using a light-activated CRISPR activation system. Gene. 677, 273-279 (2018).
- Liu, H., Gomez, G., Lin, S., Lin, S., Lin, C. Optogenetic control of transcription in zebrafish. PLoS One. 7 (11), e50738 (2012).
- Buckley, C. E., et al. Reversible optogenetic control of subcellular protein localization in a live vertebrate embryo. Developmental Cell. 36 (1), 117-126 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır