Method Article
Оптогенетическая активация передачи сигналов у эмбрионов рыбок данио-рерио
* Эти авторы внесли равный вклад
В этой статье
Резюме
Оптогенетическое манипулирование сигнальными путями может быть мощной стратегией для изучения того, как сигнализация расшифровывается в развитии, регенерации, гомеостазе и заболевании. Этот протокол содержит практические рекомендации по использованию сигнальных активаторов узловых и костных морфогенных белков (BMP) на основе чувствительных к свету кислороду доменов в раннем эмбрионе рыбки данио.
Аннотация
Сигнальные пути управляют фундаментальными биологическими процессами, включая развитие, регенерацию, гомеостаз и болезни. Методы экспериментального манипулирования сигналами необходимы для понимания того, как сигнализация интерпретируется в этих широких контекстах. Молекулярно-оптогенетические инструменты могут обеспечить обратимые, настраиваемые манипуляции активностью сигнальных путей с высокой степенью пространственно-временного контроля и применяются in vitro, ex vivo и in vivo. Эти инструменты объединяют светочувствительные белковые домены, такие как гомодимеризирующий домен LOV (LOV) в синем свете, с сигнальными эффекторами для обеспечения светозависимого экспериментального контроля над сигналами. Этот протокол содержит практические рекомендации по использованию костного морфогенетического белка (BMP) на основе LOV и узловых сигнальных активаторов bOpto-BMP и bOpto-Nodal в оптически доступном раннем эмбрионе рыбки данио. В ней описаны два контрольных эксперимента: быстрый анализ фенотипа для определения подходящих условий эксперимента и иммунофлуоресцентный анализ для непосредственной оценки передачи сигналов. Вместе эти контрольные эксперименты могут помочь создать конвейер для использования оптогенетических инструментов на ранних эмбрионах рыбок данио. Эти стратегии предоставляют мощную платформу для изучения роли сигналов в развитии, здоровье и физиологии.
Введение
Сигнальные пути позволяют клеткам реагировать на окружающую среду и координировать действия в масштабах всей ткани и организма. Сигналы, имеющие решающее значение для эмбрионального развития, включают членов суперсемейства TGF-beta, костный морфогенетический белок (BMP) и Nodal 1,2,3. Во время эмбриогенеза пути, регулируемые этими и другими сигналами, формируют план тела, контролируя экспрессию генов и дополнительные процессы, чтобы гарантировать, что различные ткани и органы развиваются и взаимодействуют должным образом. Патологии, в том числе врожденные дефекты и рак, могут возникать при нарушении передачи сигналов или реакций на передачу сигналов 4,5,6,7. Несмотря на тщательные исследования сигнализации, многое еще предстоит выяснить о том, как уровни и динамика декодируются в различных контекстах 8,9,10,11, особенно во время развития 12,13,14,15,16,17,18,19.
Чтобы понять, как декодируется сигнализация, идеальным экспериментом было бы манипулирование уровнями сигналов, временем и/или динамикой — с высокой степенью пространственного и временного контроля — и оценка результатов. Например, предложены точные пространственные сигнальные градиенты для моделирования развивающихся тканей20,21. Изменение пространственных распределений сигнального градиента помогло бы проверить эту гипотезу22. Кроме того, становится все более очевидной важность сигнальной динамики в генерировании разнообразных клеточных ответов: один и тот же сигнальный путь может инструктировать клетки дифференцироваться или пролиферировать в зависимости от частоты передачи сигналов, например, 9,23. Экспериментальные парадигмы, в которых можно легко манипулировать динамикой сигналов, будут полезны для изучения взаимосвязи между динамикой и решениями о судьбе клеток 8,12,13,14,15.
Исторически сложилось так, что для манипулирования сигналами в контексте развития использовалось множество методов, что привело к фундаментальным открытиям 1,2,3. Передача сигналов может быть заблокирована с помощью мутантов с потерей функции, экспрессии ингибиторов эктопии или препаратов-антагонистов. Методы активации сигнализации включают препараты-агонисты, рекомбинантные лиганды, эктопическую экспрессию лигандов или конститутивно активных рецепторов, а также мутанты ингибиторов путей с потерей функции. Эти методы варьируются в континууме экспериментального контроля. Например, мутанты и эктопическая экспрессия могут оказаться на стороне кувалды континуума: при таких подходах драматические, системные изменения в активности путей могут вызвать раннюю смерть и препятствовать исследованиям на более поздних стадиях, или со временем могут привести к плейотропным эффектам, которые трудно отделить друг от друга. Кроме того, часто бывает сложно независимо манипулировать одним сигнальным признаком за раз, таким как уровень или длительность. На другом конце континуума некоторые методы предлагают более точный экспериментальный контроль, такие как микрофлюидные устройства, которые подвергают образцы воздействию лекарств или рекомбинантных белков с временным, а иногда и пространственным контролем 18,24,25, или генетические методы, включая индуцируемые тепловым шоком и тканеспецифичные промоторы, которые могут предложить аналогичные преимущества16,26,27. Однако эти методы могут быть сложными в исполнении, могут быть необратимыми, могут иметь относительно медленную кинетику или плохое разрешение, а также могут быть недоступны в некоторых модельных системах.
Молекулярно-оптогенетические подходы являются мощным дополнением к этому инструментарию. Эти подходы используют белки, которые реагируют на различные длины волн света, для манипулирования биологическими процессами, включая передачу сигналов 8,12,13,14,15, и разрабатывались в течение десятилетий для использования в различных системах от клеточных культур до цельных животных 12,13,28. По сравнению с исторически сложившимися подходами, молекулярная оптогенетика часто может предложить более высокую степень пространственно-временного контроля над биологическими процессами: регулятором в оптогенетических системах является свет, а управление длиной волны, интенсивностью, продолжительностью и частотой воздействия света относительно простое. С помощью сложных систем, таких как конфокальные и двухфотонные микроскопы, возможно пространственное управление в субклеточном диапазоне 29,30,31. Инструменты для оптогенетического манипулирования сигналами были разработаны и применены в нескольких системах, в том числе описанных в Johnson et al.22, Čapek et al.32, Krishnamurthy et al.33 и Huang et al.34. Например, используя пространственный контроль, обеспечиваемый оптогенетикой, эта стратегия была недавно использована для модификации сигнального градиента у эмбрионов дрозофилы, демонстрируя, что эмбриогенез мух удивительно устойчив к изменениям этого градиента22. Обратимость и быстрая кинетика включения и выключения оптогенетических сигнальных активаторов также сделали их привлекательными инструментами для исследования расшифровки сигнальной динамики 8,12,13,14,15,34,35,36.
Ранний эмбрион данио-рерио представляет собой систему in vivo , хорошо подходящую для оптогенетических исследований, поскольку она оплодотворяется извне, прозрачна, удобна для микроскопии и генетически поддается лечению. Воздействие света легче доставлять эмбрионам, которые развиваются вне матери, свет может проникать и получать доступ к их непрозрачным тканям, живые эмбрионы рыбок данио-рерио хорошо переносят визуализацию (в дополнение к тому, что они прозрачны), а существующие генетические методы предоставляют прямые возможности для экспериментов по нокдауну и гиперэкспрессии, в дополнение к разработке полезныхтрансгенных препаратов.
Недавно были разработаны оптогенетические инструменты для активации передачи сигналов BMP38 и Nodal39 у эмбрионов рыбок данио при воздействии синего света (рис. 1). Мы называем эти инструменты bOpto-BMP и bOpto-Nodal (b — активируемый синим светом и Opto — оптогенетический). bOpto-BMP/Nodal основаны на схожих механизмах активации путей. Связывание BMP или узловых лигандов с соответствующими рецепторными серин-треонинкиназами приводит к взаимодействию рецепторных киназных доменов, которые приводят к фосфорилированию сигнальных эффекторов (Smad1/5/9 для BMP и Smad2/3 для узлов). Фосфорилированные сигнальные эффекторы затем транслоцируются в ядро и регулируют экспрессию гена-мишени3 (рис. 1A, D). Эти взаимодействия рецепторных киназ можно сделать светочувствительными, связав рецепторные киназы со светочувствительными димеризирующими белками: при воздействии света эти химерные белки должны димеризироваться, заставляя рецепторные киназные домены взаимодействовать и активировать передачу сигналов (рис. 1B, C, E, F). Важно отметить, что, в отличие от эндогенных рецепторов, bOpto-BMP/Nodal не содержат внеклеточных лиганд-связывающих доменов, обеспечивая лиганд-независимую активность (рис. 1C, F). Эта стратегия оптогенетической активации была сначала достигнута с рецепторными тирозинкиназами40,41,42, а затем применена к рецепторным серин-треонинкиназам.
bOpto-BMP/Nodal использует чувствительный к синему свету (~450 нм) гомодимеризирующий свет-кислород-напряжение-чувствительный домен (LOV) из водоросли Vaucheria fridiga белок AUREO1 (VfLOV)43,44. Эти конструкции состоят из мембранно-нацеленного мотива миристоилирования, за которым следуют домены киназы BMP или узлового рецептора, слитые с доменом LOV (рис. 1B, E). Воздействие синего света должно вызывать гомодимеризацию LOV, что приводит к взаимодействию доменов рецепторкиназы, которые приводят к соответствующему фосфорилированию Smad и активации путей (рис. 1C, F). Для bOpto-BMP было обнаружено, что комбинация конструкций с рецепторными киназными доменами I типа из Acvr1l (также известных как Alk8) и BMPR1aa (также известных как Alk3) и рецепторным киназным доменом II типа из BMPR2a оптимально активирует сигнализацию38 (Addgene #207614, #207615 и #207616). Для bOpto-Nodal используется комбинация конструкций с рецепторным киназным доменом I типа из Acvr1ba и рецепторным киназным доменом II типа из Acvr2ba39.
bOpto-BMP/Nodal были введены в ранние эмбрионы данио-рерио путем инъекции мРНК на одноклеточной стадии и использованы для изучения роли продолжительности передачи сигналов в узловой интерпретации39, для определения того, почему данио-рерио теряют способность реагировать на узел45, и для изучения того, как гены-мишени BMP реагируют на различные уровни передачи сигналов BMP38. Вполне вероятно, что эти инструменты будут по-прежнему полезны в широком спектре будущих расследований. Однако сила оптогенетических сигнальных активаторов также является их слабостью: со светочувствительными образцами следует обращаться с осторожностью, чтобы избежать непреднамеренной эктопической сигнальной активности. Воздействие комнатного света или солнечного света может активировать bOpto-BMP/Nodal.
В этом протоколе содержатся практические рекомендации по использованию кодируемых мРНК LOV-активаторов BMP и Nodal в ранних эмбрионах рыбок данио. Он начинается с подробного описания одной из стратегий создания светового короба для управления равномерным освещением и температурой (Рисунок 2, Дополнительный файл 1, Дополнительный файл 2, Дополнительный файл 3, Дополнительный файл 4, Дополнительный файл 5, Дополнительный файл 6, Дополнительный файл 7, Дополнительный файл 8). Затем описываются два ключевых контрольных эксперимента, которые определяют, ведет ли оптогенетический сигнальный активатор себя так, как ожидалось, т.е. активирует активность проводящих путей только при воздействии света (рис. 3). Первый контрольный анализ включает в себя изучение фенотипов через один день после оплодотворения у эмбрионов, подвергшихся воздействию света, и эмбрионов, не подвергшихся воздействию света (рис. 3А). Эмбрионы, подвергшиеся воздействию света с помощью мРНК, но не необлученные эмбрионы, должны фенокопировать BMP или узловую гиперэкспрессию (рис. 4A, B; Фенотипы BMP, в частности, четко различимы в этой точкевремени 46). Этот анализ обеспечивает быстрое считывание активности. Во втором контрольном анализе, чтобы определить, вызваны ли фенотипы конкретно избытком BMP или узловой сигнализации, и непосредственно наблюдать за изменением уровней сигнализации, используется иммунофлуоресцентное окрашивание для обнаружения фосфорилированных сигнальных эффекторов (pSmad1/5/9 или pSmad2/3, соответственно) после 20-минутного воздействия света на поздней стадии бластулы / ранней гаструляции, когда сигнальная активность была хорошо описана12. 16,17,47,48,49,50 (рисунок 3Б и рисунок 4В). (Обратите внимание, что, несмотря на то, что пространственно локализованная активация была продемонстрирована как для bOpto-BMP38, так и для bOpto-Nodal39, этот протокол описывает только однородное воздействие света и стратегии активации сигналов.) Рекомендуется проводить эти контрольные эксперименты до применения bOpto-BMP/Nodal к конкретным исследовательским вопросам, чтобы определить идеальные локальные условия эксперимента.
протокол
Протоколы исследований данио-рерио были рассмотрены и одобрены Комитетом по уходу за животными и их использованию при Национальных институтах здравоохранения (ASP 21-008). Все исследования рыбок данио-рерио проводились в соответствии с Руководством по уходу и использованию лабораторных животных.
1. Сборка светового короба
- Чтобы контролировать освещенность и температуру, сконструируйте световой короб, в котором в качестве источника света используется светодиодный (LED) микропластинчатый осветитель (Рисунок 2A, Таблица материалов, Дополнительный файл 1, Дополнительный файл 2). Этот настраиваемый осветитель обеспечивает динамическое, программируемое управление на нескольких длинах волн.
ПРИМЕЧАНИЕ: Существует множество возможных стратегий построения светового короба, и альтернативный подход может быть более подходящим (см., например, Gerhardt et al.51, Bugaj et al.52, Kumar and Khammash 53 и др., стр. https://www.optobase.org/materials/). - Включите в световой короб следующие функции: контроль температуры (28 °C идеально подходит для эмбрионов рыбок данио), исключение нежелательного света (например, комнатного света и солнечного света), равномерная подача синего света, покрывающего целевую область (например, 6-луночная пластина), а также контроль интенсивности света и динамики экспозиции.
ПРИМЕЧАНИЕ: bOpto-BMP/Nodal активируются синим светом, но некоторые оптогенетические инструменты реагируют на другие длины волн. Используйте соответствующую длину волны для оптогенетического инструмента. - Просверлите отверстие в верхней части инкубатора (Рисунок 2B), которое немного шире, чем выходная линза светодиода.
- Убедитесь, что в верхней части инкубатора нет электрических компонентов, которые будут разрушены сверлением (Таблица материалов). В этом можно убедиться, связавшись с производителем инкубатора и спросив напрямую.
- Если на верхней панели инкубатора есть отверстие, используйте ступенчатое сверло, чтобы увеличить размер отверстия до 1,25 дюйма. В противном случае используйте 1,25-дюймовую кольцевую пилу с оправкой.
- Если есть внутренние панели, которые блокируют источник света, просверлите отверстие соответствующего размера, чтобы убедиться, что световой конус не заблокирован (Рисунок 2A). Панели обычно изготавливаются из тонкого листового металла, поэтому используйте медленные скорости и сверла по металлу, чтобы предотвратить повреждение (рекомендуется кобальтовое сверло).
- Соорудите светодиодный держатель, чтобы закрепить светодиодный микропластинчатый осветитель в верхней части инкубатора (Рисунок 2C, Дополнительный файл 3, Дополнительный файл 4, Дополнительный файл 5, Дополнительный файл 6, Дополнительный файл 7, Дополнительный файл 8).
- Прикрепите четыре стойки куба M3 к вертикальной части кронштейна с помощью винтов M3.
- Прикрепите два боковых кронштейна слева и справа от кубических стоек вертикального кронштейна. Установите еще одну стойку куба в оставшееся отверстие на боковых кронштейнах.
- Прикрепите вертикальный кронштейн к светодиодному микропластинчатому осветителю в сборе (таблица материалов) с помощью винтов M6. Поместите прокладку светодиодной линзы на линзу светодиодной системы.
- Прикрепите собранные детали к креплению панели инкубатора, затем к стойкам M3 на вертикальных и боковых кронштейнах. Поместите прокладку инкубатора на просверленное отверстие сверху инкубатора.
- Поместите крепление панели инкубатора поверх прокладки инкубатора, убедившись, что отверстия прокладки и панели концентрически расположены с отверстием инкубатора. Прикрепите панель к верхней части инкубатора с помощью винтов No 8. Убедитесь, что это уплотнение светонепроницаемое.
- Поместите 6-луночную тарелку на верхнюю полку инкубатора. Определите, равномерно ли световой луч покрывает пластину (рис. 2A). Используйте лист бумаги, чтобы визуализировать световое покрытие.
- Если вся пластина не покрыта лучом, увеличьте расстояние между светодиодом и пластиной, переместив полку вниз. Для системы, описанной здесь, достаточно ~14 дюймов между светодиодом и полкой.
- Используйте экспонометр для определения уровня освещенности и пространственной однородности (Таблица материалов).
- Чтобы избежать непреднамеренного попадания солнечных лучей и освещения в помещении, используйте уплотнители, чтобы обеспечить светонепроницаемость дверцы инкубатора (Рисунок 2A).
- Эмбрионы рыбок данио-рерио интенсивно развиваются при температуре 28 °C54. Используйте термометр для карты памяти, чтобы убедиться, что световой короб держит 28 °C.
2. Генерация мРНК для инъекций
ПРИМЕЧАНИЕ: pCS2+ является векторной основой для конструкций bOpto-BMP38 и bOpto-Nodal39. Этот переносчик устойчив к ампициллину. bOpto-BMP состоит из трех конструкций (рис. 1B): BMPR1aa-LOV (Addgene # 207614): предполагаемый домен киназы рецептора BMPR1aa типа I (также известный как Alk3), слившийся с LOV; Acvr1l-LOV (Addgene # 207615): предполагаемый киназный домен рецептора Acvr1l типа I (также известный как Alk8), слитый с LOV; и BMPR2a-LOV (Addgene # 207616): предполагаемый киназный домен рецептора BMPR2a типа II и следующий за ним С-концевой домен, слитый с LOV. bOpto-Nodal состоит из двух конструкций (рис. 1E): Acvr1ba-LOV: предполагаемый киназный домен рецептора Acvr1ba типа I (также известный как Acvr1b), слитый с LOV; Acvr2ba-LOV: предполагаемый киназный домен рецептора Acvr2ba типа II (также известный как Acvr2b), слитый с LOV.
- Для линеаризации плазмид расщепляют от 2 до 5 мкг плазмидной ДНК с использованием фермента рестрикции NotI при 37 °C в течение 1-3 ч (таблица материалов).
ПРИМЕЧАНИЕ: Также возможна генерация линеаризованной ДНК с использованием плазмиды в качестве ПЦР-матрицы. - Очистите ДНК с помощью стандартного набора для очистки на основе колонки (Таблица материалов).
- Используйте набор для транскрипции in vitro SP6, такой как набор mMessage mMachine, для транскрибирования РНК из линеаризованного шаблона (таблица материалов). Установите две реакции в соответствии с рекомендациями производителя, чтобы обеспечить более высокий выход.
- Очистите РНК с помощью стандартного набора для очистки РНК на основе колонки (таблица материалов). Также возможна очистка с помощью осаждения.
3. Инъекция мРНК
- Не менее чем за 1 день до инъекций изготовьте инъекционные чашки и покрытые агарозой 6-луночные планшеты.
- Приготовьте 200 мл 1% агарозы в питательной среде рыбки данио и поставьте в микроволновую печь до полного растворения агарозы. Любая стандартная среда эмбриона данио-рерио должна быть приемлемой; Тем не менее, исключите метиленовый синий из эмбриональной среды, так как он может повлиять на последующую визуализацию в других приложениях.
- Осторожно перелейте расплавленную агарозу в пластиковые чашки Петри размером 100 мм х 15 мм. Наполните посуду наполовину.
- Промойте форму для литья под давлением питательной средой и аккуратно поместите на расплавленную агарозу, убедившись, что между формой и агарозой не застряли пузырьки. Используйте скотч, чтобы сделать выступ на задней части формы для удобства размещения и извлечения.
- Форма должна плавать в расплавленной агарозе. Если форма тонет, осторожно вынуть из расплавленной агарозы и повторить шаг 3.1.3.
- После того, как агароза застынет, с помощью язычка аккуратно удалите форму. Этот процесс можно ускорить, поставив блюдо при температуре 4 °C.
- При работе с дехорионированными эмбрионами для иммунофлуоресцентных экспериментов изготавливают 6-луночные планшеты, покрытые агарозой.
- Используйте одноразовую пластиковую пипетку объемом 10 мл для переноса достаточного количества расплавленной агарозы, чтобы покрыть дно каждой лунки 6-луночного планшета.
- Храните чашки для инъекций и 6-луночные планшеты при температуре 4 °C. Их можно использовать сразу или хранить до тех пор, пока агароза не высохнет или не загрязнится (обычно 2-3 недели).
- Подготовьте стеклянные наконечники для пипеток с пламенем, если вы работаете с дехорионированными эмбрионами для иммунофлуоресцентных экспериментов.
- Вставьте конец стеклянной пипетки в пламя горелки Бунзена и непрерывно вращайте, пока края не станут гладкими. Дехорионизированные эмбрионы должны комфортно проходить через конец пипетки. Не допускайте уменьшения отверстия ниже диаметра эмбриона.
- Либо приобретите, либо вытащите иглы для микроинъекций (Таблица материалов). Желательно иметь под рукой дополнительные иглы в день инъекций на случай, если потребуется их замена.
- За день до инъекций настройте заводчиков данио-рерио в соответствии со стандартными операционными процедурами (СОП) института. Держите самцов и самок отдельно.
- Включите регулятор температуры светового короба, чтобы поддерживать температуру 28 °C. Чтобы температура светового короба оставалась на уровне 28 °C, контролируйте температуру с помощью термометра на карте памяти (Таблица материалов).
- Приготовьте смеси для инъекций мРНК. Введите эквимолярные количества каждой конструкции. Необходимо опытным путем определить, какое количество вводить.
- Размеры расшифровки bOpto-BMP следующие:
Acvr1l-LOV = 2007 нуклеотидов (nt)
BMPR1aa-LOV = 1983 нт
BMPR2a-LOV = 3409 нт - Чтобы ввести эквимолярные количества, введите в 1,01 раза больше конструкции Acvr1l, чем BMPR1aa; инжектировать в 1,72 раза больше конструкции BMPR2a, чем BMPR1aa.
- Размеры опто-узлового транскрипта следующие:
Acvr1ba-LOV и Acvr2ba-LOV - это 1962 nt. - Чтобы ввести эквимолярные количества, введите одинаковое количество каждой конструкции.
- Приготовьте эквимолярные инъекционные смеси, объединив все мРНК, нацеленные на один путь, в одну инъекционную смесь. При желании включите инжекционный индикатор фенолового красного. Для данных, показанных на рисунке 4, использовали по 15 пг каждой bOpto-Nodal конструкции (Acvr1ba-LOV и Acvr2ba-LOV), а для bOpto-BMP использовали 7,8 пг Acvr1l-LOV и BMPR1aa-LOV и 13,4 пг BMPR2a-LOV.
- Хранить смеси для впрыска при температуре -20 °C. После определения оптимальной концентрации инъекционной смеси делают аликвоты объемом 5-10 мкл и хранят при температуре -20 °C или -80 °C.
- День инъекции
- При проведении анализа на фенотипирование (рис. 3A) введите через хорион непосредственно в центр клетки на стадии одной клетки в соответствии с СОП вашей лаборатории. Хорион защищает эмбрионы от стрессовых факторов окружающей среды и удерживает лизированные эмбрионы. Это полезно при подсчете баллов для точного количественного определения лизированных эмбрионов (рис. 4A, B).
- При проведении иммунофлуоресцентного анализа (рис. 3B) эмбрионы в конечном итоге должны быть дехорионированы для визуализации (рис. 4C). Поэтому вводят непосредственно в центр клетки дехорионированных эмбрионов на одноклеточной стадии (протокол дехорионирования см. Rogers et al.55 ). В качестве альтернативы эмбрионы могут быть дехорионированы вручную после фиксации, но это более обременительно, чем дехорионирование проназой.
- Используйте пипетки из воспламененного стекла для обработки дехорионированных эмбрионов (шаг 3.1.10). Следите за тем, чтобы дехорионированные эмбрионы не подвергались воздействию воздуха или пластика, так как это может привести к лизису эмбрионов. Обращайтесь с дехорионизированными эмбрионами осторожно.
- Подготовьте дополнительную чашку с невведенными эмбрионами в качестве примера для оценки прогрессирования стадии (см. шаг 4.3.5). Убедитесь, что прокси-эмбрионы получены от одного и того же набора экспериментальных эмбрионов, чтобы все эмбрионы были оплодотворены в одно и то же время от одних и тех же родителей. Это полезно для иммунофлуоресцентного анализа, где стадия имеет значение, но не является необходимым для анализа на фенотипирование.
- Используйте следующие условия как для фенотипирования, так и для иммунофлуоресцентного анализа: 1) неинъекционный, необлученный, 2) неинъекционный, подвергшийся воздействию света, 3) инъекционный, неэкспонированный, 4) введенный, подвергшийся воздействию света. Выберите не менее 30 эмбрионов для каждого состояния. Для оптимального здоровья эмбрионов не инкубируйте более 30 эмбрионов в лунке в 6-луночном планшете.
- После инъекции переносят эмбрионы в меченые чашки Петри или 6-луночные планшеты, покрытые агарозой (для дехорионированных эмбрионов) и инкубируют при 28 °C. Эмбрионы еще не чувствительны к свету. Обращайтесь с введенными эмбрионами так, как если бы они были светочувствительными через 1,5 часа после оплодотворения.
4. Эксперимент с экспозицией света
ПРИМЕЧАНИЕ: Воздействие света ~450 нм с интенсивностью излучения 45 Вт/м2 надежно активирует bOpto-BMP/Nodal без явной фототоксичности (информацию о экспонометре см. в таблице материалов). Уровень оптогенетически активированной сигнализации может быть настроен путем изменения значений освещенности38. Тем не менее, фототоксичность необходимо будет оценивать при более высокой интенсивности облучения.
- Чувствительный ко времени шаг. На стадии от 4 до 16 клеток, около 1,5 hpf, удаляют неоплодотворенные и нездоровые эмбрионы. При необходимости перераспределить, чтобы обеспечить одинаковое количество эмбрионов в каждой лунке (не более 30).
ПРИМЕЧАНИЕ: Важно выполнять этот этап на стадии от 4 до 16 клеток, потому что эмбрионы становятся светочувствительными, когда введенная мРНК транслируется в белок. Мы не наблюдали доказательств того, что эмбрионы в значительной степени светочувствительны до 1,5 hpf. Чтобы свести к минимуму непреднамеренную фотоактивацию при оценке эмбрионов после 1,5 hpf, используйте красные лампы или накройте источники света, включая столики микроскопа, красной гелевой фильтровальной бумагой, которая блокирует LOV-димеризацию синих длин волн (Таблица материалов).- Последовательно оценивайте эмбрионы, чтобы обеспечить объективное распределение между условиями и экспериментами.
- Для анализа фенотипирования используйте следующий протокол 1-дневного воздействия света, начиная с 1,5 hpf (рис. 3A).
- Оберните неэкспонированную контрольную пластину алюминиевой фольгой. Эта пластина должна включать как неинъекционные, так и инъецированные эмбрионы. Убедитесь, что тарелка полностью покрыта, и следите за тем, чтобы фольга не попала на разрывы. Поместите эту пластину на нижнюю полку светового короба с температурой 28 °C (Рисунок 2A).
- Поместите открытую пластину на верхнюю полку светового короба с температурой 28 °C (Рисунок 2A). Убедитесь, что крышка находится на чашке, чтобы избежать испарения среды эмбриона. Включите синий свет (яркость 45 Вт/м2 надежно активирует передачу сигналов).
- Закройте дверцу светового короба, чтобы избежать непреднамеренного попадания света в помещение. При желании поместите термометр с картой памяти внутрь светового короба перед закрытием дверцы. Не открывайте дверь до тех пор, пока фенотип не будет подсчитан через 1 день после оплодотворения (DPF; см. шаг 5.1).
- Для иммунофлуоресцентного анализа подвергают эмбрионы воздействию синего света в течение 20 минут, начиная примерно с 40% эпиболии56 (~6 hpf), и фиксируют сразу после воздействия света вместе с неэкспонированными контрольными группами (рис. 3B). 20-минутное воздействие синего света при 40% эпиболии воспроизводимо активирует передачу сигналов.
- Около 1,5 hpf, отдельно заверните открытую и неэкспонированную посуду в алюминиевую фольгу. Убедитесь, что посуда полностью накрыта, и следите за тем, чтобы не попасть в фольгу. Оставьте прокси-блюдо незавернутым. Поместите завернутую посуду и неупакованную прокси-тарелку в световой короб с температурой 28 °C (Рисунок 2A). Пока не включайте светодиод.
- При тестировании более одного количества мРНК в необлученном состоянии сортируйте эмбрионы, введенные в разных количествах, в отдельные 6-луночные планшеты, покрытые агарозой, что поможет свести к минимуму непреднамеренное воздействие света во время последующей фиксации.
- Закройте дверцу светового короба, чтобы избежать непреднамеренного попадания света в помещение.
- Разбавьте запас формальдегида до 4% в 1 растворе с фосфатно-солевым буфером (PBS) и в 1 мл в предварительно промаркированные пробирки для микроцентрифуг с круглым дном объемом 2 мл, по одной пробирке на состояние. Хранить при температуре 4 °C.
- Около 5 hpf извлеките прокси-чашку, содержащую невведенные эмбрионы, и оцените стадию развития с помощью препарирующего эндоскопа. Стадия прокси-эмбрионов должна отражать стадию светочувствительных эмбрионов в завернутой посуде.
- Также уберите завернутую посуду, чтобы все блюда имели одинаковую температуру. Повторяйте до тех пор, пока прокси-эмбрионы не достигнут 40% эпиболии (~6 hpf). Прогрессирование эмбриогенеза чувствительно к температуре54; Поэтому, чем дольше чашки находятся вне инкубатора, тем больше времени потребуется эмбрионам, чтобы достичь 40% эпиболии.
- После того, как прокси-эмбрионы достигнут 40% эпиболии, разверните открытую чашку и поместите ее на верхнюю полку светового короба (Рисунок 2А). Оставьте неэкспонированную посуду (тарелки) завернутой и поставьте на нижнюю полку. Немедленно включите синюю лампу, закройте дверцу и установите таймер на 20 минут (яркость 45 Вт/м2 надежно активирует сигнализацию).
- Чтобы подготовиться к фиксации, устраните как можно больше света в помещении (закройте жалюзи на окнах, выключите верхний свет, выключите экраны и т.д.). Убедитесь, что пробирки, содержащие формальдегид, имеют соответствующую маркировку. Непосредственно перед фиксацией снять формальдегидсодержащие трубки с 4 °С и поместить рядом со световым коробом.
- Чувствительный ко времени и свету шаг. Будьте готовы к быстрому перемещению по истечении 20 минут воздействия света. Через 20 минут откройте дверцу светового короба и выньте неэкспонированную тарелку.
- Используйте воспламененный стеклянный наконечник пипетки для быстрого, но осторожного переноса светочувствительных эмбрионов в подготовленную соответствующую пробирку с 4% формальдегидом.
- Минимизируйте время переноса (<45 с) светочувствительных эмбрионов, чтобы избежать непреднамеренного воздействия света. Убедитесь, что в пипетке нет пузырьков воздуха. Воздействие воздуха разрушает дехорионизированные эмбрионы.
- Чтобы выбросить эмбрионы в формальдегид, погрузите стеклянный наконечник пипетки в формальдегид и дайте эмбрионам погрузиться в жидкость. Сведите к минимуму количество эмбриональной среды, которое переносится в формальдегид, удерживая эмбрионы на конце кончика.
- После переноса эмбрионов верните пипетку в ту же лунку и проведите пипеткой вверх и вниз, чтобы удалить застрявшие эмбрионы. Это предотвращает случайное попадание эмбрионов из нескольких состояний в одну пробирку.
- Немедленно повторите шаги 4.3.11-4.3.13 для неэкспонированных, невведенных эмбрионов, а затем для экспонированных эмбрионов (инъекционных и неинъекционных).
- Храните фиксированные эмбрионы при температуре 4 °C в течение ночи.
5. Оценка эксперимента
- Оценка фенотипа и визуализация
- При 1 dpf, в идеале между 24-32 hpf, извлекают эмбрионы из светового короба для оценки фенотипов с помощью препарирующего эндоскопа и создания оценочной рубрики. Это экспериментальная конечная точка; Непреднамеренная фотоактивация больше не является проблемой.
- Забивайте эмбрионы, пока они еще находятся в хорионе, для легкости. Используйте пипетку или зонд для перемещения эмбрионов, чтобы рассмотреть их под разными углами.
- Эмбрионы, испытывающие избыточную передачу сигналов BMP, будут вентрализованы с различной степенью тяжести, как подробно описано в Kishimoto et al. 199746 (рис. 4А, левая панель). Эмбрионы, испытывающие избыточную узловую сигнализацию, будут иметь ряд дефектов развития, связанных с избытком мезендодермы (рис. 4A, правая панель)1,3,47,57,58,59,60. Они часто лизируются на 1 dpf.
- Оцените каждый эмбрион во всех условиях (рис. 4B). Получите общее изображение всех эмбрионов в каждой лунке. При желании дехорионат и визуализируют отдельные репрезентативные эмбрионы в метилцеллюлозе (рис. 4А).
- Иммунофлуоресцентное окрашивание и визуализация
- После инкубации эмбрионов в 4% формальдегиде при 4 °C в течение ночи удаляют формальдегид и промывают 3-5 раз 1 фосфатно-солевым буфером с Tween20 (PBST). Удалите ПБСТ и добавьте 100% метанола.
- Закройте трубки и осторожно переверните их, чтобы смешать остаточный PBST и метанол. Промыть 2 раза с метанолом и хранить при -20 °C не менее 2 ч до лет.
- Протокол иммунофлюоресценции pSmad1/5/9 (BMP) см. в Rogers et al.38. Протокол иммунофлюоресценции pSmad2/3 (Nodal) см. van Boxtel et al.17 и Rogers et al.47.
- Визуализируйте иммуноокрашенные эмбрионы с помощью микроскопа, способного к оптическому срезированию (например, конфокальный или световой листовой микроскоп). Избегайте насыщения и поддерживайте одинаковые условия визуализации между всеми образцами, окрашенными одними и теми же антителами.
- Снимок в течение 5 дней после завершения иммунофлуоресцентного окрашивания, потому что флуоресценция может исчезнуть со временем.
Результаты
Цель двух описанных здесь контрольных экспериментов состоит в том, чтобы определить, активируют ли bOpto-BMP/Nodal свои соответствующие пути в ответ на воздействие синего света, не влияя на передачу сигналов в отсутствие света, как ожидалось. Используйте эти элементы управления, чтобы установить соответствующий экспериментальный рабочий процесс в вашей лаборатории, прежде чем применять bOpto-BMP/Nodal к интересующим вас исследовательским вопросам.
Анализ фенотипирования может быть завершен всего за 2 дня и дает полезное представление о сигнальной активности и фототоксичности (рис. 3A). Эмбрионы, подвергшиеся воздействию синего света, должны фенокопировать избыточную передачу сигналов BMP (вентризация46; Рисунок 4А, левая панель) или Узловая сигнализация (дефекты развития, связанные с экстрамезендодермой 1,3,47,57,58,59,60 (Рисунок 4А, правая панель)). При инъекции эмбрионы, подвергшиеся воздействию света, являются афенотипными, проверьте качество мРНК и рассмотрите возможность введения большего количества инъекций, а также перепроверьте стратегию воздействия света, чтобы обеспечить постоянное воздействие яркого света (~450 нм света с интенсивностью излучения 45 Вт/м2 должен сильно активировать передачу сигналов). Напротив, инъекционные, необлученные эмбрионы должны выглядеть идентично неинъекционным братьям и сестрам. При инъекции необлученные эмбрионы демонстрируют фенотипы, уменьшают количество введенной мРНК и пересматривают экспериментальную установку, чтобы убедиться, что необлученные эмбрионы защищены от воздействия света. Данные, представленные на рисунке 4B, показывают результаты типичных экспериментов по фенотипированию с соответствующими количествами мРНК и условиями воздействия: сильная сигнальная активность очевидна у инъецированных, подвергшихся воздействию света эмбрионов, и только небольшая часть инъецированных, необлученных эмбрионов демонстрирует фенотипы.
Анализ на фенотипирование также дает возможность оценить фототоксичность. Если фототоксичность незначительна, неинъекционные, подвергшиеся воздействию света эмбрионы должны выглядеть дикого типа, похожими на неинъецированные, необлученные эмбрионы. Если неинъекционные, подвергшиеся воздействию света эмбрионы имеют дефекты, но не неинъецированные, необлученные эмбрионы, подумайте о том, чтобы уменьшить световое излучение. Излучение 45 Вт/м2 надежно активирует передачу сигналов без явной фототоксичности. Данные, представленные на рисунке 4B , не показывают никаких тревожных различий между невведенными, световыми и неинъецированными, необлученными эмбрионами, что указывает на пренебрежимо малую фототоксичность.
Несмотря на то, что иммунофлуоресцентный анализ требует больше времени и усилий (~1 неделя) по сравнению с фенотипированием (2 дня), иммунофлуоресцентное окрашивание обеспечивает прямое считывание активности сигнального пути и может выявить тонкие сигнальные изменения, которые могут не отражаться в общей морфологии. Иммунофлуоресценция особенно важна для оценки ответов на bOpto-Nodal, поскольку избыток узловой сигнализации часто приводит к лизицизму эмбрионов на 1 dpf, что может иметь множество причин, в отличие от специфических вентralизационных фенотипов, характерных для избыточной передачи сигналов BMP46 (рис. 4A). Эмбрионы, подвергшиеся воздействию синего света, должны демонстрировать равномерное увеличение фосфорилирования Smad1/5/9 или Smad2/3 по сравнению с эмбрионами, не подвергшимися воздействию света. Если уровни не повышаются или повышаются лишь незначительно, проверьте качество мРНК и подумайте о том, чтобы ввести больше, а также перепроверьте стратегию воздействия света. 20-минутное воздействие синего света с интенсивностью излучения 45 Вт/м2 около 40% эпиболии должно сильно активировать передачу сигналов. Если окрашивание pSmad неоднородное, попробуйте ввести мРНК в центр клетки (а не в желток), что может привести к более равномерному распределению мРНК.
Инъецированные, необлученные эмбрионы должны иметь уровни pSmad, сопоставимые с неинъецированными эмбрионами. Как ни странно, мы наблюдали более герметичное фосфорилирование Smad с bOpto-Nodal, чем bOpto-BMP. Если уровень pSmad повышен в введенных, необлученных эмбрионах, уменьшите количество введенной мРНК. Кроме того, пересмотрите экспериментальную установку, чтобы убедиться, что 1) неэкспонированные эмбрионы не подвергаются случайному воздействию света, и 2) воздействие света во время фиксации минимально. На этапе фиксации критически важно не допустить, чтобы между извлечением из светового короба и погружением в формальдегид прошло не более 45 с. Кроме того, на этом этапе сведите к минимуму воздействие комнатного света и солнечного света, закрыв оконные жалюзи, выключив источники белого света, используя красный свет или накрыв источники белого света синей светоблокирующей гелевой фильтровальной бумагой (Таблица материалов).
Данные, представленные на рисунке 4C , показывают результаты типичных экспериментов по иммунофлуоресцентному окрашиванию с соответствующими количествами мРНК и условиями воздействия света: уровни pSmad одинаковы у неинъецированных и необлученных эмбрионов, в то время как инъецированные эмбрионы, подвергшиеся воздействию света, демонстрируют более высокие уровни фосфорилирования Smad.
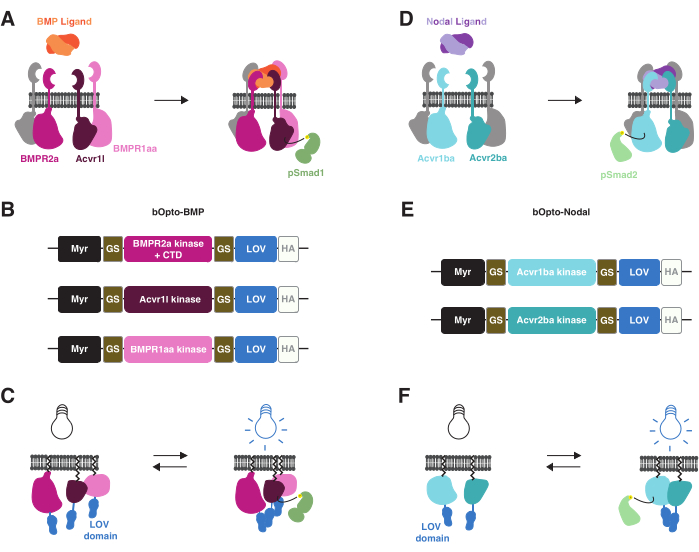
Рисунок 1: Стратегия активации bOpto-BMP и -Nodal signaling . (A) Эндогенный сигнальный путь BMP активируется связыванием лиганда BMP, что приводит к образованию рецепторного комплекса I/II типа, фосфорилированию Smad1/5/9 и экспрессии генов-мишеней BMP. Рецепторы I типа BMPR1aa и Acvr1l также известны как Alk3 и Alk8 соответственно. BMPR2a является рецептором II типа. (B) bOpto-BMP конструкции38. Предполагаемые киназные домены BMPR1aa и Acvr1l сливаются с LOV; слияние BMPR2a-LOV содержит предполагаемый киназный домен и рецепторный С-концевой домен (CTD). Все слияния нацелены на мембрану с мотивом миристоилирования (Myr). Домены разделяются глицин-сериновыми (GS) линкерами. Конструкты помечаются в CTD тегом эпитопа HA. Было обнаружено, что эта комбинация из трех конструктов оптимально активирует передачу сигналов BMP. (C) bОпто-BMP-опосредованная активация сигнализации BMP. При воздействии синего света домены LOV димеризируются, что, как полагают, вызывает образование комплексов и активацию сигналов. (D) Эндогенный узловой сигнальный путь активируется связыванием узлового лиганда, что приводит к образованию рецепторного комплекса I/II типа, фосфорилированию Smad2/3 и экспрессии генов-мишеней узлов. Рецептор I типа Acvr1ba и рецептор II типа Acvr2ba также известны как Acvr1b и Acvr2b соответственно. (E) bОптико-узловые конструкции39. Предполагаемые киназные домены из Acvr1ba и Acvr2ba сливаются с LOV. Все слияния нацелены на мембрану с мотивом миристоилирования (Myr). Домены разделяются компоновщиками GS. Конструкты помечаются в CTD тегом эпитопа HA. (F) bОпто-узловая опосредованная активация узловой сигнализации. При воздействии синего света домены LOV димеризируются, что, как полагают, вызывает образование комплексов и активацию сигналов. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
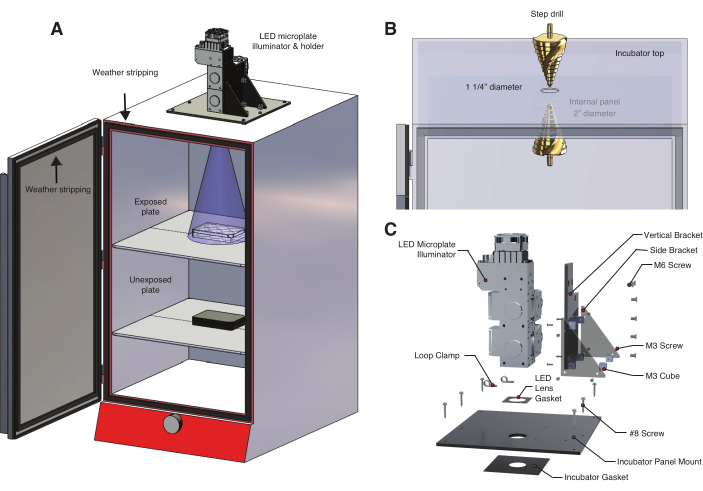
Рисунок 2: Световой короб с регулируемой температурой для оптогенетических экспериментов . (A) Светодиодный микропластинчатый осветитель крепится к верхней части инкубатора с помощью специально изготовленного светодиодного держателя. Эмбрионы данио-рерио в 6-луночной пластине на первой полке подвергаются воздействию света через отверстие, просверленное в верхней части инкубатора. На нижней полке находится второй набор неэкспонированных контрольных эмбрионов в 6-луночной пластине, обернутой алюминиевой фольгой. Дверца инкубатора облицована уплотнителем, чтобы предотвратить непреднамеренное воздействие комнатного света или солнечного света. (B) Подробная информация о процедуре создания отверстия в инкубаторе с помощью ступенчатого сверла. Используемая здесь модель инкубатора имеет внутреннюю панель, которая требует сверления второго, большего отверстия (Таблица материалов). (C) Деталь специального светодиодного держателя, предназначенного для трехволновой системы освещения. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
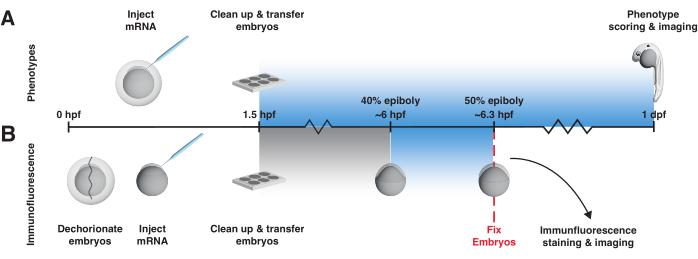
Рисунок 3: Рабочий процесс эксперимента bOpto-BMP/Nodal. Анализ фенотипа и иммунофлуоресцентное окрашивание pSmad для тестирования активности bOpto-BMP/Nodal. Эмбрионам вводят мРНК на одноклеточной стадии и переносят в световой короб не позднее, чем через 1,5 ч после оплодотворения (hpf). (А) Фенотипический анализ. Эмбрионы с инъекциями и братья и сестры, не получившие инъекции, выращиваются в темноте или подвергаются равномерному воздействию синего света, начиная с 1,5 hpf до 1 дня после оплодотворения (DPF). Оптогенетическая сигнальная активность может быть оценена путем оценки эмбрионов по фенотипам, соответствующим избыточной активности пути. (B) иммунофлуоресцентное окрашивание pSmad. Инъецированные эмбрионы и неинъекционные братья и сестры выращиваются в темноте до 40% эпиболии (~6 hpf). Половина введенных и половина невведенных эмбрионов подвергается воздействию однородного синего света в течение 20 минут. После экспозиции все эмбрионы фиксируют и подвергают иммунофлуоресцентному окрашиванию на pSmad. Повышенные уровни pSmad1/5/9 или pSmad2/3 отражают оптогенетическую активацию BMP или узловой сигнализации, соответственно. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
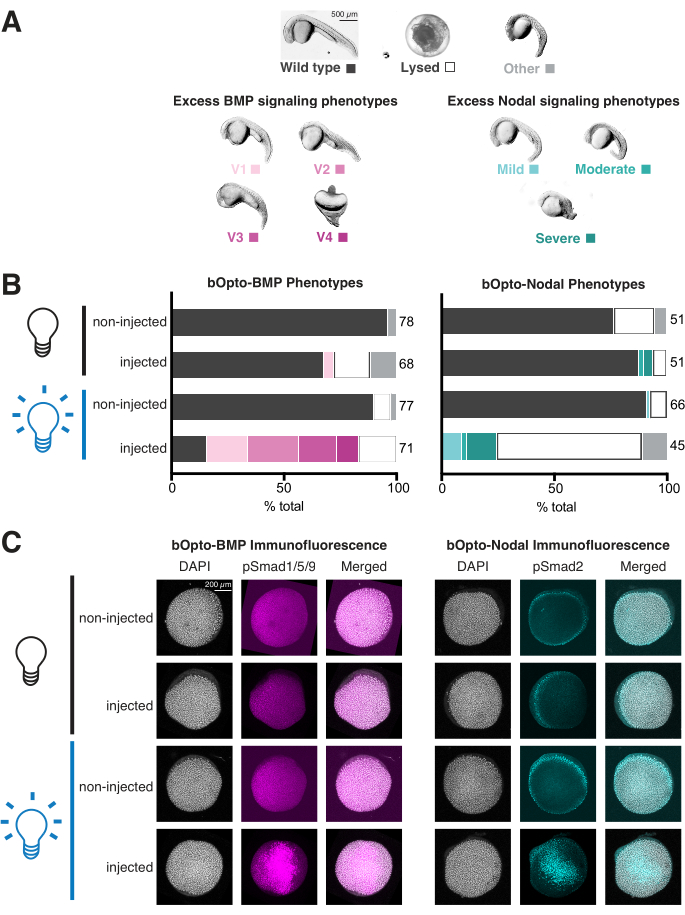
Рисунок 4: Оценка световых сигнальных реакций у эмбрионов рыбок данио. Эмбрионы данио-рерио вводили на одноклеточной стадии мРНК, кодирующей bOpto-BMP/Nodal. (А) Эмбрионы либо выращивали в темноте, либо подвергали воздействию однородного синего света, начиная с 1,5 ч после оплодотворения. Фенотипы оценивали через 1 день после оплодотворения (DPF). Показаны репрезентативные фенотипы. Избыточная передача сигналов BMP приводит к вентризации (левая панель), в то время как избыточная передача сигналов узлам вызывает дефекты развития, связанные с дополнительной мезендодермой (правая панель). Масштабная линейка = 500 мкм. (B) Количественная оценка фенотипа. Введенные эмбрионы и неинъекционные братья и сестры выращивались в темноте, начиная с 1,5 hpf (черная лампа). Половина инъекционных и половина невведенных эмбрионов подвергались воздействию однородного синего света (синяя лампа). (C) Эмбрионы с инъекциями и братья и сестры, не получившие инъекции, выращивались в темноте, начиная с 1,5 hpf (черная лампочка). При 40% эпиболии (~6 hpf) половина введенных и половина невведенных эмбрионов подвергались воздействию однородного синего света (синяя лампа). Через 20 мин все эмбрионы фиксировали и подвергали иммунофлуоресцентному окрашиванию на фосфорилированный Smad1/5/9 или Smad2/3. Более высокая интенсивность pSmad указывает на усиление BMP/Nodal сигнализации, соответственно. Масштабная линейка = 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл 1: Световой короб в сборе. Файл 3D PDF, показывающий 3D-вид всей сборки светового короба. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 2: Световой короб в разобранном виде. 3D-файл PDF, показывающий 3D-вид разнесенного светового короба в сборе. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 3: Большая легкая прокладка. Файл чертежа САПР (. DWG) для изготовления большой световой прокладки для держателя светодиода с помощью лазерного резака. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 4: Маленькая легкая прокладка. Файл чертежа САПР (. DWG) для изготовления небольшой световой прокладки для держателя светодиода с помощью лазерного резака. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 5: Акриловая основа платформы. Файл чертежа САПР (. DWG) для изготовления акрилового основания платформы светодиодного держателя с помощью лазерного резака. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 6: Акриловая платформа вертикальная. Файл чертежа САПР (. DWG) для изготовления акриловой платформы для светодиодного держателя вертикальной с помощью лазерного резака. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 7: Акриловая опора слева. Файл чертежа САПР (. DWG) для изготовления держателя светодиода с акриловой левой опорой с помощью лазерного резака. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 8: Акриловая опора справа. Файл чертежа САПР (. DWG) для изготовления акриловой правой опоры светодиодного держателя с помощью лазерного резака. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
Инъекция мРНК является текущей стратегией доставки bOpto-BMP/Nodal эмбрионам рыбок данио. У этого способа есть несколько недостатков. Во-первых, соответствующее количество мРНК варьируется в зависимости от лаборатории. Используемое количество должно быть достаточным для надежной активации сигнализации при воздействии света, но без непреднамеренной активации в темноте. Хорошей идеей является тестирование нескольких количеств, чтобы найти оптимальные уровни мРНК, и после их установления создать аликвоты мастер-смеси для воспроизводимого введения того же количества мРНК. Во-вторых, неравномерное распределение введенной мРНК может привести к неравномерной активации сигналов. Считается, что инъекция в центр клетки (а не в желток) способствует равномерному распределению мРНК. Наконец, поскольку введенная мРНК со временем деградирует, этот подход может не подходить для экспериментов на более старых эмбрионах. В будущем эти проблемы могут быть решены с помощью трансгенных линий данио-рерио, повсеместно экспрессирующих bOpto-BMP/Nodal с материнским или лекарственно-индуцируемым промотором. Несмотря на то, что работа с потенциально светочувствительными взрослыми рыбками данио-рерио может быть сложной задачей в этом контексте, трансгенные рыбки данио-рерио 61,62 и дрозофилы 22,34,35,63, содержащие оптогенетические инструменты, были успешно разработаны.
Предотвращение непреднамеренной фотоактивации является общей проблемой при использовании оптогенетических инструментов. Для простоты относитесь к инъекционным эмбрионам старше 1,5 hpf как к светочувствительным. Непреднамеренного воздействия света часто можно избежать, просто обернув тарелки или посуду алюминиевой фольгой. Однако для экспериментов, требующих визуального наблюдения за живыми эмбрионами старше 1,5 hpf, можно использовать красные источники света или покрыть белые источники света недорогой гелевой фильтровальной бумагой, блокирующей LOV-димеризирующие длины волн (Таблица материалов).
Описанный здесь световой короб предназначен для конкретных применений, требующих точного контроля над уровнями светового излучения, динамикой и длинами волн (рис. 2). К другим преимуществам этого светового короба относятся равномерное воздействие света, незначительный непреднамеренный нагрев образца, достаточное пространство для нескольких 6-луночных планшетов и долговечные, спектрально хорошо охарактеризованные источники света. Тем не менее, различные стратегии воздействия света могут быть предпочтительными в зависимости от области применения. Многие лаборатории разработали более простые и экономичные системы равномерного воздействия света с меньшей занимаемой площадью, включая облицовку инкубаторов светодиодными лентами, подвешивание светодиодных панелей над образцами или включение светодиодов в крышки чашк для культивирования 32,38,39,40,64,65,66 . Важно отметить, что световой короб, используемый в этом протоколе, не позволяет пользователям самостоятельно регулировать отдельные лунки (в отличие от Bugaj et al.52) или обеспечивать пространственный контроль над освещенностью. Пространственно локализованная оптогенетическая активация была продемонстрирована с помощью bOpto-BMP38 и bOpto-Nodal39 с использованием лазеров в SPIM или конфокальных системах соответственно, а также была реализована со многими другими оптогенетическими стратегиями в различных модельных системах (обсуждается в Rogers and Müller12). Некоторые подходы даже достигают субклеточного пространственного разрешения 29,30,31. Несмотря на то, что реализация пространственно локализованных систем воздействия света выходит за рамки данного протокола, эксперименты по пространственной активации с помощью bOpto-BMP/Nodal теоретически возможны с помощью специализированного оборудования, такого как цифровые микрозеркальные устройства или маскирующие подходы. Читателям рекомендуется изучить обширную литературу по самодельным световым коробам для оптогенетических экспериментов, прежде чем переходить к стратегии воздействия света (см., например, Gerhardt et al.51, Bugaj et al.52, Kumar and Khammash 53 и др. на https://www.optobase.org/materials/).
Молекулярно-оптогенетические стратегии часто предлагают более высокую степень пространственно-временного контроля над биологическими процессами по сравнению с историческими подходами, такими как мутанты, эктопическая экспрессия генов, рекомбинантные белки и лекарства. Читатели, заинтересованные в преимуществах оптогенетических подходов, могут ознакомиться с другими опубликованными инструментами, доступными для рыбок данио-рерио и других организмов. К ним относятся инструменты для манипулирования дополнительными сигнальными путями 32,65,67,68, регуляции экспрессии генов 61,64,66,69,70,71, изменения локализации белка 31,72 и активации апоптоза 62. Эти и многие другие инструменты удобно каталогизированы на OptoBase, курируемом веб-ресурсе, посвященном молекулярно-оптогенетическим подходам28. Для тех, кто вдохновлен созданием новых оптогенетических инструментов, ресурс также содержит полезные описания светочувствительных белков, которые использовались в широком спектре стратегий, включая светочувствительные белки, реагирующие на зеленые, красные и ближние инфракрасные длины волн. Мы рады, что научное сообщество осознает весь потенциал молекулярно-оптогенетических подходов.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Финансирование этого протокола было предоставлено KWR в рамках Очной программы NICHD (ZIA HD009002-01). Мы благодарим Джеффа Фаррелла (Jeff Farrell) и его лабораторию за их полезные отзывы, Уилла Андерсона (Will Anderson) за отличную техническую поддержку, Лиэнн Ианнуччи (Leanne Iannucci) за стресс-тестирование протокола и измерение освещенности, а также NIH Shared Zebrafish за их усердную работу по поддержанию здоровья рыбок данио.
Материалы
| Name | Company | Catalog Number | Comments |
| Building a light box & Light exposure protocol | |||
| #8 x 1" Hex Self-drilling Screw | McMaster-Carr | 99663A222 | 1.4.5 |
| Digital Optical Power and Energy Meter | ThorLabs | PM100D | 1.7 4 |
| Incubator (142 liters) | Boekel Scientific | 139400 | 1.3.1 |
| Incubator Panel Mount (1/4" thick cast black acrylic) | Custom part / Piedmont Plastics | Incubator_panel | 1.4.4 |
| Large HSS Spiral Groove Step Drill Bit | CO-Z | SDB0001TA | 1.3.2 |
| LED lens gasket, Incubator gasket; 1/32" thick black silicone | McMaster-Carr | 5812T12 | 1.4.3 1.4.4 |
| LED microplate illuminator | Prizmatix | NA | 1.1 1.4.3 |
| M3 10mm Cube Standoff | Newark Eletronics | 005.60.533 | 1.4.1 |
| M3 x 10mm 316SS Flat Head Screw | McMaster-Carr | 91801A156 | 1.4.1 |
| M6 x 10mm 316SS Flat Head Screw | McMaster-Carr | 91801A305 | 1.4.3 |
| Memory card thermometer | Fisherbrand | 15-081-111 | 1.9 3.2.1 |
| Microscope Slide Power Meter Sensor Head (150 mW) | ThorLabs | S170C | 1.7 4 |
| Red gel filter paper #E106 | Rosco / B&H Foto & Electronics | 110084014805-E106 | 4.2.1 |
| Side Brackets (1/4" thick cast black acrylic) | Custom part / Piedmont Plastics | Side_bracket | 1.4.2 |
| Vertical Bracket (1/4" thick cast black acrylic) | Custom part / Piedmont Plastics | Vertical_bracket | 1.4.1 |
| Weather stripping: Light duty EPDM foam, 1/2" wd 1/4" tk | McMaster-Carr | 8694K12 | 1.8 |
| Generating mRNA | |||
| EZNA MicroElute Cycle Pure Kit | Omega | D6293-02 | 2.4 |
| GeneJET Miniprep Kit (250 rxns) | Thermo Scientific | K0503 | 2.2 |
| Microsample incubator (Hybex) | SciGene | 1057-30-0 | 2 |
| Microsample incubator 1.5 ml tube block (Hybex) | SciGene | 1057-34-0 | 2 |
| Nanodrop One Spectrophotometer | Thermo Scientific | ND-ONE-W | 2.4 |
| NotI-HF restriction enzyme | New England Biolabs (NEB) | R3189L | 2.1 |
| pCS2-Opto-Alk3 | Addgene | 207614 | 2 |
| pCS2-Opto-Alk8 | Addgene | 207615 | 2 |
| pCS2-Opto-BMPR2a | Addgene | 207616 | 2 |
| RNeasy Mini Kit (250 rxns) | Qiagen | 74106 | 2.3 |
| Injecting mRNA | |||
| Agarose (UltraPure) | Invitrogen / Thermo Fisher | 16500500 | 3.1.1 |
| 250 ml glass beakers | Fisherbrand | FB100250 | 3.3.2 |
| 6-well dishes (case of 50) | Falcon | 08 772 1B | 3.1.6 |
| B-8A ball joint | Narishige | B-8A | 3.3 |
| Back pressure unit (microinjection rig component) | Applied Scientific Instrumentation (ASI) | BPU | 3.3 |
| Foot switch (microinjection rig component) | Applied Scientific Instrumentation (ASI) | FWS | 3.3 |
| GJ-1 magnetic stand | Narishige | GJ-1 | 3.3 |
| Glass capillaries (4 in, OD 1 mm, filament) | World Precision Instruments | 1B100F-4 | 3.1.11 |
| Glass petri dish bottoms (for dechorionating) | Pyrex | 08-748A | 3.3.2 |
| Glass pipettes (5 3/4" with wide tip) | Kimble-Chase | 63A53WT | 3.1.9 |
| Injection dish molds | Adaptive Science Tools | tu1 | 3.1.3 |
| IP iron plate | Narishige | IP | 3.3 |
| M-152 micromanipulator | Narishige | M-152 | 3.3 |
| Micro pipette holder kit (microinjection rig component) | Applied Scientific Instrumentation (ASI) | MIMPH-MPIP-Kit | 3.3 |
| Micrometers | Meiji Techno America | MA285 | 3.3 |
| MPPI-2 pressure injector (microinjection rig component) | Applied Scientific Instrumentation (ASI) | MPPI-3 | 3.3 |
| Needle puller | World Precision Instruments | PUL-1000 | 3.1.11 |
| Petri dishes (100 mm x 15 mm, case of 500) | Falcon | 08-757-100D | 3.1.2 |
| Pipettor (10 ml, green) | Bel-Art | F37898-0000 | 3.3 |
| Pronase | Roche | 11459643001 | 3.3.2 |
| Squeeze bottles (500 ml) | Nalgene / Thermo Scientific | 2402-0500 | 3.3 |
Ссылки
- Jones, W. D., Mullins, M. C. Cell signaling pathways controlling an axis organizing center in the zebrafish. Current Topics in Developmental Biology. 150, 149-209 (2022).
- Hill, C. S. Establishment and interpretation of NODAL and BMP signaling gradients in early vertebrate development. Current Topics in Developmental Biology. 149, 311-340 (2022).
- Zinski, J., Tajer, B., Mullins, M. C. TGF-β Family Signaling in Early Vertebrate Development. Cold Spring Harbor Perspectives in Biology. 10 (6), a033274 (2018).
- Shore, E. M., Kaplan, F. S. Inherited human diseases of heterotopic bone formation. Nature Reviews. Rheumatology. 6 (9), 518-527 (2010).
- Hebron, K. E., Hernandez, E. R., Yohe, M. E. The RASopathies: from pathogenetics to therapeutics. Disease Models & Mechanisms. 15 (2), dmm049107 (2022).
- Grant, M. G., Patterson, V. L., Grimes, D. T., Burdine, R. D. Modeling Syndromic Congenital Heart Defects in Zebrafish. Current Topics in Developmental Biology. 124, 1-40 (2017).
- Nusse, R., Clevers, H. Wnt/beta-Catenin Signaling, Disease, and Emerging Therapeutic Modalities. Cell. 169 (6), 985-999 (2017).
- Farahani, P. E., Reed, E. H., Underhill, E. J., Aoki, K., Toettcher, J. E. Signaling, Deconstructed: Using Optogenetics to Dissect and Direct Information Flow in Biological Systems. Annual Review of Biomedical Engineering. 23, 61-87 (2021).
- Purvis, J. E., Lahav, G. Encoding and decoding cellular information through signaling dynamics. Cell. 152 (5), 945-956 (2013).
- Wibisana, J. N., Okada, M. Encoding and decoding NF-kappaB nuclear dynamics. Current Opinion in Cell Biology. 77, 102103 (2022).
- Friedel, L., Loewer, A. The guardian's choice: how p53 enables context-specific decision-making in individual cells. TheFEBS Journal. 289 (1), 40-52 (2022).
- Rogers, K. W., Müller, P. Optogenetic approaches to investigate spatiotemporal signaling during development. Current Topics in Developmental Biology. 137, 37-77 (2020).
- Johnson, H. E., Toettcher, J. E. Illuminating developmental biology with cellular optogenetics. Current Opinion in Biotechnology. 52, 42-48 (2018).
- Bosman, S. L., Sonnen, K. F. Signaling oscillations in embryonic development. Current Topics in Developmental Biology. 149, 341-372 (2022).
- Li, P., Elowitz, M. B. Communication codes in developmental signaling pathways. Development. 146 (12), dev170977 (2019).
- Tucker, J. A., Mintzer, K. A., Mullins, M. C. The BMP signaling gradient patterns dorsoventral tissues in a temporally progressive manner along the anteroposterior axis. Developmental Cell. 14 (1), 108-119 (2008).
- van Boxtel, A. L., et al. A temporal window for signal activation dictates the dimensions of a Nodal signaling domain. Developmental Cell. 35 (2), 175-185 (2015).
- Sorre, B., Warmflash, A., Brivanlou, A. H., Siggia, E. D. Encoding of temporal signals by the TGF-β pathway and implications for embryonic patterning. Developmental Cell. 30 (3), 334-342 (2014).
- Economou, A. D., Hill, C. S. Temporal dynamics in the formation and interpretation of Nodal and BMP morphogen gradients. Current Topics in Developmental Biology. 137, 363-389 (2020).
- Rogers, K. W., Schier, A. F. Morphogen gradients: from generation to interpretation. Annual Review of Cell and Developmental Biology. 27, 377-407 (2011).
- Barkai, N., Shilo, B. Z. Robust generation and decoding of morphogen gradients. Cold Spring Harbor Perspectives in Biology. 1 (5), a001990 (2009).
- Johnson, H. E., Djabrayan, N. J. V., Shvartsman, S. Y., Toettcher, J. E. Optogenetic Rescue of a Patterning Mutant. Current Biology. 30 (17), 3414-3424 (2020).
- Imayoshi, I., et al. Oscillatory control of factors determining multipotency and fate in mouse neural progenitors. Science. 342 (6163), 1203-1208 (2013).
- Lin, B., et al. Synthetic spatially graded Rac activation drives cell polarization and movement. Proceedings of the National Academy of Sciences of the United States of America. 109 (52), E3668-E3677 (2012).
- Cui, K. W., et al. Spatially controlled stem cell differentiation via morphogen gradients: A comparison of static and dynamic microfluidic platforms. Journal of Vacuum Science & Technology. A, Vaccum, Surfaces, and Films. 38 (3), 033205 (2020).
- Faden, F., Mielke, S., Lange, D., Dissmeyer, N. Generic tools for conditionally altering protein abundance and phenotypes on demand. Biological Chemistry. 395 (7-8), 737-762 (2014).
- Shoji, W., Sato-Maeda, M. Application of heat shock promoter in transgenic zebrafish. Development, Growth & Differentiation. 50 (6), 401-406 (2008).
- Kolar, K., Knobloch, C., Stork, H., Znidaric, M., Weber, W. OptoBase: A web platform for molecular optogenetics. ACS Synthetic Biology. 7 (7), 1825-1828 (2018).
- Benedetti, L., et al. Light-activated protein interaction with high spatial subcellular confinement. Proceedings of the National Academy of Sciences of the United States of America. 115 (10), E2238-E2245 (2018).
- Krueger, D., De Renzis, S. Optogenetic Methods to Control Tissue Mechanics in Drosophila. Methods in Molecular Biology. 2540, 269-283 (2022).
- Buckley, C. E. Optogenetic Control of Subcellular Protein Location and Signaling in Vertebrate Embryos. Methods in Molecular Biology. 1920, 143-162 (2019).
- Čapek, D., et al. Light-activated Frizzled7 reveals a permissive role of non-canonical wnt signaling in mesendoderm cell migration. Elife. 8, e42093 (2019).
- Krishnamurthy, V. V., et al. Reversible optogenetic control of kinase activity during differentiation and embryonic development. Development. 143 (21), 4085-4094 (2016).
- Huang, A., Amourda, C., Zhang, S., Tolwinski, N. S., Saunders, T. E. Decoding temporal interpretation of the morphogen Bicoid in the early Drosophila embryo. Elife. 6, e26258 (2017).
- Johnson, H. E., Toettcher, J. E. Signaling dynamics control cell fate in the early Drosophila embryo. Developmental Cell. 48 (3), 361.e3-370.e3 (2019).
- Aoki, K., et al. Stochastic ERK activation induced by noise and cell-to-cell propagation regulates cell density-dependent proliferation. Molecular Cell. 52 (4), 529-540 (2013).
- Chow, R. W., Vermot, J. The rise of photoresponsive protein technologies applications in vivo: a spotlight on zebrafish developmental and cell biology. F1000Research. , (2017).
- Rogers, K. W., ElGamacy, M., Jordan, B. M., Müller, P. Optogenetic investigation of BMP target gene expression diversity. Elife. 9, e58641 (2020).
- Sako, K., et al. Optogenetic control of Nodal signaling reveals a temporal pattern of Nodal signaling regulating cell fate specification during gastrulation. Cell Reports. 16 (3), 866-877 (2016).
- Grusch, M., et al. Spatio-temporally precise activation of engineered receptor tyrosine kinases by light. The EMBO Journal. 33 (15), 1713-1726 (2014).
- Crossman, S. H., Janovjak, H. Light-activated receptor tyrosine kinases: Designs and applications. Current Opinion in Pharmacology. 63, 102197 (2022).
- Kainrath, S., Janovjak, H. Design and Application of Light-Regulated Receptor Tyrosine Kinases. Methods in Molecular Biology. 2173, 233-246 (2020).
- Takahashi, F., et al. AUREOCHROME, a photoreceptor required for photomorphogenesis in stramenopiles. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19625-19630 (2007).
- Toyooka, T., Hisatomi, O., Takahashi, F., Kataoka, H., Terazima, M. Photoreactions of aureochrome-1. Biophysical Journal. 100 (11), 2801-2809 (2011).
- Vopalensky, P., Pralow, S., Vastenhouw, N. L. Reduced expression of the Nodal co-receptor Oep causes loss of mesendodermal competence in zebrafish. Development. 145 (5), dev.158832 (2018).
- Kishimoto, Y., Lee, K. H., Zon, L., Hammerschmidt, M., Schulte-Merker, S. The molecular nature of zebrafish swirl: BMP2 function is essential during early dorsoventral patterning. Development. 124 (22), 4457-4466 (1997).
- Rogers, K. W., et al. Nodal patterning without Lefty inhibitory feedback is functional but fragile. Elife. 6, e28785 (2017).
- Dubrulle, J., et al. Response to Nodal morphogen gradient is determined by the kinetics of target gene induction. Elife. 4, e05042 (2015).
- Harvey, S. A., Smith, J. C. Visualisation and quantification of morphogen gradient formation in the zebrafish. PLoS Biology. 7 (5), e1000101 (2009).
- Zinski, J., Tuazon, F., Huang, Y., Mullins, M., Umulis, D. Imaging and Quantification of P-Smad1/5 in Zebrafish Blastula and Gastrula Embryos. Methods in Molecular Biology. 1891, 135-154 (2019).
- Gerhardt, K. P., Castillo-Hair, S. M., Tabor, J. J. DIY optogenetics: Building, programming, and using the Light Plate Apparatus. Methods in Enzymology. 624, 197-226 (2019).
- Bugaj, L. J., Lim, W. A. High-throughput multicolor optogenetics in microwell plates. Nature Protocols. 14 (7), 2205-2228 (2019).
- Kumar, S., Khammash, M. Platforms for Optogenetic Stimulation and Feedback Control. Frontiers in Bioengineering and Biotechnology. 10, 918917 (2022).
- Urushibata, H., et al. Control of Developmental Speed in Zebrafish Embryos Using Different Incubation Temperatures. Zebrafish. 18 (5), 316-325 (2021).
- Rogers, K. W., Bläßle, A., Schier, A. F., Müller, P. Measuring protein stability in living zebrafish embryos using fluorescence decay after photoconversion (FDAP). Journal of Visualized Experiments. (95), e52266 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Feldman, B., et al. Zebrafish organizer development and germ-layer formation require nodal-related signals. Nature. 395 (6698), 181-185 (1998).
- Shimizu, T., et al. Cooperative roles of Bozozok/Dharma and Nodal-related proteins in the formation of the dorsal organizer in zebrafish. Mechanisms of Development. 91 (1-2), 293-303 (2000).
- Rebagliati, M. R., Toyama, R., Fricke, C., Haffter, P., Dawid, I. B. Zebrafish nodal-related genes are implicated in axial patterning and establishing left-right asymmetry. Developmental Biology. 199 (2), 261-272 (1998).
- Gritsman, K., Talbot, W. S., Schier, A. F. Nodal signaling patterns the organizer. Development. 127 (5), 921-932 (2000).
- LaBelle, J., et al. TAEL 2.0: An Improved Optogenetic Expression System for Zebrafish. Zebrafish. 18 (1), 20-28 (2021).
- Mruk, K., Ciepla, P., Piza, P. A., Alnaqib, M. A., Chen, J. K. Targeted cell ablation in zebrafish using optogenetic transcriptional control. Development. 147 (12), dev183640 (2020).
- Johnson, H. E., et al. The spatiotemporal limits of developmental Erk signaling. Developmental Cell. 40 (2), 185-192 (2017).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Patel, A. L., et al. Optimizing photoswitchable MEK. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25756-25763 (2019).
- LaBelle, J., Woo, S. Light-Induced GFP Expression in Zebrafish Embryos using the Optogenetic TAEL/C120 System. Journal of Visualized Experiments. (174), e62818 (2021).
- Kainrath, S., Stadler, M., Reichhart, E., Distel, M., Janovjak, H. Green-light-induced inactivation of receptor signaling using cobalamin-binding domains. Angewandte Chemie. 56 (16), 4608-4611 (2017).
- Benman, W., et al. Temperature-responsive optogenetic probes of cell signaling. Nat Chem Biol. 18 (2), 152-160 (2022).
- Reade, A., et al. TAEL: a zebrafish-optimized optogenetic gene expression system with fine spatial and temporal control. Development. 144 (2), 345-355 (2017).
- Putri, R. R., Chen, L. Spatiotemporal control of zebrafish (Danio rerio) gene expression using a light-activated CRISPR activation system. Gene. 677, 273-279 (2018).
- Liu, H., Gomez, G., Lin, S., Lin, S., Lin, C. Optogenetic control of transcription in zebrafish. PLoS One. 7 (11), e50738 (2012).
- Buckley, C. E., et al. Reversible optogenetic control of subcellular protein localization in a live vertebrate embryo. Developmental Cell. 36 (1), 117-126 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены