Method Article
Optogenetische Signalaktivierung in Zebrafischembryonen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die optogenetische Manipulation von Signalwegen kann eine leistungsfähige Strategie sein, um zu untersuchen, wie Signale in der Entwicklung, Regeneration, Homöostase und Krankheit entschlüsselt werden. Dieses Protokoll enthält praktische Richtlinien für die Verwendung von Licht-Sauerstoff-Spannungs-Sensordomänen-basierten Knoten- und knochenmorphogenen Protein-Signalaktivatoren (BMP) im frühen Zebrafischembryo.
Zusammenfassung
Signalwege orchestrieren grundlegende biologische Prozesse, einschließlich Entwicklung, Regeneration, Homöostase und Krankheit. Methoden zur experimentellen Manipulation der Signalübertragung sind erforderlich, um zu verstehen, wie die Signalübertragung in diesen vielfältigen Kontexten interpretiert wird. Molekulare optogenetische Werkzeuge können reversible, abstimmbare Manipulationen der Signalwegaktivität mit einem hohen Maß an raumzeitlicher Kontrolle ermöglichen und wurden in vitro, ex vivo und in vivo angewendet. Diese Werkzeuge koppeln lichtempfindliche Proteindomänen, wie z. B. die LOV-Domäne (Blue Light Homodimerizing Light-Oxygen-Voltage Sensing), mit Signaleffektoren, um eine lichtabhängige experimentelle Kontrolle über die Signalübertragung zu erhalten. Dieses Protokoll enthält praktische Richtlinien für die Verwendung des LOV-basierten knochenmorphogenetischen Proteins (BMP) und der Nodal-Signalaktivatoren bOpto-BMP und bOpto-Nodal im optisch zugänglichen frühen Zebrafischembryo. Es werden zwei Kontrollexperimente beschrieben: Ein schneller Phänotyp-Assay zur Bestimmung geeigneter Versuchsbedingungen und ein Immunfluoreszenz-Assay zur direkten Beurteilung der Signalübertragung. Zusammen können diese Kontrollexperimente dazu beitragen, eine Pipeline für den Einsatz optogenetischer Werkzeuge in frühen Zebrafischembryonen zu etablieren. Diese Strategien bieten eine leistungsstarke Plattform, um die Rolle der Signalübertragung in Entwicklung, Gesundheit und Physiologie zu untersuchen.
Einleitung
Signalwege ermöglichen es Zellen, auf ihre Umgebung zu reagieren und Aktivitäten auf gewebe- und organismusweiter Ebene zu koordinieren. Zu den Signalen, die für die Embryonalentwicklung entscheidend sind, gehören die Mitglieder der TGF-beta-Superfamilie, das knochenmorphogenetische Protein (BMP) und Nodal 1,2,3. Während der Embryogenese steuern die Signalwege, die durch diese und andere Signale reguliert werden, den Körperplan, indem sie die Genexpression und zusätzliche Prozesse steuern, um sicherzustellen, dass sich verschiedene Gewebe und Organe richtig entwickeln und miteinander interagieren. Pathologien, einschließlich Geburtsfehler und Krebs, können auftreten, wenn die Signalübertragung oder die Reaktion auf Signale gestört ist 4,5,6,7. Trotz gründlicher Untersuchungen der Signalübertragung muss noch viel mehr darüber entdeckt werden, wie Ebenen und Dynamiken in einer Vielzahl von Kontexten entschlüsselt werden 8,9,10,11, insbesondere während der Entwicklung 12,13,14,15,16,17,18,19.
Um zu verstehen, wie Signale dekodiert werden, wäre ein ideales Experiment, Signalebenen, Timing und/oder Dynamik zu manipulieren - mit einem hohen Maß an räumlicher und zeitlicher Kontrolle - und die Ergebnisse zu bewerten. Zum Beispiel werden präzise räumliche Signalgradienten vorgeschlagen, um sich entwickelnde Gewebe zu strukturieren20, 21. Eine Änderung der räumlichen Verteilung des Signalgradienten würde helfen, diese Hypothesezu testen 22. Darüber hinaus wird die Bedeutung der Signaldynamik für die Erzeugung verschiedener zellulärer Reaktionen immer deutlicher: Derselbe Signalweg kann Zellen anweisen, sich in Abhängigkeit von der Signalfrequenz zu differenzieren oder zu vermehren, zum Beispiel 9,23. Experimentelle Paradigmen, in denen die Signaldynamik leicht manipuliert werden kann, werden wertvoll sein, um die Beziehung zwischen Dynamik und Entscheidungen über das Zellschicksal zu erforschen 8,12,13,14,15.
In der Vergangenheit wurden mehrere Methoden verwendet, um die Signalübertragung in Entwicklungskontexten zu manipulieren, was zu grundlegenden Entdeckungen führte 1,2,3. Die Signalübertragung kann durch Loss-of-Function-Mutanten, ektopische Inhibitorexpression oder Antagonisten blockiert werden. Zu den Methoden zur Aktivierung der Signalübertragung gehören Agonisten, rekombinante Liganden, ektopische Expression von Liganden oder konstitutiv aktiven Rezeptoren und Loss-of-Function-Mutanten von Signalweginhibitoren. Diese Methoden erstrecken sich entlang eines Kontinuums experimenteller Kontrolle. Zum Beispiel können Mutanten und ektopische Expression auf die Vorschlaghammer-Seite des Kontinuums fallen: Mit diesen Ansätzen können dramatische, systemische Veränderungen der Signalwegaktivität zu einem frühen Tod führen und Untersuchungen in späteren Stadien ausschließen oder im Laufe der Zeit zu pleiotropen Effekten führen, die schwer zu entwirren sind. Darüber hinaus ist es oft schwierig, ein Signalisierungsmerkmal nach dem anderen unabhängig zu manipulieren, z. B. Pegel oder Dauer. Am anderen Ende des Kontinuums bieten einige Methoden eine präzisere experimentelle Kontrolle, wie z. B. mikrofluidische Geräte, die Proben Medikamenten oder rekombinanten Proteinen mit zeitlicher und manchmal räumlicher Kontrolle aussetzen 18,24,25, oder genetische Methoden, einschließlich hitzeschockinduzierbarer und gewebespezifischer Promotoren, die ähnliche Vorteile bieten können16,26,27. Diese Methoden können jedoch schwierig auszuführen sein, sind möglicherweise nicht reversibel, haben eine relativ langsame Kinetik oder eine schlechte Auflösung und sind in einigen Modellsystemen möglicherweise nicht verfügbar.
Molekulare optogenetische Ansätze sind eine leistungsstarke Ergänzung dieses Instrumentariums. Diese Ansätze verwenden Proteine, die auf verschiedene Lichtwellenlängen reagieren, um biologische Prozesse zu manipulieren, einschließlich der Signalübertragung 8,12,13,14,15, und wurden über Jahrzehnte für den Einsatz in einer Vielzahl von Systemen von der Zellkultur bis hin zu ganzen Tieren entwickelt 12,13,28. Im Vergleich zu historischen Ansätzen kann die molekulare Optogenetik oft ein höheres Maß an raumzeitlicher Kontrolle über biologische Prozesse bieten: Der Controller in optogenetischen Systemen ist das Licht, und die Kontrolle von Lichtwellenlänge, -intensität, -dauer und -expositionsfrequenz ist relativ einfach. Mit ausgeklügelten Systemen wie Konfokal- und Zwei-Photonen-Mikroskopen ist eine räumliche Kontrolle im subzellulären Bereich möglich 29,30,31. Werkzeuge zur optogenetischen Manipulation der Signalübertragung wurden entwickelt und in mehreren Systemen angewendet, darunter die in Johnson et al.22, Čapek et al.32, Krishnamurthy et al.33 und Huang et al.34 beschriebenen Systeme. Unter Ausnutzung der räumlichen Kontrolle, die die Optogenetik bietet, wurde diese Strategie kürzlich verwendet, um einen Signalgradienten in Drosophila-Embryonen zu modifizieren, was zeigt, dass die Embryogenese von Fliegen überraschend robust gegenüber Änderungen dieses Gradienten ist22. Die Reversibilität und die schnelle Ein-/Aus-Kinetik von optogenetischen Signalaktivatoren haben sie auch zu attraktiven Werkzeugen für die Untersuchung der Dekodierung der Signaldynamik 8,12,13,14,15,34,35,36 gemacht.
Der frühe Zebrafischembryo ist ein In-vivo-System , das sich gut für optogenetische Studien eignet, da es extern befruchtet, transparent, mikroskopiefreundlich und genetisch behandelbar ist. Embryonen, die sich außerhalb der Mutter entwickeln, lassen sich leichter mit Licht versorgen, Licht kann in ihr nicht undurchsichtiges Gewebe eindringen und es erreichen, lebende Zebrafischembryonen vertragen die Bildgebung gut (und sind außerdem transparent), und bestehende genetische Methoden bieten neben der Entwicklung nützlicher transgener Methoden unkomplizierte Möglichkeiten für Knockdown- und Überexpressionsexperimente37.
Kürzlich wurden optogenetische Werkzeuge entwickelt, um den BMP38- und Nodal39-Signalweg in Zebrafischembryonen mit Blaulichtexposition zu aktivieren (Abbildung 1). Wir bezeichnen diese Werkzeuge als bOpto-BMP und bOpto-Nodal (b für blaues Licht aktiviert und Opto für optogenetisch). bOpto-BMP/Nodal basieren auf ähnlichen Signalweg-Aktivierungsmechanismen. Die Bindung von BMP- oder Nodal-Liganden an ihre jeweiligen Serin-Threonin-Kinasen treibt Rezeptorkinase-Domänen-Interaktionen an, die zur Phosphorylierung von Signaleffektoren führen (Smad1/5/9 für BMP und Smad2/3 für Nodal). Phosphorylierte Signaleffektoren translozieren dann in den Zellkern und regulieren die Expression des Zielgens3 (Abbildung 1A,D). Diese Rezeptorkinase-Wechselwirkungen können lichtempfindlich gemacht werden, indem Rezeptorkinasen an lichtempfindliche dimerisierende Proteine gekoppelt werden: Bei Lichtexposition sollten diese chimären Proteine dimerisieren, wodurch die Rezeptorkinase-Domänen interagieren und die Signalübertragung aktivieren (Abbildung 1B,C,E,F). Wichtig ist, dass bOpto-BMP/Nodal im Gegensatz zu endogenen Rezeptoren keine extrazellulären Ligandenbindungsdomänen enthalten, was eine ligandenunabhängige Aktivität gewährleistet (Abbildung 1C,F). Diese optogenetische Aktivierungsstrategie wurde zunächst mit Rezeptor-Tyrosinkinasen40,41,42 erreicht und dann auf Rezeptor-Serin-Threonin-Kinasen angewendet.
bOpto-BMP/Nodal verwenden die auf blaues Licht reagierende (~450 nm) homodimerisierende LOV-Domäne (Light-Oxygen-Voltage Sensing) aus dem AUREO1-Protein der Alge Vaucheria fridiga AUREO1 (VfLOV)43,44. Diese Konstrukte bestehen aus einem auf die Membran abzielenden Myristoylierungsmotiv, gefolgt von BMP- oder Nodalrezeptorkinase-Domänen, die mit einer LOV-Domäne fusioniert sind (Abbildung 1B,E). Die Exposition gegenüber blauem Licht sollte eine LOV-Homodimerisierung verursachen, was zu Interaktionen mit Rezeptorkinase-Domänen führt, die zu einer entsprechenden Smad-Phosphorylierung und Signalwegaktivierung führen (Abbildung 1C,F). Für bOpto-BMP wurde eine Kombination von Konstrukten mit den Typ-I-Rezeptorkinase-Domänen von Acvr1l (auch bekannt als Alk8) und BMPR1aa (auch bekannt als Alk3) und der Typ-II-Rezeptorkinase-Domäne von BMPR2a gefunden, um die Signalübertragung optimal zu aktivieren38 (Addgene #207614, #207615 und #207616). Für bOpto-Nodal wird eine Kombination von Konstrukten mit der Typ-I-Rezeptorkinase-Domäne von Acvr1ba und der Typ-II-Rezeptorkinase-Domäne von Acvr2ba verwendet39.
bOpto-BMP/Nodal wurden durch Injektion von mRNA im Einzelzellstadium in frühe Zebrafischembryonen eingeführt und verwendet, um die Rolle der Signaldauer bei der Nodal-Interpretation39 zu untersuchen, um festzustellen, warum Zebrafische die Fähigkeit verlieren, auf Nodal45 zu reagieren, und um zu untersuchen, wie BMP-Zielgene auf verschiedene BMP-Signalebenen reagieren38. Es ist wahrscheinlich, dass diese Instrumente auch in Zukunft bei einer Vielzahl von Untersuchungen nützlich sein werden. Die Stärke der optogenetischen Signalaktivatoren ist jedoch auch ihre Schwäche: Lichtempfindliche Proben müssen mit Vorsicht behandelt werden, um eine unbeabsichtigte ektopische Signalaktivität zu vermeiden. Die Einwirkung von Raumlicht oder Sonnenlicht kann bOpto-BMP/Nodal aktivieren.
Dieses Protokoll enthält praktische Vorschläge für die Verwendung von mRNA-kodierten LOV-basierten BMP- und Nodal-Aktivatoren in frühen Zebrafischembryonen. Es beginnt mit der Beschreibung einer Strategie zum Aufbau eines Leuchtkastens zur Steuerung einer gleichmäßigen Lichtexposition und Temperatur (Abbildung 2, Ergänzungsdatei 1, Ergänzungsdatei 2, Ergänzungsdatei 3, Ergänzungsdatei 4, Ergänzungsdatei 5, Ergänzungsdatei 6, Ergänzungsdatei 7, Ergänzungsdatei 8). Anschließend werden zwei wichtige Kontrollexperimente beschrieben, die bestimmen, ob sich ein optogenetischer Signalaktivator wie erwartet verhält, d. h. die Signalwegaktivität nur aktiviert, wenn er Licht ausgesetzt wird (Abbildung 3). Der erste Kontrolltest beinhaltet die Untersuchung der Phänotypen einen Tag nach der Befruchtung in lichtexponierten und nicht exponierten Embryonen (Abbildung 3A). mRNA-injizierte, lichtexponierte Embryonen, aber keine nicht-exponierten Embryonen, sollten BMP oder Knoten-Überexpression phänophonieren (Abbildung 4A,B; Insbesondere BMP-Phänotypen sind zu diesem Zeitpunkt deutlich unterscheidbar(Punkt 46). Dieser Assay bietet eine schnelle Aktivitätsauslesung. Um festzustellen, ob die Phänotypen spezifisch durch einen Überschuss an BMP oder Nodal-Signalgebung verursacht werden, und um die Veränderung der Signalwerte direkt zu beobachten, wird die Immunfluoreszenzfärbung verwendet, um phosphorylierte Signaleffektoren (pSmad1/5/9 bzw. pSmad2/3) nach einer 20-minütigen Lichtexposition um das späte Blastula-/frühe Gastrulationsstadium herum nachzuweisen, wenn die Signalaktivität gut beschrieben wurde12. 16,17,47,48,49,50 (Abbildung 3B und Abbildung 4C). (Es ist zu beachten, dass, obwohl sowohl für bOpto-BMP38 als auch für bOpto-Nodal39 eine räumlich lokalisierte Aktivierung nachgewiesen wurde, dieses Protokoll nur eine gleichmäßige Lichtexposition und Signalaktivierungsstrategien beschreibt.) Es ist ratsam, diese Kontrollexperimente vor der Anwendung von bOpto-BMP/Nodal auf bestimmte Forschungsfragen durchzuführen, um ideale lokale Versuchsbedingungen zu bestimmen.
Protokoll
Die Forschungsprotokolle für Zebrafische wurden vom NICHD Animal Care and Use Committee der National Institutes of Health (ASP 21-008) geprüft und genehmigt. Alle Zebrafischstudien wurden in Übereinstimmung mit dem Leitfaden für die Pflege und Verwendung von Versuchstieren durchgeführt.
1. Einen Leuchtkasten bauen
- Um die Lichtexposition und die Temperatur zu steuern, konstruieren Sie einen Leuchtkasten, der eine Leuchtdiode (LED)-Mikroplattenbeleuchtung als Lichtquelle verwendet (Abbildung 2A, Materialtabelle, Zusatzdatei 1, Zusatzdatei 2). Diese anpassbare Beleuchtung bietet eine dynamische, programmierbare Steuerung über mehrere Wellenlängen.
ANMERKUNG: Es gibt viele mögliche Strategien, um einen Leuchtkasten zu bauen, und ein alternativer Ansatz kann angemessener sein (siehe z. B. Gerhardt et al.51, Bugaj et al.52, Kumar und Khammash 53 und mehr unter https://www.optobase.org/materials/). - Integrieren Sie die folgenden Funktionen in den Leuchtkasten: Temperaturregelung (28 °C ist ideal für Zebrafischembryonen), Ausschluss von unerwünschtem Licht (z. B. Raumlicht und Sonnenlicht), gleichmäßige Abgabe von blauem Licht, das den Zielbereich abdeckt (z. B. 6-Well-Platte) und Kontrolle über Lichtintensität und Belichtungsdynamik.
HINWEIS: bOpto-BMP/Nodal werden durch blaues Licht aktiviert, aber einige optogenetische Werkzeuge reagieren auf andere Wellenlängen. Verwenden Sie die geeignete Wellenlänge für das optogenetische Werkzeug. - Bohren Sie ein Loch durch die Oberseite eines Inkubators (Abbildung 2B), das etwas breiter ist als die LED-Ausgangslinse.
- Stellen Sie sicher, dass sich oben im Inkubator keine elektrischen Komponenten befinden, die durch Bohren zerstört werden (Materialtabelle). Dies kann festgestellt werden, indem man sich direkt an den Hersteller des Inkubators wendet und nachfragt.
- Wenn auf der Oberseite des Inkubators ein Loch vorhanden ist, verwenden Sie einen Stufenbohrer, um die Lochgröße auf 1,25 Zoll zu erhöhen. Ansonsten verwenden Sie eine 1,25 Zoll Lochsäge mit Dorn.
- Wenn es interne Paneele gibt, die die Lichtquelle blockieren, bohren Sie die entsprechende Lochgröße, um sicherzustellen, dass der Lichtkegel nicht blockiert wird (Abbildung 2A). Paneele bestehen in der Regel aus dünnem Blech, verwenden Sie daher langsame Geschwindigkeiten und Metallbohrer, um Beschädigungen zu vermeiden (Kobaltbohrer empfohlen).
- Konstruieren Sie eine LED-Halterung, um die LED-Mikroplattenbeleuchtung an der Oberseite des Inkubators zu befestigen (Abbildung 2C, Ergänzungsdatei 3, Ergänzungsdatei 4, Ergänzungsdatei 5, Ergänzungsdatei 6, Ergänzungsdatei 7, Ergänzungsdatei 8).
- Montieren Sie vier M3-Würfelabstandshalter mit M3-Schrauben am vertikalen Halterungsstück.
- Befestigen Sie die beiden seitlichen Halterungen links und rechts von den Würfelabstandshaltern der vertikalen Halterung. Montieren Sie einen weiteren Würfel-Abstandshalter an dem übrig gebliebenen Loch an den seitlichen Halterungen.
- Montieren Sie das vertikale Halterungsstück mit M6-Schrauben an der LED-Mikroplattenbeleuchtung (Materialtabelle). Platzieren Sie die LED-Linsendichtung über der LED-Systemlinse.
- Montieren Sie die zusammengebauten Teile an der Halterung des Inkubators und dann an den M3-Abstandshaltern an den vertikalen und seitlichen Halterungen. Platzieren Sie die Dichtung des Inkubators über dem gebohrten Loch auf der Oberseite des Inkubators.
- Platzieren Sie die Halterung des Inkubator-Panels auf der Dichtung des Inkubators und stellen Sie sicher, dass die Dichtung und die Panel-Öffnungen konzentrisch mit dem Loch des Inkubators sind. Befestigen Sie die Platte mit den Schrauben Nr. 8 am oberen Rand des Inkubators. Stellen Sie sicher, dass diese Dichtung lichtdicht ist.
- Stellen Sie eine 6-Well-Platte auf die oberste Ablage des Inkubators. Stellen Sie fest, ob der Lichtstrahl die Platte gleichmäßig abdeckt (Abbildung 2A). Verwenden Sie ein Blatt Papier, um die Lichtabdeckung zu visualisieren.
- Wenn nicht die gesamte Platte vom Strahl abgedeckt wird, vergrößern Sie den Abstand zwischen LED und Platte, indem Sie das Regal nach unten bewegen. Für das hier beschriebene System sind ~14 Zoll zwischen LED und Regal ausreichend.
- Verwenden Sie einen Belichtungsmesser, um die Bestrahlungsstärke und die räumliche Gleichmäßigkeit zu bestimmen (Materialtabelle).
- Um unbeabsichtigte Sonneneinstrahlung und Raumlicht zu vermeiden, verwenden Sie Dichtungen, um sicherzustellen, dass die Inkubatortür lichtdicht ist (Abbildung 2A).
- Zebrafischembryonen entwickeln sich robust bei 28 °C54. Verwenden Sie ein Speicherkartenthermometer, um sicherzustellen, dass der Leuchtkasten 28 °C hält.
2. Generierung von mRNA für die Injektion
ANMERKUNG: pCS2+ ist das Vektor-Rückgrat für die bOpto-BMP-Konstrukte38 und die bOpto-Knoten-Konstrukte39. Dieser Vektor ist Ampicillin-resistent. bOpto-BMP besteht aus drei Konstrukten (Abbildung 1B): BMPR1aa-LOV (Addgene # 207614): Mutmaßliche Kinasedomäne des Typ-I-BMPR1aa-Rezeptors (auch bekannt als Alk3), fusioniert mit LOV; Acvr1l-LOV (Addgene # 207615): Mutmaßliche Kinasedomäne des Typ-I-Acvr1l-Rezeptors (auch bekannt als Alk8), fusioniert mit LOV; und BMPR2a-LOV (Addgene # 207616): Mutmaßliche Kinasedomäne des Typ-II-BMPR2a-Rezeptors und der folgenden C-terminalen Domäne, die mit LOV fusioniert ist. bOpto-Nodal besteht aus zwei Konstrukten (Abbildung 1E): Acvr1ba-LOV: Mutmaßliche Kinasedomäne des Typ-I-Acvr1ba-Rezeptors (auch bekannt als Acvr1b), fusioniert mit LOV; Acvr2ba-LOV: Mutmaßliche Kinasedomäne des Typ-II-Acvr2ba-Rezeptors (auch bekannt als Acvr2b), der mit LOV fusioniert ist.
- Um Plasmide zu linearisieren, verdauen Sie zwischen 2-5 μg Plasmid-DNA unter Verwendung des NotI-Restriktionsenzyms bei 37 °C für 1-3 h (Materialtabelle).
HINWEIS: Es ist auch möglich, linearisierte DNA mit dem Plasmid als PCR-Template zu erzeugen. - Reinigen Sie DNA mit einem standardmäßigen säulenbasierten Aufreinigungskit (Materialtabelle).
- Verwenden Sie ein In-vitro-SP6-Transkriptionskit , wie z. B. ein mMessage mMachine-Kit, um RNA aus dem linearisierten Template (Materialtabelle) zu transkribieren. Richten Sie zwei Reaktionen gemäß den Empfehlungen des Herstellers ein, um eine höhere Ausbeute zu gewährleisten.
- Reinigen Sie RNA mit einem säulenbasierten Standard-RNA-Reinigungskit (Materialtabelle). Es ist auch möglich, über Fällung zu reinigen.
3. Injektion von mRNA
- Mindestens 1 Tag vor der Injektion Injektionsschalen und Agarose-beschichtete 6-Well-Platten herstellen.
- 200 ml 1%ige Agarose in Zebrafisch-Embryomedium und Mikrowelle zubereiten, bis sich die Agarose vollständig aufgelöst hat. Jedes Standard-Zebrafisch-Embryo-Medium sollte akzeptabel sein; Schließen Sie jedoch Methylenblau aus dem Embryonalmedium aus, da es die nachgeschaltete Bildgebung in anderen Anwendungen beeinträchtigen kann.
- Die geschmolzene Agarose vorsichtig in 100 mm x 15 mm große Kunststoff-Petrischalen gießen. Das Geschirr zur Hälfte füllen.
- Spülen Sie eine Spritzgussform mit Embryo-Medium aus und legen Sie sie vorsichtig auf geschmolzene Agarose, wobei Sie sicherstellen müssen, dass keine Blasen zwischen der Form und der Agarose eingeschlossen werden. Verwenden Sie Klebeband, um eine Lasche auf der Rückseite der Form zu machen, um das Platzieren und Entnehmen zu erleichtern.
- Die Form sollte in der geschmolzenen Agarose schwimmen. Wenn die Form absinkt, vorsichtig aus der geschmolzenen Agarose nehmen und Schritt 3.1.3 wiederholen.
- Nachdem die Agarose fest geworden ist, verwenden Sie die Lasche, um die Form vorsichtig zu entfernen. Dies kann beschleunigt werden, indem die Schale auf 4 °C gestellt wird.
- Stellen Sie mit Agarose beschichtete 6-Well-Platten her, wenn Sie mit dechorionierten Embryonen für Immunfluoreszenzexperimente arbeiten.
- Verwenden Sie eine 10-ml-Einwegpipette aus Kunststoff, um genügend geschmolzene Agarose zu übertragen, um den Boden jeder Vertiefung einer 6-Well-Platte zu bedecken.
- Injektionsschalen und 6-Well-Platten bei 4 °C lagern. Sie können sofort verwendet oder gelagert werden, bis die Agarose ausgetrocknet oder verunreinigt ist (in der Regel 2-3 Wochen).
- Bereiten Sie Pipettenspitzen aus geflammtem Glas vor, wenn Sie mit dechorionierten Embryonen für Immunfluoreszenzexperimente arbeiten.
- Stecken Sie das Ende einer Glaspipette in eine Bunsenbrennerflamme und drehen Sie es kontinuierlich, bis die Ränder glatt sind. Dechorionierte Embryonen müssen bequem durch das Ende der Pipette passen. Lassen Sie die Öffnung nicht unter den Durchmesser eines Embryos schrumpfen.
- Mikroinjektionsnadeln entweder kaufen oder ziehen (Materialtabelle). Es ist ratsam, am Tag der Injektionen zusätzliche Nadeln zur Verfügung zu haben, falls ein Ersatz erforderlich ist.
- Richten Sie am Tag vor der Injektion Zebrafischzüchter gemäß den Standardarbeitsanweisungen (SOPs) des Instituts ein. Halten Sie Männchen und Weibchen getrennt.
- Schalten Sie den Temperaturregler des Leuchtkastens ein, um 28 °C zu halten. Um sicherzustellen, dass die Temperatur des Leuchtkastens bei 28 °C bleibt, überwachen Sie die Temperatur mit einem Speicherkartenthermometer (Materialtabelle).
- mRNA-Injektionsmischung(en) vorbereiten. Injizieren Sie äquimolare Mengen jedes Konstrukts. Es ist notwendig, empirisch zu bestimmen, welche Menge injiziert werden soll.
- Die bOpto-BMP-Transkriptgrößen sind wie folgt:
Acvr1l-LOV = 2007 Nukleotide (nt)
BMPR1aa-LOV = 1983 nt
BMPR2a-LOV = 3409 nt - Um äquimolare Mengen zu injizieren, injizieren Sie 1,01x mehr des Acvr1l-Konstrukts als BMPR1aa; injizieren 1,72x mehr des BMPR2a-Konstrukts als BMPR1aa.
- Die Größe des bOpto-Nodal-Transkripts ist wie folgt:
Acvr1ba-LOV und Acvr2ba-LOV sind beide 1962 nt. - Um äquimolare Mengen zu injizieren, injizieren Sie die gleiche Menge von jedem Konstrukt.
- Bereiten Sie äquimolare Injektionsmischungen vor, indem Sie alle mRNAs, die auf einen Signalweg abzielen, in einer Injektionsmischung kombinieren. Fügen Sie bei Bedarf Phenolrot-Injektionstracer hinzu. Für die in Abbildung 4 gezeigten Daten wurden 15 pg jedes bOpto-Nodal-Konstrukts (Acvr1ba-LOV und Acvr2ba-LOV) verwendet, für bOpto-BMP 7,8 pg Acvr1l-LOV und BMPR1aa-LOV und 13,4 pg BMPR2a-LOV.
- Injektionsmischungen bei -20 °C lagern. Sobald die optimale Konzentration der Injektionsmischung bestimmt wurde, 5-10 μl Aliquots herstellen und bei -20 °C oder -80 °C lagern.
- Tag der Injektion
- Wenn Sie einen Phänotypisierungsassay (Abbildung 3A) durchführen, injizieren Sie durch das Chorion direkt in die Mitte der Zelle im Einzelzellstadium gemäß der SOP Ihres Labors. Das Chorion schützt die Embryonen vor Umweltstressoren und hält die lysierten Embryonen in Schach. Dies ist hilfreich beim Scoring für eine genaue Quantifizierung der lysierten Embryonen (Abbildung 4A,B).
- Bei der Durchführung eines Immunfluoreszenz-Assays (Abbildung 3B) müssen die Embryonen schließlich für die Bildgebung dechoriert werden (Abbildung 4C). Injizieren Sie daher direkt in die Mitte der Zelle von dechorionierten Embryonen im Einzelzellstadium (siehe Rogers et al.55 für das Dechorisierungsprotokoll). Alternativ können Embryonen nach der Fixierung manuell dechoriert werden, was jedoch umständlicher ist als das Dekorieren mit Pronase.
- Verwenden Sie Pipetten aus geflammtem Glas, um dechorionierte Embryonen zu handhaben (Schritt 3.1.10). Achten Sie darauf, dechorierte Embryonen nicht der Luft oder Plastik auszusetzen, da dies zur Lyse der Embryonen führt. Behandeln Sie dechorionierte Embryonen vorsichtig.
- Bereiten Sie eine zusätzliche Schale mit nicht injizierten Embryonen als Proxy vor, um das Fortschreiten des Stadiums zu beurteilen (siehe Schritt 4.3.5). Stellen Sie sicher, dass die Proxy-Embryonen von der gleichen Gruppe experimenteller Embryonen stammen, so dass alle Embryonen zur gleichen Zeit von denselben Eltern befruchtet wurden. Dies ist nützlich für den Immunfluoreszenz-Assay, bei dem das Stadium relevant ist, aber für den Phänotypisierungs-Assay nicht erforderlich ist.
- Verwenden Sie die folgenden Bedingungen sowohl für die Phänotypisierung als auch für die Immunfluoreszenz-Assays: 1) nicht injiziert, nicht exponiert, 2) nicht injiziert, Licht ausgesetzt, 3) injiziert, nicht exponiert, 4) injiziert, Licht ausgesetzt. Wählen Sie mindestens 30 Embryonen pro Bedingung aus. Für eine optimale Gesundheit der Embryonen sollten nicht mehr als 30 Embryonen pro Well in einer 6-Well-Platte inkubiert werden.
- Nach der Injektion werden die Embryonen in markierte Petrischalen oder mit Agarose beschichtete 6-Well-Platten (für dechorionierte Embryonen) übertragen und bei 28 °C inkubiert. Embryonen sind noch nicht lichtempfindlich. Behandeln Sie injizierte Embryonen nach 1,5 Stunden nach der Befruchtung (hpf) so, als ob sie lichtempfindlich wären.
4. Lichtexpositions-Experiment
HINWEIS: Die Bestrahlung mit ~450 nm Licht mit einer Bestrahlungsstärke von 45 W/m2 aktiviert bOpto-BMP/Nodal ohne offensichtliche Phototoxizität (Informationen zum Belichtungsmesser finden Sie in der Materialtabelle). Das Niveau der optogenetisch aktivierten Signalübertragung kann durch Ändern der Bestrahlungsstärkewerte38 eingestellt werden. Die Phototoxizität muss jedoch bei höheren Bestrahlungsstärken bewertet werden.
- Zeitkritischer Schritt. Im 4- bis 16-Zell-Stadium, etwa 1,5 hpf, entfernen Sie unbefruchtete und kranke Embryonen. Bei Bedarf umverteilen, um die gleiche Anzahl von Embryonen in jeder Vertiefung (nicht mehr als 30) zu gewährleisten.
HINWEIS: Es ist wichtig, diesen Schritt im 4- bis 16-Zell-Stadium durchzuführen, da die Embryonen lichtempfindlich werden, wenn die injizierte mRNA in ein Protein übersetzt wird. Wir haben keine Hinweise darauf beobachtet, dass Embryonen vor 1,5 hpf signifikant lichtempfindlich sind. Um eine unbeabsichtigte Photoaktivierung bei der Beurteilung von Embryonen nach 1,5 hpf zu minimieren, verwenden Sie rotes Licht oder decken Sie Lichtquellen - einschließlich Mikroskoptische - mit rotem Gelfilterpapier ab, das LOV-dimerisierende blaue Wellenlängen blockiert (Materialtabelle).- Bewerten Sie die Embryonen konsistent, um eine unvoreingenommene Verteilung zwischen Bedingungen und Experimenten zu gewährleisten.
- Verwenden Sie für den Phänotypisierungsassay das folgende 1-Tages-Lichtexpositionsprotokoll ab 1,5 hpf (Abbildung 3A).
- Wickeln Sie die nicht belichtete Steuerplatte in Aluminiumfolie ein. Diese Platte sollte sowohl nicht injizierte als auch injizierte Embryonen enthalten. Achten Sie darauf, dass die Platte vollständig bedeckt ist und achten Sie darauf, dass keine Risse in die Folie gelangen. Platzieren Sie diese Platte auf der unteren Ablage des 28 °C warmen Leuchtkastens (Abbildung 2A).
- Legen Sie die freiliegende Platte auf die oberste Ablage des 28 °C warmen Leuchtkastens (Abbildung 2A). Stellen Sie sicher, dass die Abdeckung auf der Schale liegt, um eine Verdunstung des Embryonalmediums zu vermeiden. Schalten Sie das blaue Licht ein (eine Bestrahlungsstärke von 45 W/m2 aktiviert die Signalisierung).
- Schließen Sie die Tür des Leuchtkastens, um unbeabsichtigte Lichteinwirkung im Raum zu vermeiden. Falls gewünscht, legen Sie ein Speicherkartenthermometer in den Leuchtkasten, bevor Sie die Tür schließen. Öffnen Sie die Tür erst, wenn der Phänotyp 1 Tag nach der Befruchtung (dpf; siehe Schritt 5.1) bewertet wird.
- Für den Immunfluoreszenz-Assay werden die Embryonen 20 Minuten lang blauem Licht ausgesetzt, beginnend mit etwa 40% Epibolie56 (~6 hpf) und sofort nach der Lichtexposition zusammen mit den nicht exponierten Kontrollen fixiert (Abbildung 3B). Eine 20-minütige Blaulicht-Exposition bei 40% Epibolie aktiviert reproduzierbar die Signalübertragung.
- Wickeln Sie bei etwa 1,5 hpf sowohl das freiliegende als auch das nicht belichtete Geschirr separat in Alufolie ein. Achten Sie darauf, dass das Geschirr vollständig bedeckt ist und achten Sie darauf, dass keine Risse in die Folie gelangen. Lassen Sie die Proxy-Schale unverpackt. Stellen Sie die verpackten Schalen und die unverpackte Proxy-Schale in den 28 °C heißen Leuchtkasten (Abbildung 2A). Schalten Sie die LED noch nicht ein.
- Wenn Sie mehr als eine mRNA-Menge testen, sortieren Sie die Embryonen, die mit unterschiedlichen Mengen injiziert wurden, in einzelne Agarose-beschichtete 6-Well-Platten, was dazu beiträgt, die unbeabsichtigte Lichtexposition während der anschließenden Fixierung zu minimieren.
- Schließen Sie die Tür des Leuchtkastens, um unbeabsichtigte Lichteinwirkung im Raum zu vermeiden.
- Verdünnen Sie den Formaldehydstoff auf 4 % in 1x phosphatgepufferter Kochsalzlösung (PBS) und aliquoten Sie 1 ml in voretikettierte 2-ml-Mikrozentrifugenröhrchen mit rundem Boden, ein Röhrchen pro Bedingung. Bei 4 °C lagern.
- Entfernen Sie nach etwa 5 Stunden die Proxy-Schale mit den nicht injizierten Embryonen und beurteilen Sie das Entwicklungsstadium mit einem Präpariergerät. Das Stadium der Proxy-Embryonen sollte das Stadium der lichtempfindlichen Embryonen in den verpackten Schalen widerspiegeln.
- Nimm auch das eingewickelte Geschirr heraus, damit alle Gerichte die gleiche Temperatur haben. Wiederholen Sie den Vorgang, bis die Proxy-Embryonen 40% Epibolie (~6 hpf) erreicht haben. Das Fortschreiten der Embryogenese ist temperaturabhängig54; Je länger sich die Schalen außerhalb des Inkubators befinden, desto länger dauert es also, bis die Embryonen 40% Epibolie erreicht haben.
- Sobald die Proxy-Embryonen 40 % Epibolie erreicht haben, wickeln Sie die freigelegte Schale aus und stellen Sie sie auf die oberste Ablage des Leuchtkastens (Abbildung 2A). Lassen Sie die nicht freigelegte(n) Schale(n) eingewickelt und stellen Sie sie auf die untere Ablage. Schalten Sie sofort das Blaulicht ein, schließen Sie die Tür und stellen Sie einen Timer auf 20 min ein (eine Bestrahlungsstärke von 45 W/m2 aktiviert die Signalisierung).
- Um die Fixierung vorzubereiten, eliminieren Sie so viel Raumlicht wie möglich (schließen Sie die Jalousien, schalten Sie die Deckenbeleuchtung aus, schalten Sie die Bildschirme aus usw.). Stellen Sie sicher, dass die formaldehydhaltigen Röhrchen entsprechend gekennzeichnet sind. Unmittelbar vor der Fixierung formaldehydhaltige Röhrchen ab 4 °C entfernen und neben den Leuchtkasten stellen.
- Zeit- und lichtempfindliche Stufe. Bereiten Sie sich darauf vor, sich am Ende der 20-minütigen Lichtexposition schnell zu bewegen. Öffnen Sie nach 20 Minuten die Tür des Leuchtkastens und entfernen Sie die nicht belichtete Schale.
- Verwenden Sie eine Pipettenspitze aus geflammtem Glas, um lichtempfindliche Embryonen schnell, aber schonend in das vorbereitete entsprechende Röhrchen mit 4%igem Formaldehyd zu übertragen.
- Minimieren Sie die Übertragungszeit (<45 s) von lichtempfindlichen Embryonen, um eine unbeabsichtigte Lichtexposition zu vermeiden. Stellen Sie sicher, dass sich keine Luftblasen in der Pipette befinden. Die Exposition gegenüber der Luft zerstört dechorionierte Embryonen.
- Um Embryonen in Formaldehyd auszustoßen, tauchen Sie die Glaspipettenspitze in das Formaldehyd und lassen Sie die Embryonen in die Flüssigkeit sinken. Minimieren Sie die Menge des Embryomediums, die auf das Formaldehyd übertragen wird, indem Sie die Embryonen am Ende der Spitze halten.
- Nachdem die Embryonen übertragen wurden, legen Sie die Pipette wieder in dieselbe Vertiefung und pipettieren Sie sie auf und ab, um festsitzende Embryonen zu entfernen. Dadurch wird verhindert, dass Embryonen durch mehrere Erkrankungen versehentlich in einem Eileiter landen.
- Wiederholen Sie sofort die Schritte 4.3.11-4.3.13 für die nicht exponierten, nicht injizierten Embryonen, gefolgt von den exponierten Embryonen (injiziert und nicht injiziert).
- Fixierte Embryonen über Nacht bei 4 °C lagern.
5. Auswertung von Experimenten
- Phänotyp-Scoring und Bildgebung
- Bei 1 dpf, idealerweise zwischen 24-32 hpf, entnehmen Sie die Embryonen aus dem Leuchtkasten, um die Phänotypen mit einem Präpariergerät zu beurteilen und eine Bewertungsrubrik zu erstellen. Dies ist der experimentelle Endpunkt. Eine versehentliche Photoaktivierung ist kein Problem mehr.
- Ritzen Sie die Embryonen ein, während sie sich noch im Chorion befinden, um die Einfachheit zu erleichtern. Verwenden Sie eine Pipette oder Sonde, um Embryonen zu bewegen, um sie aus mehreren Blickwinkeln zu betrachten.
- Embryonen mit übermäßiger BMP-Signalübertragung werden mit unterschiedlichem Schweregrad ventralisiert, wie in Kishimoto et al. ausführlich beschrieben. 199746 (Abbildung 4A, links). Embryonen mit übermäßiger Nodal-Signalgebung weisen eine Reihe von Entwicklungsstörungen auf, die mit einem Überschuss an Mesendoderm zusammenhängen (Abbildung 4A, rechtes Bild)1,3,47,57,58,59,60. Sie werden oft um 1 dpf lysiert haben.
- Bewerten Sie jeden Embryo unter allen Bedingungen (Abbildung 4B). Verschaffen Sie sich ein Übersichtsbild aller Embryonen in jeder Vertiefung. Falls gewünscht, werden einzelne repräsentative Embryonen in Methylcellulose dechorioniert und abgebildet (Abbildung 4A).
- Immunfluoreszenzfärbung und Bildgebung
- Nach der Inkubation der Embryonen in 4% Formaldehyd bei 4 °C über Nacht Formaldehyd entfernen und 3-5x mit 1x phosphatgepufferter Kochsalzlösung mit Tween20 (PBST) waschen. PBST entfernen und 100% Methanol hinzufügen.
- Schließen Sie die Röhrchen und drehen Sie sie vorsichtig um, um PBST-Reste und Methanol zu mischen. 2x mit Methanol waschen und bei -20 °C mindestens 2 h bis zu Jahren lagern.
- Für das Immunfluoreszenzprotokoll pSmad1/5/9 (BMP) siehe Rogers et al.38. Für das pSmad2/3 (Nodal) Immunfluoreszenzprotokoll siehe van Boxtel et al.17 und Rogers et al.47.
- Bildgebung immungefärbter Embryonen mit einem Mikroskop, das optische Schnitte durchführen kann (z. B. ein konfokales oder Lichtblattmikroskop). Vermeiden Sie Sättigung und halten Sie identische Bildgebungsbedingungen zwischen allen Proben aufrecht, die mit demselben Antikörper gefärbt sind.
- Bild innerhalb von 5 Tagen nach Abschluss der Immunfluoreszenzfärbung, da die Fluoreszenz mit der Zeit verblassen kann.
Ergebnisse
Das Ziel der beiden hier beschriebenen Kontrollexperimente ist es, festzustellen, ob bOpto-BMP/Nodal ihre jeweiligen Signalwege als Reaktion auf Blaulichtexposition aktivieren, ohne die Signalübertragung in Abwesenheit von Licht zu beeinflussen, wie erwartet. Verwenden Sie diese Steuerelemente, um den geeigneten experimentellen Arbeitsablauf in Ihrem Labor einzurichten, bevor Sie bOpto-BMP/Nodal auf Ihre Forschungsfragen anwenden.
Der Phänotypisierungsassay kann in nur 2 Tagen abgeschlossen werden und liefert einen nützlichen Hinweis auf die Signalaktivität und Phototoxizität (Abbildung 3A). Injizierte, blaulichtexponierte Embryonen sollten einen übermäßigen BMP-Signalweg phänophonieren (Ventralisation46; Abbildung 4A, linkes Bild) oder Knotensignalisierung (Entwicklungsstörungen im Zusammenhang mit dem zusätzlichen Mesendoderm 1,3,47,57,58,59,60 (Abbildung 4A, rechtes Bild)). Wenn injizierte, lichtexponierte Embryonen aphenotypisch sind, testen Sie die Qualität der mRNA und erwägen Sie, mehr zu injizieren, und überprüfen Sie die Lichtexpositionsstrategie, um eine konstante Exposition gegenüber hellem Licht zu gewährleisten (~450 nm Licht mit einer Bestrahlungsstärke von 45 W/m2 sollte die Signalübertragung stark aktivieren). Im Gegensatz dazu sollten injizierte, nicht exponierte Embryonen identisch mit nicht injizierten Geschwistern aussehen. Wenn injizierte, nicht exponierte Embryonen Phänotypen aufweisen, reduzieren Sie die Menge der injizierten mRNA und bewerten Sie den Versuchsaufbau neu, um sicherzustellen, dass nicht exponierte Embryonen vor Lichtexposition geschützt sind. Die in Abbildung 4B gezeigten Daten zeigen die Ergebnisse typischer Phänotypisierungsexperimente mit geeigneten mRNA-Mengen und Expositions-Bedingungen: Eine starke Signalaktivität ist in injizierten, lichtexponierten Embryonen offensichtlich, wobei nur ein kleiner Teil der injizierten, nicht exponierten Embryonen Phänotypen aufwies.
Der Phänotypisierungs-Assay bietet auch die Möglichkeit, die Phototoxizität zu bewerten. Wenn die Phototoxizität vernachlässigbar ist, sollten nicht injizierte, lichtexponierte Embryonen Wildtyp-Embryonen sein, ähnlich wie nicht injizierte, nicht exponierte Embryonen. Wenn nicht injizierte, lichtexponierte Embryonen Defekte aufweisen, aber keine injizierten, nicht exponierten Embryonen, sollten Sie in Betracht ziehen, die Lichtbestrahlung zu verringern. Eine Bestrahlungsstärke von 45 W/m2 aktiviert die Signalübertragung ohne offensichtliche Phototoxizität. Die in Abbildung 4B gezeigten Daten zeigen keine besorgniserregenden Unterschiede zwischen nicht injizierten, lichtexponierten und nicht injizierten, nicht exponierten Embryonen, was auf eine vernachlässigbare Phototoxizität hindeutet.
Obwohl die Immunfluoreszenz-Assays im Vergleich zum Phänotypisierungs-Assay (2 Tage) mehr Zeit und Mühe (~1 Woche) erfordern, bietet die Immunfluoreszenz-Färbung ein direktes Auslesen der Signalwegaktivität und kann subtile Signalveränderungen aufdecken, die sich möglicherweise nicht in der groben Morphologie widerspiegeln. Die Immunfluoreszenz ist besonders wichtig, um das Ansprechen auf bOpto-Nodal zu beurteilen, da eine übermäßige Nodal-Signalgebung oft dazu führt, dass Embryonen um 1 dpf lysieren, was viele Ursachen haben kann - im Gegensatz zu den spezifischen Ventraisationsphänotypen, die für die übermäßige BMP-Signalgebung charakteristisch sind46 (Abbildung 4A). Injizierte, Blaulicht-exponierte Embryonen sollten im Vergleich zu nicht injizierten, lichtexponierten Embryonen einen gleichmäßigen Anstieg der Smad1/5/9- oder Smad2/3-Phosphorylierung aufweisen. Wenn die Werte nicht oder nur schwach erhöht sind, testen Sie die Qualität der mRNA und erwägen Sie, mehr zu injizieren, und überprüfen Sie die Lichtexpositionsstrategie. Eine 20-minütige Exposition gegenüber blauem Licht mit einer Bestrahlungsstärke von 45 W/m2 bei etwa 40% Epibolie sollte die Signalübertragung stark aktivieren. Wenn die pSmad-Färbung ungleichmäßig ist, versuchen Sie, mRNA in die Mitte der Zelle (und nicht in das Eigelb) zu injizieren, was zu einer gleichmäßigeren mRNA-Verteilung führen kann.
Injizierte, nicht exponierte Embryonen sollten einen pSmad-Spiegel aufweisen, der mit dem von nicht injizierten Embryonen vergleichbar ist. Anekdotisch haben wir eine undichtere Smad-Phosphorylierung mit bOpto-Nodal als mit bOpto-BMP beobachtet. Wenn die pSmad-Spiegel in injizierten, nicht exponierten Embryonen erhöht sind, ist die Menge der injizierten mRNA zu reduzieren. Darüber hinaus sollte der Versuchsaufbau neu bewertet werden, um sicherzustellen, dass 1) nicht exponierte Embryonen nicht versehentlich Licht ausgesetzt werden und 2) die Lichtexposition während der Fixierung minimal ist. Während des Fixierungsschritts ist es wichtig, dass zwischen der Entnahme aus dem Leuchtkasten und dem Eintauchen in Formaldehyd nicht mehr als 45 s vergehen. Minimieren Sie während dieses Schritts außerdem die Exposition gegenüber Raumlicht und Sonnenlicht, indem Sie Jalousien schließen, weiße Lichtquellen ausschalten, rotes Licht verwenden oder weiße Lichtquellen mit blaulichtblockierendem Gelfilterpapier abdecken (Materialtabelle).
Die Daten in Abbildung 4C zeigen die Ergebnisse typischer Immunfluoreszenz-Färbeexperimente mit geeigneten mRNA-Mengen und Lichtexpositionsbedingungen: Die pSmad-Spiegel sind bei nicht injizierten und nicht exponierten Embryonen ähnlich, während injizierte, lichtexponierte Embryonen höhere Smad-Phosphorylierungswerte aufweisen.
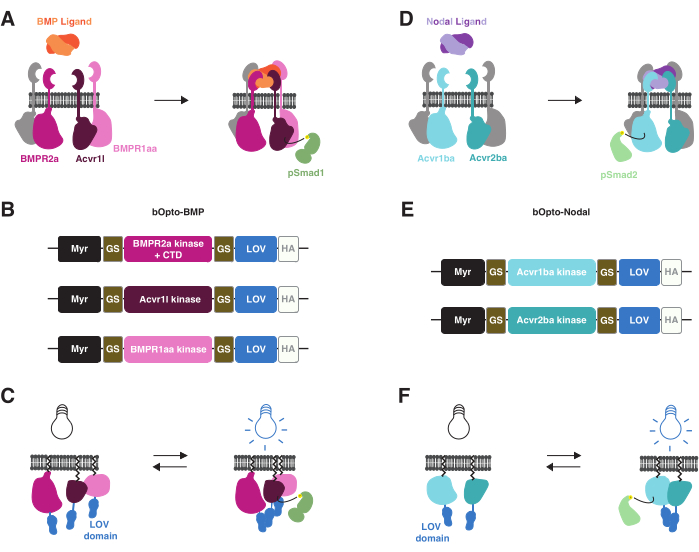
Abbildung 1: Aktivierungsstrategie des bOpto-BMP- und -Nodal-Signalwegs . (A) Der endogene BMP-Signalweg wird durch die Bindung des BMP-Liganden aktiviert, was zur Bildung eines Typ-I/II-Rezeptorkomplexes, zur Phosphorylierung von Smad1/5/9 und zur Expression von BMP-Zielgenen führt. Die Typ-I-Rezeptoren BMPR1aa und Acvr1l werden auch als Alk3 bzw. Alk8 bezeichnet. BMPR2a ist ein Typ-II-Rezeptor. (B) bOpto-BMP-Konstrukte38. Mutmaßliche Kinasedomänen von BMPR1aa und Acvr1l sind mit LOV fusioniert; Die BMPR2a-LOV-Fusion enthält die mutmaßliche Kinasedomäne und die C-terminale Domäne (CTD) des Rezeptors. Alle Fusionen sind membranspezifisch mit einem Myristoylierungsmotiv (Myr) versehen. Die Domänen sind durch Glycin-Serin (GS)-Linker getrennt. Konstrukte werden an der CTD mit einem HA-Epitop-Tag markiert. Es wurde festgestellt, dass diese Kombination von drei Konstrukten die BMP-Signalübertragung optimal aktiviert. (C) bOpto-BMP-vermittelte Aktivierung des BMP-Signalwegs. Wenn sie blauem Licht ausgesetzt werden, dimerisieren LOV-Domänen, was vermutlich die Bildung komplexer Komplexe und die Aktivierung von Signalen auslöst. (D) Der endogene Nodal-Signalweg wird durch Nodal-Ligandenbindung aktiviert, was zur Bildung eines Typ-I/II-Rezeptorkomplexes, zur Phosphorylierung von Smad2/3 und zur Expression von Nodal-Zielgenen führt. Der Typ-I-Rezeptor Acvr1ba und der Typ-II-Rezeptor Acvr2ba werden auch als Acvr1b bzw. Acvr2b bezeichnet. (E) bOpto-Knoten-Konstrukte39. Mutmaßliche Kinasedomänen von Acvr1ba und Acvr2ba sind mit LOV fusioniert. Alle Fusionen sind membranspezifisch mit einem Myristoylierungsmotiv (Myr) versehen. Domains werden durch GS-Linker getrennt. Konstrukte werden an der CTD mit einem HA-Epitop-Tag markiert. (F) bOpto-Nodal-vermittelte Aktivierung des Nodal-Signalwegs. Wenn sie blauem Licht ausgesetzt werden, dimerisieren LOV-Domänen, was vermutlich die Bildung komplexer Komplexe und die Aktivierung von Signalen auslöst. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
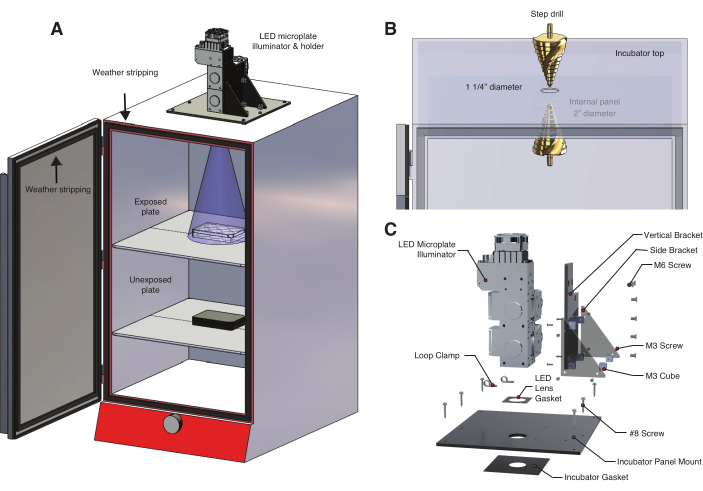
Abbildung 2: Temperaturgesteuerter Leuchtkasten für optogenetische Experimente . (A) Eine LED-Mikroplattenbeleuchtung wird mit einem speziell angefertigten LED-Halter an der Oberseite eines Inkubators montiert. Zebrafischembryonen in einer 6-Well-Platte auf dem ersten Regal werden durch ein Loch, das in die Oberseite des Inkubators gebohrt wurde, dem Licht ausgesetzt. Das untere Regal enthält einen zweiten Satz unbelichteter Kontrollembryonen in einer mit Aluminiumfolie umwickelten 6-Well-Platte. Die Tür des Inkubators ist mit einer Dichtung ausgekleidet, um eine unbeabsichtigte Einwirkung von Raumlicht oder Sonnenlicht zu verhindern. (B) Einzelheiten des Verfahrens zum Anlegen eines Lochs in den Inkubator mit einem Stufenbohrer. Das hier verwendete Inkubatormodell verfügt über eine Innenverkleidung, für die ein zweites, größeres Loch gebohrt werden musste (Materialtabelle). (C) Detail der kundenspezifischen LED-Halterung, die für ein Beleuchtungssystem mit drei Wellenlängen entwickelt wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
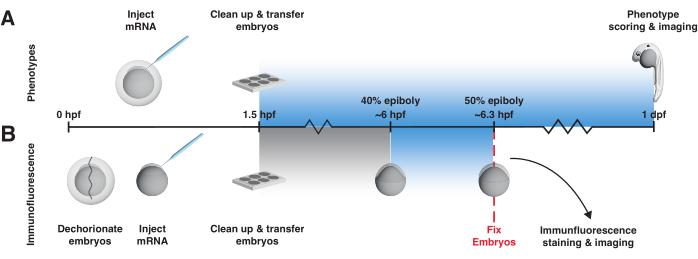
Abbildung 3: Arbeitsablauf des bOpto-BMP/Nodal-Experiments. Phänotyp-Assay und pSmad-Immunfluoreszenzfärbung zur Testaktivität von bOpto-BMP/Nodal. Die Embryonen werden im Einzelzellstadium mit mRNA injiziert und spätestens 1,5 Stunden nach der Befruchtung (hpf) in einen Leuchtkasten übertragen. (A) Phänotyp-Assay. Injizierte Embryonen und nicht injizierte Geschwister werden im Dunkeln aufgezogen oder gleichmäßigem blauem Licht ausgesetzt, beginnend bei 1,5 hpf bis 1 Tag nach der Befruchtung (dpf). Die optogenetische Signalaktivität kann bewertet werden, indem Embryonen auf Phänotypen untersucht werden, die mit einer übermäßigen Signalwegaktivität übereinstimmen. (B) pSmad-Immunfluoreszenzfärbung. Injizierte Embryonen und nicht injizierte Geschwister werden im Dunkeln aufgezogen, bis 40% Epibolie (~6 hpf) erreicht sind. Die Hälfte der injizierten und die Hälfte der nicht injizierten Embryonen werden dann 20 Minuten lang gleichmäßigem blauem Licht ausgesetzt. Nach der Exposition werden alle Embryonen fixiert und einer Immunfluoreszenzfärbung auf pSmad unterzogen. Erhöhte Spiegel von pSmad1/5/9 oder pSmad2/3 spiegeln die optogenetische Aktivierung des BMP- bzw. Nodal-Signalwegs wider. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
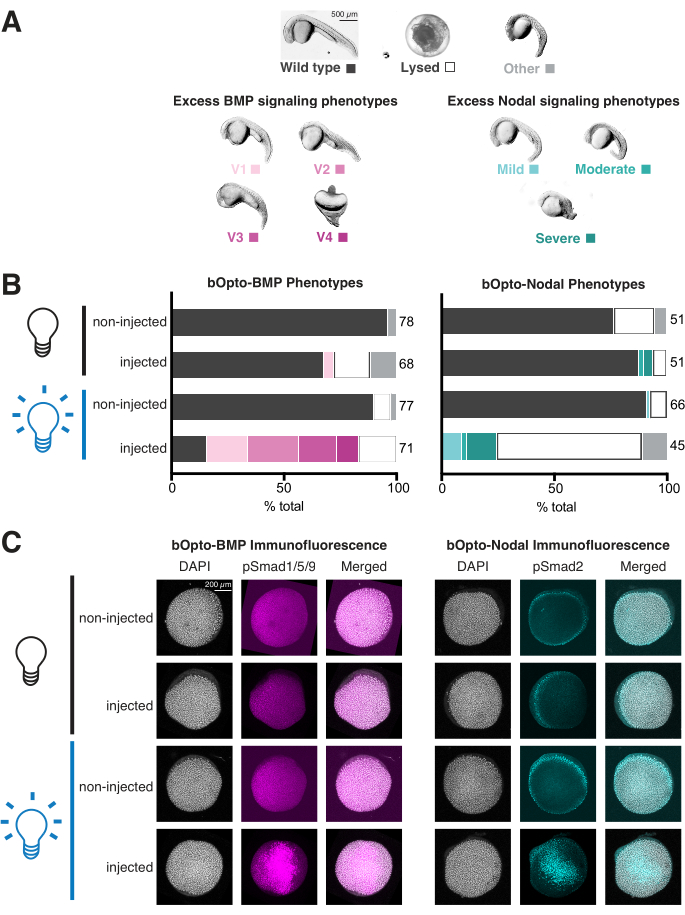
Abbildung 4: Beurteilung von lichtaktivierten Signalantworten in Zebrafischembryonen. Zebrafischembryonen wurden im Einzelzellstadium mit mRNA injiziert, die für bOpto-BMP/Nodal kodiert. (A) Die Embryonen wurden entweder im Dunkeln aufgezogen oder 1,5 Stunden nach der Befruchtung (hpf) gleichmäßigem blauem Licht ausgesetzt. Die Phänotypen wurden 1 Tag nach der Befruchtung (dpf) bewertet. Repräsentative Phänotypen werden gezeigt. Ein Überschuss an BMP-Signalen führt zu einer Ventralisierung (linkes Bild), während ein Überschuss an Knotensignalen Entwicklungsstörungen verursacht, die mit einem zusätzlichen Mesendoderm assoziiert sind (rechtes Bild). Maßstabsbalken = 500 μm. (B) Quantifizierung des Phänotyps. Injizierte Embryonen und nicht injizierte Geschwister wurden im Dunkeln ab 1,5 hpf (schwarze Zwiebel) aufgezogen. Die Hälfte der injizierten und die Hälfte der nicht injizierten Embryonen wurden einheitlichem blauem Licht (blaue Glühbirne) ausgesetzt. (C) Injizierte Embryonen und nicht injizierte Geschwister wurden im Dunkeln ab 1,5 hpf (schwarze Zwiebel) aufgezogen. Bei 40% Epibolie (~6 hpf) wurde die Hälfte der injizierten und die Hälfte der nicht injizierten Embryonen einheitlichem blauem Licht (blaue Bulb) ausgesetzt. Nach 20 Minuten wurden alle Embryonen fixiert und einer Immunfluoreszenzfärbung auf phosphoryliertes Smad1/5/9 oder Smad2/3 unterzogen. Höhere pSmad-Intensitäten deuten auf eine erhöhte BMP/Nodal-Signalgebung hin. Maßstabsleiste = 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzungsdatei 1: Leuchtkasten-Vollmontage. 3D-PDF-Datei mit einer 3D-Ansicht der gesamten Leuchtkastenbaugruppe. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 2: Explosionszeichnung des Leuchtkastens. 3D-PDF-Datei mit einer 3D-Ansicht der explodierten Leuchtkastenbaugruppe. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 3: Große leichte Dichtung. CAD-Zeichnungsdatei (. DWG-Format), um die große Lichtdichtung für die LED-Fassung mit einem Lasercutter herzustellen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 4: Kleine leichte Dichtung. CAD-Zeichnungsdatei (. DWG-Format), um die kleine Lichtdichtung für den LED-Halter mit einem Lasercutter herzustellen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 5: Plattformsockel aus Acryl. CAD-Zeichnungsdatei (. DWG-Format), um den LED-Halter aus Acryl-Plattformsockel mit einem Laserschneider herzustellen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 6: Acrylplattform vertikal. CAD-Zeichnungsdatei (. DWG-Format), um die LED-Halter-Acrylplattform vertikal mit einem Laserschneider herzustellen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 7: Acrylstütze links. CAD-Zeichnungsdatei (. DWG-Format), um den linken Träger aus LED-Halter aus Acryl mit einem Laserschneider herzustellen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 8: Acryl-Stütze rechts. CAD-Zeichnungsdatei (. DWG-Format), um den rechten Träger aus Acryl des LED-Halters mit einem Laserschneider herzustellen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die Injektion von mRNA ist die derzeitige Strategie, um bOpto-BMP/Nodal an Zebrafischembryonen abzugeben. Diese Methode hat mehrere Nachteile. Erstens variiert die angemessene Menge an mRNA von Labor zu Labor. Die verwendete Menge sollte ausreichen, um die Signalisierung bei Lichteinwirkung robust zu aktivieren, jedoch ohne unbeabsichtigte Dunkelaktivierung. Es ist eine gute Idee, mehrere Mengen zu testen, um optimale mRNA-Spiegel zu finden, und nach der Festlegung Aliquoten eines Mastermixes zu erstellen, um die gleiche Menge an mRNA reproduzierbar einzuführen. Zweitens kann eine ungleichmäßige Verteilung der injizierten mRNA zu einer ungleichmäßigen Signalaktivierung führen. Es wird angenommen, dass die Injektion in die Mitte der Zelle (nicht in das Eigelb) eine gleichmäßige mRNA-Verteilung fördert. Da injizierte mRNA mit der Zeit abgebaut wird, ist dieser Ansatz möglicherweise nicht für Experimente an älteren Embryonen geeignet. In Zukunft könnten diese Probleme durch transgene Zebrafischlinien gelöst werden, die ubiquitär bOpto-BMP/Nodal mit einem mütterlichen oder medikamenteninduzierbaren Promotor exprimieren. Obwohl die Arbeit mit potentiell lichtempfindlichen adulten Zebrafischen in diesem Zusammenhang eine Herausforderung darstellen kann, wurden die transgenen Zebrafische 61,62 und Drosophila 22,34,35,63 mit optogenetischen Werkzeugen erfolgreich entwickelt.
Die Vermeidung einer unbeabsichtigten Photoaktivierung ist eine generelle Herausforderung bei optogenetischen Werkzeugen. Der Einfachheit halber behandeln Sie injizierte Embryonen, die älter als 1,5 hpf sind, als lichtempfindlich. Eine unbeabsichtigte Lichteinwirkung kann oft vermieden werden, indem Teller oder Schalen einfach mit Alufolie umwickelt werden. Für Experimente, die eine visuelle Beobachtung von lebenden Embryonen erfordern, die älter als 1,5 hpf sind, ist es jedoch möglich, rote Lichtquellen zu verwenden oder weiße Lichtquellen mit kostengünstigem Gelfilterpapier abzudecken, das LOV-dimerisierende Wellenlängen blockiert (Materialtabelle).
Der hier beschriebene Leuchtkasten ist für spezifische Anwendungen konzipiert, die eine präzise Steuerung der Lichtbestrahlungsstärke, -dynamik und -wellenlängen erfordern (Abbildung 2). Zu den weiteren Vorteilen dieses Leuchtkastens gehören eine gleichmäßige Lichtbelichtung, eine vernachlässigbare unbeabsichtigte Erwärmung der Proben, ausreichend Platz für mehrere 6-Well-Platten und langlebige, spektral gut charakterisierte Lichtquellen. Je nach Forschungsanwendung können jedoch unterschiedliche Lichtexpositionsstrategien bevorzugt werden. Viele Labore haben einfachere und kostengünstigere Systeme für gleichmäßige Lichtbelichtung mit geringerem Platzbedarf entwickelt, einschließlich der Auskleidung von Inkubatoren mit LED-Streifen, der Aufhängung von LED-Panels über Proben oder der Integration von LEDs in Kulturschalendeckeln 32,38,39,40,64,65,66 . Wichtig ist, dass der in diesem Protokoll verwendete Leuchtkasten es den Benutzern nicht erlaubt, einzelne Vertiefungen unabhängig voneinander zu regulieren (im Gegensatz zu Bugaj et al.52) oder eine räumliche Kontrolle über die Lichtexposition zu ermöglichen. Die räumlich lokalisierte optogenetische Aktivierung wurde mit bOpto-BMP38 und bOpto-Nodal39 unter Verwendung von Lasern in SPIM- bzw. konfokalen Systemen demonstriert und auch mit vielen anderen optogenetischen Strategien in einer Vielzahl von Modellsystemen realisiert (diskutiert in Rogers und Müller12). Einige Ansätze haben sogar eine subzelluläre räumliche Auflösung erreicht 29,30,31. Obwohl die Implementierung von räumlich lokalisierten Lichtbelichtungssystemen außerhalb des Geltungsbereichs dieses Protokolls liegt, sind räumliche Aktivierungsexperimente mit bOpto-BMP/Nodal theoretisch mit spezialisierten Geräten wie digitalen Mikrospiegelgeräten oder Maskierungsansätzen möglich. Die Leser werden ermutigt, die umfangreiche Literatur über DIY-Leuchtkästen für optogenetische Experimente zu erkunden, bevor sie sich für eine Lichtexpositionsstrategie entscheiden (siehe z.B. Gerhardt et al.51, Bugaj et al.52, Kumar und Khammash 53 und mehr bei https://www.optobase.org/materials/).
Molekulare optogenetische Strategien bieten oft ein höheres Maß an raumzeitlicher Kontrolle über biologische Prozesse im Vergleich zu historischen Ansätzen wie Mutanten, ektopischer Genexpression, rekombinanten Proteinen und Medikamenten. Leser, die sich für die Vorteile optogenetischer Ansätze interessieren, können andere veröffentlichte Werkzeuge erkunden, die bei Zebrafischen und anderen Organismen verfügbar sind. Dazu gehören Werkzeuge zur Manipulation zusätzlicher Signalwege 32,65,67,68, zur Regulierung der Genexpression 61,64,66,69,70,71, zur Veränderung der Proteinlokalisierung 31,72 und zur Aktivierung der Apoptose 62. Diese und viele andere Werkzeuge sind bequem auf OptoBase katalogisiert, einer kuratierten Webressource für molekulare optogenetische Ansätze28. Für diejenigen, die sich von der Entwicklung neuartiger optogenetischer Werkzeuge inspirieren lassen, bietet die Ressource auch nützliche Beschreibungen von lichtempfindlichen Proteinen, die in einer Vielzahl von Strategien eingesetzt wurden, einschließlich lichtempfindlicher Proteine, die auf grüne, rote und nahinfrarote Wellenlängen reagieren. Wir freuen uns, dass die wissenschaftliche Gemeinschaft das volle Potenzial molekular-optogenetischer Ansätze ausschöpfen kann.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Finanziert wurde dieses Protokoll durch das NICHD Intramural Program an KWR (ZIA HD009002-01). Wir danken Jeff Farrell und seinem Labor für ihr aufschlussreiches Feedback, Will Anderson für die hervorragende technische Unterstützung, Leanne Iannucci für den Stresstest des Protokolls und die Messung der Bestrahlungsstärke und der NIH Shared Zebrafish Einrichtung für ihre harte Arbeit, die Zebrafische gesund zu halten.
Materialien
| Name | Company | Catalog Number | Comments |
| Building a light box & Light exposure protocol | |||
| #8 x 1" Hex Self-drilling Screw | McMaster-Carr | 99663A222 | 1.4.5 |
| Digital Optical Power and Energy Meter | ThorLabs | PM100D | 1.7 4 |
| Incubator (142 liters) | Boekel Scientific | 139400 | 1.3.1 |
| Incubator Panel Mount (1/4" thick cast black acrylic) | Custom part / Piedmont Plastics | Incubator_panel | 1.4.4 |
| Large HSS Spiral Groove Step Drill Bit | CO-Z | SDB0001TA | 1.3.2 |
| LED lens gasket, Incubator gasket; 1/32" thick black silicone | McMaster-Carr | 5812T12 | 1.4.3 1.4.4 |
| LED microplate illuminator | Prizmatix | NA | 1.1 1.4.3 |
| M3 10mm Cube Standoff | Newark Eletronics | 005.60.533 | 1.4.1 |
| M3 x 10mm 316SS Flat Head Screw | McMaster-Carr | 91801A156 | 1.4.1 |
| M6 x 10mm 316SS Flat Head Screw | McMaster-Carr | 91801A305 | 1.4.3 |
| Memory card thermometer | Fisherbrand | 15-081-111 | 1.9 3.2.1 |
| Microscope Slide Power Meter Sensor Head (150 mW) | ThorLabs | S170C | 1.7 4 |
| Red gel filter paper #E106 | Rosco / B&H Foto & Electronics | 110084014805-E106 | 4.2.1 |
| Side Brackets (1/4" thick cast black acrylic) | Custom part / Piedmont Plastics | Side_bracket | 1.4.2 |
| Vertical Bracket (1/4" thick cast black acrylic) | Custom part / Piedmont Plastics | Vertical_bracket | 1.4.1 |
| Weather stripping: Light duty EPDM foam, 1/2" wd 1/4" tk | McMaster-Carr | 8694K12 | 1.8 |
| Generating mRNA | |||
| EZNA MicroElute Cycle Pure Kit | Omega | D6293-02 | 2.4 |
| GeneJET Miniprep Kit (250 rxns) | Thermo Scientific | K0503 | 2.2 |
| Microsample incubator (Hybex) | SciGene | 1057-30-0 | 2 |
| Microsample incubator 1.5 ml tube block (Hybex) | SciGene | 1057-34-0 | 2 |
| Nanodrop One Spectrophotometer | Thermo Scientific | ND-ONE-W | 2.4 |
| NotI-HF restriction enzyme | New England Biolabs (NEB) | R3189L | 2.1 |
| pCS2-Opto-Alk3 | Addgene | 207614 | 2 |
| pCS2-Opto-Alk8 | Addgene | 207615 | 2 |
| pCS2-Opto-BMPR2a | Addgene | 207616 | 2 |
| RNeasy Mini Kit (250 rxns) | Qiagen | 74106 | 2.3 |
| Injecting mRNA | |||
| Agarose (UltraPure) | Invitrogen / Thermo Fisher | 16500500 | 3.1.1 |
| 250 ml glass beakers | Fisherbrand | FB100250 | 3.3.2 |
| 6-well dishes (case of 50) | Falcon | 08 772 1B | 3.1.6 |
| B-8A ball joint | Narishige | B-8A | 3.3 |
| Back pressure unit (microinjection rig component) | Applied Scientific Instrumentation (ASI) | BPU | 3.3 |
| Foot switch (microinjection rig component) | Applied Scientific Instrumentation (ASI) | FWS | 3.3 |
| GJ-1 magnetic stand | Narishige | GJ-1 | 3.3 |
| Glass capillaries (4 in, OD 1 mm, filament) | World Precision Instruments | 1B100F-4 | 3.1.11 |
| Glass petri dish bottoms (for dechorionating) | Pyrex | 08-748A | 3.3.2 |
| Glass pipettes (5 3/4" with wide tip) | Kimble-Chase | 63A53WT | 3.1.9 |
| Injection dish molds | Adaptive Science Tools | tu1 | 3.1.3 |
| IP iron plate | Narishige | IP | 3.3 |
| M-152 micromanipulator | Narishige | M-152 | 3.3 |
| Micro pipette holder kit (microinjection rig component) | Applied Scientific Instrumentation (ASI) | MIMPH-MPIP-Kit | 3.3 |
| Micrometers | Meiji Techno America | MA285 | 3.3 |
| MPPI-2 pressure injector (microinjection rig component) | Applied Scientific Instrumentation (ASI) | MPPI-3 | 3.3 |
| Needle puller | World Precision Instruments | PUL-1000 | 3.1.11 |
| Petri dishes (100 mm x 15 mm, case of 500) | Falcon | 08-757-100D | 3.1.2 |
| Pipettor (10 ml, green) | Bel-Art | F37898-0000 | 3.3 |
| Pronase | Roche | 11459643001 | 3.3.2 |
| Squeeze bottles (500 ml) | Nalgene / Thermo Scientific | 2402-0500 | 3.3 |
Referenzen
- Jones, W. D., Mullins, M. C. Cell signaling pathways controlling an axis organizing center in the zebrafish. Current Topics in Developmental Biology. 150, 149-209 (2022).
- Hill, C. S. Establishment and interpretation of NODAL and BMP signaling gradients in early vertebrate development. Current Topics in Developmental Biology. 149, 311-340 (2022).
- Zinski, J., Tajer, B., Mullins, M. C. TGF-β Family Signaling in Early Vertebrate Development. Cold Spring Harbor Perspectives in Biology. 10 (6), a033274 (2018).
- Shore, E. M., Kaplan, F. S. Inherited human diseases of heterotopic bone formation. Nature Reviews. Rheumatology. 6 (9), 518-527 (2010).
- Hebron, K. E., Hernandez, E. R., Yohe, M. E. The RASopathies: from pathogenetics to therapeutics. Disease Models & Mechanisms. 15 (2), dmm049107 (2022).
- Grant, M. G., Patterson, V. L., Grimes, D. T., Burdine, R. D. Modeling Syndromic Congenital Heart Defects in Zebrafish. Current Topics in Developmental Biology. 124, 1-40 (2017).
- Nusse, R., Clevers, H. Wnt/beta-Catenin Signaling, Disease, and Emerging Therapeutic Modalities. Cell. 169 (6), 985-999 (2017).
- Farahani, P. E., Reed, E. H., Underhill, E. J., Aoki, K., Toettcher, J. E. Signaling, Deconstructed: Using Optogenetics to Dissect and Direct Information Flow in Biological Systems. Annual Review of Biomedical Engineering. 23, 61-87 (2021).
- Purvis, J. E., Lahav, G. Encoding and decoding cellular information through signaling dynamics. Cell. 152 (5), 945-956 (2013).
- Wibisana, J. N., Okada, M. Encoding and decoding NF-kappaB nuclear dynamics. Current Opinion in Cell Biology. 77, 102103 (2022).
- Friedel, L., Loewer, A. The guardian's choice: how p53 enables context-specific decision-making in individual cells. TheFEBS Journal. 289 (1), 40-52 (2022).
- Rogers, K. W., Müller, P. Optogenetic approaches to investigate spatiotemporal signaling during development. Current Topics in Developmental Biology. 137, 37-77 (2020).
- Johnson, H. E., Toettcher, J. E. Illuminating developmental biology with cellular optogenetics. Current Opinion in Biotechnology. 52, 42-48 (2018).
- Bosman, S. L., Sonnen, K. F. Signaling oscillations in embryonic development. Current Topics in Developmental Biology. 149, 341-372 (2022).
- Li, P., Elowitz, M. B. Communication codes in developmental signaling pathways. Development. 146 (12), dev170977 (2019).
- Tucker, J. A., Mintzer, K. A., Mullins, M. C. The BMP signaling gradient patterns dorsoventral tissues in a temporally progressive manner along the anteroposterior axis. Developmental Cell. 14 (1), 108-119 (2008).
- van Boxtel, A. L., et al. A temporal window for signal activation dictates the dimensions of a Nodal signaling domain. Developmental Cell. 35 (2), 175-185 (2015).
- Sorre, B., Warmflash, A., Brivanlou, A. H., Siggia, E. D. Encoding of temporal signals by the TGF-β pathway and implications for embryonic patterning. Developmental Cell. 30 (3), 334-342 (2014).
- Economou, A. D., Hill, C. S. Temporal dynamics in the formation and interpretation of Nodal and BMP morphogen gradients. Current Topics in Developmental Biology. 137, 363-389 (2020).
- Rogers, K. W., Schier, A. F. Morphogen gradients: from generation to interpretation. Annual Review of Cell and Developmental Biology. 27, 377-407 (2011).
- Barkai, N., Shilo, B. Z. Robust generation and decoding of morphogen gradients. Cold Spring Harbor Perspectives in Biology. 1 (5), a001990 (2009).
- Johnson, H. E., Djabrayan, N. J. V., Shvartsman, S. Y., Toettcher, J. E. Optogenetic Rescue of a Patterning Mutant. Current Biology. 30 (17), 3414-3424 (2020).
- Imayoshi, I., et al. Oscillatory control of factors determining multipotency and fate in mouse neural progenitors. Science. 342 (6163), 1203-1208 (2013).
- Lin, B., et al. Synthetic spatially graded Rac activation drives cell polarization and movement. Proceedings of the National Academy of Sciences of the United States of America. 109 (52), E3668-E3677 (2012).
- Cui, K. W., et al. Spatially controlled stem cell differentiation via morphogen gradients: A comparison of static and dynamic microfluidic platforms. Journal of Vacuum Science & Technology. A, Vaccum, Surfaces, and Films. 38 (3), 033205 (2020).
- Faden, F., Mielke, S., Lange, D., Dissmeyer, N. Generic tools for conditionally altering protein abundance and phenotypes on demand. Biological Chemistry. 395 (7-8), 737-762 (2014).
- Shoji, W., Sato-Maeda, M. Application of heat shock promoter in transgenic zebrafish. Development, Growth & Differentiation. 50 (6), 401-406 (2008).
- Kolar, K., Knobloch, C., Stork, H., Znidaric, M., Weber, W. OptoBase: A web platform for molecular optogenetics. ACS Synthetic Biology. 7 (7), 1825-1828 (2018).
- Benedetti, L., et al. Light-activated protein interaction with high spatial subcellular confinement. Proceedings of the National Academy of Sciences of the United States of America. 115 (10), E2238-E2245 (2018).
- Krueger, D., De Renzis, S. Optogenetic Methods to Control Tissue Mechanics in Drosophila. Methods in Molecular Biology. 2540, 269-283 (2022).
- Buckley, C. E. Optogenetic Control of Subcellular Protein Location and Signaling in Vertebrate Embryos. Methods in Molecular Biology. 1920, 143-162 (2019).
- Čapek, D., et al. Light-activated Frizzled7 reveals a permissive role of non-canonical wnt signaling in mesendoderm cell migration. Elife. 8, e42093 (2019).
- Krishnamurthy, V. V., et al. Reversible optogenetic control of kinase activity during differentiation and embryonic development. Development. 143 (21), 4085-4094 (2016).
- Huang, A., Amourda, C., Zhang, S., Tolwinski, N. S., Saunders, T. E. Decoding temporal interpretation of the morphogen Bicoid in the early Drosophila embryo. Elife. 6, e26258 (2017).
- Johnson, H. E., Toettcher, J. E. Signaling dynamics control cell fate in the early Drosophila embryo. Developmental Cell. 48 (3), 361.e3-370.e3 (2019).
- Aoki, K., et al. Stochastic ERK activation induced by noise and cell-to-cell propagation regulates cell density-dependent proliferation. Molecular Cell. 52 (4), 529-540 (2013).
- Chow, R. W., Vermot, J. The rise of photoresponsive protein technologies applications in vivo: a spotlight on zebrafish developmental and cell biology. F1000Research. , (2017).
- Rogers, K. W., ElGamacy, M., Jordan, B. M., Müller, P. Optogenetic investigation of BMP target gene expression diversity. Elife. 9, e58641 (2020).
- Sako, K., et al. Optogenetic control of Nodal signaling reveals a temporal pattern of Nodal signaling regulating cell fate specification during gastrulation. Cell Reports. 16 (3), 866-877 (2016).
- Grusch, M., et al. Spatio-temporally precise activation of engineered receptor tyrosine kinases by light. The EMBO Journal. 33 (15), 1713-1726 (2014).
- Crossman, S. H., Janovjak, H. Light-activated receptor tyrosine kinases: Designs and applications. Current Opinion in Pharmacology. 63, 102197 (2022).
- Kainrath, S., Janovjak, H. Design and Application of Light-Regulated Receptor Tyrosine Kinases. Methods in Molecular Biology. 2173, 233-246 (2020).
- Takahashi, F., et al. AUREOCHROME, a photoreceptor required for photomorphogenesis in stramenopiles. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19625-19630 (2007).
- Toyooka, T., Hisatomi, O., Takahashi, F., Kataoka, H., Terazima, M. Photoreactions of aureochrome-1. Biophysical Journal. 100 (11), 2801-2809 (2011).
- Vopalensky, P., Pralow, S., Vastenhouw, N. L. Reduced expression of the Nodal co-receptor Oep causes loss of mesendodermal competence in zebrafish. Development. 145 (5), dev.158832 (2018).
- Kishimoto, Y., Lee, K. H., Zon, L., Hammerschmidt, M., Schulte-Merker, S. The molecular nature of zebrafish swirl: BMP2 function is essential during early dorsoventral patterning. Development. 124 (22), 4457-4466 (1997).
- Rogers, K. W., et al. Nodal patterning without Lefty inhibitory feedback is functional but fragile. Elife. 6, e28785 (2017).
- Dubrulle, J., et al. Response to Nodal morphogen gradient is determined by the kinetics of target gene induction. Elife. 4, e05042 (2015).
- Harvey, S. A., Smith, J. C. Visualisation and quantification of morphogen gradient formation in the zebrafish. PLoS Biology. 7 (5), e1000101 (2009).
- Zinski, J., Tuazon, F., Huang, Y., Mullins, M., Umulis, D. Imaging and Quantification of P-Smad1/5 in Zebrafish Blastula and Gastrula Embryos. Methods in Molecular Biology. 1891, 135-154 (2019).
- Gerhardt, K. P., Castillo-Hair, S. M., Tabor, J. J. DIY optogenetics: Building, programming, and using the Light Plate Apparatus. Methods in Enzymology. 624, 197-226 (2019).
- Bugaj, L. J., Lim, W. A. High-throughput multicolor optogenetics in microwell plates. Nature Protocols. 14 (7), 2205-2228 (2019).
- Kumar, S., Khammash, M. Platforms for Optogenetic Stimulation and Feedback Control. Frontiers in Bioengineering and Biotechnology. 10, 918917 (2022).
- Urushibata, H., et al. Control of Developmental Speed in Zebrafish Embryos Using Different Incubation Temperatures. Zebrafish. 18 (5), 316-325 (2021).
- Rogers, K. W., Bläßle, A., Schier, A. F., Müller, P. Measuring protein stability in living zebrafish embryos using fluorescence decay after photoconversion (FDAP). Journal of Visualized Experiments. (95), e52266 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Feldman, B., et al. Zebrafish organizer development and germ-layer formation require nodal-related signals. Nature. 395 (6698), 181-185 (1998).
- Shimizu, T., et al. Cooperative roles of Bozozok/Dharma and Nodal-related proteins in the formation of the dorsal organizer in zebrafish. Mechanisms of Development. 91 (1-2), 293-303 (2000).
- Rebagliati, M. R., Toyama, R., Fricke, C., Haffter, P., Dawid, I. B. Zebrafish nodal-related genes are implicated in axial patterning and establishing left-right asymmetry. Developmental Biology. 199 (2), 261-272 (1998).
- Gritsman, K., Talbot, W. S., Schier, A. F. Nodal signaling patterns the organizer. Development. 127 (5), 921-932 (2000).
- LaBelle, J., et al. TAEL 2.0: An Improved Optogenetic Expression System for Zebrafish. Zebrafish. 18 (1), 20-28 (2021).
- Mruk, K., Ciepla, P., Piza, P. A., Alnaqib, M. A., Chen, J. K. Targeted cell ablation in zebrafish using optogenetic transcriptional control. Development. 147 (12), dev183640 (2020).
- Johnson, H. E., et al. The spatiotemporal limits of developmental Erk signaling. Developmental Cell. 40 (2), 185-192 (2017).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Patel, A. L., et al. Optimizing photoswitchable MEK. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25756-25763 (2019).
- LaBelle, J., Woo, S. Light-Induced GFP Expression in Zebrafish Embryos using the Optogenetic TAEL/C120 System. Journal of Visualized Experiments. (174), e62818 (2021).
- Kainrath, S., Stadler, M., Reichhart, E., Distel, M., Janovjak, H. Green-light-induced inactivation of receptor signaling using cobalamin-binding domains. Angewandte Chemie. 56 (16), 4608-4611 (2017).
- Benman, W., et al. Temperature-responsive optogenetic probes of cell signaling. Nat Chem Biol. 18 (2), 152-160 (2022).
- Reade, A., et al. TAEL: a zebrafish-optimized optogenetic gene expression system with fine spatial and temporal control. Development. 144 (2), 345-355 (2017).
- Putri, R. R., Chen, L. Spatiotemporal control of zebrafish (Danio rerio) gene expression using a light-activated CRISPR activation system. Gene. 677, 273-279 (2018).
- Liu, H., Gomez, G., Lin, S., Lin, S., Lin, C. Optogenetic control of transcription in zebrafish. PLoS One. 7 (11), e50738 (2012).
- Buckley, C. E., et al. Reversible optogenetic control of subcellular protein localization in a live vertebrate embryo. Developmental Cell. 36 (1), 117-126 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten