Method Article
Omurgalı Retinasında İç Nükleer Tabaka Nöronlarını İncelemek için Geliştirilmiş Bir Düz Montaj Preparatı Olarak Bölünmüş Retina
Bu Makalede
Özet
Bu çalışma, fotoreseptör hücre gövdelerinin çıkarılmasının daha hızlı antikor difüzyonu ve immünohistokimya, in situ hibridizasyon ve elektrofizyoloji deneyleri için iç retinal nöronlara gelişmiş yama pipet erişimi sağladığı alternatif bir düz montajlı retina preparatı sunmaktadır.
Özet
Omurgalı retinasının bipolar hücreleri ve yatay hücreleri, fotonlar fotoreseptörler tarafından tespit edildikten sonra görsel bilgiyi işleyen ilk nöronlardır. Işık adaptasyonu, kontrast duyarlılığı ve uzamsal ve renk kontrastı gibi temel işlemleri gerçekleştirirler. Davranışlarını yöneten kesin devre ve biyokimyasal mekanizmaların tam olarak anlaşılması, görsel sinirbilim araştırmalarını ve oftalmolojik tıbbı ilerletecektir. Bununla birlikte, bipolar ve yatay hücrelerin (retinal bütün bağlar ve dikey dilimler) incelenmesi için mevcut preparatlar, bu hücrelerin anatomisini ve fizyolojisini yakalama kapasitelerinde sınırlıdır. Bu çalışmada, fotoreseptör hücre gövdelerini canlı, düz montajlı fare retinalarından çıkarmak için bir yöntem sunuyoruz, verimli yama klempleme ve hızlı immüno-etiketleme için bipolar ve yatay hücrelere gelişmiş erişim sağlıyoruz. Bölünmüş retinalar, izole edilmiş bir fare retinasının iki parça nitroselüloz arasına sıkıştırılması ve ardından nazikçe soyulmasıyla hazırlanır. Ayırma, retinayı dış pleksiform tabakanın hemen üzerine böler ve biri fotoreseptör hücre gövdelerini ve diğeri kalan iç retinayı içeren iki parça nitroselüloz verir. Dikey retina dilimlerinden farklı olarak, bölünmüş retina preparatı, iç retinal nöronların dendritik süreçlerini kesmez, bu da boşluk bağlantısına bağlı ağların ve geniş alanlı amakrin hücrelerin katkılarını entegre eden bipolar ve yatay hücrelerden kayıtlara izin verir. Bu çalışma, elektrofizyoloji, immünohistokimya ve in situ hibridizasyon deneylerinde yatay ve bipolar hücrelerin incelenmesi için bu preparatın çok yönlülüğünü göstermektedir.
Giriş
Retina, ışığın yakalandığı ve beyin tarafından yorumlanabilen elektrokimyasal bir sinyale dönüştürüldüğü arka gözde bulunan ince bir sinir dokusudur. Retinanın arkasında, çubuk ve koni fotoreseptörleri ışıkla uyarılır, bu da nörotransmitterglutamat 1'in tonik salınım oranını azaltır. Glutamat konsantrasyonundaki bu ışığa bağlı değişikliği deneyimleyen ve buna yanıt veren ilk nöronlar, somaları iç nükleer tabakanın (INL) en dış bölgesinde bulunan bipolar hücreler (BC'ler) ve yatay hücrelerdir (HC'ler). Bu ikinci dereceden nöronlar, retinada sinyal işlemenin ilk aşamasını gerçekleştirir ve ışık adaptasyonu, kontrast duyarlılığı ve uzamsal/renk karşıtlığı gibi görüşün kritik özelliklerini şekillendirir2. Bu işlevler BC'lere ve HC'lere atfedilmiş olsa da, bu süreçlerin altında yatan devre ve biyokimyasal mekanizmalar tam olarak anlaşılmamıştır3. Bu nedenle, BC ve HC fizyolojisini keşfetmek için araç ve yöntemlerin geliştirilmesi büyük önem taşımaktadır.
Dikey (enine) retina kesitleri, BC'leri ve HC'leri incelemek için en pratik model olduğunu uzun zamandır kanıtlamıştır; bununla birlikte, BC ve HC fizyolojisinin belirli yönlerine bu model altında deneyci tarafından erişilemez. HC'lerden doğrudan kayıtlar veya BC'ler üzerindeki etkilerinin dolaylı ölçümleri, bu hücrelerin lateral süreçleri dilimleme sırasında kesildiği için retinanın endojen bağlantısını yansıtmaz. Tüm retina preparatları, bu yanal süreçleri koruyarak bu sorunu ortadan kaldırır, ancak çevredeki retina katmanları bu hücrelere erişim için bir zorluk teşkil eder4. Tüm retina yuvasındaki INL nöronlarındanimmün boyama 5,6,7,8 ve yama klemp kayıtları9 ile ilgili çok sayıda örnek olsa da, bu verilerin toplanmasını hızlandırmak ve basitleştirmek için bir fırsat vardır. Enine kesitlerin doğal sınırlamaları ve tüm montaj modelinin zorlukları, bu alternatif düz montajlı retina preparatının geliştirilmesine ilham verdi.
Aşağıdaki çalışma, basitleştirilmiş yama klempleme ve daha hızlı, daha verimli immüno-etiketleme için BC'lere ve HC'lere erişimi geliştirmek için fotoreseptör tabakasını canlı, düz montajlı retinalardan kolayca çıkarmak için bir protokolü açıklamaktadır. İzole edilmiş bir retinanın her iki tarafına bağlı iki nitroselüloz membran parçasının soyulması, dokuyu fotoreseptör aksonları yoluyla yırtarak dış pleksiform tabakayı (OPL) ve tüm iç retina tabakalarını tutan bölünmüş bir retina bırakır. Diğerleri retinanın katmanlarını mekanik olarak ayırmak için protokolleri tanımlamış olsa da, bu yöntemler ya yama klempleme ve mikroskopi uygulamaları için uygun değildir ya da dokunun sıkıcı manipülasyonunu gerektirir. Bu yöntemlerin birçoğu, tabaka ayrımı için donmuş veya liyofilize doku gerektirir, bu da onları elektrofizyoloji deneyleriyleuyumsuz hale getirir 10,11,12. Diğerleri canlı doku için tasarlanmıştır, ancak fotoreseptörleri çıkarmak için filtre kağıdı 4,11 ile 5-15 ardışık peeling veya tripsin 13 ile tedavi gerektirir. Burada açıklanan teknik, fotoreseptör çıkarma prosedürünü basitleştirerek ve aşağı akış uygulamalarının repertuarını genişleterek öncüllerini geliştirir.
Protokol
Farelere su ve yiyecek ad libitum sağlandı ve 12 saatlik bir aydınlık / karanlık döngüsünde tutuldu. Fareler, izoflurana maruz bırakılarak ötenazi ve ardından servikal çıkık yapıldı. Tüm hayvan prosedürleri Ulusal Sağlık Enstitüleri yönergelerine uygundu ve Oregon Sağlık ve Bilim Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylandı.
NOT: Canlı dokunun sağlığını korumak için göz enükleasyonu, retina diseksiyonu ve retina yarması mümkün olduğunca çabuk yapılmalıdır. Diseksiyonu göz başına 4 dakika < tamamlamayı hedefleyin. Bu üç adım sırayla gerçekleştirilmelidir. Yabani tip fareler: Deneyler için yetişkin (>3 ay) erkek ve dişi C57BL / 6J fareler kullanıldı. Sinaps morfolojisi için, Pcp2 promotörü (Pcp2-cre / GFP)14 altında yeşil floresan proteini (GFP) eksprese eden fareler kullanıldı. Transgenik fareler: İmmünohistokimya veya elektrofizyoloji deneyleri sırasında GFP ile yatay hücre görselleştirmesi için üçlü transgenik bir fare kullanıldı: vGATFLPo; vGlut2Cre; Ai80d. vGATFlpo ve vGluT2Cre suşları, ilgili promotörlerinin aşağı akışında Flpo veya Cre rekombinaz eksprese eden knock-in farelerdir. Ai80d faresi, kesişimsel bir raportör faredir (CatCh/EYFP) ve Cre ve Flpo rekombinazlarını eksprese eden hücrelerde yalnızcaCa2+ geçirgen kanal rodopsini (ChR2) eksprese eder. Bu nedenle, üçlü transgenik fare, hem VGAT hem de vGluT2 ekspresyonu öyküsü olan hücrelerde yalnızca ChR2'yi eksprese eder.
1. Retina diseksiyonu ve retina yarılması için materyal hazırlama
- Nitroselüloz membran parçaları hazırlayın
NOT: Bölünmüş retinanın nitroselüloz membrandan ayrılması, mikroskopide arka plan floresansını azaltır ve yama kelepçesi kaydını basitleştirir. Membran kaldırma işlemi doku fiksasyonundan önce veya sonra yapılabilir. Sabit bölünmüş retinalar için, nitroselüloz membran parçalarını tedavi etmek gerekli değildir. Canlı bölünmüş retinalar için, dokudan nazikçe ayrılmayı kolaylaştırmak için zarı 1.1.3 - 1.1.5 adımlarına göre tedavi edin.- 16 adet (veya daha fazla) nitroselüloz membranı 5 mm x 5 mm kareler halinde kesin. Ekstra toplu olarak hazırlanabilir ve ileride kullanılmak üzere saklanabilir.
- Membran parçalarının yarısını daha sonra kullanmak üzere bir kenara koyun. Bu parçalar bir bloke edici çözelti ile muamele edilmeyecektir.
- Kalan parçaları deterjan içermeyen bir IHC bloke edici solüsyonda (%3 at serumu + PBS ile seyreltilmiş %0.025NaN3 gibi) oda sıcaklığında 10 dakika boyunca hafifçe çalkalayarak inkübe edin.
DİKKAT: Güçlü bir toksin olduğu için NaN3'ü kullanırken uygun KKD kullanın. - Membran parçalarını, bikarbonat tamponlu Ames ortamında oda sıcaklığında 10 dakika inkübe ederek hafifçe çalkalayarak iyice yıkayın.
- Tıkalı membran parçalarını tamamen havayla kurutun (~ 20 dk). Membran parçalarını etiketleyin ve oda sıcaklığında saklayın, işlem görmemiş membran parçalarından ayrı tutun.
- Ames medyasını hazırlama
- Bikarbonat tamponlu Ames ortamı hazırlayın ve çözeltiyi sabit karbojenasyon (%95O2 ve% 5 CO2) altında oda sıcaklığında tutun.
2. Fare gözü enükleasyonu
- Fareyi kurumsal IACUC yönergelerine göre mevcut herhangi bir yöntemle ötenazi yapın.
- Fareyi bir tarafa çevirin ve iki parmağınızı kullanarak göz yuvasının etrafına hafifçe bastırın. Bu, gözün kafatasından dışarı çıkmasına neden olur.
- Kavisli diseksiyon makası kullanarak, optik siniri kesmek ve gözü kafatasından ayırmak için şişkin gözün altını kesin.
- Gözü makasla alın ve buz gibi Ames ortamıyla dolu bir Petri kabına yerleştirin.
NOT: Dokunun bölündükten sonra sabitleneceği aşağı akış uygulamaları için, Ames ortamı yerine buz gibi PBS kullanılabilir. - Kalan göz için 2.1 - 2.4 arasındaki adımları tekrarlayın.
3. Retina diseksiyonu
- Bir gözü taze, buz gibi Ames ortamı içeren yeni bir Petri kabına aktarmak için özel cam transfer pipetini kullanın.
NOT: Özel transfer pipetinin geniş açıklığı, dokunun yanlışlıkla ezilmesini önler ve cam kullanılması, dokunun pipetin duvarlarına yapışmasını en aza indirir. Bununla birlikte, deneyci bu aleti kullanma konusunda zaten yetkinse, geniş ağızlı bir plastik transfer pipeti de kabul edilebilir. - Ekstra bağ dokusunu Petri kabının dibine sabitleyerek gözü stabilize etmek için forseps kullanın. Ardından, Vannas makası için bir giriş noktası oluşturmak üzere 25G'lik bir iğne kullanarak gözü ora serrata çizgisi boyunca delin.
- Kornea gözün geri kalanından kurtulana kadar ora serrata çizgisi boyunca kesmek için Vannas makası kullanın (Ek Şekil 1A). Forseps kullanarak lensi vizör lastiğinden çıkarın (Ek Şekil 1B).
- Vizör lastiğini büyük hacimli (≥100 mL) karbojene Ames'e aktarmak için özel cam pipeti kullanın ve kalan gözle 3.1 - 3.3 arasındaki adımları tekrarlayın.
NOT: Diğer göze diseksiyon yapılırken doku sağlığını korumak için göz kapakları karbojene Ames'e yerleştirilir. - Bir vizör lastiğini taze karbonjene Ames ile doldurulmuş bir Petri kabına aktarın.
- Vannas makası kullanarak, skleranın kenarından içe doğru küçük bir kesme yapın, ardından sklerayı retinadan soymak için iki çift forseps kullanın (Ek Şekil 1C). Retinayı forseps ile tutmaktan kaçının. Bunun yerine, makas makası tarafından oluşturulan sklera kanatlarını ayırın.
- Sklera ve retinayı birbirine bağlayan optik siniri kesmek için Vannas makasını kullanın (Ek Şekil 1D), ardından retinayı izole etmek için makas veya forseps kullanarak retinayı skleradan nazikçe kaldırın. (Şekil 1A).
NOT: RPE tipik olarak vizör adaptörüne bağlı kalacak olsa da, retinaya takılması durumunda RPE'yi çıkarmak için ekstra bir adım gerekmez. Bu noktada, düzleştirme adımı sırasında kıvrılmayı önlemek için retinanın kenarları isteğe bağlı olarak bir neşter ile kesilebilir (Şekil 1B). - Retinayı yarıya veya dörde bölmek için bir neşter kullanın (Şekil 1C), ardından parçaları büyük hacimli (≥ 100 mL) sürekli karbonjene Ames ortamına geri döndürmek için özel transfer pipetini kullanın.
NOT: Yarım veya çeyrek seçimi özneldir. İstediğiniz uygulama için en iyi seçeneği seçin. - Retina bölme işlemine geçmeden önce kalan göz için 3.5 - 3.8 arasındaki adımları tekrarlayın.
4. Retina bölünmesi
- Ames ortamını Petri kaplarından atın ve yerine taze karbonjene Ames koyun.
NOT: Retina bölme prosedürünün geri kalanında karbojenasyonu korumak için, Petri kabındaki ortamı kabaca her 5 dakikada bir taze karbonjene Ames ile değiştirin. - Özel transfer pipetini kullanarak, ganglion hücresi yukarı bakacak şekilde bir cam slayt (7.5 cm x 5 cm) üzerine bir retina parçası yerleştirin, ardından çevreleyen sıvıyı hassas bir görev mendiliyle çıkararak düzleştirin (Şekil 1D). Gerekirse, retina kenarlarını diseksiyon mikroskobu altında ince uçlu bir boya fırçasıyla hafifçe çekin.
- Forseps kullanarak 5 mm x 5 mm'lik kuru bir nitroselüloz membran parçasını retinaya indirerek ganglion hücre tarafına yapışmasını sağlayın (Şekil 1E).
NOT: Canlı dokudan zarın çıkarılması gerekiyorsa (yani elektrofizyoloji için), bu adım için serumla işlenmiş kuru bir membran parçası kullanın (ayrıntılar için bkz. adım 1.1.3 - 1.1.5). Bu, ganglion hücre tabakasına yapışma gücünü azaltır ve retinanın bölünme sonrası nitroselülozdan çıkarılmasını kolaylaştırır. - Nitroselüloz cam slayt üzerinde duracak şekilde retinayı ters çevirin ve retinanın fotoreseptör tarafına kuru bir 5 mm x 5 mm membran parçası yerleştirin (Şekil 1F).
- Boya fırçasının ıslanan ucunu iki zar arasındaki boşluğa dokundurun ve kılcal hareketin Ames'i sandviçin içine emmesine izin verin (Şekil 1G). Bu, zarların retinaya yapışmasını azaltır ve yalnızca retina hassas görev mendili ile aşırı kurutulmuşsa gereklidir.
NOT: Retina parlak görünümünü kaybetmişse, aşırı kurumuştur ve adım 4.5 gereklidir. - Düzgün yapışmayı sağlamak için, ıslak bir boya fırçası ile üst membrana aşağı doğru hafif basınç uygulayın (Şekil 1H).
- Alt zarı bir çift forseps ile cama sabitlerken, üst zarı ikinci bir forseps çifti ile nazikçe soymak için yavaş ve sabit bir hareket kullanın. Bu, retinanın OPL'nin hemen üzerinde bölünmesine neden olacaktır (Şekil 1I).
- Fotoreseptörleri içeren üst zarı atın (Şekil 1J, solda). Alt zar, bundan böyle bölünmüş retina olarak adlandırılan iç retinayı içerir (Şekil 1J, sağda).
- Bölünmüş retinayı hemen karbojene Ames ortamına geri döndürün.
NOT: Canlı doku üzerinde yapılan deneyler için, retinalar bölündükten sonra karbojene Ames'te 15-30 dakikalık bir iyileşme süresinden yararlanabilir.

Şekil 1: Bölünmüş retina prosedürü . (A) Soğuk PBS veya Ames ortamında enükleasyon ve göz kapağı hazırlığının ardından, fare retinasını vizör lastiğinden izole edin ve PBS'yi oda sıcaklığında, karbojene Ames ortamı ile değiştirin. (B) Bir neşter kullanarak, içe doğru kıvrılan bölge kalmayana kadar retinanın kenarlarını kesin (isteğe bağlı). (C) Bir neşter kullanarak retinayı dörde veya yarıya bölün. (D) Özel transfer pipetini kullanarak bir cam slayt üzerine (ganglion hücresi tarafı yukarı) bir parça retina yerleştirin ve hassas bir görev mendili kullanarak tüm fazla Ames'i çıkarın. Bir sonraki adıma geçmeden önce yarı kuru retinanın cam üzerinde düz durduğundan emin olun. Retinanın düz olmayan bölgelerini nazikçe açmak için Ames ile ıslatılmış bir boya fırçası ucu kullanın. (E) Forseps kullanarak, düzleştirilmiş retinanın üzerine önceden kesilmiş bir kuru nitroselüloz membran parçası (5 mm x 5 mm) yerleştirin. (F) Nitroselüloz parçasını, retinanın fotoreseptör tarafı şimdi yukarı bakacak şekilde çevirin. Sonra retinanın üzerine başka bir kuru zar parçası yerleştirin. (G) Fırçanın ıslak ucunu iki zar arasındaki boşluğa dokundurun ve kılcal hareketin Ames'i sandviçin içine emmesine izin verin. Bu, zarların retinaya yapışmasını azaltır ve yalnızca retina hassas görev mendili ile aşırı kurutulmuşsa gereklidir. (H) Sıkıştırılmış retinanın ortasına hafifçe aşağı doğru bastırmak için ıslak bir boya fırçası ucu kullanın. (I) Alt membran parçasını cam slayta sabitlemek için bir çift forseps kullanırken, üst membran parçasını alttakinden nazikçe soymak için başka bir forseps kullanın. (J) İç retina (solda) alt zarda kalırken, fotoreseptörler (sağda) üst zarla birlikte çekilir. (A), (B), (C), (D) ve (J) panelleri diseksiyon mikroskobu kullanılarak elde edildi; ölçek çubuğu yaklaşık 1 mm'yi temsil eder; paneller (E-I) büyütme olmadan bir akıllı telefon kamerası ile elde edildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. İmmünofloresan deneyleri için bölünmüş retinaların hazırlanması
NOT: Bölünmüş retina, adım 5.5'e kadar nitroselüloz membrana bağlı kalmaya devam edecektir. Adım 5.1, 5.2, 5.3 veya 5.4'ü tamamlayın, dördü de farklı deneyler için değil.
DİKKAT: Uygun KKD kullanın ve paraformaldehit (fiksatif) kullanırken dikkatli olun.
- Düz montajlı immünofloresan için hazırlık
- Bölünmüş retinayı% 4 paraformaldehit içinde, retinayı tamamen kaplayacak kadar çözelti kullanarak buz üzerinde 30 dakika inkübe edin.
- Bölünmüş retinaları 3-5 mL oda sıcaklığında PBS'de 10x yıkayın. İsteğe bağlı duraklama: Bölünmüş retinalar PBS'de 4 °C'de 24 saate kadar bırakılabilir.
- Bölünmüş retinanın dikey kesitleri ile immünofloresan için hazırlık
- Bölünmüş retinayı% 4 paraformaldehit içinde, retinayı tamamen kaplayacak kadar çözelti kullanarak buz üzerinde 30 dakika inkübe edin.
- Bölünmüş retinaları 3-5 mL oda sıcaklığında PBS'de 10x yıkayın. İsteğe bağlı duraklama: Bölünmüş retinalar PBS'de 4 °C'de 24 saate kadar bırakılabilir.
- Membran hala takılıyken, dokuyu kriyoproteksiyonla korumak için bölünmüş retinayı sırayla %10, %20 ve %30 sükroz içine 4 °C'de 1 saat daldırın.
- Kriyo korumalı bölünmüş retinaları optimum kesme sıcaklığı (OCT) bileşiğine yerleştirin ve kriyoseksiyona kadar -80 °C'de (6 aya kadar) saklayın.
- Gömülü bölünmüş retinaları -80 °C'den çıkarın ve 20 μm kalınlığındaki bölümleri kesmek için bir kriyostat kullanın. Bölümleri elektrostatik olarak yüklü cam mikroskop slaytlarına monte edin, kurumaya bırakın ve ardından -20 °C'de 6 aya kadar saklayın.
- Dual floresan in situ hibridizasyon ve immünohistokimya için hazırlık
- Bölünmüş retinayı% 4 paraformaldehit içinde, retinayı tamamen kaplayacak kadar çözelti kullanarak 2 saat boyunca buz üzerinde inkübe edin.
- Bölünmüş retinaları 3-5 mL oda sıcaklığında PBS'de 10x yıkayın. İsteğe bağlı duraklama: Bölünmüş retinalar PBS'de 4 °C'de 24 saate kadar bırakılabilir.
- Elektrofizyoloji için hazırlık
- Bir mikropipet çektirmesi kullanarak filamentli kalın duvarlı borosilikat cam pipetleri çekerek yama pipetleri hazırlayın. Yalnızca ölçülen direnci 6-10 MΩ arasında olan pipetler kullanın.
- Çekilen pipetleri (mM cinsinden) içeren dahili solüsyonla doldurun: 125 K-glukonat, 8 KCl, 5 HEPES, 1 MgCl 2, 1 CaCl 2,0.2 EGTA, 3 ATP-Mg ve 0.5 GTP-Na.
- Bölünmüş retinanın nitroselüloz membrandan çıkarılması
- Hidrofobik bir bariyer kalemi kullanarak, bir mikroskop lamı (~1 cm çapında) üzerinde dairesel kuyucuklar hazırlayın ve 5-10 dakika kurumaya bırakın.
- Bölünmüş retinaları hazırlanan hidrofobik bariyer kalem yuvalarına yerleştirin ve tamamen kaplayacak kadar PBS ekleyin.
- Diseksiyon mikroskobu altında, ince bir boya fırçasının kıllarını dokunun kenarlarının altına itin ve yavaşça yukarı doğru kaldırın. Bu şekilde, retinayı zardan uzaklaştırmak için bir daire içinde çalışın.
- Zarı yüzen retina parçasının altından çıkarmak için forseps kullanın.
- Kalan PBS'yi dikkatlice aspire edin, böylece retina parçası mikroskop lamı üzerinde, ganglion hücre tarafı aşağı bakacak şekilde durur.
NOT: Aşağıdaki adımlar sırayla gerçekleştirilmemelidir. İstenen uygulama için uygun protokolü seçin (yani, immün boyama veya çift floresan in situ hibridizasyon [FISH] ve immünohistokimya [IHC] veya elektrofizyoloji).
6. İmmün boyama
- Henüz hazırlanmadıysa, bir mikroskop lamı (~1 cm çapında) üzerinde dairesel oyuklar oluşturmak için hidrofobik bir bariyer kalem kullanın ve 5-10 dakika havada kurumaya bırakın. Tüm inkübasyon adımları ve yıkama adımları bu kalem kuyularında gerçekleştirilecektir.
- Bölünmüş retinaları veya dikey bölünmüş retina bölümlerini antikor inkübasyon solüsyonunda (AIS:% 3 at serumu,% 0.5 Triton X-100,% 0.025 NaN3 PBS'de) oda sıcaklığında 30 dakika inkübe edin.
- Bölünmüş retinaları veya dikey bölünmüş retina bölümlerini, oda sıcaklığında 1 saat boyunca AIS içinde seyreltilmiş birincil antikorlarla inkübe edin.
NOT: Primer antikor inkübasyon süresi, farklı protein hedefleri ve antikorlar için optimizasyon gerektirecektir. - Dokuyu oda sıcaklığında 3 kez PBS'de yıkayın.
- Dokuyu oda sıcaklığında 1 saat boyunca AIS içinde seyreltilmiş ikincil antikorlarla inkübe edin. Dokuyu oda sıcaklığında 3 kez PBS'de yıkayın.
- Nükleer boyama isteniyorsa, dokuyu oda sıcaklığında 30 saniye boyunca PBS'de seyreltilmiş DAPI ile inkübe edin. Dokuyu 1 kez oda sıcaklığında PBS'de yıkayın.
- Her bir doku parçasına bir damla slayt montaj ortamı uygulayın ve bir cam lamel monte edin.
- Numuneyi kapatmak için lamel kenarlarına oje sürün. Slaytı 4 °C'de saklayın.
7. Çift FISH ve IHC
- Slayta yapışmayı artırmak için bölünmüş retinaları 40 °C'de bir hibridizasyon fırınında 30 dakika pişirin.
- RNAscope FISH protokolünü aşağıdaki istisnalar ve değişikliklerle üreticinin protokolüne göre tamamlayın:
- Antijen alma basamağı gerekmez. Oda sıcaklığında 18 dakikalık bir inkübasyon süresine sahip proteaz III kullanın.
- Hidrofobik bir bariyer kalemi tarafından yapılan kuyucuklar içindeki slayt üzerindeki tüm yıkama adımlarını gerçekleştirin.
- Numuneleri PBS'de seyreltilmiş primer antikorda (Malzeme Tablosuna bakınız) hibridizasyon fırınında 40 ° C'de 30 dakika inkübe edin. Numuneleri oda sıcaklığında PBS'de 3 kez yıkayın.
- Numuneleri PBS'de seyreltilmiş ikincil antikorda (Malzeme Tablosuna bakınız) hibridizasyon fırınında 40 ° C'de 30 dakika inkübe edin. Numuneleri oda sıcaklığında PBS'de 3 kez yıkayın.
- Numuneleri oda sıcaklığında 30 saniye boyunca 1x DAPI'de inkübe edin. Numuneleri oda sıcaklığında PBS'de 1 kez yıkayın.
- Her bir doku parçasına bir damla solma önleyici montaj ortamı uygulayın ve bir cam lamel takın.
- Numuneyi kapatmak için lamel kenarlarına oje sürün. Slaytı 4 °C'de saklayın.
8. Elektrofizyoloji
- Nitroselüloz membranı çıkardıktan sonra, bölünmüş bir retinayı yama kelepçesi kayıt odasına aktarın ve bir platin arp ile nazikçe yerine sabitleyin.
- Deney boyunca, bölünmüş retinayı %95O2 ve %5CO2 ile karbojene edilmiş Ames çözeltisi ile sürekli olarak perfüze edin. Çözeltiyi 32-34 °C arasında tutun.
NOT: Deney sırasında doku, Dodt gradyan kontrast mikroskobu kullanılarak görselleştirilebilir. - Oda aydınlatması altında, INL nöronlarından kayıt yapmak için tüm hücre voltajı kenetleme gerçekleştirin.
- Kayıt sırasında, farmasötik bileşikleri uygulamak için bir mikro hücresel enjeksiyon ünitesi veya channelrhodopsin'i (ChR2) uyarmak için 470 nm'lik bir LED kullanarak ışık tepkilerini simüle edin.
NOT: Işık yoğunluğu, dijital optik güç ölçer kullanılarak ölçülebilir.
- Kayıt sırasında, farmasötik bileşikleri uygulamak için bir mikro hücresel enjeksiyon ünitesi veya channelrhodopsin'i (ChR2) uyarmak için 470 nm'lik bir LED kullanarak ışık tepkilerini simüle edin.
9. Konfokal mikroskopi
- Konfokal immünofloresan için, 40x/1.3 veya 63x/1.40 yağa daldırma objektifi kullanarak konfokal mikroskopla görüntü alın. Parlaklığı ve kontrastı ayarlamak ve görüntü yığınlarından Z projeksiyonları oluşturmak için FIJI'yi kullanın.
Sonuçlar
Retina bölünmesi fotoreseptör terminallerini korur
Retina bölünmesinin OPL'deki ikinci dereceden nöronların dendritlerine zarar vermediğini doğrulamak için, bölünmüş retinaların dikey bölümleri, sinaptik vezikül proteini sinaptofizin (yeşil) ve protein kinaz C alfa'ya (PKCa; kırmızı) karşı antikorlarla boyandı. Bölünmüş retinanın üst kısmındaki yoğun sinaptofizin etiketleme bandı, fotoreseptör sinaptik terminallerinin korunduğunu gösterir (Şekil 2). Ayrıca, PKCa boyaması çubuk bipolar hücrelerin (RBC'ler) normal morfolojisini ortaya çıkarır. Hiçbir fotoreseptör çekirdeği görünmez, bu da retinanın OPL ile en içteki fotoreseptör hücre gövdeleri arasında bölündüğünü gösterir (Şekil 2).
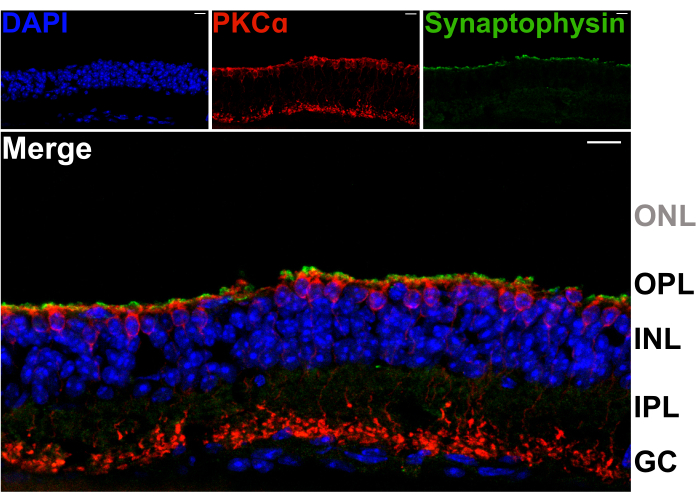
Şekil 2: Bölünmüş retinalar fotoreseptör terminallerini korur. Bölme prosedürünü takiben kriyoseksiyona tabi tutulan (20 μm kalınlıkta) bir tükürük retinasının dikey kesitini gösteren floresan konfokal mikrograflar. Her görüntü, konfokal bir z-yığınının maksimum izdüşümüdür. Kesit, RBC'leri ve sinaptik vezikülleri görselleştirmek için sırasıyla PKCa (üst orta) ve sinaptofizin (sağ üst) antikorları ile immün olarak etiketlendi. Birleştirilmiş görüntü (altta), OPL'deki RBC'lerin (kırmızı) apikal süreçlerinin hemen üzerinde, fotoreseptör terminallerinde bulunan sinaptik vezikülleri (yeşil) göstermektedir. Hücre çekirdekleri DAPI (mavi) ile etiketlenmiştir. ONL içinde hiçbir fotoreseptör çekirdeği görünmez. Kısaltmalar: ONL = dış nükleer katman; OPL = dış pleksiform tabaka; INL = iç nükleer katman; IPL = iç pleksiform tabaka; GC = ganglion hücreleri. Ölçek çubukları = 10 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
OPL'deki sinaps morfolojisi, retina bölünmesinden sonra korunur
PCP2 promotörü14 altındaki RBC'lerde GFP'yi eksprese eden bir fare kullanılarak, OPL'deki sinaptik öncesi ve sonrası proteinler, bir bölünmeyi takiben bu sinaptik tabakanın bütünlüğünü değerlendirmek için immüno-etiketlendi14. Fotoreseptörlerin aksonları aracılığıyla meydana gelen kesme kuvvetlerine rağmen, RGS11 için etiketlenmiş RBC dendritlerinin ve CtBP215 için etiketlenmiş fotoreseptör sinaptik şeritlerinin normal konumlandırılması gözlendiğinden, bölünme OPL'deki fotoreseptör-BC sinapslarının morfolojisini bozmaz (Şekil 3). Çubuklar ve RBC'ler arasındaki her sinaptik temas için, RGS11, sinaptik şeritlerin (yeşil) at nalı şeklinde yer alan kırmızı punkta olarak görülebilir. Daha sonraki bir deneyde, post-sinaptik ON-BC dendritik uçlarını16 etiketlemek için bir anti-GPR179 antikoru16 kullanıldı ve pre-sinaptik çubuk fotoreseptör terminallerini etiketlemek için bir anti-PSD-95 antikoru kullanıldı (Ek Şekil 2). Bu sonuçlar, bölünmüş retina preparatında OPL'nin stabilitesini tekrar doğrulamaktadır, çünkü RBC dendritlerinin pre-sinaptik partnerleri olan çubuk terminalleri ile yakından ilişkili olduğu gösterilmiştir.
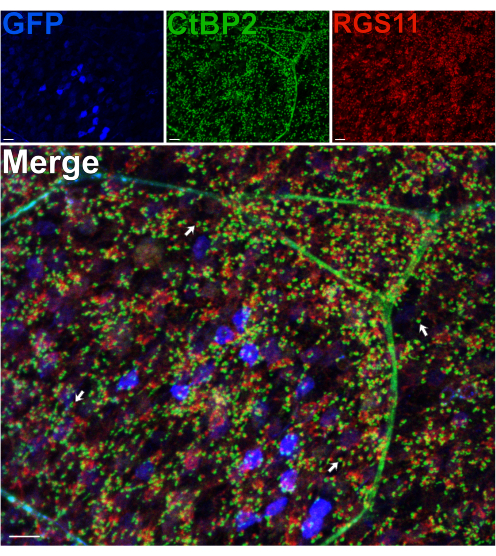
Şekil 3: OPL'deki sinaps morfolojisi, retina bölünmesinden sonra korunur. Pcp2 promotörü altındaki RBC'lerde GFP'yi eksprese eden transgenik bir fareden bölünmüş bir retinanın konfokal immünofloresan görüntüleri. GFP ekspresyon seviyeleri (mavi) retinadaki RBC'ler arasında değişir. Bölünmeyi takiben, retina sabitlendi, daha sonra fotoreseptör sinaptik şeritlerini ve ON-BC dendritik uçlarını etiketlemek için sırasıyla CtBP2 (yeşil) ve RGS11'e (kırmızı) karşı antikorlarla inkübe edildi. Her kırmızı-yeşil çift, bir çubuk ve bir ON-BC arasındaki sinaptik teması temsil eder. Ölçek çubukları = 10 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Retina bölünmesi RBC canlılığını korur
Bir bölünmeden sonra iç retinal nöronların canlılığını değerlendirmek için, ölü hücrelerin tanımlanmasını sağlayan bir membran geçirimsiz, yakın kızılötesi nükleer boya (MI-NIR) kullanıldı. MI-NIR ile inkübasyondan sonra, bölünmüş retinalar sabitlendi, daha sonra RBC'leri tanımlamak için anti-PKCa ile etiketlendi. Bölünmüş retinanın konfokal mikrografları, doku boyunca hücre canlılığında bölgesel değişkenliği ortaya çıkarır ve bazı bölgeler diğerlerinden daha yüksek hücre ölümü oranları yaşar. Bu değişkenlik, diseksiyon, bölme veya taşıma prosedürleri sırasında retinanın belirli bölgelerine verilen hasardan kaynaklanabilir (Şekil 4). RBC'lerin hücre gövdelerinin, INL'nin en dış bölgesinde, bölünme bölgesine yakın olduğu göz önüne alındığında, canlılıklarının dikkatli bir şekilde değerlendirilmesi garanti edildi. PKCa ve MI-NIR'ın kıt kolokalizasyonu, çoğu RBC'nin retina bölünmesinden sonra canlı kaldığını doğruladı (Şekil 4).
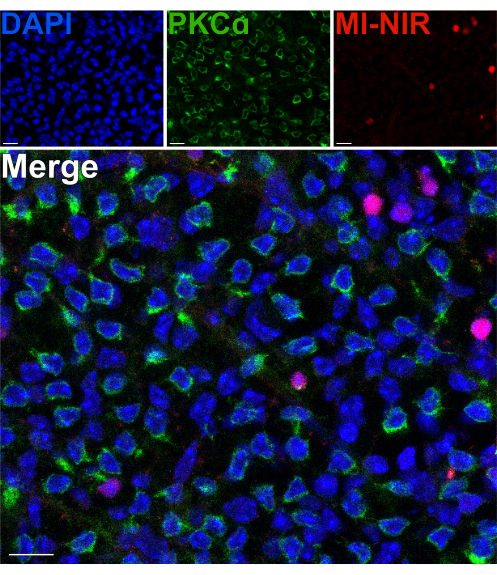
Şekil 4: Çubuk bipolar hücreler retina bölünmesinden sonra yaşayabilir. Düz bir perspektifte bölünmüş retinanın bir bölgesini gösteren floresan konfokal mikrograflar. Bölündükten sonra, canlı retina 37 ° C'de 30 dakika boyunca MI-NIR boyası (kırmızı) ile inkübe edildi. Retina daha sonra sabitlendi ve RBC'leri görselleştirmek için PKCa'ya karşı antikorlarla immüno-etiketlendi. Retinanın bu bölgesinde, PKCa ve MI-NIR'ın kolokalizasyonu nadirdir. MI-NIR, ERITROSITLERE ait olmayan çekirdeklerle (mavi) birlikte lokalize olur. Kısaltmalar: MI-NIR = membran geçirimsiz NIR canlı/ölü leke. Ölçek çubukları = 10 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bölünmüş retinalar ikili FISH ve IHC'ye uygundur
Standart IHC için fiksasyon süresini uzatarak, bölünmüş retinalar, mRNA'ları ve proteinleri aynı anda etiketlemek için FISH ve IHC tarafından sırayla işlenebilir17,18. Deneyler, %4 paraformaldehitte 2 saatlik bir fiksasyonun, antikor bağlanması için protein epitoplarını korurken sağlam mRNA etiketlemesi sağladığını doğruladı. FISH, dış INL'deki RBC'lerin (anti-PKCa antikoru) konumu ile ilişkili olarak GABAA reseptör alt birimi δ (GABRD; anti-sens mRNA probları) ekspresyonunu görselleştirmek için bölünmüş retinalarda ve ardından IHC üzerinde gerçekleştirildi (Şekil 5A). GABRD mRNA ekspresyonu RBC'lerde nadir görülür (Şekil 5A); bununla birlikte, transkript, sağlam bir retinadan enine kesitler üzerindeki etiketleme deseni ile kanıtlandığı gibi, amakrin hücreler ve ganglion hücreleri tarafından bol miktarda eksprese edilir (Şekil 5B). Dış INL'de (Şekil 5A), GABRD mRNA, farklı hücrelerde konsantre olduğu iç INL'ye (Şekil 5C) kıyasla daha eşit dağılmıştır. Diğer GABA reseptör alt birimlerini hedef alan antisens problar, probların özgüllüğünü gösteren farklı etiketleme modelleri üretir (veriler gösterilmemiştir).
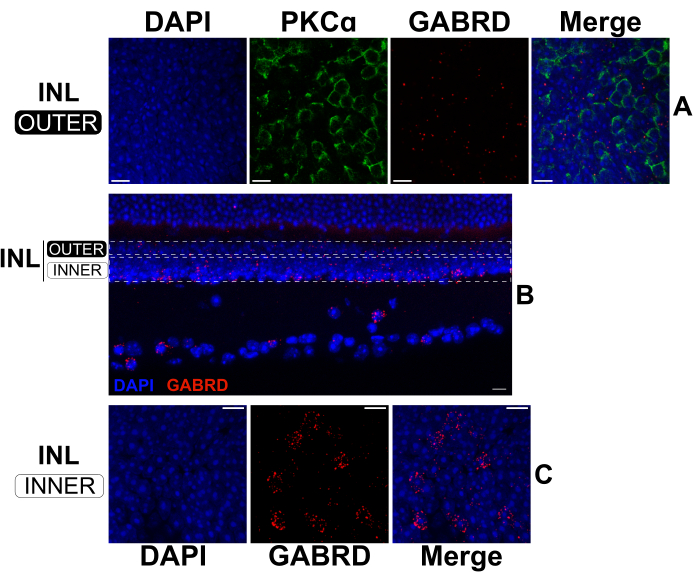
Şekil 5: Bölünmüş bir retinada ve sağlam bir retinada ikili FISH ve IHC. (A, C) Düz montajlı bölünmüş retinanın konfokal mikrografları ve (B) sağlam bir retinadan dikey bir kesit. (A) ve (C)'deki görüntüler, sırasıyla INL'nin üst ve alt bölgelerindeki optik bölümlerin maksimum izdüşümleridir. (B)'deki noktalı dikdörtgenler, (A) ve (C)'de gösterilen çıkıntıları oluşturmak için kullanılan yaklaşık sınırları temsil eder. Bölünmüş retina (A, C) 2 saat boyunca sabitlendi, daha sonra GABRD'ye (kırmızı) karşı antisens mRNA probları ile etiketlendi. Daha sonra, bölünmüş retina, RBC'leri (yeşil) etiketlemek için PKCa'ya karşı antikorlarla boyandı. PKCα kanalı, netlik için alt INL'nin projeksiyonlarından çıkarıldı. (B)'deki sağlam retina, kesit alınmadan önce 24 saat boyunca sabitlendi. Daha sonra, sabit retina GABRD'ye (kırmızı) karşı antisens mRNA probları ile işaretlendi. Tüm numuneler, lamel montajından önce 20 saniye boyunca DAPI (mavi) ile boyandı. Kısaltmalar: INL = iç nükleer katman. Ölçek çubukları= 10 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bölünmüş retinalar, BC'lerden ve HC'lerden yama klemp elektrofizyoloji kaydı için çok uygundur
Geleneksel bir bütün retina yuvasına bir BC veya HC soma yama yapmak için, pipetin ganglion hücre tarafından veya fotoreseptör tarafından yaklaşması gerekir. Her iki yaklaşım da INL'ye ulaşmak için birkaç retina katmanının geçilmesini gerektirir ve bu sırada pipet ucu genellikle döküntüler tarafından tıkanır. Bir vibratom dilimi preparatında, BC ve HC somalarına kolayca erişilebilir, ancak dendritik süreçleri kopabilir ve yanal bağlantılarını bozabilir. Bununla birlikte, bölünmüş retinalarda, RBC'lerin ve HC'lerin hücre gövdeleri doku yüzeyinde bulunur ve OPL'nin yanal devresini korurken yama pipetlerine büyük ölçüde gelişmiş erişim sağlar.
Şekil 6, bölünmüş bir retinada BC'lerden kaydedilen kimyasal olarak simüle edilmiş ışık tepkilerini göstermektedir. Perfüze Ames ortamı, karanlıkta fotoreseptörlerden glutamat salınımını simüle etmek için bir grup III mGluR agonisti olan L-AP4 (4 μM) ile desteklendi. mGluR6 antagonisti, CPPG (Ames cinsinden 600 μM), mGluR6'nın inhibisyonu yoluyla bir ışık parlamasını simüle etmek için yamalı hücrenin (-60 mV'de tutulan) dendritleri üzerine şişirildi. Hücreler, CPPG nefeslerine iki tip içe doğru akımla yanıt verdi. Bir tip, retina dilimlerinde RBC'lerden kaydedilen kanonik ışıkla uyarılmış akımlara benzer şekilde, bir plato (Şekil 6A) tarafından takip edilen bir geçici akımı gösterir19. Diğer tip, ON koni bipolar hücrelerden (ON-CBC) kaydedilen akımlara benzeyen, şişme süresi boyunca (Şekil 6B) sürdürülür (Şekil 19).
Dilim preparatlarında korunması genellikle zor olan geniş bir dendritik alana sahip bir hücre tipi olan HC'leri hedeflemek için ayrı bir deney yapıldı. Floresan mikroskobu altında kolay tanımlamayı kolaylaştırmak için HC'lerde kanal rodopsin (ChR2) ve GFP'yi eksprese eden bir fare hattı kullanıldı. İlk olarak, HC'lerden gelen akımlar, bir dizi depolarizasyon adımına (-100 mV ila 50 mV, adım boyutu = 15 mV) yanıt olarak kaydedildi ve bunlara içe doğru akımlar ve ardından dış akımlar geldi (Şekil 6C). Bu hücreler daha sonra iki hücrede büyük, ChR2 güdümlü içe doğru akımlar üreten kısa bir mavi ışık darbesi (200 ms, 470 nm) ile uyarıldı (Şekil 6D).
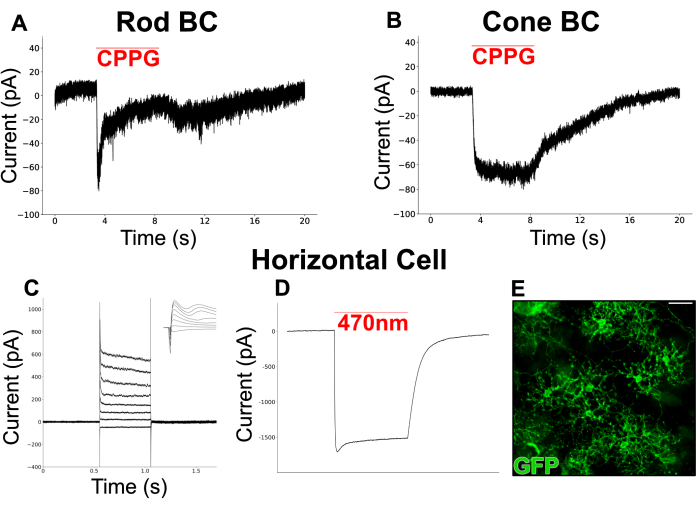
Şekil 6: Bölünmüş retinalardaki INL nöronlarından yama klemp kayıtları . (A) Varsayılan bir RBC ve (B) CBC, L-AP4 (4 μM) içeren perfüze Ames ortamında -60 mV'de voltajla kenetlendi. CPPG'nin (600 μM) klemplenmiş hücrelerin dendritleri üzerine şişirilmesi, RBC'de geçici olan ancak CBC'de sürdürülen içe doğru bir akımı çağırdı. (A)'daki RBC kaydı tek bir iz iken, (B)'deki CBC kaydı 3 izin ortalamasını temsil eder. (C) Bir vGATFLPo'daki bir HC'den bir yama kelepçesi kaydı; vGlut2Cre; Ai80d fare. Kırmızı çizgi, ChR200 üzerinden büyük, içe doğru akımı çağırmak için kullanılan 470 ms, 2 nm ışık darbesinin süresini gösterir. (D) -60 mV'de voltaj kenetlenmiş, daha sonra 15 mV aralıklarla -70 mV ile +35 mV arasında adım atan ve -60 mV'a geri dönen bir HC'den enjekte edilen akım yanıtları. Ek, voltaj adımının başlangıcını çevreleyen 6 ms'lik bir pencerede aynı izleri gösterir. (E) Bir vGATFLPo'da GFP'yi eksprese eden yatay hücreleri gösteren düz montajlı bölünmüş retinanın immünofloresan mikrografı; vGlut2Cre; Ai80d fare. Ölçek çubuğu = 20 μm. Elektrofizyoloji verileri 20 kHz örnekleme hızında toplanmış ve 5 kHz'de alçak geçiren Bessel filtre ile filtrelenmiştir. Veriler daha sonra dışa aktarıldı ve Python 3 kullanılarak çevrimdışı görselleştirme ve analiz gerçekleştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Retina bölünmesi, INL ve OPL anatomisinin hızlı bir şekilde sorgulanmasını sağlar
Retinanın dış sınırlayıcı membranı (ELM) ve ONL, antikorların iç retinaya difüzyonunu engelleyen ve optimal olmayan immün boyama koşulları yaratan ~90 μm kalınlığında bir bariyer içerir20,21,22. Bu nedenle, konvansiyonel düz montajlı retina kullanan OPL veya INL'deki immüno-etiketleme hedefleri, genellikle 48-96 saat antikor inkübasyonlarıgerektiren zaman yoğun boyama protokolleri gerektirir 5,6,7,8,20,22.
Fotoreseptörlerin çıkarılması, iç retinal nöronların hızlı antikor penetrasyonuna izin verir. Sonuç olarak, retina içi protein hedeflerinin etiketlenmesi, boya konjuge primer antikorların kullanılmasıyla 1 saat gibi kısa bir sürede gerçekleştirilebilir. PKCa ve Calbindin-D'ye karşı antikorlar, sırasıyla INL'nin RBC'lerini ve HC'lerini etiketlemek için kullanıldı (Şekil 7). Geniş alanlı nöronların yanal süreçlerini kesen geleneksel dikey retina kesitlerinin aksine, bölünmüş retina preparatı, HC'ler gibi geniş alanlı hücrelerin tam dendritik çardağının görselleştirilmesini sağlar (Şekil 6E, Şekil 7).
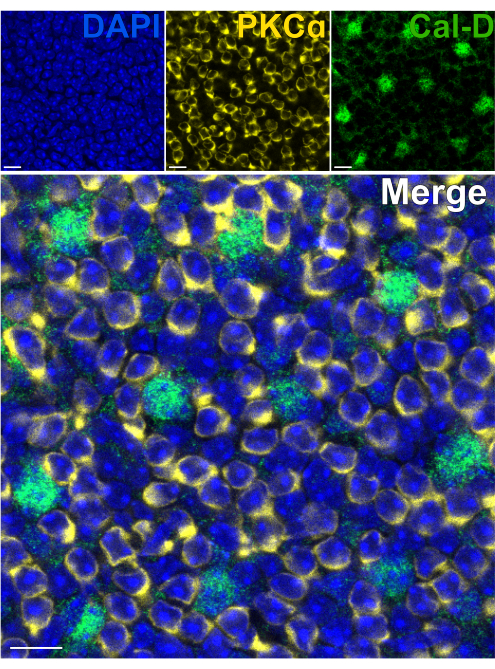
Şekil 7: Bölünmüş bir retinada iç retina proteinlerinin hızlı immüno-etiketlemesi. Düz bir perspektiften bölünmüş bir retinanın konfokal immünofloresan görüntüleri. Bölünmüş retina, sırasıyla ON-BC'leri ve HC'leri etiketlemek için oda sıcaklığında 1 saat boyunca PKCa (sarı) ve Calbindin-D'ye (yeşil) karşı antikorlarla inkübe edildi. (A) Her bir kanal görüntüsü, dört optik bölümden oluşan ortalama bir Z-projeksiyonudur: DAPI, Ortalama z10-13; Calbindin-D, Ortalama z11-14; PKCα, Ortalama z11-14. (B) Birleştirilen görüntüde, aynı çıkıntılar üst üste bindirilir. Ölçek çubukları = 10 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Retina diseksiyonunun temel aşamaları. Tüm görüntüler, diseksiyon mikroskobunun oküler lenslerine monte edilmiş bir akıllı telefon kamerası ile çekildi. (A) Korneanın çıkarılmasını takiben bir fare gözünün yukarıdan aşağıya görüntüsü. (B) Lens çıkarıldıktan sonra fare vizör lastiğinin yukarıdan aşağıya görüntüsü. (C) Fare vizör lastiğindeki sklerada küçük bir kesi yapılır. Oklar, retinayı skleradan ayırmaya başlamak için forseps tarafından zıt yönlerde çekilen skleranın iki kanadını gösterir. (D) Sklera retinadan kısmen çekildikten sonra, Vannas makası sklera ve retina arasına sokulur ve optik sinir kesilerek retina serbest bırakılır. Kırmızı noktalı daire optik sinir başını gösterir ve makas doğru kesme yörüngesini gösterir (sklera ve retina arasına makas yerleştirin). Sklera sonrası izole retina uzaklaştırılır. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 2: Bölünmüş retinada OPL'nin sinaptik öncesi ve sonrası bileşenlerinin karakterizasyonu. Bölünmüş bir retinada OPL'den konfokal immünofloresan görüntüler. Bölünmüş retina, sırasıyla ON-BC'lerin dendritik uçlarına ve çubuk fotoreseptörlerinin terminallerine etiketlemek için oda sıcaklığında 1 saat boyunca GPR179 ve PSD95'e karşı antikorlarla inkübe edildi. Sol ve orta görüntüler, birkaç optik bölümün maksimum izdüşümleridir; Aynı çıkıntılar en sağdaki resimde üst üste bindirilir. ON-BC dendritik uçlarındaki GPR179 punktasının, OPL içindeki sağlam sinaptik temasları gösteren, çubuk fotoreseptör terminalleri ile yakın ilişki içinde olduğu görülmektedir. Ölçek çubukları = 10 μm. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 3: Sorun giderme: bölünmüş retinanın kalitesinin değerlendirilmesi. Hücre çekirdeklerini görselleştirmek için DAPI ile boyanmış bölünmüş bir retinanın floresan mikrografları. Hücreler, çekirdeğin çapına ve doku derinliğine göre tanımlanabilir. (A) Fotoreseptör çekirdekleri daha küçük, daha parlak ve daha yüzeyselken, (B) BC çekirdekleri daha büyük, daha sönük ve daha derindir. (C) Fotoreseptörlerin tam olarak çıkarılmadığı bir bölgenin düşük büyütmeli görüntüsü. Odakta görünen çekirdekler, görüntünün odak dışında görünen kenarlarındaki fotoreseptör çekirdeklerinden daha derin olan BC'lerdendir. (A) ve (B) için ölçek çubukları = 20 μm. (C) = 50 μm için ölçek çubuğu. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Fotoreseptörler foton absorpsiyonunu nörotransmitter salınımına dönüştürdükten sonra, BC'ler ve HC'ler görsel sinyali işleyen ilk retinal nöronlardır23. Bu nöronların önemi iyi takdir edilmekle birlikte, işlevlerinin çoğu tam olarak anlaşılmamış veya tamamen keşfedilmemiştir. Birçok BC ve HC fizyoloji çalışması, yanal bağlantıyı korurken INL nöronlarına erişimi iyileştiren düz montajlı bir retina preparatından faydalanabilir. Bölünmüş retina yönteminin geliştirilmesi, düz montaj oryantasyonunda BC'lerden ve HC'lerden yüksek kaliteli elektrofizyolojik kayıtlar ve mikroskopi verileri elde etmek için kolay bir protokol sağlama çabasını temsil eder. Burada tarif edilen bölünmüş retina hazırlığı, özel ekipman kullanılmadan retina izolasyonunu takiben fare başına yaklaşık 20 dakika (retina başına 10 dakika) içinde gerçekleştirilebilir. Yöntem, mevcut fotoreseptör çıkarma prosedürlerinden ilham alır, ancak basitlik, hız ve çok yönlülükte önemli gelişmeler sunar 4,10,11,12,13. Retina katmanlarını ayırmak için önceki yöntemlerin aksine, retina bölme, retinaya dondurulması, liyofilizasyon veya tekrar tekrar yapıştırıcı uygulanmasını gerektirmez. Uygulamada, neredeyse tüm fotoreseptörler nitroselüloz membran ile tek bir gözyaşı ile çıkarılabilir. Bu yaklaşımın hızı ve kolaylığı, retinanın karbojene Ames'ten geçirdiği süreyi en aza indirerek uzun süreler boyunca yüksek hücre canlılığı sağlar; bölünmüş retinalar, bölünmeden sonra birkaç saat boyunca karbojene Ames ortamında tutulabilir. Bu preparattaki INL nöronlarının sağlığının bir kanıtı olarak, bir canlı/ölü hücre boyası (Şekil 4) ve yama-kelepçe elektrofizyolojisi (Şekil 6), bir bölünmeyi takiben RBC'lerin ve HC'lerin yaşayabilirliğini doğrular.
Bölünmüş retinalarda fotoreseptör tabakasının çıkarılması, antikorların INL'ye difüzyon süresini önemli ölçüde azaltarak immünoişaretleme sırasında önemli bir avantaj sağlar. Birincil ve ikincil antikor etiketlemesi 2 saat içinde tamamlanabilir, bu da hedefe bağlı olarak 72 saat veya daha uzun sürebilengeleneksel düz montajlı boyamaya göre önemli bir gelişme 5,6,7,8,20,22. Sonuç olarak, mikroskopi verileri doku hazırlığı ile aynı gün elde edilebilir ve bu da immünofloresan deneylerinin hızını büyük ölçüde hızlandırır. mRNA prob tavlamasını kolaylaştırmak için, FISH deneyleri tipik olarak immünoetiketlemeden çok daha uzun fiksasyon süreleri (~ 24 saat) önerir18. Bununla birlikte, burada sunulan deneyler, 2 saatlik bir fiksasyonun hala istisnai FISH etiketlemesi ürettiğini göstermektedir (Şekil 5). Fiksasyon süresinin 30 dakikadan 2 saate uzatılmasına rağmen, mükemmel immüno-etiketleme elde etmek için antijen alma adımlarının gerçekleştirilmesi gerekli değildi, ancak bu antikor veya antijene göre değişebilir. FISH protokolündeki proteaz tedavisi, muhtemelen hedef epitopların yok edilmesi nedeniyle antikor etiketlemesine müdahale edebilir. Bu sorun, birden fazla epitopu hedef alan poliklonal antikorlar kullanılarak aşıldı ve epitop yıkımının immüno-etiketlemeyi engelleme olasılığını azalttı. Ek olarak, yeterli doku penetrasyonu sağlarken aşırı epitop değişikliğini önlemek için orta derecede bir proteaz tedavisi (ACD proteaz III) kullanıldı.
Bazen, retina bunun yerine dış nükleer tabakadan (ONL) bölünür ve INL hücreleri görünmeyen fotoreseptör soma katmanlarını geride bırakır. Bunu önlemek için, retinanın cam üzerinde tamamen düz durduğundan ve retinanın etrafındaki kalıntı sıvının çıkarıldığından emin olunmalıdır. Boya fırçası ile nitroselülozun üzerine daha sıkı bastırmak da ONL'den ayrılmayı önlemeye yardımcı olabilir. Zar çok ıslanırsa veya retina kendi üzerine katlanırsa, başarılı bir bölünme şansı büyük ölçüde azalacaktır. Hücre çekirdeklerini boyamak için DAPI kullanmak, bölünmenin kalitesini değerlendirmek ve kalan fotoreseptörlerin kapsamını belirlemek için yararlıdır. Fotoreseptör çekirdekleri daha küçük, daha parlak ve daha yüzeyseldir (Ek Şekil 3A), BC çekirdekleri ise daha büyük, daha sönük ve daha derindir (Ek Şekil 3B). Bazı durumlarda, yırtılma düzlemi retina parçası boyunca biraz değişecek ve bu da fotoreseptör hücre gövdelerinin tamamen çıkarılmadığı yamalara neden olacaktır (Ek Şekil 3C). Mikroskopi ve elektrofizyoloji uygulamaları için bu, fotoreseptörlerin uygun şekilde çıkarıldığı bölgelerden kaliteli veri toplama yeteneğini engellemez; Açıkta kalan iç retinanın geniş alanları, bir yama pipeti ile görüntüleme veya kayıt yaparken kolayca bulunabilir. Daha tam fotoreseptör çıkarılması isteniyorsa, ek bir nitroselüloz membran parçası ile ikinci bir yırtılma gerçekleştirilebilir, ancak %100 fotoreseptör çıkarılması garanti edilmez. Bu nedenle, artık fotoreseptör materyalinin sonuçları etkileyebileceği gen ekspresyonu veya proteomik çalışmalarda bölünmüş retinalar kullanılırken dikkatli olunması önerilir. Tek hücreli uygulamalar için, fotoreseptörlerden gelen veriler analizden çıkarılabileceğinden, bu endişe yersizdir.
Bölünmüş retina preparatının avantajları belki de en çok geniş alan internöronlarının elektrofizyolojik kayıtlarında belirgindir. Geleneksel dikey dilimler, geniş alanlı hücrelerin kapsamlı süreçlerini keserken, bölünmüş retina preparatı, OPL ve IPL'yi olduğu gibi bırakır ve HCs 24, A17s25, TH ACS 26 ve NOS-1 ACS27 gibi geniş alan hücrelerinden girdi yakalamaya izin verir. Bu nedenle, sonuçların yorumlanması ve retina dilimlerinden toplanan önceki verilerle karşılaştırılması dikkatli düşünmeyi gerektirir. Bununla birlikte, ışık stimülasyonunun farmakolojik taklitlerini kullanan deneylerde, bu sonuçlar retina dilimlerinden kaydedilen verilere benzemektedir19. ChR2'yi hücreye özgü promotörler altında eksprese ederek, istenen hücrenin dikey bilgi yolu üzerindeki etkisini araştırmak için INL'deki BC'lerden kayıt yaparken istenen bir hücre popülasyonu uyarılabilir. Amakrin hücreler gibi daha derin INL nöronlarından doğrudan kayıt, bölünmüş retinada da mümkündür. Bu durumda, yama elektrodunun önce daha yüzeysel INL nöronlarından geçmesi gerekirken, geleneksel bir tam montaj preparatına kıyasla yolunu tıkayan önemli ölçüde daha az doku vardır.
Bu yöntem, geniş alan hücrelerinin diğer nöronlar üzerindeki etkisini ölçmeye ek olarak, dendritleri OPL28'de geniş bir boşluk-bağlantı bağlantılı ağ oluşturan HC'lerden doğrudan tek hücreli yama klemplemesini sağlar. Yatay hücreler, retina yoluyla dikey bilgi iletimini şekillendiren fotoreseptörlere kritik geri bildirim gönderir. Bununla birlikte, HC'lerin dendritik alanları dikey dilimler halinde kesildiğinden, tek hücreli kayıt verileri eksiktir. Bu çalışma, ChR2 ile uyarılmış akımların üçlü bir transgenik fare hattında kaydedildiği anatomik ve fizyolojik olarak bozulmamış HC'leri sunmaktadır (Şekil 6 C-E). ChR2 stimülasyonunun dışında, bölünmüş retina endojen HC akımlarını ve boşluk bağlantı bağlantısı28'i incelemek için kullanılabilir. Bölünmüş retina, kimyasal uygulama veya ChR2 stimülasyonu ile indüklenen sinaptik bağlantı ve nöronal aktiviteyi incelemek için uygun bir model sağlarken, fotoreseptörlerin eksikliği, doğal ışık tepkilerinin veya ışık adaptasyon mekanizmalarının doğrudan araştırılmasını engeller.
Retinada in situ görüntüleme son yıllarda takdire şayan bir ilerleme kaydetmiştir. Bununla birlikte, görüntüleme çalışmalarının çoğu, tüm retina preparatlarında ganglion hücre tabakası ile sınırlıdır29. Yazarlar, bölünmüş retinada fotoreseptörlerin yokluğunun, onu OPL ve INL'de canlı kalsiyum görüntüleme için ideal bir model haline getireceğini öngörmektedir. Kalsiyum görüntülemenin ötesinde, bu model iGluSnFR30,31, iGABASnFR32 ve pHluorin 33 gibi genetik olarak kodlanmış biyosensörlerle kullanım için büyük bir potansiyele sahiptir. Bölünmüş retina preparatı ile birleştiğinde, bu güçlü araçlar, retinada ışık işlemeye katkıda bulunan BC'lerin ve HC'lerin sinaptik etkileşimlerini ve biyofiziksel özelliklerini keşfetmek için etkili bir yaklaşım sunabilir.
Açıklamalar
Yazarlar hiçbir rakip mali çıkar beyan etmemektedir.
Teşekkürler
Bu çalışma aşağıdaki NIH hibeleri ile desteklenmiştir: NIH hibe R01EY031596 (CM'ye); NIH hibe R01EY029985 (CM'ye); NIH hibe P30EY010572 (CM'ye); NIH hibe R01EY032564 (BS'ye). Retina kesitlerinin hazırlanmasındaki teknik desteği için Tammie Haley'e ve bu çalışmada kullanılan mRNA FISH problarına cömertçe katkıda bulunduğu için Dr. Charles Allen'a teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| #1.5 glass coverslips | Fisherbrand | 12544E | |
| 2 pairs of Dumont #5 forceps | Ted Pella | 38125 | |
| 25 gauge needle | Becton Dickenson | 305122 | |
| 470 nm LED | THORLABS | M470L2 | |
| 5-306 curved scissors | Miltex | 5-306 | |
| 9" disposable pasteur pipetes | Fisherbrand | 13-678-20D | for constructing custom transfer pipette |
| Ai80d mouse | Jackson Laboratories | 25109 | RRID: IMSR_JAX:025109 |
| Ames Medium w/L-Glutamate | US Biological | A1372-25 | |
| amplifier control software | Molecular Devices | Clampex 10.3 software | |
| anti-calbindin D28K antibody | Invitrogen | PA-5 85669 | RRID: AB_2792808, host species = rabbit; 1:100 dilution |
| anti-CtBP2 antibody | BD Biosciences | 612044 | RRID: AB_399431, host species = mouse; 1:5000 dilution |
| anti-GPR179 antibody | NA | NA | gift from Kirill Martemyanov; Scripps Research Institute, Jupiter, FL; host species = sheep; 1:1000 dilution |
| anti-PKC alpha antibody | Sigma-Aldrich | P4334 | RRID: AB_477345, host species = rabbit; 1:5000 dilution |
| anti-PKC alpha antibody | Santa Cruz Biotechnology | sc8393 AF594 | RRID: AB_628142, host species = mouse; 1:1000 dilution |
| anti-PSD95 antibody | BD Transduction Laboratories | 610495 | RRID: AB_397862, host species = mouse; 1:1000 dilution |
| anti-RGS11 antibody | NA | NA | gift from Ted Wensel; Baylor College of Medicine, Houston, TX; host species = rabbit; between 1:1000 and 1:5000 dilution |
| anti-Synaptophysin P38 antibody | Sigma | S-S5768 | RRID: AB_477523, host species = mouse; 1:1000 dilution |
| Aquamount mounting media | Epredia | 13800 | slide mounting media |
| C57BL/6J mouse | Jackson Laboratories | 000664 | RRID: IMSR_JAX:000664 |
| carbogen tank | Matheson | NA | 95% O2 and 5% CO2 |
| custom transfer pipette | custom build | NA | Instructions: use scissors to cut off the tip of a plasitc transfer pipette at the point it begins to taper. Use pliers to safely break off the last 2-3 inches of a glass pasteur pipette. Fit the narrow end of the glass pasteur pipette into the wide tip of the plastic transfer pipete. Wrap parafilm around the joint of the two pieces to enhance the seal. |
| Digitical optical power meter | THORLABS | PM100D | |
| dissection microscope | Zeiss | Stemi 2000 | |
| electrophysiology amplifier | Molecular Devices | Axopatch 200B | |
| electrophysiology microscope | Olympus | OLYMPUS, BX50WI | Dodt gradient contrast microscopy |
| Fluoromount-G | SouthernBiotech | 0100-01 | |
| HC PL APO CS2 40x/1.3 | Leica | 506358 | |
| HC PL APO CS2 63x/1.40 | Leica | 15506350 | |
| Hybridization oven | Robbins Scientific | Model 1000 | for RNAscope protocol only |
| Immedge hydrophobic barrier pen | Vector Laboratories | H-4000 | |
| isoflurane | Piramal Critical Care | 66794-017-25 | |
| Kimwipe (delicate task wipe) | Kimtech Science | 34155 | |
| Leica HC PL APO CS2 40x/1.3 oil immersion objective | Leica | 506358 | |
| Leica HC PL APO CS2 63x/1.40 oil immersion objective | Leica | 15506350 | |
| Leica TCS SP8 X confocal microscope | Leica | discontinued | |
| medium 15 mm petri dish | Corning | 25060-60 | eyes are kept here during retina dissection |
| Merit 97-275 steel scissors | Merit | 97-275 | |
| Micropipette Puller | Sutter Instrument | p-97 | |
| Mm-Gabrd-C2 mRNA probe | ACD | 459481-C2 | |
| mouse euthanasia chamber | NA | NA | custom build; glass petri dish covering a small glass jar. |
| nitrocellulose membrane filters | GE Healthcare Life Sciences; Whatman | 7184-005 | 0.45 µm pore size |
| Picospritzer | General Valve Corporation | Picospritzer II | referred to in the text as microcellular injection unit |
| plastic transfer pipets | Fisherbrand | 13-711-7M | for constructing custom transfer pipette |
| Plastic tubing | Tygon | R-603 | for connection to carbogen tank |
| platinum harp | custom build | NA | for anchoring split retinas within the electrophysiology recording chamber. |
| size 0 paint brush | generic | NA | for flattening retina during splitting. |
| SlowFade Gold antifade reagent | Molecular Probes | S36937 | referred to in the text as anti-fade mounting media |
| small 10 mm petri dish | Falcon | 353001 | eyes are placed here following enucleation |
| small glass pane (7.5 cm x 5 cm) | generic | NA | isolatd retina pieces are placed onto this for the splitting procedure |
| Superfrost plus microscope slides | Fisherbrand | 12-550-15 | electrostatically-charged glass microscope slides |
| Thick-walled borosilicate glass pipettes with filament | Sutter Instrument | BF150-86-10HP | |
| Vannas Scissors; straight | Titan Medical | TMS121 | not brand specific; any comparable scissors will work |
| vGATFLPo mouse | Jackson Laboratories | 29591 | RRID: IMSR_JAX:029591 |
| vGlut2Cre mouse | Jackson Laboratories | 28863, 016963 | RRID: IMSR_JAX:028863, RRID: IMSR_JAX:016963 |
| Zombie NIR Fixable Viability Kit | BioLegend | 423105 | referred to in the text as MI-NIR |
Referanslar
- Morgans, C. W. Neurotransmitter release at ribbon synapses in the retina. Immunology & Cell Biology. 78 (4), 442-446 (2000).
- Euler, T., Haverkamp, S., Schubert, T., Baden, T. Retinal bipolar cells: elementary building blocks of vision. Nature Reviews Neuroscience. 15 (8), 507-519 (2014).
- Barnes, S., Grove, J. C. R., McHugh, C. F., Hirano, A. A., Brecha, N. C. Horizontal Cell Feedback to Cone Photoreceptors in Mammalian Retina: Novel Insights From the GABA-pH Hybrid Model. Frontiers in Cellular Neuroscience. 14, (2020).
- Walston, S. T., Chang, Y. C., Weiland, J. D., Chow, R. H. Method to remove photoreceptors from whole mount retina in vitro. Journal of Neurophysiology. 118 (5), 2763-2769 (2017).
- Stefanov, A., Novelli, E., Strettoi, E. Inner retinal preservation in the photoinducible I307N rhodopsin mutant mouse, a model of autosomal dominant retinitis pigmentosa. Journal of Comparative Neurology. 528 (9), 1502-1522 (2020).
- Matsuoka, R. L., Nguyen-Ba-Charvet, K. T., Parray, A., Badea, T. C., Chédotal, A., Kolodkin, A. L. Transmembrane semaphorin signaling controls laminar stratification in the mammalian retina. Nature. 470 (7333), 259-263 (2011).
- Matsuoka, R. L., et al. Guidance-Cue Control of Horizontal Cell Morphology, Lamination, and Synapse Formation in the Mammalian Outer Retina. Journal of Neuroscience. 32 (20), 6859-6868 (2012).
- Wässle, H., Puller, C., Müller, F., Haverkamp, S. Cone Contacts, Mosaics, and Territories of Bipolar Cells in the Mouse Retina. Journal of Neuroscience. 29 (1), 106-117 (2009).
- Thoreson, W. B., Dacey, D. M. Diverse Cell Types, Circuits, and Mechanisms for Color Vision in the Vertebrate Retina. Physiological Reviews. 99 (3), 1527-1573 (2019).
- Guido, M. E., et al. A simple method to obtain retinal cell preparations highly enriched in specific cell types. Suitability for lipid metabolism studies. Brain Research Protocols. 4 (2), 147-155 (1999).
- Rose, K., Walston, S. T., Chen, J. Separation of photoreceptor cell compartments in mouse retina for protein analysis. Molecular Neurodegeneration. 12 (1), 28(2017).
- Todorova, V., et al. Retinal Layer Separation (ReLayS) method enables the molecular analysis of photoreceptor segments and cell bodies, as well as the inner retina. Scientific Reports. 12 (1), 20195(2022).
- Shiosaka, S., Kiyama, H., Tohyama, M. A simple method for the separation of retinal sublayers from the entire retina with special reference to application for cell culture. Journal of Neuroscience Methods. 10 (3), 229-235 (1984).
- Ivanova, E., Hwang, G. S., Pan, Z. H. Characterization of transgenic mouse lines expressing Cre-recombinase in the retina. Neuroscience. 165 (1), 233-243 (2010).
- Sarria, I., Orlandi, C., McCall, M. A., Gregg, R. G., Martemyanov, K. A. Intermolecular Interaction between Anchoring Subunits Specify Subcellular Targeting and Function of RGS Proteins in Retina ON-Bipolar Neurons. The Journal of Neuroscience. 36 (10), 2915-2925 (2016).
- Orlandi, C., Cao, Y., Martemyanov, K. A. Orphan Receptor GPR179 Forms Macromolecular Complexes With Components of Metabotropic Signaling Cascade in Retina ON-Bipolar Neurons. Investigative Ophthalmology & Visual Science. 54 (10), 7153-7161 (2013).
- Dikshit, A., Zong, H., Anderson, C., Zhang, B., Ma, X. -J. Simultaneous Visualization of RNA and Protein Expression in Tissue Using a Combined RNAscopeTM In Situ Hybridization and Immunofluorescence Protocol. Methods in Molecular Biology. 2148, Clifton, N.J. 301-312 (2020).
- Wang, F., et al. RNAscope. The Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Morgans, C. W., et al. TRPM1 is required for the depolarizing light response in retinal ON-bipolar cells. Proceedings of the National Academy of Sciences of the United States of America. 106 (45), 19174-19178 (2009).
- Alessio, E., Zhang, D. Q. Immunostaining of whole-mount retinas with the CLARITY tissue clearing method. Investigative Ophthalmology & Visual Science. 61 (7), 5054(2020).
- Ferguson, L. R., Dominguez, J. M., Balaiya, S., Grover, S., Chalam, K. V. Retinal Thickness Normative Data in Wild-Type Mice Using Customized Miniature SD-OCT. PLoS ONE. 8 (6), e67265(2013).
- Ivanova, E., Toychiev, A. H., Yee, C. W., Sagdullaev, B. T. Optimized Protocol for Retinal Wholemount Preparation for Imaging and Immunohistochemistry. Journal of Visualized Experiments JoVE. (82), e51018(2013).
- Kolb, H. Neurotransmitters in the Retina. Webvision: The Organization of the Retina and Visual System. , University of Utah Health Sciences Center. (1995).
- Chaya, T., et al. Versatile functional roles of horizontal cells in the retinal circuit. Scientific Reports. 7 (1), 5540(2017).
- Egger, V., Diamond, J. S. A17 Amacrine Cells and Olfactory Granule Cells: Parallel Processors of Early Sensory Information. Frontiers in Cellular Neuroscience. 14, 600537(2020).
- Dacey, D. M. The dopaminergic amacrine cell. The Journal of Comparative Neurology. 301 (3), 461-489 (1990).
- Park, S. J., et al. Connectomic analysis reveals an interneuron with an integral role in the retinal circuit for night vision. eLife. 9, 56077(2020).
- Janssen-Bienhold, U., et al. Connexin57 is expressed in dendro-dendritic and axo-axonal gap junctions of mouse horizontal cells and its distribution is modulated by light. The Journal of Comparative Neurology. 513 (4), 363-374 (2009).
- Jain, V., et al. The functional organization of excitation and inhibition in the dendrites of mouse direction-selective ganglion cells. eLife. 9, 52949(2020).
- Marvin, J. S., et al. Stability, affinity, and chromatic variants of the glutamate sensor iGluSnFR. Nature Methods. 15 (11), 936-939 (2018).
- Strauss, S., et al. Center-surround interactions underlie bipolar cell motion sensitivity in the mouse retina. Nature Communications. 13 (1), 5574(2022).
- Marvin, J. S., et al. A genetically encoded fluorescent sensor for in vivo imaging of GABA. Nature Methods. 16 (8), 763-770 (2019).
- Beckwith-Cohen, B., Holzhausen, L. C., Wang, T. M., Rajappa, R., Kramer, R. H. Localizing Proton-Mediated Inhibitory Feedback at the Retinal Horizontal Cell-Cone Synapse with Genetically-Encoded pH Probes. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 39 (4), 651-662 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır