Method Article
Split Retina als verbessertes Flatmount-Präparat zur Untersuchung von Neuronen der inneren Kernschicht in der Netzhaut von Wirbeltieren
In diesem Artikel
Zusammenfassung
In dieser Arbeit wird ein alternatives Flatmount-Retina-Präparat vorgestellt, bei dem die Entfernung von Photorezeptor-Zellkörpern eine schnellere Antikörperdiffusion und einen verbesserten Patch-Pipettenzugang zu inneren Netzhautneuronen für Immunhistochemie, In-situ-Hybridisierung und elektrophysiologische Experimente ermöglicht.
Zusammenfassung
Bipolare Zellen und horizontale Zellen der Netzhaut von Wirbeltieren sind die ersten Neuronen, die visuelle Informationen verarbeiten, nachdem Photonen von Photorezeptoren detektiert wurden. Sie führen grundlegende Operationen wie Lichtanpassung, Kontrastempfindlichkeit sowie räumliche und farbliche Opponenz durch. Ein vollständiges Verständnis der genauen Schaltkreise und biochemischen Mechanismen, die ihr Verhalten steuern, wird die visuelle neurowissenschaftliche Forschung und die ophthalmologische Medizin voranbringen. Derzeitige Vorbereitungen zur Untersuchung von bipolaren und horizontalen Zellen (retinale ganze Halterungen und vertikale Schichten) sind jedoch nur begrenzt in der Lage, die Anatomie und Physiologie dieser Zellen zu erfassen. In dieser Arbeit stellen wir eine Methode zur Entfernung von Photorezeptor-Zellkörpern aus lebenden, flach montierten Mäusenetzen vor, die einen verbesserten Zugang zu bipolaren und horizontalen Zellen für ein effizientes Patch-Clamping und eine schnelle Immunmarkierung ermöglicht. Gespaltene Netzhäute werden hergestellt, indem eine isolierte Maus-Netzhaut zwischen zwei Stücke Nitrozellulose gelegt und dann vorsichtig auseinandergezogen wird. Durch die Trennung wird die Netzhaut direkt über der äußeren plexiformen Schicht gespalten, um zwei Stücke Nitrozellulose zu erhalten, von denen eines die Photorezeptor-Zellkörper und das andere die verbleibende innere Netzhaut enthält. Im Gegensatz zu vertikalen Retina-Schnitten durchtrennt das Split-Retina-Präparat nicht die dendritischen Fortsätze der inneren Netzhautneuronen, was Aufnahmen von bipolaren und horizontalen Zellen ermöglicht, die die Beiträge von Gap-Junction-gekoppelten Netzwerken und Weitfeld-Amakrinzellen integrieren. Diese Arbeit demonstriert die Vielseitigkeit dieses Präparats für die Untersuchung von horizontalen und bipolaren Zellen in Elektrophysiologie, Immunhistochemie und in situ Hybridisierungsexperimenten.
Einleitung
Die Netzhaut ist ein dünnes Nervengewebe im hinteren Auge, in dem Licht abgefangen und in ein elektrochemisches Signal umgewandelt wird, das vom Gehirn interpretiert werden kann. Auf der Rückseite der Netzhaut werden Stäbchen- und Zapfen-Photorezeptoren durch Licht stimuliert, wodurch die tonische Freisetzungsrate des Neurotransmitters Glutamat1 reduziert wird. Die ersten Neuronen, die diese lichtinduzierte Änderung der Glutamatkonzentration erfahren und darauf reagieren, sind die Bipolarzellen (BCs) und horizontalen Zellen (HCs), deren Somas sich in der äußersten Region der inneren Kernschicht (INL) befinden. Diese Neuronen zweiter Ordnung führen die erste Stufe der Signalverarbeitung in der Netzhaut durch und prägen kritische Merkmale des Sehens wie Lichtanpassung, Kontrastempfindlichkeit und räumliche/farbige Opponenz2. Während diese Funktionen BCs und HCs zugeschrieben wurden, sind die Schaltkreise und biochemischen Mechanismen, die diesen Prozessen zugrunde liegen, noch nicht vollständig verstanden3. Daher ist die Weiterentwicklung von Werkzeugen und Methoden zur Erforschung der BC- und HC-Physiologie von größter Bedeutung.
Vertikale (transversale) Netzhautschnitte haben sich seit langem als das praktischste Modell für die Untersuchung von BCs und HCs erwiesen. Bestimmte Aspekte der BC- und HC-Physiologie sind für den Experimentator unter diesem Modell jedoch nicht zugänglich. Direkte Aufzeichnungen von HCs oder indirekte Messungen ihrer Auswirkungen auf BCs spiegeln nicht die endogene Konnektivität der Netzhaut wider, da die lateralen Fortsätze dieser Zellen beim Schneiden durchtrennt werden. Präparationen der gesamten Netzhaut umgehen dieses Problem, indem sie diese lateralen Fortsätze erhalten, aber die umgebenden Netzhautschichten stellen eine Herausforderung für den Zugang zu diesen Zellen dar4. Es gibt zwar zahlreiche Beispiele für die Immunfärbung von 5,6,7,8 und Patch-Clamp-Aufzeichnungen9 von INL-Neuronen in der gesamten Netzhaut, aber es besteht die Möglichkeit, die Erfassung dieser Daten zu beschleunigen und zu vereinfachen. Die inhärenten Einschränkungen von Querschnitten und die Herausforderungen des gesamten Montierungsmodells inspirierten daher die Entwicklung dieses alternativen Flatmount-Retina-Präparats.
Die folgende Arbeit beschreibt ein Protokoll zur einfachen Entfernung der Photorezeptorschicht von lebenden, flach montierten Netzhäuten, um den Zugang zu BCs und HCs für ein vereinfachtes Patch-Clamping und eine schnellere, effizientere Immunmarkierung zu verbessern. Durch das Auseinanderziehen von zwei Stücken einer Nitrozellulosemembran, die auf beiden Seiten einer isolierten Netzhaut angebracht sind, wird das Gewebe durch die Photorezeptor-Axone gerissen, so dass eine gespaltene Netzhaut zurückbleibt, die die äußere plexiforme Schicht (OPL) und alle inneren Netzhautschichten zurückhält. Während andere Protokolle für die mechanische Trennung von Schichten der Netzhaut beschrieben haben, sind diese Methoden entweder schlecht für Patch-Clamp- und Mikroskopieanwendungen geeignet oder erfordern eine langwierige Manipulation des Gewebes. Einige dieser Methoden erfordern gefrorenes oder lyophilisiertes Gewebe für die Schichttrennung, was sie mit elektrophysiologischen Experimenten unvereinbarmacht 10,11,12. Andere sind für lebendes Gewebe konzipiert, erfordern aber 5-15 aufeinanderfolgende Peelings mit Filterpapier 4,11 oder eine Behandlung mit Trypsin 13, um die Photorezeptoren zu entfernen. Die hier beschriebene Technik verbessert ihre Vorgänger, indem sie das Verfahren zur Entfernung von Photorezeptoren vereinfacht und das Repertoire der nachgeschalteten Anwendungen erweitert.
Protokoll
Die Mäuse wurden ad libitum mit Wasser und Futter versorgt und in einem 12-stündigen Hell-Dunkel-Zyklus gehalten. Mäuse wurden durch Exposition gegenüber Isofluran euthanasiert, gefolgt von einer Zervixluxation. Alle Tierbehandlungen entsprachen den Richtlinien der National Institutes of Health und wurden vom Oregon Health and Science University Institutional Animal Care and Use Committee genehmigt.
HINWEIS: Augenenukleation, Netzhautdissektion und Netzhautspaltung sollten so schnell wie möglich durchgeführt werden, um die Gesundheit des lebenden Gewebes zu erhalten. Versuchen Sie, die Präparation in < 4 Minuten pro Auge abzuschließen. Diese drei Schritte sind nacheinander durchzuführen. Wildtyp-Mäuse: Für Experimente wurden adulte (>3 Monate) männliche und weibliche C57BL/6J-Mäuse verwendet. Für die Synapsenmorphologie wurden Mäuse verwendet, die grün fluoreszierendes Protein (GFP) unter dem Pcp2-Promotor (Pcp2-cre/GFP)14 exprimierten. Transgene Mäuse: Für die horizontale Zellvisualisierung mit GFP während immunhistochemischer oder elektrophysiologischer Experimente wurde eine dreifach transgene Maus verwendet: vGATFLPo; vGlut2Cre; Ai80d. Bei den vGATFlpo- und vGluT2Cre-Stämmen handelt es sich um Knock-in-Mäuse, die Flpo- oder Cre-Rekombinase stromabwärts ihrer jeweiligen Promotoren exprimieren. Die Ai80d-Maus ist eine intersektionale Reportermaus (CatCh/EYFP) und exprimiert Ca2+ permeables Kanalrhodopsin (ChR2) nur in Zellen, die Cre- und Flpo-Rekombinasen exprimieren. Daher exprimiert die dreifach transgene Maus ChR2 nur in Zellen, in denen in der Vergangenheit sowohl VGAT als auch vGluT2 exprimiert wurde.
1. Materialvorbereitung für die Netzhautdissektion und Netzhautspaltung
- Vorbereiten von Stücken der Nitrozellulosemembran
HINWEIS: Das Lösen der gespaltenen Netzhaut von der Nitrozellulosemembran reduziert die Hintergrundfluoreszenz in der Mikroskopie und vereinfacht die Aufzeichnung der Patch-Klemme. Die Membranentfernung kann vor oder nach der Gewebefixierung durchgeführt werden. Bei festsitzenden gespaltenen Netzhäuten ist es nicht notwendig, die Stücke der Nitrozellulosemembran zu behandeln. Bei lebender gespaltener Netzhaut ist die Membran gemäß den Schritten 1.1.3 - 1.1.5 zu behandeln, um eine sanfte Ablösung vom Gewebe zu ermöglichen.- Schneiden Sie 16 Stück (oder mehr) Nitrozellulosemembran in 5 mm x 5 mm große Quadrate. Extra kann in großen Mengen zubereitet und für die zukünftige Verwendung aufbewahrt werden.
- Die Hälfte der Membranstücke für die spätere Verwendung beiseite legen. Diese Teile werden nicht mit einer Blockierlösung behandelt.
- Inkubieren Sie die restlichen Stücke 10 Minuten lang in einer detergenzienfreien IHC-Blockierungslösung (z. B. 3 % Pferdeserum + 0,025 % NaN3 verdünnt in PBS) für 10 Minuten bei Raumtemperatur und schütteln Sie sie vorsichtig.
VORSICHT: Verwenden Sie beim Umgang mit NaN3 geeignete PSA, da es sich um ein starkes Toxin handelt. - Waschen Sie die Membranstücke gründlich durch Inkubation in bikarbonatgepufferten Ames-Medien für 10 Minuten bei Raumtemperatur und schütteln Sie sie vorsichtig.
- Trocknen Sie die verstopften Membranstücke vollständig an der Luft (~20 min). Beschriften und lagern Sie die Membranstücke bei Raumtemperatur und trennen Sie sie von den unbehandelten Membranstücken.
- Vorbereiten von Ames-Medien
- Bereiten Sie bikarbonatgepufferte Ames-Medien vor und bewahren Sie die Lösung bei Raumtemperatur unter konstanter Carbogenation (95 % O2 und 5 %CO2) auf.
2. Enukleation des Mausauges
- Euthanasieren Sie die Maus mit jeder verfügbaren Methode gemäß den institutionellen IACUC-Richtlinien.
- Drehen Sie die Maus auf eine Seite und drücken Sie mit zwei Fingern vorsichtig um die Augenhöhle herum. Dies führt dazu, dass sich das Auge aus dem Schädel herauswölbt.
- Schneide mit einer gebogenen Präparierschere unter das vorgewölbte Auge, um den Sehnerv zu durchtrennen und das Auge vom Schädel zu trennen.
- Schöpfen Sie das Auge mit einer Schere aus und legen Sie es in eine Petrischale, die mit eiskaltem Ames-Medium gefüllt ist.
HINWEIS: Für nachgelagerte Anwendungen, bei denen das Gewebe nach der Spaltung fixiert wird, kann eiskaltes PBS anstelle von Ames-Medien verwendet werden. - Wiederholen Sie die Schritte 2.1 - 2.4 für das verbleibende Auge.
3. Präparation der Netzhaut
- Verwenden Sie die kundenspezifische Glastransferpipette, um ein Auge in eine neue Petrischale mit frischem, eiskaltem Ames-Medium zu übertragen.
HINWEIS: Die weite Öffnung der kundenspezifischen Transferpipette verhindert ein versehentliches Quetschen des Gewebes, und die Verwendung von Glas minimiert die Haftung des Gewebes an den Wänden der Pipette. Eine Weithals-Transferpipette aus Kunststoff ist jedoch auch akzeptabel, wenn der Versuchsleiter bereits mit diesem Werkzeug vertraut ist. - Verwende eine Pinzette, um das Auge zu stabilisieren, indem du das überschüssige Bindegewebe am Boden der Petrischale feststeckst. Stechen Sie dann mit einer 25G-Nadel entlang der Ora-Serrata-Linie in das Auge, um einen Eintrittspunkt für die Vannas-Schere zu schaffen.
- Schneiden Sie mit einer Vannas-Schere entlang der Ora-Serrata-Linie, bis sich die Hornhaut vom Rest des Auges löst (Ergänzende Abbildung 1A). Entfernen Sie die Linse mit einer Pinzette aus der Augenmuschel (Ergänzende Abbildung 1B).
- Verwenden Sie die benutzerdefinierte Glaspipette, um die Augenmuschel auf ein großes Volumen (≥100 ml) karbogenierte Ames zu übertragen, und wiederholen Sie die Schritte 3.1 - 3.3 mit dem verbleibenden Auge.
HINWEIS: Die Augenmuscheln werden in carbogenierte Ames eingesetzt, um die Gesundheit des Gewebes zu erhalten, während die Dissektion am anderen Auge durchgeführt wird. - Eine Augenmuschel in eine Petrischale geben, die mit frisch karbogeniertem Ames gefüllt ist.
- Machen Sie mit einer Vannas-Schere einen kleinen Schnitt vom Rand der Sklera nach innen und ziehen Sie dann mit zwei Pinzetten die Sklera von der Netzhaut ab (Ergänzende Abbildung 1C). Vermeiden Sie es, die Netzhaut mit der Pinzette zu greifen. Ziehe stattdessen die Laschen der Sklera auseinander, die durch die Scherenschere entstanden sind.
- Verwenden Sie die Vannas-Schere, um den Sehnerv zu durchtrennen, der die Sklera und die Netzhaut verbindet (Ergänzende Abbildung 1D), und hebeln Sie dann die Netzhaut vorsichtig mit der Schere oder Pinzette von der Sklera ab, um die Netzhaut zu isolieren. (Abbildung 1A).
HINWEIS: Während das RPE in der Regel an der Augenmuschel befestigt bleibt, sind keine zusätzlichen Schritte erforderlich, um das RPE zu entfernen, falls es an der Netzhaut befestigt ist. An dieser Stelle können die Ränder der Netzhaut optional mit einem Skalpell beschnitten werden, um ein Kräuseln während des Abflachungsschritts zu verhindern (Abbildung 1B). - Verwenden Sie ein Skalpell, um die Netzhaut in zwei Hälften oder Viertel zu schneiden (Abbildung 1C), und verwenden Sie dann die benutzerdefinierte Transferpipette, um die Stücke in ein großes Volumen (≥ 100 ml) kontinuierlich karbogenisiertes Ames-Medium zurückzuführen.
HINWEIS: Die Wahl der Hälften oder Viertel ist subjektiv. Wählen Sie die beste Option für die gewünschte Anwendung. - Wiederholen Sie die Schritte 3.5 - 3.8 für das verbleibende Auge, bevor Sie mit der Netzhautspaltung fortfahren.
4. Netzhaut-Spaltung
- Entsorgen Sie das Ames-Medium aus den Petrischalen und ersetzen Sie es durch frisch karbogenisiertes Ames.
HINWEIS: Um die Carbogenation während des restlichen Retina-Splitting-Vorgangs aufrechtzuerhalten, ersetzen Sie das Medium in der Petrischale etwa alle 5 Minuten durch frisch carbogenierte Ames. - Legen Sie mit der benutzerdefinierten Transferpipette ein Stück Netzhaut mit der Ganglienzellseite nach oben auf einen Objektträger (7,5 cm x 5 cm) und drücken Sie es dann flach, indem Sie die umgebende Flüssigkeit mit einem vorsichtigen Tuch entfernen (Abbildung 1D). Falls erforderlich, ziehen Sie die Netzhautränder vorsichtig mit einem feinen Pinsel unter einem Präpariermikroskop ab.
- Verwenden Sie eine Pinzette, um ein trockenes, 5 mm x 5 mm großes Stück Nitrozellulosemembran auf die Netzhaut zu senken, wodurch es an der Seite der Ganglienzellen haftet (Abbildung 1E).
HINWEIS: Wenn eine Membranentfernung aus lebendem Gewebe erforderlich ist (z. B. für die Elektrophysiologie), verwenden Sie für diesen Schritt ein trockenes Stück serumbehandelter Membran (siehe Schritte 1.1.3 - 1.1.5 für Details). Dadurch verringert sich die Stärke der Adhäsion an der Ganglienzellschicht, wodurch es einfacher wird, die Netzhaut nach der Spaltung von der Nitrozellulose zu entfernen. - Drehen Sie die Netzhaut um, so dass die Nitrozellulose auf dem Objektträger aufliegt, und legen Sie ein trockenes Stück 5 mm x 5 mm Membran auf die Photorezeptorseite der Netzhaut (Abbildung 1F).
- Berühren Sie die benetzte Spitze des Pinsels mit dem Zwischenraum zwischen den beiden Membranen und lassen Sie die Kapillarwirkung den Ames in das Sandwich saugen (Abbildung 1G). Dies reduziert die Haftung der Membranen an der Netzhaut und ist nur dann notwendig, wenn die Netzhaut mit dem empfindlichen Aufgabentuch übermäßig getrocknet wurde.
HINWEIS: Wenn die Netzhaut ihr glänzendes Aussehen verloren hat, wurde sie übermäßig ausgetrocknet und Schritt 4.5 ist erforderlich. - Um eine gleichmäßige Haftung zu gewährleisten, üben Sie mit einem nassen Pinsel leichten Druck nach unten auf die obere Membran aus (Abbildung 1H).
- Während Sie die untere Membran mit einer Pinzette am Glas feststecken, ziehen Sie die obere Membran mit einer zweiten Pinzette mit einer langsamen, gleichmäßigen Bewegung vorsichtig ab. Dies führt dazu, dass sich die Netzhaut knapp über der OPL aufspaltet (Abbildung 1I).
- Werfen Sie die obere Membran mit den Photorezeptoren ab (Abbildung 1J, links). Die untere Membran enthält die innere Netzhaut, die im Folgenden als gespaltene Netzhaut bezeichnet wird (Abbildung 1J, rechts).
- Führen Sie die gespaltene Netzhaut sofort wieder in ein carbogeniertes Ames-Medium zurück.
HINWEIS: Bei Experimenten an lebendem Gewebe kann die Netzhaut von einer 15-30-minütigen Erholungsphase bei carbogenierten Ames nach der Teilung profitieren.

Abbildung 1: Verfahren zur Teilung der Netzhaut . (A) Nach der Enukleation und der Vorbereitung der Augenmuschel in kaltem PBS- oder Ames-Medium wird die Netzhaut der Maus von der Augenmuschel isoliert und das PBS durch ein bei Raumtemperatur behandeltes, carbogeniertes Ames-Medium ersetzt. (B) Schneiden Sie mit einem Skalpell die Ränder der Netzhaut weg, bis keine Regionen mehr vorhanden sind, die sich nach innen krümmen (optional). (C) Schneiden Sie die Netzhaut mit einem Skalpell in Viertel oder Hälften. (D) Legen Sie ein Stück Netzhaut mit der benutzerdefinierten Transferpipette auf einen Objektträger (Ganglienzellseite nach oben) und entfernen Sie alle überschüssigen Ames mit einem vorsichtigen Tuch. Stellen Sie sicher, dass die halbtrockene Netzhaut flach auf dem Glas liegt, bevor Sie mit dem nächsten Schritt fortfahren. Verwenden Sie eine mit Ames benetzte Pinselspitze, um Bereiche der Netzhaut, die nicht flach sind, vorsichtig zu entfalten. (E) Legen Sie mit einer Pinzette ein vorgeschnittenes Stück trockene Nitrozellulosemembran (5 mm x 5 mm) auf die abgeflachte Netzhaut. (F) Drehen Sie das Stück Nitrozellulose um, so dass die Photorezeptorseite der Netzhaut nun nach oben zeigt. Legen Sie dann ein weiteres trockenes Stück Membran auf die Netzhaut. (G) Berühren Sie mit der nassen Spitze der Bürste den Raum zwischen den beiden Membranen und lassen Sie die Kapillarwirkung das Ames in das Sandwich einsaugen. Dies reduziert die Haftung der Membranen an der Netzhaut und ist nur dann notwendig, wenn die Netzhaut mit dem Delicate Task Wipe übermäßig getrocknet wurde. (H) Drücken Sie mit einer nassen Pinselspitze vorsichtig nach unten auf die Mitte der Netzhaut. (I) Verwenden Sie eine Pinzette, um das untere Stück der Membran auf dem Glasobjektträger zu befestigen, während Sie mit einer anderen Pinzette das obere Stück der Membran vorsichtig vom unteren entfernen. (J) Die innere Netzhaut (links) verbleibt auf der unteren Membran, während die Photorezeptoren (rechts) mit der oberen Membran weggezogen werden. Die Panels (A), (B), (C), (D) und (J) wurden mit einem Präpariermikroskop aufgenommen; Der Maßstabsbalken stellt ca. 1 mm dar; Panels (E-I) wurden mit einer Smartphone-Kamera ohne Vergrößerung aufgenommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Präparation von gespaltenen Netzhäuten für Immunfluoreszenzexperimente
HINWEIS: Die gespaltene Netzhaut ist bis Schritt 5.5 noch an der Nitrozellulosemembran befestigt. Führen Sie entweder die Schritte 5.1, 5.2, 5.3 oder 5.4 aus, nicht alle vier, da diese für unterschiedliche Experimente gelten.
VORSICHT: Verwenden Sie geeignete PSA und gehen Sie beim Umgang mit Paraformaldehyd (Fixiermittel) vorsichtig vor.
- Vorbereitung für Flatmount-Immunfluoreszenz
- Die gespaltene Netzhaut wird 30 Minuten lang in 4%igem Paraformaldehyd auf Eis inkubiert und dabei so viel Lösung verwendet, dass die Netzhaut vollständig bedeckt ist.
- Waschen Sie die gespaltene Netzhaut 3x in 5-10 ml PBS bei Raumtemperatur. Optionale Pause: Gespaltene Netzhäute können bis zu 24 Stunden lang bei 4 °C in PBS belassen werden.
- Vorbereitung für die Immunfluoreszenz mit vertikalen Schnitten der gespaltenen Netzhaut
- Die gespaltene Netzhaut wird 30 Minuten lang in 4%igem Paraformaldehyd auf Eis inkubiert und dabei so viel Lösung verwendet, dass die Netzhaut vollständig bedeckt ist.
- Waschen Sie die gespaltene Netzhaut 3x in 5-10 ml PBS bei Raumtemperatur. Optionale Pause: Gespaltene Netzhäute können bis zu 24 Stunden lang bei 4 °C in PBS belassen werden.
- Während die Membran noch befestigt ist, wird die gespaltene Netzhaut nacheinander in 10 %, 20 % und 30 % Saccharose bei 4 °C für jeweils 1 h getaucht, um das Gewebe kryozu schützen.
- Betten Sie die kryogeschützten Spaltnetzhaut in eine Mischung mit optimaler Schnitttemperatur (O.C.T.) ein und lagern Sie sie bis zur Kryosektion bei -80 °C (bis zu 6 Monate).
- Entfernen Sie die eingebettete gespaltene Netzhaut bei -80 °C und schneiden Sie mit einem Kryostaten 20 μm dicke Abschnitte. Montieren Sie die Schnitte auf elektrostatisch aufgeladene Objektträger aus Glas, lassen Sie sie an der Luft trocknen und lagern Sie sie dann bis zu 6 Monate bei -20 °C.
- Vorbereitung für duale Fluoreszenz-in-situ-Hybridisierung und Immunhistochemie
- Die gespaltene Netzhaut wird 2 h lang in 4%igem Paraformaldehyd auf Eis inkubiert und dabei so viel Lösung verwendet, dass die Netzhaut vollständig bedeckt ist.
- Waschen Sie die gespaltene Netzhaut 3x in 5-10 ml PBS bei Raumtemperatur. Optionale Pause: Gespaltene Netzhäute können bis zu 24 Stunden lang bei 4 °C in PBS belassen werden.
- Vorbereitung auf die Elektrophysiologie
- Bereiten Sie Patch-Pipetten vor, indem Sie dickwandige Borosilikatglaspipetten mit Filament mit einem Mikropipettenzieher ziehen. Verwenden Sie nur Pipetten mit einem gemessenen Widerstand zwischen 6-10 MΩ.
- Füllen Sie die entnommenen Pipetten mit einer internen Lösung auf, die Folgendes enthält (in mM): 125 K-Gluconat, 8 KCl, 5 HEPES, 1 MgCl 2, 1 CaCl 2,0,2 EGTA, 3 ATP-Mg und 0,5 GTP-Na.
- Entfernung der gespaltenen Netzhaut von der Nitrozellulosemembran
- Bereiten Sie mit einem hydrophoben Barrierestift kreisförmige Vertiefungen auf einem Objektträger (~1 cm Durchmesser) vor und lassen Sie sie 5-10 Minuten an der Luft trocknen.
- Platzieren Sie die gespaltene Netzhaut in den vorbereiteten hydrophoben Barrierestiften und fügen Sie so viel PBS hinzu, dass sie vollständig bedeckt sind.
- Schieben Sie unter einem Präpariermikroskop die Borsten eines feinen Pinsels unter die Ränder des Gewebes und heben Sie sie vorsichtig nach oben. Arbeiten Sie sich auf diese Weise kreisförmig um die Netzhaut herum, um sie von der Membran wegzuheben.
- Verwende eine Pinzette, um die Membran unter dem schwimmenden Stück Netzhaut zu entfernen.
- Saugen Sie das verbleibende PBS vorsichtig ab, so dass das Stück Netzhaut mit der Ganglienzellseite nach unten auf dem Objektträger zu liegen kommt.
HINWEIS: Die folgenden Schritte dürfen nicht nacheinander ausgeführt werden. Wählen Sie das geeignete Protokoll für die gewünschte Anwendung (z. B. Immunfärbung oder duale Fluoreszenz-in-situ-Hybridisierung [FISH] und Immunhistochemie [IHC] oder Elektrophysiologie).
6. Immunfärbung
- Falls noch nicht vorbereitet, verwenden Sie einen hydrophoben Barrierestift, um kreisförmige Vertiefungen auf einem Objektträger (~1 cm Durchmesser) zu erzeugen und lassen Sie sie 5-10 Minuten lang an der Luft trocknen. Alle Inkubations- und Waschschritte werden in diesen Pen-Vertiefungen durchgeführt.
- Inkubieren Sie die gespaltene Netzhaut oder die vertikalen gespaltenen Netzhautschnitte in Antikörper-Inkubationslösung (AIS: 3 % Pferdeserum, 0,5 % Triton X-100, 0,025 % NaN3 in PBS) für 30 Minuten bei Raumtemperatur.
- Inkubieren Sie die gespaltenen Netzhäute oder vertikalen gespaltenen Netzhautschnitte mit primären Antikörpern, die in AIS verdünnt sind, für 1 Stunde bei Raumtemperatur.
HINWEIS: Die Inkubationszeit für primäre Antikörper muss für verschiedene Proteinziele und Antikörper optimiert werden. - Waschen Sie das Taschentuch 3x bei PBS bei Raumtemperatur.
- Inkubieren Sie das Gewebe mit Sekundärantikörpern, die in AIS verdünnt sind, für 1 h bei Raumtemperatur. Waschen Sie das Taschentuch 3x bei PBS bei Raumtemperatur.
- Wenn eine Kernfärbung gewünscht ist, wird das Gewebe mit DAPI, das in PBS verdünnt ist, 30 s lang bei Raumtemperatur inkubiert. Waschen Sie das Taschentuch 1x bei PBS bei Raumtemperatur.
- Tragen Sie einen Tropfen Objektträger-Montagemedium auf jedes Stück Taschentuch auf und bringen Sie ein Deckglas an.
- Tragen Sie Nagellack an den Rändern des Deckglases auf, um die Probe zu versiegeln. Den Objektträger bei 4 °C lagern.
7. Dual FISH und IHC
- Die gespaltene Netzhaut bei 40 °C für 30 min in einem Hybridisierungsofen backen, um die Haftung auf dem Objektträger zu erhöhen.
- Füllen Sie das RNAscope FISH-Protokoll gemäß dem Protokoll des Herstellers mit den folgenden Ausnahmen und Änderungen aus:
- Es ist kein Schritt zur Antigengewinnung erforderlich. Verwenden Sie Protease III mit einer Inkubationszeit von 18 min bei Raumtemperatur.
- Führen Sie alle Waschschritte auf dem Objektträger innerhalb der Vertiefungen durch, die von einem hydrophoben Barrierestift hergestellt werden.
- Die Proben werden in Primärantikörpern verdünnt (siehe Materialtabelle) in PBS für 30 min bei 40 °C im Hybridisierungsofen inkubiert. Waschen Sie die Proben 3x bei PBS bei Raumtemperatur.
- Die Proben werden in Sekundärantikörpern verdünnt (siehe Materialtabelle) in PBS für 30 min bei 40 °C im Hybridisierungsofen inkubiert. Waschen Sie die Proben 3x bei PBS bei Raumtemperatur.
- Inkubieren Sie die Proben in 1x DAPI für 30 s bei Raumtemperatur. Waschen Sie die Proben 1x bei PBS bei Raumtemperatur.
- Tragen Sie einen Tropfen Anti-Fade-Eindeckmittel auf jedes Stück Taschentuch auf und montieren Sie ein Deckglas aus Glas.
- Tragen Sie Nagellack an den Rändern des Deckglases auf, um die Probe zu versiegeln. Den Objektträger bei 4 °C lagern.
8. Elektrophysiologie
- Nachdem Sie die Nitrozellulosemembran entfernt haben, übertragen Sie eine gespaltene Netzhaut in die Patch-Clamp-Aufnahmekammer und verankern Sie sie vorsichtig mit einer Platinharfe.
- Während des gesamten Experiments wird die gespaltene Netzhaut kontinuierlich mit Ames-Lösung durchblutet, die mit 95 % O2 und 5 %CO2 carbogeniert ist. Halten Sie die Lösung zwischen 32 und 34 °C.
HINWEIS: Während des Experiments kann das Gewebe mit der Dodt-Gradientenkontrastmikroskopie sichtbar gemacht werden. - Führen Sie unter Raumbeleuchtung eine Ganzzellen-Spannungsklemmung durch, um von INL-Neuronen aufzuzeichnen.
- Simulieren Sie während der Aufnahme Lichtreaktionen mit einer mikrozellulären Injektionseinheit zum Auftragen pharmazeutischer Verbindungen oder einer 470-nm-LED zur Stimulation von Channelrhodopsin (ChR2).
HINWEIS: Die Lichtintensität kann mit einem digitalen optischen Leistungsmesser gemessen werden.
- Simulieren Sie während der Aufnahme Lichtreaktionen mit einer mikrozellulären Injektionseinheit zum Auftragen pharmazeutischer Verbindungen oder einer 470-nm-LED zur Stimulation von Channelrhodopsin (ChR2).
9. Konfokale Mikroskopie
- Für die konfokale Immunfluoreszenz nehmen Sie Bilder mit einem konfokalen Mikroskop mit einem 40x/1,3 oder 63x/1,40 Ölimmersionsobjektiv auf. Verwenden Sie FIJI, um Helligkeit und Kontrast anzupassen und Z-Projektionen aus Bildstapeln zu generieren.
Ergebnisse
Durch die Spaltung der Netzhaut bleiben die Photorezeptorendigungen erhalten
Um zu bestätigen, dass die Netzhautspaltung die Dendriten von Neuronen zweiter Ordnung im OPL nicht schädigt, wurden vertikale Schnitte der gespaltenen Netzhaut mit Antikörpern gegen das synaptische Vesikelprotein Synaptophysin (grün) und die Proteinkinase C alpha (PKCα; rot) gefärbt. Die intensive Bande der Synaptophysinmarkierung auf der Oberseite der gespaltenen Netzhaut deutet darauf hin, dass die synaptischen Endigungen der Photorezeptoren erhalten bleiben (Abbildung 2). Darüber hinaus zeigt die PKCα-Färbung eine normale Morphologie der Stäbchen-Bipolarzellen (RBCs). Es sind keine Photorezeptorkerne sichtbar, was darauf hindeutet, dass die Netzhaut zwischen der OPL und der innersten Reihe von Photorezeptorzellkörpern aufgeteilt ist (Abbildung 2).
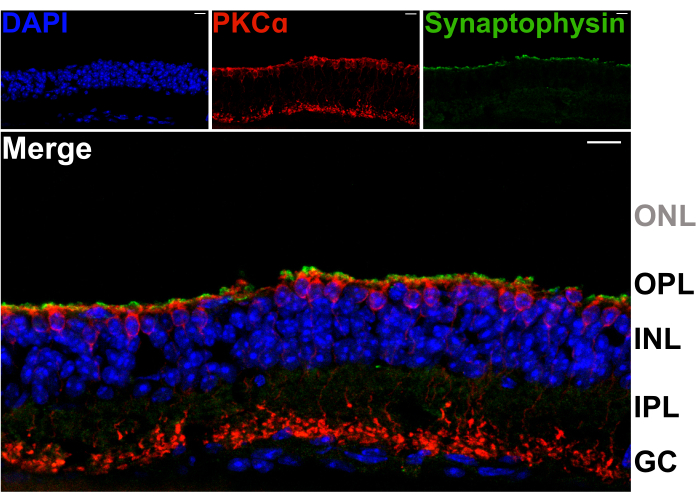
Abbildung 2: Gespaltene Netzhäute behalten Photorezeptoren. Konfokale Fluoreszenzaufnahmen, die einen vertikalen Querschnitt einer Spuck-Netzhaut zeigen, die nach dem Splitting-Verfahren kryogeschnitten wurde (20 μm Dicke). Jedes Bild ist eine maximale Projektion eines konfokalen Z-Stapels. Der Schnitt wurde mit Antikörpern gegen PKCα (oben Mitte) und Synaptophysin (oben rechts) immunmarkiert, um Erythrozyten bzw. synaptische Vesikel sichtbar zu machen. Das zusammengefügte Bild (unten) zeigt synaptische Vesikel (grün), die sich in den Photorezeptorendigungen befinden, direkt über den apikalen Fortsätzen der Erythrozyten (rot) in der OPL. Zellkerne sind mit DAPI (blau) markiert. Innerhalb der ONL sind keine Photorezeptorkerne sichtbar. Abkürzungen: ONL = äußere Kernschicht; OPL = äußere plexiforme Schicht; INL = innere Kernschicht; IPL = innere plexiforme Schicht; GC = Ganglienzellen. Maßstabsbalken = 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Morphologie der Synapsen im OPL bleibt nach der Spaltung der Netzhaut erhalten
Unter Verwendung einer Maus, die GFP in Erythrozyten unter dem PCP2-Promotorexprimiert, wurden 14 prä- und postsynaptische Proteine in der OPL immunmarkiert, um die Integrität dieser synaptischen Schicht nach einer Spaltungzu beurteilen 14. Trotz der Scherkräfte, die durch die Axone der Photorezeptoren auftreten, stört die Spaltung nicht die Morphologie der Photorezeptor-BC-Synapsen in der OPL, da eine normale Positionierung von Erythrozytendendriten, die für RGS11 markiert sind, und von synaptischen Photorezeptorbändern, die für CtBP215 markiert sind, beobachtet wird (Abbildung 3). Bei jedem synaptischen Kontakt zwischen Stäbchen und Erythrozyten kann RGS11 als rote Punkta gesehen werden, die innerhalb der Hufeisenform der synaptischen Bänder (grün) liegen. In einem nachfolgenden Experiment wurde ein Anti-GPR179-Antikörper 16 verwendet, um die postsynaptischen ON-BC-dendritischen Spitzen16 zu markieren, und ein Anti-PSD-95-Antikörper wurde verwendet, um präsynaptische Stäbchen-Photorezeptor-Endigungen zu markieren (ergänzende Abbildung 2). Diese Ergebnisse bestätigen erneut die Stabilität der OPL in der gespaltenen Netzhautpräparation, da gezeigt wird, dass Erythrozyten-Dendriten eng mit ihrem präsynaptischen Partner, den Stäbchenterminals, assoziiert sind.
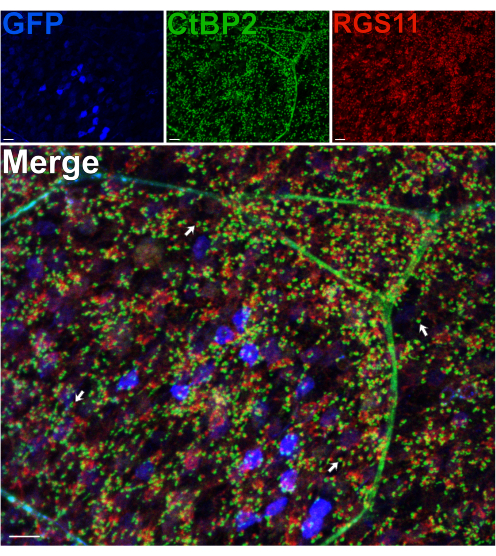
Abbildung 3: Die Morphologie der Synapsen in der OPL bleibt nach der Spaltung der Netzhaut erhalten. Konfokale Immunfluoreszenzbilder einer gespaltenen Netzhaut einer transgenen Maus, die GFP in Erythrozyten unter dem Pcp2-Promotor exprimiert. Die Höhe der GFP-Expression (blau) variiert zwischen den Erythrozyten in der Netzhaut. Nach der Spaltung wurde die Netzhaut fixiert und dann mit Antikörpern gegen CtBP2 (grün) und RGS11 (rot) inkubiert, um photorezeptorische synaptische Bänder bzw. ON-BC-dendritische Spitzen zu markieren. Jedes Rot-Grün-Paar stellt einen synaptischen Kontakt zwischen einem Stäbchen und einem ON-BC dar. Maßstabsbalken = 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Spaltung der Netzhaut erhält die Lebensfähigkeit der Erythrozyten
Um die Lebensfähigkeit der innernetzalen Neuronen nach einer Spaltung zu beurteilen, wurde ein membranundurchlässiger, nahinfraroter Kernfarbstoff (MI-NIR) verwendet, der die Identifizierung toter Zellen ermöglicht. Nach der Inkubation mit MI-NIR wurden gespaltene Netzhäute fixiert und dann mit Anti-PKCα markiert, um Erythrozyten zu identifizieren. Konfokale Mikroskopaufnahmen der gespaltenen Netzhaut zeigen eine regionale Variabilität der Zelllebensfähigkeit im gesamten Gewebe, wobei einige Regionen höhere Zelltodraten aufweisen als andere. Diese Variabilität kann auf Schäden zurückzuführen sein, die bestimmten Regionen der Netzhaut während der Dissektion, Spaltung oder Handhabung zugefügt werden (Abbildung 4). Angesichts der Tatsache, dass sich die Zellkörper der Erythrozyten in der äußersten Region des INL befinden, in der Nähe des Ortes der Spaltung, war eine sorgfältige Bewertung ihrer Lebensfähigkeit erforderlich. Die seltene Kolokalisation von PKCα und MI-NIR bestätigte, dass die meisten Erythrozyten nach der Spaltung der Netzhaut lebensfähig bleiben (Abbildung 4).
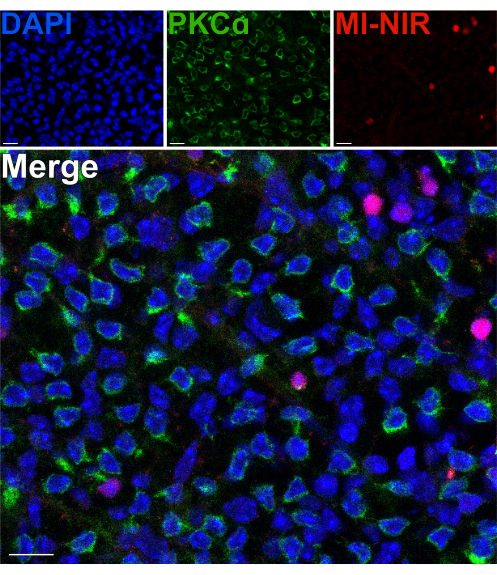
Abbildung 4: Stäbchen-Bipolarzellen sind nach Netzhautspaltung lebensfähig. Fluoreszierende konfokale Mikroskopaufnahmen, die einen Bereich einer gespaltenen Netzhaut in einer flachen Perspektive zeigen. Nach der Spaltung wurde die lebende Netzhaut mit dem MI-NIR-Farbstoff (rot) für 30 min bei 37 °C inkubiert. Die Netzhaut wurde dann fixiert und mit Antikörpern gegen PKCα immunmarkiert, um Erythrozyten sichtbar zu machen. In dieser Region der Netzhaut ist eine Kolokalisation von PKCα und MI-NIR selten. MI-NIR kolokalisiert mit Zellkernen (blau), die nicht zu den Erythrozyten gehören. Abkürzungen: MI-NIR = membranundurchlässige NIR-Lebend-/Totfärbung. Maßstabsbalken = 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Geteilte Netzhäute sind für duale FISH und IHC zugänglich
Durch die Verlängerung der Fixierungszeit für Standard-IHC können gespaltene Netzhäute sequenziell durch FISH und IHC prozessiert werden, um mRNAs und Proteine gleichzeitig zu markieren17,18. Experimente bestätigten, dass eine 2-stündige Fixierung in 4% Paraformaldehyd eine robuste mRNA-Markierung ergibt, während die Proteinepitope für die Antikörperbindung erhalten bleiben. FISH wurde an gespaltenen Netzhäuten durchgeführt, gefolgt von IHC, um die Expression der GABA-A-Rezeptor-Untereinheit δ (GABRD; Anti-Sense-mRNA-Sonden) in Bezug auf die Position von Erythrozyten (Anti-PKCα-Antikörper) im äußeren INL sichtbar zu machen (Abbildung 5A). Die Expression von GABRD-mRNA scheint in Erythrozyten selten zu sein (Abbildung 5A); Das Transkript wird jedoch reichlich von Amakrinzellen und Ganglienzellen exprimiert, wie das Markierungsmuster auf Querschnitten einer intakten Netzhaut zeigt (Abbildung 5B). Im äußeren INL (Abbildung 5A) ist die GABRD-mRNA gleichmäßiger verteilt als im inneren INL (Abbildung 5C), wo sie in verschiedenen Zellen konzentriert ist. Antisense-Sonden, die auf andere GABA-Rezeptor-Untereinheiten abzielen, erzeugen unterschiedliche Markierungsmuster, was die Spezifität der Sonden demonstriert (Daten nicht gezeigt).
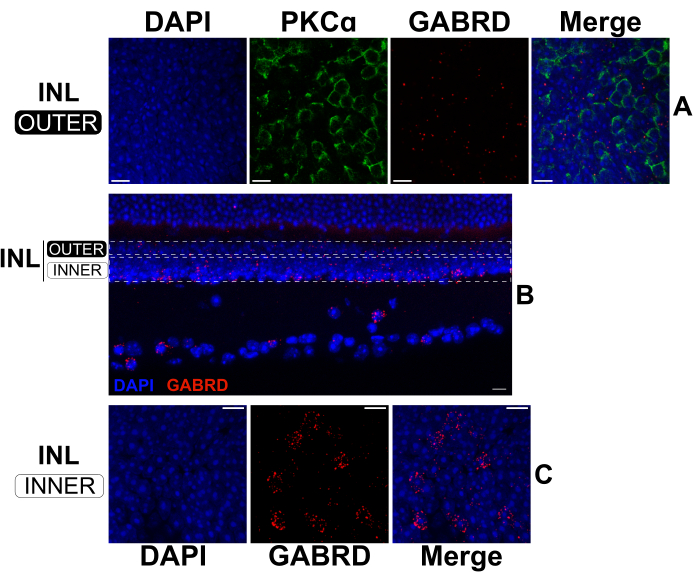
Abbildung 5: Duale FISH und IHC in einer gespaltenen Netzhaut und einer intakten Netzhaut. (A, C) Konfokale mikroskopische Aufnahmen einer flach montierten geteilten Netzhaut und (B) eines vertikalen Schnitts einer intakten Netzhaut. Die Bilder in (A) und (C) sind maximale Projektionen von optischen Schnitten im oberen bzw. unteren Bereich des INL. Die gepunkteten Rechtecke in (B) stellen die ungefähren Grenzen dar, die zum Erstellen der in (A) und (C) gezeigten Projektionen verwendet werden. Die gespaltene Netzhaut (A, C) wurde für 2 h fixiert und dann mit Antisense-mRNA-Sonden gegen GABRD (rot) markiert. Anschließend wurde die gespaltene Netzhaut mit Antikörpern gegen PKCα gefärbt, um Erythrozyten zu markieren (grün). Der PKCα-Kanal wurde aus Gründen der Übersichtlichkeit in den Projektionen des unteren INL weggelassen. Die intakte Netzhaut in (B) wurde vor der Sektion 24 h lang fixiert. Anschließend wurde die fixierte Netzhaut mit Antisense-mRNA-Sonden gegen GABRD markiert (rot). Alle Proben wurden 20 s lang mit DAPI (blau) gefärbt, bevor sie mit dem Deckglas versehen wurden. Abkürzungen: INL = innere Kernschicht. Maßstabsbalken = 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Geteilte Netzhäute eignen sich gut für die elektrophysiologische Aufzeichnung von BCs und HCs mit Patch-Clamp
Um ein BC- oder HC-Soma in einer herkömmlichen Netzhaut zu flicken, muss sich die Pipette entweder von der Seite der Ganglienzellen oder von der Seite des Photorezeptors nähern. Bei beiden Ansätzen müssen mehrere Netzhautschichten durchquert werden, um das INL zu erreichen, wobei die Pipettenspitze oft durch Ablagerungen blockiert wird. Bei einer Vibratom-Schnittpräparation sind die BC- und HC-Somas leicht zugänglich, aber ihre dendritischen Fortsätze können durchtrennt werden, wodurch ihre lateralen Verbindungen unterbrochen werden. In gespaltenen Netzhäuten sitzen jedoch die Zellkörper von Erythrozyten und HCs an der Oberfläche des Gewebes, was einen stark verbesserten Zugang zu Patch-Pipetten ermöglicht, während die lateralen Schaltkreise der OPL erhalten bleiben.
Abbildung 6 zeigt chemisch simulierte Lichtantworten, die von BCs in einer gespaltenen Netzhaut aufgezeichnet wurden. Das perfundierte Ames-Medium wurde mit L-AP4 (4 μM), einem mGluR-Agonisten der Gruppe III, ergänzt, um die Freisetzung von Glutamat von Photorezeptoren in der Dunkelheit zu simulieren. Der mGluR6-Antagonist, CPPG (600 μM, in Ames), wurde auf die Dendriten der gepatchten Zelle (gehalten bei -60 mV) gepustet, um einen Lichtblitz durch Hemmung von mGluR6 zu simulieren. Die Zellen reagierten auf CPPG-Stöße mit zwei Arten von nach innen gerichteten Strömen. Ein Typ zeigt einen transienten Strom, gefolgt von einem Plateau (6A), ähnlich den kanonischen lichtevozierten Strömen, die von Erythrozyten in Netzhautschnitten19 aufgezeichnet wurden. Der andere Typ bleibt während der gesamten Zugdauer erhalten (Abbildung 6B) und ähnelt den Strömen, die von ON-Zapfen-Bipolarzellen (ON-CBC) aufgezeichnet werden19.
Ein separates Experiment wurde durchgeführt, um HCs anzusprechen, einen Zelltyp mit einem breiten dendritischen Feld, der in Schnittpräparaten oft schwer zu konservieren ist. Eine Mauslinie, die Kanalrhodopsin (ChR2) und GFP in HCs exprimiert, wurde verwendet, um eine einfache Identifizierung unter einem Fluoreszenzmikroskop zu ermöglichen. Zunächst wurden Ströme von HCs als Reaktion auf eine Reihe von Depolarisationsschritten (-100 mV bis 50 mV, Schrittweite = 15 mV) aufgezeichnet, auf die sie mit einwärts gerichteten Strömen gefolgt von nach außen gerichteten Strömen reagierten (Abbildung 6C). Diese Zellen wurden dann mit einem kurzen Blaulichtpuls (200 ms, 470 nm) stimuliert, der große, ChR2-getriebene nach innen gerichtete Ströme in zwei Zellen erzeugte (Abbildung 6D).
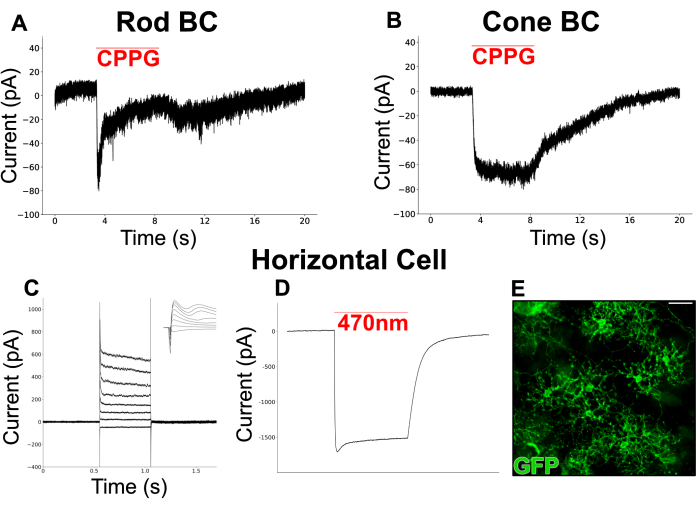
Abbildung 6: Patch-Clamp-Aufzeichnungen von INL-Neuronen in gespaltenen Netzhäuten . (A) Eine mutmaßliche Erythrozyte und (B) eine CBC wurden bei -60 mV in perfundierten Ames-Medien, die L-AP4 (4 μM) enthielten, spannungsgeklemmt. Das Aufblasen von CPPG (600 μM) auf die Dendriten der geklemmten Zellen löste einen nach innen gerichteten Strom aus, der in der Erythrozyte transient war, aber im CBC aufrechterhalten wurde. Die Erythrozytenaufzeichnung in (A) ist eine einzelne Spur, während die CBC-Aufzeichnung in (B) den Durchschnitt von 3 Spuren darstellt. (C) eine Patch-Clamp-Aufnahme von einem HC in einem vGATFLPo; vGlut2Cre; Ai80d Maus. Die rote Linie zeigt die Dauer eines 200 ms und 470 nm langen Lichtimpulses, der verwendet wird, um den großen, nach innen gerichteten Strom durch ChR2 aufzurufen. (D) Eingespeiste Stromantworten von einem HC, dessen Spannung auf -60 mV geklemmt war, dann in 15-mV-Intervallen zwischen -70 mV und +35 mV wechselte und zu -60 mV zurückkehrte. Der Einschub zeigt die gleichen Kurven in einem 6-ms-Fenster, das den Beginn des Spannungsschritts umgibt. (E) Immunfluoreszenzmikroskopische Aufnahme einer flach montierten, gespaltenen Netzhaut, die horizontale Zellen zeigt, die GFP in einem vGATFLPo exprimieren; vGlut2Cre; Ai80d Maus. Maßstabsbalken = 20 μm. Elektrophysiologische Daten wurden mit einer Abtastrate von 20 kHz gesammelt und mit einem Tiefpass-Bessel-Filter bei 5 kHz gefiltert. Die Daten wurden dann exportiert und die Offline-Visualisierung und -Analyse mit Python 3 durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Retina-Splitting ermöglicht schnelle Abfrage der INL- und OPL-Anatomie
Die äußere limitierende Membran (ELM) der Netzhaut und ONL bilden eine ~90 μm dicke Barriere, die die Diffusion von Antikörpern in die innere Netzhaut behindert und suboptimale Immunfärbebedingungen schafft20,21,22. Daher erfordert die Immunmarkierung von Zielen in der OPL oder INL mit einer herkömmlichen Flatmount-Netzhaut zeitintensive Färbeprotokolle, die oft eine 48-96-stündige Antikörperinkubation erfordern 5,6,7,8,20,22.
Die Entfernung der Photorezeptoren ermöglicht ein schnelles Eindringen von Antikörpern in innere Netzhautneuronen. Infolgedessen kann die Markierung von Intra-Retina-Proteinzielen mit Hilfe von farbstoffkonjugierten Primärantikörpern in nur 1 h erreicht werden. Antikörper gegen PKCα und Calbindin-D wurden verwendet, um Erythrozyten bzw. HCs des INL zu markieren (Abbildung 7). Im Gegensatz zu herkömmlichen vertikalen Netzhautschnitten, die die lateralen Fortsätze von Weitfeldneuronen abschneiden, ermöglicht das Split-Retina-Präparat die Visualisierung des gesamten dendritischen Dorns von Weitfeldzellen wie HCs (Abbildung 6E, Abbildung 7).
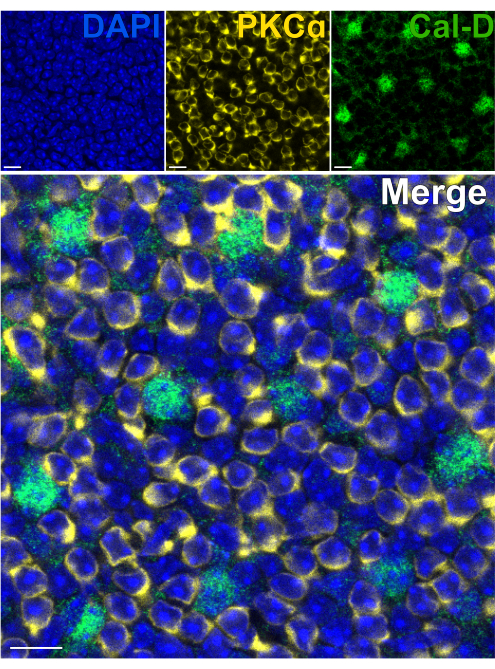
Abbildung 7: Schnelle Immunmarkierung von Proteinen der inneren Netzhaut in einer gespaltenen Netzhaut. Konfokale Immunfluoreszenzbilder einer gespaltenen Netzhaut aus einer Flatmount-Perspektive. Die gespaltene Netzhaut wurde mit Antikörpern gegen PKCα (gelb) und Calbindin-D (grün) für 1 h bei Raumtemperatur inkubiert, um ON-BCs bzw. HCs zu markieren. (A) Jedes Einzelkanalbild ist eine durchschnittliche Z-Projektion, die sich aus vier optischen Abschnitten zusammensetzt: DAPI, Mittelwert z10-13; Calbindin-D, Durchschnitt z11-14; PKCα, Mittelwert z11-14. (B) Im zusammengeführten Bild werden die gleichen Projektionen überlagert. Maßstabsbalken = 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: Schlüsselphasen der Netzhautdissektion. Alle Bilder wurden mit einer Smartphone-Kamera aufgenommen, die an den Okularlinsen eines Präpariermikroskops befestigt war. (A) Ein Top-Down-Bild eines Mausauges nach Entfernung der Hornhaut. (B) Ein Top-Down-Bild der Mausaugenmuschel nach dem Entfernen der Linse. (C) Es wird ein kleiner Schnitt in der Sklera an der Augenmuschel der Maus gemacht. Pfeile zeigen die beiden Klappen der Sklera an, die mit einer Zange in entgegengesetzte Richtungen gezogen werden, um die Netzhaut von der Sklera zu trennen. (D) Nachdem die Sklera teilweise von der Netzhaut weggezogen wurde, wird eine Vannas-Schere zwischen die Sklera und die Netzhaut eingeführt und der Sehnerv durchtrennt, wodurch die Netzhaut befreit wird. Der rot gestrichelte Kreis zeigt den Sehnervenkopf, und die Schere zeigt die korrekte Schnittbahn (Schere zwischen Sklera und Netzhaut einführen). Die isolierte Netzhaut nach der Sklera wird weggerissen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Charakterisierung prä- und postsynaptischer Komponenten der OPL in der gespaltenen Netzhaut. Konfokale Immunfluoreszenzbilder aus dem OPL in einer gespaltenen Netzhaut. Die gespaltene Netzhaut wurde mit Antikörpern gegen GPR179 und PSD95 für 1 h bei Raumtemperatur inkubiert, um an den dendritischen Spitzen von ON-BCs bzw. an den Enden der Stäbchen-Photorezeptoren zu markieren. Das linke und das mittlere Bild sind maximale Projektionen mehrerer optischer Schnitte; Die gleichen Projektionen werden im Bild ganz rechts überlagert. GPR179-Punkte in den dendritischen ON-BC-Spitzen assoziieren eng mit den Photorezeptor-Endigungen des Stäbchens, was auf intakte synaptische Kontakte innerhalb der OPL hinweist. Maßstabsbalken = 10 μm. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 3: Fehlerbehebung: Beurteilung der Qualität einer gerissenen Netzhaut. Fluoreszierende mikroskopische Aufnahmen einer gespaltenen Netzhaut, die mit DAPI gefärbt wurde, um Zellkerne sichtbar zu machen. Zellen können anhand des Durchmessers und der Gewebetiefe des Zellkerns identifiziert werden. (A) Photorezeptorkerne sind kleiner, heller und oberflächlicher, während (B) BC-Kerne größer, schwächer und tiefer sind. (C) Ein Bild mit geringer Vergrößerung einer Region, in der die Photorezeptoren unvollständig entfernt wurden. Die Kerne, die im Fokus erscheinen, stammen aus BCs, die tiefer sind als die Photorezeptorkerne an den Rändern des Bildes, die unscharf erscheinen. Maßstabsbalken für (A) und (B) = 20 μm. Maßstabsleiste für (C) = 50 μm. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Nachdem Photorezeptoren die Photonenabsorption in die Freisetzung von Neurotransmittern umgewandelt haben, sind BCs und HCs die ersten retinalen Neuronen, die das visuelle Signal verarbeiten23. Während die Bedeutung dieser Neuronen allgemein anerkannt ist, sind viele ihrer Funktionen unvollständig verstanden oder ganz unerforscht. Viele Studien zur BC- und HC-Physiologie würden wahrscheinlich von einem Flatmount-Retina-Präparat profitieren, das den Zugang zu INL-Neuronen verbessert und gleichzeitig die laterale Konnektivität aufrechterhält. Die Entwicklung der Split-Retina-Methode stellt den Versuch dar, ein einfaches Protokoll für die Erfassung hochwertiger elektrophysiologischer Aufzeichnungen und Mikroskopiedaten von BCs und HCs in einer Flatmount-Ausrichtung bereitzustellen. Die hier beschriebene Split-Retina-Präparation kann in etwa 20 Minuten pro Maus (10 Minuten pro Netzhaut) nach der Netzhautisolierung durchgeführt werden, ohne dass spezielle Geräte verwendet werden müssen. Die Methode ist von bestehenden Verfahren zur Entfernung von Photorezeptoren inspiriert, bietet aber erhebliche Verbesserungen in Bezug auf Einfachheit, Geschwindigkeit und Vielseitigkeit 4,10,11,12,13. Im Gegensatz zu früheren Methoden zur Trennung von Netzhautschichten erfordert die Netzhautspaltung kein Einfrieren, Gefriertrocknung oder wiederholtes Auftragen von Klebstoffen auf die Netzhaut. Mit etwas Übung können mit der Nitrozellulosemembran fast alle Photorezeptoren in einem einzigen Riss entfernt werden. Die Geschwindigkeit und Leichtigkeit dieses Ansatzes ermöglicht es, die Zeit, die die Netzhaut außerhalb von carbogenierten Ames verbringt, zu minimieren, was eine hohe Zelllebensfähigkeit über lange Zeiträume ermöglicht. Gespaltene Netzhäute können in carbogenierten Ames-Medien für mehrere Stunden nach dem Split aufrechterhalten werden. Als Beweis für die Gesundheit der INL-Neuronen in diesem Präparat bestätigen eine Lebend-/Totenzellfärbung (Abbildung 4) und eine Patch-Clamp-Elektrophysiologie (Abbildung 6) die Lebensfähigkeit von Erythrozyten und HCs nach einer Spaltung.
Die Entfernung der Photorezeptorschicht in gespaltenen Netzhäuten bietet einen signifikanten Vorteil bei der Immunmarkierung, indem die Diffusionszeit von Antikörpern in das INL drastisch verkürzt wird. Die Markierung von Primär- und Sekundärantikörpern kann innerhalb von 2 Stunden abgeschlossen werden, was eine wesentliche Verbesserung gegenüber der herkömmlichen Flatmount-Färbung darstellt, die je nach Zielmolekül 72 Stunden oder länger dauern kann 5,6,7,8,20,22. Dadurch können Mikroskopiedaten noch am selben Tag wie die Gewebepräparation erfasst werden, was das Tempo von Immunfluoreszenzexperimenten drastisch beschleunigt. Um das Annealing von mRNA-Sonden zu erleichtern, empfehlen FISH-Experimente in der Regel viel längere Fixierungszeiten (~24 h) als die Immunmarkierung18. Die hier vorgestellten Experimente zeigen jedoch, dass eine 2-stündige Fixierung immer noch eine außergewöhnliche FISH-Markierung erzeugt (Abbildung 5). Trotz der Verlängerung der Fixationszeit von 30 min auf 2 h war es nicht notwendig, Antigen-Retrieval-Schritte durchzuführen, um eine hervorragende Immunmarkierung zu erhalten, aber dies kann je nach Antikörper oder Antigen variieren. Die Proteasebehandlung im FISH-Protokoll kann die Markierung von Antikörpern beeinträchtigen, wahrscheinlich aufgrund der Zerstörung von Zielepitopen. Dieses Problem wurde durch die Verwendung von polyklonalen Antikörpern umgangen, die auf mehrere Epitope abzielen, wodurch die Wahrscheinlichkeit verringert wurde, dass die Epitopzerstörung die Immunmarkierung behindern würde. Zusätzlich wurde eine moderate Proteasebehandlung (ACD-Protease III) eingesetzt, um eine übermäßige Epitopveränderung zu verhindern und gleichzeitig eine ausreichende Gewebepenetration zu gewährleisten.
Gelegentlich spaltet sich die Netzhaut stattdessen durch die äußere Kernschicht (ONL) und hinterlässt Schichten von Photorezeptor-Somas, ohne dass INL-Zellen sichtbar sind. Um dies zu verhindern, sollte man darauf achten, dass die Netzhaut völlig flach auf dem Glas liegt und dass die Restflüssigkeit um die Netzhaut herum entfernt wurde. Wenn Sie mit dem Pinsel fester auf die Nitrozellulose drücken, kann dies auch dazu beitragen, ein Aufspalten durch die ONL zu verhindern. Wenn die Membran zu nass wird oder die Netzhaut über sich selbst gefaltet ist, verringern sich die Chancen auf eine erfolgreiche Spaltung erheblich. Die Verwendung von DAPI zur Färbung von Zellkernen ist nützlich, um die Qualität der Spaltung zu beurteilen und die Bedeckung der verbleibenden Photorezeptoren zu bestimmen. Photorezeptorkerne sind kleiner, heller und oberflächlicher (ergänzende Abbildung 3A), während BC-Kerne größer, schwächer und tiefer sind (ergänzende Abbildung 3B). In einigen Fällen variiert die Ebene des Risses leicht über das Stück Netzhaut, was zu Flecken führt, an denen die Zellkörper der Photorezeptoren nicht vollständig entfernt wurden (Ergänzende Abbildung 3C). Für Anwendungen in der Mikroskopie und Elektrophysiologie hindert dies nicht daran, qualitativ hochwertige Daten aus Regionen zu sammeln, in denen Photorezeptoren ordnungsgemäß entfernt wurden. Große Felder der freiliegenden inneren Netzhaut können bei der Bildgebung oder Aufzeichnung mit einer Patch-Pipette leicht gefunden werden. Wenn eine vollständigere Entfernung der Photorezeptoren gewünscht wird, kann ein zweiter Aufriss mit einem zusätzlichen Stück Nitrozellulosemembran durchgeführt werden, obwohl eine 100%ige Entfernung der Photorezeptoren nicht garantiert ist. Vorsicht ist daher geboten, wenn gespaltene Netzhäute in Genexpressions- oder Proteomikstudien verwendet werden, bei denen Restmaterial von Photorezeptoren die Ergebnisse beeinflussen könnte. Für Einzelzellanwendungen ist diese Sorge unbegründet, da Daten von Photorezeptoren von der Analyse ausgeschlossen werden können.
Die Vorteile der Split-Retina-Präparation kommen vielleicht am deutlichsten bei elektrophysiologischen Ableitungen von Weitfeld-Interneuronen zum Tragen. Während herkömmliche vertikale Schichten die ausgedehnten Prozesse von Weitfeldzellen durchtrennen, lässt die geteilte Netzhautpräparation die OPL und IPL intakt, so dass man den Input von Weitfeldzellen wie HCs24, A17s25, TH ACs 26 und NOS-1 ACs27 erfassen kann, die sonst in vertikalen Schichten übersehen würden. Daher erfordert die Interpretation der Ergebnisse und der Vergleich mit früheren Daten, die aus Netzhautschnitten gesammelt wurden, sorgfältige Überlegungen. In Experimenten mit pharmakologischen Nachahmungen der Lichtstimulation ähneln diese Ergebnisse jedoch Daten, die aus Netzhautschnitten aufgezeichnet wurden19. Durch die Expression von ChR2 unter zellspezifischen Promotoren kann man eine gewünschte Zellpopulation stimulieren, während man BCs im INL aufzeichnet, um den Einfluss der gewünschten Zelle auf den vertikalen Informationsweg zu untersuchen. Die direkte Aufzeichnung von tieferen INL-Neuronen, wie z. B. Amakrinzellen, ist auch in der gespaltenen Netzhaut möglich. Während in diesem Fall die Patch-Elektrode zuerst durch die oberflächlicheren INL-Neuronen wandern muss, gibt es im Vergleich zu einem herkömmlichen Ganzmontagepräparat deutlich weniger Gewebe, das ihren Weg behindert.
Neben der Messung des Einflusses von Weitfeldzellen auf andere Neuronen ermöglicht diese Methode das direkte Einzelzell-Patch-Clamping von HCs, deren Dendriten ein ausgedehntes Gap-Junction-gekoppeltes Netzwerk im OPL28 bilden. Horizontale Zellen senden kritisches Feedback an Photorezeptoren, die die Übertragung vertikaler Informationen durch die Netzhaut beeinflussen. Da die dendritischen Felder von HCs jedoch in vertikalen Schichten abgeschnitten sind, fehlen Einzelzellaufzeichnungsdaten. In dieser Arbeit werden anatomisch und physiologisch intakte HCs vorgestellt, aus denen ChR2-evozierte Ströme in einer dreifach transgenen Mauslinie aufgezeichnet werden (Abbildung 6 C-E). Außerhalb der ChR2-Stimulation kann die gespaltene Netzhaut verwendet werden, um endogene HC-Ströme und Gap-Junction-Kopplungzu untersuchen 28. Während die gespaltene Netzhaut ein geeignetes Modell für die Untersuchung der synaptischen Konnektivität und der neuronalen Aktivität darstellt, die durch chemische Anwendung oder ChR2-Stimulation induziert wird, schließt das Fehlen von Photorezeptoren eine direkte Erforschung natürlicher Lichtreaktionen oder Lichtanpassungsmechanismen aus.
Die In-situ-Bildgebung in der Netzhaut hat in den letzten Jahren bewundernswerte Fortschritte gemacht. Die Mehrzahl der bildgebenden Untersuchungen beschränkt sich jedoch auf die Ganglienzellschicht in Whole-Mount-Retina-Präparaten29. Die Autoren gehen davon aus, dass das Fehlen von Photorezeptoren in der gespaltenen Netzhaut sie zu einem idealen Modell für die Live-Kalzium-Bildgebung im OPL und INL macht. Über die Kalziumbildgebung hinaus hat dieses Modell ein großes Potenzial für den Einsatz mit genetisch kodierten Biosensoren wie iGluSnFR 30,31, iGABASnFR32 und pHluorin33. In Kombination mit dem Split-Retina-Präparat können diese leistungsstarken Werkzeuge einen effizienten Ansatz zur Erforschung der synaptischen Interaktionen und biophysikalischen Eigenschaften von BCs und HCs bieten, die zur Lichtverarbeitung in der Netzhaut beitragen.
Offenlegungen
Die Autoren erklären, dass es keine konkurrierenden finanziellen Interessen gibt.
Danksagungen
Diese Arbeit wurde durch die folgenden NIH-Zuschüsse unterstützt: NIH-Zuschuss R01EY031596 (an C.M.); NIH-Zuschuss R01EY029985 (an C.M.); NIH-Zuschuss P30EY010572 (an C.M.); NIH-Stipendium R01EY032564 (an B.S.). Wir danken Tammie Haley für ihre technische Unterstützung bei der Vorbereitung von Netzhautschnitten und Dr. Charles Allen für die großzügige Bereitstellung der mRNA FISH-Sonden, die in dieser Arbeit verwendet wurden.
Materialien
| Name | Company | Catalog Number | Comments |
| #1.5 glass coverslips | Fisherbrand | 12544E | |
| 2 pairs of Dumont #5 forceps | Ted Pella | 38125 | |
| 25 gauge needle | Becton Dickenson | 305122 | |
| 470 nm LED | THORLABS | M470L2 | |
| 5-306 curved scissors | Miltex | 5-306 | |
| 9" disposable pasteur pipetes | Fisherbrand | 13-678-20D | for constructing custom transfer pipette |
| Ai80d mouse | Jackson Laboratories | 25109 | RRID: IMSR_JAX:025109 |
| Ames Medium w/L-Glutamate | US Biological | A1372-25 | |
| amplifier control software | Molecular Devices | Clampex 10.3 software | |
| anti-calbindin D28K antibody | Invitrogen | PA-5 85669 | RRID: AB_2792808, host species = rabbit; 1:100 dilution |
| anti-CtBP2 antibody | BD Biosciences | 612044 | RRID: AB_399431, host species = mouse; 1:5000 dilution |
| anti-GPR179 antibody | NA | NA | gift from Kirill Martemyanov; Scripps Research Institute, Jupiter, FL; host species = sheep; 1:1000 dilution |
| anti-PKC alpha antibody | Sigma-Aldrich | P4334 | RRID: AB_477345, host species = rabbit; 1:5000 dilution |
| anti-PKC alpha antibody | Santa Cruz Biotechnology | sc8393 AF594 | RRID: AB_628142, host species = mouse; 1:1000 dilution |
| anti-PSD95 antibody | BD Transduction Laboratories | 610495 | RRID: AB_397862, host species = mouse; 1:1000 dilution |
| anti-RGS11 antibody | NA | NA | gift from Ted Wensel; Baylor College of Medicine, Houston, TX; host species = rabbit; between 1:1000 and 1:5000 dilution |
| anti-Synaptophysin P38 antibody | Sigma | S-S5768 | RRID: AB_477523, host species = mouse; 1:1000 dilution |
| Aquamount mounting media | Epredia | 13800 | slide mounting media |
| C57BL/6J mouse | Jackson Laboratories | 000664 | RRID: IMSR_JAX:000664 |
| carbogen tank | Matheson | NA | 95% O2 and 5% CO2 |
| custom transfer pipette | custom build | NA | Instructions: use scissors to cut off the tip of a plasitc transfer pipette at the point it begins to taper. Use pliers to safely break off the last 2-3 inches of a glass pasteur pipette. Fit the narrow end of the glass pasteur pipette into the wide tip of the plastic transfer pipete. Wrap parafilm around the joint of the two pieces to enhance the seal. |
| Digitical optical power meter | THORLABS | PM100D | |
| dissection microscope | Zeiss | Stemi 2000 | |
| electrophysiology amplifier | Molecular Devices | Axopatch 200B | |
| electrophysiology microscope | Olympus | OLYMPUS, BX50WI | Dodt gradient contrast microscopy |
| Fluoromount-G | SouthernBiotech | 0100-01 | |
| HC PL APO CS2 40x/1.3 | Leica | 506358 | |
| HC PL APO CS2 63x/1.40 | Leica | 15506350 | |
| Hybridization oven | Robbins Scientific | Model 1000 | for RNAscope protocol only |
| Immedge hydrophobic barrier pen | Vector Laboratories | H-4000 | |
| isoflurane | Piramal Critical Care | 66794-017-25 | |
| Kimwipe (delicate task wipe) | Kimtech Science | 34155 | |
| Leica HC PL APO CS2 40x/1.3 oil immersion objective | Leica | 506358 | |
| Leica HC PL APO CS2 63x/1.40 oil immersion objective | Leica | 15506350 | |
| Leica TCS SP8 X confocal microscope | Leica | discontinued | |
| medium 15 mm petri dish | Corning | 25060-60 | eyes are kept here during retina dissection |
| Merit 97-275 steel scissors | Merit | 97-275 | |
| Micropipette Puller | Sutter Instrument | p-97 | |
| Mm-Gabrd-C2 mRNA probe | ACD | 459481-C2 | |
| mouse euthanasia chamber | NA | NA | custom build; glass petri dish covering a small glass jar. |
| nitrocellulose membrane filters | GE Healthcare Life Sciences; Whatman | 7184-005 | 0.45 µm pore size |
| Picospritzer | General Valve Corporation | Picospritzer II | referred to in the text as microcellular injection unit |
| plastic transfer pipets | Fisherbrand | 13-711-7M | for constructing custom transfer pipette |
| Plastic tubing | Tygon | R-603 | for connection to carbogen tank |
| platinum harp | custom build | NA | for anchoring split retinas within the electrophysiology recording chamber. |
| size 0 paint brush | generic | NA | for flattening retina during splitting. |
| SlowFade Gold antifade reagent | Molecular Probes | S36937 | referred to in the text as anti-fade mounting media |
| small 10 mm petri dish | Falcon | 353001 | eyes are placed here following enucleation |
| small glass pane (7.5 cm x 5 cm) | generic | NA | isolatd retina pieces are placed onto this for the splitting procedure |
| Superfrost plus microscope slides | Fisherbrand | 12-550-15 | electrostatically-charged glass microscope slides |
| Thick-walled borosilicate glass pipettes with filament | Sutter Instrument | BF150-86-10HP | |
| Vannas Scissors; straight | Titan Medical | TMS121 | not brand specific; any comparable scissors will work |
| vGATFLPo mouse | Jackson Laboratories | 29591 | RRID: IMSR_JAX:029591 |
| vGlut2Cre mouse | Jackson Laboratories | 28863, 016963 | RRID: IMSR_JAX:028863, RRID: IMSR_JAX:016963 |
| Zombie NIR Fixable Viability Kit | BioLegend | 423105 | referred to in the text as MI-NIR |
Referenzen
- Morgans, C. W. Neurotransmitter release at ribbon synapses in the retina. Immunology & Cell Biology. 78 (4), 442-446 (2000).
- Euler, T., Haverkamp, S., Schubert, T., Baden, T. Retinal bipolar cells: elementary building blocks of vision. Nature Reviews Neuroscience. 15 (8), 507-519 (2014).
- Barnes, S., Grove, J. C. R., McHugh, C. F., Hirano, A. A., Brecha, N. C. Horizontal Cell Feedback to Cone Photoreceptors in Mammalian Retina: Novel Insights From the GABA-pH Hybrid Model. Frontiers in Cellular Neuroscience. 14, (2020).
- Walston, S. T., Chang, Y. C., Weiland, J. D., Chow, R. H. Method to remove photoreceptors from whole mount retina in vitro. Journal of Neurophysiology. 118 (5), 2763-2769 (2017).
- Stefanov, A., Novelli, E., Strettoi, E. Inner retinal preservation in the photoinducible I307N rhodopsin mutant mouse, a model of autosomal dominant retinitis pigmentosa. Journal of Comparative Neurology. 528 (9), 1502-1522 (2020).
- Matsuoka, R. L., Nguyen-Ba-Charvet, K. T., Parray, A., Badea, T. C., Chédotal, A., Kolodkin, A. L. Transmembrane semaphorin signaling controls laminar stratification in the mammalian retina. Nature. 470 (7333), 259-263 (2011).
- Matsuoka, R. L., et al. Guidance-Cue Control of Horizontal Cell Morphology, Lamination, and Synapse Formation in the Mammalian Outer Retina. Journal of Neuroscience. 32 (20), 6859-6868 (2012).
- Wässle, H., Puller, C., Müller, F., Haverkamp, S. Cone Contacts, Mosaics, and Territories of Bipolar Cells in the Mouse Retina. Journal of Neuroscience. 29 (1), 106-117 (2009).
- Thoreson, W. B., Dacey, D. M. Diverse Cell Types, Circuits, and Mechanisms for Color Vision in the Vertebrate Retina. Physiological Reviews. 99 (3), 1527-1573 (2019).
- Guido, M. E., et al. A simple method to obtain retinal cell preparations highly enriched in specific cell types. Suitability for lipid metabolism studies. Brain Research Protocols. 4 (2), 147-155 (1999).
- Rose, K., Walston, S. T., Chen, J. Separation of photoreceptor cell compartments in mouse retina for protein analysis. Molecular Neurodegeneration. 12 (1), 28(2017).
- Todorova, V., et al. Retinal Layer Separation (ReLayS) method enables the molecular analysis of photoreceptor segments and cell bodies, as well as the inner retina. Scientific Reports. 12 (1), 20195(2022).
- Shiosaka, S., Kiyama, H., Tohyama, M. A simple method for the separation of retinal sublayers from the entire retina with special reference to application for cell culture. Journal of Neuroscience Methods. 10 (3), 229-235 (1984).
- Ivanova, E., Hwang, G. S., Pan, Z. H. Characterization of transgenic mouse lines expressing Cre-recombinase in the retina. Neuroscience. 165 (1), 233-243 (2010).
- Sarria, I., Orlandi, C., McCall, M. A., Gregg, R. G., Martemyanov, K. A. Intermolecular Interaction between Anchoring Subunits Specify Subcellular Targeting and Function of RGS Proteins in Retina ON-Bipolar Neurons. The Journal of Neuroscience. 36 (10), 2915-2925 (2016).
- Orlandi, C., Cao, Y., Martemyanov, K. A. Orphan Receptor GPR179 Forms Macromolecular Complexes With Components of Metabotropic Signaling Cascade in Retina ON-Bipolar Neurons. Investigative Ophthalmology & Visual Science. 54 (10), 7153-7161 (2013).
- Dikshit, A., Zong, H., Anderson, C., Zhang, B., Ma, X. -J. Simultaneous Visualization of RNA and Protein Expression in Tissue Using a Combined RNAscopeTM In Situ Hybridization and Immunofluorescence Protocol. Methods in Molecular Biology. 2148, Clifton, N.J. 301-312 (2020).
- Wang, F., et al. RNAscope. The Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Morgans, C. W., et al. TRPM1 is required for the depolarizing light response in retinal ON-bipolar cells. Proceedings of the National Academy of Sciences of the United States of America. 106 (45), 19174-19178 (2009).
- Alessio, E., Zhang, D. Q. Immunostaining of whole-mount retinas with the CLARITY tissue clearing method. Investigative Ophthalmology & Visual Science. 61 (7), 5054(2020).
- Ferguson, L. R., Dominguez, J. M., Balaiya, S., Grover, S., Chalam, K. V. Retinal Thickness Normative Data in Wild-Type Mice Using Customized Miniature SD-OCT. PLoS ONE. 8 (6), e67265(2013).
- Ivanova, E., Toychiev, A. H., Yee, C. W., Sagdullaev, B. T. Optimized Protocol for Retinal Wholemount Preparation for Imaging and Immunohistochemistry. Journal of Visualized Experiments JoVE. (82), e51018(2013).
- Kolb, H. Neurotransmitters in the Retina. Webvision: The Organization of the Retina and Visual System. , University of Utah Health Sciences Center. (1995).
- Chaya, T., et al. Versatile functional roles of horizontal cells in the retinal circuit. Scientific Reports. 7 (1), 5540(2017).
- Egger, V., Diamond, J. S. A17 Amacrine Cells and Olfactory Granule Cells: Parallel Processors of Early Sensory Information. Frontiers in Cellular Neuroscience. 14, 600537(2020).
- Dacey, D. M. The dopaminergic amacrine cell. The Journal of Comparative Neurology. 301 (3), 461-489 (1990).
- Park, S. J., et al. Connectomic analysis reveals an interneuron with an integral role in the retinal circuit for night vision. eLife. 9, 56077(2020).
- Janssen-Bienhold, U., et al. Connexin57 is expressed in dendro-dendritic and axo-axonal gap junctions of mouse horizontal cells and its distribution is modulated by light. The Journal of Comparative Neurology. 513 (4), 363-374 (2009).
- Jain, V., et al. The functional organization of excitation and inhibition in the dendrites of mouse direction-selective ganglion cells. eLife. 9, 52949(2020).
- Marvin, J. S., et al. Stability, affinity, and chromatic variants of the glutamate sensor iGluSnFR. Nature Methods. 15 (11), 936-939 (2018).
- Strauss, S., et al. Center-surround interactions underlie bipolar cell motion sensitivity in the mouse retina. Nature Communications. 13 (1), 5574(2022).
- Marvin, J. S., et al. A genetically encoded fluorescent sensor for in vivo imaging of GABA. Nature Methods. 16 (8), 763-770 (2019).
- Beckwith-Cohen, B., Holzhausen, L. C., Wang, T. M., Rajappa, R., Kramer, R. H. Localizing Proton-Mediated Inhibitory Feedback at the Retinal Horizontal Cell-Cone Synapse with Genetically-Encoded pH Probes. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 39 (4), 651-662 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten