Method Article
Retina divisa come preparazione flatmount migliorata per lo studio dei neuroni dello strato nucleare interno nella retina dei vertebrati
In questo articolo
Riepilogo
Questo lavoro presenta una preparazione alternativa della retina flatmount in cui la rimozione dei corpi cellulari dei fotorecettori consente una diffusione più rapida degli anticorpi e un migliore accesso con pipette patch ai neuroni retinici interni per esperimenti di immunoistochimica, ibridazione in situ ed elettrofisiologia.
Abstract
Le cellule bipolari e le cellule orizzontali della retina dei vertebrati sono i primi neuroni a elaborare le informazioni visive dopo che i fotoni sono stati rilevati dai fotorecettori. Eseguono operazioni fondamentali come l'adattamento alla luce, la sensibilità al contrasto e l'opposizione spaziale e cromatica. Una comprensione completa dei circuiti precisi e dei meccanismi biochimici che governano il loro comportamento farà progredire la ricerca sulle neuroscienze visive e la medicina oftalmologica. Tuttavia, gli attuali preparativi per l'esame delle cellule bipolari e orizzontali (supporti retinici interi e fette verticali) sono limitati nella loro capacità di catturare l'anatomia e la fisiologia di queste cellule. In questo lavoro, presentiamo un metodo per rimuovere i corpi cellulari dei fotorecettori dalle retine di topo vive e piatte, fornendo un migliore accesso alle cellule bipolari e orizzontali per un efficiente patch clamping e una rapida immunomarcatura. Le retine divise vengono preparate inserendo una retina di topo isolata tra due pezzi di nitrocellulosa, quindi staccandoli delicatamente. La separazione divide la retina appena sopra lo strato plessiforme esterno per produrre due pezzi di nitrocellulosa, uno contenente i corpi cellulari dei fotorecettori e un altro contenente la retina interna rimanente. A differenza delle fette verticali di retina, la preparazione della retina divisa non interrompe i processi dendritici dei neuroni retinici interni, consentendo registrazioni da cellule bipolari e orizzontali che integrano i contributi delle reti accoppiate alla giunzione gap e delle cellule amacrine ad ampio campo. Questo lavoro dimostra la versatilità di questo preparato per lo studio di cellule orizzontali e bipolari in esperimenti di elettrofisiologia, immunoistochimica e ibridazione in situ .
Introduzione
La retina è un sottile tessuto neurale situato nella parte posteriore dell'occhio dove la luce viene intercettata ed elaborata in un segnale elettrochimico che può essere interpretato dal cervello. Nella parte posteriore della retina, i fotorecettori dei coni e dei bastoncelli sono stimolati dalla luce, che riduce il tasso di rilascio tonico del neurotrasmettitore, il glutammato1. I primi neuroni a sperimentare e rispondere a questo cambiamento indotto dalla luce nella concentrazione di glutammato sono le cellule bipolari (BC) e le cellule orizzontali (HC), i cui somi risiedono nella regione più esterna dello strato nucleare interno (INL). Questi neuroni di secondo ordine eseguono la prima fase dell'elaborazione del segnale nella retina e modellano le caratteristiche critiche della visione come l'adattamento alla luce, la sensibilità al contrasto e l'opposizione spaziale/cromatica2. Mentre queste funzioni sono state attribuite a BC e HC, i circuiti e i meccanismi biochimici alla base di questi processi non sonocompletamente compresi. Pertanto, l'avanzamento di strumenti e metodi per esplorare la fisiologia BC e HC è di fondamentale importanza.
Le sezioni verticali (trasversali) della retina si sono dimostrate a lungo il modello più pratico per lo studio di BC e HC; tuttavia, alcuni aspetti della fisiologia BC e HC sono inaccessibili allo sperimentatore nell'ambito di questo modello. Le registrazioni dirette degli HC o le misurazioni indirette dei loro effetti sui BC non riflettono la connettività endogena della retina poiché i processi laterali di queste cellule vengono recisi durante lo slicing. I preparati a base di retina a montaggio intero aggirano questo problema preservando questi processi laterali, ma gli strati retinici circostanti rappresentano una sfida per l'accesso a queste cellule4. Mentre ci sono abbondanti esempi di immunocolorazione 5,6,7,8 e registrazioni di patch clamp9 da neuroni INL in retine intere, c'è l'opportunità di accelerare e semplificare la raccolta di questi dati. I limiti intrinseci delle sezioni trasversali e le sfide dell'intero modello di montaggio hanno quindi ispirato lo sviluppo di questa preparazione alternativa della retina a montaggio piatto.
Il seguente lavoro descrive un protocollo per rimuovere facilmente lo strato di fotorecettori dalle retine vive e piatte per migliorare l'accesso a BC e HC per un patch clamping semplificato e un'immunomarcatura più rapida ed efficiente. La rimozione di due pezzi di membrana di nitrocellulosa attaccati a entrambi i lati di una retina isolata strappa il tessuto attraverso gli assoni dei fotorecettori, lasciando una retina divisa che trattiene lo strato plessiforme esterno (OPL) e tutti gli strati retinici interni. Mentre altri hanno descritto protocolli per separare meccanicamente gli strati della retina, questi metodi sono poco adatti per il patch clamping e le applicazioni di microscopia o richiedono una noiosa manipolazione del tessuto. Molti di questi metodi richiedono tessuto congelato o liofilizzato per la separazione degli strati, rendendoli incompatibili con gli esperimenti di elettrofisiologia10,11,12. Altri sono progettati per tessuti vivi, ma richiedono 5-15 peeling sequenziali con carta da filtro 4,11 o un trattamento con tripsina 13 per rimuovere i fotorecettori. La tecnica qui descritta migliora le precedenti semplificando la procedura di rimozione dei fotorecettori e ampliando il repertorio delle applicazioni a valle.
Protocollo
Ai topi è stata fornita acqua e cibo ad libitum e sono stati mantenuti con un ciclo luce/buio di 12 ore. I topi sono stati soppressi mediante esposizione all'isoflurano seguita da lussazione cervicale. Tutte le procedure sugli animali sono state conformi alle linee guida del National Institutes of Health e approvate dal Comitato istituzionale per la cura e l'uso degli animali dell'Oregon Health and Science University.
NOTA: L'enucleazione dell'occhio, la dissezione della retina e la divisione della retina devono essere eseguite il più rapidamente possibile per preservare la salute del tessuto vivente. Cerca di completare la dissezione in < 4 minuti per occhio. Questi tre passaggi devono essere eseguiti in sequenza. Topi wild-type: per gli esperimenti sono stati utilizzati topi C57BL/6J maschi e femmine adulti (>3 mesi). Per la morfologia delle sinapsi, sono stati utilizzati topi che esprimono la proteina fluorescente verde (GFP) sotto il promotore Pcp2 (Pcp2-cre/GFP)14 . Topi transgenici: per la visualizzazione orizzontale delle cellule con GFP durante esperimenti di immunoistochimica o elettrofisiologia, è stato utilizzato un topo triplo transgenico: vGATFLPo; vGlut2Cre; AI80d. I ceppi vGATFlpo e vGluT2Cre sono topi knock-in che esprimono Flpo o Cre ricombinasi a valle dei rispettivi promotori. Il topo Ai80d è un topo reporter intersezionale (CatCh/EYFP) ed esprime solo rodopsina del canale permeabile Ca2+ (ChR2) nelle cellule che esprimono le ricombinasi Cre e Flpo. Pertanto, il topo transgenico triplo esprime ChR2 solo in cellule con una storia di espressione sia di VGAT che di vGluT2.
1. Preparazione dei materiali per la dissezione della retina e la divisione della retina
- Preparare pezzi di membrana di nitrocellulosa
NOTA: Il distacco della retina divisa dalla membrana in nitrocellulosa riduce la fluorescenza di fondo in microscopia e semplifica la registrazione del patch clamp. La rimozione della membrana può essere eseguita prima o dopo la fissazione del tessuto. Per le retine divise fisse, non è necessario trattare i pezzi di membrana in nitrocellulosa. Per le retine divise vive, trattare la membrana secondo i passaggi 1.1.3 - 1.1.5 per facilitare il distacco delicato dal tessuto.- Tagliare 16 pezzi (o più) di membrana di nitrocellulosa in quadrati di 5 mm x 5 mm. Extra può essere preparato alla rinfusa e conservato per un uso futuro.
- Metti da parte metà dei pezzi di membrana per un uso successivo. Questi pezzi non saranno trattati con una soluzione bloccante.
- Incubare i pezzi rimanenti in una soluzione bloccante IHC priva di detergenti (come 3% siero di cavallo + 0,025% NaN3 diluito in PBS) per 10 minuti a temperatura ambiente, agitando delicatamente.
ATTENZIONE: Utilizzare DPI appropriati quando si maneggia NaN3, poiché è una potente tossina. - Lavare accuratamente i pezzi di membrana mediante incubazione in terreno Ames tamponato con bicarbonato per 10 minuti a temperatura ambiente, agitando delicatamente.
- Asciugare completamente all'aria i pezzi di membrana ostruiti (~20 min). Etichettare e conservare i pezzi di membrana a temperatura ambiente, tenendoli separati dai pezzi di membrana non trattati.
- Preparare i supporti Ames
- Preparare il terreno Ames tamponato con bicarbonato e mantenere la soluzione a temperatura ambiente sotto carbogenazione costante (95% O 2 e 5% CO2 ).
2. Enucleazione dell'occhio del topo
- Sopprimere il topo con qualsiasi metodo disponibile secondo le linee guida istituzionali IACUC.
- Capovolgi il mouse su un lato e usa due dita per premere delicatamente intorno all'orbita. Ciò farà sì che l'occhio fuoriesca dal cranio.
- Usando forbici da dissezione curve, taglia sotto l'occhio rigonfio per recidere il nervo ottico e separare l'occhio dal cranio.
- Raccogli l'occhio con le forbici e mettilo in una capsula di Petri riempita con terreno Ames ghiacciato.
NOTA: Per le applicazioni a valle in cui il tessuto verrà fissato dopo la scissione, è possibile utilizzare PBS ghiacciato al posto dei terreni Ames. - Ripetere i passaggi da 2.1 a 2.4 per l'occhio rimanente.
3. Dissezione della retina
- Utilizzate la pipetta di trasferimento in vetro personalizzata per trasferire un occhio su una nuova capsula di Petri contenente terreni Ames freschi e ghiacciati.
NOTA: L'ampia apertura della pipetta di trasferimento personalizzata impedisce lo schiacciamento accidentale del tessuto e l'uso del vetro riduce al minimo l'adesione del tessuto alle pareti della pipetta. Tuttavia, una pipetta di trasferimento in plastica a bocca larga è accettabile anche se lo sperimentatore è già esperto nell'uso di questo strumento. - Usa le pinze per stabilizzare l'occhio fissando il suo tessuto connettivo extra sul fondo della capsula di Petri. Quindi, fora la cruna lungo la linea dell'ora serrata usando un ago da 25G per creare un punto di ingresso per le forbici Vannas.
- Utilizzare le forbici Vannas per tagliare lungo la linea dell'ora serrata fino a quando la cornea non si stacca dal resto dell'occhio (Figura supplementare 1A). Rimuovere la lente dall'oculare utilizzando una pinza (Figura supplementare 1B).
- Utilizzare la pipetta di vetro personalizzata per trasferire l'oculare in un grande volume (≥100 ml) di Ames carbogenato e ripetere i passaggi da 3.1 a 3.3 con l'occhio rimanente.
NOTA: Le conchiglie oculari vengono inserite in Ames carbogenati per mantenere la salute dei tessuti mentre la dissezione viene eseguita sull'altro occhio. - Trasferire una conchiglia oculare in una capsula di Petri riempita con Ames appena carbogenato.
- Usando le forbici Vannas, fai un piccolo taglio verso l'interno dal bordo della sclera, quindi usa due paia di pinze per staccare la sclera dalla retina (Figura supplementare 1C). Evita di afferrare la retina con le pinze. Invece, separa i lembi della sclera creati dalla forbice.
- Utilizzare le forbici Vannas per tagliare il nervo ottico che collega la sclera e la retina (Figura supplementare 1D), quindi sollevare delicatamente la retina dalla sclera usando le forbici o le pinze per isolare la retina. (Figura 1A).
NOTA: Mentre l'RPE rimarrà in genere attaccato all'oculare, non sono necessari ulteriori passaggi per rimuovere l'RPE nel caso in cui sia attaccato alla retina. A questo punto, i bordi della retina possono essere opzionalmente tagliati con un bisturi per evitare che si arriccino durante la fase di appiattimento (Figura 1B). - Utilizzare un bisturi per tagliare la retina a metà o in quarti (Figura 1C), quindi utilizzare la pipetta di trasferimento personalizzata per riportare i pezzi in un grande volume (≥ 100 ml) di terreno di terreno Ames carbogenato in continuo.
NOTA: La scelta delle metà o dei quarti è soggettiva. Scegliere l'opzione migliore per l'applicazione desiderata. - Ripetere i passaggi da 3.5 a 3.8 per l'occhio rimanente prima di procedere alla divisione della retina.
4. Spaccatura della retina
- Eliminare il terreno Ames dalle piastre di Petri e sostituirlo con Ames appena carbogenato.
NOTA: Per mantenere la carbogenazione per tutto il resto della procedura di divisione della retina, sostituire il terreno nella capsula di Petri con Ames appena carbogenato all'incirca ogni 5 minuti. - Utilizzando la pipetta di trasferimento personalizzata, posizionare un pezzo di retina su un vetrino (7,5 cm x 5 cm), con la cellula gangliare rivolta verso l'alto, quindi appiattirlo rimuovendo il liquido circostante con una salvietta delicata (Figura 1D). Se necessario, tirare delicatamente i bordi della retina con un pennello a punta fine sotto un microscopio da dissezione.
- Utilizzare una pinza per abbassare un pezzo secco di membrana in nitrocellulosa di 5 mm x 5 mm sulla retina, facendolo aderire al lato della cellula gangliare (Figura 1E).
NOTA: Se è necessaria la rimozione della membrana dal tessuto vivo (ad esempio, per l'elettrofisiologia), utilizzare un pezzo asciutto di membrana trattata con siero per questa fase (vedere i passaggi 1.1.3 - 1.1.5 per i dettagli). Ciò riduce la forza dell'adesione allo strato di cellule ganglionari, facilitando la rimozione della retina dalla nitrocellulosa dopo la scissione. - Capovolgere la retina in modo che la nitrocellulosa poggi sul vetrino e posizionare un pezzo asciutto di membrana di 5 mm x 5 mm sul lato fotorecettore della retina (Figura 1F).
- Toccare con la punta bagnata del pennello lo spazio tra le due membrane e lasciare che l'azione capillare risucchi l'Ames nel sandwich (Figura 1G). Ciò riduce l'aderenza delle membrane alla retina ed è necessario solo se la retina è stata eccessivamente asciugata con la delicata salvietta.
NOTA: Se la retina ha perso il suo aspetto lucido, è stata eccessivamente secca ed è necessario il passaggio 4.5. - Per garantire un'aderenza uniforme, applicare una leggera pressione verso il basso sulla membrana superiore con un pennello bagnato (Figura 1H).
- Mentre si fissa la membrana inferiore al vetro con un paio di pinze, utilizzare un movimento lento e costante per staccare delicatamente la membrana superiore con un secondo paio di pinze. Ciò causerà la divisione della retina appena sopra l'OPL (Figura 1I).
- Scartare la membrana superiore contenente i fotorecettori (Figura 1J, a sinistra). La membrana inferiore contiene la retina interna, d'ora in poi denominata retina divisa (Figura 1J, a destra).
- Riportare immediatamente la retina divisa nei terreni di Ames carbogenati.
NOTA: Per gli esperimenti su tessuti viventi, le retine possono beneficiare di un periodo di recupero di 15-30 minuti in Ames carbogenato dopo la scissione.

Figura 1: Procedura di splittazione della retina. (A) Dopo l'enucleazione e la preparazione della conchiglia oculare in terreni PBS o Ames freddi, isolare la retina del topo dall'oculare e sostituire il PBS con terreni Ames carbogenati a temperatura ambiente. (B) Usando un bisturi, taglia i bordi della retina fino a quando non ci sono regioni con un ricciolo verso l'interno (facoltativo). (C) Tagliare la retina in quarti o a metà usando un bisturi. (D) Posizionare un pezzo di retina su un vetrino (con la cellula gangliare rivolta verso l'alto) utilizzando la pipetta di trasferimento personalizzata e rimuovere tutto l'Ames in eccesso utilizzando una salvietta delicata. Assicurarsi che la retina semi-secca sia appoggiata sul vetro prima di procedere al passaggio successivo. Usa la punta di un pennello bagnato da Ames per aprire delicatamente le regioni della retina che non sono piatte. (E) Usando una pinza, posizionare un pezzo pretagliato di membrana in nitrocellulosa secca (5 mm x 5 mm) sulla retina appiattita. (F) Capovolgere il pezzo di nitrocellulosa in modo che il lato fotorecettore della retina sia ora rivolto verso l'alto. Quindi posizionare un altro pezzo di membrana asciutto sulla retina. (G) Toccare la punta bagnata della spazzola con lo spazio tra le due membrane e lasciare che l'azione capillare risucchi l'Ames nel sandwich. Ciò riduce l'aderenza delle membrane alla retina ed è necessario solo se la retina è stata eccessivamente asciugata con la delicata salvietta. (H) Utilizzare la punta di un pennello bagnato per premere delicatamente verso il basso al centro della retina a sandwich. (I) Utilizzare un paio di pinze per fissare il pezzo inferiore di membrana sul vetrino, mentre si utilizza un altro paio di pinze per staccare delicatamente il pezzo superiore di membrana da quello inferiore. (J) La retina interna (a sinistra) rimane sulla membrana inferiore mentre i fotorecettori (a destra) vengono allontanati con la membrana superiore. I pannelli (A), (B), (C), (D) e (J) sono stati acquisiti utilizzando un microscopio da dissezione; la barra della scala rappresenta circa 1 mm; (E-I) sono stati acquisiti con la fotocamera di uno smartphone senza ingrandimento. Fare clic qui per visualizzare una versione più grande di questa figura.
5. Preparazione di retine divise per esperimenti di immunofluorescenza
NOTA: La retina divisa sarà ancora attaccata alla membrana di nitrocellulosa fino al passaggio 5.5. Completare i passaggi 5.1, 5.2, 5.3 o 5.4, non tutti e quattro in quanto si tratta di esperimenti diversi.
ATTENZIONE: Utilizzare DPI appropriati e procedere con cautela quando si maneggia la paraformaldeide (fissativo).
- Preparazione per l'immunofluorescenza flatmount
- Incubare la retina divisa in paraformaldeide al 4% su ghiaccio per 30 minuti utilizzando una soluzione sufficiente a coprire completamente la retina.
- Lavare le retine divise 3 volte in 5-10 ml di PBS a temperatura ambiente. Pausa facoltativa: le retine divise possono essere lasciate in PBS a 4 °C per un massimo di 24 ore.
- Preparazione all'immunofluorescenza con sezioni verticali di retina divisa
- Incubare la retina divisa in paraformaldeide al 4% su ghiaccio per 30 minuti utilizzando una soluzione sufficiente a coprire completamente la retina.
- Lavare le retine divise 3 volte in 5-10 ml di PBS a temperatura ambiente. Pausa facoltativa: le retine divise possono essere lasciate in PBS a 4 °C per un massimo di 24 ore.
- Con la membrana ancora attaccata, immergere in sequenza la retina divisa in saccarosio al 10%, 20% e 30% a 4 °C per 1 ora ciascuna per crioproteggere il tessuto.
- Incorporare le retine divise crioprotette in un composto a temperatura di taglio ottimale (O.C.T.) e conservarle a -80 °C (fino a 6 mesi) fino alla criosezione.
- Rimuovere le retine divise incorporate da -80 °C e utilizzare un criostato per tagliare sezioni spesse 20 μm. Montare le sezioni su vetrini da microscopio caricati elettrostaticamente, lasciarli asciugare all'aria, quindi conservarli a -20 °C per un massimo di 6 mesi.
- Preparazione per ibridazione in situ a doppia fluorescenza e immunoistochimica
- Incubare la retina divisa in paraformaldeide al 4% su ghiaccio per 2 ore utilizzando una soluzione sufficiente a coprire completamente la retina.
- Lavare le retine divise 3 volte in 5-10 ml di PBS a temperatura ambiente. Pausa facoltativa: le retine divise possono essere lasciate in PBS a 4 °C per un massimo di 24 ore.
- Preparazione per l'elettrofisiologia
- Preparare le pipette patch estraendo le pipette in vetro borosilicato a parete spessa con il filamento utilizzando un estrattore per micropipette. Utilizzare solo pipette con una resistenza misurata compresa tra 6 e 10 MΩ.
- Riempire nuovamente le pipette estratte con una soluzione interna contenente (in mM): 125 K-gluconato, 8 KCl, 5 HEPES, 1 MgCl 2, 1 CaCl 2,0,2 EGTA, 3 ATP-Mg e 0,5 GTP-Na.
- Rimozione della retina divisa dalla membrana di nitrocellulosa
- Utilizzando una penna barriera idrofoba, preparare dei pozzetti circolari su un vetrino da microscopio (~1 cm di diametro) e lasciarli asciugare all'aria per 5-10 minuti.
- Posizionare le retine divise all'interno dei pozzetti della penna barriera idrofobica preparati e aggiungere una quantità di PBS sufficiente a coprirle completamente.
- Sotto un microscopio da dissezione, spingere le setole di un pennello fine sotto i bordi del tessuto e sollevare delicatamente verso l'alto. In questo modo, lavora intorno alla retina in cerchio per sollevarla dalla membrana.
- Usa una pinza per rimuovere la membrana da sotto il pezzo di retina galleggiante.
- Aspirare con cautela il PBS rimanente in modo che il pezzo di retina si appoggi sul vetrino del microscopio, con la cellula gangliare rivolta verso il basso.
NOTA: I seguenti passaggi non devono essere eseguiti in sequenza. Scegliere il protocollo appropriato per l'applicazione desiderata (ad esempio, immunocolorazione o ibridazione in situ a doppia fluorescenza [FISH] e immunoistochimica [IHC] o elettrofisiologia).
6. Immunocolorazione
- Se non ancora preparato, utilizzare una penna barriera idrofobica per creare pozzetti circolari su un vetrino da microscopio (~1 cm di diametro) e lasciarli asciugare all'aria per 5-10 minuti. Tutte le fasi di incubazione e di lavaggio saranno eseguite all'interno di questi pozzetti.
- Incubare le retine divise o le sezioni verticali della retina divisa in soluzione di incubazione anticorpale (AIS: 3% siero di cavallo, 0,5% Triton X-100, 0,025% NaN3 in PBS) per 30 minuti a temperatura ambiente.
- Incubare le retine divise o le sezioni verticali della retina con anticorpi primari diluiti in AIS per 1 ora a temperatura ambiente.
NOTA: Il tempo di incubazione degli anticorpi primari richiederà l'ottimizzazione per diversi bersagli proteici e anticorpi. - Lavare il fazzoletto 3 volte in PBS a temperatura ambiente.
- Incubare il tessuto con anticorpi secondari diluiti in AIS per 1 ora a temperatura ambiente. Lavare il fazzoletto 3 volte in PBS a temperatura ambiente.
- Se si desidera la colorazione nucleare, incubare il tessuto con DAPI diluito in PBS per 30 s a temperatura ambiente. Lavare il fazzoletto 1 volta in PBS a temperatura ambiente.
- Applicare una goccia di materiale di montaggio per vetrini su ciascun pezzo di tessuto e montare un vetrino coprioggetti.
- Applicare lo smalto intorno ai bordi del vetrino coprioggetto per sigillare il campione. Conservare il vetrino a 4 °C.
7. Doppio FISH e IHC
- Cuocere le retine divise a 40 °C per 30 minuti in forno di ibridazione per aumentare l'aderenza al vetrino.
- Completare il protocollo RNAscope FISH secondo il protocollo del produttore con le seguenti eccezioni e modifiche:
- Non è necessaria alcuna fase di recupero dell'antigene. Utilizzare la proteasi III con un tempo di incubazione di 18 minuti a temperatura ambiente.
- Eseguire tutte le fasi di lavaggio sul vetrino all'interno dei pozzetti realizzati da una penna barriera idrofoba.
- Incubare i campioni in anticorpo primario diluito (vedere Tabella dei materiali) in PBS per 30 minuti a 40 °C nel forno di ibridazione. Lavare i campioni 3 volte in PBS a temperatura ambiente.
- Incubare i campioni in anticorpi secondari diluiti (vedi Tabella dei materiali) in PBS per 30 minuti a 40 °C nel forno di ibridazione. Lavare i campioni 3 volte in PBS a temperatura ambiente.
- Incubare i campioni in 1x DAPI per 30 s a temperatura ambiente. Lavare i campioni 1 volta in PBS a temperatura ambiente.
- Applicare una goccia di materiale di montaggio anti-sbiadimento su ogni pezzo di tessuto e montare un vetrino coprioggetti.
- Applicare lo smalto intorno ai bordi del vetrino coprioggetto per sigillare il campione. Conservare il vetrino a 4 °C.
8. Elettrofisiologia
- Dopo aver rimosso la membrana di nitrocellulosa, trasferire una retina divisa nella camera di registrazione del patch-clamp e ancorarla delicatamente in posizione con un'arpa di platino.
- Durante l'esperimento, perfondere continuamente la retina divisa con una soluzione di Ames carbogenata con il 95% di O 2 e il 5% di CO2 . Mantenere la soluzione a una temperatura compresa tra 32-34 °C.
NOTA: Durante l'esperimento, il tessuto può essere visualizzato utilizzando la microscopia a gradiente di contrasto Dodt. - Sotto l'illuminazione della stanza, eseguire il clampaggio della tensione dell'intera cellula per registrare dai neuroni INL.
- Durante la registrazione, simula le risposte alla luce utilizzando un'unità di iniezione microcellulare per applicare composti farmaceutici o un LED a 470 nm per stimolare la canalrodopsina (ChR2).
NOTA: L'intensità della luce può essere misurata utilizzando un misuratore di potenza ottica digitale.
- Durante la registrazione, simula le risposte alla luce utilizzando un'unità di iniezione microcellulare per applicare composti farmaceutici o un LED a 470 nm per stimolare la canalrodopsina (ChR2).
9. Microscopia confocale
- Per l'immunofluorescenza confocale, acquisire immagini con un microscopio confocale utilizzando un obiettivo a immersione in olio 40x/1,3 o 63x/1,40. Utilizzare FIJI per regolare la luminosità e il contrasto e per generare proiezioni Z da pile di immagini.
Risultati
La divisione della retina preserva i terminali dei fotorecettori
Per confermare che la scissione della retina non danneggia i dendriti dei neuroni di secondo ordine nell'OPL, sezioni verticali di retine divise sono state colorate con anticorpi contro la proteina della vescicola sinaptica sinaptofisina (verde) e la proteina chinasi C alfa (PKCα; rosso). L'intensa banda di marcatura della sinaptofisina nella parte superiore della retina divisa indica che i terminali sinaptici dei fotorecettori sono mantenuti (Figura 2). Inoltre, la colorazione con PKCα rivela la normale morfologia delle cellule bipolari dei bastoncelli (RBC). Non sono visibili nuclei di fotorecettori, il che indica che la retina è divisa tra l'OPL e la fila più interna di corpi cellulari fotorecettori (Figura 2).
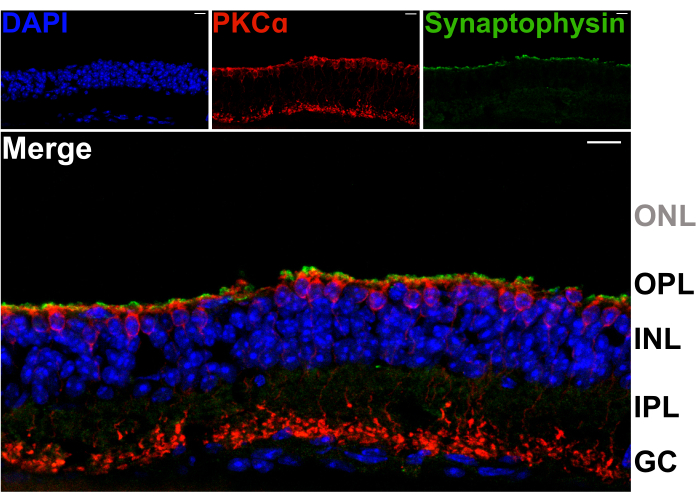
Figura 2: Le retine divise trattengono i terminali dei fotorecettori. Micrografie confocali fluorescenti che mostrano una sezione trasversale verticale di una retina sputata che è stata criosezionata (spessore 20 μm) dopo la procedura di scissione. Ogni immagine è una proiezione massima di uno z-stack confocale. La sezione è stata immunomarcata con anticorpi contro PKCα (in alto al centro) e sinaptofisina (in alto a destra) per visualizzare rispettivamente i globuli rossi e le vescicole sinaptiche. L'immagine unita (in basso) mostra le vescicole sinaptiche (in verde), che risiedono nei terminali dei fotorecettori, appena sopra i processi apicali dei globuli rossi (in rosso) nell'OPL. I nuclei cellulari sono marcati con DAPI (blu). Nessun nucleo di fotorecettori è visibile all'interno dell'ONL. Abbreviazioni: ONL = strato nucleare esterno; OPL = strato plessiforme esterno; INL = strato nucleare interno; IPL = strato plessiforme interno; GC = cellule ganglionari. Barre di scala = 10 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
La morfologia delle sinapsi nell'OPL è preservata dopo la scissione della retina
Utilizzando un topo che esprime GFP nei globuli rossi sotto il promotore pcp2, 14 proteine pre- e post-sinaptiche nell'OPL sono state immunomarcate per valutare l'integrità di questo strato sinaptico dopo una divisione14. Nonostante le forze di taglio che si verificano attraverso gli assoni dei fotorecettori, la scissione non perturba la morfologia delle sinapsi fotorecettoriali-BC nell'OPL, poiché si osserva il normale posizionamento dei dendriti dei globuli rossi, marcati per RGS11, e dei nastri sinaptici dei fotorecettori, marcati per CtBP215 (Figura 3). Per ogni contatto sinaptico tra bastoncelli e globuli rossi, RGS11 può essere visto come un punto rosso che si trova all'interno della forma a ferro di cavallo dei nastri sinaptici (verde). In un esperimento successivo, un anticorpo anti-GPR17916 è stato utilizzato per marcare le punte dendritiche post-sinapticheON-BC 16 e un anticorpo anti-PSD-95 è stato utilizzato per marcare i terminali dei fotorecettori dei bastoncelli pre-sinaptici (Figura 2 supplementare). Questi risultati confermano ancora una volta la stabilità dell'OPL nella preparazione della retina divisa, poiché i dendriti dei globuli rossi si associano strettamente con il loro partner pre-sinaptico, i terminali dei bastoncelli.
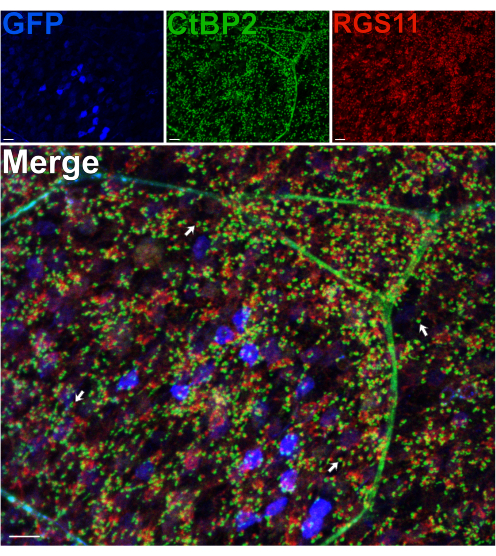
Figura 3: La morfologia delle sinapsi nell'OPL è preservata dopo la divisione della retina. Immagini di immunofluorescenza confocale di una retina divisa da un topo transgenico che esprime GFP in globuli rossi sotto il promotore Pcp2. I livelli di espressione della GFP (blu) variano tra i globuli rossi nella retina. Dopo la scissione, la retina è stata fissata, quindi incubata con anticorpi contro CtBP2 (verde) e RGS11 (rosso) per marcare rispettivamente i nastri sinaptici dei fotorecettori e le punte dendritiche ON-BC. Ogni coppia rosso-verde rappresenta un contatto sinaptico tra un bastoncino e un ON-BC. Barre di scala = 10 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
La divisione della retina mantiene la vitalità dei globuli rossi
Per valutare la vitalità dei neuroni retinici interni dopo una scissione, è stato utilizzato un colorante nucleare impermeabile alla membrana nel vicino infrarosso (MI-NIR), che consente l'identificazione delle cellule morte. Dopo l'incubazione con MI-NIR, le retine divise sono state fissate, quindi etichettate con anti-PKCα per identificare i globuli rossi. Le micrografie confocali della retina divisa rivelano una variabilità regionale nella vitalità cellulare in tutto il tessuto, con alcune regioni che sperimentano tassi più elevati di morte cellulare rispetto ad altre. Questa variabilità può derivare da danni inflitti a determinate regioni della retina durante le procedure di dissezione, scissione o manipolazione (Figura 4). Dato che i corpi cellulari dei globuli rossi risiedono nella regione più esterna dell'INL, vicino al sito della scissione, era giustificata un'attenta valutazione della loro vitalità. La scarsa colocalizzazione di PKCα e MI-NIR ha confermato che la maggior parte dei globuli rossi rimane vitale dopo la scissione della retina (Figura 4).
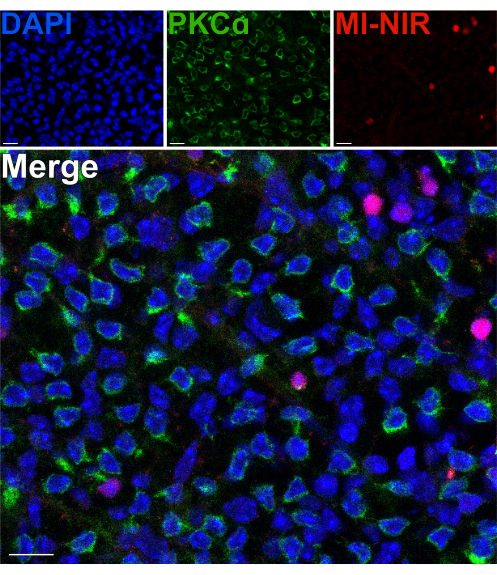
Figura 4: Le cellule bipolari dei bastoncelli sono vitali dopo la divisione della retina. Micrografie confocali fluorescenti che mostrano una regione di una retina divisa in una prospettiva flatmount. Dopo la scissione, la retina viva è stata incubata con colorante MI-NIR (rosso) per 30 minuti a 37 °C. La retina è stata quindi fissata e immunomarcata con anticorpi contro PKCα per visualizzare i globuli rossi. In questa regione della retina, la colocalizzazione di PKCα e MI-NIR è poco frequente. MI-NIR colocalizza con nuclei (blu) che non appartengono ai globuli rossi. Abbreviazioni: MI-NIR = colorazione viva/morta NIR impermeabile a membrana. Barre di scala = 10 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Le retine divise sono suscettibili di doppia FISH e IHC
Estendendo il tempo di fissazione per l'IHC standard, le retine divise possono essere processate in sequenza da FISH e IHC per marcare contemporaneamente mRNA e proteine17,18. Gli esperimenti hanno confermato che una fissazione di 2 ore in paraformaldeide al 4% produce una robusta marcatura dell'mRNA, pur preservando gli epitopi proteici per il legame con gli anticorpi. La FISH è stata eseguita su retine divise seguite da IHC per visualizzare l'espressione della subunità del recettore GABAA δ (GABRD; sonde mRNA anti-senso) in relazione alla posizione dei globuli rossi (anticorpo anti-PKCα) nell'INL esterno (Figura 5A). L'espressione dell'mRNA di GABRD appare rara nei globuli rossi (Figura 5A); tuttavia, il trascritto è abbondantemente espresso dalle cellule amacrine e dalle cellule ganglionari, come evidenziato dal pattern di marcatura sulle sezioni trasversali di una retina intatta (Figura 5B). Nell'INL esterno (Figura 5A), l'mRNA GABRD è distribuito in modo più uniforme rispetto all'INL interno (Figura 5C) dove è concentrato in cellule distinte. Le sonde antisenso che hanno come bersaglio altre subunità del recettore GABA producono modelli di marcatura distinti, dimostrando la specificità delle sonde (dati non mostrati).
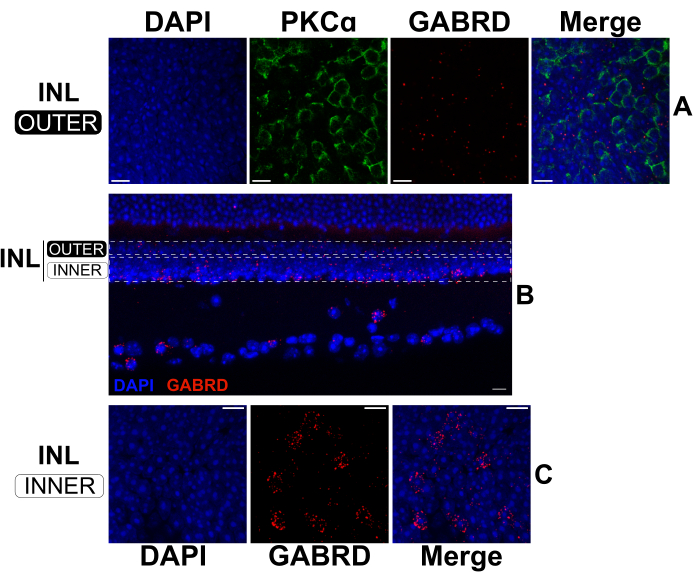
Figura 5: Doppio FISH e IHC in una retina divisa e una retina intatta. (A, C) Micrografie confocali di una retina divisa flatmount e (B) una sezione verticale di una retina intatta. Le immagini in (A) e (C) sono proiezioni massime di sezioni ottiche rispettivamente nelle regioni superiore e inferiore dell'INL. I rettangoli punteggiati in (B) rappresentano i contorni approssimativi utilizzati per creare le proiezioni mostrate in (A) e (C). La retina divisa (A, C) è stata fissata per 2 ore, quindi marcata con sonde a mRNA antisenso contro GABRD (rosso). Successivamente, la retina divisa è stata colorata con anticorpi contro PKCα per marcare i globuli rossi (verde). Il canale PKCα è stato omesso dalle proiezioni dell'INL inferiore per chiarezza. La retina intatta in (B) è stata fissata per 24 ore prima del sezionamento. Successivamente, la retina fissa è stata marcata con sonde a mRNA antisenso contro GABRD (rosso). Tutti i campioni sono stati colorati con DAPI (blu) per 20 secondi prima del montaggio del vetrino coprioggetto. Abbreviazioni: INL = strato nucleare interno. Barre graduate= 10 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Le retine divise sono adatte per la registrazione elettrofisiologica patch-clamp di BC e HC
Per applicare un patch a un soma BC o HC in una retina tradizionale a montaggio intero, la pipetta deve avvicinarsi dal lato della cellula gangliare o dal lato del fotorecettore. Entrambi gli approcci richiedono l'attraversamento di diversi strati retinici per raggiungere l'INL, durante il quale il puntale della pipetta viene spesso ostruito da detriti. In una preparazione di fette di vibratomo, i somi BC e HC sono facilmente accessibili, ma i loro processi dendritici possono essere recisi, interrompendo le loro connessioni laterali. Nelle retine divise, tuttavia, i corpi cellulari dei globuli rossi e degli HC si trovano sulla superficie del tessuto, fornendo un accesso notevolmente migliorato alle pipette patch e preservando i circuiti laterali dell'OPL.
La Figura 6 mostra le risposte alla luce simulate chimicamente registrate dai BC in una retina divisa. Il terreno di Ames perfuso è stato integrato con L-AP4 (4 μM), un agonista mGluR di gruppo III, per simulare il rilascio di glutammato dai fotorecettori al buio. L'antagonista di mGluR6, CPPG (600 μM, in Ames), è stato soffiato sui dendriti della cellula patchata (mantenuta a -60 mV) per simulare un lampo di luce tramite l'inibizione di mGluR6. Le cellule hanno risposto agli sbuffi di CPPG con due tipi di correnti verso l'interno. Un tipo mostra una corrente transitoria seguita da un plateau (Figura 6A), simile alle correnti canoniche evocate dalla luce registrate dai globuli rossi nelle fette di retina19. L'altro tipo rimane sostenuto per tutta la durata del soffio (Figura 6B), simile alle correnti registrate dalle cellule bipolari a cono ON (ON-CBC)19.
È stato eseguito un esperimento separato per colpire gli HC, un tipo di cellula con un ampio campo dendritico che è spesso difficile da preservare nelle preparazioni a fette. È stata utilizzata una linea murina che esprime il canale rodopsina (ChR2) e GFP negli HC per facilitare l'identificazione al microscopio a fluorescenza. In primo luogo, le correnti provenienti dagli HC sono state registrate in risposta a una serie di fasi di depolarizzazione (da -100 mV a 50 mV, dimensione del passo = 15 mV) a cui hanno risposto con correnti verso l'interno seguite da correnti verso l'esterno (Figura 6C). Queste cellule sono state quindi stimolate con un breve impulso di luce blu (200 ms, 470 nm) che ha prodotto grandi correnti verso l'interno guidate da ChR2 in due cellule (Figura 6D).
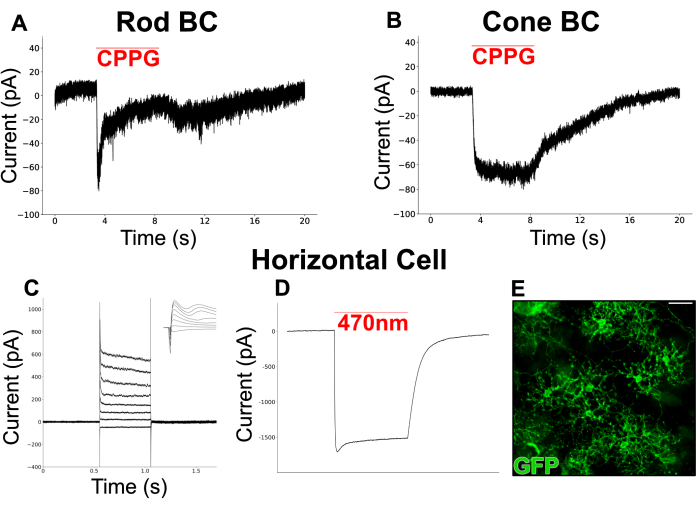
Figura 6: Registrazioni di patch clamp da neuroni INL in retine divise. (A) Un globulo rosso putativo e (B) un CBC putativo sono stati sottoposti a clampaggio a -60 mV in terreni Ames perfusi contenenti L-AP4 (4 μM). Soffiando CPPG (600 μM) sui dendriti delle cellule bloccate si invocava una corrente verso l'interno che era transitoria nei globuli rossi ma sostenuta nel CBC. La registrazione dei globuli rossi in (A) è una singola traccia, mentre la registrazione del globulo rosso in (B) rappresenta la media di 3 tracce. (C) Una registrazione patch clamp da un HC in un vGATFLPo; vGlut2Cre; Mouse Ai80d. La linea rossa mostra la durata di un impulso luminoso di 200 ms e 470 nm utilizzato per invocare la grande corrente verso l'interno attraverso ChR2. (D) Risposte di corrente iniettate da un HC che è stato bloccato in tensione a -60 mV, quindi è passato tra -70 mV e +35 mV a intervalli di 15 mV e riportato a -60 mV. L'inserto mostra le stesse tracce in una finestra di 6 ms che circonda l'inizio del passo di tensione. (E) Micrografia a immunofluorescenza di una retina divisa flatmount che mostra cellule orizzontali che esprimono GFP in un vGATFLPo; vGlut2Cre; Mouse Ai80d. Barra della scala = 20 μm. I dati elettrofisiologici sono stati raccolti a una frequenza di campionamento di 20 kHz e filtrati con un filtro di Bessel passa-basso a 5 kHz. I dati sono stati quindi esportati e la visualizzazione e l'analisi offline sono state eseguite utilizzando Python 3. Fare clic qui per visualizzare una versione più grande di questa figura.
La divisione della retina consente di interrogare rapidamente l'anatomia di INL e OPL
La membrana limitante esterna (ELM) della retina e l'ONL comprendono una barriera spessa ~90 μm, che impedisce la diffusione degli anticorpi nella retina interna e crea condizioni di immunocolorazione non ottimali20,21,22. Pertanto, i bersagli immunomarcati nell'OPL o nell'INL utilizzando una retina piatta convenzionale richiedono protocolli di colorazione ad alta intensità di tempo che spesso richiedono incubazioni anticorpalidi 48-96 ore 5,6,7,8,20,22.
La rimozione dei fotorecettori consente una rapida penetrazione degli anticorpi nei neuroni retinici interni. Di conseguenza, la marcatura dei bersagli proteici della retina interna può essere raggiunta in appena 1 ora con l'uso di anticorpi primari coniugati con coloranti. Gli anticorpi contro PKCα e Calbindin-D sono stati utilizzati per marcare rispettivamente i globuli rossi e gli HC dell'INL (Figura 7). A differenza delle tradizionali sezioni verticali della retina che troncano i processi laterali dei neuroni ad ampio campo, la preparazione della retina divisa consente la visualizzazione dell'intero albero dendritico delle cellule ad ampio campo come gli HC (Figura 6E, Figura 7).
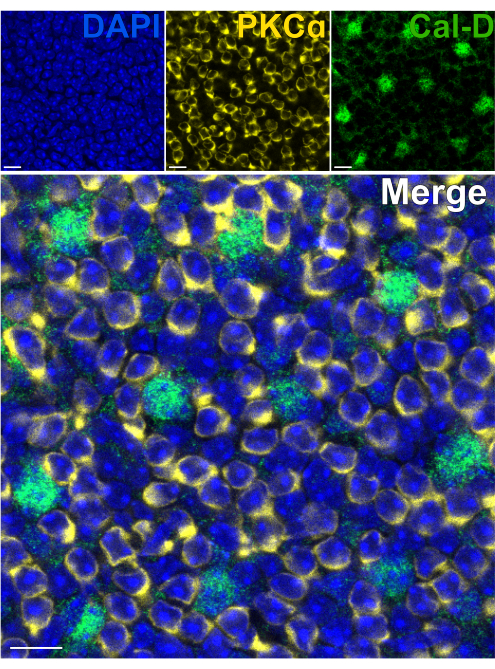
Figura 7: Immunomarcatura rapida delle proteine della retina interna in una retina divisa. Immagini confocali in immunofluorescenza di una retina divisa da una prospettiva flatmount. La retina divisa è stata incubata con anticorpi contro PKCα (giallo) e Calbindin-D (verde) per 1 ora a temperatura ambiente per marcare rispettivamente ON-BC e HC. (A) Ogni immagine a canale singolo è una proiezione Z media composta da quattro sezioni ottiche: DAPI, media z10-13; Calbindin-D, Media z11-14; PKCα, Media z11-14. (B) Nell'immagine unita, le stesse proiezioni sono sovrapposte. Barre di scala = 10 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura supplementare 1: Fasi chiave della dissezione della retina. Tutte le immagini sono state scattate con la fotocamera di uno smartphone montata sulle lenti oculari di un microscopio da dissezione. (A) Un'immagine dall'alto verso il basso di un occhio di topo dopo la rimozione della cornea. (B) Un'immagine dall'alto verso il basso dell'oculare del mouse dopo che la lente è stata rimossa. (C) Viene praticata una piccola incisione nella sclera dell'oculare del topo. Le frecce indicano i due lembi della sclera che vengono tirati in direzioni opposte da una pinza per iniziare a separare la retina dalla sclera. (D) Dopo che la sclera è stata parzialmente staccata dalla retina, le forbici di Vannas vengono inserite tra la sclera e la retina e il nervo ottico viene reciso, liberando la retina. Il cerchio rosso tratteggiato mostra la testa del nervo ottico e le forbici mostrano la corretta traiettoria di taglio (inserire le forbici tra la sclera e la retina). La retina isolata dopo la sclera viene rimossa. Fare clic qui per scaricare il file.
Figura 2 supplementare: Caratterizzazione delle componenti pre- e post-sinaptiche dell'OPL nella retina divisa. Immagini di immunofluorescenza confocale dall'OPL in una retina divisa. La retina divisa è stata incubata con anticorpi contro GPR179 e PSD95 per 1 ora a temperatura ambiente per marcarsi rispettivamente con le punte dendritiche degli ON-BC e i terminali dei fotorecettori dei bastoncelli. Le immagini a sinistra e al centro sono proiezioni massime di diverse sezioni ottiche; Le stesse proiezioni sono sovrapposte nell'immagine più a destra. Si è visto che GPR179 puncta nelle punte dendritiche ON-BC si associa strettamente con i terminali dei fotorecettori dei bastoncelli, dimostrando contatti sinaptici intatti all'interno dell'OPL. Barre di scala = 10 μm. Clicca qui per scaricare questo file.
Figura supplementare 3: Risoluzione dei problemi: valutazione della qualità di una retina divisa. Micrografie fluorescenti di una retina divisa colorata con DAPI per visualizzare i nuclei cellulari. Le cellule possono essere identificate in base al diametro e alla profondità del tessuto del nucleo. (A) I nuclei dei fotorecettori sono più piccoli, più luminosi e più superficiali, mentre (B) i nuclei BC sono più grandi, più deboli e più profondi. (C) Un'immagine a basso ingrandimento di una regione in cui i fotorecettori sono stati rimossi in modo incompleto. I nuclei che appaiono a fuoco provengono da BC, che sono più profondi dei nuclei dei fotorecettori ai bordi dell'immagine che appaiono sfocati. Barre di scala per (A) e (B) = 20 μm. Barra della scala per (C) = 50 μm. Fare clic qui per scaricare questo file.
Discussione
Dopo che i fotorecettori trasducono l'assorbimento dei fotoni nel rilascio di neurotrasmettitori, BC e HC sono i primi neuroni retinici a elaborare il segnale visivo23. Sebbene l'importanza di questi neuroni sia ben apprezzata, molte delle loro funzioni sono incompletamente comprese o del tutto inesplorate. Molti studi di fisiologia BC e HC trarrebbero probabilmente beneficio da una preparazione retinica flatmount che migliora l'accesso ai neuroni INL preservando la connettività laterale. Lo sviluppo del metodo della retina divisa rappresenta uno sforzo per fornire un protocollo semplice per l'acquisizione di registrazioni elettrofisiologiche di alta qualità e dati di microscopia da BC e HC in un orientamento flatmount. La preparazione della retina divisa qui descritta può essere eseguita in circa 20 minuti per topo (10 minuti per retina) dopo l'isolamento della retina, senza l'uso di apparecchiature specializzate. Il metodo trae ispirazione dalle procedure esistenti di rimozione dei fotorecettori, ma offre miglioramenti significativi in termini di semplicità, velocità e versatilità 4,10,11,12,13. A differenza dei metodi precedenti per separare gli strati retinici, la divisione della retina non richiede congelamento, liofilizzazione o applicazione ripetuta di adesivi alla retina. Con la pratica, quasi tutti i fotorecettori possono essere rimossi in una sola lacerazione con la membrana di nitrocellulosa. La velocità e la facilità di questo approccio consentono di ridurre al minimo il tempo che la retina trascorre fuori dall'Ames carbogenato, consentendo un'elevata vitalità cellulare per lunghi periodi; Le retine divise possono essere mantenute in terreni di Ames carbogenati per diverse ore dopo la scissione. A testimonianza della salute dei neuroni INL in questa preparazione, una colorazione a cellule vive/morte (Figura 4) e l'elettrofisiologia patch-clamp (Figura 6) confermano la vitalità dei globuli rossi e degli HC dopo una scissione.
La rimozione dello strato di fotorecettori nelle retine divise offre un vantaggio significativo durante l'immunomarcatura, riducendo drasticamente il tempo di diffusione degli anticorpi nell'INL. La marcatura degli anticorpi primari e secondari può essere completata entro 2 ore, un miglioramento sostanziale rispetto alla colorazione convenzionale flatmount che può richiedere 72 ore o più a seconda del target 5,6,7,8,20,22. Di conseguenza, i dati di microscopia possono essere acquisiti lo stesso giorno della preparazione del tessuto, accelerando drasticamente il ritmo degli esperimenti di immunofluorescenza. Per facilitare la ricottura della sonda di mRNA, gli esperimenti FISH raccomandano in genere tempi di fissazione molto più lunghi (~24 ore) rispetto all'immunomarcatura18. Tuttavia, gli esperimenti qui presentati dimostrano che una fissazione di 2 ore produce ancora un'eccezionale marcatura FISH (Figura 5). Nonostante l'estensione del tempo di fissazione da 30 minuti a 2 ore, non è stato necessario eseguire passaggi di recupero dell'antigene per ottenere un'eccellente immunomarcatura, ma questo può variare a seconda dell'anticorpo o dell'antigene. Il trattamento con proteasi nel protocollo FISH può interferire con la marcatura degli anticorpi, probabilmente a causa della distruzione degli epitopi bersaglio. Questo problema è stato aggirato utilizzando anticorpi policlonali che prendono di mira più epitopi, diminuendo la probabilità che la distruzione dell'epitopo ostacolerebbe l'immunomarcatura. Inoltre, è stato utilizzato un trattamento con proteasi moderata (ACD proteasi III) per prevenire un'eccessiva alterazione dell'epitopo, pur fornendo una sufficiente penetrazione nei tessuti.
Occasionalmente, la retina si divide invece attraverso lo strato nucleare esterno (ONL), lasciando dietro di sé strati di somi fotorecettori senza cellule INL visibili. Per evitare ciò, è necessario assicurarsi che la retina sia completamente piatta sul vetro e che sia stato rimosso qualsiasi liquido residuo intorno alla retina. Premendo più saldamente sulla nitrocellulosa con il pennello può anche aiutare a prevenire la spaccatura attraverso l'ONL. Se la membrana diventa troppo bagnata o la retina è ripiegata su se stessa, le possibilità di una separazione di successo saranno notevolmente ridotte. L'uso del DAPI per colorare i nuclei cellulari è utile per valutare la qualità della scissione e per determinare la copertura dei fotorecettori rimanenti. I nuclei dei fotorecettori sono più piccoli, più luminosi e più superficiali (Figura 3A supplementare), mentre i nuclei BC sono più grandi, più deboli e più profondi (Figura 3B supplementare). In alcuni casi, il piano della lacrima varierà leggermente attraverso il pezzo di retina, risultando in chiazze in cui i corpi cellulari dei fotorecettori non sono stati completamente rimossi (Figura 3C supplementare). Per le applicazioni in microscopia ed elettrofisiologia, ciò non ostacola la capacità di raccogliere dati di qualità da regioni in cui i fotorecettori sono stati adeguatamente rimossi; Ampi campi di retina interna esposta possono essere facilmente trovati durante l'imaging o la registrazione con una pipetta patch. Se si desidera una rimozione più completa dei fotorecettori, è possibile eseguire una seconda lacerazione con un pezzo aggiuntivo di membrana in nitrocellulosa, sebbene la rimozione del fotorecettore al 100% non sia garantita. Si consiglia quindi cautela quando si utilizzano retine divise in studi di espressione genica o proteomica in cui il materiale fotorecettore residuo potrebbe influenzare i risultati. Per le applicazioni a singola cellula, questa preoccupazione è ingiustificata, in quanto i dati provenienti dai fotorecettori possono essere esclusi dall'analisi.
I vantaggi della preparazione della retina divisa sono forse più salienti nelle registrazioni elettrofisiologiche di interneuroni ad ampio campo. Mentre le tradizionali fette verticali interrompono i processi estesi delle cellule ad ampio campo, la preparazione della retina divisa lascia intatti l'OPL e l'IPL, consentendo di catturare l'input da cellule ad ampio campo come HC24, A17s 25, TH AC 26 e NOS-1 AC27 che altrimenti verrebbero trascurate nelle fette verticali. Pertanto, l'interpretazione dei risultati e il confronto con i dati precedenti raccolti dalle fette di retina richiedono un'attenta riflessione. Ciononostante, negli esperimenti che utilizzano imitazioni farmacologiche della stimolazione luminosa, questi risultati assomigliano ai dati registrati da fette di retina19. Esprimendo ChR2 sotto promotori cellula-specifici, è possibile stimolare una popolazione cellulare desiderata durante la registrazione da BC nell'INL per studiare l'impatto della cellula desiderata sul percorso verticale dell'informazione. La registrazione diretta dai neuroni INL più profondi, come le cellule amacrine, è anche possibile nella retina divisa. Mentre in questo caso l'elettrodo patch deve prima viaggiare attraverso i neuroni INL più superficiali, c'è molto meno tessuto che ostruisce il suo percorso rispetto a una tradizionale preparazione a montaggio intero.
Oltre a misurare l'influenza delle cellule ad ampio campo su altri neuroni, questo metodo consente il clampaggio diretto di patch a singola cellula da HC, i cui dendriti formano un'estesa rete accoppiata gap-junction nell'OPL28. Le cellule orizzontali inviano un feedback critico ai fotorecettori che modellano la trasmissione delle informazioni verticali attraverso la retina. Tuttavia, poiché i campi dendritici degli HC sono troncati in fette verticali, mancano dati di registrazione a singola cellula. Questo lavoro presenta HC anatomicamente e fisiologicamente intatti da cui vengono registrate correnti evocate da ChR2 in una linea murina transgenica tripla (Figura 6 C-E). Al di fuori della stimolazione ChR2, la retina divisa può essere utilizzata per studiare le correnti HC endogene e l'accoppiamento della giunzione gap28. Mentre la retina divisa fornisce un modello conveniente per studiare la connettività sinaptica e l'attività neuronale indotta dall'applicazione chimica o dalla stimolazione ChR2, la mancanza di fotorecettori preclude qualsiasi esplorazione diretta delle risposte alla luce naturale o dei meccanismi di adattamento alla luce.
L'imaging in situ nella retina ha fatto progressi ammirevoli negli ultimi anni. Tuttavia, la maggior parte degli studi di imaging sono limitati allo strato di cellule gangliari nelle preparazioni retiniche a montaggio intero29. Gli autori prevedono che l'assenza di fotorecettori nella retina divisa lo renderà un modello ideale per l'imaging del calcio vivo nell'OPL e nell'INL. Oltre all'imaging del calcio, questo modello ha un grande potenziale per l'uso con biosensori geneticamente codificati come iGluSnFR30,31, iGABASnFR 32 e pHluorin 33. In combinazione con la preparazione della retina divisa, questi potenti strumenti possono offrire un approccio efficiente per esplorare le interazioni sinaptiche e le proprietà biofisiche di BC e HC che contribuiscono all'elaborazione della luce nella retina.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari in competizione.
Riconoscimenti
Questo lavoro è stato sostenuto dalle seguenti sovvenzioni NIH: R01EY031596 di sovvenzione NIH (a C.M.); R01EY029985 di sovvenzione NIH (a C.M.); P30EY010572 di sovvenzione NIH (a C.M.); Sovvenzione NIH R01EY032564 (a BS). Ringraziamo Tammie Haley per il suo supporto tecnico nella preparazione delle sezioni di retina e il Dr. Charles Allen per aver generosamente contribuito con le sonde mRNA FISH utilizzate in questo lavoro.
Materiali
| Name | Company | Catalog Number | Comments |
| #1.5 glass coverslips | Fisherbrand | 12544E | |
| 2 pairs of Dumont #5 forceps | Ted Pella | 38125 | |
| 25 gauge needle | Becton Dickenson | 305122 | |
| 470 nm LED | THORLABS | M470L2 | |
| 5-306 curved scissors | Miltex | 5-306 | |
| 9" disposable pasteur pipetes | Fisherbrand | 13-678-20D | for constructing custom transfer pipette |
| Ai80d mouse | Jackson Laboratories | 25109 | RRID: IMSR_JAX:025109 |
| Ames Medium w/L-Glutamate | US Biological | A1372-25 | |
| amplifier control software | Molecular Devices | Clampex 10.3 software | |
| anti-calbindin D28K antibody | Invitrogen | PA-5 85669 | RRID: AB_2792808, host species = rabbit; 1:100 dilution |
| anti-CtBP2 antibody | BD Biosciences | 612044 | RRID: AB_399431, host species = mouse; 1:5000 dilution |
| anti-GPR179 antibody | NA | NA | gift from Kirill Martemyanov; Scripps Research Institute, Jupiter, FL; host species = sheep; 1:1000 dilution |
| anti-PKC alpha antibody | Sigma-Aldrich | P4334 | RRID: AB_477345, host species = rabbit; 1:5000 dilution |
| anti-PKC alpha antibody | Santa Cruz Biotechnology | sc8393 AF594 | RRID: AB_628142, host species = mouse; 1:1000 dilution |
| anti-PSD95 antibody | BD Transduction Laboratories | 610495 | RRID: AB_397862, host species = mouse; 1:1000 dilution |
| anti-RGS11 antibody | NA | NA | gift from Ted Wensel; Baylor College of Medicine, Houston, TX; host species = rabbit; between 1:1000 and 1:5000 dilution |
| anti-Synaptophysin P38 antibody | Sigma | S-S5768 | RRID: AB_477523, host species = mouse; 1:1000 dilution |
| Aquamount mounting media | Epredia | 13800 | slide mounting media |
| C57BL/6J mouse | Jackson Laboratories | 000664 | RRID: IMSR_JAX:000664 |
| carbogen tank | Matheson | NA | 95% O2 and 5% CO2 |
| custom transfer pipette | custom build | NA | Instructions: use scissors to cut off the tip of a plasitc transfer pipette at the point it begins to taper. Use pliers to safely break off the last 2-3 inches of a glass pasteur pipette. Fit the narrow end of the glass pasteur pipette into the wide tip of the plastic transfer pipete. Wrap parafilm around the joint of the two pieces to enhance the seal. |
| Digitical optical power meter | THORLABS | PM100D | |
| dissection microscope | Zeiss | Stemi 2000 | |
| electrophysiology amplifier | Molecular Devices | Axopatch 200B | |
| electrophysiology microscope | Olympus | OLYMPUS, BX50WI | Dodt gradient contrast microscopy |
| Fluoromount-G | SouthernBiotech | 0100-01 | |
| HC PL APO CS2 40x/1.3 | Leica | 506358 | |
| HC PL APO CS2 63x/1.40 | Leica | 15506350 | |
| Hybridization oven | Robbins Scientific | Model 1000 | for RNAscope protocol only |
| Immedge hydrophobic barrier pen | Vector Laboratories | H-4000 | |
| isoflurane | Piramal Critical Care | 66794-017-25 | |
| Kimwipe (delicate task wipe) | Kimtech Science | 34155 | |
| Leica HC PL APO CS2 40x/1.3 oil immersion objective | Leica | 506358 | |
| Leica HC PL APO CS2 63x/1.40 oil immersion objective | Leica | 15506350 | |
| Leica TCS SP8 X confocal microscope | Leica | discontinued | |
| medium 15 mm petri dish | Corning | 25060-60 | eyes are kept here during retina dissection |
| Merit 97-275 steel scissors | Merit | 97-275 | |
| Micropipette Puller | Sutter Instrument | p-97 | |
| Mm-Gabrd-C2 mRNA probe | ACD | 459481-C2 | |
| mouse euthanasia chamber | NA | NA | custom build; glass petri dish covering a small glass jar. |
| nitrocellulose membrane filters | GE Healthcare Life Sciences; Whatman | 7184-005 | 0.45 µm pore size |
| Picospritzer | General Valve Corporation | Picospritzer II | referred to in the text as microcellular injection unit |
| plastic transfer pipets | Fisherbrand | 13-711-7M | for constructing custom transfer pipette |
| Plastic tubing | Tygon | R-603 | for connection to carbogen tank |
| platinum harp | custom build | NA | for anchoring split retinas within the electrophysiology recording chamber. |
| size 0 paint brush | generic | NA | for flattening retina during splitting. |
| SlowFade Gold antifade reagent | Molecular Probes | S36937 | referred to in the text as anti-fade mounting media |
| small 10 mm petri dish | Falcon | 353001 | eyes are placed here following enucleation |
| small glass pane (7.5 cm x 5 cm) | generic | NA | isolatd retina pieces are placed onto this for the splitting procedure |
| Superfrost plus microscope slides | Fisherbrand | 12-550-15 | electrostatically-charged glass microscope slides |
| Thick-walled borosilicate glass pipettes with filament | Sutter Instrument | BF150-86-10HP | |
| Vannas Scissors; straight | Titan Medical | TMS121 | not brand specific; any comparable scissors will work |
| vGATFLPo mouse | Jackson Laboratories | 29591 | RRID: IMSR_JAX:029591 |
| vGlut2Cre mouse | Jackson Laboratories | 28863, 016963 | RRID: IMSR_JAX:028863, RRID: IMSR_JAX:016963 |
| Zombie NIR Fixable Viability Kit | BioLegend | 423105 | referred to in the text as MI-NIR |
Riferimenti
- Morgans, C. W. Neurotransmitter release at ribbon synapses in the retina. Immunology & Cell Biology. 78 (4), 442-446 (2000).
- Euler, T., Haverkamp, S., Schubert, T., Baden, T. Retinal bipolar cells: elementary building blocks of vision. Nature Reviews Neuroscience. 15 (8), 507-519 (2014).
- Barnes, S., Grove, J. C. R., McHugh, C. F., Hirano, A. A., Brecha, N. C. Horizontal Cell Feedback to Cone Photoreceptors in Mammalian Retina: Novel Insights From the GABA-pH Hybrid Model. Frontiers in Cellular Neuroscience. 14, (2020).
- Walston, S. T., Chang, Y. C., Weiland, J. D., Chow, R. H. Method to remove photoreceptors from whole mount retina in vitro. Journal of Neurophysiology. 118 (5), 2763-2769 (2017).
- Stefanov, A., Novelli, E., Strettoi, E. Inner retinal preservation in the photoinducible I307N rhodopsin mutant mouse, a model of autosomal dominant retinitis pigmentosa. Journal of Comparative Neurology. 528 (9), 1502-1522 (2020).
- Matsuoka, R. L., Nguyen-Ba-Charvet, K. T., Parray, A., Badea, T. C., Chédotal, A., Kolodkin, A. L. Transmembrane semaphorin signaling controls laminar stratification in the mammalian retina. Nature. 470 (7333), 259-263 (2011).
- Matsuoka, R. L., et al. Guidance-Cue Control of Horizontal Cell Morphology, Lamination, and Synapse Formation in the Mammalian Outer Retina. Journal of Neuroscience. 32 (20), 6859-6868 (2012).
- Wässle, H., Puller, C., Müller, F., Haverkamp, S. Cone Contacts, Mosaics, and Territories of Bipolar Cells in the Mouse Retina. Journal of Neuroscience. 29 (1), 106-117 (2009).
- Thoreson, W. B., Dacey, D. M. Diverse Cell Types, Circuits, and Mechanisms for Color Vision in the Vertebrate Retina. Physiological Reviews. 99 (3), 1527-1573 (2019).
- Guido, M. E., et al. A simple method to obtain retinal cell preparations highly enriched in specific cell types. Suitability for lipid metabolism studies. Brain Research Protocols. 4 (2), 147-155 (1999).
- Rose, K., Walston, S. T., Chen, J. Separation of photoreceptor cell compartments in mouse retina for protein analysis. Molecular Neurodegeneration. 12 (1), 28(2017).
- Todorova, V., et al. Retinal Layer Separation (ReLayS) method enables the molecular analysis of photoreceptor segments and cell bodies, as well as the inner retina. Scientific Reports. 12 (1), 20195(2022).
- Shiosaka, S., Kiyama, H., Tohyama, M. A simple method for the separation of retinal sublayers from the entire retina with special reference to application for cell culture. Journal of Neuroscience Methods. 10 (3), 229-235 (1984).
- Ivanova, E., Hwang, G. S., Pan, Z. H. Characterization of transgenic mouse lines expressing Cre-recombinase in the retina. Neuroscience. 165 (1), 233-243 (2010).
- Sarria, I., Orlandi, C., McCall, M. A., Gregg, R. G., Martemyanov, K. A. Intermolecular Interaction between Anchoring Subunits Specify Subcellular Targeting and Function of RGS Proteins in Retina ON-Bipolar Neurons. The Journal of Neuroscience. 36 (10), 2915-2925 (2016).
- Orlandi, C., Cao, Y., Martemyanov, K. A. Orphan Receptor GPR179 Forms Macromolecular Complexes With Components of Metabotropic Signaling Cascade in Retina ON-Bipolar Neurons. Investigative Ophthalmology & Visual Science. 54 (10), 7153-7161 (2013).
- Dikshit, A., Zong, H., Anderson, C., Zhang, B., Ma, X. -J. Simultaneous Visualization of RNA and Protein Expression in Tissue Using a Combined RNAscopeTM In Situ Hybridization and Immunofluorescence Protocol. Methods in Molecular Biology. 2148, Clifton, N.J. 301-312 (2020).
- Wang, F., et al. RNAscope. The Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Morgans, C. W., et al. TRPM1 is required for the depolarizing light response in retinal ON-bipolar cells. Proceedings of the National Academy of Sciences of the United States of America. 106 (45), 19174-19178 (2009).
- Alessio, E., Zhang, D. Q. Immunostaining of whole-mount retinas with the CLARITY tissue clearing method. Investigative Ophthalmology & Visual Science. 61 (7), 5054(2020).
- Ferguson, L. R., Dominguez, J. M., Balaiya, S., Grover, S., Chalam, K. V. Retinal Thickness Normative Data in Wild-Type Mice Using Customized Miniature SD-OCT. PLoS ONE. 8 (6), e67265(2013).
- Ivanova, E., Toychiev, A. H., Yee, C. W., Sagdullaev, B. T. Optimized Protocol for Retinal Wholemount Preparation for Imaging and Immunohistochemistry. Journal of Visualized Experiments JoVE. (82), e51018(2013).
- Kolb, H. Neurotransmitters in the Retina. Webvision: The Organization of the Retina and Visual System. , University of Utah Health Sciences Center. (1995).
- Chaya, T., et al. Versatile functional roles of horizontal cells in the retinal circuit. Scientific Reports. 7 (1), 5540(2017).
- Egger, V., Diamond, J. S. A17 Amacrine Cells and Olfactory Granule Cells: Parallel Processors of Early Sensory Information. Frontiers in Cellular Neuroscience. 14, 600537(2020).
- Dacey, D. M. The dopaminergic amacrine cell. The Journal of Comparative Neurology. 301 (3), 461-489 (1990).
- Park, S. J., et al. Connectomic analysis reveals an interneuron with an integral role in the retinal circuit for night vision. eLife. 9, 56077(2020).
- Janssen-Bienhold, U., et al. Connexin57 is expressed in dendro-dendritic and axo-axonal gap junctions of mouse horizontal cells and its distribution is modulated by light. The Journal of Comparative Neurology. 513 (4), 363-374 (2009).
- Jain, V., et al. The functional organization of excitation and inhibition in the dendrites of mouse direction-selective ganglion cells. eLife. 9, 52949(2020).
- Marvin, J. S., et al. Stability, affinity, and chromatic variants of the glutamate sensor iGluSnFR. Nature Methods. 15 (11), 936-939 (2018).
- Strauss, S., et al. Center-surround interactions underlie bipolar cell motion sensitivity in the mouse retina. Nature Communications. 13 (1), 5574(2022).
- Marvin, J. S., et al. A genetically encoded fluorescent sensor for in vivo imaging of GABA. Nature Methods. 16 (8), 763-770 (2019).
- Beckwith-Cohen, B., Holzhausen, L. C., Wang, T. M., Rajappa, R., Kramer, R. H. Localizing Proton-Mediated Inhibitory Feedback at the Retinal Horizontal Cell-Cone Synapse with Genetically-Encoded pH Probes. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 39 (4), 651-662 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon