Method Article
Parkinson Hastalığının Drosophila Modelinde Kabızlığın Ölçülmesi
Bu Makalede
Özet
Bu protokol, Parkinson hastalığının alfa-sinüklein bazlı Drosophila modelinde kabızlığın modellenmesi için bir test sunar.
Özet
Parkinson hastalığında (PH) motor olmayan semptomlar yaygındır, tedavisi zordur ve yaşam kalitesini önemli ölçüde bozar. Yaygın bir motor olmayan semptom, PH tanısından yıllar hatta on yıllar önce gelebilen kabızlıktır. Kabızlık, PH'nin hayvan modellerinde yeterince araştırılmamıştır ve spesifik tedavilerden yoksundur. Bu test, insan alfa-sinükleinin bir pan-nöronal sürücü altında eksprese edildiği bir Drosophila PD modelini kullanır. Alfa-sinüklein eksprese eden sinekler, PD'nin ayırt edici özelliklerini geliştirir: dopaminerjik nöronların kaybı, motor bozukluk ve alfa-sinüklein inklüzyonları
Bu protokol, bu sineklerde kabızlığı incelemek için bir yöntemi özetlemektedir. Sinekler gece boyunca mavi renk katkılı sinek yemine yerleştirilir ve ertesi gün standart mamaya aktarılır. Daha sonra 8 saat boyunca her saat başı standart sinek yemi içeren yeni şişelere taşınırlar. Her transferden önce, flakon duvarındaki toplam dışkı lekelerine kıyasla mavi renkli dışkı lekelerinin yüzdesi hesaplanır. Alfa-sinüklein içermeyen kontrol sinekleri, alfa-sinüklein eksprese eden sineklerden saatler önce tüm mavi boyayı dışarı atar. Ek olarak, mavi renkli yiyeceklerin bağırsaktan geçişi basit bir fotoğrafla izlenebilir. Bu testin basitliği, Drosophila'da kabızlık değiştiricilerini tanımlamak için ileri genetik veya kimyasal taramalarda kullanılmasını sağlar.
Giriş
Parkinson hastalığı (PH), klinik olarak bradikinezi, rijidite ve tremor gibi motor semptomların varlığı ile karakterize olan ve önemli morbidite ile sonuçlanan ilerleyici bir nörodejeneratif hastalıktır1. Patolojik olarak PH, substantia nigra'daki dopaminerjik nöronların kaybı ve alfa-sinükleinin yanlış katlanması ile tanımlanır, bu da Lewy cisimciklerinin ve Lewy nöritlerinin oluşumuna yol açar. PH'nin patogenezi tam olarak anlaşılamamıştır, muhtemelen genetik ve çevresel faktörlerin karmaşık bir etkileşiminden kaynaklanmaktadır 2,3. Şu anda, muhtemelen kısmen tanı sırasında mevcut olan patolojinin ileri evresi nedeniyle hastalık modifiye edici tedaviler mevcut değildir. Çalışmalar, substantia nigra'daki dopaminerjik nöronların %60'ından fazlasının motor semptomların başlamasıyla zaten kaybolduğunu göstermiştir ve bu da erken hastalık tespiti için potansiyel biyobelirteçleri keşfetme ihtiyacının altını çizmektedir4. Bu tür bir klinik biyobelirteç, PD hastalarında 5,6 yaygın olan ve motor semptomların başlangıcından yıllar hatta on yıllar önce gelebilen kabızlıktır.
PH'nin motor semptomlara dayalı klinik tanımına rağmen, kabızlık, semptomatik olarak tedavisi daha zor olan ve hastaların yaşam kalitesinde önemli bozulmaya neden olan birkaç motor olmayan semptomdan biridir7. Beyin ve enterik sinir sistemi arasındaki çift yönlü iletişimi temsil eden bağırsak-beyin eksenindeki değişiklikler PH patogenezinde rol oynamaktadır. Alfa-sinüklein agregatları, PD hastalarının gastrointestinal sistemlerinden alınan doku örneklerindebulunmuştur 8 ve hayvan modelleri, enterik sinir sistemindeki alfa-sinüklein agregatlarının prion benzeri bir şekilde merkezi sinir sistemine9 yayıldığını göstermektedir. Ek olarak, PD hastaları bağırsak mikrobiyomunda10 anormallikler sergiler ve aşırı bağırsak iltihabı11 yaşayabilir. Parkinson ile ilişkili kabızlığın sineklerde12,13 veyakemirgenlerde 14,15 bildirilen birkaç modeli ile PD'de kabızlık yeterince araştırılmamıştır.
Bu test, sineklerin bir pan-nöronal sürücü olan n-sinaptobrevin kontrolü altında insan alfa-sinüklein genini eksprese ettiği bir Drosophila PD modelini kullanır. Bu sinekler, alfa-sinüklein agregasyonu, motor disfonksiyon ve yaşa bağlı nörodejenerasyon dahil olmak üzere PD'nin tüm ayırt edici özelliklerini sergiler ve dopaminerjik nöronların kaybına neden olur16,17. Önceki çalışmalar, bağırsak işlev bozukluğunu değerlendirmek, sinek dışkı maddesini ölçmek ve sindirim sistemindeki fonksiyonel farklılıkları ortaya çıkarmak için çeşitli genetik hatlardaki dışkı miktarlarını karşılaştırmak için sineklerde dışkı çıkışının ölçülmesini sağlamıştır 18,19,20. Burada, insan alfa-sinükleinini eksprese eden sinekleri kullanarak kabızlık testini gösteriyoruz. Bu basit ama değerli araç, PH'nin önemli bir motor olmayan semptomunun incelenmesini sağlar.
Protokol
Bu tahlilde kullanılan sinekler: kontrol: nSyb-QF2, nSyb-Gal4/+; alfa-sinüklein sinekleri: nSyb-QF2, nSyb-Gal4, QUAS-alfa-sinüklein/+; 1 ve 10 gün sonra; erkek ve dişi (çiftleşmiş ve çiftleşmemiş) sinekler (bkz.
1. Boyalı sinek yeminin hazırlanması
- Mavi yumuşak jel macun gıda boyasını (Malzeme Tablosuna bakın) 1:1 oranında (v/v) damıtılmış suyla karıştırın.
NOT: Bazı mavi boyaların nöroprotektif etkileri olduğu gösterildiğinden, yalnızca emilmeyen boyalar içeren ticari gıda boyası kullanın21. - Standart mısır unu-agardan (Malzeme Tablosuna bakınız) oluşan sinek yemi şişelerini, yiyecek bir sıvı veya bulamaç halinde eriyene kadar 10-15 saniye aralıklarla mikrodalgada ısıtın. Yiyeceklerin kaynamasına izin vermeyin.
- Şişeler arasında homojen bir renk elde etmek için boya karışımını her bir gıda şişesine ekleyin. Boya karışımında gıda homojen bir şekilde mavi olana kadar karıştırın (Şekil 1). Yiyeceğin rengi doygun olacak ve şişeler arasında renk değişikliği olmayacak şekilde bir miktar mavi boya karışımı ekleyin.
NOT: Yiyecekler hızla katılaştığı için bu adım mikrodalgada pişirildikten hemen sonra yapılmalıdır. Yiyecek katılaşırsa, şişeyi tekrar mikrodalgada pişirin. - Boyalı gıda şişelerini katılaşana kadar kurumaya bırakın. Başıboş sineklerin şişeye inmesini önlemek için kuruturken şişe açıklıklarının üzerine ince bir kağıt havlu yerleştirin.
- Yiyecekler soğuduktan ve katılaştıktan sonra, test için kullanılacak sinekleri mavi yiyeceğe aktarın.
NOT: Dar şişeler (25 mm) için, her şişeye 9-14 sinek eklenmesi önerilir. Geniş şişeler (28,5 mm) için, her şişeye 10-20 sinek eklenmesi önerilir. Sinekler cinsiyet veya çiftleşme deneyimi ile ayrılmaz ve hem çiftleşmiş hem de çiftleşmemiş dişilerle karışık bir erkek ve dişi sinek popülasyonu içerir. - Şişeleri bir inkübatörde gece boyunca 25 ° C'de sineklerle inkübe edin.
2. Sineklerin görüntülenmesi
NOT: Bu adım isteğe bağlıdır (Şekil 2).
- Ertesi sabah (saat 0), temsilci sinekleri 60 saniye boyunca karbondioksit ile uyuşturun. Sineği ventral taraf yukarı bakacak şekilde yerleştirin.
- Bir kamera kullanarak (Malzeme Tablosuna bakın), sindirim sisteminde kalan mavi yiyecek miktarını görselleştirmek için her saat başı sineklerin görüntülerini yakalayın.
NOT: Bu sinekler, anestezi sonuçları etkileyebileceğinden, testin kantitatif kısmı için kullanılmamalıdır (adım 3). - Her saat başı anestezi uygulayın ve yeni sinekleri görüntüleyin.
3. Kabızlık tahlilinin yapılması
- Kalan (anestezi uygulanmamış) sinekleri standart Drosophila gıdası ile şişelere aktarın. Her şişeyi numaralandırın.
- Sinekleri kuluçka makinesinde 25 °C'de 60 dakika bekletin.
- 60 dakika sonra, sinekleri standart Drosophila yemi ile yeni şişelere aktarın. İlk flakon setinden veri kaydına başlayın.
- Sayımın başlayacağı noktayı işaretlemek için şişenin uzunluğu boyunca noktalı bir çizgi çizin.
- Her şişenin duvarındaki küçük, yuvarlak noktaların sayısını manuel olarak sayın. Yiyecek veya flakon tapasında bulunan noktaları saymayın.
- Her şişenin duvarındaki mavi noktaların sayısını sayarak başlayın.
- Her şişenin duvarındaki opak, renksiz noktaların sayısını sayın.
NOT: Her nokta, idrar ve dışkı maddesinin bir kombinasyonu olan sinek dışkısıdır22. Bazen, bir sinek dışkı üzerinde yürüyebilir ve bir iz bırakabilir, bu durumda, izdeki her bir işareti değil, yalnızca orijinal noktayı sayın. - Her flakon için mavi noktaların toplam nokta sayısına oranını kaydedin.
NOT: Toplam nokta sayısı, aynı şişenin duvarındaki renksiz nokta sayısına eklenen bir şişenin duvarındaki mavi nokta sayısıdır. Bu, saat başına mavi dışkı maddesinin yüzdesini hesaplamak için kullanılacaktır. - 3.2-3.8 adımlarını yedi kez daha tekrarlayın ve toplam 8 saat boyunca her saat veri toplayın.
4. Veri analizi
- Her koşul için saat başına mavi dışkı maddesinin yüzdesini grafiklendirin.
- Koşullar arasındaki verileri karşılaştırın.
NOT: İstatistiksel anlamlılık 3 şekilde belirlenebilir: koşullar arasındaki bireysel zaman noktalarını karşılaştırarak, çizginin zaman içindeki eğimini ölçerek veya eğrinin altındaki alanı karşılaştırarak.
Sonuçlar
Drosophila karnı şeffaf olduğu için, canlı anestezi uygulanmış sineklerde bağırsakta mavi yiyecekler görselleştirilebilir. Bağırsak geçişindeki niteliksel farklılıklar, çeşitli zaman noktalarında sineklerin görüntüleri alınarak değerlendirilebilir. Kontrol sineklerinde, mavi yiyecek hızla dışarı atılırken, alfa-sinüklein sineklerinde, mavi yiyecek bağırsakta 8 saat kadar kalır (Şekil 2).
Alfa-sinüklein sinekleri, eklosiyondan 10 gün sonra gelişen sağlam bir fenotip ile yaşa bağlı nörodejenerasyon gösterir10. Bu zaman noktasında, kontrol sinekleriyle karşılaştırıldığında bağırsak geçiş süresindeki farklılıklar, koşullar arasındaki bireysel zaman noktalarını karşılaştırarak, çizginin zaman içindeki eğimini ölçerek veya eğrinin altındaki alanı karşılaştırarak görülür (Şekil 3). Motor disfonksiyon ve nörodejenerasyonun da henüz mevcut olmadığı daha erken bir zaman noktasında, eklosiyondan sonraki 1. günde kontrol ve alfa-sinüklein sinekleri arasındaki bağırsak geçişinde herhangi bir fark gözlenmemiştir (Şekil 4).
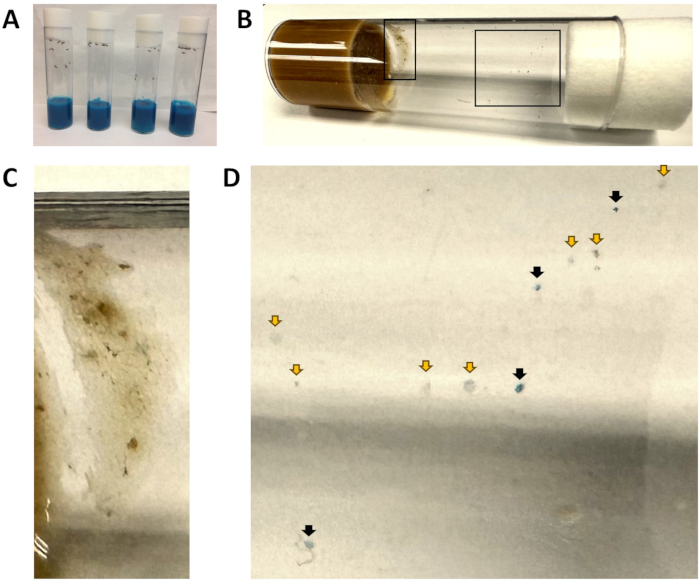
Şekil 1: Mavi gıda şişeleri ve dışkı lekeleri. (A) Tüm şişeler mavi renkli yiyecekler içerir. Bu noktada, sinekler mavi yiyeceğe yeni tanıtıldı ve mavi dışkı maddesi görünmüyor. (B) W1118 sinekleri 1 saat boyunca taze yiyeceğe aktarıldıktan sonra bir şişe çıkarıldı. Sol iç kısım (C) hücresinde, sağ iç kısım ise (D) şeklinde büyütülür. (C) Sinek yemi varlığı nedeniyle analizden çıkarılan bir alan. (D) Mavi (siyah oklar) ve mavi olmayan noktaları (sarı oklar) gösteren dışkı noktalarının büyütülmüş görünümü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Boyalı gıdanın zaman içindeki bağırsak geçişinin görselleştirilmesi. Kontrol sinekleri ve nöronlarda insan alfa-sinüklein eksprese eden sinekler, gece boyunca maviye boyanmış yiyeceklerde bırakıldı ve ertesi gün standart ortama aktarıldı. Sinekler seri olarak her saat başı yeni standart sinek yemine aktarıldı. Aktarımdan sonraki sıfır ve 2, 4, 6 ve 8 saat sonraki temsili görüntüler gösterilir. Kontrol ve alfa-sinüklein sinekleri, sıfır zamanında bağırsakta benzer mavi yiyecek yamaları gösterir. Sonraki zaman noktalarında, kontrol sinekleri, alfa-sinüklein sineklerinden daha az mavi yiyeceğe sahiptir ve kontrol sineklerinde 8 saatlik zaman noktasında tüm mavi yiyecekler kaybolur. Her bir sinek hattı için genotipler aşağıdaki gibidir: kontrol (nSyb-QF2, nSyb-Gal4/+); alfa-sinüklein uçar (nSyb-QF2, nSyb-Gal4, QUAS-alfa-sinüklein / +). Dişi sinekler, daha büyük olmaları nedeniyle karnı daha kolay görselleştirme yetenekleri nedeniyle görüntüleme için kullanılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
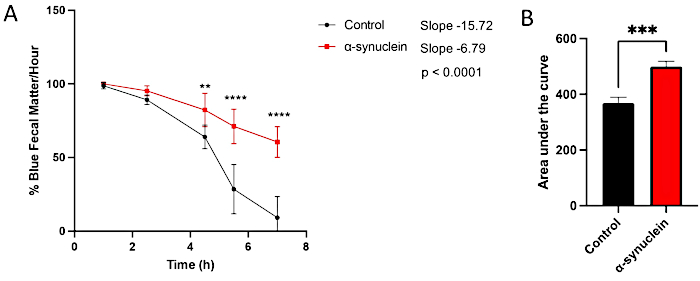
Şekil 3: Eklosiyon sonrası 10. günde kabızlık testi sinekler. Kontrol sinekleri ve nöronlarda insan alfa-sinüklein eksprese eden sinekler, gece boyunca maviye boyanmış yiyeceklerde bırakıldı ve ertesi gün standart sinek yemine aktarıldı. Sinekler her saat başı yeni standart medyaya seri olarak aktarıldı. (A) Saatteki mavi dışkı maddesi yüzdesi. Hata çubukları standart sapmayı temsil eder. N = genotip başına 6 şişe; Her şişe 9-14 sinek içeriyordu. Tüm istatistiksel analizler Graphpad Prism'de yapıldı (bkz. Her bir zaman noktasındaki istatistiksel anlamlılık, iki yönlü ANOVA kullanılarak hesaplandı. Doğrunun eğimi ve eğimler arasındaki fark doğrusal regresyon analizi kullanılarak hesaplanmıştır. (B) Her genotip için eğrinin altındaki alan hesaplandı. Hata çubukları standart sapmayı temsil eder. Her bir sinek hattı için genotipler aşağıdaki gibidir: kontrol (nSyb-QF2, nSyb-Gal4/+); alfa-sinüklein uçar (nSyb-QF2, nSyb-Gal4, QUAS-alfa-sinüklein / +). Hem erkek hem de dişi sinekler kabaca eşit sayılarda bulunur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
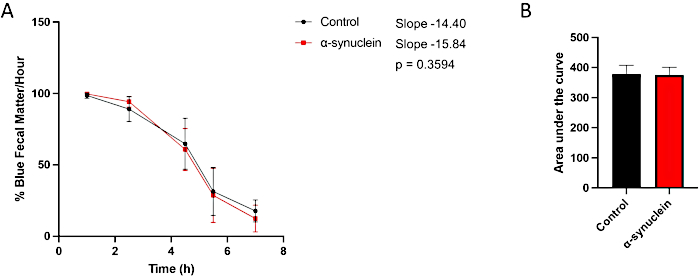
Şekil 4: Eklosiyon sonrası 1. günde kabızlık testi sinekler. Kontrol sinekleri ve nöronlarda insan alfa-sinüklein eksprese eden sinekler, gece boyunca maviye boyanmış yiyeceklerde bırakıldı ve ertesi gün standart ortama aktarıldı. Sinekler seri olarak her saat başı yeni standart sinek yemine aktarıldı. (A) Saatteki mavi dışkı maddesi yüzdesi. Hata çubukları standart sapmayı temsil eder. N = genotip başına minimum 5 şişe; Her şişe 9-14 sinek içeriyordu. Tüm istatistiksel analizler Graphpad Prism programında yapıldı. Her bir zaman noktasındaki istatistiksel anlamlılık, iki yönlü ANOVA kullanılarak hesaplandı. Doğrunun eğimi ve eğimler arasındaki fark doğrusal regresyon analizi kullanılarak hesaplanmıştır. (B) Her genotip için eğrinin altındaki alan hesaplandı. Hata çubukları standart sapmayı temsil eder. Her bir sinek hattı için genotipler aşağıdaki gibidir: kontrol (nSyb-QF2, nSyb-Gal4/+); alfa-sinüklein uçar (nSyb-QF2, nSyb-Gal4, QUAS-alfa-sinüklein / +). Hem erkek hem de dişi sinekler kabaca eşit sayılarda bulunur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokolde, testin başarılı bir şekilde tamamlanmasına yardımcı olacak birkaç adım vardır. İlk olarak, her flakon için her tur arasındaki zaman aralıklarının deney boyunca tutarlı olmasını sağlamak önemlidir. Şişeleri sayılarla etiketlemek, uzun genotip açıklamalarına olan ihtiyacı ortadan kaldırmaya yardımcı olacak ve zamandan tasarruf sağlayacaktır. Ek olarak, dışkı maddesi22'yi sayma yönteminin deney boyunca tutarlı kalması çok önemlidir. Gıda ve flakon tıkacı üzerinde mavi dışkı maddesi görünürken, renksiz dışkı maddesi görünmez. Bu nedenle, yiyecek veya flakon tıkacı üzerindeki mavi noktaları saymayın.
Davranışsal tahlillerde, sinek davranışındaki dalgalanmalar veya tahlili etkileyen bilinmeyen değişkenler nedeniyle sonuçlarda tutarsızlık olasılığı her zaman vardır. Tüm deneyler için aynı Drosophila ortamını, aynı gıda boyasını ve aynı marka flakonları kullanmanızı öneririz. İlginç bir şekilde, birkaç denemede, sineklerin, muhtemelen sineklerin sirkadiyen ritmi nedeniyle öğleden sonra erken saatlerde daha az dışkılama eğiliminde oldukları gözlemlenmiştir23. Bununla birlikte, bu davranış hem kontrol sineklerinde hem de alfa-sinüklein eksprese eden sineklerde tutarlıdır, bu nedenle endişe uyandırmamalıdır.
Sinekler tahlilin başlangıcında mavi dışkı salgılamazsa, kullanılan boyanın yeterince pigmentli olmaması mümkündür. Bu durumda, boyanın damıtılmış suya oranı buna göre artırılabilir. Sineğin sindirim sisteminde sadece az miktarda mavi yiyecek kaldığında, dışkı maddesinin soluk mavi mi yoksa renksiz mi olduğunu belirlemek zor olabilir. Bu olduğunda, şişenin arkasına beyaz bir kağıt koymak, dışkı noktasının rengini belirlemeye yardımcı olacaktır. Dışkı maddesi çok açık mavi olsa bile, renksiz dışkı maddesi yerine mavi dışkı maddesi olarak kaydetmek en iyisidir.
Bu testin bir sınırlaması, dışkı lekelerinin manuel olarak sayılmasını gerektirmesidir. Yüksek verimli tarama potansiyelini artırmak için, bu protokol gelecekte çok kuyulu plakalarda bireysel sinekler tarafından üretilen mavi dışkı noktalarının otomatik olarak ölçülmesine izin verecek şekilde değiştirilebilir. Diğer bir sınırlama, alfa-sinüklein modelinin bir PD prodromal modeline geliştirilme potansiyeline sahip olmasına rağmen, nörodejenerasyon olmadan kabızlığın mevcut olduğu optimal bir zaman noktasının henüz tanımlanmamış olmasıdır.
Özetle, bu yöntem, bir Drosophila PD modelinde, az çalışılmış bir motor olmayan PD semptomu olan kabızlığın modellenmesi için basit ve anlaşılır bir yaklaşım sunar.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Brigham and Women's Hospital ve Harvard Medical School'dan Dr. Mel Feany'ye, Drosophila çizgilerini ifade eden kontrol ve alfa-sinükleinin nazik armağanı için teşekkür ederiz. Dr. Olsen'e aşağıdaki hibe desteği kaynaklarını kabul ediyoruz: NINDS K08, Amerikan Parkinson Hastalığı Derneği George C. Cotzias Bursu, Savunma Bakanlığı Parkinson Hastalığı Erken Araştırmacı Ödülü.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1400 g sucrose | MP Biomedicals | 904713 | |
| 1800 g dextrose | MP Biomedicals | 901521 | |
| 2884 g yeast | MP Biomedicals | 903312 | |
| 428 g agar | Fisher Scientific | 10253156 | |
| 4600 mL molasses | Grandma's Molasses | 7971942 | |
| 68 L water | N/A | N/A | |
| 680 mL tegosept mix (1200 g tegosept in 6 L ethanol) | |||
| 6864 g cornmeal | Pearl Milling | 125045 | |
| 800 mL acid mix (83 mL phosphoric acid in 1 L water + 836 mL propionic acid in 1 L water) | |||
| cellSens Standard software | Olympus | N/A | |
| Ethanol | Pharmco-Aper | 111ACS200 | |
| Flugs for wide plastic vials | Genesee Scientific | 49-101 | |
| Flystuff wide Drosophila vials, polystyrene | Genesee Scientific | 32-117 | |
| Graphpad Prism | GraphPad | N/A | Version 9.5.1 |
| Olympus DP23 camera | Olympus | N/A | |
| Olympus SZX12 Stereo Microscope | Olympus | N/A | |
| Phosphoric Acid | Fisher Scientific | S25470A | |
| Propionic Acid | Fisher Scientific | A258 - 500 | |
| Soft gel paste food color, Royal blue | AmeriColor | 202 | |
| Tegosept | Apex | 20-258 | |
| Drosophila Stocks | |||
| nSyb-QF2, nSyb-Gal4 | All lines provided by Dr. Mel Feany | N/A | Lines are available directly from Dr. Feany |
| nSyb-QF2, nSyb-Gal4, QUAS-alpha synuclein | N/A | ||
| w1118 | N/A |
Referanslar
- Kalia, L. V., Lang, A. E. Parkinson's disease. Lancet. 386 (9996), 896-912 (2015).
- Bloem, B. R., Okun, M. S., Klein, C. Parkinson's disease. Lancet. 397 (10291), 2284-2303 (2021).
- Ball, N., Teo, W. P., Chandra, S., Chapman, J. Parkinson's disease and the environment. Front Neurol. 10, 218 (2019).
- Zhou, J., Li, J., Papaneri, A. B., Kobzar, N. P., Cui, G. Dopamine neuron challenge test for early detection of Parkinson's disease. NPJ Parkinsons Dis. 7 (1), 116 (2021).
- Ueki, A., Otsuka, M. Life style risks of Parkinson's disease: association between decreased water intake and constipation. J Neurol. 251 (Suppl 7), vII18-vII23 (2004).
- Houser, M. C., Tansey, M. G. The gut-brain axis: is intestinal inflammation a silent driver of Parkinson's disease pathogenesis. NPJ Parkinsons Dis. 3, 3 (2017).
- Pfeiffer, R. F. Non-motor symptoms in Parkinson's disease. Parkinsonism Relat Disord. 22 (Suppl 1), (2016).
- Klann, E. M., et al. The Gut-brain axis and its relation to parkinson's disease: A review. Front Aging Neurosci. 13, 782082 (2021).
- Mukherjee, A., Biswas, A., Das, S. K. Gut dysfunction in Parkinson's disease. World J Gastroenterol. 22 (25), 5742-5752 (2016).
- Yemula, N., Dietrich, C., Dostal, V., Hornberger, M. Parkinson's disease and the gut: symptoms, nutrition, and microbiota. J Parkinsons Dis. 11 (4), 1491-1505 (2021).
- Chen, S. J., Lin, C. H. Gut microenvironmental changes as a potential trigger in Parkinson's disease through the gut-brain axis. J Biomed Sci. 29 (1), 54 (2022).
- Hawrysh, P. J., et al. PRKN/parkin-mediated mitophagy is induced by the probiotics Saccharomyces boulardii and Lactococcus lactis. Autophagy. 19 (7), 2094-2110 (2023).
- Liu, W., Lim, K. L., Tan, E. K. Intestine-derived α-synuclein initiates and aggravates pathogenesis of Parkinson's disease in Drosophila. Transl Neurodegener. 11 (1), 44 (2022).
- Rota, L., et al. Constipation, deficit in colon contractions and alpha-synuclein inclusions within the colon precede motor abnormalities and neurodegeneration in the central nervous system in a mouse model of alpha-synucleinopathy. Transl Neurodegener. 8, 5 (2019).
- Diwakarla, S., et al. ATH434 reverses colorectal dysfunction in the A53T mouse model of Parkinson's disease. J Parkinsons Dis. 11 (4), 1821-1832 (2021).
- Ordonez, D. G., Lee, M. K., Feany, M. B. α-synuclein Induces mitochondrial dysfunction through spectrin and the actin cytoskeleton. Neuron. 97 (1), 108.e6-124.e6 (2018).
- Olsen, A. L., Feany, M. B. Glial α-synuclein promotes neurodegeneration characterized by a distinct transcriptional program in vivo. Glia. 67 (10), 1933-1957 (2019).
- Cognigni, P., Bailey, A. P., Miguel-Aliaga, I. Enteric neurons and systemic signals couple nutritional and reproductive status with intestinal homeostasis. Cell Metab. 13 (1), 92-104 (2011).
- Urquhart-Cronish, M., Sokolowski, M. B. Gene-environment interplay in Drosophila melanogaster: chronic nutritional deprivation in larval life affects adult fecal output. J Insect Physiol. 69, 95-100 (2014).
- Popovic, R., et al. Blocking dPerk in the intestine suppresses neurodegeneration in a Drosophila model of Parkinson's disease. Cell Death Dis. 14 (3), 206 (2023).
- Poteet, E., et al. Neuroprotective actions of methylene blue and its derivatives. PLoS One. 7 (10), e48279 (2012).
- Miguel-Aliaga, I., Jasper, H., Lemaitre, B. Anatomy and physiology of the digestive tract of Drosophila melanogaster. Genetics. 210 (2), 357-396 (2018).
- Schlichting, M., et al. A neural network underlying circadian entrainment and photoperiodic adjustment of sleep and activity in Drosophila. J Neurosci. 36 (35), 9084-9096 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır