Method Article
Mesure de la constipation dans un modèle de la maladie de Parkinson chez la drosophile
Dans cet article
Résumé
Ce protocole présente un test de modélisation de la constipation dans un modèle de drosophile de la maladie de Parkinson à base d’alpha-synucléine.
Résumé
Les symptômes non moteurs de la maladie de Parkinson (MP) sont courants, difficiles à traiter et nuisent considérablement à la qualité de vie. L’un des symptômes non moteurs les plus répandus est la constipation, qui peut précéder le diagnostic de la maladie de Parkinson de plusieurs années, voire de plusieurs décennies. La constipation a été sous-explorée dans les modèles animaux de la maladie de Parkinson et n’a pas de thérapies spécifiques. Ce test utilise un modèle de la maladie de Parkinson chez la drosophile dans lequel l’alpha-synucléine humaine est exprimée sous un pilote panneuronal. Les mouches exprimant l’alpha-synucléine développent les caractéristiques caractéristiques de la maladie de Parkinson : la perte de neurones dopaminergiques, une déficience motrice et des inclusions d’alpha-synucléine.
Ce protocole décrit une méthode pour étudier la constipation chez ces mouches. Les mouches sont placées sur de la nourriture pour mouches avec un additif de couleur bleue pendant la nuit, puis transférées dans la nourriture standard le lendemain. Ils sont ensuite déplacés dans de nouveaux flacons avec de la nourriture anti-mouches standard toutes les heures pendant 8 h. Avant chaque transfert, le pourcentage de taches fécales de couleur bleue par rapport au nombre total de taches fécales sur la paroi du flacon est calculé. Les mouches témoins qui manquent d’alpha-synucléine expulsent tout le colorant bleu des heures avant que les mouches n’expriment l’alpha-synucléine. De plus, le passage des aliments de couleur bleue de l’intestin peut être surveillé avec une simple photographie. La simplicité de ce test permet son utilisation dans des criblages génétiques ou chimiques avancés pour identifier les modificateurs de la constipation chez la drosophile.
Introduction
La maladie de Parkinson (MP) est une maladie neurodégénérative progressive caractérisée cliniquement par la présence de symptômes moteurs tels que la bradykinésie, la rigidité et les tremblements, entraînant une morbidité importante1. Pathologiquement, la maladie de Parkinson est définie par la perte de neurones dopaminergiques dans la substance noire et le mauvais repliement de l’alpha-synucléine, conduisant à la formation de corps de Lewy et de névrites de Lewy. La pathogenèse de la maladie de Parkinson reste mal comprise, probablement en raison d’une interaction complexe de facteurs génétiques et environnementaux 2,3. À l’heure actuelle, il n’existe pas de traitements modificateurs de la maladie, peut-être en partie en raison du stade avancé de la pathologie présente au moment du diagnostic. Des études ont montré que plus de 60 % des neurones dopaminergiques de la substance noire ont déjà été perdus par l’apparition des symptômes moteurs, ce qui souligne la nécessité d’explorer des biomarqueurs potentiels pour la détection précoce de la maladie4. L’un de ces biomarqueurs cliniques est la constipation, qui est fréquente chez les patients atteints de la maladie de Parkinson 5,6 et peut précéder l’apparition des symptômes moteurs de plusieurs années, voire de plusieurs décennies.
Malgré la définition clinique de la maladie de Parkinson basée sur les symptômes moteurs, la constipation est l’un des nombreux symptômes non moteurs qui sont plus difficiles à traiter symptomatiquement et qui entraînent une altération significative de la qualité de vie des patients7. Des altérations de l’axe intestin-cerveau, qui représente la communication bidirectionnelle entre le cerveau et le système nerveux entérique, ont été impliquées dans la pathogenèse de la maladie de Parkinson. Des agrégats d’alpha-synucléine ont été trouvés dans des échantillons de tissus du tractus gastro-intestinal de patients atteints de la maladie de Parkinson8, et des modèles animaux suggèrent que les agrégats d’alpha-synucléine dans le système nerveux entérique se propagent d’une manière semblable à celle d’un prion dans le système nerveux central9. De plus, les patients atteints de la maladie de Parkinson présentent des anomalies du microbiome intestinal10 et peuvent présenter une inflammation intestinale excessive11. La constipation dans la maladie de Parkinson a été sous-étudiée, avec peu de modèles rapportés de constipation associée à la maladie de Parkinson chez les mouches12,13 ou les rongeurs14,15.
Ce test utilise un modèle de la maladie de Parkinson chez la drosophile dans lequel les mouches expriment le gène de l’alpha-synucléine humaine sous le contrôle d’un pilote panneuronal, la n-synaptobrévine. Ces mouches présentent toutes les caractéristiques caractéristiques de la maladie de Parkinson, y compris l’agrégation de l’alpha-synucléine, le dysfonctionnement moteur et la neurodégénérescence liée à l’âge, entraînant la perte de neurones dopaminergiques16,17. Des études antérieures ont introduit la mesure de la production fécale chez les mouches pour évaluer le dysfonctionnement intestinal, quantifier les matières fécales des mouches et comparer les quantités d’excréments à travers diverses lignées génétiques pour révéler des différences fonctionnelles dans le système digestif 18,19,20. Ici, nous démontrons le test de constipation à l’aide de mouches exprimant l’alpha-synucléine humaine. Cet outil simple mais précieux permet d’étudier un symptôme non moteur important de la maladie de Parkinson.
Protocole
Mouches utilisées dans ce test : contrôle : nSyb-QF2, nSyb-Gal4/+ ; mouches alpha-synucléine : nSyb-QF2, nSyb-Gal4, QUAS-alpha-synucléine/+ ; 1 et 10 jours après l’éclosion ; mouches mâles et femelles (accouplées et non accouplées) (voir le tableau des matériaux).
1. Préparation de la nourriture pour mouches teintées
- Mélangez le colorant alimentaire en pâte molle bleue (voir le tableau des matériaux) avec de l’eau distillée dans un rapport de 1 :1 (v/v).
REMARQUE : Utilisez des colorants alimentaires commerciaux qui ne contiennent que des colorants non absorbables, car il a été démontré que certains colorants bleus ont des effets neuroprotecteurs21. - Passer au micro-ondes les flacons de nourriture pour mouches constitués de semoule de maïs standard (voir le tableau des matériaux) à des intervalles de 10 à 15 s jusqu’à ce que l’aliment ait fondu en un liquide ou une suspension. Ne laissez pas les aliments déborder.
- Ajoutez le mélange de colorant à chaque flacon d’aliment pour obtenir une coloration uniforme entre les flacons. Incorporez le mélange de colorant jusqu’à ce que l’aliment soit uniformément bleu (Figure 1). Ajoutez une quantité du mélange de colorant bleu de manière à ce que la couleur de l’aliment soit saturée et qu’il n’y ait pas de variation de couleur entre les flacons.
REMARQUE : Cette étape doit être effectuée peu de temps après le micro-ondes, car les aliments se solidifient rapidement. Si les aliments se solidifient, passez à nouveau le flacon au micro-ondes. - Laissez sécher les flacons d’aliments teints à l’air libre jusqu’à ce qu’ils se solidifient. Placez une fine serviette en papier sur les ouvertures du flacon pendant le séchage pour empêcher les mouches errantes d’atterrir dans le flacon.
- Une fois que la nourriture a refroidi et s’est solidifiée, transférez les mouches qui seront utilisées pour les tests dans la nourriture bleue.
REMARQUE : Pour les flacons étroits (25 mm), il est recommandé d’ajouter 9 à 14 mouches dans chaque flacon. Pour les flacons larges (28,5 mm), il est recommandé d’ajouter 10 à 20 mouches dans chaque flacon. Les mouches ne sont pas séparées par le sexe ou l’expérience d’accouplement et comprennent une population mixte de mouches mâles et femelles, avec des femelles accouplées et non accouplées. - Incuber les flacons avec des mouches pendant une nuit à 25 °C dans un incubateur.
2. Imagerie des mouches
REMARQUE : Cette étape est facultative (Figure 2).
- Le lendemain matin (temps 0), anesthésier les mouches représentatives avec du dioxyde de carbone pendant 60 s. Placez la braguette de manière à ce que la face ventrale soit tournée vers le haut.
- À l’aide d’une caméra (voir le tableau des matériaux), capturez des images des mouches à chaque heure pour visualiser la quantité de nourriture bleue qui reste dans le système digestif.
REMARQUE : Ces mouches ne doivent pas être utilisées pour la partie quantitative du test (étape 3), car l’anesthésie peut affecter les résultats. - À toutes les heures, anesthésiez et imagez les nouvelles mouches.
3. Effectuer le test de constipation
- Transférez les mouches restantes (non anesthésiées) dans des flacons contenant de la nourriture standard pour drosophile . Numérotez chaque flacon.
- Laissez les mouches dans l’incubateur à 25 °C pendant 60 min.
- Après 60 minutes, transférez les mouches dans de nouveaux flacons avec de la nourriture standard pour drosophiles . Commencez l’enregistrement des données à partir du premier jeu de flacons.
- Tracez une ligne pointillée le long de la fiole pour marquer le point à partir duquel le comptage commencera.
- Comptez manuellement le nombre de petits points ronds sur la paroi de chaque flacon. Ne comptez pas les points trouvés sur le bouchon de l’aliment ou du flacon.
- Commencez par compter le nombre de points bleus sur la paroi de chaque flacon.
- Comptez le nombre de points opaques et incolores sur la paroi de chaque flacon.
REMARQUE : Chaque point est un excrément de mouche, qui est une combinaison d’urine et de matières fécales22. À l’occasion, une mouche peut marcher sur les excréments et laisser une traînée, auquel cas, ne comptez que le point d’origine, et non chaque marque individuelle dans la traînée. - Notez le rapport entre le nombre de points bleus et le nombre total de points pour chaque flacon.
REMARQUE : Le nombre total de points est le nombre de points bleus sur la paroi d’un flacon ajouté au nombre de points incolores sur la paroi du même flacon. Cela sera utilisé pour calculer le pourcentage de matières fécales bleues par heure. - Répétez les étapes 3.2 à 3.8 sept fois de plus, en collectant des données toutes les heures pendant un total de 8 h.
4. Analyse des données
- Tracez graphiquement le pourcentage de matières fécales bleues par heure pour chaque condition.
- Comparez les données entre les conditions.
REMARQUE : La signification statistique peut être déterminée de 3 façons : en comparant des points temporels individuels entre des conditions, en mesurant la pente de la ligne au fil du temps ou en comparant l’aire sous la courbe.
Résultats
Parce que l’abdomen de la drosophile est transparent, la nourriture bleue peut être visualisée à l’intérieur de l’intestin chez les mouches vivantes anesthésiées. Les différences qualitatives dans le transit intestinal peuvent être évaluées en prenant des images des mouches à différents moments. Chez les mouches témoins, la nourriture bleue est rapidement expulsée, tandis que chez les mouches alpha-synucléine, la nourriture bleue reste présente dans l’intestin jusqu’à 8 heures (Figure 2).
Les mouches alpha-synucléine présentent une neurodégénérescence liée à l’âge, avec un phénotype robuste se développant 10 jours après l’éclosion10. À ce moment-là, les différences dans le temps de transit intestinal par rapport aux mouches témoins sont observées en comparant des points de temps individuels entre les conditions, en mesurant la pente de la ligne au fil du temps ou en comparant l’aire sous la courbe (figure 3). Aucune différence n’est observée dans le transit intestinal entre les mouches témoins et les mouches alpha-synucléine à un moment plus précoce, le jour 1 après l’éclosion, lorsque le dysfonctionnement moteur et la neurodégénérescence ne sont pas encore présents (Figure 4).
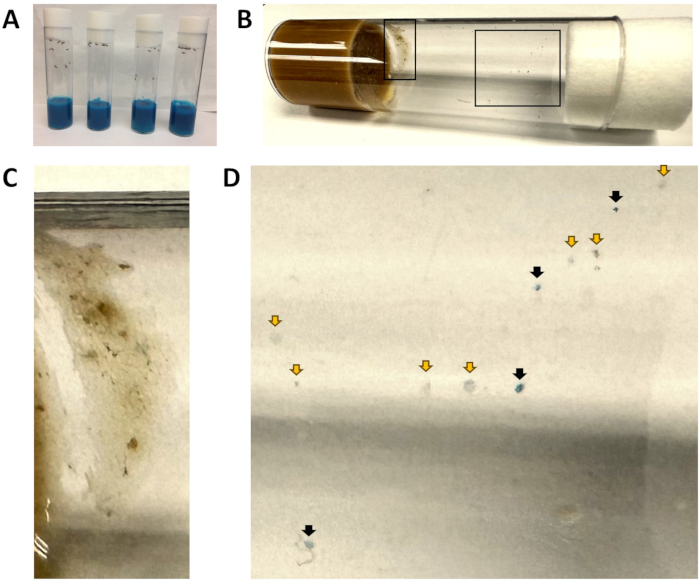
Figure 1 : Flacons d’aliments bleus et taches fécales. (A) Tous les flacons contiennent des aliments de couleur bleue. À ce stade, les mouches viennent d’être introduites dans la nourriture bleue et aucune matière fécale bleue n’est visible. (B) Un flacon après que les mouches w1118 ont été transférées dans des aliments frais pendant 1 h, puis retirées. L’encart de gauche est agrandi en (C) et l’encart de droite est agrandi en (D). (C) Une zone exclue de l’analyse en raison de la présence de nourriture pour mouches. (D) Vue agrandie des taches fécales, indiquant les taches bleues (flèches noires) et non bleues (flèches jaunes). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Visualisation du transit intestinal de l’aliment coloré au fil du temps. Les mouches témoins et les mouches exprimant l’alpha-synucléine humaine dans les neurones ont été laissées sur de la nourriture colorée en bleu pendant la nuit, puis transférées dans des milieux standard le lendemain. Les mouches ont été transférées en série dans une nouvelle nourriture standard pour mouches toutes les heures. Des images représentatives au temps zéro et 2, 4, 6 et 8 h après le transfert sont affichées. Les mouches témoins et les mouches alpha-synucléines présentent des taches similaires de nourriture bleue dans l’intestin au temps zéro. Aux points temporels suivants, les mouches témoins ont moins de nourriture bleue que les mouches alpha-synucléine, et toute la nourriture bleue a disparu au point temporel de 8 h chez les mouches témoins. Les génotypes de chaque lignée de mouche sont les suivants : témoin (nSyb-QF2, nSyb-Gal4/+) ; mouches alpha-synucléine (nSyb-QF2, nSyb-Gal4, QUAS-alpha-synucléine/+). Les mouches femelles sont utilisées pour l’imagerie en raison de leur capacité plus facile à visualiser l’abdomen en raison de leur plus grande taille. Veuillez cliquer ici pour voir une version agrandie de cette figure.
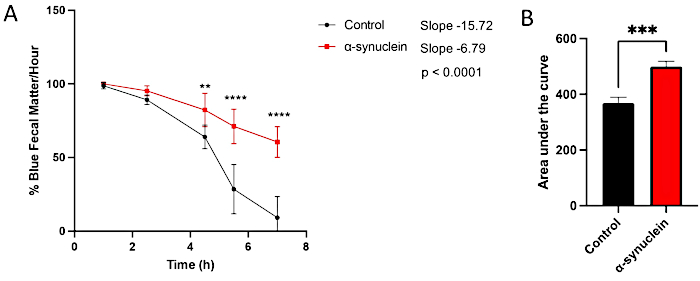
Figure 3 : Test de constipation chez les mouches post-éclosion du jour 10. Les mouches témoins et les mouches exprimant l’alpha-synucléine humaine dans les neurones ont été laissées sur de la nourriture teinte en bleu pendant la nuit, puis transférées dans la nourriture standard des mouches le lendemain. Les mouches ont été transférées en série sur de nouveaux supports standard toutes les heures. (A) Pourcentage de matières fécales bleues par heure. Les barres d’erreur représentent l’écart-type. N = 6 flacons par génotype ; Chaque flacon contenait de 9 à 14 mouches. Toutes les analyses statistiques ont été effectuées dans Graphpad Prism (voir le tableau des matériaux). La signification statistique à chaque point temporel a été calculée à l’aide d’une ANOVA à deux facteurs. La pente de la droite et la différence entre les pentes ont été calculées à l’aide de l’analyse de régression linéaire. (B) L’aire sous la courbe pour chaque génotype a été calculée. Les barres d’erreur représentent l’écart-type. Les génotypes de chaque lignée de mouche sont les suivants : témoin (nSyb-QF2, nSyb-Gal4/+) ; mouches alpha-synucléine (nSyb-QF2, nSyb-Gal4, QUAS-alpha-synucléine/+). Les mouches mâles et femelles sont incluses en nombre à peu près égal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
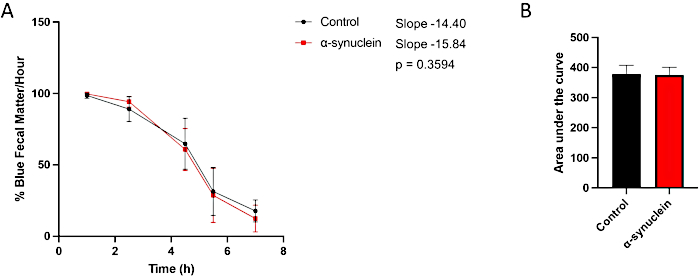
Figure 4 : Dosage de la constipation chez les mouches post-éclosion du jour 1. Les mouches témoins et les mouches exprimant l’alpha-synucléine humaine dans les neurones ont été laissées sur de la nourriture colorée en bleu pendant la nuit, puis transférées dans des milieux standard le lendemain. Les mouches ont été transférées en série dans une nouvelle nourriture standard pour mouches toutes les heures. (A) Pourcentage de matières fécales bleues par heure. Les barres d’erreur représentent l’écart-type. N = minimum 5 flacons par génotype ; Chaque flacon contenait de 9 à 14 mouches. Toutes les analyses statistiques ont été effectuées dans Graphpad Prism. La signification statistique à chaque point temporel a été calculée à l’aide d’une ANOVA à deux facteurs. La pente de la droite et la différence entre les pentes ont été calculées à l’aide de l’analyse de régression linéaire. (B) L’aire sous la courbe pour chaque génotype a été calculée. Les barres d’erreur représentent l’écart-type. Les génotypes de chaque lignée de mouche sont les suivants : témoin (nSyb-QF2, nSyb-Gal4/+) ; mouches alpha-synucléine (nSyb-QF2, nSyb-Gal4, QUAS-alpha-synucléine/+). Les mouches mâles et femelles sont incluses en nombre à peu près égal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Il y a plusieurs étapes dans ce protocole qui aideront à la réussite de l’essai. Tout d’abord, il est important de s’assurer que les intervalles de temps entre chaque tour pour chaque flacon sont cohérents tout au long de l’expérience. L’étiquetage des flacons avec des numéros permettra d’éviter d’avoir à décrire longuement les génotypes, ce qui permettra de gagner du temps. De plus, il est crucial que la méthode de comptage des matières fécales22 reste cohérente tout au long de l’expérience. Alors que les matières fécales bleues sont visibles sur le bouchon de la nourriture et du flacon, les matières fécales incolores ne le sont pas. Par conséquent, ne comptez pas les points bleus sur le bouchon de l’aliment ou du flacon.
Avec les tests comportementaux, il y a toujours une possibilité d’incohérences dans les résultats en raison de fluctuations dans le comportement des mouches ou de variables inconnues affectant le test. Nous recommandons d’utiliser le même milieu de drosophile , le même colorant alimentaire et la même marque de flacons pour toutes les expériences. Il est intéressant de noter que dans plusieurs essais, il a été observé que les mouches ont tendance à déféquer moins fréquemment en début d’après-midi, peut-être en raison du rythme circadien des mouches23. Cependant, ce comportement est cohérent à la fois chez les mouches témoins et chez les mouches exprimant l’alpha-synucléine, il ne devrait donc pas soulever de préoccupations.
Si les mouches n’excrètent pas de matières fécales bleues au début du test, il est possible que le colorant utilisé ne soit pas suffisamment pigmenté. Dans ce cas, on peut augmenter le rapport entre le colorant et l’eau distillée en conséquence. Il est également possible que lorsqu’il ne reste qu’une petite quantité de nourriture bleue dans le tube digestif de la mouche, il peut être difficile de déterminer si les matières fécales sont bleu pâle ou incolores. Lorsque cela se produit, placez une feuille de papier blanc derrière le flacon pour aider à déterminer la couleur du point fécal. Même si les matières fécales sont bleu très clair, il est préférable de les enregistrer comme des matières fécales bleues plutôt que comme des matières fécales incolores.
L’une des limites de ce test est qu’il nécessite un comptage manuel des taches fécales. Afin d’améliorer le potentiel de criblage à haut débit, ce protocole pourrait être modifié à l’avenir pour permettre la quantification automatisée des taches fécales bleues produites par des mouches individuelles dans des plaques à puits multiples. Une autre limite est que, bien que le modèle de l’alpha-synucléine ait le potentiel d’être développé en un modèle prodromique de la maladie de Parkinson, un moment optimal où la constipation est présente sans neurodégénérescence n’a pas encore été identifié.
En résumé, cette méthode offre une approche simple et directe pour modéliser la constipation, un symptôme non moteur de la maladie de Parkinson peu étudié, dans un modèle de la maladie de Parkinson chez la drosophile .
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions le Dr Mel Feany du Brigham and Women’s Hospital et de la Harvard Medical School pour l’aimable cadeau du contrôle et de l’alpha-synucléine exprimant les lignées de drosophile . Nous reconnaissons les sources suivantes de soutien financier au Dr Olsen : NINDS K08, bourse George C. Cotzias de l’American Parkinson Disease Association, prix du chercheur précoce sur la maladie de Parkinson du ministère de la Défense.
matériels
| Name | Company | Catalog Number | Comments |
| 1400 g sucrose | MP Biomedicals | 904713 | |
| 1800 g dextrose | MP Biomedicals | 901521 | |
| 2884 g yeast | MP Biomedicals | 903312 | |
| 428 g agar | Fisher Scientific | 10253156 | |
| 4600 mL molasses | Grandma's Molasses | 7971942 | |
| 68 L water | N/A | N/A | |
| 680 mL tegosept mix (1200 g tegosept in 6 L ethanol) | |||
| 6864 g cornmeal | Pearl Milling | 125045 | |
| 800 mL acid mix (83 mL phosphoric acid in 1 L water + 836 mL propionic acid in 1 L water) | |||
| cellSens Standard software | Olympus | N/A | |
| Ethanol | Pharmco-Aper | 111ACS200 | |
| Flugs for wide plastic vials | Genesee Scientific | 49-101 | |
| Flystuff wide Drosophila vials, polystyrene | Genesee Scientific | 32-117 | |
| Graphpad Prism | GraphPad | N/A | Version 9.5.1 |
| Olympus DP23 camera | Olympus | N/A | |
| Olympus SZX12 Stereo Microscope | Olympus | N/A | |
| Phosphoric Acid | Fisher Scientific | S25470A | |
| Propionic Acid | Fisher Scientific | A258 - 500 | |
| Soft gel paste food color, Royal blue | AmeriColor | 202 | |
| Tegosept | Apex | 20-258 | |
| Drosophila Stocks | |||
| nSyb-QF2, nSyb-Gal4 | All lines provided by Dr. Mel Feany | N/A | Lines are available directly from Dr. Feany |
| nSyb-QF2, nSyb-Gal4, QUAS-alpha synuclein | N/A | ||
| w1118 | N/A |
Références
- Kalia, L. V., Lang, A. E. Parkinson's disease. Lancet. 386 (9996), 896-912 (2015).
- Bloem, B. R., Okun, M. S., Klein, C. Parkinson's disease. Lancet. 397 (10291), 2284-2303 (2021).
- Ball, N., Teo, W. P., Chandra, S., Chapman, J. Parkinson's disease and the environment. Front Neurol. 10, 218 (2019).
- Zhou, J., Li, J., Papaneri, A. B., Kobzar, N. P., Cui, G. Dopamine neuron challenge test for early detection of Parkinson's disease. NPJ Parkinsons Dis. 7 (1), 116 (2021).
- Ueki, A., Otsuka, M. Life style risks of Parkinson's disease: association between decreased water intake and constipation. J Neurol. 251 (Suppl 7), vII18-vII23 (2004).
- Houser, M. C., Tansey, M. G. The gut-brain axis: is intestinal inflammation a silent driver of Parkinson's disease pathogenesis. NPJ Parkinsons Dis. 3, 3 (2017).
- Pfeiffer, R. F. Non-motor symptoms in Parkinson's disease. Parkinsonism Relat Disord. 22 (Suppl 1), (2016).
- Klann, E. M., et al. The Gut-brain axis and its relation to parkinson's disease: A review. Front Aging Neurosci. 13, 782082 (2021).
- Mukherjee, A., Biswas, A., Das, S. K. Gut dysfunction in Parkinson's disease. World J Gastroenterol. 22 (25), 5742-5752 (2016).
- Yemula, N., Dietrich, C., Dostal, V., Hornberger, M. Parkinson's disease and the gut: symptoms, nutrition, and microbiota. J Parkinsons Dis. 11 (4), 1491-1505 (2021).
- Chen, S. J., Lin, C. H. Gut microenvironmental changes as a potential trigger in Parkinson's disease through the gut-brain axis. J Biomed Sci. 29 (1), 54 (2022).
- Hawrysh, P. J., et al. PRKN/parkin-mediated mitophagy is induced by the probiotics Saccharomyces boulardii and Lactococcus lactis. Autophagy. 19 (7), 2094-2110 (2023).
- Liu, W., Lim, K. L., Tan, E. K. Intestine-derived α-synuclein initiates and aggravates pathogenesis of Parkinson's disease in Drosophila. Transl Neurodegener. 11 (1), 44 (2022).
- Rota, L., et al. Constipation, deficit in colon contractions and alpha-synuclein inclusions within the colon precede motor abnormalities and neurodegeneration in the central nervous system in a mouse model of alpha-synucleinopathy. Transl Neurodegener. 8, 5 (2019).
- Diwakarla, S., et al. ATH434 reverses colorectal dysfunction in the A53T mouse model of Parkinson's disease. J Parkinsons Dis. 11 (4), 1821-1832 (2021).
- Ordonez, D. G., Lee, M. K., Feany, M. B. α-synuclein Induces mitochondrial dysfunction through spectrin and the actin cytoskeleton. Neuron. 97 (1), 108.e6-124.e6 (2018).
- Olsen, A. L., Feany, M. B. Glial α-synuclein promotes neurodegeneration characterized by a distinct transcriptional program in vivo. Glia. 67 (10), 1933-1957 (2019).
- Cognigni, P., Bailey, A. P., Miguel-Aliaga, I. Enteric neurons and systemic signals couple nutritional and reproductive status with intestinal homeostasis. Cell Metab. 13 (1), 92-104 (2011).
- Urquhart-Cronish, M., Sokolowski, M. B. Gene-environment interplay in Drosophila melanogaster: chronic nutritional deprivation in larval life affects adult fecal output. J Insect Physiol. 69, 95-100 (2014).
- Popovic, R., et al. Blocking dPerk in the intestine suppresses neurodegeneration in a Drosophila model of Parkinson's disease. Cell Death Dis. 14 (3), 206 (2023).
- Poteet, E., et al. Neuroprotective actions of methylene blue and its derivatives. PLoS One. 7 (10), e48279 (2012).
- Miguel-Aliaga, I., Jasper, H., Lemaitre, B. Anatomy and physiology of the digestive tract of Drosophila melanogaster. Genetics. 210 (2), 357-396 (2018).
- Schlichting, M., et al. A neural network underlying circadian entrainment and photoperiodic adjustment of sleep and activity in Drosophila. J Neurosci. 36 (35), 9084-9096 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon