Method Article
Misurazione della stitichezza in un modello di Drosophila del morbo di Parkinson
In questo articolo
Riepilogo
Questo protocollo presenta un test per la modellazione della stitichezza in un modello di Drosophila basato sull'alfa-sinucleina del morbo di Parkinson.
Abstract
I sintomi non motori nella malattia di Parkinson (PD) sono comuni, difficili da trattare e compromettono significativamente la qualità della vita. Un sintomo non motorio prevalente è la stitichezza, che può precedere la diagnosi di malattia di Parkinson di anni o addirittura decenni. La stitichezza è stata poco esplorata nei modelli animali di Parkinson e manca di terapie specifiche. Questo test utilizza un modello di Drosophila di PD in cui l'alfa-sinucleina umana è espressa sotto un driver pan-neuronale. I moscerini che esprimono alfa-sinucleina sviluppano le caratteristiche distintive del morbo di Parkinson: la perdita di neuroni dopaminergici, la compromissione motoria e le inclusioni di alfa-sinucleina.
Questo protocollo delinea un metodo per studiare la stitichezza in questi moscerini. Le mosche vengono posizionate sul cibo per mosche con un additivo di colore blu durante la notte e poi trasferite al cibo standard il giorno successivo. Successivamente vengono spostati in nuove fiale con cibo standard per mosche ogni ora per 8 ore. Prima di ogni trasferimento, viene calcolata la percentuale di macchie fecali di colore blu rispetto alle macchie fecali totali sulla parete del flaconcino. I moscerini di controllo privi di alfa-sinucleina espellono tutto il colorante blu ore prima che i moscerini esprimano l'alfa-sinucleina. Inoltre, il passaggio di cibo di colore blu dall'intestino può essere monitorato con una semplice fotografia. La semplicità di questo test ne consente l'uso in screening genetici o chimici per identificare i modificatori della stitichezza in Drosophila.
Introduzione
La malattia di Parkinson (PD) è una malattia neurodegenerativa progressiva caratterizzata clinicamente dalla presenza di sintomi motori come bradicinesia, rigidità e tremore, con conseguente significativa morbilità1. Dal punto di vista patologico, la malattia di Parkinson è definita dalla perdita di neuroni dopaminergici nella substantia nigra e dal misfolding dell'alfa-sinucleina, che porta alla formazione di corpi di Lewy e neuriti di Lewy. La patogenesi della malattia di Parkinson rimane poco conosciuta, probabilmente a causa di una complessa interazione di fattori genetici e ambientali 2,3. Attualmente, le terapie modificanti la malattia non sono disponibili, probabilmente in parte a causa dello stadio avanzato della patologia presente al momento della diagnosi. Gli studi hanno dimostrato che oltre il 60% dei neuroni dopaminergici nella substantia nigra sono già stati persi dall'insorgenza dei sintomi motori, sottolineando la necessità di esplorare potenziali biomarcatori per la diagnosi precoce della malattia4. Uno di questi biomarcatori clinici è la stitichezza, che è comune nei pazienti con PD 5,6 e può precedere l'insorgenza dei sintomi motori di anni o addirittura decenni.
Nonostante la definizione clinica del PD si basi sui sintomi motori, la stitichezza è uno dei numerosi sintomi non motori che sono più difficili da trattare sintomaticamente e causano una significativa compromissione della qualità della vita dei pazienti7. Le alterazioni dell'asse intestino-cervello, che rappresenta la comunicazione bidirezionale tra il cervello e il sistema nervoso enterico, sono state implicate nella patogenesi del morbo di Parkinson. Aggregati di alfa-sinucleina sono stati trovati in campioni di tessuto provenienti dal tratto gastrointestinale di pazienti con PD8 e modelli animali suggeriscono che gli aggregati di alfa-sinucleina nel sistema nervoso enterico si diffondono in modo simile ai prioni al sistema nervoso centrale9. Inoltre, i pazienti affetti da Parkinson presentano anomalie nel microbioma intestinale10 e possono manifestare un'eccessiva infiammazione intestinale11. La stitichezza nel morbo di Parkinson è stata poco studiata, con pochi modelli riportati di stipsi associata al Parkinson nei moscerini 12,13 o nei roditori14,15.
Questo test impiega un modello di Drosophila di PD in cui i moscerini esprimono il gene dell'alfa-sinucleina umana sotto il controllo di un driver pan-neuronale, la n-sinaptobrevina. Questi moscerini presentano tutte le caratteristiche distintive del morbo di Parkinson, tra cui l'aggregazione di alfa-sinucleina, la disfunzione motoria e la neurodegenerazione legata all'età, con conseguente perdita di neuroni dopaminergici16,17. Studi precedenti hanno introdotto la misurazione della produzione fecale nei moscerini per valutare la disfunzione intestinale, quantificando la materia fecale dei moscerini e confrontando le quantità di escrementi tra varie linee genetiche per rivelare differenze funzionali nel sistema digestivo 18,19,20. Qui, dimostriamo il test di stitichezza utilizzando mosche che esprimono alfa-sinucleina umana. Questo semplice ma prezioso strumento consente lo studio di un importante sintomo non motorio del morbo di Parkinson.
Protocollo
Mosche utilizzate in questo saggio: controllo: nSyb-QF2, nSyb-Gal4/+; mosche alfa-sinucleina: nSyb-QF2, nSyb-Gal4, QUAS-alfa-sinucleina/+; 1 e 10 giorni dopo l'eclusione; mosche maschi e femmine (accoppiate e non accoppiate) (vedi Tabella dei materiali).
1. Preparazione del cibo per mosche tinte
- Miscelare il colorante alimentare in pasta gel morbido blu (vedi Tabella dei materiali) con acqua distillata in rapporto 1:1 (v/v).
NOTA: Utilizzare coloranti alimentari commerciali che contengano solo coloranti non assorbibili, poiché è stato dimostrato che alcuni coloranti blu hanno effetti neuroprotettivi21. - Cuocere nel microonde le fiale di cibo per mosche costituito da farina di mais agar standard (vedere la tabella dei materiali) a intervalli di 10-15 secondi fino a quando il cibo non si è sciolto in un liquido o in un liquame. Non lasciare che il cibo trabocchi.
- Aggiungere la miscela colorante a ciascun flaconcino di cibo per ottenere una colorazione uniforme tra i flaconcini. Mescolare la miscela di colorante fino a quando il cibo non diventa blu in modo omogeneo (Figura 1). Aggiungere una quantità della miscela di colorante blu in modo tale che il colore del cibo sia saturo e non vi siano variazioni di colore tra le fiale.
NOTA: Questo passaggio deve essere eseguito subito dopo la cottura nel microonde, poiché il cibo si solidifica rapidamente. Se il cibo si solidifica, cuoci di nuovo il flaconcino nel microonde. - Lasciare asciugare all'aria le fiale di cibo colorato fino a quando non si solidificano. Posizionare un tovagliolo di carta sottile sulle aperture del flaconcino durante l'asciugatura per evitare che eventuali mosche vaganti si fermino nel flaconcino.
- Una volta che il cibo si è raffreddato e solidificato, trasferisci le mosche che verranno utilizzate per il test sul cibo blu.
NOTA: Per i flaconcini stretti (25 mm), si consiglia di aggiungere 9-14 mosche a ciascun flaconcino. Per flaconcini larghi (28,5 mm), si consiglia di aggiungere 10-20 mosche a ciascun flaconcino. Le mosche non sono separate dal sesso o dall'esperienza di accoppiamento e comprendono una popolazione mista di mosche maschi e femmine, con femmine accoppiate e non accoppiate. - Incubare i flaconcini con mosche per una notte a 25 °C in un'incubatrice.
2. Imaging delle mosche
NOTA: Questo passaggio è facoltativo (Figura 2).
- La mattina seguente (tempo 0), anestetizzare le mosche rappresentative con anidride carbonica per 60 s. Posizionare la mosca in modo che il lato ventrale sia rivolto verso l'alto.
- Usando una macchina fotografica (vedi Tabella dei materiali), cattura immagini delle mosche ad ogni ora per visualizzare la quantità di cibo blu rimasto nell'apparato digerente.
NOTA: Queste mosche non devono essere utilizzate per la parte quantitativa del test (fase 3), poiché l'anestesia può influenzare i risultati. - Ad ogni ora, anestetizza e immagini di nuove mosche.
3. Esecuzione del test della stitichezza
- Trasferire le mosche rimanenti (non anestetizzate) in flaconcini con cibo standard per Drosophila . Numerare ogni flaconcino.
- Lasciare le mosche nell'incubatrice a 25 °C per 60 min.
- Dopo 60 minuti, trasferire le mosche in nuove fiale con cibo standard per Drosophila . Iniziare la registrazione dei dati dal primo set di flaconcini.
- Tracciare una linea tratteggiata lungo la lunghezza del flaconcino per segnare il punto da cui inizierà il conteggio.
- Contare manualmente il numero di piccoli punti rotondi sulla parete di ciascun flaconcino. Non contare i punti che si trovano sul cibo o sul tappo del flaconcino.
- Inizia contando il numero di punti blu sulla parete di ogni flaconcino.
- Contare il numero di punti opachi e incolori sulla parete di ciascun flaconcino.
NOTA: Ogni punto è escremento di mosca, che è una combinazione di urina e materia fecale22. A volte, una mosca può camminare sugli escrementi e lasciare una traccia, nel qual caso, conta solo il punto originale, non ogni singolo segno nella scia. - Registrare il rapporto tra i punti blu e il numero totale di punti per ogni flaconcino.
NOTA: Il numero totale di punti è il numero di punti blu sulla parete di un flaconcino sommato al numero di punti incolori sulla parete dello stesso flaconcino. Questo verrà utilizzato per calcolare la percentuale di materia fecale blu all'ora. - Ripetere i passaggi 3.2-3.8 altre sette volte, raccogliendo dati ogni ora per un totale di 8 ore.
4. Analisi dei dati
- Rappresentare graficamente la percentuale di materia fecale blu all'ora per ogni condizione.
- Confrontare i dati tra le condizioni.
NOTA: La significatività statistica può essere determinata in 3 modi: confrontando i singoli punti temporali tra le condizioni, misurando la pendenza della linea nel tempo o confrontando l'area sotto la curva.
Risultati
Poiché l'addome della Drosophila è trasparente, il cibo blu può essere visualizzato all'interno dell'intestino in mosche anestetizzate vive. Le differenze qualitative nel transito intestinale possono essere valutate scattando immagini delle mosche in vari punti temporali. Nei moscerini di controllo, il cibo blu viene rapidamente espulso, mentre nei moscerini alfa-sinucleina, il cibo blu rimane presente nell'intestino fino a 8 ore (Figura 2).
I moscerini dell'alfa-sinucleina mostrano una neurodegenerazione legata all'età, con un fenotipo robusto che si sviluppa entro 10 giorni dall'eclosione10. A questo punto, le differenze nel tempo di transito dell'intestino rispetto ai moscerini di controllo si osservano confrontando i singoli punti temporali tra le condizioni, misurando la pendenza della linea nel tempo o confrontando l'area sotto la curva (Figura 3). Non sono state osservate differenze nel transito intestinale tra i moscerini di controllo e alfa-sinucleina in un momento precedente, il giorno 1 post-eclosione, quando anche la disfunzione motoria e la neurodegenerazione non sono ancora presenti (Figura 4).
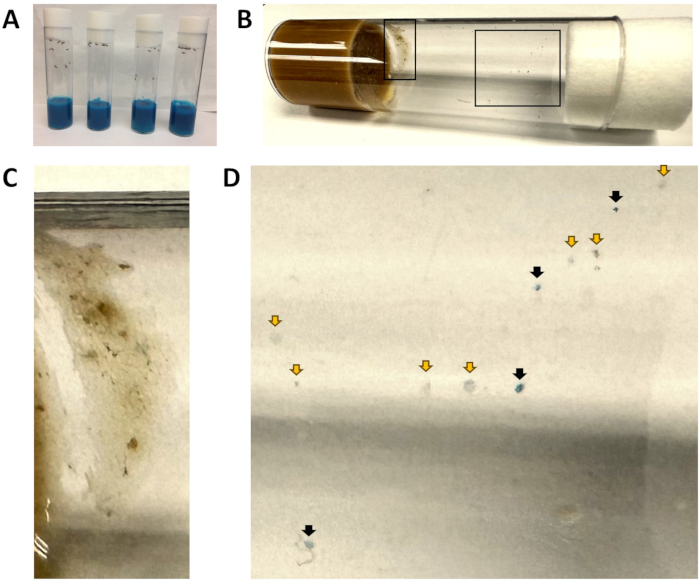
Figura 1: Fiale di cibo blu e macchie fecali. (A) Tutte le fiale contengono cibo di colore blu. A questo punto, le mosche sono appena state introdotte nel cibo blu e non è visibile alcuna materia fecale blu. (B) Un flaconcino dopo w1118 è stato trasferito nell'alimento fresco per 1 ora, quindi rimosso. L'inserto sinistro viene ingrandito in (C) e l'inserto destro viene ingrandito in (D). (C) Un'area esclusa dall'analisi a causa della presenza di cibo per mosche. (D) Vista ingrandita delle macchie fecali, che indicano macchie blu (frecce nere) e macchie non blu (frecce gialle). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Visualizzazione del transito intestinale del cibo colorato nel tempo. I moscerini di controllo e i moscerini che esprimono l'alfa-sinucleina umana nei neuroni sono stati lasciati su cibo colorato di blu durante la notte e poi trasferiti su terreni standard il giorno successivo. Le mosche sono state trasferite in serie al nuovo cibo standard per mosche ogni ora. Vengono mostrate immagini rappresentative al tempo zero e 2, 4, 6 e 8 ore dopo il trasferimento. I moscerini di controllo e alfa-sinucleina mostrano chiazze simili di cibo blu nell'intestino al tempo zero. Nei punti temporali successivi, i moscerini di controllo hanno meno cibo blu rispetto ai moscerini alfa-sinucleina e tutto il cibo blu è sparito al punto temporale di 8 ore nei moscerini di controllo. I genotipi per ogni linea di mosca sono i seguenti: controllo (nSyb-QF2, nSyb-Gal4/+); mosche alfa-sinucleina (nSyb-QF2, nSyb-Gal4, QUAS-alfa-sinucleina/+). Le mosche femmine sono utilizzate per l'imaging a causa della loro più facile capacità di visualizzare l'addome a causa delle loro dimensioni maggiori. Fare clic qui per visualizzare una versione più grande di questa figura.
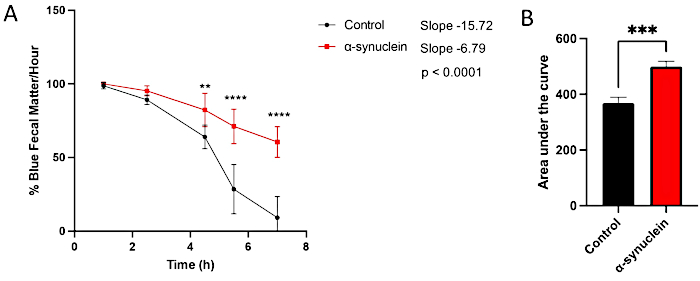
Figura 3: Saggio di stitichezza nei moscerini post-eclosion del giorno 10. Le mosche di controllo e le mosche che esprimono alfa-sinucleina umana nei neuroni sono state lasciate su cibo colorato di blu durante la notte e poi trasferite al cibo per mosche standard il giorno successivo. Le mosche sono state trasferite in serie su nuovi supporti standard ogni ora. (A) Percentuale di materia fecale blu all'ora. Le barre di errore rappresentano la deviazione standard. N = 6 fiale per genotipo; Ogni fiala conteneva 9-14 mosche. Tutte le analisi statistiche sono state eseguite in Graphpad Prism (vedi Tabella dei materiali). La significatività statistica in ogni punto temporale è stata calcolata utilizzando l'ANOVA bidirezionale. La pendenza della linea e la differenza tra le pendenze sono state calcolate utilizzando l'analisi di regressione lineare. (B) È stata calcolata l'area sotto la curva per ciascun genotipo. Le barre di errore rappresentano la deviazione standard. I genotipi per ogni linea di mosca sono i seguenti: controllo (nSyb-QF2, nSyb-Gal4/+); mosche alfa-sinucleina (nSyb-QF2, nSyb-Gal4, QUAS-alfa-sinucleina/+). Sia i maschi che le femmine sono inclusi in numero più o meno uguale. Fare clic qui per visualizzare una versione più grande di questa figura.
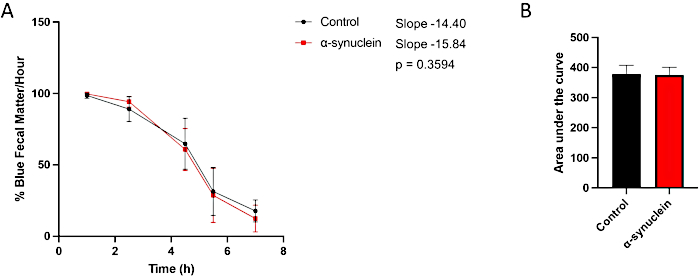
Figura 4: Saggio di stitichezza nei moscerini post-eclosion del giorno 1. I moscerini di controllo e i moscerini che esprimono l'alfa-sinucleina umana nei neuroni sono stati lasciati su cibo colorato di blu durante la notte e poi trasferiti su terreni standard il giorno successivo. Le mosche sono state trasferite in serie al nuovo cibo standard per mosche ogni ora. (A) Percentuale di materia fecale blu all'ora. Le barre di errore rappresentano la deviazione standard. N = minimo 5 fiale per genotipo; Ogni fiala conteneva 9-14 mosche. Tutte le analisi statistiche sono state eseguite in Graphpad Prism. La significatività statistica in ogni punto temporale è stata calcolata utilizzando l'ANOVA bidirezionale. La pendenza della linea e la differenza tra le pendenze sono state calcolate utilizzando l'analisi di regressione lineare. (B) È stata calcolata l'area sotto la curva per ciascun genotipo. Le barre di errore rappresentano la deviazione standard. I genotipi per ogni linea di mosca sono i seguenti: controllo (nSyb-QF2, nSyb-Gal4/+); mosche alfa-sinucleina (nSyb-QF2, nSyb-Gal4, QUAS-alfa-sinucleina/+). Sia i maschi che le femmine sono inclusi in numero più o meno uguale. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Ci sono diversi passaggi in questo protocollo che aiuteranno a completare con successo il test. In primo luogo, è importante assicurarsi che gli intervalli di tempo tra ogni ciclo per ogni flaconcino siano coerenti durante l'esperimento. Etichettare le fiale con i numeri aiuterà a evitare la necessità di lunghe descrizioni del genotipo, risparmiando tempo. Inoltre, è fondamentale che il metodo per contare la materia fecale22 rimanga coerente per tutta la durata dell'esperimento. Mentre la materia fecale blu è visibile sul cibo e sul tappo del flaconcino, la materia fecale incolore non lo è. Pertanto, non contare i punti blu sul tappo del cibo o del flaconcino.
Con i saggi comportamentali, c'è sempre la possibilità di incongruenze nei risultati a causa di fluttuazioni nel comportamento dei moscerini o di variabili sconosciute che influenzano il saggio. Si consiglia di utilizzare lo stesso terreno di Drosophila , lo stesso colorante alimentare e la stessa marca di fiale per tutti gli esperimenti. È interessante notare che, in diversi studi, è stato osservato che le mosche tendono a defecare meno frequentemente nel primo pomeriggio, probabilmente a causa del ritmo circadianodelle mosche 23. Tuttavia, questo comportamento è coerente sia nei moscerini di controllo che nei moscerini che esprimono alfa-sinucleina, quindi non dovrebbe destare preoccupazioni.
Se le mosche non espellono materia fecale blu all'inizio del test, è possibile che il colorante utilizzato non sia abbastanza pigmentato. In questo caso, si può aumentare di conseguenza il rapporto tra colorante e acqua distillata. È anche possibile che quando rimane solo una piccola quantità di cibo blu nel tratto digestivo della mosca, possa essere difficile determinare se la materia fecale è blu pallido o incolore. Quando ciò si verifica, posizionare un foglio di carta bianca dietro la fiala aiuterà a determinare il colore del punto fecale. Anche se la materia fecale è molto azzurra, è meglio registrarla come materia fecale blu piuttosto che come materia fecale incolore.
Un limite di questo test è che richiede il conteggio manuale delle macchie fecali. Per migliorare il potenziale di screening ad alto rendimento, questo protocollo potrebbe essere modificato in futuro per consentire la quantificazione automatizzata delle macchie fecali blu prodotte da singoli moscerini in piastre multi-pozzetto. Un'altra limitazione è che, sebbene il modello di alfa-sinucleina abbia il potenziale per essere sviluppato in un modello prodromico di PD, non è stato ancora identificato un punto temporale ottimale in cui la stitichezza è presente senza neurodegenerazione.
In sintesi, questo metodo offre un approccio semplice e diretto alla modellazione della stitichezza, un sintomo non motorio della malattia di Parkinson poco studiato, in un modello di malattia di Parkinson di Drosophila .
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo il Dr. Mel Feany del Brigham and Women's Hospital e della Harvard Medical School per il gentile dono delle linee di controllo e dell'alfa-sinucleina che esprime Drosophila . Riconosciamo le seguenti fonti di sovvenzione al Dr. Olsen: NINDS K08, American Parkinson Disease Association George C. Cotzias Fellowship, Department of Defense Parkinson's Disease Early Investigator Award.
Materiali
| Name | Company | Catalog Number | Comments |
| 1400 g sucrose | MP Biomedicals | 904713 | |
| 1800 g dextrose | MP Biomedicals | 901521 | |
| 2884 g yeast | MP Biomedicals | 903312 | |
| 428 g agar | Fisher Scientific | 10253156 | |
| 4600 mL molasses | Grandma's Molasses | 7971942 | |
| 68 L water | N/A | N/A | |
| 680 mL tegosept mix (1200 g tegosept in 6 L ethanol) | |||
| 6864 g cornmeal | Pearl Milling | 125045 | |
| 800 mL acid mix (83 mL phosphoric acid in 1 L water + 836 mL propionic acid in 1 L water) | |||
| cellSens Standard software | Olympus | N/A | |
| Ethanol | Pharmco-Aper | 111ACS200 | |
| Flugs for wide plastic vials | Genesee Scientific | 49-101 | |
| Flystuff wide Drosophila vials, polystyrene | Genesee Scientific | 32-117 | |
| Graphpad Prism | GraphPad | N/A | Version 9.5.1 |
| Olympus DP23 camera | Olympus | N/A | |
| Olympus SZX12 Stereo Microscope | Olympus | N/A | |
| Phosphoric Acid | Fisher Scientific | S25470A | |
| Propionic Acid | Fisher Scientific | A258 - 500 | |
| Soft gel paste food color, Royal blue | AmeriColor | 202 | |
| Tegosept | Apex | 20-258 | |
| Drosophila Stocks | |||
| nSyb-QF2, nSyb-Gal4 | All lines provided by Dr. Mel Feany | N/A | Lines are available directly from Dr. Feany |
| nSyb-QF2, nSyb-Gal4, QUAS-alpha synuclein | N/A | ||
| w1118 | N/A |
Riferimenti
- Kalia, L. V., Lang, A. E. Parkinson's disease. Lancet. 386 (9996), 896-912 (2015).
- Bloem, B. R., Okun, M. S., Klein, C. Parkinson's disease. Lancet. 397 (10291), 2284-2303 (2021).
- Ball, N., Teo, W. P., Chandra, S., Chapman, J. Parkinson's disease and the environment. Front Neurol. 10, 218 (2019).
- Zhou, J., Li, J., Papaneri, A. B., Kobzar, N. P., Cui, G. Dopamine neuron challenge test for early detection of Parkinson's disease. NPJ Parkinsons Dis. 7 (1), 116 (2021).
- Ueki, A., Otsuka, M. Life style risks of Parkinson's disease: association between decreased water intake and constipation. J Neurol. 251 (Suppl 7), vII18-vII23 (2004).
- Houser, M. C., Tansey, M. G. The gut-brain axis: is intestinal inflammation a silent driver of Parkinson's disease pathogenesis. NPJ Parkinsons Dis. 3, 3 (2017).
- Pfeiffer, R. F. Non-motor symptoms in Parkinson's disease. Parkinsonism Relat Disord. 22 (Suppl 1), (2016).
- Klann, E. M., et al. The Gut-brain axis and its relation to parkinson's disease: A review. Front Aging Neurosci. 13, 782082 (2021).
- Mukherjee, A., Biswas, A., Das, S. K. Gut dysfunction in Parkinson's disease. World J Gastroenterol. 22 (25), 5742-5752 (2016).
- Yemula, N., Dietrich, C., Dostal, V., Hornberger, M. Parkinson's disease and the gut: symptoms, nutrition, and microbiota. J Parkinsons Dis. 11 (4), 1491-1505 (2021).
- Chen, S. J., Lin, C. H. Gut microenvironmental changes as a potential trigger in Parkinson's disease through the gut-brain axis. J Biomed Sci. 29 (1), 54 (2022).
- Hawrysh, P. J., et al. PRKN/parkin-mediated mitophagy is induced by the probiotics Saccharomyces boulardii and Lactococcus lactis. Autophagy. 19 (7), 2094-2110 (2023).
- Liu, W., Lim, K. L., Tan, E. K. Intestine-derived α-synuclein initiates and aggravates pathogenesis of Parkinson's disease in Drosophila. Transl Neurodegener. 11 (1), 44 (2022).
- Rota, L., et al. Constipation, deficit in colon contractions and alpha-synuclein inclusions within the colon precede motor abnormalities and neurodegeneration in the central nervous system in a mouse model of alpha-synucleinopathy. Transl Neurodegener. 8, 5 (2019).
- Diwakarla, S., et al. ATH434 reverses colorectal dysfunction in the A53T mouse model of Parkinson's disease. J Parkinsons Dis. 11 (4), 1821-1832 (2021).
- Ordonez, D. G., Lee, M. K., Feany, M. B. α-synuclein Induces mitochondrial dysfunction through spectrin and the actin cytoskeleton. Neuron. 97 (1), 108.e6-124.e6 (2018).
- Olsen, A. L., Feany, M. B. Glial α-synuclein promotes neurodegeneration characterized by a distinct transcriptional program in vivo. Glia. 67 (10), 1933-1957 (2019).
- Cognigni, P., Bailey, A. P., Miguel-Aliaga, I. Enteric neurons and systemic signals couple nutritional and reproductive status with intestinal homeostasis. Cell Metab. 13 (1), 92-104 (2011).
- Urquhart-Cronish, M., Sokolowski, M. B. Gene-environment interplay in Drosophila melanogaster: chronic nutritional deprivation in larval life affects adult fecal output. J Insect Physiol. 69, 95-100 (2014).
- Popovic, R., et al. Blocking dPerk in the intestine suppresses neurodegeneration in a Drosophila model of Parkinson's disease. Cell Death Dis. 14 (3), 206 (2023).
- Poteet, E., et al. Neuroprotective actions of methylene blue and its derivatives. PLoS One. 7 (10), e48279 (2012).
- Miguel-Aliaga, I., Jasper, H., Lemaitre, B. Anatomy and physiology of the digestive tract of Drosophila melanogaster. Genetics. 210 (2), 357-396 (2018).
- Schlichting, M., et al. A neural network underlying circadian entrainment and photoperiodic adjustment of sleep and activity in Drosophila. J Neurosci. 36 (35), 9084-9096 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon