Method Article
Medindo a constipação em um modelo de Drosophila da doença de Parkinson
Neste Artigo
Resumo
Este protocolo apresenta um ensaio para modelagem da constipação intestinal em um modelo de doença de Parkinson baseado em alfa-sinucleína .
Resumo
Os sintomas não motores na doença de Parkinson (DP) são comuns, difíceis de tratar e comprometem significativamente a qualidade de vida. Um sintoma não motor prevalente é a constipação, que pode preceder o diagnóstico de DP em anos ou até décadas. A constipação intestinal tem sido pouco explorada em modelos animais de DP e carece de terapias específicas. Este ensaio utiliza um modelo de Drosophila de DP em que a alfa-sinucleína humana é expressa sob um driver pan-neuronal. As moscas que expressam alfa-sinucleína desenvolvem as características marcantes da DP: a perda de neurônios dopaminérgicos, comprometimento motor e inclusões de alfa-sinucleína.
Este protocolo descreve um método para estudar a constipação nessas moscas. As moscas são colocadas em alimentos de mosca com um aditivo de cor azul durante a noite e, em seguida, transferidas para o alimento padrão no dia seguinte. Eles são posteriormente movidos para novos frascos com comida padrão para moscas a cada hora por 8 h. Antes de cada transferência, a porcentagem de manchas fecais de cor azul em comparação com o total de manchas fecais na parede do frasco é calculada. As moscas de controle que não possuem alfa-sinucleína expelem todo o corante azul horas antes das moscas expressarem alfa-sinucleína. Além disso, a passagem de alimentos de cor azul do intestino pode ser monitorada com fotografias simples. A simplicidade deste ensaio permite seu uso em rastreios genéticos ou químicos para identificar modificadores da constipação em Drosophila.
Introdução
A doença de Parkinson (DP) é uma doença neurodegenerativa progressiva caracterizada clinicamente pela presença de sintomas motores como bradicinesia, rigidez e tremor, resultando em morbidade significativa1. Patologicamente, a DP é definida pela perda de neurônios dopaminérgicos na substância negra e pelo desdobramento da alfa-sinucleína, levando à formação de corpos de Lewy e neuritos de Lewy. A patogênese da DP permanece pouco compreendida, provavelmente decorrente de uma complexa interação de fatores genéticos eambientais2,3. Atualmente, terapias modificadoras da doença não estão disponíveis, possivelmente devido em parte ao estágio avançado da patologia presente no momento do diagnóstico. Estudos têm demonstrado que mais de 60% dos neurônios dopaminérgicos da substância negra já foram perdidos pelo aparecimento dos sintomas motores, reforçando a necessidade de explorar potenciais biomarcadores para a detecção precoce da doença4. Um desses biomarcadores clínicos é a constipação, que é comum em pacientes comDP5,6 e pode preceder o início dos sintomas motores em anos ou até décadas.
Apesar da definição clínica da DP baseada em sintomas motores, a constipação intestinal é um dos vários sintomas não motores que são mais difíceis de tratar sintomaticamente e causam prejuízo significativo na qualidade de vida dospacientes7. Alterações no eixo intestino-cérebro, que representa a comunicação bidirecional entre o cérebro e o sistema nervoso entérico, têm sido implicadas na patogênese da DP. Agregados de alfa-sinucleína têm sido encontrados em amostras de tecido do trato gastrointestinal de pacientes com DP8, e modelos animais sugerem que agregados de alfa-sinucleína no sistema nervoso entérico se espalham de forma príon-sínica para o sistema nervoso central9. Além disso, pacientes com DP apresentam anormalidades no microbioma intestinal10 e podem apresentar inflamação intestinal excessiva11. A constipação intestinal na DP tem sido pouco estudada, com poucos modelos relatados de constipação associada à doença de Parkinson em moscas 12,13 ou roedores14,15.
Este ensaio emprega um modelo de Drosophila de DP no qual as moscas expressam o gene da alfa-sinucleína humana sob o controle de um driver pan-neuronal, a n-sinaptobrevina. Essas moscas exibem todas as características marcantes da DP, incluindo agregação de alfa-sinucleína, disfunção motora e neurodegeneração relacionada à idade, resultando na perda de neurônios dopaminérgicos16,17. Estudos prévios introduziram a medida do débito fecal em moscas para avaliar a disfunção intestinal, quantificando a matéria fecal das moscas e comparando a quantidade de excretas através de várias linhagens genéticas para revelar diferenças funcionais no sistema digestório 18,19,20. Aqui, demonstramos o ensaio de constipação usando moscas expressando alfa-sinucleína humana. Esta ferramenta simples, mas valiosa, possibilita o estudo de um importante sintoma não motor da DP.
Protocolo
Moscas utilizadas neste ensaio: controle: nSyb-QF2, nSyb-Gal4/+; moscas alfa-sinucleínas: nSyb-QF2, nSyb-Gal4, QUAS-alfa-sinucleína/+; 1 e 10 dias pós-eclosão; moscas machos e fêmeas (acasaladas e não acasaladas) (ver Tabela de Materiais).
1. Preparação do alimento de mosca tingido
- Misture corantes alimentares de pasta de gel suave azul (ver Tabela de Materiais) com água destilada na proporção de 1:1 (v/v).
NOTA: Utilizar corantes alimentares comerciais que contenham apenas corantes não absorvíveis, pois alguns corantes azuis demonstraram ter efeitos neuroprotetores21. - Leve ao micro-ondas os frascos de alimentos para moscas constituídos por ágar-fubá padrão (ver Tabela de Materiais) em intervalos de 10-15 s até que o alimento tenha derretido em um líquido ou chorume. Não deixe os alimentos ferverem.
- Adicione a mistura de corantes a cada frasco para injetáveis de alimentos para obter uma coloração uniforme entre os frascos para injetáveis. Misture a mistura de corantes até que o alimento fique homogeneamente azul (Figura 1). Adicione uma quantidade da mistura de corante azul de modo que a cor do alimento esteja saturada e não haja variação de cor entre os frascos.
OBS: Essa etapa deve ser feita logo após o micro-ondulação, pois o alimento se solidifica rapidamente. Se o alimento se solidificar, leve o frasco para injetáveis ao micro-ondas novamente. - Deixe os frascos de alimentos tingidos secar ao ar até solidificar. Coloque uma toalha de papel fina sobre as aberturas dos frascos para injetáveis durante a secagem para evitar que moscas perdidas caiam no frasco para injetáveis.
- Uma vez que o alimento tenha resfriado e solidificado, transfira as moscas que serão usadas para teste para o alimento azul.
NOTA: Para frascos para injetáveis estreitos (25 mm), recomenda-se que sejam adicionadas 9-14 moscas a cada frasco para injetáveis. Para frascos para injetáveis largos (28,5 mm), recomenda-se que 10-20 moscas sejam adicionadas a cada frasco para injetáveis. As moscas não são separadas por sexo ou experiência de acasalamento e incluem uma população mista de moscas machos e fêmeas, com fêmeas acasaladas e não acasaladas. - Incubar os frascos para injetáveis com moscas durante a noite a 25 °C numa incubadora.
2. Imagem das moscas
NOTA: Esta etapa é opcional (Figura 2).
- Na manhã seguinte (horário 0), anestesiar as moscas representativas com dióxido de carbono por 60 s. Coloque a mosca de modo que o lado ventral esteja voltado para cima.
- Usando uma câmera (veja Tabela de Materiais), capture imagens das moscas a cada hora para visualizar a quantidade de alimento azul deixada no sistema digestivo.
NOTA: Estas moscas não devem ser usadas para a parte quantitativa do ensaio (passo 3), pois a anestesia pode afetar os resultados. - A cada hora, anestesiar e imaginar novas moscas.
3. Realização do ensaio de constipação
- Transfira as moscas restantes (não anestesiadas) para frascos com alimento padrão de Drosophila . Numere cada frasco.
- Deixe as moscas na incubadora a 25 °C durante 60 min.
- Após 60 min, transfira as moscas para novos frascos com alimento padrão de Drosophila . Inicie a gravação de dados a partir do primeiro conjunto de frascos.
- Desenhe uma linha pontilhada no comprimento do frasco para injetáveis para marcar o ponto a partir do qual a contagem começará.
- Conte manualmente o número de pontos pequenos e redondos na parede de cada frasco para injetáveis. Não conte os pontos encontrados no alimento ou no tampão do frasco para injetáveis.
- Comece contando o número de pontos azuis na parede de cada frasco.
- Conte o número de pontos opacos e incolores na parede de cada frasco para injetáveis.
NOTA: Cada ponto é excremento de mosca, que é uma combinação de urina e matéria fecal22. Na ocasião, uma mosca pode caminhar sobre os excrementos e deixar um rastro, nesse caso, conte apenas o ponto original, não cada marca individual na trilha. - Registar a proporção de pontos azuis em relação ao número total de pontos para cada frasco para injetáveis.
NOTA: O número total de pontos é o número de pontos azuis na parede de um frasco para injetáveis adicionado ao número de pontos incolores na parede do mesmo frasco para injetáveis. Isso será usado para calcular a porcentagem de matéria fecal azul por hora. - Repita as etapas 3.2-3.8 mais sete vezes, coletando dados a cada hora em um total de 8 h.
4. Análise dos dados
- Gráfico da porcentagem de matéria fecal azul por hora para cada condição.
- Compare os dados entre as condições.
NOTA: A significância estatística pode ser determinada de 3 maneiras: comparando pontos de tempo individuais entre condições, medindo a inclinação da reta ao longo do tempo ou comparando a área sob a curva.
Resultados
Como o abdômen de Drosophila é transparente, o alimento azul pode ser visualizado dentro do intestino em moscas vivas anestesiadas. Diferenças qualitativas no trânsito intestinal podem ser avaliadas por meio de imagens das moscas em vários momentos. Nas moscas controle, o alimento azul é expelido rapidamente, enquanto nas moscas alfa-sinucleínas, o alimento azul permanece presente no intestino por até 8 horas (Figura 2).
As moscas alfa-sinucleína apresentam neurodegeneração relacionada à idade, com fenótipo robusto que se desenvolve até 10 dias após a eclosão10. Nesse momento, diferenças no tempo de trânsito intestinal em comparação com moscas controle são observadas comparando-se pontos de tempo individuais entre condições, medindo-se a inclinação da reta ao longo do tempo ou comparando-se a área sob a curva (Figura 3). Não são observadas diferenças no trânsito intestinal entre moscas controle e alfa-sinucleína em um momento mais precoce, dia 1 pós-eclosão, quando a disfunção motora e a neurodegeneração também ainda não estão presentes (Figura 4).
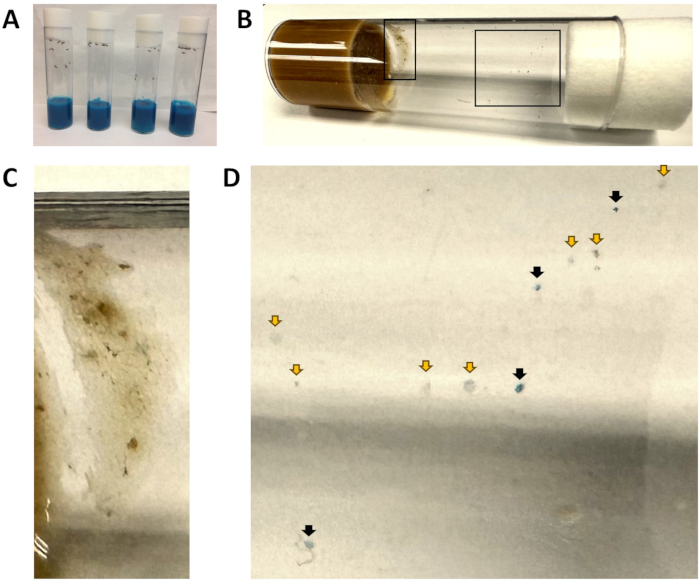
Figura 1: Frascos de alimentos azuis e manchas fecais. (A) Todos os frascos para injetáveis contêm alimentos de cor azul. Neste momento, as moscas acabam de ser introduzidas no alimento azul, e nenhuma matéria fecal azul é visível. (B) Um frasco para injetáveis após as moscas w1118 terem sido transferidos para alimentos frescos durante 1 h e, em seguida, removidos. A inserção esquerda é ampliada em (C) e a interna direita é ampliada em (D). (C) Uma área excluída da análise devido à presença de alimentos para moscas. (D) Visão ampliada das manchas fecais, indicando manchas azuis (setas pretas) e não azuis (setas amarelas). Clique aqui para ver uma versão maior desta figura.

Figura 2: Visualização do trânsito intestinal do alimento tingido ao longo do tempo. Moscas-controle e moscas expressando alfa-sinucleína humana em neurônios foram deixadas em alimentos tingidos de azul durante a noite e, em seguida, transferidas para a mídia padrão no dia seguinte. As moscas eram transferidas em série para novos alimentos padrão a cada hora. Imagens representativas no tempo zero e 2, 4, 6 e 8 h após a transferência são mostradas. As moscas controle e alfa-sinucleína mostram manchas semelhantes de alimento azul no intestino no tempo zero. Em pontos de tempo subsequentes, as moscas de controle têm menos alimento azul do que as moscas alfa-sinucleínas, e todo o alimento azul desaparece no ponto de tempo de 8 h nas moscas de controle. Os genótipos para cada linhagem de mosca são os seguintes: controle (nSyb-QF2, nSyb-Gal4/+); moscas alfa-sinucleína (nSyb-QF2, nSyb-Gal4, QUAS-alfa-sinucleína/+). As moscas fêmeas são usadas para aquisição de imagens devido à sua capacidade mais fácil de visualizar o abdômen devido ao seu tamanho maior. Clique aqui para ver uma versão maior desta figura.
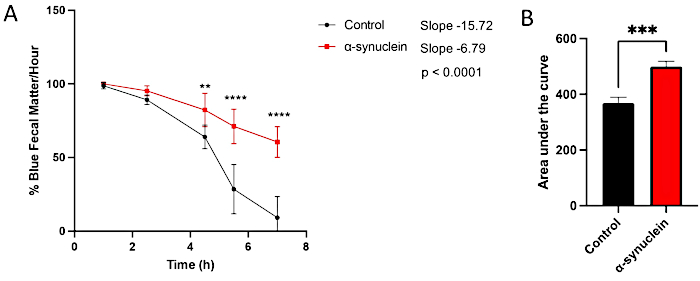
Figura 3: Ensaio de constipação no dia 10 pós-eclosão de moscas. Moscas-controle e moscas expressando alfa-sinucleína humana em neurônios foram deixadas em alimentos tingidos de azul durante a noite e, em seguida, transferidas para a comida padrão de moscas no dia seguinte. As moscas eram transferidas em série para novos meios padrão a cada hora. (A) Porcentagem de matéria fecal azul por hora. As barras de erro representam o desvio padrão. N = 6 frascos por genótipo; Cada frasco continha 9-14 moscas. Todas as análises estatísticas foram realizadas no Graphpad Prism (ver Tabela de Materiais). A significância estatística em cada momento foi calculada usando ANOVA two-way. A inclinação da reta e a diferença entre as inclinações foram calculadas por meio da análise de regressão linear. (B) A área sob a curva para cada genótipo foi calculada. As barras de erro representam o desvio padrão. Os genótipos para cada linhagem de mosca são os seguintes: controle (nSyb-QF2, nSyb-Gal4/+); moscas alfa-sinucleína (nSyb-QF2, nSyb-Gal4, QUAS-alfa-sinucleína/+). Tanto as moscas masculinas quanto as fêmeas estão incluídas em números aproximadamente iguais. Clique aqui para ver uma versão maior desta figura.
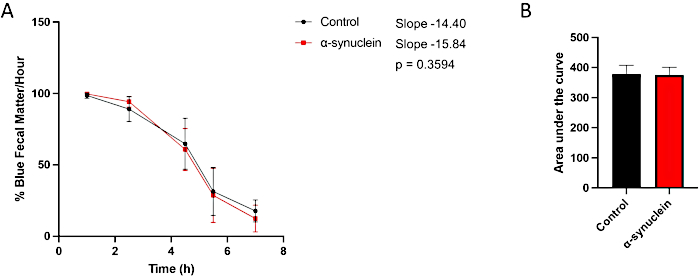
Figura 4: Ensaio de constipação no dia 1 pós-eclosão de moscas. Moscas-controle e moscas expressando alfa-sinucleína humana em neurônios foram deixadas em alimentos tingidos de azul durante a noite e, em seguida, transferidas para a mídia padrão no dia seguinte. As moscas eram transferidas em série para novos alimentos padrão a cada hora. (A) Porcentagem de matéria fecal azul por hora. As barras de erro representam o desvio padrão. N = mínimo de 5 frascos para injetáveis por genótipo; Cada frasco continha 9-14 moscas. Todas as análises estatísticas foram realizadas no Graphpad Prism. A significância estatística em cada momento foi calculada usando ANOVA two-way. A inclinação da reta e a diferença entre as inclinações foram calculadas por meio da análise de regressão linear. (B) A área sob a curva para cada genótipo foi calculada. As barras de erro representam o desvio padrão. Os genótipos para cada linhagem de mosca são os seguintes: controle (nSyb-QF2, nSyb-Gal4/+); moscas alfa-sinucleína (nSyb-QF2, nSyb-Gal4, QUAS-alfa-sinucleína/+). Tanto as moscas masculinas quanto as fêmeas estão incluídas em números aproximadamente iguais. Clique aqui para ver uma versão maior desta figura.
Discussão
Existem várias etapas neste protocolo que ajudarão na conclusão bem-sucedida do ensaio. Em primeiro lugar, é importante garantir que os intervalos de tempo entre cada rodada para cada frasco para injetáveis sejam consistentes ao longo de todo o experimento. Rotular os frascos com números ajudará a evitar a necessidade de longas descrições de genótipos, economizando tempo. Além disso, é crucial que o método de contagem da matéria fecal22 permaneça consistente durante todo o experimento. Enquanto a matéria fecal azul é visível no alimento e no tampão do frasco, a matéria fecal incolor não é. Portanto, não conte os pontos azuis no alimento ou no tampão do frasco.
Com os ensaios comportamentais, há sempre a possibilidade de inconsistências nos resultados devido a flutuações no comportamento das moscas ou variáveis desconhecidas que afetam o ensaio. Recomendamos o uso do mesmo meio de Drosophila , o mesmo corante alimentar e a mesma marca de frascos para todos os experimentos. Curiosamente, em vários ensaios, observou-se que as moscas tendem a defecar com menor frequência no início da tarde, possivelmente devido ao ritmo circadiano das moscas23. No entanto, esse comportamento é consistente tanto em moscas controle quanto em moscas expressando alfa-sinucleína, por isso não deve levantar preocupações.
Se as moscas não excretarem matéria fecal azul no início do ensaio, é possível que o corante utilizado não seja pigmentado o suficiente. Neste caso, pode-se aumentar a proporção de corante para água destilada de acordo. Também é possível que, quando há apenas uma pequena quantidade de alimento azul no trato digestivo da mosca, pode ser difícil determinar se a matéria fecal é azul pálida ou incolor. Quando isso ocorre, colocar uma folha de papel branca atrás do frasco ajudará a determinar a cor do ponto fecal. Mesmo que a matéria fecal seja azul muito clara, é melhor registrá-la como matéria fecal azul em vez de matéria fecal incolor.
Uma limitação deste ensaio é que ele requer a contagem manual de manchas fecais. Para melhorar o potencial de triagem de alto rendimento, este protocolo pode ser modificado no futuro para permitir a quantificação automatizada de manchas fecais azuis produzidas por moscas individuais em placas de poços múltiplos. Outra limitação é que, embora o modelo de alfa-sinucleína tenha potencial para ser desenvolvido em um modelo prodrômico de DP, um momento ideal em que a constipação está presente sem neurodegeneração ainda não foi identificado.
Em resumo, esse método oferece uma abordagem simples e direta para modelar a constipação, um sintoma não motor da DP pouco estudado, em um modelo de DP de Drosophila .
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos ao Dr. Mel Feany no Brigham and Women's Hospital e na Harvard Medical School pelo gentil presente do controle e da alfa-sinucleína expressando linhas de Drosophila . Agradecemos as seguintes fontes de apoio financeiro ao Dr. Olsen: NINDS K08, American Parkinson Disease Association George C. Cotzias Fellowship, Department of Defense Parkinson's Disease Early Investigator Award.
Materiais
| Name | Company | Catalog Number | Comments |
| 1400 g sucrose | MP Biomedicals | 904713 | |
| 1800 g dextrose | MP Biomedicals | 901521 | |
| 2884 g yeast | MP Biomedicals | 903312 | |
| 428 g agar | Fisher Scientific | 10253156 | |
| 4600 mL molasses | Grandma's Molasses | 7971942 | |
| 68 L water | N/A | N/A | |
| 680 mL tegosept mix (1200 g tegosept in 6 L ethanol) | |||
| 6864 g cornmeal | Pearl Milling | 125045 | |
| 800 mL acid mix (83 mL phosphoric acid in 1 L water + 836 mL propionic acid in 1 L water) | |||
| cellSens Standard software | Olympus | N/A | |
| Ethanol | Pharmco-Aper | 111ACS200 | |
| Flugs for wide plastic vials | Genesee Scientific | 49-101 | |
| Flystuff wide Drosophila vials, polystyrene | Genesee Scientific | 32-117 | |
| Graphpad Prism | GraphPad | N/A | Version 9.5.1 |
| Olympus DP23 camera | Olympus | N/A | |
| Olympus SZX12 Stereo Microscope | Olympus | N/A | |
| Phosphoric Acid | Fisher Scientific | S25470A | |
| Propionic Acid | Fisher Scientific | A258 - 500 | |
| Soft gel paste food color, Royal blue | AmeriColor | 202 | |
| Tegosept | Apex | 20-258 | |
| Drosophila Stocks | |||
| nSyb-QF2, nSyb-Gal4 | All lines provided by Dr. Mel Feany | N/A | Lines are available directly from Dr. Feany |
| nSyb-QF2, nSyb-Gal4, QUAS-alpha synuclein | N/A | ||
| w1118 | N/A |
Referências
- Kalia, L. V., Lang, A. E. Parkinson's disease. Lancet. 386 (9996), 896-912 (2015).
- Bloem, B. R., Okun, M. S., Klein, C. Parkinson's disease. Lancet. 397 (10291), 2284-2303 (2021).
- Ball, N., Teo, W. P., Chandra, S., Chapman, J. Parkinson's disease and the environment. Front Neurol. 10, 218 (2019).
- Zhou, J., Li, J., Papaneri, A. B., Kobzar, N. P., Cui, G. Dopamine neuron challenge test for early detection of Parkinson's disease. NPJ Parkinsons Dis. 7 (1), 116 (2021).
- Ueki, A., Otsuka, M. Life style risks of Parkinson's disease: association between decreased water intake and constipation. J Neurol. 251 (Suppl 7), vII18-vII23 (2004).
- Houser, M. C., Tansey, M. G. The gut-brain axis: is intestinal inflammation a silent driver of Parkinson's disease pathogenesis. NPJ Parkinsons Dis. 3, 3 (2017).
- Pfeiffer, R. F. Non-motor symptoms in Parkinson's disease. Parkinsonism Relat Disord. 22 (Suppl 1), (2016).
- Klann, E. M., et al. The Gut-brain axis and its relation to parkinson's disease: A review. Front Aging Neurosci. 13, 782082 (2021).
- Mukherjee, A., Biswas, A., Das, S. K. Gut dysfunction in Parkinson's disease. World J Gastroenterol. 22 (25), 5742-5752 (2016).
- Yemula, N., Dietrich, C., Dostal, V., Hornberger, M. Parkinson's disease and the gut: symptoms, nutrition, and microbiota. J Parkinsons Dis. 11 (4), 1491-1505 (2021).
- Chen, S. J., Lin, C. H. Gut microenvironmental changes as a potential trigger in Parkinson's disease through the gut-brain axis. J Biomed Sci. 29 (1), 54 (2022).
- Hawrysh, P. J., et al. PRKN/parkin-mediated mitophagy is induced by the probiotics Saccharomyces boulardii and Lactococcus lactis. Autophagy. 19 (7), 2094-2110 (2023).
- Liu, W., Lim, K. L., Tan, E. K. Intestine-derived α-synuclein initiates and aggravates pathogenesis of Parkinson's disease in Drosophila. Transl Neurodegener. 11 (1), 44 (2022).
- Rota, L., et al. Constipation, deficit in colon contractions and alpha-synuclein inclusions within the colon precede motor abnormalities and neurodegeneration in the central nervous system in a mouse model of alpha-synucleinopathy. Transl Neurodegener. 8, 5 (2019).
- Diwakarla, S., et al. ATH434 reverses colorectal dysfunction in the A53T mouse model of Parkinson's disease. J Parkinsons Dis. 11 (4), 1821-1832 (2021).
- Ordonez, D. G., Lee, M. K., Feany, M. B. α-synuclein Induces mitochondrial dysfunction through spectrin and the actin cytoskeleton. Neuron. 97 (1), 108.e6-124.e6 (2018).
- Olsen, A. L., Feany, M. B. Glial α-synuclein promotes neurodegeneration characterized by a distinct transcriptional program in vivo. Glia. 67 (10), 1933-1957 (2019).
- Cognigni, P., Bailey, A. P., Miguel-Aliaga, I. Enteric neurons and systemic signals couple nutritional and reproductive status with intestinal homeostasis. Cell Metab. 13 (1), 92-104 (2011).
- Urquhart-Cronish, M., Sokolowski, M. B. Gene-environment interplay in Drosophila melanogaster: chronic nutritional deprivation in larval life affects adult fecal output. J Insect Physiol. 69, 95-100 (2014).
- Popovic, R., et al. Blocking dPerk in the intestine suppresses neurodegeneration in a Drosophila model of Parkinson's disease. Cell Death Dis. 14 (3), 206 (2023).
- Poteet, E., et al. Neuroprotective actions of methylene blue and its derivatives. PLoS One. 7 (10), e48279 (2012).
- Miguel-Aliaga, I., Jasper, H., Lemaitre, B. Anatomy and physiology of the digestive tract of Drosophila melanogaster. Genetics. 210 (2), 357-396 (2018).
- Schlichting, M., et al. A neural network underlying circadian entrainment and photoperiodic adjustment of sleep and activity in Drosophila. J Neurosci. 36 (35), 9084-9096 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados