Equilibrio vapor-líquido
Visión general
Fuente: Michael G. Benton y Kerry M. Dooley, Departamento de ingeniería química, Universidad Estatal de Louisiana, Baton Rouge, LA
Equilibrio vapor-líquido es de suma importancia en aplicaciones tales como destilación, modelado ambiental y proceso general de diseño de ingeniería. Comprensión de las interacciones de los componentes en una mezcla es muy importante en el diseño, operación y análisis de tales separadores. El coeficiente de actividad es una excelente herramienta para relacionarse con las interacciones moleculares a la composición de la mezcla. Encontrar los parámetros de interacción molecular permite la futura predicción de los coeficientes de actividad para una mezcla utilizando un modelo.
Equilibrio vapor-líquido es un factor crítico en los procesos comunes en la industria química, como la destilación. La destilación es el proceso de separación de líquidos por su punto de ebullición. Una mezcla líquida es introducida en una unidad de destilación o columna, entonces hervida. Datos de equilibrio vapor-líquido están útiles para determinantes cómo líquidas las mezclas se separan. Porque los líquidos tienen puntos de ebullición diferentes, un líquido hierva en un vapor y subida en la columna, mientras que el otro se quede como un líquido y drenar a través de la unidad. El proceso es muy importante en una variedad de industrias.
En este experimento, se obtiene los coeficientes de actividad de mezclas de varias composiciones de metanol, isopropanol y agua desionizada utilizando un aparato de equilibrio vapor-líquido y cromatógrafo de gases. Además, los parámetros de interacción binaria del sistema se determinará mediante la ecuación de Wilson y los coeficientes de actividad.
Principios
Equilibrio vapor-líquido es un estado en que existe un componente puro o una mezcla de fases líquido y vapor, con equilibrio mecánico y térmico y no hay transferencia neta de masa entre las dos fases. Vapor y líquido se separan por gravedad y el calor (Figura 1). La mezcla líquida se introduce en el sistema, que se pone en un estado de vacío con una bomba de vacío. El vapor es condensado y vuelto a mezclar con el líquido, que luego se pasa a la cámara de ebullición. Diferencias en los resultados de punto de ebullición en cierta separación de la mezcla. El punto de ebullición del agua es mayor que el de los componentes añadidos, por lo que los componentes volátiles puedan evaporarse.

Figura 1: Una representación del aparato
Un coeficiente de actividad se define como el cociente de la fugacidad de un componente en una mezcla real a la fugacidad de una solución ideal de la misma composición. Fugacidad es una propiedad que se utiliza para mostrar las diferencias entre los potenciales químicos en Estados estándar. Vapor fase fugacities pueden expresarse en términos de un coeficiente de fugacidad [φ: fV = φ y f0V ], y con = fracción mol de i en la fase de vapor y f0V = el estándar de vapor fugacidad de estado (la fugacidad del vapor del componente puro a T y P). Para bajas presiones, como en este experimento, φ = 1 y f0V = P. líquido fugacities fase pueden expresarse en términos de una actividad coeficiente γ: fL = γi x f 0 L , x = fracción mol de i en la fase líquida y f0 L = la fugacidad del líquido estado estándar.
A la presión de saturación (Ps) de esta, la fugacidad de componente puro líquido sería Pis, porque el puro vapor y el líquido están en equilibrio. Fugacities líquidos son sólo débiles funciones de presión, podemos aproximamos la fugacidad del líquido de componente puro en T y P (fL 0) Ps, como la diferencia entre Ps y P no es grande. Esta aproximación se denomina generalmente "descuidar la corrección de Poynting". Si experimentadores utilizan un aparato VLE para medir las composiciones del vapor y líquido en equilibrio, los experimentadores pueden calcular directamente los coeficientes de actividad a medida también P y T. T debe ser medido para determinar PS para todos i.
El corazón del dispositivo VLE, utilizado en este experimento para determinar las composiciones de las mezclas, es una bomba Cottrell que "escupe" líquido hirviendo en un compartimiento bien aislados y de equilibrio. Dos válvulas de muestreo operado magnéticamente permiten retiro de muestras de líquidos y condensados del vapor. Un reservorio grande ayuda a amortiguar los pulsos de presión en el sistema como los interruptores de la válvula de control de encendido-apagado y de las fluctuaciones causadas por la bomba Cottrell. Una fuga lenta puede utilizarse para crear un equilibrio entre la tasa de retiro de aire y la tasa de entrada de aire para mantener una presión constante, si es necesario.
Manera comparable a resolver para el equilibrio vapor-líquido es utilizar una variedad de modelos. Ley Raoult, Ley de Dalton y ley de Henry son todos teóricos modelos que pueden encontrar los datos de concentración de equilibrio vapor-líquido. Los tres modelos están relacionados con la proporcionalidad de la presiones parciales, presión total y fracciones mol de las sustancias. Ecuación de Wilson ha demostrado para ser precisa para líquidos miscibles, mientras que no siendo demasiado complejo. Además, el modelo de Wilson incorpora coeficientes de actividad para tener en cuenta la desviación con respecto a valores ideales.
Procedimiento
1. el sistema de cebado
- Ventile el sistema de VLE usando la válvula de 3 vías de control de ventilación montada en el bastidor del aparato y (si es necesario) drenando líquido fuera del sistema en un frasco de residuos.
- Retirar los tubos de muestra y vuelva a colocar con tubos limpios (si es necesario). El líquido se drene completamente fuera del sistema.
- Para la primera serie de experimentos, rellenar a través de la válvula de entrada con una mezcla de aproximadamente (vol %) 50% metanol, isopropanol al 30% y 20% de agua. Para la segunda semana, vuelva a llenar con aproximadamente 25% metanol, isopropanol al 45% y 30% de agua. Para la tercera semana, rellene con cualquier líquido tendrá que repetir. La capacidad total de líquido es aproximadamente de 130 cm3.
- Llene con líquido justo por debajo del punto donde la bomba Cottrell se intersecta con la chaqueta del vacío. Demasiado poco líquido hará que el sistema se requieren muy altas tasas de ebullición para obtener suficiente líquido para "escupir" (cuando el líquido sale al hervir intensamente).
- Utilizar un vaso de precipitados y vierta el líquido en el puerto de adición en la parte superior de la cámara de equilibrio. Cerrar el puerto.
- Compruebe la presión barométrica con el manómetro de mercurio en la pared. Ajusta el "cero" en el calibrador de presión digital para igualar (si es necesario).
- Cambiar la válvula de tres vías de salida al "control" y poner en marcha la bomba de vacío y regulador de la presión.
- Abrir la válvula de gas en el regulador de presión de varias vueltas y observar la presión de la gota rápidamente. Vigilar la presión en el calibrador de presión digital.
- Establecer el control presión-punto de ajuste en el regulador de presión para obtener ~ 700 mm Hg. escuche clic de la válvula de control. Una vez alcanzado el punto de control, el ruido de la bomba de vacío, será auditivamente diferente.
- En este punto, con la válvula del acelerador abierto varias vueltas, cada vez que se abre la válvula de control, exceso de aire se vuelca a la bomba de vacío y la presión se sumerge por debajo de 700 mm antes de recuperarse poco a poco. Cerrar la válvula del acelerador completamente, luego abra acerca de 1/2 vuelta.
- Espere a que la válvula de control comenzar a hacer clic en nuevo, luego cierre la válvula de válvula reguladora en pequeños incrementos hasta que la presión fluctúa sólo ~0.5 mmHg o menos cuando la válvula está abierta. Realizar ajustes menores en el punto de control o la válvula de escape como sea necesario para mantener muy cerca de 700 mmHg.
- Una vez que la mezcla esté dentro de ± 10 mmHg de 700 mmHg, encienda el calentador, calefacción manto electricidad, agua de condensador y agitador magnético. Probar la potencia del calentador de 25-30% y el 1.5-2 vueltas manto poder para iniciar. El aparato requiere 20 minutos o menos un equilibrio de enfoque. Mantener regulación de la presión durante este tiempo.
2. ejecución del experimento
- Al hervir, la bomba Cottrell empezará a escupir el líquido y se aprecia líquido gotea hacia la cámara de ebullición. Vapor condensado se necesita más tiempo para aparecer. Cuando se alcanza el equilibrio, los experimentadores ver constantes gotas de vapor condensado (2 - 3 gotas/s.) y líquido (2 - 3 gotas/s.). La temperatura debe ser estable a ± 0,03 º c y la presión debe ser estable a 700.0 ± 0.5 mmHg. Cuando estas condiciones se han establecido para al menos 2 minutos (o menos), se alcanza el equilibrio.
- Abra las válvulas magnéticas (marcadas "1" y "2" en el controlador) 4 o 5 veces cada uno durante el tiempo suficiente para recoger sobre 0,5 cm3 de líquido en cada tubo de muestra y cerrar los tubos. Si una válvula no responde a su botón, trate de mover el interruptor de alimentación para el controlador luego en. Esta primera muestra se utiliza para lavar los tubos y el sistema de entrega y se descartarán. Lavado sustituye cualquier producto químico restante en los lados de los tubos con el mismo químico que está siendo muestreado, por lo que no afectará a la composición de la prueba.
- Momentáneamente Desconecte la alimentación al calentador, esperar 30 s para la cocción desaparecen, y luego ventile el sistema con la válvula de 3 vías de control de ventilación. Retirar los tubos de muestra, agitar varias veces y luego volcar en el recipiente de residuos.
- Vuelva a colocar los tubos de muestras en el sistema, gire la válvula de ventilación atrás para "controlar", gire el poder volver a la estufa y esperar a equilibrio ser restablecido. Esto sólo tomará unos pocos minutos si el aparato no enfría. Cuando el equilibrio se restablece, se puede observar una ligera diferencia en la temperatura. Esto puede ser debido a una perturbación leve de la composición total por muestreo.
- Una vez restablecido el equilibrio, tomar dos nuevas muestras. Tienen dos frascos etiquetados con nuevos tabiques listos.
- ~0.5 cm3 muestras en cada tubo, apague el calentador, ventilaci6n el sistema, retirar los tubos de muestra y verter en los frascos. Tape los frascos y reemplace los tubos de muestras con tubos limpios si es necesario.
- Al análisis de las muestras, preparar una nueva muestra. Escurrir el ~ 15 cm3 de líquido en un vaso de precipitados o matraz. Añadir ~ 20 cm3 de metanol puro o metanol/isopropanol al 50/50 a través del puerto de la muestra. Esto le dará una nueva composición general.
- Asegúrese de que los tubos de muestras están totalmente vacíos, luego cerrar el sistema, la válvula de respiradero del interruptor "control" y vuelva a encender el calentador. Si se trabaja rápidamente, equilibrio nuevo establecerá rápidamente. Tenga en cuenta que debe existir una diferencia de temperatura de la muestra anterior.
- Repita el equilibrado y procedimiento de muestreo antes, recordar tomar una muestra para lavar y luego tomar la muestra final. Continúan los experimentos mediante la adición de componentes. Doce puntos son suficientes para determinar los coeficientes de actividad y (aproximadamente) los coeficientes de interacción binarios.
3. Apagar el sistema
- Apague los calentadores. Cuando el aparato comienza a enfriar, apague el agitador y condensador de agua.
- Devolver el sistema a la presión atmosférica; Ajuste el regulador > 1020 mbar, cierre la válvula del acelerador, coloque la válvula de tres vías para ventilar y abrir la válvula en el tanque.
- Una vez alcanzada la presión atmosférica, apague la bomba. Drenar el líquido del depósito hasta alcanzar el nivel de la válvula, pero dejar el resto del líquido en el depósito. Cierre la válvula de 3 vías.
4. Análisis
- Regresión no lineal y una cantidad estándar de función objetivo residuos cuadrados, utilizar los coeficientes de actividad calculados a partir de los datos en bruto a retroceder las 6 constantes para la ecuación de Wilson ternaria (abajo), para este sistema. Evaluar la calidad del ajuste por métodos gráficos y computación las desviaciones relativas porcentajes promedio (APRD), que media caben errores x 100.

- Convergen en los verdaderos valores óptimos de varias diversas direcciones en el espacio del parámetro de respuesta mediante el uso de un método factorial para la conjetura inicial. Calcular la precisión de las mediciones de GC suficientemente replicando una muestra del GC para determinar precisiones relativas según la estadística t y uso las precisiones para determinar si debe aceptar / rechazar una determinada medición de GC por apropiado prueba de hipótesis.
- Comparar la Precision relativa de la medición de GC a las APRDs y discutir. También reporte el Precision absoluta de los manómetros de presión y temperatura - determinar estos una vez al día.
Resultados
Los coeficientes de actividad de los datos no muestran desviaciones significativas de un valor medio para cada componente (cuadro 1). Esto es como se esperaba ya para el componente intermedio composiciones que no son grandes variaciones. Sin embargo, los componentes cerca de la 1 tienen 1 cerca de γ. Componentes de baja composición tienen alta γ. Componentes más altos de concentración en una mezcla que tendrá una menor desviación, por lo tanto será más cercana a ideal (γ = 1). Componentes con menores concentraciones en una mezcla tendrá mayores desviaciones, por lo que su γ será mayor que 1.
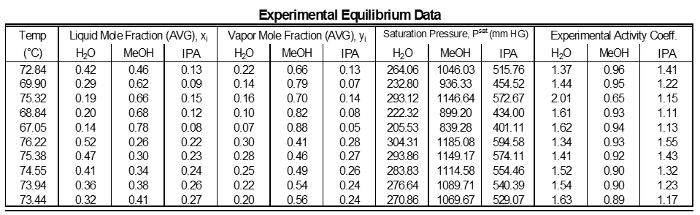
Tabla 1: Resultados de cada muestreo de los datos experimentales.
Los datos se ajustaron a los parámetros del modelo de Wilson y se calcularon los coeficientes (tabla 2). Una simple reducción en la suma de cuadrados residuales entre experimental y coeficientes de actividad de la ecuación (1) Wilson. Esto fue alcanzado usando la función solver de Excel. La trama de la paridad que se muestra relaciona con coeficientes de actividad de Wilson ecuación modelo los coeficientes de actividad experimental encontrado. Los coeficientes de la actividad experimental se calculó y gráficamente comparados con los coeficientes del modelo calculado.

Tabla 2: Resultados del ajuste de los datos a los parámetros del modelo de Wilson.
 (1)
(1)
Los valores encontrados fueron el mejor ajuste (tabla 3). Idealmente la correlación es a lo largo de la y = x línea; sin embargo, se encontró una correlación significativa que se asemeja a la situación ideal (figura 2). Los coeficientes de actividad de los datos no mostraron desviaciones significativas de un valor medio para cada componente, como era de esperar. Una reducción en la suma de cuadrados residuales entre experimental y coeficientes de actividad de ecuación de Wilson fue utilizado con la función solver de Excel. La trama de la paridad relaciona con coeficientes de actividad de Wilson ecuación modelo los coeficientes de actividad experimental encontrado.
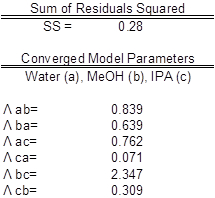
Tabla 3: parámetros y agua (a), MeOH (b), IPA (c) del modelo. Los valores experimentales se comparan con valores.

Figura 2 : Representación de la correlación entre los coeficientes de actividad experimental y los coeficientes de actividad de modelo.
Aplicación y resumen
Este experimento demostró el equilibrio de mezclas de metanol - isopropanol - agua vapor-líquido en una constante P = 700 mm Hg y cómo medir la temperatura y composición y calcular coeficientes de actividad. Los coeficientes de actividad de los datos significativamente se desvía de un valor medio para cada componente, como era de esperar. Una reducción en la suma de cuadrados residuales entre experimental y coeficientes de actividad de ecuación de Wilson fue utilizado con la función solver de Excel. La trama de la paridad relaciona con coeficientes de actividad de Wilson ecuación modelo los coeficientes de actividad experimental encontrado.
En la industria del petróleo, la destilación es el proceso primario para la separación de productos derivados del petróleo. Muchas refinerías de petróleo usan destilación de petróleo crudo1. Hidrocarburos ligeros se separan de las partículas más pesadas, separar en base a puntos de ebullición1. Materiales pesados como aceites se acumulan en las placas inferiores, mientras que materiales ligeros como el propano y el butano se levantan1gas. Hidrocarburos, como gasolina, jet, combustible diesel, están separados1. Este proceso se repite a menudo muchas veces completamente separado y refinar los productos1. Refinerías de ejecutan estos procesos en estado estacionario, creando constantemente nuevos productos al máximo de su capacidad, por lo que la eficiencia es clave1. Ingenieros químicos trabajan en estos procesos se centran en la optimización de la eficiencia de la producción1.
Columnas de destilación de la bandeja también se utilizan para separar una gran variedad de productos químicos. El etanol es un tal producto. A través de procesos estrechamente relacionados, una variedad de productos tales como licores, cerveza y etanol grado combustible pueden ser destilada2. Cantidades específicas de alcohol pueden ser separados del agua para crear una prueba específica2. Este proceso se limita a reducir el porcentaje de agua en el producto, pero no puede eliminar completamente2. Para eliminar el agua completamente, destilación azeotrópica se requiere, que utiliza productos químicos extractor para separar agua etanol2.
Referencias
- About the Refinery." Processing & Refining Crude Oil. Chevron.com, n.d. Web. 17 Nov. 2016.
- Madson, PW. Ethanol Distillation: The Fundamentals. Cincinnati: Katzen International, n.d. Print. Accessed from Web. 01 Oct. 2016.
Tags
Saltar a...
Vídeos de esta colección:

Now Playing
Equilibrio vapor-líquido
Chemical Engineering
88.1K Vistas

Prueba de la eficiencia de transferencia de calor de un intercambiador de calor de tubos con aletas
Chemical Engineering
17.8K Vistas

Uso de una bandeja de secado para investigar la transferencia de calor convectiva y conductiva
Chemical Engineering
43.8K Vistas

Viscosidad de las soluciones de propilenglicol
Chemical Engineering
32.4K Vistas

Porosimetría de un polvo de alúmina de sílice
Chemical Engineering
9.6K Vistas

Demostración del modelo de ley de energía a través de extrusión
Chemical Engineering
10.0K Vistas

Amortiguador de gas
Chemical Engineering
36.4K Vistas

El efecto de la relación de reflujo en la eficiencia de destilación de bandeja
Chemical Engineering
77.4K Vistas

Eficiencia de la extracción líquido-líquido
Chemical Engineering
48.3K Vistas

Reactor de fase líquida: Inversión de sacarosa
Chemical Engineering
9.6K Vistas

Cristalización del ácido salicílico mediante modificación química
Chemical Engineering
24.2K Vistas

Flujo monofásico y bifásico en un reactor de lecho compacto
Chemical Engineering
18.8K Vistas

Cinética de la polimerización por adición de polidimetilsiloxano
Chemical Engineering
16.0K Vistas

Reactor catalítico: Hidrogenación de etileno
Chemical Engineering
30.2K Vistas

Spin y Chill
Chemical Engineering
7.3K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados