A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الخطية من الفحص البروتين برادفورد
In This Article
Summary
هو خطر على دقة وحساسية من بروتين تقرير الفحص برادفورد سريعة ومريحة من خلال استقامة الذاتية. نظهر الخطية إجراء بسيط هو أن يزيد كثيرا من الدقة ، ويحسن من حساسية مقايسة حول أضعاف - 10 ، ويخفف كثيرا تدخل المنظفات.
Abstract
ويتم إنجاز تقرير كميات من البروتين ميكروغرام في مقايسة Coomassie برادفورد الزرقاء الرائعة التي كتبها قياس الامتصاصية في 590 نانومتر. هذا الاختبار الأكثر شيوعا وبسيطة تمكن السريع الكمي البروتين في الخلية lysates ، الكسور الخلوية ، أو عينات البروتين المؤتلف ، لغرض التطبيع القياسات البيوكيميائية. ومع ذلك ، واستقامة تنازلات جوهرية لحساسية ودقة هذه الطريقة. وتبين أنه في ظل ظروف الفحص القياسية ، فإن نسبة من قياسات الامتصاصية في 590 نانومتر و 450 نانومتر خطي صارم مع تركيز البروتين. هذا الإجراء البسيط يزيد من دقة ويحسن من حساسية مقايسة حول الكمي ، 10 أضعاف السماح باستمرار إلى 50 نانوغرام من ألبومين المصل البقري. علاوة على ذلك ، تقلص إلى حد كبير التدخل قدم عادة بواسطة المنظفات المستخدمة لإنشاء خلية lysates البروتوكول الجديد. معادلة خطية وضعت على أساس العمل الجماعي وقانون بير يناسب تماما على البيانات التجريبية.
Protocol
الخطية للمعايرة برادفورد رسم بياني البروتين :
ويستخدم على نطاق واسع الرائعة Coomassie مقايسة البروتين الأزرق ، والمعروفة عموما باسم مقايسة برادفورد 1 ، بسبب البروتوكول الملحق بها سريعة ومريحة وكذلك حساسيته النسبية. للأسف ، هناك درجة كبيرة من انحناء أكثر من مجموعة واسعة من تركيزات البروتين (الشكل 1). لذلك ، يستخدم فقط مجموعة ضيقة من تركيزات عالية نسبيا من البروتين ، 2-10 ملغ / مل جيش صرب البوسنة ، لمعايرة الرسم البياني ، والتي تناسبها ثم أفضل الانحدار الخطي (الشكل 1 ، والأخضر). ومع ذلك ، فإن استقامة يتطلب تركيز البروتين من العينات غير معروف على أنها تقع ضمن نطاق محدود من الرسم البياني المعايرة من أجل تجنب خطأ كبير ، وأنه أيضا يقلل من الدقة في نطاق محدود. واستقامة يمثل مشكلة خطيرة ولا سيما عندما المبالغ ميكروجرام من البروتين ليست متاحة ، وغالبا ما يتطلب الأمر التخفيفات متعددة من العينات غير معروف.
كما لوحظ في ورقة برادفورد الأصلي ، "مصدر استقامة هو في حد ذاته منذ كاشف هناك تداخل في طيف من الألوان المختلفة الشكلين للصباغة." 1. في الواقع ، ثلاثة أشكال من الصبغة الزرقاء الرائعة Coomassie في التوازن الحمضي القاعدي في درجة الحموضة الحمضية المعتاد للمقايسة 2. الأشكال الأحمر والأزرق والأخضر وماكسيما الامتصاصية في 470 ، 590 ، 650 نانومتر ، وعلى التوالي (الشكل 2). الأزرق هو الشكل الذي يربط البروتين ، وتشكيل المعقدة التي تمتص الضوء بشكل مكثف في 594 نانومتر 3 و 4 (الشكل 2). برادفورد أشار أيضا إلى أن "قيمة أساسية للكاشف يتناقص باستمرار كما لا بد من صبغ لبروتين" (1) (الشكل 3). لذا ، حاولنا لحساب الحد من الخلفية 590 نانومتر كما يتم إضافة كميات متزايدة من البروتين ، عن طريق قياس التغير في الامتصاصية عند 450 نانومتر ، حيث معقدة البروتين صبغة لا تمتص. وجدنا أن خلفية الانخفاض جزئيا ، ولكن ليس بشكل كامل ، وحسابات للاستقامة (الشكل 4).
ثم افترضنا ان هذا الانخفاض في تركيز الصبغة حرة أخرى تنتج تشويه للاستجابة خطية ، لأنه كما البروتين صبغة ملزمة في التوازن 5 ، تشكيل معقدة لا يتوقف فقط على تركيز البروتين الحرة ، ولكن أيضا على أن للصباغة مجانا (الشكل 5). مع الأخذ في الاعتبار كلا من المسائل المتصلة تركيز متغير من الصبغة مجانا ، وضعنا المعادلة الرياضية التي توضح وجود علاقة خطية بين تركيز البروتين ونسبة قياسات الامتصاصية ، 590 نانومتر أكثر من 450 نانومتر (الشكل 6). ويمكن العثور على وصف مفصل للدراسة النظرية والتجريبية في المنشور لدينا 1996 في الكيمياء الحيوية التحليلية 6. تم اختبار تجريبي للمعادلة رياضية ، ووجدت أن تسفر منحنى معايرة خطي على المدى تركيزات بروتين كامل (الشكل 7). وعلاوة على ذلك ، تم التحقق من صحة هذه المعادلة أيضا قرار مستقل من قيمة الرقم الهيدروجيني التي تعتمد على الصحيح من التقاطع العمودي 6.
بروتوكول مفصلة لتحسين الفحص البروتين برادفورد ، وذلك باستخدام قارئ امتصاص Microplate :
- إعداد محلول المخزون 0.1 ملغ / مل من الألبومين القياسية ، المصل البقري. ويمكن اختيار أي معيار آخر ، ولكن الملاحظة التي يجب أن تستخدم نفس المعايير في جميع التجارب.
- تخفيف عينات غير معروفة في المياه منزوع الأيونات. تهدف إلى 5-50 ميكروغرام / مل. حتى الآن ، وتركيزات البروتين أعلى أو أقل من مقبولة ، حيث لا يوجد حد واضح لمجموعة خطية من الفحص. ومع ذلك ، يجب أن يكون القياس ضمن نطاق خطية من القارئ الامتصاصية.
- تمييع كاشف برادفورد (بيو راد) 2.5 أضعاف في الماء منزوع الأيونات.
- إضافة 0 و 10-50 ميكرولتر من محلول المخزون BSA إلى الآبار ثلاث نسخ (0-5 خلق منحنى المعايرة BSA ميكروغرام). تكمل مع الماء منزوع الأيونات لتصل إلى 100 ميكرولتر / أيضا.
- في آبار مختلفة ، إضافة ميكرولتر من 100 عينة غير معروفة في triplicates. ويمكن استخدام تركيزات مختلفة من عينة غير معروفة لزيادة الدقة.
- إضافة 100 ميكرولتر من كاشف برادفورد المخففة لجميع الآبار. الحجم الكلي هو 200 ميكرولتر / أيضا.
- الانتظار ما لا يقل عن 5 دقائق ، ولكن ليس أكثر من 60 دقيقة من أجل التنمية اللون.
- يجب أن تكون فارغة 200 ميكرولتر من الماء منزوع الأيونات (وليس البروتين الصبغة صفر أيضا).
- قياس الامتصاصية في 590 نانومتر ، وعند 450 نانومتر.
- إعداد رسم بياني المعايرة عن طريق قسمة صافي القيم الامتصاصية في 590 نانومتر ، وعند 450 نانومتر. علما أن البروتين صفر (صباغة فقط) ينبغي أن تدرج قيمة كنقطة البيانات (الشكل 8).
- حساب تركيز عينة مجهولة على أساس معادلة خطية من منحنى المعايرة (الشكل 9).
ممثل النتائج :
خلافا للالامتصاصية في طول موجة واحدة من 590 نانومتر ، ونسبة من القيم الامتصاصية ، 590 نانومتر أكثر من 450 نانومتر ، والخطية ثإيث تركيز بروتين (شكل 10).
قد يكون تركيز البروتين من العينة مجهولة تحسب ببساطة باستخدام معادلة خطية من منحنى المعايرة (الشكل رقم 10 ، المعادلة).
ومع ذلك ، يتم الحصول على زيادة الدقة عن طريق قياس عدة التخفيفات عينة مجهولة. تحقيقا لهذه الغاية ، وإعداد الرسوم البيانية two. الاول هو رسم بياني لمعايرة مستوى البروتين مع ميكروغرام على المحور X (الشكل رقم 11 ، الحق). الرسم البياني الثاني هو لنموذج غير معروف ، مع ميكرولتر من العينة الأصلي مخفف على المحور X (الشكل رقم 11 ، اليسار). وينبغي أن تدرج قيمة الصبغة فقط في كل من الرسوم البيانية (الشكل رقم 11). مشتق تركيز البروتين من العينة مجهولة بقسمة المنحدرات من عينة مجهولة ومعيار (الشكل رقم 11 ، المعادلة).
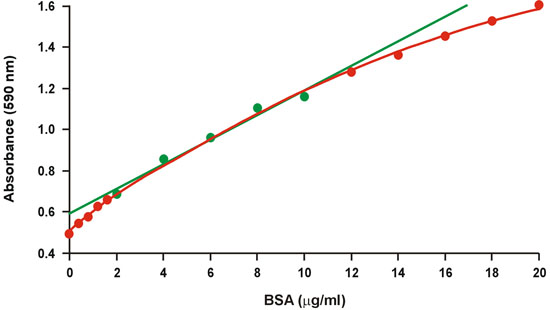
الشكل 1. التقليدية الرسم البياني المعايرة برادفورد. يتم تمثيل مجموعة الرموز الخطية الخضراء.

الشكل 2. الأطياف للمجمع البروتين وصبغ للصباغة وحدها.

الشكل 3. البروتين صبغة التوازن.
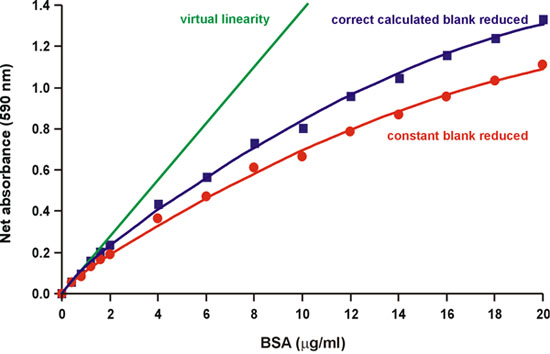
الشكل 4. لحد من الخلفية تصحيح احتساب الانخفاضات جزئيا استقامة.
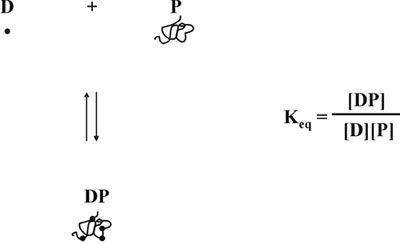
الشكل 5. البروتين صبغة التوازن.

الشكل 6. الأساس الرياضي لالخطية للفحص البروتين برادفورد.
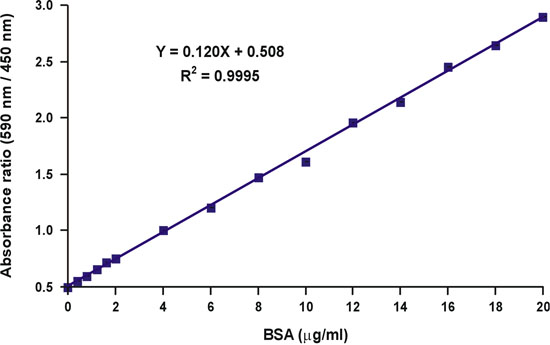
الشكل 7. الخطية من الرسم البياني المعايرة برادفورد.

الشكل 8. حساب القيم نسبة الامتصاصية.

الرقم 9. برادفورد والمعايرة الخطي الرسم البياني.
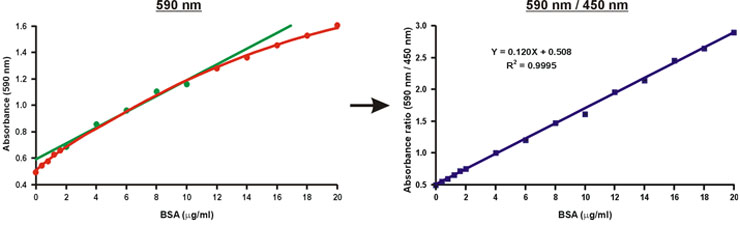
الرقم 10. الخطية من الرسم البياني المعايرة برادفورد.
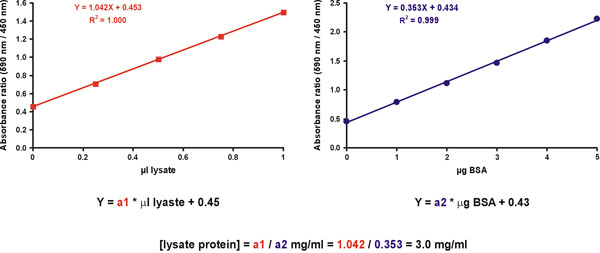
الرقم 11. مجهول العينة تركيز الحساب.
Discussion
وفحص البروتين برادفورد تحظى بشعبية نظرا لسهولة الأداء والحساسية النسبية. عرضت الخطية على تركيزات بروتين كامل مجموعة التي حصلت عليها بروتوكول هنا يبسط كذلك مقايسة ، والعينات غير معروفة لا تحتاج إلى تدخل ضمن نطاق الرسم البياني المعايرة.
Acknowledgements
وتكرس هذه الورقة لذكرى الراحل Selinger الدكتور تسفي ، الذي استضاف البحوث الأصلية وصفها هنا.
Materials
| Name | Company | Catalog Number | Comments |
| Bradford reagent | Bio-Rad | 500-0006 | |
| Bovine Serum Albumin | Amersco | 0332 | |
| Multiplate absorbance reader | BioTek | Synergy2 |
References
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Chial, H. J., Thompson, H. B., Splittgerber, A. G. A spectral study of the charge forms of Coomassie blue G. Anal Biochem. 209, 258-266 (1993).
- Chial, H. J., Splittgerber, A. G. A comparison of the binding of Coomassie brilliant blue to proteins at low and neutral pH. Anal Biochem. 213, 362-369 (1993).
- Compton, S. J., Jones, C. G. Mechanism of dye response and interference in the Bradford protein assay. Anal Biochem. 151, 369-374 (1985).
- Congdon, R. W., Muth, G. W., Splittgerber, A. G. The binding interaction of Coomassie blue with proteins. Anal Biochem. 213, 407-413 (1993).
- Zor, T., Selinger, Z. Linearization of the Bradford protein assay increases its sensitivity: theoretical and experimental studies. Anal Biochem. 236, 302-308 (1996).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved