A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
לינאריזציה של assay חלבון ברדפורד
In This Article
Summary
הדיוק והרגישות של נחישות חלבון ידי assay ברדפורד מהירה ונוחה נפגעת על ידי הליניאריות מהותי. אנחנו מראים הליך לינאריזציה פשוט מגדיל מאוד את הדיוק, משפרת את הרגישות של assay על פי 10, וכן מפחית באופן משמעותי את ההפרעה באמצעות דטרגנטים.
Abstract
קביעת כמויות מיקרוגרם של חלבון ב assay Coomassie ברדפורד כחול מבריק נעשה על ידי מדידת ספיגת ב 590 ננומטר. זה assay הנפוצה ביותר מאפשרת כימות חלבון מהיר פשוט lysates תא, שברים הסלולר, או דגימות חלבון רקומביננטי, לצורך נורמליזציה מדידות ביוכימיות. עם זאת, הליניאריות מהותי פשרות את הרגישות ואת הדיוק של שיטה זו. זה הראו כי בתנאים assay סטנדרטי, יחס של מדידות ספיגת ב 590 ננומטר ו -450 ננומטר הוא ליניארי לחלוטין עם ריכוז חלבון. הליך זה פשוט מגדיל את הדיוק משפר את הרגישות של assay על כימות, של פי 10 המתיר עד 50 ננוגרם של אלבומין בסרום שור. יתר על כן, התערבות הציג כלל על ידי דטרגנטים, כי הם השתמשו כדי ליצור את התא lysates מופחת במידה ניכרת על ידי פרוטוקול חדש. משוואה ליניארית שפותחה על בסיס של פעולה המונית החוק של באר לגמרי תואם את נתוני הניסוי.
Protocol
לינאריזציה של גרף כיול חלבון ברדפורד:
Assay החלבון מבריק Coomassie כחול, הידוע בכינויו assay ברדפורד 1, נעשה שימוש נרחב בגלל פרוטוקול מהיר ונוח שלה, כמו גם רגישות היחסי. למרבה הצער, יש מידה רבה של עקמומיות פני טווח רחב של ריכוזי חלבון (איור 1). לכן, רק טווח צר של ריכוז חלבון גבוהה יחסית, 2-10 מ"ג / מ"ל BSA, משמש גרף הכיול, אשר לאחר מכן יותר מתאים רגרסיה ליניארית (איור 1, ירוק). עם זאת, הליניאריות דורש ריכוז חלבון של דגימות ידוע ליפול בטווח מוגבל של הגרף כיול על מנת למנוע טעות גדולה, זה גם מפחית את דיוק בטווח מוגבל. הליניאריות מציגה בעיה חמורה במיוחד כאשר כמויות מיקרוגרם של חלבון אינם זמינים, והוא כרוך לעתים קרובות דילולים מרובים של דגימות ידוע.
כפי שצוין במאמר המקורי ברדפורד, "מקור הליניאריות הוא מגיב עצמה מאז קיימת חפיפה בספקטרום של שתי צורות שונות של צבע לצבוע." 1. למעשה, שלוש צורות של צבע כחול מבריק Coomassie נמצאים בשיווי משקל חומצה בסיס ב-pH חומצי הרגיל של assay 2. הצורות אדום, כחול וירוק יש ספיגת מקסימום ב 470, 590, ו 650 ננומטר, בהתאמה (איור 2). כחול הוא טופס שקושר את החלבון, ויצרו מורכבות מאוד סופג אור ב 594 ננומטר 3, 4 (איור 2). ברדפורד גם ציין כי "הערך רקע מגיב ומצטמצם כמו לצבוע יותר הוא קשור לחלבון" 1 (איור 3). לכן, ניסינו לחשב את הפחתת רקע 590 ננומטר כמו הגדלת כמויות חלבון מתווספים, על ידי מדידת השינוי של ספיגת ב 450 ננומטר, שבו מורכבים חלבונים לצבוע לא לספוג. מצאנו כי על רקע ירידה חלקית, אך לא באופן מלא, מהווה הליניאריות (איור 4).
החוקרים שיערו אז כי הירידה בריכוז לצבוע חינם מייצר עוד עיוות של התגובה ליניארי, כי כמו חלבון לצבוע מחייב הוא בשיווי משקל 5, היווצרות מורכבות תלויה לא רק ריכוז של חלבון החופשי, אלא גם על זו של צבען החופשי (איור 5). אם ניקח בחשבון גם בנושאים הקשורים הריכוז המשתנה של צבע החופשי, פיתחנו משוואה מתמטית המתארת מערכת יחסים ליניארי בין ריכוז החלבון לבין היחס בין מדידות ספיגת, 590 ננומטר מעל 450 ננומטר (איור 6). תיאור מפורט של המחקר התיאורטי הניסוי ניתן למצוא בפרסום שלנו בשנת 1996 אנליטית ביוכימיה 6. משוואה מתמטית היה לבדוק באופן ניסויי ונמצא תשואה עקומת כיול ליניארית לאורך טווח ריכוזי חלבון שלם (איור 7). יתר על כן, המשוואה היה תוקף גם על ידי קביעה עצמאית של ערך ה-pH תלויי הנכון של ליירט את ציר Y 6.
פרוטוקול מפורטות Assay ברדפורד משופר חלבון, באמצעות Reader ספיגת microplate:
- הכן 0.1 מ"ג / מ"ל פתרון המניות של תקן, אלבומין בסרום שור. בכל קנה מידה אחרים עשויים להיבחר, אך מציינים כי תקן אותו חייב לשמש בניסויים בכלל.
- לדלל את דגימות ידוע במים deionized. השתדל 50-50 מיקרוגרם / מ"ל. עם זאת, ריכוזי חלבון גבוה או נמוך יותר מקובלים, שכן אין גבול ברור לטווח ליניארי של assay. עם זאת, המדידה חייב להיות בטווח הליניארי של הקורא ספיגת.
- לדלל את ריאגנט ברדפורד (Bio-Rad) פי 2.5 במים deionized.
- הוספת 0 ו 10-50 μl של פתרון מניות BSA לבארות בשלושה עותקים (יצירת 0-5 מיקרוגרם BSA עקומת כיול). משלימים עם מים deionized להגיע 100 μl / היטב.
- בבארות שונים, להוסיף 100 μl של מדגם לא ידוע triplicates. ריכוזים אחדים של המדגם לא ידוע ניתן להשתמש כדי להגדיל את הדיוק.
- הוסף 100 μl של מגיב ברדפורד מדולל לכל הבארות. נפח סך 200 μl / היטב.
- המתן לפחות 5 דקות, אך לא יותר מ 60 דקות לפיתוח הצבע.
- ריק חייב להיות 200 μl מים deionized (ולא לצבוע חלבון אפס היטב).
- מדוד את ספיגת ב 590 ננומטר ב 450 ננומטר.
- להכין גרף כיול על ידי חלוקת ערכי ספיגת נטו 590 ננומטר ב 450 ננומטר. שים לב כי החלבון אפס (צבע בלבד) ערך יש לכלול נקודת נתונים (איור 8).
- חשב את הריכוז של המדגם לא ידוע על בסיס המשוואה ליניארית של עקומת הכיול (איור 9).
נציג תוצאות:
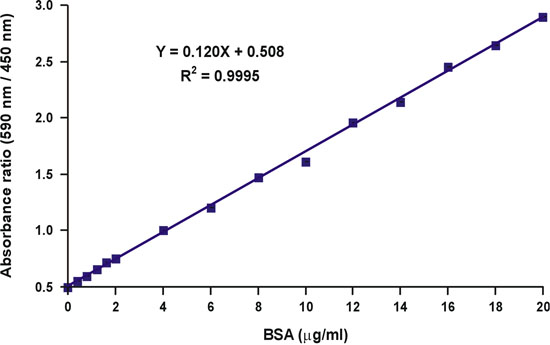
בניגוד ספיגת באורך גל אחד של 590 ננומטר, היחס של ספיגת ערכים, 590 ננומטר מעל 450 ננומטר, הוא ליניארי wריכוז החלבון ith (איור 10).
ריכוז החלבון של המדגם לא ידוע ניתן לחשב בפשטות באמצעות משוואה ליניארית של עקומת הכיול (איור 10, המשוואה).
עם זאת, הדיוק גדל מתקבל על ידי מדידת מספר דילולים מדגם לא ידוע. לשם כך, להכין שני גרפים. הראשון הוא גרף כיול עבור תקן עם חלבון מיקרוגרם על ציר X (איור 11, ימין). הגרף השני הוא למדגם הלא ידוע, עם μl של המדגם המקורי חי על ציר X (איור 11, משמאל). ערך רק צבע יש לכלול גם גרפים (איור 11). ריכוז החלבון של המדגם לא ידוע נגזר על ידי חלוקת המדרונות של המדגם לא ידוע ורמת (איור 11, המשוואה).
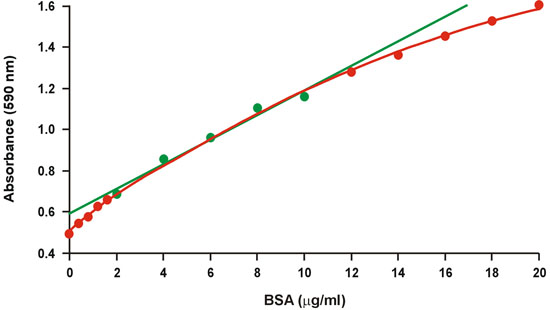
באיור 1. קונבנציונלי ברדפורד גרף כיול. טווח ליניארי מיוצג על ידי סמלים ירוקים.

איור 2. ספקטרה מורכבים של חלבונים ושל צבע לצבוע לבד.

איור 3. חלבון לצבוע שיווי משקל.
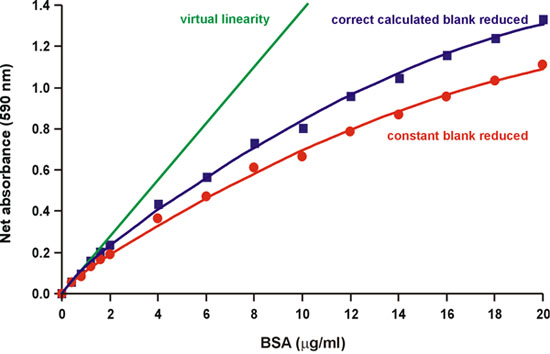
איור 4. הפחתת ברקע מחושב נכון חלקית פוחתת הליניאריות.
איור 5. חלבון לצבוע שיווי משקל.

איור 6. בסיס מתמטי לינאריזציה של assay חלבון ברדפורד.
איור 7. לינאריזציה של הגרף כיול ברדפורד.

איור 8. חישוב ערכי יחס ספיגת.

איור 9. ברדפורד גרף כיול ליניארית.
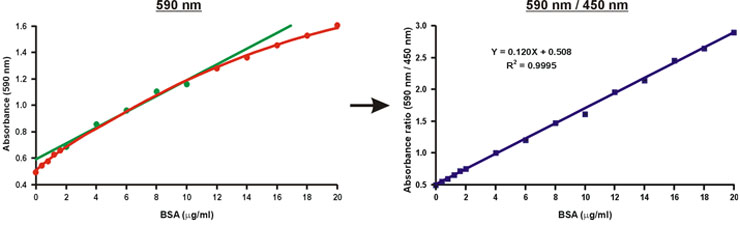
איור 10. לינאריזציה של הגרף כיול ברדפורד.
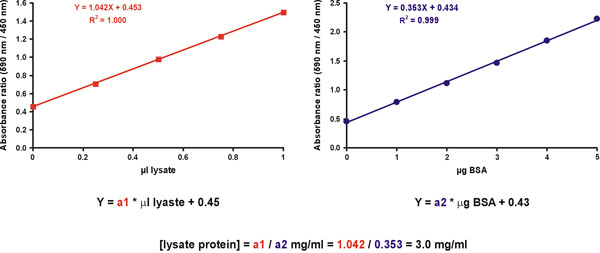
איור 11. חישוב ידוע מדגם ריכוז.
Discussion
Assay חלבון ברדפורד הוא פופולרי בשל קלות הביצוע רגישות יחסית. לינאריזציה על ריכוזי חלבון שלם טווח מתקבל על ידי פרוטוקול המובא כאן עוד מפשט את assay, כמו דגימות ידוע לא צריך ליפול בטווח של גרף הכיול.
חשוב לציין, את פרוטוקול שיפור נוסף מס...
Acknowledgements
מאמר זה מוקדש לזכרו של המנוח ד"ר צבי זלינגר, אשר אירח את המחקר המקורי המתואר כאן.
Materials
| Name | Company | Catalog Number | Comments |
| Bradford reagent | Bio-Rad | 500-0006 | |
| Bovine Serum Albumin | Amersco | 0332 | |
| Multiplate absorbance reader | BioTek | Synergy2 |
References
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Chial, H. J., Thompson, H. B., Splittgerber, A. G. A spectral study of the charge forms of Coomassie blue G. Anal Biochem. 209, 258-266 (1993).
- Chial, H. J., Splittgerber, A. G. A comparison of the binding of Coomassie brilliant blue to proteins at low and neutral pH. Anal Biochem. 213, 362-369 (1993).
- Compton, S. J., Jones, C. G. Mechanism of dye response and interference in the Bradford protein assay. Anal Biochem. 151, 369-374 (1985).
- Congdon, R. W., Muth, G. W., Splittgerber, A. G. The binding interaction of Coomassie blue with proteins. Anal Biochem. 213, 407-413 (1993).
- Zor, T., Selinger, Z. Linearization of the Bradford protein assay increases its sensitivity: theoretical and experimental studies. Anal Biochem. 236, 302-308 (1996).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved