Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bradford Protein Testi lineerleştirilmesi
Özet
Hızlı ve rahat Bradford yöntemi ile protein tayini doğruluk ve hassasiyet içsel doğrusal tehlikeye düşer. Biz büyük ölçüde hassasiyeti artırır yaklaşık 10 kat testin duyarlılığını artırır ve anlamlı deterjanların müdahaleleri azaltıyor, basit bir doğrusallaştırma prosedürü göstermektedir.
Özet
Bradford Coomassie parlak mavi tayininde protein mikrogram miktarların belirlenmesi, 590 nm'de absorbans ölçümü ile gerçekleştirilir. Bu en yaygın test biyokimyasal ölçümleri normalleştirme amacıyla, hızlı ve basit bir protein, hücre lizatları, hücresel kesirler, ya da rekombinant protein örneklerinin kantifikasyon sağlar. Ancak, içsel bir doğrusal bu yöntemin duyarlılığı ve hassasiyeti uzlaşır. Bu, standart test koşulları altında 590 nm'de absorbans ölçümleri ve 450 nm dalga oranı, protein konsantrasyonu ile kesinlikle doğrusal olduğunu göstermiştir. Bu basit bir prosedür doğruluğunu artırır ve 50 ng bovine serum albumin, 10 kat izin kantifikasyon hakkında testinin duyarlılığını artırır. Ayrıca, sık hücre lizatları oluşturmak için kullanılan deterjanların piyasaya girişim yeni bir protokol tarafından büyük ölçüde azalır. Kitlesel eylem ve Beer yasası temelinde geliştirilen bir lineer denklem deneysel veriler mükemmel uyuyor.
Protokol
Bradford Protein Kalibrasyon Grafik Doğrusallaştırma:
1 Bradford testinin yaygın olarak bilinen Coomassie parlak mavi protein tahlil, yaygın, hızlı ve kullanışlı bir protokol yanı sıra bağıl duyarlılık nedeniyle kullanılır . Ne yazık ki, büyük ölçüde protein konsantrasyonları (Şekil 1) üzerinde geniş bir eğrilik var. Bu nedenle, nispeten yüksek protein konsantrasyonları, 2-10 mg / ml BSA, sadece dar bir aralıkta daha iyi (Şekil 1, yeşil) lineer regresyon uygun kalibrasyon grafiği için kullanılır. Ancak, doğrusal olmayan büyük bir hata önlemek için kalibrasyon grafiği sınırlı giren bilinmeyen örneklerin protein konsantrasyonu gerektirir ve aynı zamanda sınırlı aralığında hassasiyeti azaltır. Doğrusal mikrogram miktarda protein mevcut değildir, özellikle ciddi bir sorun sunar ve genellikle bilinmeyen örneklerin birden fazla dilüsyonları gerektirir.
Orijinal Bradford yazıda belirtildiği gibi, "doğrusal kaynak, boya iki farklı renk formları spektrumunun bir çakışma olmadığından reaktif kendisidir." 1. Aslında, üç tür Coomassie parlak mavi boya 2 testin normal asidik pH, asit-baz dengesi . Kırmızı, mavi ve yeşil formları sırasıyla 590, 470 ve 650 nm (Şekil 2) absorbans maxima var. Mavi, yoğun, 594 nm 3, 4 (Şekil 2) ışık emer karmaşık bir şekillendirme, protein bağlayan şeklidir. Bradford 1 (Şekil 3) "reaktif için arka plan değeri daha fazla boya proteine bağlı olarak sürekli azalmaktadır" diye kaydetti. Bu nedenle, artan protein miktarları eklenir, protein boyası kompleksi emmez, 450 nm dalga boyunda absorbans değişimi ölçerek, 590 nm arka plan azalma hesaplamak için çalıştı. Bulduğumuz azalan arka plan kısmen değil, tamamen doğrusal hesapları (Şekil 4).
Protein-boya bağlayıcı bir denge 5 olduğu gibi, çünkü, sonra ücretsiz boya konsantrasyonunda azalma doğrusal yanıt başka bir bozulma ürettiği hipotezi, kompleks oluşum değil, aynı zamanda ücretsiz boya, sadece protein konsantrasyonu bağlıdır. (Şekil 5). Değişken ücretsiz boya konsantrasyonu ile ilgili hem konular göz önüne alırsak, biz, protein konsantrasyon ve absorbans ölçümleri 590 nm, 450 nm (Şekil 6) üzerinde oranı arasında doğrusal bir ilişki tanımlayan matematiksel bir denklem geliştirdi. Teorik ve deneysel çalışmanın ayrıntılı bir açıklama Analitik Biyokimya 6 1996 yayında bulunabilir. Matematiksel denklemi deneysel olarak test edilmiş ve tüm protein konsantrasyonları aralığı (Şekil 7) üzerinde lineer bir kalibrasyon eğrisi verimi tespit edildi. Ayrıca, denklem Y ekseni önünü 6, doğru pH-bağımlı değeri bağımsız bir kararlılık tarafından da doğrulandı .
Geliştirilmiş Bradford Protein Testi için ayrıntılı Protokolü, Mikroplaka Absorbans Okuyucu:
- Standart, sığır serum albumin 0.1 mg / ml stok solüsyonu hazırlayın. Herhangi bir diğer standart seçilmiş, ancak aynı standart tüm deneylerde kullanılan gerektiğini unutmayın olabilir.
- Bilinmeyen örnekler deiyonize su ile seyreltilir. 5-50 mg / ml hedefliyoruz. Ancak, testin doğrusal aralığı için belirgin bir sınır olmadığı için daha yüksek veya daha düşük protein konsantrasyonları, kabul edilebilir. Ancak, ölçüm absorbans okuyucu doğrusal aralığı içinde olmalıdır.
- Deiyonize su Bradford reaktifi (Bio-Rad) 2.5 kat sulandırınız.
- 0 ve üç nüsha kuyuları (0-5 mg BSA kalibrasyon eğrisi oluşturma) BSA stok solüsyonu 10-50 ul ekleyin. / Ul 100 ulaşmak için deiyonize su ile tamamlayın.
- Farklı bir kuyu, 100 ul triplicates bilinmeyen örnek ekleyin. Bilinmeyen örnek çeşitli konsantrasyonlarda doğruluğunu artırmak için kullanılıyor olabilir.
- Tüm kuyulara seyreltilmiş Bradford reaktifi 100 ul ekleyin. Toplam hacmi 200 ul / iyi.
- En az 5 dakika değil, renk gelişimi için fazla 60 dakika bekleyin.
- Boş deiyonize su (ve sıfır protein boyası) 200 ul olmalıdır.
- 590 nm ve 450 nm dalga boyunda absorbansı ölçülür.
- , 590 nm net absorbans değerleri bölerek ve 450 nm dalga boyunda bir kalibrasyon grafiği hazırlayın. Sıfır protein (sadece boya) değer bir veri noktası (Şekil 8) olarak dahil olması gerektiğini unutmayın.
- Kalibrasyon eğrisi (Şekil 9) lineer denklem dayalı bilinmeyen numune konsantrasyonu hesaplayın.
Temsilcisi Sonuçlar:
Absorbans 590 nm tek bir dalga boyu, absorbans değerleri, 590 nm 450 nm üstü oranı aksine, lineer wi. protein konsantrasyonu (Şekil 10).
Bilinmeyen örnek protein konsantrasyonu kalibrasyon eğrisi (Şekil 10, denklem) lineer denklem kullanılarak hesaplanmıştır olabilir.
Ancak, artan doğruluğu bilinmeyen birkaç numune dilüsyonları ölçerek elde edilir. Bu amaçla, iki grafikler hazırlar. Ilk X ekseni (Şekil 11, sağ) mg protein ile standart bir kalibrasyon grafiği. İkinci grafikte X ekseni (Şekil 11, sol) orijinal sulandırılmamış örnek ul, bilinmeyen bir örnek. Boya sadece değeri (Şekil 11) her iki grafiklerde dahil edilmelidir. Bilinmeyen örnek protein konsantrasyonu bilinmeyen bir örnek ve standart eteklerinde (Şekil 11, denklem) bölünmesi ile elde edilir.
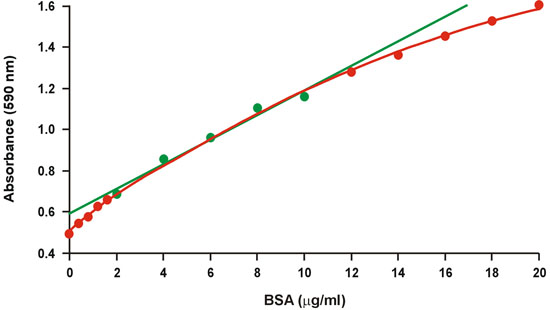
Şekil 1. Konvansiyonel Bradford kalibrasyon grafiği. Doğrusal aralığı yeşil sembollerle temsil edilmektedir.

Şekil 2 protein-boya kompleks ve yalnız boya Spectra.

Şekil 3. Protein-boya denge.
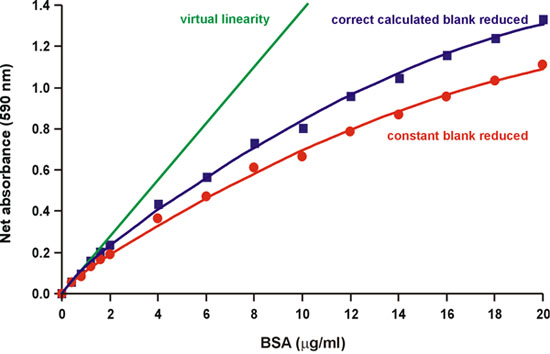
Şekil 4 doğru hesaplanan arka plan Azaltma kısmen doğrusal azalır.
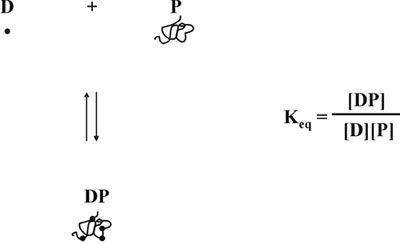
Şekil 5 Protein-boya denge.

Şekil 6 Bradford protein testinin doğrusallaştırma için matematiksel olarak.
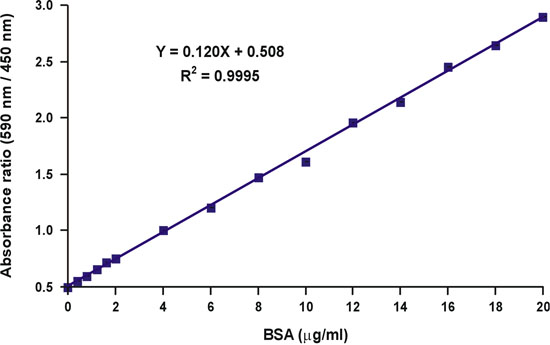
Şekil 7 Bradford kalibrasyon grafiği Doğrusallaştırma.

Şekil 8 absorbans oranı değerlerinin hesaplanması.

Şekil 9 A lineer Bradford kalibrasyon grafiği.
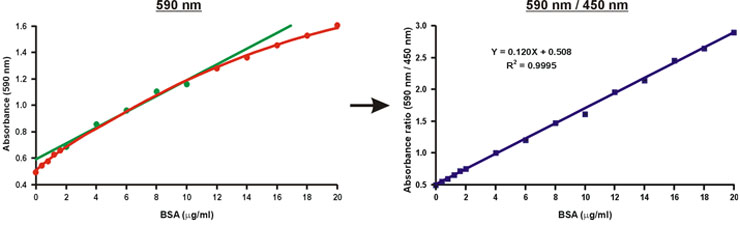
Şekil 10 Bradford kalibrasyon grafiği Doğrusallaştırma.
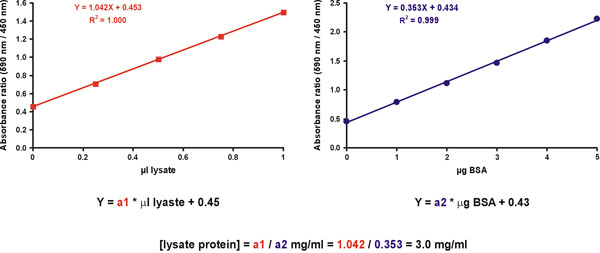
Şekil 11 Bilinmeyen numune konsantrasyonu hesaplama.
Tartışmalar
Bradford protein tahlil performans ve bağıl duyarlılık kolaylığı nedeniyle popüler. Protokol ile elde edilen aralığı tüm protein konsantrasyonları üzerine doğrusallaştırma, bilinmeyen örnekler aralığında kalibrasyon grafiği düşmeye gerek yok, burada daha fazla testin kolaylaştırır sundu.
Önemlisi, daha da geliştirilmiş protokol orijinal Bradford protokolü üzerinden aşağıdaki avantajları sağlar:
- Doğruluğunu arttırdı.
- Hassasiyet, ...
Teşekkürler
Bu kağıt, burada açıklanan orijinal araştırma ev sahipliği yapan merhum Dr. Zvi Selinger anısına adanmış.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Bradford reagent | Bio-Rad | 500-0006 | |
| Bovine Serum Albumin | Amersco | 0332 | |
| Multiplate absorbance reader | BioTek | Synergy2 |
Referanslar
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Chial, H. J., Thompson, H. B., Splittgerber, A. G. A spectral study of the charge forms of Coomassie blue G. Anal Biochem. 209, 258-266 (1993).
- Chial, H. J., Splittgerber, A. G. A comparison of the binding of Coomassie brilliant blue to proteins at low and neutral pH. Anal Biochem. 213, 362-369 (1993).
- Compton, S. J., Jones, C. G. Mechanism of dye response and interference in the Bradford protein assay. Anal Biochem. 151, 369-374 (1985).
- Congdon, R. W., Muth, G. W., Splittgerber, A. G. The binding interaction of Coomassie blue with proteins. Anal Biochem. 213, 407-413 (1993).
- Zor, T., Selinger, Z. Linearization of the Bradford protein assay increases its sensitivity: theoretical and experimental studies. Anal Biochem. 236, 302-308 (1996).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır