JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
브래드 포드 단백질 분석의 선형화
요약
신속하고 편리한 브래드 포드 분석에 의해 단백질 결정의 정확성과 감도는 본질적인 비선 형성에 의해 손상됩니다. 우리는 크게, 정확성을 증가 10 배에 대한 분석의 감도를 향상하고, 크게 세제에 의해 간섭을 줄일 수있는 간단한 선형화 절차를 보여줍니다.
초록
브래드 쿠매시 화려한 파란색 분석에서 단백질의 마이크로 그램 수량의 결정은 590 nm의 흡광도에서 측정하여 수행됩니다. 이것은 가장 일반적인 분석은 생화 학적 측정의 정상화를 목적으로, 세포 lysates, 휴대 분수, 또는 재조합 단백질 샘플에 신속하고 간단하게 단백질 부량 수 있습니다. 그러나, 본질적 비선 형성이 방법의 감도와 정확성을 타협. 이것은 표준 분석 조건 하에서 흡광도 590 NM에서 측정과 450 nm의 비율은 단백질 농도와 엄격하게 선형임을 표시됩니다. 이 간단한 절차는 정확성을 증가 및 아래쪽 소 혈청 알부민 50 NG 10 배, 좋으 부량에 대한 분석의 감도를 향상시킵니다. 또한, 일반적으로 세포 lysates을 만드는 데 사용되는 세제의 도입 간섭은 크게 새로운 프로토콜에 의해 줄어 듭니다. 대량 작업 및 맥주의 율법에 기초하여 개발된 선형 방정식 완벽하게 실험 데이터를 맞는 데요.
프로토콜
브래드 포드 단백질 보정 그래프의 선형화 :
일반적으로 브래드 포드 분석 1로 알려진 쿠매시 화려한 파란색 단백질 분석은, 널리 때문에 신속하고 편리한 프로토콜뿐만 아니라 그 상대 감도의하는 데 사용됩니다. 불행히도, 단백질 농도의 광범위한 (그림 1) 이상의 곡률의 큰 정도가 있습니다. 따라서, 상대적으로 높은 단백질 농도, 20-10 MG / ML BSA의 단지 좁은 범위는 다음 더 나은 (그림 1, 녹색) 선형 회귀에 맞는 보정 그래프에 대한 사용됩니다. 그러나, 비선 형성은 큰 오류를 방지하기 위해 교정 그래프의 제한된 범위 내에서 가을에 알려지지 않은 샘플의 단백질 농도를 필요로하고 또한 제한된 범위의 정확성을 줄일 수 있습니다. 비선 형성은 단백질의 마이크로 그램 금액은 사용할 수 없습니다 특히 심각한 문제를 제시하고, 그것은 종종 알려지지 않은 샘플의 여러 dilutions이 필요합니다.
마찬가지로 원래 브래드 포드 종이에 명시된 바와 같이, "염료의 두 가지 색상 형태의 스펙트럼에 중복이되기 때문에 비선 형성의 원인은 시약 자체입니다."1. 사실, 쿠매시 화려한 파란색 색소의 세 형태 분석 2 일반적인 산성 산도에서 산성 - 기본 평형에 있습니다. 빨간색, 파란색, 그리고 녹색 양식, 470에서 각각 590과 650 nm의 (그림 2) 흡광도 맥시멈 있습니다. 파란 달아 NM 3, 4 (그림 2) 594에서 빛을 흡수 복잡한을 형성 단백질 바인딩 형식입니다. 브래드 포드는 또한 1 (그림 3) "더 많은 염료는 단백질 바인딩으로 시약의 배경 값이 지속적으로 감소하고있다"고 지적했다. 증가 단백질 수량이 추가로 따라서, 우리는 단백질 염색 단지가 흡수하지 않는 450 nm의에서 흡광도의 변화를 측정하여 590 nm의 배경의 감소를 계산하기 위해 시도했습니다. 우리는 발견 감소 배경 부분 것이 아니지만 완전히, 비선 형성 (그림 4)를 차지하고 있습니다.
단백질 염색 바인딩은 평형 5와 같이 있기 때문에 우리는 그때, 무료 염료 농도의 감소가 선형 응답의 또 다른 왜곡을 생성하는 가상, 복잡한 형성은뿐만 아니라 무료로 염료의에서뿐만 아니라 무료로 단백질의 농도에 따라 달라집니다 (그림 5). 계정에 무료 염료의 변수 농도와 관련된 두 문제를 복용, 우리는 단백질 농도와 흡광도 측정, 450 NM (그림 6)을 통해 590 nm의 비율 사이의 선형 관계를 설명하는 수학 방정식을 개발했습니다. 이론 및 실험적 연구에 대한 자세한 설명은 분석 생화학 6 우리 1,996 간행물에서 찾을 수 있습니다. 수학 방정식은 실험적으로 테스트하여 전체 단백질 농도 범위 (그림 7)을 통해 선형 보정 곡선을 얻을 것으로 판명되었다. 또한 방정식은 Y 축 절편 6 올바른 산도에 의존 가치의 독립적인 결정에 의해도 확인되었다.
향상된 브래드 포드 단백질 분석에 대한 자세한 프로토콜, Microplate의 흡광도 Reader를 사용하여
- 표준 소 혈청 알부민의 0.1 MG / ML 재고 솔루션을 준비합니다. 다른 표준은 선택하지만, 같은 표준은 모든 실험에서 사용해야합니다 수 있습니다.
- 탈이온수에있는 미지의 샘플을 희석. 5-50 μg / ML하는 것을 목표로하고 있습니다. 분석의 선형 범위에 대한 명백한 제한이 없기 때문에 아직 높거나 낮은 단백질 농도가 허용됩니다. 그러나, 측정 흡광도 리더의 선형 범위 내에서해야합니다.
- 탈이온수의 브래드 포드 시약 (바이오 래드)가 2.5 배 희석.
- 0 세중의의 우물 (0-5 μg BSA 보정 곡선을 만드는)에 BSA 주식 솔루션의 10-50 μl를 추가합니다. / 잘 100 μl에 도달 탈이온수로 보완합니다.
- 다른 우물에서 triplicates에 알려지지 않은 샘플 100 μl를 추가합니다. 미지 시료의 농도는 몇 가지 정확성을 높이기 위해 사용할 수 있습니다.
- 모든 우물에 희석 브래드 포드 시약 100 μl를 추가합니다. 총 볼륨 잘 200 μl / 수 있습니다.
- 적어도 5 분 아니지만 색상 개발을위한 이상 60 분 정도 기다립니다.
- 빈은 탈이온수 (가 아니라 잘 제로 단백질 색소) 200 μl해야합니다.
- 590 NM에서 450 nm의 흡광도에서를 측정.
- 590 nm의 흡광도에서 네트워크의 가치를 나누어 450 nm의에서 보정 그래프를 준비합니다. 제로 단백질 (단 염료) 값이 데이터 포인트 (그림 8)로 포함되어야합니다.
- 교정 곡선 (그림 9)의 선형 방정식을 바탕으로 미지 시료의 농도를 계산합니다.
대표 결과 :
590 NM의 단일 파장, 흡광도 값을 450 nm의 이상의 590 nm의 비율에서 흡광도와는 달리, 선형 w는ith 단백질 농도 (그림 10).
미지의 시료의 단백질 농도는 단순히 교정 곡선 (그림 10, 방정식)의 선형 방정식을 사용하여 계산됩니다.
그러나, 증가 정확도는 몇 가지 알려지지 않은 샘플 dilutions를 측정하여 얻을 수 있습니다. 이를 위해 두 개의 그래프를 준비합니다. 첫 번째는 X 축 (그림 11, 오른쪽)에서 μg 단백질과 표준 교정 그래프입니다. 두 번째 그래프는 X 축 (그림 11, 왼쪽)에있는 원래 undiluted 샘플 μl와 함께 미지의 샘플입니다. 염료 전용 값은 (그림 11) 두 그래프에 포함되어야합니다. 미지의 시료의 단백질 농도는 미지의 시료와 표준의 슬로프 (그림 11, 방정식)을 나누어 파생됩니다.
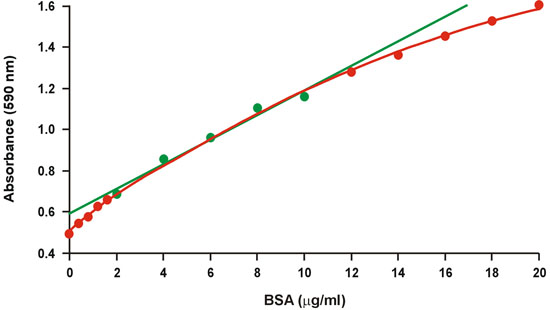
그림 1. 기존 브래드 포드 교정 그래프. 선형 범위는 녹색 기호로 표시됩니다.

그림 2. 단백질 염색 복합 혼자 염료의 스펙트럼.

그림 3. 단백질 염색 평형.
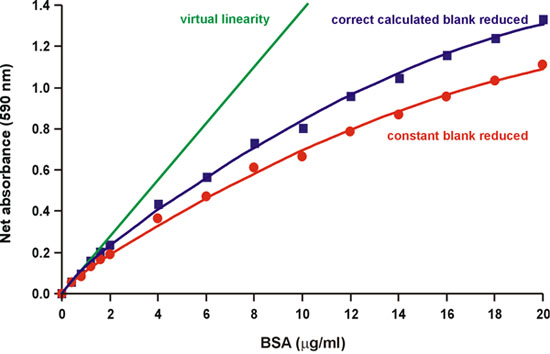
그림 4. 정확한 계산 배경 감소는 부분 비선 형성을 감소시킵니다.
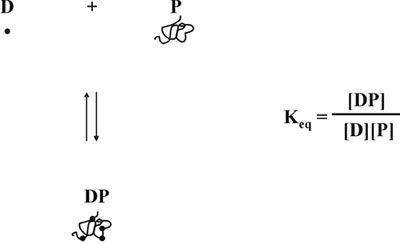
그림 5. 단백질 염색 평형.

그림 6. 브래드 포드 단백질 분석의 선형화을위한 수학 기초.
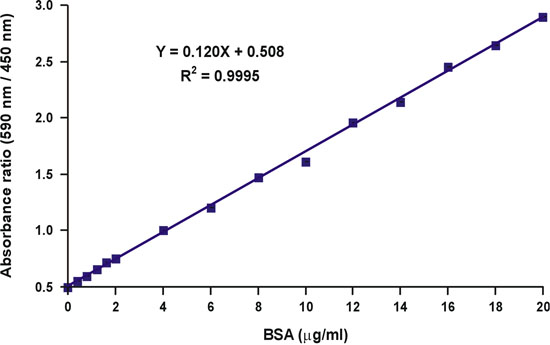
그림 7. 브래드 포드 보정 그래프의 선형화.

그림 8. 흡광도 비율 값 계산.

그림 9. 리니어 브래드 포드 교정 그래프.
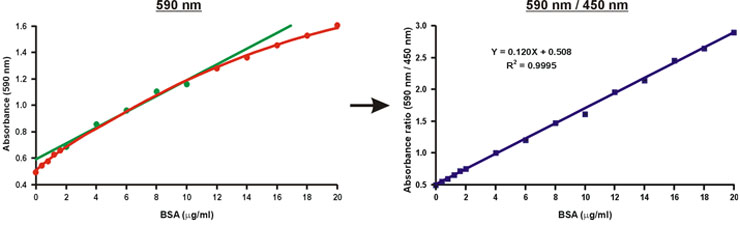
그림 10. 브래드 포드 보정 그래프의 선형화.
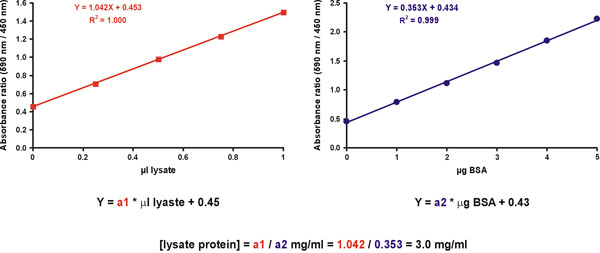
그림 11. 불명 샘플 농도 계산.
토론
브래드 포드 단백질 분석 인해 성능과 상대 감도 자사의 용이성으로 인기가 있습니다. 프로토콜에 의해 얻은 범위 전체 단백질 농도 이상의 선형화는 미지 샘플의 교정 그래프의 범위 내에서 빠지지하지 않아도 여기에 추가로, 분석을 간단하게 제시.
중요한 것은 향상된 프로토콜은 더 이상 원래 브래드 프로토콜에 비해 다음과 같은 장점을 제공합니다 :
- 정확도를 ...
감사의 말
본 논문은 여기에서 설명한 원래 연구를 호스팅하는 후반 박사 Zvi 셀린저의 기억에 전념하고 있습니다.
자료
| Name | Company | Catalog Number | Comments |
| Bradford reagent | Bio-Rad | 500-0006 | |
| Bovine Serum Albumin | Amersco | 0332 | |
| Multiplate absorbance reader | BioTek | Synergy2 |
참고문헌
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Chial, H. J., Thompson, H. B., Splittgerber, A. G. A spectral study of the charge forms of Coomassie blue G. Anal Biochem. 209, 258-266 (1993).
- Chial, H. J., Splittgerber, A. G. A comparison of the binding of Coomassie brilliant blue to proteins at low and neutral pH. Anal Biochem. 213, 362-369 (1993).
- Compton, S. J., Jones, C. G. Mechanism of dye response and interference in the Bradford protein assay. Anal Biochem. 151, 369-374 (1985).
- Congdon, R. W., Muth, G. W., Splittgerber, A. G. The binding interaction of Coomassie blue with proteins. Anal Biochem. 213, 407-413 (1993).
- Zor, T., Selinger, Z. Linearization of the Bradford protein assay increases its sensitivity: theoretical and experimental studies. Anal Biochem. 236, 302-308 (1996).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유