A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزل الخلايا البطانية صمامي
In This Article
Summary
نحن نقدم طريقة لعزل وزراعة السكان نقية من خلايا صمام القلب البطانية (مركزنا). يمكن عزل مركزنا من جانبي نتوء أو النشرة وبعدها مباشرة ، الخلية الأساسية خلالي (VIC) العزلة واضح ومباشر.
Abstract
صمامات القلب هي وحدها المسؤولة عن الحفاظ على اتجاه وتدفق الدم من خلال نظام القلب والأوعية الدموية. وتتعرض هذه رقيقة ، والأنسجة الليفية للضغوط ميكانيكية كبيرة لأنها تفتح وتغلق عدة مليارات من المرات على مدى العمر. على التحمل لا تصدق من هذه الأنسجة ويرجع ذلك إلى صمامي المقيمين البطانية (VEC) وخلايا الخلالية (VIC) أن إصلاح وإعادة تشكيلها باستمرار استجابة للإشارات المحلية الميكانيكية والبيولوجية. إلا في الآونة الأخيرة بدأنا لفهم السلوكيات الفريدة لهذه الخلايا ، والتي في التجارب المختبرية لعبت دورا رئيسيا. لا سيما التحدي هو العزلة وثقافة مركزنا. يجب توخي الحذر خاصة من لحظة إزالة الأنسجة من المضيف من خلال الطلاء النهائية. هنا نقدم بروتوكولات العزل المباشر ، والعزلة جانب معين ، والثقافة ، والتحقق من السكان نقية من مركزنا. نستخدم الهضم الأنزيمي تليها تقنية مسحة رقيقة تجريف لإزاحة الخلايا السطحية فقط. ثم يتم جمع هذه الخلايا في أنبوب وطرد الى بيليه. هو معلق ثم بيليه ومطلي في قوارير ثقافة ما قبل المغلفة مع مصفوفة أنا الكولاجين. وأكد مركزنا النمط الظاهري كبح النمو عن طريق الاتصال والتعبير عن علامات معينة مثل البطانية PECAM1 (CD31) ، عامل فون ويلبراند (vWF) ، والتعبير السلبي للأكتين ألفا العضلات الملساء (α - SMA). وترتبط الخصائص الفنية للمركزنا مع مستويات عالية من LDL الأسيتيل. خلافا لخلايا بطانة الأوعية الدموية ، ومركزنا في قدرة فريدة على التحول الى اللحمة المتوسطة ، والذي يحدث عادة خلال تشكيل صمام الجنينية 1. وهذا يمكن أن يحدث أيضا أثناء فترات طويلة متموجة كبير آخر في الثقافة المختبر ، لذلك ينبغي بذل العناية لمرور عند أو بالقرب من نقطة التقاء. بعد عزلة مركزنا ، يمكن عندئذ السكان نقية من VIC الحصول عليها بسهولة.
Protocol
1. إعداد
- درج الأوتوكلاف في صك تغطية البنود التالية :
- ملقط الأنسجة مسننة -- للحصول على التعامل مع الأنسجة النشرة
- مقص نسيج (8 سم) -- للحصول على النشرة والتشذيب الأنسجة cusps
- مسحات القطن -- لعزل الطبقة البطانية من النشرة أو نتوء
- جعل محلول معقم كولاجيناز
- إضافة 4.0 جرام من مسحوق DMEM إلى 250 مليلتر من الماء MΩ 18.
- إضافة 1،11 غراما من بيكربونات الصوديوم.
- إضافة (600 U / مل) 180000 وحدة من كولاجيناز.
- إضافة 1 ٪ (3mL) البنسلين / الستبرتوميسين.
- ضبط الرقم الهيدروجيني من الحل إلى 7.2.
- تقديم حل ما يصل الى 270 مل.
- تعقيم الحل عن طريق تمرير من خلال مرشح 0.2 ميكرون.
- إضافة 10 ٪ (30mL) من مصل بقري جنيني العقيمة.
- جعل العقيمة المتوسطة الخلية البطانية
- إضافة 6.7 جرام من مسحوق DMEM إلى 400 مليلتر من الماء MΩ 18.
- إضافة 1،85 غراما من بيكربونات الصوديوم.
- إضافة (50 يو / مل) 25000 وحدة من الهيبارين.
- إضافة 1 ٪ (5mL) البنسلين / الستبرتوميسين.
- ضبط الرقم الهيدروجيني من الحل إلى 7.2.
- تقديم حل ما يصل إلى 450 مل.
- تعقيم الحل عن طريق تمرير من خلال مرشح 0.2 ميكرون.
- إضافة 10 ٪ (50mL) من مصل بقري جنيني العقيمة.
- جعل العقيمة المتوسطة الخلية خلالي
- إضافة 13،37 غراما من مسحوق DMEM إلى 800 مليلتر من الماء MΩ 18.
- إضافة 3.7 جرام من بيكربونات الصوديوم.
- إضافة 1 ٪ (10ML) البنسلين / الستبرتوميسين.
- ضبط الرقم الهيدروجيني من الحل إلى 7.2.
- تقديم حل ما يصل الى 900 مل.
- تعقيم الحل عن طريق تمرير من خلال مرشح 0.2 ميكرون.
- إضافة 10 ٪ (100ML) من المصل البقري العقيمة.
2. عزلة منشورات صمام القلب
- استئصال جذر الأبهر فورا وجو معقم و مطهر من القلب بعد التضحية.
- شطف جيدا جذر الأبهر من الدم مع DPBS العقيمة الباردة. لا بد من إزالة كافة مكونات الدم في أقرب وقت ممكن للحد من مركزنا الموت والتلوث الجرثومي. لا ينصح المضادات الحيوية وantimycotics في هذه المرحلة لأنها يمكن أن تكون ضارة إلى مركزنا.
- عزل منشورات صمام (3 في صمام) مباشرة من جذر ومكان في أنبوب عقيم 15 مليلتر المخروطية مليئة DPBS 12 مل الباردة. يهز عدة مرات لإزالة الأنقاض وإعادة ملء مع DPBS الطازجة.
- النقل إلى المختبر على الجليد.
- لدى وصوله الى المختبر ، ومكان الحاوية مع الأنسجة تحت غطاء محرك السيارة العقيمة.
3. عزل طبقة بطانة
- ملء طبق العقيمة مع 35mm 3mL حل كولاجيناز الباردة في صمام (3 منشورات).
- وضع جميع المنشورات ثلاثة من أنبوب 15 مل في صحن مليء الحل كولاجيناز.
- احتضان النسيج لمدة 5-10 دقائق عند 37 درجة مئوية.
- إزالة الطبقة البطانية بلطف عن طريق تناوب مسحة جافة معقمة على سطح المنشور. اتجاه الدوران وكمية من تطبيق القص هو أمر حاسم لنقاء العينة. ينبغي للتناوب المسحة يكون في الاتجاه المعاكس لحركة خطية من يدك خلق القص للرقابة. هذا القص هو ما يرفع من الخلايا البطانية في الأنسجة. ينبغي ألا يكون مقدار القوة المستخدمة يكون كافيا ليشعر مقاومة الأنسجة ، ولكن لا تتمكن من اختراق الغشاء القاعدي.
- أحيانا ، الداب المسحة في حل كولاجيناز لإزاحة الخلايا من ألياف الحافة. بعد اكتمال ينظف ، ينبغي للنسيج من طبقة بطانة يشعرون قليلا سلاسة من ذي قبل.
- جمع تعليق خلية / كولاجيناز ونقل إلى أنبوب جديد 15mL العقيمة.
- أنابيب الطرد المركزي في 1000 دورة في الدقيقة لمدة 5 دقائق لبيليه أية خلايا منعزلة ونضح طاف. إذا عزل خلايا الخلالية كذلك ، تنفيذ هذا البروتوكول في حين يتم طرد هذه الخلايا.
- أضف 3 مل من المتوسط الخنزيري البطانية للأنابيب 15 مليلتر ، جهاز الطرد المركزي للمرة الثانية ، ووسائل الإعلام نضح. هذا الطرد المركزي الثاني يستخدم في مساعدة تصفية بعض المواد غير المرغوب فيها مثل الألياف الحافة.
- اعادة تعليق الخلايا البطانية طرد في 5 مل من البطانية والمتوسطة الخنازير لوحة الخلايا في قارورة T - 25 قبل المغلفة مع الكولاجين (1 قارورة في استخدام أنبوب الطرد المركزي).
- السماح للخلايا تنمو على الأقل 2-3 أيام قبل تغيير المتوسطة البطانية. هذا يساعد على استعادة خلايا وتقسيم منذ بدء عملية العزل قاسية إلى حد ما ، والعائد الخلية قد تكون منخفضة. فمن الأهمية بمكان أن الخلايا مرور بالقرب من نقطة التقاء منذ تثبيط الاتصال يمكن أن تؤدي إلى تحول الخلية.
4. إعداد طبق من عيار 60 ملم الثقافة لعزل محددة الجانبية
- خط 60 ملم الزجاج أطباق بتري برقائق الألومنيوم (2 في أطباق زجاجية leafle ر). احباط الألومنيوم يساعد على إزالة البارافين ، بحيث يمكن إعادة استخدامها في طبق بتري للزجاج العزلة الأخرى.
- مكان الخرز البارافين داخل أطباق ، أي نحو نصف كاملة ، وغطاء لالتعقيم.
- بمجرد اكتمال التعقيم والبارافين وذاب ، نقل فرقة طبق على السطح شقة باردة. كما البارافين يبرد ، فإنه سيتم التشدد وخلق طبقة من شأنها أن تدعم ثقوب الإبر.
- بعد 30 دقيقة ، ويمكن تعقيمها ثم طبق استخدامها بوصفها دائرة العزلة إلى شل النسيج النشرة.
5. عزل طبقة معينة الجانبية غشائي
- إزالة منشورات من أنابيب 15mL ومكان على استعداد طبق 60mm ثقافة محددة لعزل الجانب.
- التلاعب في النشرة بحيث الجانب البطينية هو على وجهه على سطح البارافين ترك الجانب الليفية تتعرض لها. دبوس حواف المنشور لفضح الطبقة البطانية.
- وضع قطرات قليلة من كولاجيناز الباردة على كل سطح (صعودا التي تواجه) البطانية واحتضان النسيج لمدة 5-10 دقائق في 37 درجة مئوية.
- كما كان من قبل ، وإزالة الطبقة البطانية بلطف عن طريق تناوب مسحة جافة معقمة على سطح المنشور. اتجاه الدوران وكمية من تطبيق القص هو أمر حاسم لنقاء العينة. ينبغي للتناوب المسحة يكون في الاتجاه المعاكس لحركة خطية من يدك خلق القص للرقابة. هذا القص هو ما يرفع من الخلايا البطانية في الأنسجة وأي شيء آخر. ينبغي ألا يكون مقدار القوة المستخدمة يكون كافيا ليشعر مقاومة الأنسجة ، ولكن لا اختراق داخل الأنسجة.
- أحيانا ، الداب المسحة في حل كولاجيناز لإزاحة الخلايا من ألياف الحافة. بعد اكتمال ينظف ، ينبغي للنسيج من طبقة بطانة يشعرون قليلا سلاسة من ذي قبل.
- جمع تعليق خلية / كولاجيناز ونقل إلى أنبوب جديد 15mL العقيمة. بيان خصوصية الجانب على تسمية (يمكن تجميع منشورات من نفس صمام معا).
- نقل منشورات على طبق ثقافة جديدة بحيث يتعرض الآن للجانب البطينية وكرر الخطوات من (5،3-5،6).
- حالما يتم جمع كل خلية تعليق / كولاجيناز ، أنابيب الطرد المركزي في 1000 دورة في الدقيقة ل5minutes إلى أي خلايا معزولة ، ونضح بيليه طاف. إذا عزل خلايا الخلالية كذلك ، تنفيذ هذا البروتوكول في حين يتم طرد هذه الخلايا.
- أضف 3 مل من المتوسط الخنزيري البطانية للأنابيب ، الطرد المركزي للمرة الثانية ، ونضح وسائل الإعلام. هذا الطرد المركزي الثاني يستخدم في مساعدة تصفية بعض المواد غير المرغوب فيها مثل الألياف الحافة.
- اعادة تعليق الخلايا البطانية طرد في 5 مل من البطانية والمتوسطة الخنازير لوحة الخلايا في قارورة T - 25 قبل المغلفة مع الكولاج (استخدام القارورة 1 في أنبوب الطرد المركزي).
- السماح للخلايا تنمو على الأقل 2-3 أيام قبل تغيير المتوسطة البطانية. هذا يساعد على استعادة خلايا وتقسيم منذ بدء عملية العزل قاسية إلى حد ما. إذا لاحظت أن يكون العائد المنخفض جدا ، ويفكر في الانتقال الى أصغر قارورة أو لوحة جيدا منذ خلية خلية التصاق يشجع نمو الخلايا. تذكر أن مرور بالقرب من نقطة التقاء منذ تثبيط الاتصال يمكن أن تؤدي إلى تحول الخلية.
6. عزل خلايا خلالية
- ملء العقيمة الطرد المركزي مل 15 أنبوب مع 10 مل من محلول كولاجيناز لكل صمام (3 منشورات).
- بعد ينظف المنشورات من الخلايا البطانية والمكان على الفور في الأنبوب 15mL المناسبة مع حل كولاجيناز.
- احتضان لحوالي 12 إلى 18 ساعة (تستنهض الهمم بلطف إذا رغبت في ذلك).
- مزيج النسيج المتدهورة بلطف مع ماصة المصلية حتى تعليق خلية / كولاجيناز يصبح متجانس. هذا يساعد على التجانس تفتيت الأنسجة والخلايا الافراج خلالي.
- الطرد المركزي النسيج هضمها لمدة 5 دقائق عند 1000 دورة في الدقيقة ، ونضح وطاف.
- إضافة 5 مل المتوسطة الخنزيري الخلالي للأنابيب 15mL ، الطرد المركزي للمرة الثانية ، ونضح الطافي.
- اعادة تعليق الخلايا البطانية طرد في 5 مل من خلالي والمتوسطة الخنازير لوحة الخلايا في T - 75 قارورة (1 قارورة في استخدام أنبوب الطرد المركزي).
- السماح للخلايا تنمو على الأقل 1-2 أيام قبل تغيير المتوسطة الخلية خلالي. وسوف يكون هناك أكثر بكثير من الحطام الأنسجة مع الخلايا البطانية ولكن ، وهذا هو المتوقع. يجب أن تنمو الخلايا أيضا أن التقاء أسرع من الخلايا البطانية بسبب العائد الخلية وطبيعتها.
7. ممثل صور

الشكل 1. ومورفولوجيا الخلايا المعزولة في آخر أيام العزلة 2-3. (A) يحمل مركزنا مورفولوجيا نموذجية البطانية وشكل مجموعات لتعزيز النمو. (ب) VIC مورفولوجيا يشبه myofibroblasts التي عادة ما تكون على شكل مغزلي وموزعة بالتساوي في جميع أنحاء القارورة.
الطبقة = "jove_content"> 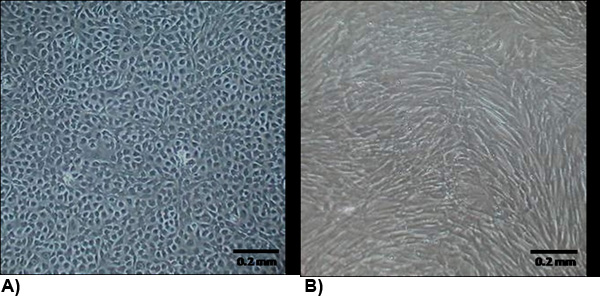
الشكل 2 ، ومورفولوجيا الخلايا المعزولة في confluency. (A) يحمل مركزنا مورفولوجيا نموذجية البطانية التي عادة ما تكون الحصوه والاتصال النمو الكبت. (ب) VIC مورفولوجيا يشبه myofibroblasts التي عادة ما تكون على شكل مغزلي وليس الاتصال النمو الكبت.
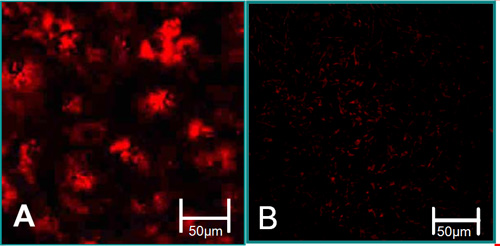
الشكل 3. خصائص وظيفة الخلايا المعزولة 6. (أ) ترتبط مركزنا مع مستويات عالية من امتصاص LDL الأسيتيل (الحمراء). (ب) ترتبط VIC مع مستويات منخفضة من امتصاص LDL الأسيتيل.
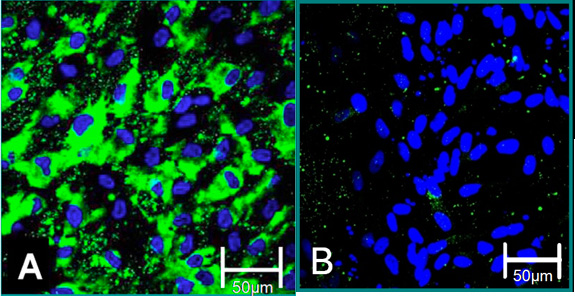
الشكل 4. علامات الخلوي للخلايا منعزلة 6. (أ) يساهم مركزنا النمط الظاهري لتلطيخ إيجابية لعامل فون ويلبراند (الأخضر) ، الزرقاء (نوى). (ب) وساهمت في تلطيخ VIC النمط الظاهري السلبية لعامل فون ويلبراند.
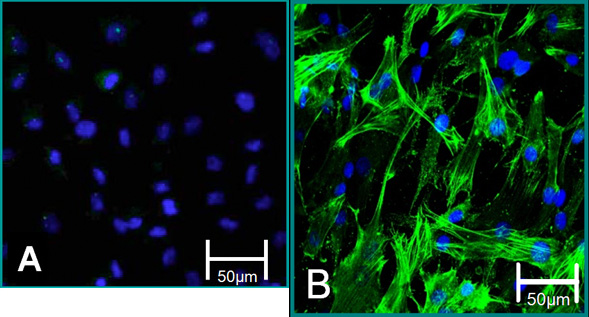
الشكل 5. علامات الخلوي للخلايا معزولة. (أ) يساهم مركزنا النمط الظاهري لتلطيخ السلبية لSMA ألفا (الأخضر) ، الزرقاء (نوى). (ب) وساهمت في تلطيخ VIC النمط الظاهري إيجابية لSMA ألفا.
| تفارق عامل | تفارق وتقنيات | خلية كوكتيل | خلية الكمية | الخلية نقاء | تلوث |
| EDTA (3mM) دون CaCl 2 | 5 ، 20 ، 60 دقيقة. بالإضافة إلى ذلك قبل CaCl 2 | 20 ، 60 ، 120 دقيقة. قبل جمع | -- | + / -- | + + + |
| EDTA (6mM) دون CaCl 2 | 5 ، 20 ، 60 دقيقة. بالإضافة إلى ذلك قبل CaCl 2 | 20 ، 60 ، 120 دقيقة. قبل جمع | + / -- | + | + + + |
| التربسين - EDTA (0.5 غرام / لتر) | 5 ، 10 ، 15 دقيقة. قبل التعطيل | جمعت المتوسطة فورا | + | + | + + |
| كولاجيناز الثاني (300 U / مل) | 5 ، 10 ، 15 دقيقة. قبل التعطيل | جمعت المتوسطة فورا | -- ، + ، + + | -- ، + + ، + | + |
| كولاجيناز الثاني (600 U / مل) | 5 ، 10 ، 15 دقيقة. قبل التعطيل | جمعت المتوسطة فورا | + + + ، + + + | + + ، + + ، -- | -- |
الجدول 1. نتائج أولية بطانية صمامي بروتوكولات العزل الخلية.
Access restricted. Please log in or start a trial to view this content.
Discussion
وقد ضعف فهم البيولوجيا صمامي بسبب الصعوبات التقنية وعزل السكان زراعة نقي من الخلايا البطانية صمامي. تقنيات العزل نموذجية تشمل الهضم الأنزيمي من المصفوفة القاعدية الأساسية الكيميائية أو تفارق من السندات لاصقة 2،3 البطانية. وقد تم تقييم التجارب نوعيا العزلة الأ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
Acknowledgements
ويدعم هذا البحث من قبل على جائزة التوظيف جبهة الخلاص الوطني ، ومؤسسة هارتويل ، وجمعية القلب الأميركية (# 0830384N).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium | Mediatech, Inc. | 50-103-PB | |
| Fetal Bovine Serum | GIBCO, by Life Technologies | 26140 | |
| Penicillin Streptomycin | GIBCO, by Life Technologies | 15140-122 | |
| 0.25% Trypsin-EDTA | GIBCO, by Life Technologies | 25200 | |
| Heparin Sodium Salt | Sigma-Aldrich | H4784-1G | |
| Collagenase Type 2 | Worthington Biochemical | LS004176 | |
| DPBS | GIBCO, by Life Technologies | 21300-058 | |
| Rat Tail Collagen | BD Biosciences | 354236 | |
| Critical Swabs | VWR international | 89031-270 | |
| Sodium Bicarbonate | Sigma-Aldrich | 55761 | |
| T25 Flasks | BD Biosciences | 353018 | |
| T75 Flasks | BD Biosciences | 353136 | |
| 24 Well Plate | Falcon BD | 353047 | |
| 60x15 mm Dishes | VWR international | 25384-092 | |
| 60x15 Glass Dishes | VWR international | 89000-310 | |
| Paraffin Embedding Wax | Electron Microscopy Sciences | 19304-01 | |
| Precision Glide Needles | BD Biosciences | 305165 | |
| 500 mL Nalgene Filters | VWR international | 73520-985 | |
| 1L Nalgene Filters | VWR international | 73520-986 | |
| Tissue Forceps | Fine Science Tools | 11023-15 | |
| FSC Tweezers #5 | Fine Science Tools | 11295-00 |
References
- Thompson, R. P., Fitzharris, T. P. Morphogenesis of the truncus arteriosus of the chick embryo heart: the formation and migration of mesenchymal tissue. Am J Anat. 154, 545-556 (1979).
- Johnson, C. M., Fass, D. N. Porcine cardiac valvular endothelial cells in culture: A relative deficiency of fibronectin synthesis in vitro. Lab Invest. 49 (5), 589-598 (1983).
- Manduteanu, I., Popov, D., Radu, A., Simionescu, M. Calf cardiac valvular endothelial cells in culture: production of glycosaminoglycans, prostacyclin and fibronectin. J Mol Cell Cardiol. 20 (2), 103-118 (1988).
- Cheunyg, W. Techniques for isolating and purifying porcine aortic valve endothelial cells. JHVD. 17 (6), 674-681 (2008).
- Paranya, G., Vineberg, S., Dvorin, E., Kaushal, S., Roth, S. J., Rabkin, E., Schoen, F. J., Bischoff, J. Aortic valve endothelial cells undergo transforming growth factor-beta-mediated and non-transforming growth factor-beta-mediated transdifferentiation in vitro. Am J Pathol. 159 (4), 1335-1343 (2001).
- Butcher, J. T., Penrod, A., Garcia, A. J. M., Nerem, R. M. Unique morphology and focal adhesion development of valvular endothelial cells in static and fluid flow environments. Arterioscler Thromb Vasc Bio. 24 (1), 1429-1434 (2004).
- Simmons, C. A., Grant, G. R., Manduchi, E., Davies, P. F. Spatial heterogeneity of endothelial phenotypes correlates with side-specific vulnerability to calcification in normal porcine aortic valves. Circ Res. 96, 792-799 (2005).
- Butcher, J. T., Tressel, S., Johnson, T., Turner, D., Sorescu, G., Jo, H., Nerem, R. M. Transcriptional Profiles of Valvular and Vascular Endothelial Cells Reveal Phenotypic Differences: Influence of Shear Stress. Arterioscler Thromb Vasc Biol. 26, 69-69 (2006).
- Parachuri, S., Yang, J. H., Aikawa, E., Melero-Martin, J. M., Khan, Z. A., Loukogeorgakis, S., Schoen, F. J., Bischoff, J. Human Pulmonary Valve Progenitor Cells Exhibit Endothelial/Mesenchymal Plasticity in Response to Vascular Endothelial Growth Factor-A and Transforming Growth Factor-β2. Circ Res. 99 (8), 861-869 (2006).
- Shi, Q. Evidence for circulating bone marrow-derived endothelial cells. Blood. 92, 362-367 (1998).
- Rehman, J., Li, J., Orschell, C. M., March, K. L. Peripheral blood endothelial progenitor cells are derived from monocyte/macrophages and secrete angiogenic growth factors. Circulation. 107, 1164-1169 (2003).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved