Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aislamiento de células endoteliales valvular
En este artículo
Resumen
Ofrecemos un método para aislar y cultivar las poblaciones puras de células endoteliales de la válvula del corazón (VEC). VEC puede ser aislada de uno y otro lado de la cúspide o el prospecto e inmediatamente después, las células intersticiales de base (CIV) aislada es muy sencillo.
Resumen
Las válvulas del corazón es el único responsable de mantener el flujo de sangre unidireccional a través del sistema cardiovascular. Estos tejidos finos y fibrosos están sometidas a importantes tensiones mecánicas que pueden abrir y cerrar miles de millones de veces durante un período de vida. La increíble resistencia de estos tejidos se debe a la residencia del endotelio valvular (VEC) y las células intersticiales (VIC) que constantemente la reparación y remodelación en respuesta a las señales mecánicas y biológicas. Sólo recientemente hemos comenzado a comprender los comportamientos únicos de estas células, por lo que la experimentación in vitro ha jugado un papel clave. Especialmente difícil es el aislamiento y cultivo de VEC. Especial cuidado se debe utilizar desde el momento en que se extirpa el tejido del huésped a través de revestimiento final. Aquí se presentan los protocolos para el aislamiento directo, aislamiento secundarios específicos, la cultura, y la verificación de las poblaciones puras de VEC. Usamos la digestión enzimática seguida de una técnica de raspado suave esponja para separar las células en la superficie. Estas células son luego recogidos en un tubo y se centrifuga en una pastilla. El pellet se resuspende entonces y se colocaron en frascos de cultivo pre-recubiertos con colágeno I de la matriz. Fenotipo VEC es confirmado por el contacto inhibe el crecimiento y la expresión de marcadores endoteliales específicos, tales como PECAM1 (CD31), Factor Von Willebrand (FVW), y la expresión negativa de la actina de músculo liso alfa (α-SMA). Las características funcionales de VEC se asocian con altos niveles de LDL acetilada. A diferencia de las células endoteliales vasculares, VEC tiene la capacidad única de transformarse en mesénquima, que normalmente ocurre durante la formación embrionaria de la válvula 1. Esto también puede ocurrir durante el confluente de manera significativa después de prolongados en cultivo in vitro, así que el cuidado debe ser de paso o cerca de su confluencia. Tras el aislamiento VEC, poblaciones puras de VIC pueden ser fácilmente adquiridas.
Protocolo
1. Preparación
- Autoclave en un instrumento bandeja cubierta los siguientes elementos:
- Dentada con fórceps del tejido - Para el manejo de los tejidos folleto
- Tijeras de tejidos (8 cm) - Para cortar el tejido folleto y las cúspides
- Los hisopos de algodón - Para aislar la capa endotelial de la hoja o cúspide
- Hacer una solución estéril de colagenasa
- Añadir 4,0 gramos de polvo DMEM a 250 ml de 18 mW de agua.
- Añadir 1,11 gramos de bicarbonato de sodio.
- Añadir (600 U / mL) 180.000 unidades de la colagenasa.
- Añadir al 1% (3 ml) de penicilina / estreptomicina.
- Ajustar el pH de la solución a 7,2.
- Se lleva la solución hasta 270 ml.
- Esterilizar la solución al pasar por un filtro de 0,2 micras.
- Añadir un 10% (30 ml) de suero fetal bovino estéril.
- Haz medio estéril de las células endoteliales
- Añadir 6,7 gramos de polvo DMEM a 400 ml de 18 mW de agua.
- Añadir 1,85 gramos de bicarbonato de sodio.
- Añadir (50 U / mL) 25.000 unidades de heparina.
- Agregue 1% (5 ml) de penicilina / estreptomicina.
- Ajustar el pH de la solución a 7,2.
- Se lleva la solución hasta 450 ml.
- Esterilizar la solución al pasar por un filtro de 0,2 micras.
- Añadir un 10% (50 ml) de suero fetal bovino estéril.
- Haz medio estéril de células intersticiales
- Añadir 13,37 gramos de polvo DMEM a 800 ml de 18 mW de agua.
- Añadir 3,7 gramos de bicarbonato de sodio.
- Agregue 1% (10 ml) de penicilina / estreptomicina.
- Ajustar el pH de la solución a 7,2.
- Se lleva la solución hasta 900 ml.
- Esterilizar la solución al pasar por un filtro de 0,2 micras.
- Añadir un 10% (100 ml) de suero bovino estéril.
2. El aislamiento de valvas de las válvulas del corazón
- Impuestos Especiales de la raíz aórtica inmediatamente y aséptica del corazón después del sacrificio.
- Enjuague bien la raíz aórtica de sangre fría con DPBS estéril. Es imperativo eliminar todos los componentes de la sangre tan pronto como sea posible para limitar la muerte VEC y la contaminación bacteriana. Antibióticos y antimicóticos no son aconsejables en esta etapa, ya que son potencialmente dañinas para el VEC.
- Aislar valvas de las válvulas (3 por válvula) directamente de la raíz y el lugar en un tubo cónico de 15 ml estéril llena con 12 ml de DPBS frío. Agite varias veces para eliminar los residuos y relleno con DPBS fresco.
- Transporte al laboratorio en hielo.
- A su llegada al laboratorio, colocar el recipiente con el tejido debajo de la campana estéril.
3. El aislamiento de la capa endotelial
- Llenar un plato de 35 mm estéril con 3 ml de solución de colagenasa frío por la válvula (3 hojas).
- Coloque los tres folletos del tubo de 15 ml en el plato lleno con la solución de colagenasa.
- Incubar el tejido durante 5-10 minutos a 37 ° C.
- Retire con cuidado la capa endotelial de rotación de un hisopo estéril seco sobre la superficie de la hoja. El sentido de giro y la cantidad de cizalladura aplicada es fundamental para la pureza de la muestra. La rotación del algodón debe estar en una dirección opuesta al movimiento lineal de la mano la creación de un corte controlado. Este corte es lo que levanta las células endoteliales del tejido. La cantidad de fuerza aplicada debe ser suficiente para sentir la resistencia del tejido, pero no penetran en la membrana basal.
- De vez en cuando, aplique el hisopo dentro de la solución de colagenasa para separar las células de las fibras de la punta. Después de hisopado se haya completado, la textura de la capa endotelial debe sentirse un poco más suave que antes.
- Recoger la suspensión de células / colagenasa y la transferencia a un nuevo tubo de 15 ml estéril.
- Centrifugar los tubos a 1000 rpm durante 5 minutos para que sedimenten las células aisladas y aspirar el sobrenadante. Si el aislamiento de células intersticiales, así, lleve a cabo ese protocolo, mientras que estas células se centrifugan.
- Añadir 3 ml de medio porcino endotelial a la tubos de 15 ml, centrifugar por segunda vez, y los medios de comunicación aspirado. Esta segunda centrifugación ayuda a filtrar algunos de los materiales no deseados, como las fibras de la punta.
- Vuelva a suspender las células endoteliales se centrifuga en 5 ml de medio porcino endoteliales y las células de la placa en un pre-recubiertos frasco T-25 con colágeno (use un frasco por cada tubo de centrífuga).
- Deje que las células crecen por lo menos 2-3 días antes de cambiar el medio endoteliales. Esto ayuda a que las células se dividen y se recuperan desde el proceso de aislamiento es muy duro y el rendimiento celular puede ser baja. Es muy importante para las células paso cerca de la confluencia ya que la inhibición de contacto podría conducir a la transformación celular.
4. Preparación de la placa de cultivo de 60 mm de aislamiento secundarios específicos
- La línea de 60 mm de vidrio placas de Petri con papel de aluminio (2 platos de vidrio por leaflet). El papel de aluminio ayuda a eliminar la parafina, para que el plato Petri de vidrio se puede reutilizar para otros aislamientos.
- Lugar bolas de parafina en los platos, hasta la mitad, y la cobertura de tratamiento en autoclave.
- Una vez que el autoclave se ha completado y la parafina se funde, se mueve el conjunto de plato para una superficie plana y fría. A medida que la parafina se enfría, se endurece y crea una capa que apoyará a los pinchazos de la aguja.
- Después de 30 minutos, el plato esterilizada se puede utilizar como una cámara de aislamiento para inmovilizar el tejido folleto.
5. El aislamiento de lado de la capa endotelial específico
- Retire los folletos de los tubos de 15 ml y coloque en un plato de cultivo preparados para el aislamiento de 60 mm secundarios específicos.
- Manipular el volante para que el lado ventricularis está boca abajo sobre la superficie de la parafina, dejando la parte fibrosa expuestos. Pin de los bordes de la hoja para exponer la capa endotelial.
- Ponga unas gotas de la colagenasa en frío en cada superficie (arriba de cara) endotelial e incubar el tejido durante 5-10 minutos a 37 ° C.
- Al igual que antes, retire suavemente la capa endotelial de rotación de un hisopo estéril seco sobre la superficie de la hoja. El sentido de giro y la cantidad de cizalladura aplicada es fundamental para la pureza de la muestra. La rotación del algodón debe estar en una dirección opuesta al movimiento lineal de la mano la creación de un corte controlado. Este corte es lo que levanta las células endoteliales de los tejidos y nada más. La cantidad de fuerza aplicada debe ser suficiente para sentir la resistencia del tejido, pero no penetra en el tejido.
- De vez en cuando, aplique el hisopo dentro de la solución de colagenasa para separar las células de las fibras de la punta. Después de hisopado se haya completado, la textura de la capa endotelial debe sentirse un poco más suave que antes.
- Recoger la suspensión de células / colagenasa y la transferencia a un nuevo tubo de 15 ml estéril. Indican especificidad lado de la etiqueta (folletos de la misma válvula se pueden agrupar entre sí).
- La transferencia de los prospectos para una placa de cultivo nuevo para que el lado ventricularis quedará al descubierto y repita los pasos (5.3 a 5.6).
- Una vez que todos suspensión celular / colagenasa se recoge, centrifugue los tubos a 1000 rpm durante 5 minutos para que sedimenten las células aisladas y aspirar el sobrenadante. Si el aislamiento de células intersticiales, así, lleve a cabo ese protocolo, mientras que estas células se centrifugan.
- Añadir 3 ml de medio porcino endotelial a los tubos de centrífuga por segunda vez, y aspirar los medios de comunicación. Esta segunda centrifugación ayuda a filtrar algunos de los materiales no deseados, como las fibras de la punta.
- Vuelva a suspender las células endoteliales se centrifuga en 5 ml de medio porcino endoteliales y las células de la placa en un pre-recubrimiento T-25 matraz con collage (use un frasco por cada tubo de centrífuga).
- Deje que las células crecen por lo menos 2-3 días antes de cambiar el medio endoteliales. Esto ayuda a que las células se dividen y se recuperan desde el proceso de aislamiento es bastante dura. Si nota que el rendimiento sea muy bajo, considere a un matraz pequeño o una placa y desde las células de adhesión celular promueve el crecimiento celular. Recuerde que paso cerca de la confluencia ya que la inhibición de contacto podría conducir a la transformación celular.
6. El aislamiento de las células intersticiales
- Llene un tubo de centrífuga estéril 15 ml con 10 ml de solución de colagenasa por válvula (3 folletos).
- Después de limpiando los folletos de las células endoteliales, inmediatamente el lugar en el tubo de 15 ml con la adecuada solución de colagenasa.
- Se incuba durante aproximadamente 12 a 18 horas (agitar suavemente, si lo desea).
- Mezclar el tejido degradado suavemente con una pipeta serológica hasta que la suspensión de células / colagenasa se homogeniza. Esta homogeneización ayuda a romper el tejido y la liberación de las células intersticiales.
- Centrifugar el tejido digerido durante 5 minutos a 1000 rpm y aspirar el sobrenadante.
- Añadir 5 ml de medio porcino intersticial a los tubos de 15 ml, centrifugar por segunda vez, y aspirar sobrenadante.
- Vuelva a suspender las células endoteliales se centrifuga en 5 ml de medio porcino intersticial y la placa de las células en un frasco T-75 (uso de un frasco por cada tubo de centrífuga).
- Deje que las células crecen por lo menos 1-2 días antes de cambiar el medio de células intersticiales. Habrá restos mucho más tejido que con las células endoteliales, pero que se espera. Las células también debe crecer hasta la confluencia más rápido que las células endoteliales, debido a la producción de células y su naturaleza.
7. Imágenes representativas

Figura 1. La morfología de las células aisladas de 2-3 días después de la aislamiento. (A) VEC presentan una morfología típica endoteliales y formar grupos para promover el crecimiento. (B) VIC morfología es similar a miofibroblastos que por lo general en forma de huso y dispersándose por todo el frasco.
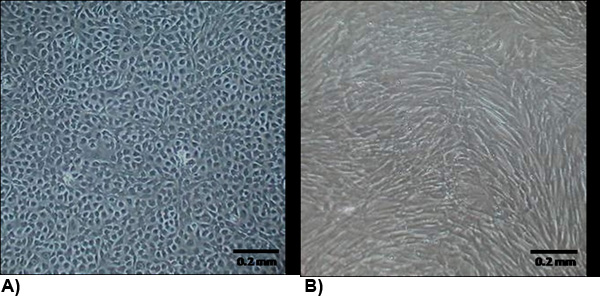
Figura 2. La morfología de las células aisladas en la confluencia. (A) VEC presentan una morfología típica endoteliales, que son generalmente de adoquines y el contacto inhibe el crecimiento. (B) VIC morfología es similar a miofibroblastos que por lo general en forma de huso y no inhibe el crecimiento de contacto.
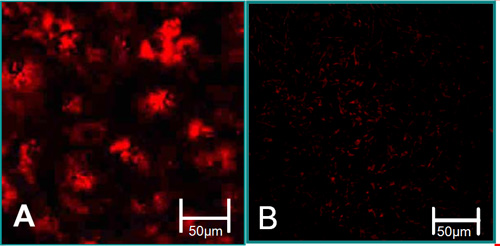
Figura 3. Las características de la función de las células aisladas 6. (A) VEC están asociados con altos niveles de captación de LDL acetilada (rojo). (B) VIC están asociados con bajos niveles de captación de LDL acetilada.
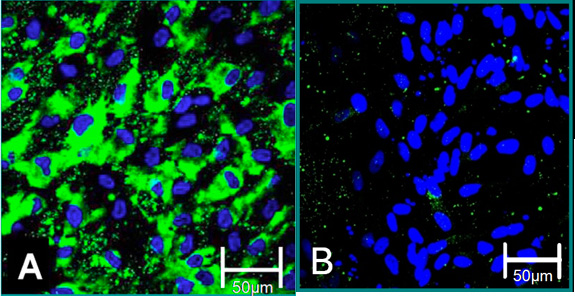
Figura 4. Marcadores celulares de células aisladas 6. (A) fenotipo VEC se contribuye a una tinción positiva para el factor von Willebrand (verde), azul (núcleos). (B) fenotipo VIC es una contribución a la tinción negativa de factor von Willebrand.
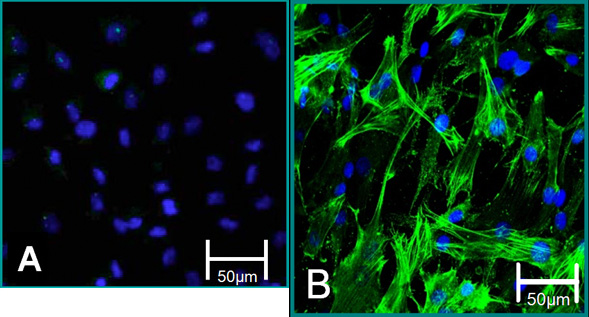
Figura 5. Marcadores celulares de células aisladas. (A) fenotipo VEC es una contribución a la tinción negativa para el alfa SMA (verde), azul (núcleos). (B) fenotipo VIC se contribuye a una tinción positiva para el SMA alfa.
| Agente de la disociación | La disociación Técnica | La recogida de células | Cantidad de células | Célula Pureza | Contaminación |
| EDTA (3 mM) sin CaCl2 | 5, 20, 60 min. Además antes de CaCl2 | 20, 60, 120 min. antes de la recolección | - | + / - | + + + |
| EDTA (6 mm) sin CaCl2 | 5, 20, 60 min. Además antes de CaCl2 | 20, 60, 120 min. antes de la recolección | + / - | + | + + + |
| Tripsina-EDTA (0,5 g / L) | 5, 10, 15 min. antes de la desactivación | Medio de recogida inmediatamente | + | + | + + |
| Colagenasa II (300 U / mL) | 5, 10, 15 min. antes de la desactivación | Medio de recogida inmediatamente | -, +, + + | -, + +, + | + |
| Colagenasa II (600 U / mL) | 5, 10, 15 min. antes de la desactivación | Medio de recogida inmediatamente | +, + +, + + + | + +, + +, - | - |
Tabla 1. Resultados preliminares de los protocolos de las células endoteliales valvular aislada.
Access restricted. Please log in or start a trial to view this content.
Discusión
La comprensión de la biología valvular se ha visto afectada por las dificultades técnicas de aislamiento y cultivo de poblaciones puras de células endoteliales valvular. Técnicas típicas de aislamiento implican digestión enzimática de la matriz subyacente basal o químicos de disociación de las uniones adhesivas endotelial 2,3. Los experimentos preliminares de aislamiento se evaluaron cualitativamente mediante la variación de los agentes de la disociación y el período de incubación. Los resultado...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Agradecimientos
Esta investigación es apoyada por el premio CARRERA NSF, la Fundación Hartwell, y la Asociación Americana del Corazón (# 0830384N).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium | Mediatech, Inc. | 50-103-PB | |
| Fetal Bovine Serum | GIBCO, by Life Technologies | 26140 | |
| Penicillin Streptomycin | GIBCO, by Life Technologies | 15140-122 | |
| 0.25% Trypsin-EDTA | GIBCO, by Life Technologies | 25200 | |
| Heparin Sodium Salt | Sigma-Aldrich | H4784-1G | |
| Collagenase Type 2 | Worthington Biochemical | LS004176 | |
| DPBS | GIBCO, by Life Technologies | 21300-058 | |
| Rat Tail Collagen | BD Biosciences | 354236 | |
| Critical Swabs | VWR international | 89031-270 | |
| Sodium Bicarbonate | Sigma-Aldrich | 55761 | |
| T25 Flasks | BD Biosciences | 353018 | |
| T75 Flasks | BD Biosciences | 353136 | |
| 24 Well Plate | Falcon BD | 353047 | |
| 60x15 mm Dishes | VWR international | 25384-092 | |
| 60x15 Glass Dishes | VWR international | 89000-310 | |
| Paraffin Embedding Wax | Electron Microscopy Sciences | 19304-01 | |
| Precision Glide Needles | BD Biosciences | 305165 | |
| 500 mL Nalgene Filters | VWR international | 73520-985 | |
| 1L Nalgene Filters | VWR international | 73520-986 | |
| Tissue Forceps | Fine Science Tools | 11023-15 | |
| FSC Tweezers #5 | Fine Science Tools | 11295-00 |
Referencias
- Thompson, R. P., Fitzharris, T. P. Morphogenesis of the truncus arteriosus of the chick embryo heart: the formation and migration of mesenchymal tissue. Am J Anat. 154, 545-556 (1979).
- Johnson, C. M., Fass, D. N. Porcine cardiac valvular endothelial cells in culture: A relative deficiency of fibronectin synthesis in vitro. Lab Invest. 49 (5), 589-598 (1983).
- Manduteanu, I., Popov, D., Radu, A., Simionescu, M. Calf cardiac valvular endothelial cells in culture: production of glycosaminoglycans, prostacyclin and fibronectin. J Mol Cell Cardiol. 20 (2), 103-118 (1988).
- Cheunyg, W. Techniques for isolating and purifying porcine aortic valve endothelial cells. JHVD. 17 (6), 674-681 (2008).
- Paranya, G., Vineberg, S., Dvorin, E., Kaushal, S., Roth, S. J., Rabkin, E., Schoen, F. J., Bischoff, J. Aortic valve endothelial cells undergo transforming growth factor-beta-mediated and non-transforming growth factor-beta-mediated transdifferentiation in vitro. Am J Pathol. 159 (4), 1335-1343 (2001).
- Butcher, J. T., Penrod, A., Garcia, A. J. M., Nerem, R. M. Unique morphology and focal adhesion development of valvular endothelial cells in static and fluid flow environments. Arterioscler Thromb Vasc Bio. 24 (1), 1429-1434 (2004).
- Simmons, C. A., Grant, G. R., Manduchi, E., Davies, P. F. Spatial heterogeneity of endothelial phenotypes correlates with side-specific vulnerability to calcification in normal porcine aortic valves. Circ Res. 96, 792-799 (2005).
- Butcher, J. T., Tressel, S., Johnson, T., Turner, D., Sorescu, G., Jo, H., Nerem, R. M. Transcriptional Profiles of Valvular and Vascular Endothelial Cells Reveal Phenotypic Differences: Influence of Shear Stress. Arterioscler Thromb Vasc Biol. 26, 69-69 (2006).
- Parachuri, S., Yang, J. H., Aikawa, E., Melero-Martin, J. M., Khan, Z. A., Loukogeorgakis, S., Schoen, F. J., Bischoff, J. Human Pulmonary Valve Progenitor Cells Exhibit Endothelial/Mesenchymal Plasticity in Response to Vascular Endothelial Growth Factor-A and Transforming Growth Factor-β2. Circ Res. 99 (8), 861-869 (2006).
- Shi, Q. Evidence for circulating bone marrow-derived endothelial cells. Blood. 92, 362-367 (1998).
- Rehman, J., Li, J., Orschell, C. M., March, K. L. Peripheral blood endothelial progenitor cells are derived from monocyte/macrophages and secrete angiogenic growth factors. Circulation. 107, 1164-1169 (2003).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados