Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kapak Endotel Hücreleri İzolasyon
Bu Makalede
Özet
Yalıtma ve kalp kapakçığı endotel hücreleri (VEC) saf kültür popülasyonları için bir yöntem sağlar. VEC tüberkülü veya broşürün her iki taraftan da izole edilmiş ve hemen şu olabilir, altta yatan interstisyel hücre (VIC) izolasyonu basittir.
Özet
Kalp kapakçıkları, kardiyovasküler sistem üzerinden tek yönlü kan akışını sürdürmek için sadece siz sorumlusunuz. Bu ince, lifli dokuların bir ömrü üzerinden birkaç milyar kez açık ve kapalı olarak önemli bir mekanik streslere maruz kalmaktadır. Bu dokuların inanılmaz bir dayanıklılık endotel yerleşik kapak (VEC) ve interstisyel hücreler nedeniyle (VIC), yerel mekanik ve biyolojik sinyallere yanıt olarak sürekli onarım ve bozulmasina. Sadece son zamanlarda, bu hücrelerin in vitro deneyler önemli bir rol oynamıştır eşsiz davranışları anlamak için başladık . Özellikle zorlu VEC izolasyonu ve kültürü. Özel bakım andan itibaren doku son kaplama ile ev sahibi kaldırılır kullanılması gerekir. Burada doğrudan izolasyon, yan özel izolasyon, kültür ve VEC saf popülasyonlarının doğrulanması için protokoller mevcut. Biz nazik bir çubukla kazıma tekniği ile sadece yüzey hücreleri çıkarmak için enzimatik sindirim kullanın. Bu hücreler daha sonra bir tüp içine toplanır ve bir pelet içine santrifüj. Pelet sonra yeniden bekletildi ve kollajen ben matris ile kaplı öncesi kültür şişeler içine kaplama. Büyüme ve PECAM1 (CD31) gibi endotel spesifik belirteçler ifade inhibe VEC fenotip kişi tarafından onaylandıktan sonra, Von Willebrand Faktör (vWF) ve alfa-düz kas aktin (α-SMA) negatif ifade. VEC fonksiyonel özellikleri, yüksek asetillenmiş LDL düzeyleri ile ilişkilidir. Vasküler endotelyal hücrelerin aksine, VEC normalde embriyonik valf 1 oluşumu sırasında meydana gelen mezenşimin haline dönüştürmek için eşsiz bir kapasiteye sahip. Bu aynı zamanda in vitro kültüründe önemli ölçüde uzamış yazılan konfluent sırasında meydana gelebilir, bu yüzden bakım izdiham veya yakınındaki geçit yapılmalıdır. VEC izolasyondan sonra, VIC saf toplumlarda daha sonra kolayca elde edilebilir.
Protokol
1. Hazırlık
- Kapalı bir enstrüman Otoklav aşağıdaki öğeleri tepsi:
- Tırtıklı doku forseps - broşür doku taşıma için
- Doku makas (8 cm) - broşür doku ve yaprakçıkların kırpma
- Pamuk Swablar - broşür veya tüberkülü endotel tabakası izole için
- Steril kollajenaz çözüm olun
- 4.0 gram toz DMEM 250 mL 18 M su ekleyin.
- 1.11 gram sodyum bikarbonat ekleyin.
- Kollajenaz, 180.000 adet (600 U / ml) ekleyin.
- % 1 (3ml) Penisilin / Streptomisin ekleyin.
- PH 7.2 'ye çözüm ayarlayın.
- 270 ml çözüm getirin.
- 0.2 mikron filtre geçerek çözüm sterilize edin.
- % 10 (30 ml) steril fetal sığır serumu ekleyin.
- Steril endotel hücre orta olun
- 6.7 gram toz DMEM 400 mL 18 M su ekleyin.
- 1.85 gram sodyum bikarbonat ekleyin.
- (50 U / ml) 25.000 ünite heparin ekleyin.
- % 1 (5 mL) Penisilin / Streptomisin ekleyin.
- PH 7.2 'ye çözüm ayarlayın.
- 450 mL çözüm getirin.
- 0.2 mikron filtre geçerek çözüm sterilize edin.
- % 10 (50 ml) steril fetal sığır serumu ekleyin.
- Steril interstisyel hücre orta olun
- 13.37 gram toz DMEM 800 mL 18 M su ekleyin.
- 3.7 gram sodyum bikarbonat ekleyin.
- % 1 (10 ml) Penisilin / Streptomisin ekleyin.
- PH 7.2 'ye çözüm ayarlayın.
- 900 mL çözüm getirin.
- 0.2 mikron filtre geçerek çözüm sterilize edin.
- % 10 (100 ml) steril sığır serumu ekleyin.
2. Kalp Vana Broşürler izolasyonu
- Aort kökü kurban sonra kalp ve hemen aseptik Vergi.
- Kan aort kökü soğuk steril DPBS ile iyice durulayın. VEC ölüm ve bakteriyel kontaminasyon sınırlamak için tüm kan bileşenleri en kısa sürede kaldırmak için zorunludur. Antibiyotikler ve antimikotikleri VEC potansiyel zararlı olduğundan bu aşamada önerilmemektedir.
- Doğrudan, 12 mL soğuk DPBS dolu steril 15 ml konik tüp kök ve yerden kapakçıkların (3 valf başına) yalıtın. Taze DPBS enkaz ve dolum kaldırmak için birkaç kez çalkalayınız.
- Buz üzerinde laboratuar geri taşınması.
- Laboratuarda varışta, steril kaputun altındaki doku ile kap yerleştirin.
3. Endotel Katman İzolasyonu
- Valf başına soğuk kollajenaz çözüm (3 broşürler) 3ml steril bir 35mm çanak doldurun.
- Kollajenaz çözümü ile dolu çanak içine 15 ml tüp üç broşürler yerleştirin.
- 37 5-10 dakika doku inkübe ° C
- Endotel tabakası broşürün yüzeyine kuru steril bir çubukla çevirerek yavaşça çıkarın. Kayma uygulanan dönme yönü ve miktarı numune saflık için kritik öneme sahiptir. Çubukla dönme elinizi doğrusal hareket kontrollü bir kesme oluşturmak için bir ters yönde olmalıdır. Bu kayma, doku endotel hücreleri ne asansörleri. Kuvvet uygulanan miktar doku direnci hissediyorum ama, bazal membran nüfuz için yeterli olmalıdır.
- Bazen, dab kollajenaz çözüm içindeki çubukla ucu lifleri hücreleri çıkarmak için. Sürüntü tamamlandıktan sonra, endotel tabakasının doku öncesine göre biraz daha yumuşak hissediyorum gerekir.
- Hücre süspansiyonu / kollajenaz toplayın ve yeni bir 15 mL steril tüp transferi.
- Pelet için 5 dakika herhangi bir izole hücreler için tüpleri 1000 rpm'de santrifüj ve süpernatant aspirat. Iyi interstisyel hücreler izole Eğer bu hücreler santrifüj edilirken, bu protokol yapmak.
- 3 ml, 15 ml tüpler endotel porcine orta, ikinci kez santrifüj ve aspirat medya. Bu ikinci santrifüj ucu lifleri gibi bazı istenmeyen malzeme filtre yardımcı olur.
- Santrifüje endotel hücreleri, kolajen ile bir ön kaplı T-25 balonuna (kullanım santrifüj tüp başına 1 balon) 5 ml endotel porcine orta ve plaka hücrelerin yeniden askıya.
- Hücrelerin endotel orta değiştirmeden önce en az 2-3 gün büyümesine izin. Bu hücrelerin kurtarmak ve izolasyon işlemi oldukça sert ve hücre verimi düşük olabilir bu yana bölmek yardımcı olur. Temas inhibisyonu hücre dönüşümün yol açabileceği için izdiham yakın geçiş hücreleri için çok önemlidir.
4. Side Özel İzolasyon 60 mm Kültür Bulaşık hazırlanması
- Alüminyum folyo ile (Line 60 mm cam petri kaplarına leafle başına 2 cam yemeklerit). Alüminyum folyo, cam petri diğer izolasyonların yeniden böylece, parafin giderilmesine yardımcı olur.
- Yaklaşık yarısı dolu, bulaşıkları içinde parafin boncuklar yerleştirin ve otoklav için kapak.
- Otoklav tamamlandı ve parafin eritilmiş sonra, serin bir düz yüzeye çanak topluluk taşıyın. Parafin soğudukça, sertleşecek ve iğne destek olacak bir katman oluşturun.
- 30 dakika sonra, sterilize çanak broşür doku hareketsiz için bir izolasyon odası olarak kullanılan olabilir.
5. Side Özel Endotel Layer izolasyonu
- Broşürler tarafında belirli bir izolasyonu için hazırlanan 60mm kültür kaplarına 15 mL tüpler ve yerden çıkarın.
- Broşürün ventricularis yan fibrosa yan maruz bırakarak parafin yüzey üzerine yüzü aşağı bakacak şekilde işleyebilirsiniz. Endotel tabakasının açığa çıkarmak için broşürün kenarlarına iğne.
- 37 her biri için (yukarı doğru bakan) endotel yüzeyinde bir kaç damla soğuk kollajenaz koyun ve 5-10 dakika doku inkübe ° C
- Daha önce olduğu gibi, endotel tabakası broşürün yüzeyine kuru steril bir çubukla çevirerek yavaşça çıkarın. Kayma uygulanan dönme yönü ve miktarı numune saflık için kritik öneme sahiptir. Çubukla dönme elinizi doğrusal hareket kontrollü bir kesme oluşturmak için bir ters yönde olmalıdır. Bu kayma, doku ve başka bir şey endotel hücreleri kaldırır ne olduğunu. Kuvvet uygulanan miktar doku direnci hissediyorum, fakat doku içinde nüfuz etmez yeterli olacaktır.
- Bazen, dab kollajenaz çözüm içindeki çubukla ucu lifleri hücreleri çıkarmak için. Sürüntü tamamlandıktan sonra, endotel tabakasının doku öncesine göre biraz daha yumuşak hissediyorum gerekir.
- Hücre süspansiyonu / kollajenaz toplayın ve yeni bir 15 mL steril tüp transferi. Etiket üzerinde yan özgüllük (aynı valf broşürler bir araya toplanmış olabilir) belirtiniz.
- Ventricularis yan adımları tekrarlayın (5,3-5,6) maruz kalan ve böylece yeni bir kültür çanak broşürler aktarın.
- Tüm hücre süspansiyonu / kollajenaz toplandıktan sonra, pelet herhangi bir izole hücreler 5minutes için tüpleri 1000 rpm'de santrifüj ve süpernatant aspirat. Iyi interstisyel hücreler izole Eğer bu hücreler santrifüj edilirken, bu protokol yapmak.
- 3 ml tüpler endotel porcine orta, ikinci kez santrifüj ve medya aspirat. Bu ikinci santrifüj ucu lifleri gibi bazı istenmeyen malzeme filtre yardımcı olur.
- Santrifüje endotel hücreleri, kolaj (santrifüj tüpüne başına 1 balon) ile bir ön kaplı T-25 balon endotel porcine orta ve plaka hücrelerin 5 ml yeniden askıya.
- Hücrelerin endotel orta değiştirmeden önce en az 2-3 gün büyümesine izin. Bu hücreleri kurtarmak ve izolasyon işlemi oldukça sert olduğundan bölmek yardımcı olur. Verim çok düşük olduğunu fark ederseniz, daha küçük bir balon veya iyi plaka hareket, hücre-hücre adezyon, hücre büyümesini teşvik düşünün. Temas inhibisyonu hücre dönüşümün yol açabileceği için izdiham yakın geçiş unutmayın.
6. İnterstisyel Hücreleri İzolasyon
- Valf başına kollajenaz çözüm (3 broşürler) 10 ml ile 15 ml steril bir santrifüj tüpüne doldurun.
- Endotel hücreleri broşürler sürüntü sonra hemen kollajenaz çözümü ile ilgili 15 mL tüp koyun.
- Yaklaşık 12 ila 18 saat boyunca inkübe edin (hafifçe ajitasyon istenirse).
- Serolojik bir pipet yardımıyla hücre süspansiyonu / kollajenaz homojenize olana kadar bozulmuş doku hafifçe karıştırın. Bu homojenizasyon doku break up ve interstisyel hücreleri serbest yardımcı olur.
- 1000 rpm'de 5 dakika sindirilir doku Santrifüj ve süpernatant aspire.
- 15 mL tüplere 5 ml interstisyel porcine orta, ikinci kez santrifüj ve supernate aspire.
- Santrifüj 5 ml interstisyel porcine orta ve plaka hücrelerin endotel hücreleri yeniden askıya T-75 balonuna (santrifüj tüp başına 1 şişesi kullanın).
- Interstisyel hücre orta değiştirmeden önce en az 1-2 gün hücrelerin büyümesini sağlar. Beklenen endotel hücreleri, fakat çok daha fazla doku enkaz olacak. Hücreler de hücre verim ve doğaları nedeniyle endotel hücreleri daha hızlı izdiham büyümek gerekir.
7. Temsilci Görüntüler

Şekil 1: 2-3 gün yazılan izolasyon izole hücrelerinin morfolojisi. (A) VEC tipik bir endotel morfolojisi ve form büyümeyi teşvik etmek için kümeler sergilerler. (B) VIC morfolojisi, genellikle iğsi ve şişeyi boyunca yayılır miyofibroblastlar benzer.
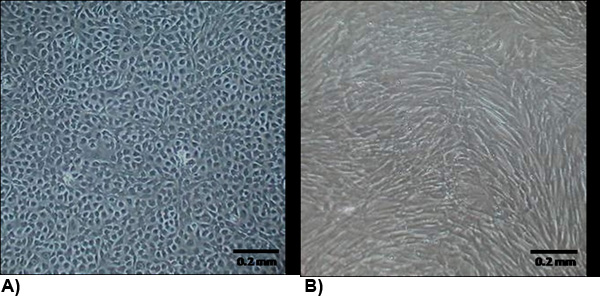
Şekil 2 confluency izole hücrelerinin morfolojisi. (A) VEC genellikle Arnavut kaldırımlı ve büyüme temas inhibe tipik bir endotel morfolojisi sergilerler. (B) VIC morfoloji, genel olarak iğsi ve büyüme temas inhibe miyofibroblastlar benzer.
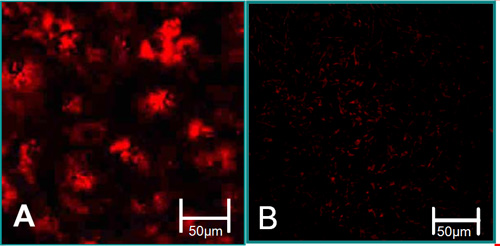
Şekil 3. izole hücrelerinin işlevi özellikleri 6. (A) VEC asetillenmiş LDL alımını yüksek seviyede (kırmızı) ile ilişkilidir. (B) VIC asetillenmiş LDL alımını düşük seviyeleri ile ilişkilidir.
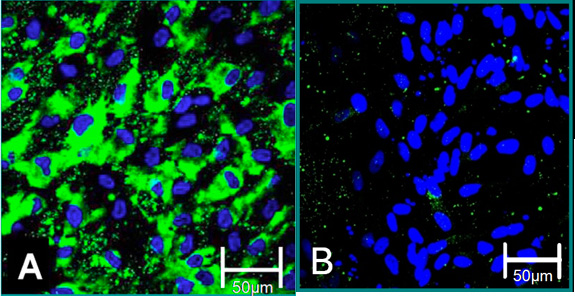
Şekil 4 izole hücrelerin 6 Hücresel belirteçleri. (A) VEC fenotip Von Willebrand Faktör (yeşil), mavi (çekirdekleri) pozitif boyanma katkıda. (B) VIC fenotip Von Willebrand Faktörü negatif boyama katkıda bulunulmuştur.
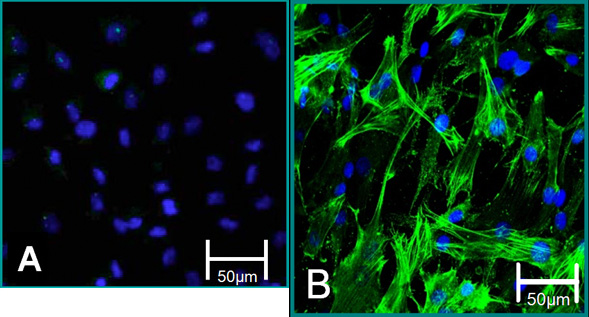
Şekil 5 izole hücrelerin hücresel belirteçleri. (A) alfa SMA (yeşil), mavi (çekirdekleri) için negatif boyama VEC fenotipe katkıda bulunulmuştur. (B) VIC fenotip alfa SMA pozitif boyanma katkıda bulunulmuştur.
| Disosiyasyon Ajan | Disosiyasyon Tekniği | Hücre Toplama | Hücre Miktar | Hücre Saflık | Bulaşma |
| CaCl 2 olmadan EDTA (3mm) | 5, 20, 60 dk. CaCl 2 ek önce | 20, 60, 120 dk. toplama önce | - | + / - | + + + |
| CaCl 2 olmadan EDTA (6mm) | 5, 20, 60 dk. CaCl 2 ek önce | 20, 60, 120 dk. toplama önce | + / - | + | + + + |
| Tripsin-EDTA (0.5 g / L) | 5, 10, 15 dk. deaktivasyon önce | Orta hemen toplanan | + | + | + + |
| Kollajenaz II (300 U / ml) | 5, 10, 15 dk. deaktivasyon önce | Orta hemen toplanan | -, + + + | - + + + | + |
| Kollajenaz II (600 U / ml) | 5, 10, 15 dk. deaktivasyon önce | Orta hemen toplanan | + + + + + + | + + + + - | - |
Tablo 1 sonuçtan ön kapak endotel hücre izolasyonu protokolleri.
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Kapak biyoloji bir anlayış izole teknik zorluklar ve kapak endotelyal hücrelerin kültür saf popülasyonları tarafından bozulmuş oldu. Tipik izolasyon teknikleri, altta yatan bazal matris veya endotel yapışkan bağları 2,3 kimyasal disosiasyon enzimatik sindirim içerir . Ön izolasyon deneyleri niteliksel disosiasyon ajanlar ve farklı inkübasyon süreleri değerlendirildi. Bu deneylerin sonuçları, 60 dakika kadar EDTA (veya tripsin-EDTA) kuluçka yerinden oynatmamaya hücreleri başarısız old...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Teşekkürler
Bu araştırma, NSF KARİYER ödülü, Hartwell Vakfı ve Amerikan Kalp Derneği (# 0830384N) tarafından desteklenmektedir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium | Mediatech, Inc. | 50-103-PB | |
| Fetal Bovine Serum | GIBCO, by Life Technologies | 26140 | |
| Penicillin Streptomycin | GIBCO, by Life Technologies | 15140-122 | |
| 0.25% Trypsin-EDTA | GIBCO, by Life Technologies | 25200 | |
| Heparin Sodium Salt | Sigma-Aldrich | H4784-1G | |
| Collagenase Type 2 | Worthington Biochemical | LS004176 | |
| DPBS | GIBCO, by Life Technologies | 21300-058 | |
| Rat Tail Collagen | BD Biosciences | 354236 | |
| Critical Swabs | VWR international | 89031-270 | |
| Sodium Bicarbonate | Sigma-Aldrich | 55761 | |
| T25 Flasks | BD Biosciences | 353018 | |
| T75 Flasks | BD Biosciences | 353136 | |
| 24 Well Plate | Falcon BD | 353047 | |
| 60x15 mm Dishes | VWR international | 25384-092 | |
| 60x15 Glass Dishes | VWR international | 89000-310 | |
| Paraffin Embedding Wax | Electron Microscopy Sciences | 19304-01 | |
| Precision Glide Needles | BD Biosciences | 305165 | |
| 500 mL Nalgene Filters | VWR international | 73520-985 | |
| 1L Nalgene Filters | VWR international | 73520-986 | |
| Tissue Forceps | Fine Science Tools | 11023-15 | |
| FSC Tweezers #5 | Fine Science Tools | 11295-00 |
Referanslar
- Thompson, R. P., Fitzharris, T. P. Morphogenesis of the truncus arteriosus of the chick embryo heart: the formation and migration of mesenchymal tissue. Am J Anat. 154, 545-556 (1979).
- Johnson, C. M., Fass, D. N. Porcine cardiac valvular endothelial cells in culture: A relative deficiency of fibronectin synthesis in vitro. Lab Invest. 49 (5), 589-598 (1983).
- Manduteanu, I., Popov, D., Radu, A., Simionescu, M. Calf cardiac valvular endothelial cells in culture: production of glycosaminoglycans, prostacyclin and fibronectin. J Mol Cell Cardiol. 20 (2), 103-118 (1988).
- Cheunyg, W. Techniques for isolating and purifying porcine aortic valve endothelial cells. JHVD. 17 (6), 674-681 (2008).
- Paranya, G., Vineberg, S., Dvorin, E., Kaushal, S., Roth, S. J., Rabkin, E., Schoen, F. J., Bischoff, J. Aortic valve endothelial cells undergo transforming growth factor-beta-mediated and non-transforming growth factor-beta-mediated transdifferentiation in vitro. Am J Pathol. 159 (4), 1335-1343 (2001).
- Butcher, J. T., Penrod, A., Garcia, A. J. M., Nerem, R. M. Unique morphology and focal adhesion development of valvular endothelial cells in static and fluid flow environments. Arterioscler Thromb Vasc Bio. 24 (1), 1429-1434 (2004).
- Simmons, C. A., Grant, G. R., Manduchi, E., Davies, P. F. Spatial heterogeneity of endothelial phenotypes correlates with side-specific vulnerability to calcification in normal porcine aortic valves. Circ Res. 96, 792-799 (2005).
- Butcher, J. T., Tressel, S., Johnson, T., Turner, D., Sorescu, G., Jo, H., Nerem, R. M. Transcriptional Profiles of Valvular and Vascular Endothelial Cells Reveal Phenotypic Differences: Influence of Shear Stress. Arterioscler Thromb Vasc Biol. 26, 69-69 (2006).
- Parachuri, S., Yang, J. H., Aikawa, E., Melero-Martin, J. M., Khan, Z. A., Loukogeorgakis, S., Schoen, F. J., Bischoff, J. Human Pulmonary Valve Progenitor Cells Exhibit Endothelial/Mesenchymal Plasticity in Response to Vascular Endothelial Growth Factor-A and Transforming Growth Factor-β2. Circ Res. 99 (8), 861-869 (2006).
- Shi, Q. Evidence for circulating bone marrow-derived endothelial cells. Blood. 92, 362-367 (1998).
- Rehman, J., Li, J., Orschell, C. M., March, K. L. Peripheral blood endothelial progenitor cells are derived from monocyte/macrophages and secrete angiogenic growth factors. Circulation. 107, 1164-1169 (2003).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır