Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Isolierung von Valvular Endothelzellen
In diesem Artikel
Zusammenfassung
Wir stellen eine Methode zur Isolierung und Kultivierung von reinen Populationen von Herzklappen-Endothelzellen (VEC). VEC von beiden Seiten der Höcker oder Prospekt isoliert werden können und unmittelbar nach ist zugrundeliegenden interstitiellen Zellen (VIC) Isolierung einfach.
Zusammenfassung
Herzklappen sind allein verantwortlich für unidirektionale Blutfluss durch das Herz-Kreislauf-System. Diese dünne, faserige Gewebe zu erheblichen mechanischen Belastungen, wie sie öffnen und schließen mehrere Milliarden Mal im Lauf ihres Lebens ausgesetzt. Die unglaubliche Ausdauer dieser Gewebe ist aufgrund der ansässigen valvular Endothelzellen (VEC) und interstitiellen Zellen (VIC), die ständig repariert und neu zu gestalten als Reaktion auf lokale mechanische und biologische Signale. Erst vor kurzem haben wir begonnen, das einzigartige Verhalten dieser Zellen, für die in vitro Experimente eine wichtige Rolle gespielt hat, zu verstehen. Besonders herausfordernd ist die Isolierung und Kultivierung von VEC. Besondere Sorgfalt verwendet ab dem Zeitpunkt der Gewebe vom Host bis zur endgültigen Beschichtung entfernt werden. Hier präsentieren wir Protokolle zur direkten Isolierung, Seite spezifische Isolierung, Kultur, und die Überprüfung der reinen Populationen von VEC. Wir verwenden enzymatische Verdauung durch eine sanfte Tupfer Schabetechnik nur oberflächlichen Zellen verdrängen gefolgt. Diese Zellen werden dann in ein Röhrchen gesammelt und zentrifugiert zu einem Pellet. Das Pellet wird dann resuspendiert und in Kulturflaschen vorbeschichtet mit Kollagen I-Matrix. VEC-Phänotyp wird durch den Kontakt bestätigt gehemmt Wachstum und die Expression von endothelialen spezifische Marker wie PECAM1 (CD31), Von-Willebrand-Faktor (vWF) und negative Expression von alpha-smooth muscle actin (α-SMA). Die funktionellen Eigenschaften von VEC sind mit hoher acetylierte LDL assoziiert. Im Gegensatz zu vaskulären Endothelzellen, haben VEC die einzigartige Fähigkeit, sich in Mesenchym, was normalerweise während der Embryonalentwicklung Ventil Formation 1 zu transformieren. Dies kann auch während der deutlich längeren Beitrag konfluent in vitro-Kultur auftreten, so ist darauf zu, um den Durchgang an oder nahe Einmündung erfolgen. Nach VEC Isolation, können reine Populationen von VIC dann leicht erworben werden.
Protokoll
1. Vorbereitung
- Autoclave in einem überdachten Sterilisierkassettensystem die folgenden Punkte:
- Serrated Gewebe Zange - Für den Umgang mit der Broschüre Gewebe
- Tissue Schere (8 cm) - Zum Beschneiden Merkblatt Gewebe und Höcker
- Wattestäbchen - Zur Isolierung der Endothelschicht aus der Broschüre oder Höcker
- Machen Sie sterile Kollagenase-Lösung
- Add 4,0 g pulverisierte DMEM auf 250 mL von 18 MOhm Wasser.
- Add 1,11 Gramm Natriumbicarbonat.
- Add (600 U / mL) 180.000 Einheiten Kollagenase.
- Add 1% (3 ml) Penicillin / Streptomycin.
- Den pH-Wert der Lösung auf 7,2.
- Bringen Sie die Lösung bis zu 270 mL.
- Sterilisieren Sie die Lösung, indem sie durch einen 0,2 um Filter.
- Fügen Sie 10% (30 ml) steriler Rinderfötenserum.
- Machen Sie sterile Endothelzellen Medium
- Add 6,7 Gramm Pulver DMEM auf 400 mL von 18 MOhm Wasser.
- Add 1,85 Gramm Natriumbicarbonat.
- Add (50 U / mL) 25.000 Einheiten Heparin.
- Add 1% (5 ml) Penicillin / Streptomycin.
- Den pH-Wert der Lösung auf 7,2.
- Bringen Sie die Lösung bis zu 450 mL.
- Sterilisieren Sie die Lösung, indem sie durch einen 0,2 um Filter.
- Fügen Sie 10% (50 ml) steriler Rinderfötenserum.
- Machen Sie sterile interstitielle Zellmedium
- Add 13,37 g pulverisierter DMEM auf 800 mL von 18 MOhm Wasser.
- Add 3,7 g Natriumbicarbonat.
- Add 1% (10 ml) Penicillin / Streptomycin.
- Den pH-Wert der Lösung auf 7,2.
- Bringen Sie die Lösung bis zu 900 mL.
- Sterilisieren Sie die Lösung, indem sie durch einen 0,2 um Filter.
- Fügen Sie 10% (100 ml) steriler Rinderserum.
2. Isolierung von Herzklappenflügel
- Excise der Aortenwurzel sofort und aseptisch aus dem Herzen nach der Tötung.
- Spülen Sie die Aortenwurzel von Blut mit kaltem sterilem DPBS. Es ist zwingend notwendig, um alle Blutbestandteile so schnell wie möglich zu entfernen, um VEC Tod und bakterielle Kontamination zu begrenzen. Antibiotika und Antimykotika sind zu diesem Zeitpunkt nicht empfohlen, da sie potentiell schädlich für die VEC sind.
- Isolieren Klappensegel (3 pro Ventil) direkt von der Wurzel und in eine sterile 15 ml konische Röhrchen mit 12 ml kaltem DPBS gefüllt. Schütteln Sie mehrmals, um Schutt und wieder mit frischer DPBS entfernen.
- Transport ins Labor auf Eis.
- Bei der Ankunft im Labor, den Behälter mit dem Gewebe unter der sterile Haube.
3. Isolierung von Endothel
- Füllen Sie eine sterile 35mm Teller mit 3 ml kalte Collagenase-Lösung pro Ventil (3 Broschüren).
- Legen Sie alle drei Segel aus dem 15-ml-Tube in die Schale mit der Collagenase-Lösung gefüllt.
- Inkubieren des Gewebes für 5-10 Minuten bei 37 ° C.
- Entfernen Sie vorsichtig das Endothel durch Drehen einer trockenen sterilen Tupfer auf die Oberfläche des Blattes. Die Drehrichtung und Höhe der Scher-Anwendung ist entscheidend für die Reinheit Ihrer Probe. Die Rotation der Tupfer sollte in die entgegengesetzte Richtung in eine lineare Bewegung der Hand eine kontrollierte Scher werden. Diese Schere ist das, was hebt die Endothelzellen aus dem Gewebe. Der Betrag der Kraft angewendet werden sollte genug, um den Widerstand des Gewebes fühlen, aber nicht durchdringen die Basalmembran.
- Gelegentlich dab den Tupfer in der Collagenase-Lösung zu verdrängen Zellen von der Spitze Fasern. Nach Abtupfen abgeschlossen ist, sollte die Textur der Endothelschicht fühlen etwas glatter als zuvor.
- Sammeln Sie die Zellsuspension / Kollagenase und Übertragung auf einen neuen sterilen 15 ml Tube.
- Zentrifugieren Sie die Röhrchen bei 1000 rpm für 5 Minuten auf Pellet keine isolierten Zellen und saugen Überstand. Wenn isolieren interstitiellen Zellen sowie, führen das Protokoll, während diese Zellen werden zentrifugiert werden.
- Add 3 mL der endothelialen Schweine Medium, um die 15 ml Röhrchen, Zentrifuge ein zweites Mal, und saugen Medien. Diese zweite Zentrifugation hilft Filter einige der unerwünschten Materialien wie Spitze Fasern.
- Re-suspend der zentrifugierten Endothelzellen in 5 ml Endothelzellen vom Schwein mittel-und Platte die Zellen in einem vorbeschichteten T-25 Kolben mit Kollagen (Einsatz 1 Flasche pro Zentrifugenröhrchen).
- Lassen Sie die Zellen wachsen mindestens 2-3 Tage vor dem Ändern der endothelialen Medium. Dies hilft den Zellen wieder und teilen seit der Trennung Prozess ist ziemlich hart und die Zelle liefern kann niedrig sein. Es ist wichtig, um den Durchgang Zellen in der Nähe Zusammenfluss da der Kontakt Hemmung Zelltransformation führen könnte.
4. Vorbereitung von 60 mm Kulturschale für Side Specific Isolation
- Linie die 60 mm Petrischalen aus Glas mit Alu-Folie (2 Glasschalen pro leaflet). Die Aluminiumfolie hilft, das Paraffin zu entfernen, so dass das Glas-Petrischale für andere Isolierungen können wiederverwendet werden.
- Legen Paraffin Perlen innerhalb der Gerichte, etwa zur Hälfte gefüllt, und ein Cover für Autoklavieren.
- Nach dem Autoklavieren ist vollständig und Paraffin geschmolzen ist, bewegen Sie die Schüssel Ensemble zu einem kühlen ebene Fläche. Wie das Paraffin kühlt, wird es hart, und erstellen Sie eine Schicht, die Nadelstiche unterstützen wird.
- Nach 30 Minuten kann die sterilisiert Gericht dann als Isolation Kammer verwendet werden, um den Prospekt Gewebe zu fixieren.
5. Isolierung von Side Specific Endothelschicht
- Entfernen Sie die Blätter aus dem 15mL Rohre und am vorbereitet 60mm Kulturschale für Seite spezifische Isolierung.
- Bearbeiten Sie die Packungsbeilage, so dass die ventricularis Seite nach unten auf das Paraffin Oberfläche Verlassen des fibrosa Seite ausgesetzt. Pin den Rändern des Blattes auf die endotheliale Schicht freizulegen.
- Legen Sie ein paar Tropfen kalten Kollagenase auf jeder (nach oben gerichteten) Endotheloberfläche und inkubieren das Gewebe für 5-10 Minuten bei 37 ° C.
- Wie zuvor entfernen Sie vorsichtig das Endothel durch Drehen einer trockenen sterilen Tupfer auf die Oberfläche des Blattes. Die Drehrichtung und Höhe der Scher-Anwendung ist entscheidend für die Reinheit Ihrer Probe. Die Rotation der Tupfer sollte in die entgegengesetzte Richtung in eine lineare Bewegung der Hand eine kontrollierte Scher werden. Diese Schere ist das, was hebt die Endothelzellen aus dem Gewebe und sonst nichts. Der Betrag der Kraft angewendet werden sollte genug, um den Widerstand des Gewebes fühlen, aber nicht in das Gewebe eindringen.
- Gelegentlich dab den Tupfer in der Collagenase-Lösung zu verdrängen Zellen von der Spitze Fasern. Nach Abtupfen abgeschlossen ist, sollte die Textur der Endothelschicht fühlen etwas glatter als zuvor.
- Sammeln Sie die Zellsuspension / Kollagenase und Übertragung auf einen neuen sterilen 15 ml Tube. Geben Seite Spezifität auf dem Etikett (Flugblätter aus dem gleichen Ventil kann zusammengefasst werden müssen).
- Übertragen Sie die Flugblätter an eine neue Kulturschale, so dass die ventricularis Seite jetzt ausgesetzt ist, und wiederholen Sie die Schritte (5,3-5,6).
- Sobald alle Zellsuspension / Kollagenase gesammelt, zentrifugieren bei 1000 rpm für 5 Minuten auf Pellet keine isolierten Zellen und saugen Überstand. Wenn isolieren interstitiellen Zellen sowie, führen das Protokoll, während diese Zellen werden zentrifugiert werden.
- Add 3 mL der endothelialen Schweine Medium, um die Rohre, Zentrifuge ein zweites Mal, und saugen Medien. Diese zweite Zentrifugation hilft Filter einige der unerwünschten Materialien wie Spitze Fasern.
- Re-suspend der zentrifugierten Endothelzellen in 5 ml Endothelzellen vom Schwein mittel-und Platte die Zellen in einem vorbeschichteten T-25 Kolben mit Collage (Einsatz 1 Flasche pro Zentrifugenröhrchen).
- Lassen Sie die Zellen wachsen mindestens 2-3 Tage vor dem Ändern der endothelialen Medium. Dies hilft den Zellen wieder und teilen seit der Trennung Prozess ist ziemlich hart. Wenn Sie die Ausbeute sehr gering zu sein Hinweis, in Erwägung ziehen, auf einen kleineren Kolben oder Well-Platte seit Zell-Zell-Adhäsion fördert das Zellwachstum. Denken Sie daran, um den Durchgang in der Nähe Zusammenfluss da der Kontakt Hemmung Zelltransformation führen könnte.
6. Isolation der interstitiellen Zellen
- Füllen Sie eine sterile 15-ml-Zentrifugenröhrchen mit 10 ml Kollagenase-Lösung pro Ventil (3 Broschüren).
- Nach Abtupfen die Flugblätter von Endothelzellen sollten sofort in den entsprechenden 15mL Rohr mit der Collagenase-Lösung.
- Inkubieren für ca. 12 bis 18 Stunden (leicht bewegen, wenn gewünscht).
- Mix der abgebauten Gewebe vorsichtig mit einer serologischen Pipette bis Zellsuspension / Kollagenase wird homogenisiert. Diese Homogenisierung hilft brechen das Gewebe und lassen Sie die interstitiellen Zellen.
- Centrifuge der verdauten Gewebe 5 Minuten bei 1000 rpm und saugen Sie den Überstand.
- Add 5 mL interstitielle Schweine Medium, um die 15 ml Zentrifugenröhrchen, Zentrifuge ein zweites Mal, und saugen Überstand.
- Re-suspend der zentrifugierten Endothelzellen in 5 ml interstitiellen Schwein mittel-und Platte die Zellen in einem T-75-Kolben (Einsatz 1 Flasche pro Zentrifugenröhrchen).
- Lassen Sie die Zellen wachsen mindestens 1-2 Tage vor dem Ändern der interstitiellen Zellmedium. Es wird viel mehr Gewebereste, als mit den Endothelzellen, aber das ist zu erwarten. Die Zellen sollten auch zur Konfluenz schneller als die Endothelzellen, weil der Zelle Ertrag und ihrer Natur wachsen.
7. Vertreter Images

Abbildung 1. Die Morphologie der isolierten Zellen auf 2-3 Tage nach der Trennung. (A) VEC weisen eine typische endotheliale Morphologie und Cluster bilden, um Wachstum zu fördern. (B) VIC Morphologie ähnelt Myofibroblasten, die im Allgemeinen spindelförmig und gleichmäßig über den Kolben zu verbreiten.
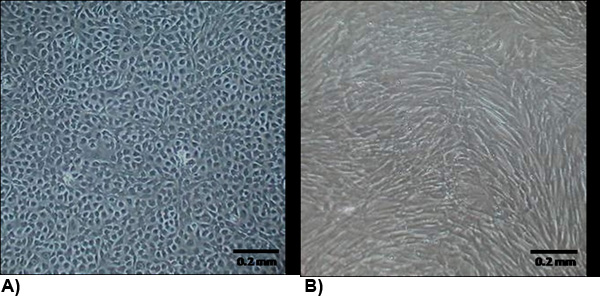
Abbildung 2. Die Morphologie der isolierten Zellen bei Konfluenz. (A) VEC weisen eine typische endotheliale Morphologie, die im Allgemeinen mit Kopfsteinpflaster und Wachstum Kontakt gehemmt. (B) VIC Morphologie ähnelt Myofibroblasten, die im Allgemeinen spindelförmig und nicht Wachstum Kontakt gehemmt.
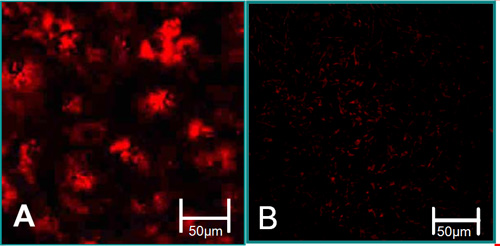
Abbildung 3. Die Funktion Eigenschaften der isolierten Zellen 6. (A) VEC sind mit hoher acetylierte LDL-Aufnahme (rot) verbunden. (B) VIC sind mit niedrigem acetyliertes LDL-Aufnahme verbunden sind.
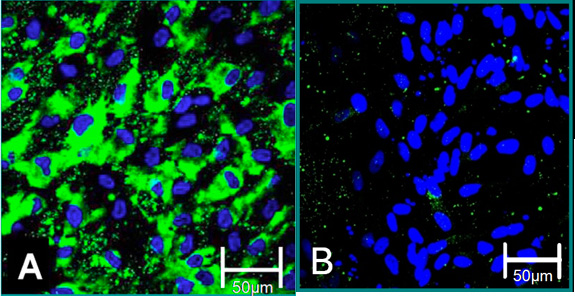
Abbildung 4. Cellular Marker isoliert Zellen 6. (A) VEC-Phänotyp ist eine positive Färbung für Von-Willebrand-Faktor (grün), blau (Kernen) beigetragen. (B) VIC Phänotyp ist, negative Färbung für Von-Willebrand-Faktor beigetragen.
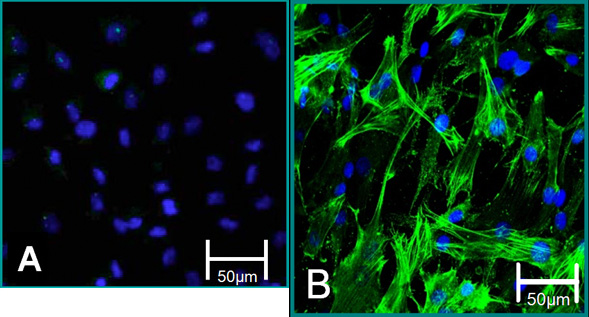
Abbildung 5. Cellular Marker der isolierten Zellen. (A) VEC-Phänotyp ist, negative Färbung für alpha SMA (grün), blau (Kernen) beigetragen. (B) VIC Phänotyp ist eine positive Färbung für alpha SMA beigetragen.
| Dissoziation Agenten | Dissoziation Technik | Zell-Sammlung | Zellmenge | Zelle Reinheit | Kontamination |
| EDTA (3mm) ohne CaCl 2 | 5, 20, 60 min. vor CaCl 2-Zugabe | 20, 60, 120 min. vor Abholung | - | + / - | + + + |
| EDTA (6mm), ohne CaCl 2 | 5, 20, 60 min. vor CaCl 2-Zugabe | 20, 60, 120 min. vor Abholung | + / - | + | + + + |
| Trypsin-EDTA (0,5 g / L) | 5, 10, 15 min. vor Deaktivierung | Medium gesammelt sofort | + | + | + + |
| Collagenase II (300 U / mL) | 5, 10, 15 min. vor Deaktivierung | Medium gesammelt sofort | -, +, + + | -, + +, + | + |
| Collagenase II (600 U / mL) | 5, 10, 15 min. vor Deaktivierung | Medium gesammelt sofort | + + + + + + | + +, + +, - | - |
Tabelle 1. Ergebnisse der vorläufigen valvular Endothelzellen isoliert Protokolle.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Ein Verständnis der Herzklappen Biologie hat durch technische Schwierigkeiten Isolierung und Kultivierung reine Populationen valvular Endothelzellen beeinträchtigt wurde. Typische Isolierung Techniken beinhalten enzymatische Verdauung der zugrunde liegenden basalen Matrix oder chemische Spaltung von Endothelzellen Klebeverbindungen 2,3. Vorläufige Isolation Experimente wurden qualitativ durch unterschiedliche Dissoziation Agenten und Inkubationszeiten untersucht. Die Ergebnisse dieser Experimente zeigten, ...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Danksagungen
Diese Forschung wird durch die NSF CAREER-Preis, der Hartwell-Stiftung und der American Heart Association (# 0830384N) unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium | Mediatech, Inc. | 50-103-PB | |
| Fetal Bovine Serum | GIBCO, by Life Technologies | 26140 | |
| Penicillin Streptomycin | GIBCO, by Life Technologies | 15140-122 | |
| 0.25% Trypsin-EDTA | GIBCO, by Life Technologies | 25200 | |
| Heparin Sodium Salt | Sigma-Aldrich | H4784-1G | |
| Collagenase Type 2 | Worthington Biochemical | LS004176 | |
| DPBS | GIBCO, by Life Technologies | 21300-058 | |
| Rat Tail Collagen | BD Biosciences | 354236 | |
| Critical Swabs | VWR international | 89031-270 | |
| Sodium Bicarbonate | Sigma-Aldrich | 55761 | |
| T25 Flasks | BD Biosciences | 353018 | |
| T75 Flasks | BD Biosciences | 353136 | |
| 24 Well Plate | Falcon BD | 353047 | |
| 60x15 mm Dishes | VWR international | 25384-092 | |
| 60x15 Glass Dishes | VWR international | 89000-310 | |
| Paraffin Embedding Wax | Electron Microscopy Sciences | 19304-01 | |
| Precision Glide Needles | BD Biosciences | 305165 | |
| 500 mL Nalgene Filters | VWR international | 73520-985 | |
| 1L Nalgene Filters | VWR international | 73520-986 | |
| Tissue Forceps | Fine Science Tools | 11023-15 | |
| FSC Tweezers #5 | Fine Science Tools | 11295-00 |
Referenzen
- Thompson, R. P., Fitzharris, T. P. Morphogenesis of the truncus arteriosus of the chick embryo heart: the formation and migration of mesenchymal tissue. Am J Anat. 154, 545-556 (1979).
- Johnson, C. M., Fass, D. N. Porcine cardiac valvular endothelial cells in culture: A relative deficiency of fibronectin synthesis in vitro. Lab Invest. 49 (5), 589-598 (1983).
- Manduteanu, I., Popov, D., Radu, A., Simionescu, M. Calf cardiac valvular endothelial cells in culture: production of glycosaminoglycans, prostacyclin and fibronectin. J Mol Cell Cardiol. 20 (2), 103-118 (1988).
- Cheunyg, W. Techniques for isolating and purifying porcine aortic valve endothelial cells. JHVD. 17 (6), 674-681 (2008).
- Paranya, G., Vineberg, S., Dvorin, E., Kaushal, S., Roth, S. J., Rabkin, E., Schoen, F. J., Bischoff, J. Aortic valve endothelial cells undergo transforming growth factor-beta-mediated and non-transforming growth factor-beta-mediated transdifferentiation in vitro. Am J Pathol. 159 (4), 1335-1343 (2001).
- Butcher, J. T., Penrod, A., Garcia, A. J. M., Nerem, R. M. Unique morphology and focal adhesion development of valvular endothelial cells in static and fluid flow environments. Arterioscler Thromb Vasc Bio. 24 (1), 1429-1434 (2004).
- Simmons, C. A., Grant, G. R., Manduchi, E., Davies, P. F. Spatial heterogeneity of endothelial phenotypes correlates with side-specific vulnerability to calcification in normal porcine aortic valves. Circ Res. 96, 792-799 (2005).
- Butcher, J. T., Tressel, S., Johnson, T., Turner, D., Sorescu, G., Jo, H., Nerem, R. M. Transcriptional Profiles of Valvular and Vascular Endothelial Cells Reveal Phenotypic Differences: Influence of Shear Stress. Arterioscler Thromb Vasc Biol. 26, 69-69 (2006).
- Parachuri, S., Yang, J. H., Aikawa, E., Melero-Martin, J. M., Khan, Z. A., Loukogeorgakis, S., Schoen, F. J., Bischoff, J. Human Pulmonary Valve Progenitor Cells Exhibit Endothelial/Mesenchymal Plasticity in Response to Vascular Endothelial Growth Factor-A and Transforming Growth Factor-β2. Circ Res. 99 (8), 861-869 (2006).
- Shi, Q. Evidence for circulating bone marrow-derived endothelial cells. Blood. 92, 362-367 (1998).
- Rehman, J., Li, J., Orschell, C. M., March, K. L. Peripheral blood endothelial progenitor cells are derived from monocyte/macrophages and secrete angiogenic growth factors. Circulation. 107, 1164-1169 (2003).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten