JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
판막병 내피 세포의 분리
요약
우리는 분리하고 심장 밸브 내피 세포 (VEC)의 culturing 순수한 인구를위한 방법을 제공합니다. VEC는 (雨 期) 또는 전단지의 양쪽으로부터 격리하고 즉시 다음과 같은 수 있습니다 기본 중간 세포 (VIC) 격리는 간단합니다.
초록
심장 판막은 심장 혈관 시스템을 통해 단방향 혈액 흐름을 유지하는 책임은 전적으로 귀하에게 있습니다. 이 얇고 섬유질 조직들은 수명 동안 억 여러 번 열고 닫는 등 상당한 기계적 스트레스를 받게됩니다. 이러한 조직의 놀라운 인내력은 내피 거주 판막병 (VEC)와 중간 세포에 의한 (VIC)는 지속적으로 지방 기계 및 생물 학적 신호에 대한 응답으로 수리 및 개조. 최근 우리는 시험 관내 실험에서 중요한 역할을 담당해 왔습니다있는 이들 세포의 독특한 행동을 이해하기 시작했다. 특히 도전은 VEC의 격리와 문화입니다. 특별한주의는 순간부터 조직이 최종 도금을 통해 호스트에서 제거됩니다 사용해야합니다. 여기 우리는 직접적인 고립, 측면 구체적인 고립, 문화, VEC의 순수한 인구의 검증을위한 프로토콜을 제시한다. 우리는 표면 세포를 이동시키다하는 부드러운 면봉 사장을 때릴 때의 기술 다음 효소 소화를 사용합니다. 이러한 세포는 다음 튜브에 수집하여 펠렛으로 centrifuged 있습니다. 펠렛은 다음 resuspended과 콜라겐 I 매트릭스 사전 코팅 문화 flasks로 도금입니다. VEC의 표현형가 접촉에 의해 확인하는 것은 성장과 같은 PECAM1 (CD31)로 내피 특정 마커의 표현을 저해, 폰 Willebrand 팩터 (vWF), 그리고 알파 - 부드러운 근육 굴지 (α - SMA)의 부정적인 표현. VEC의 기능적 특성은 acetylated LDL 높은 수준의와 관련된 있습니다. 혈관 내피 세포와는 달리, VEC는 일반적으로 배아 밸브 형성 한 동안 발생 mesenchyme로 변환하는 독특한 능력을했습니다. 이것은 또한 체외 문화에 크게 연장 게시물 합류하는 동안 발생할 수 있으므로주의가 합류 또는 가까운 통로로하여야한다. VEC 분리 후, VIC의 순수한 인구 그때 쉽게 취득하실 수 있습니다.
프로토콜
1. 준비
- 대상 기기에 압력솥은 다음 항목을 트레이 :
- 톱니 모양의 조직 포셉 - 전단지 조직을 처리
- 조직 가위 (8cm) - 전단지 조직 및 cusps을 트리밍을 위해
- 면화 면봉 - 전단지 또는 끝에서 내피 레이어를 격리 시킨것에 대한
- 무균 collagenase 솔루션을 확인하십시오
- 18 MΩ 물 250 ML에 가루 DMEM의 4.0 g을 추가합니다.
- 나트륨 중탄산염의 1.11 g을 추가합니다.
- (600 U / ML) collagenase의 180,000 단위를 추가합니다.
- 1퍼센트 (3mL) 페니실린 / 스트렙토 마이신을 추가합니다.
- 7.2 솔루션의 산도를 조정합니다.
- 270 ML에 대한 해결책을 가져 오십시오.
- 0.2 μm의 필터를 통과하여 솔루션을 소독.
- 무균 태아 소 혈청의 10 % (30mL) 추가합니다.
- 무균 내피 세포 미디어 만들기
- 18 MΩ 물 400 ML에 가루 DMEM의 6.7 g을 추가합니다.
- 나트륨 중탄산염의 1.85 g을 추가합니다.
- (50 U / ML) 헤파린의 25,000 단위를 추가합니다.
- 1퍼센트 (5mL) 페니실린 / 스트렙토 마이신을 추가합니다.
- 7.2 솔루션의 산도를 조정합니다.
- 450 ML에 대한 해결책을 가져 오십시오.
- 0.2 μm의 필터를 통과하여 솔루션을 소독.
- 무균 태아 소 혈청의 10 % (50mL)를 추가합니다.
- 무균 중간 세포 미디어를 확인
- 18 MΩ 물 800 ML에 가루 DMEM의 13.37 g을 추가합니다.
- 나트륨 중탄산염 3.7 g을 추가합니다.
- 1퍼센트 (10mL) 페니실린 / 스트렙토 마이신을 추가합니다.
- 7.2 솔루션의 산도를 조정합니다.
- 900 ML에 대한 해결책을 가져 오십시오.
- 0.2 μm의 필터를 통과하여 솔루션을 소독.
- 무균 소 혈청의 10 % (100mL)를 추가합니다.
2. 심장 밸브 전단지의 분리
- 희생 후 마음에서 즉시 무균 엑사이스 대동맥 루트.
- 철저하게 추위 무균 DPBS과 혈액의 대동맥 뿌리를 씻어. 그것은 VEC의 죽음과 박테리아 오염을 제한하는 모든 혈액 구성 요소를 가능한 한 빨리를 제거하는 필수적입니다. 그들은 VEC에 잠재적으로 해로운 있기 때문에 항생제와 antimycotics이 단계에서 권고하지 않습니다.
- 바로 12 ML 감기 DPBS 가득한 살균 15 ML 원뿔 관에 뿌리와 장소에서 밸브 전단지 (3 밸브 당) 분리. 신선한 DPBS와 파편과 리필을 제거하기 위해 여러 번 흔들어.
- 얼음에있는 실험실로 이송합니다.
- 실험실에 도착하자마자, 멸균 후드 아래에있는 조직과 용기를 놓습니다.
3. 내피 층의 분리
- 밸브마다 감기 collagenase 솔루션 (3 전단지)을 3mL와 살균 35mm 요리를 입력합니다.
- collagenase 솔루션 가득 그릇에 15 ML 관에서 세 전단지를 놓습니다.
- 37 5-10분에 대한 조직을 품어 ° C.
- 부드럽게 전단지의 표면에 건조한 멸균 면봉을 돌려 내피 층을 제거합니다. 전단 적용의 회전과 금액의 방향은 샘플의 순도를 위해 중요합니다. 면봉의 회전이 제어 전단을 만드는 손의 직선 운동에 반대 방향으로해야합니다. 이 전단은 조직에서 내피 세포 리프트 무엇입니까. 강제 적용의 금액은 조직의 저항을 느낄하지만, 지하 막에 침투하지 않도록 충분해야합니다.
- 때때로 소량의 collagenase 솔루션 내에서 면봉은 팁 섬유에서 세포를 이동시키다 수 있습니다. 보라고가 완료되면, 내피 층의 질감보다 약간 부드러워지는 느낌한다.
- 세포 현탁액 / collagenase를 수집하고 새로운 살균 15mL 튜브로 전송할 수 있습니다.
- 펠렛 5 분 어떤 고립된 세포 1,000 RPM에서 튜브를 원심과 뜨는을 대기음. 뿐만 아니라 중간 세포를 분리하는 경우 이러한 세포가 centrifuged되고있는 동안, 그 프로토콜을 수행합니다.
- 15 ML 튜브에 내피 돼지의 매체 3 ML 추가, 두 번째 시간을 원심 분리기하고, 기음 미디어. 이 초 원심 분리는 팁 섬유로 불필요한 자료의 일부를 필터링하는 데 도움이됩니다.
- centrifuged 내피 세포가 콜라겐과 사전 코팅 T - 25 플라스크 (사용 원심 분리기 튜브 당 1 플라스크)에 내피 돼지의 미디어 및 플레이트 세포 5 ML에 다시 일시 중지합니다.
- 세포가 내피 매체를 변경하기 전에 최소한 2~3일 성장하자. 이것은 세포가 회복과 격리 프로세스가 매우 거칠고이고 세포 수율이 낮은 수 있기 때문에 나눌 수 있습니다. 연락처 억제가 세포 변형을 초래할 수 있으므로이 코플루엔스 근처 통로 세포에 중요합니다.
4. 사이드 특정 절연을위한 60mm 문화 요리의 준비
- 알루미늄 호일 (와 라인 60mm 유리 배양 접시 당 leafle이 유리 요리T). 알루미늄 포일은 유리 페트리 접시는 다른 isolations 위해 재사 용할 수 있도록, 파라핀을 제거하는 데 도움이됩니다.
- 반쯤 찼다고에 대한, 요리 이내 파라핀 비즈를 삽입하고, autoclaving 커버.
- autoclaving가 완료되고 파라핀이 녹아되면 시원한 평면으로 요리의 앙상블 이동합니다. 파라핀이 차가워지면서, 그것은 강화가되며 바늘 자국을 지원하는 레이어를 만들 수 있습니다.
- 30 분 후에, 살균 요리는 다음 전단지 조직을 고정하기 위해 격리 챔버로 사용할 수 있습니다.
5. 사이드 특정 내피 층의 분리
- 측면 특정 격리 준비 60mm 문화 접시에있는 15mL 튜브 장소에서 전단지를 제거합니다.
- ventricularis 측면이 fibrosa 측면이 노출 떠나는 파라핀 표면에 내려 얼굴 있도록 전단지를 조작. 내피 층을 노출하는 전단지의 가장자리를 핀.
- 37 각 (이상 방향) 내피 표면에 감기 collagenase 몇 방울을 넣고 50-10분에 대한 조직을 품어 ° C.
- 전처럼 부드럽게 전단지의 표면에 건조한 멸균 면봉을 돌려 내피 층을 제거합니다. 전단 적용의 회전과 금액의 방향은 샘플의 순도를 위해 중요합니다. 면봉의 회전이 제어 전단을 만드는 손의 직선 운동에 반대 방향으로해야합니다. 이 전단은 조직과 다른 아무것도에서 내피 세포 리프트 무엇입니까. 강제 적용의 금액은 조직의 저항을 느낄 수 있지만, 조직 내에 침투하지 않는 정도로해야합니다.
- 때때로 소량의 collagenase 솔루션 내에서 면봉은 팁 섬유에서 세포를 이동시키다 수 있습니다. 보라고가 완료되면, 내피 층의 질감보다 약간 부드러워지는 느낌한다.
- 세포 현탁액 / collagenase를 수집하고 새로운 살균 15mL 튜브로 전송할 수 있습니다. 라벨 측면 특이성을 (같은 밸브의 전단지를 함께 풀링 수 있음)을 나타냅니다.
- ventricularis 측면 이제 노출 및 반복 단계 (5.3-5.6)되도록 새로운 문화 요리에 전단지를 전송합니다.
- 모든 세포 현탁액 / collagenase가 수집되면, 펠렛 어떤 격리 세포 오분 1,000 RPM에서 튜브를 원심과 뜨는을 대기음. 뿐만 아니라 중간 세포를 분리하는 경우 이러한 세포가 centrifuged되고있는 동안, 그 프로토콜을 수행합니다.
- 튜브에 내피 돼지의 매체 3 ML 추가, 두 번째 시간을 원심 분리기, 그리고 미디어를 대기음. 이 초 원심 분리는 팁 섬유로 불필요한 자료의 일부를 필터링하는 데 도움이됩니다.
- centrifuged 내피 세포가 합성 (원심 분리기 튜브마다 사용하는 한 플라스크)로 사전 코팅 T - 25 플라스크에 내피 돼지의 미디어 및 플레이트 세포 5 ML에 다시 일시 중지합니다.
- 세포가 내피 매체를 변경하기 전에 최소한 2~3일 성장하자. 이것은 세포가 회복과 격리 프로세스가 매우 거친이기 때문에 나눌 수 있습니다. 당신은 생산량이 매우 낮을 것으로 예고 경우, 세포 세포의 부착은 세포 성장을 촉진 때문에 작은 술병이나 잘 플레이트로 이동 고려해보십시오. 연락처 억제가 세포 변형을 초래할 수 있으므로 합류 근처에 통과해야합니다.
6. 중간 세포의 분리
- 밸브마다 collagenase 솔루션 (3 전단지) 10 ML과 멸균 15 ML의 원심 분리기 튜브를 입력합니다.
- 내피 세포의 전단지를 보라고 후, 즉시 collagenase 솔루션 해당 15mL 튜브에서 그들을 놓으십시오.
- (원하는 경우 부드럽게 선동) 약 12-18시간위한 부화.
- 세포 현탁액 / collagenase가 균질 될 때까지 serological 피펫과 함께 부드럽게 저하된 조직을 섞는다. 이 균질의 조직을 헤어지게하고 중간 세포를 출시하는 데 도움이됩니다.
- 1,000 RPM에서 5 분 동안 소화 조직을 원심 분리기 및 뜨는을 대기음.
- 15mL 튜브 5 ML 중간 돼지의 매체를 추가, 두 번째 시간을 원심 분리기 및 supernate을 대기음.
- centrifuged 내피 세포의 중간 돼지의 미디어 및 플레이트 세포 5 ML에 다시 중단 T - 75 플라스크 (원심 분리기 튜브 당 1 플라스크를 사용하여).
- 세포는 중간 세포 매체를 변경하기 전에 최소한 1-2일 성장하자. 예상되는 내피 세포하지만,보다 많은 조직 파편있을 것입니다. 세포는 또한 빠른 때문에 세포 수율과 자연의 내피 세포보다 합류로 성장한다.
7. 대표 이미지

그림 1. 2-3일 게시물 절연의 절연 세포의 형태. (A) VEC는 일반 내피 형태학 및 형태의 성장을 촉진하기 위해 클러스터를 나타냅니다. (B) VIC의 형태는 일반적으로 스핀들 모양과 술병에 걸쳐 균등하게 분산시키고 myofibroblasts 비슷합니다.
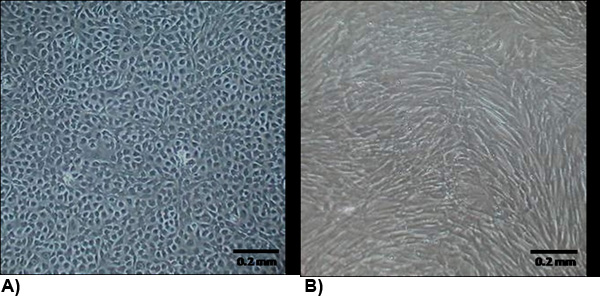
그림 2. confluency에서 분리된 세포의 형태. (A) VEC은 일반적으로 조약돌과 성장 접촉 저해하는 전형적인 내피 형태를 나타냅니다. (B) VIC의 형태는 일반적으로 스핀들 모양이 아니라 성장 접촉 저해 아르 myofibroblasts 비슷합니다.
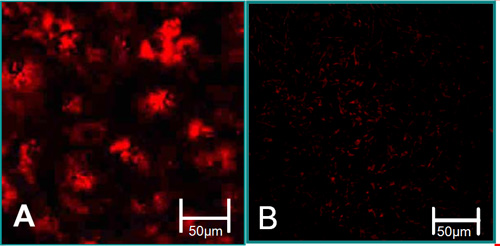
그림 3. 격리 세포의 기능 특성 6. (A) VEC는 acetylated LDL 이해 높은 수준의 (적색)과 연결되어 있습니다. (B) VIC는 acetylated LDL 이해의 낮은 수준과 관련됩니다.
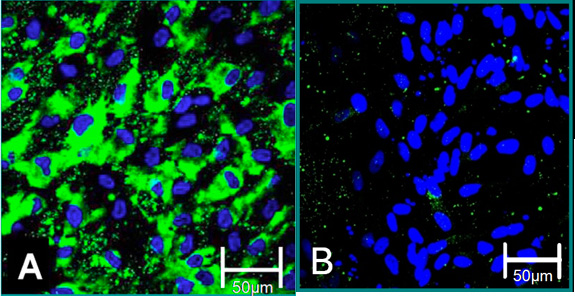
그림 4. 절연 세포 6 세포 마커. (A) VEC의 표현형는 본 Willebrand 팩터 (녹색), 파랑 (핵)에 대한 긍정적인 얼룩에 기여합니다. (B) VIC의 표현형는 본 Willebrand 팩터에 대한 부정적인 얼룩에 기여합니다.
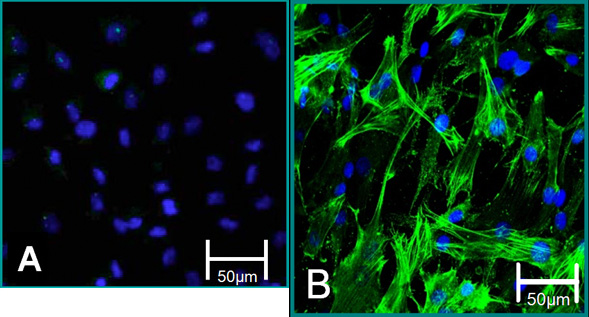
그림 5. 격리 세포의 세포 마커. (A) VEC의 표현형는 알파 SMA (녹색), 파랑 (핵)에 대한 부정적인 얼룩에 기여합니다. (B) VIC의 표현형는 알파 SMA에 대한 긍정적인 얼룩에 기여합니다.
| 해리 에이전트 | 분리 기술 | 셀 컬렉션 | 셀 수량 | 세포 퓨리티 | 오염 |
| CaCl 2없이 EDTA (에틸렌 다이아 민 테트라 초산) (3mM) | 5, 20, 60 분. CaCl 2뿐만 아니라 전 | 20, 60, 120 분. 수령 전에 | - | + / - | + + + |
| CaCl 2없이 EDTA (에틸렌 다이아 민 테트라 초산) (6mM) | 5, 20, 60 분. CaCl 2뿐만 아니라 전 | 20, 60, 120 분. 수령 전에 | + / - | + | + + + |
| 트립신 - EDTA (에틸렌 다이아 민 테트라 초산) (0.5 g / L) | 5, 10, 15 분. 비활성화하기 전에 | 매체 즉시 수집 | + | + | + + |
| Collagenase II (300 U / ML) | 5, 10, 15 분. 비활성화하기 전에 | 매체 즉시 수집 | -, +, + + | - + + + | + |
| Collagenase II (600 U / ML) | 5, 10, 15 분. 비활성화하기 전에 | 매체 즉시 수집 | +, + +, + + + | + +, + +, - | - |
표 1. 예비 밸브 모양의 내피 세포 격리 프로토콜의 결과.
토론
밸브 모양의 생물학의 이해는 분리 기술적인 문제 및 밸브 모양의 내피 세포의 culturing 순수 인구에 의해 장애인되었습니다. 일반 절연 기술 기본 기초 매트릭스 또는 내피 접착 채권 2,3의 화학 분해 효소의 소화를 포함. 예비 분리 실험은 질적으로 분리 직원과 부화 기간 변화에 의해 평가되었다. 이러한 실험의 결과는 최대 60 분 동안 그 EDTA (에틸렌 다이아 민 테트라 초산) (또는 트립신 -...
공개
감사의 말
이 연구는 NSF 경력 수상, 하트웰 재단, 그리고 미국 심장 협회 (# 0830384N)에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium | Mediatech, Inc. | 50-103-PB | |
| Fetal Bovine Serum | GIBCO, by Life Technologies | 26140 | |
| Penicillin Streptomycin | GIBCO, by Life Technologies | 15140-122 | |
| 0.25% Trypsin-EDTA | GIBCO, by Life Technologies | 25200 | |
| Heparin Sodium Salt | Sigma-Aldrich | H4784-1G | |
| Collagenase Type 2 | Worthington Biochemical | LS004176 | |
| DPBS | GIBCO, by Life Technologies | 21300-058 | |
| Rat Tail Collagen | BD Biosciences | 354236 | |
| Critical Swabs | VWR international | 89031-270 | |
| Sodium Bicarbonate | Sigma-Aldrich | 55761 | |
| T25 Flasks | BD Biosciences | 353018 | |
| T75 Flasks | BD Biosciences | 353136 | |
| 24 Well Plate | Falcon BD | 353047 | |
| 60x15 mm Dishes | VWR international | 25384-092 | |
| 60x15 Glass Dishes | VWR international | 89000-310 | |
| Paraffin Embedding Wax | Electron Microscopy Sciences | 19304-01 | |
| Precision Glide Needles | BD Biosciences | 305165 | |
| 500 mL Nalgene Filters | VWR international | 73520-985 | |
| 1L Nalgene Filters | VWR international | 73520-986 | |
| Tissue Forceps | Fine Science Tools | 11023-15 | |
| FSC Tweezers #5 | Fine Science Tools | 11295-00 |
참고문헌
- Thompson, R. P., Fitzharris, T. P. Morphogenesis of the truncus arteriosus of the chick embryo heart: the formation and migration of mesenchymal tissue. Am J Anat. 154, 545-556 (1979).
- Johnson, C. M., Fass, D. N. Porcine cardiac valvular endothelial cells in culture: A relative deficiency of fibronectin synthesis in vitro. Lab Invest. 49 (5), 589-598 (1983).
- Manduteanu, I., Popov, D., Radu, A., Simionescu, M. Calf cardiac valvular endothelial cells in culture: production of glycosaminoglycans, prostacyclin and fibronectin. J Mol Cell Cardiol. 20 (2), 103-118 (1988).
- Cheunyg, W. Techniques for isolating and purifying porcine aortic valve endothelial cells. JHVD. 17 (6), 674-681 (2008).
- Paranya, G., Vineberg, S., Dvorin, E., Kaushal, S., Roth, S. J., Rabkin, E., Schoen, F. J., Bischoff, J. Aortic valve endothelial cells undergo transforming growth factor-beta-mediated and non-transforming growth factor-beta-mediated transdifferentiation in vitro. Am J Pathol. 159 (4), 1335-1343 (2001).
- Butcher, J. T., Penrod, A., Garcia, A. J. M., Nerem, R. M. Unique morphology and focal adhesion development of valvular endothelial cells in static and fluid flow environments. Arterioscler Thromb Vasc Bio. 24 (1), 1429-1434 (2004).
- Simmons, C. A., Grant, G. R., Manduchi, E., Davies, P. F. Spatial heterogeneity of endothelial phenotypes correlates with side-specific vulnerability to calcification in normal porcine aortic valves. Circ Res. 96, 792-799 (2005).
- Butcher, J. T., Tressel, S., Johnson, T., Turner, D., Sorescu, G., Jo, H., Nerem, R. M. Transcriptional Profiles of Valvular and Vascular Endothelial Cells Reveal Phenotypic Differences: Influence of Shear Stress. Arterioscler Thromb Vasc Biol. 26, 69-69 (2006).
- Parachuri, S., Yang, J. H., Aikawa, E., Melero-Martin, J. M., Khan, Z. A., Loukogeorgakis, S., Schoen, F. J., Bischoff, J. Human Pulmonary Valve Progenitor Cells Exhibit Endothelial/Mesenchymal Plasticity in Response to Vascular Endothelial Growth Factor-A and Transforming Growth Factor-β2. Circ Res. 99 (8), 861-869 (2006).
- Shi, Q. Evidence for circulating bone marrow-derived endothelial cells. Blood. 92, 362-367 (1998).
- Rehman, J., Li, J., Orschell, C. M., March, K. L. Peripheral blood endothelial progenitor cells are derived from monocyte/macrophages and secrete angiogenic growth factors. Circulation. 107, 1164-1169 (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유