É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento de Valvular Células Endoteliais
Neste Artigo
Resumo
Nós fornecemos um método para isolar e populações de cultura pura de células endoteliais válvula cardíaca (VEC). VEC pode ser isolado de ambos os lados da cúspide ou folheto e imediatamente a seguir, a célula intersticial subjacente isolamento (VIC) é simples.
Resumo
Válvulas do coração é o único responsável por manter o fluxo sanguíneo unidirecional através do sistema cardiovascular. Esses finos, tecidos fibrosos são submetidos a tensões mecânicas significativas como abrir e fechar vários bilhões de vezes ao longo de uma vida. A resistência incrível destes tecidos é devido ao valvular residente endotelial (VEC) e células intersticiais (VIC) que constantemente reparação e remodelação em resposta a sinais locais mecânico e biológico. Apenas recentemente nós começamos a compreender os comportamentos ímpares dessas células, para o qual a experimentação in vitro tem desempenhado um papel fundamental. Particularmente desafiante é o isolamento e cultura de VEC. Cuidado especial deve ser usado a partir do momento em que o tecido é removido do host através de revestimento final. Aqui apresentamos os protocolos para o isolamento direto, o isolamento lado específico, cultura e verificação das populações puras de VEC. Usamos digestão enzimática seguido por uma técnica suave swab raspagem para retirar células da superfície somente. Estas células são então coletadas em um tubo e centrifugado em um pellet. O pellet é ressuspenso em seguida, e banhado em frascos de cultura pré-revestida com colágeno da matriz I. Fenótipo VEC é confirmado pelo contato inibiu o crescimento ea expressão de marcadores endoteliais específicos, tais como PECAM1 (CD31), fator de von Willebrand (vWF), e expressão negativa de alfa-actina de músculo liso (α-SMA). As características funcionais do VEC estão associados com altos níveis de LDL acetilada. Ao contrário de células endoteliais vasculares, VEC tem a capacidade única de transformar em mesênquima, que normalmente ocorre durante a formação embrionária válvula 1. Isso também pode ocorrer durante significativamente confluentes pós prolongada na cultura in vitro, assim que o cuidado deve ser feito para passagem em ou perto de confluência. Após o isolamento VEC, populações puras de VIC podem ser facilmente adquiridos.
Protocolo
1. Preparação
- Autoclave em um instrumento coberto bandeja os seguintes itens:
- Pinça serrilhada - Para manuseio do tecido folheto
- Tesoura de tecido (8 cm) - Para corte de tecido e folheto cúspides
- Cotonetes de algodão - Para isolar a camada endotelial do folheto ou cúspide
- Fazer a solução de colagenase estéril
- Adicionar 4,0 gramas de pó DMEM para 250 mL de água de 18 mohms.
- Adicionar 1,11 gramas de bicarbonato de sódio.
- Add (600 U / mL) 180.000 unidades de colagenase.
- Adicionar 1% (3 mL) Penicilina / Estreptomicina.
- Ajustar o pH da solução para 7,2.
- Levar a solução até 270 mL.
- Esterilizar a solução, passando por um filtro de 0,2 mm.
- Adicionar 10% (30ml) de soro fetal bovino estéril.
- Faça médio de células endoteliais estéril
- Adicionar 6,7 gramas de pó DMEM para 400 mL de água de 18 mohms.
- Adicionar 1,85 gramas de bicarbonato de sódio.
- Adicionar (50 U / mL) 25.000 unidades de heparina.
- Adicionar 1% (5 mL) Penicilina / Estreptomicina.
- Ajustar o pH da solução para 7,2.
- Levar a solução até 450 mL.
- Esterilizar a solução, passando por um filtro de 0,2 mm.
- Adicionar 10% (50 ml) de soro fetal bovino estéril.
- Faça médio de células estéreis intersticial
- Adicionar 13,37 gramas de pó DMEM para 800 mL de água de 18 mohms.
- Adicionar 3,7 gramas de bicarbonato de sódio.
- Adicionar 1% (10 ml) Penicilina / Estreptomicina.
- Ajustar o pH da solução para 7,2.
- Levar a solução até 900 mL.
- Esterilizar a solução, passando por um filtro de 0,2 mm.
- Adicionar 10% (100 mL) de soro bovino estéril.
2. Isolamento dos folhetos da válvula cardíaca
- A raiz da aorta especiais de consumo imediato e de forma asséptica do coração após o sacrifício.
- Lave bem a raiz da aorta de sangue com o frio DPBS estéril. É imperativo para remover todos os componentes do sangue o mais rapidamente possível para limitar o VEC morte e contaminação bacteriana. Antibióticos e antimicóticos não são aconselhados, nesta fase, uma vez que são potencialmente prejudiciais para o VEC.
- Isolar folhetos da válvula (3 por válvula) diretamente a partir da raiz e coloque em um tubo cônico 15 mL estéril preenchida com 12 mL DPBS frio. Agite várias vezes para remover os resíduos e reabastecer com DPBS fresco.
- Transporte para o laboratório em gelo.
- À chegada ao laboratório, colocar o recipiente com o tecido sob o capô estéril.
3. Isolamento da camada endotelial
- Encha um prato estéril 35mm com 3 mL de solução de colagenase frio por válvula (3 folhetos).
- Coloque todos os três folhetos do tubo de 15 mL para o prato cheio com a solução de colagenase.
- Incubar o tecido por 5-10 minutos a 37 ° C.
- Remover suavemente a camada endotelial girando um algodão estéril e seco sobre a superfície do folheto. O sentido de rotação ea quantidade de cisalhamento aplicada é crítica para a pureza de sua amostra. A rotação da haste deve ficar em uma direção oposta ao movimento linear de sua mão criando uma tesoura controlada. Este corte é o que levanta a células endoteliais do tecido. A quantidade de força aplicada deve ser suficiente para sentir a resistência do tecido, mas, não penetram na membrana basal.
- Ocasionalmente, dab o swab dentro da solução de colagenase para desalojar as células das fibras ponta. Depois de esfregar está completa, a textura da camada endotelial deve se sentir um pouco mais suave do que antes.
- Recolher a suspensão de células / colagenase e transferir para um tubo estéril nova 15mL.
- Centrifugar os tubos a 1000 rpm por 5 minutos para sedimentar as células isoladas e aspire o sobrenadante. Se isolar células intersticiais, bem como, realizar esse protocolo, enquanto essas células estão sendo centrifugado.
- Adicionar 3 ml de meio de suínos endoteliais para os 15 tubos mL, centrifugar uma segunda vez, e mídia aspirar. Esta segunda centrifugação ajuda a filtrar alguns dos materiais indesejáveis, tais como fibras de ponta.
- Re-suspender as células endoteliais centrifugadas em 5 mL de meio de suínos endoteliais e placa de as células em um pré-revestido frasco de T-25 com colágeno (use um frasco por tubo de centrifugação).
- Permitir que as células crescer pelo menos 2-3 dias antes de mudar o meio endoteliais. Isto ajuda a recuperar as células e dividir uma vez que o processo de isolamento é bastante dura eo rendimento das células pode ser baixo. É fundamental para as células passagem perto confluência vez que a inibição de contato pode levar à transformação celular.
4. Preparação de 60 Dish Cultura mm para isolamento específico Side
- A linha de 60 mm de vidro placas de Petri com papel de alumínio (2 pratos de vidro por leaflet). A folha de alumínio ajuda a remover a parafina, de modo que a placa de Petri de vidro pode ser reutilizado para outros isolamentos.
- Lugar contas de parafina dentro dos pratos, cerca de metade cheio, e cobertura para autoclave.
- Uma vez que a autoclave é completo e de parafina é derretida, mova o ensemble prato para uma superfície fria plana. Como a parafina esfria, ele vai endurecer e criar uma camada que irá apoiar punções de agulha.
- Após 30 minutos, o prato esterilizado pode então ser usado como uma câmara de isolamento para imobilizar o tecido folheto.
5. Isolamento de camada específica Side endotelial
- Remove os folhetos dos tubos 15mL e coloque no prato de cultura preparado 60mm para isolamento específico lado.
- Manipular o folheto de modo que o lado ventricularis é a face para baixo sobre a superfície de parafina deixando o lado fibrosa expostos. Pin das bordas do folheto para expor a camada endotelial.
- Coloque algumas gotas de colagenase frio em cada superfície (para cima-facing) e incubar endoteliais do tecido por 5-10 minutos a 37 ° C.
- Como antes, remover suavemente a camada endotelial girando um algodão estéril e seco sobre a superfície do folheto. O sentido de rotação ea quantidade de cisalhamento aplicada é crítica para a pureza de sua amostra. A rotação da haste deve ficar em uma direção oposta ao movimento linear de sua mão criando uma tesoura controlada. Este corte é o que levanta a células endoteliais do tecido e nada mais. A quantidade de força aplicada deve ser suficiente para sentir a resistência do tecido, mas, não penetram no tecido.
- Ocasionalmente, dab o swab dentro da solução de colagenase para desalojar as células das fibras ponta. Depois de esfregar está completa, a textura da camada endotelial deve se sentir um pouco mais suave do que antes.
- Recolher a suspensão de células / colagenase e transferir para um tubo estéril nova 15mL. Indicam especificidade lado na etiqueta (folhetos da válvula mesmo pode ser agrupados).
- Transferir os folhetos para um prato nova cultura para que o lado ventricularis está agora exposta e repita os passos (5,3-5,6).
- Uma vez que todos suspensão celular / colagenase é coletado, centrifugar os tubos a 1000 rpm por 5 minutos para sedimentar as células isoladas e aspire o sobrenadante. Se isolar células intersticiais, bem como, realizar esse protocolo, enquanto essas células estão sendo centrifugado.
- Adicionar 3 ml de meio de suínos endoteliais para os tubos, centrífuga uma segunda vez, e aspire mídia. Esta segunda centrifugação ajuda a filtrar alguns dos materiais indesejáveis, tais como fibras de ponta.
- Re-suspender as células endoteliais centrifugadas em 5 mL de meio de suínos endoteliais e placa de as células em um pré-revestido frasco de T-25 com colagem (use um frasco por tubo de centrifugação).
- Permitir que as células crescer pelo menos 2-3 dias antes de mudar o meio endoteliais. Isto ajuda a recuperar as células e dividir uma vez que o processo de isolamento é bastante dura. Se você observar o rendimento ser muito baixa, considerar a mudança para um pequeno frasco ou placa bem desde a adesão célula-célula promove o crescimento celular. Lembre-se de passagem perto confluência vez que a inibição de contato pode levar à transformação celular.
6. Isolamento de células intersticiais
- Encha um tubo de centrifugação estéril 15 mL com 10 mL de solução de colagenase por válvula (3 folhetos).
- Depois de esfregar os folhetos de células endoteliais, imediatamente colocá-los no tubo apropriado 15mL com a solução de colagenase.
- Incubar por aproximadamente 12 a 18 horas (agitar suavemente se desejar).
- Misture delicadamente o tecido degradadas com uma pipeta sorológica, até suspensão de células / colagenase fica homogeneizado. Esta homogeneização ajuda a quebrar o tecido e liberar as células intersticiais.
- Centrifugar o tecido digerido por 5 minutos a 1000 rpm e aspire o sobrenadante.
- Adicionar 5 mL de médio suína intersticial para os tubos de 15mL, centrífuga uma segunda vez, e aspire sobrenadante.
- Re-suspender as células endoteliais centrifugadas em 5 mL de meio de suínos intersticial e placa de as células em um T-75 frasco (use um frasco por tubo de centrifugação).
- Permitir que as células crescer pelo menos 1-2 dias antes de mudar o meio de célula intersticial. Haverá restos de tecido muito mais do que com as células endoteliais, mas, que é esperado. As células também deve crescer a confluência mais rápido que as células endoteliais por causa do rendimento das células e sua natureza.
7. Imagens representante

Figura 1. A morfologia das células isoladas em 2-3 dias após o isolamento. (A) VEC apresentam uma morfologia típica endoteliais e formar grupos para promover o crescimento. (B) VIC morfologia é semelhante a miofibroblastos que geralmente são fusiformes e espalhe uniformemente em todo o frasco.
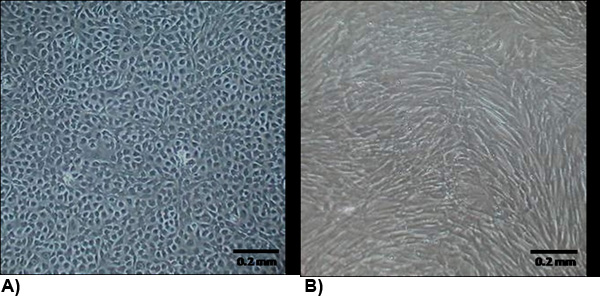
Figura 2. A morfologia das células isoladas na confluência. (A) VEC apresentam uma morfologia típica endoteliais que geralmente são de paralelepípedos e contactar o crescimento inibido. (B) VIC morfologia é semelhante a miofibroblastos que geralmente são fusiformes e não contato com crescimento inibido.
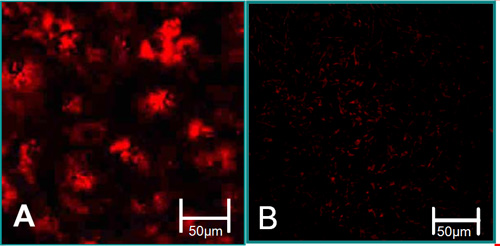
Figura 3. As características da função de células isoladas 6. (A) VEC estão associados com altos níveis de captação de LDL acetilada (vermelho). (B) VIC estão associados com baixos níveis de captação de LDL acetilada.
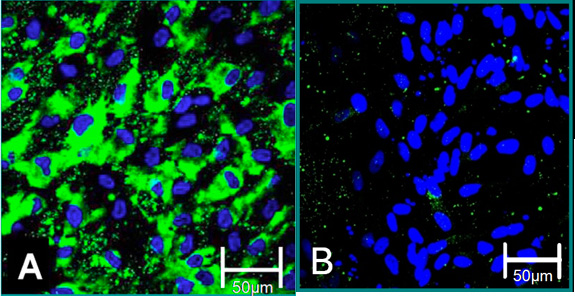
Figura 4. Marcadores celulares de células isoladas 6. (A) fenótipo VEC é contribuído para coloração positiva para o Fator de Von Willebrand (verde), azul (núcleos). (B) é o fenótipo VIC contribuiu para coloração negativa de Von Willebrand.
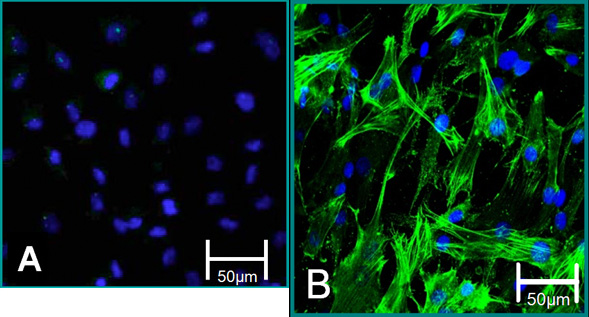
Figura 5. Marcadores celulares de células isoladas. (A) fenótipo VEC é contribuído para coloração negativa para alfa-SMA (verde), azul (núcleos). (B) é o fenótipo VIC contribuiu para coloração positiva para a SMA alpha.
| Dissociação Agent | Dissociação Técnica | Coleta de célula | Quantidade de células | Célula Pureza | Contaminação |
| EDTA (3mm) sem CaCl 2 | 5, 20, 60 min. antes disso CaCl 2 | 20, 60, 120 min. antes da coleta | - | + / - | + + + |
| EDTA (6mm) sem CaCl 2 | 5, 20, 60 min. antes disso CaCl 2 | 20, 60, 120 min. antes da coleta | + / - | + | + + + |
| Tripsina-EDTA (0,5 g / L) | 5, 10, 15 min. antes de desactivação | Médias coletadas imediatamente | + | + | + + |
| Colagenase II (300 U / mL) | 5, 10, 15 min. antes de desactivação | Médias coletadas imediatamente | -, +, + + | -, + +, + | + |
| Colagenase II (600 U / mL) | 5, 10, 15 min. antes de desactivação | Médias coletadas imediatamente | +, + +, + + + | + +, + +, - | - |
Tabela 1. Resultados preliminares de valvular protocolos de isolamento das células endoteliais.
Access restricted. Please log in or start a trial to view this content.
Discussão
Uma compreensão da biologia valvular tem sido prejudicada por dificuldades técnicas de isolamento e as populações de cultura pura de células endoteliais valvular. Técnicas de isolamento típico envolvem digestão enzimática da matriz subjacente basal ou dissociação química de ligações adesivas endotelial 2,3. Experimentos de isolamento preliminares foram avaliados qualitativamente por diferentes agentes dissociação e períodos de incubação. Os resultados destes experimentos mostraram que EDTA ...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Agradecimentos
Esta pesquisa é apoiada pela concessão de CARREIRA NSF, a Fundação Hartwell, e da American Heart Association (# 0830384N).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium | Mediatech, Inc. | 50-103-PB | |
| Fetal Bovine Serum | GIBCO, by Life Technologies | 26140 | |
| Penicillin Streptomycin | GIBCO, by Life Technologies | 15140-122 | |
| 0.25% Trypsin-EDTA | GIBCO, by Life Technologies | 25200 | |
| Heparin Sodium Salt | Sigma-Aldrich | H4784-1G | |
| Collagenase Type 2 | Worthington Biochemical | LS004176 | |
| DPBS | GIBCO, by Life Technologies | 21300-058 | |
| Rat Tail Collagen | BD Biosciences | 354236 | |
| Critical Swabs | VWR international | 89031-270 | |
| Sodium Bicarbonate | Sigma-Aldrich | 55761 | |
| T25 Flasks | BD Biosciences | 353018 | |
| T75 Flasks | BD Biosciences | 353136 | |
| 24 Well Plate | Falcon BD | 353047 | |
| 60x15 mm Dishes | VWR international | 25384-092 | |
| 60x15 Glass Dishes | VWR international | 89000-310 | |
| Paraffin Embedding Wax | Electron Microscopy Sciences | 19304-01 | |
| Precision Glide Needles | BD Biosciences | 305165 | |
| 500 mL Nalgene Filters | VWR international | 73520-985 | |
| 1L Nalgene Filters | VWR international | 73520-986 | |
| Tissue Forceps | Fine Science Tools | 11023-15 | |
| FSC Tweezers #5 | Fine Science Tools | 11295-00 |
Referências
- Thompson, R. P., Fitzharris, T. P. Morphogenesis of the truncus arteriosus of the chick embryo heart: the formation and migration of mesenchymal tissue. Am J Anat. 154, 545-556 (1979).
- Johnson, C. M., Fass, D. N. Porcine cardiac valvular endothelial cells in culture: A relative deficiency of fibronectin synthesis in vitro. Lab Invest. 49 (5), 589-598 (1983).
- Manduteanu, I., Popov, D., Radu, A., Simionescu, M. Calf cardiac valvular endothelial cells in culture: production of glycosaminoglycans, prostacyclin and fibronectin. J Mol Cell Cardiol. 20 (2), 103-118 (1988).
- Cheunyg, W. Techniques for isolating and purifying porcine aortic valve endothelial cells. JHVD. 17 (6), 674-681 (2008).
- Paranya, G., Vineberg, S., Dvorin, E., Kaushal, S., Roth, S. J., Rabkin, E., Schoen, F. J., Bischoff, J. Aortic valve endothelial cells undergo transforming growth factor-beta-mediated and non-transforming growth factor-beta-mediated transdifferentiation in vitro. Am J Pathol. 159 (4), 1335-1343 (2001).
- Butcher, J. T., Penrod, A., Garcia, A. J. M., Nerem, R. M. Unique morphology and focal adhesion development of valvular endothelial cells in static and fluid flow environments. Arterioscler Thromb Vasc Bio. 24 (1), 1429-1434 (2004).
- Simmons, C. A., Grant, G. R., Manduchi, E., Davies, P. F. Spatial heterogeneity of endothelial phenotypes correlates with side-specific vulnerability to calcification in normal porcine aortic valves. Circ Res. 96, 792-799 (2005).
- Butcher, J. T., Tressel, S., Johnson, T., Turner, D., Sorescu, G., Jo, H., Nerem, R. M. Transcriptional Profiles of Valvular and Vascular Endothelial Cells Reveal Phenotypic Differences: Influence of Shear Stress. Arterioscler Thromb Vasc Biol. 26, 69-69 (2006).
- Parachuri, S., Yang, J. H., Aikawa, E., Melero-Martin, J. M., Khan, Z. A., Loukogeorgakis, S., Schoen, F. J., Bischoff, J. Human Pulmonary Valve Progenitor Cells Exhibit Endothelial/Mesenchymal Plasticity in Response to Vascular Endothelial Growth Factor-A and Transforming Growth Factor-β2. Circ Res. 99 (8), 861-869 (2006).
- Shi, Q. Evidence for circulating bone marrow-derived endothelial cells. Blood. 92, 362-367 (1998).
- Rehman, J., Li, J., Orschell, C. M., March, K. L. Peripheral blood endothelial progenitor cells are derived from monocyte/macrophages and secrete angiogenic growth factors. Circulation. 107, 1164-1169 (2003).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados