È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Isolamento di cellule endoteliali valvolare
In questo articolo
Riepilogo
Forniamo un metodo per isolare e popolazioni coltura pura di cellule endoteliali valvola cardiaca (VEC). VEC può essere isolato da entrambi i lati della cuspide o depliant e subito dopo, alla base di cellule interstiziali (VIC) isolamento è semplice.
Abstract
Valvole cardiache è l'unico responsabile per il mantenimento del flusso unidirezionale del sangue attraverso il sistema cardiovascolare. Queste sottili, tessuti fibrosi sono sottoposti a notevoli sollecitazioni meccaniche come aprire e chiudere diversi miliardi di volte in un ciclo di vita. L'incredibile resistenza di questi tessuti è dovuta alla valvolare residente endoteliale (VEC) e le cellule interstiziali (VIC) che costantemente la riparazione e rimodellare in risposta a segnali meccanici locali e biologici. Solo di recente abbiamo cominciato a capire i comportamenti unica di queste cellule, per il quale nella sperimentazione in vitro ha svolto un ruolo chiave. Particolarmente impegnativo è l'isolamento e la coltura di VEC. Particolare cura deve essere utilizzato dal momento in cui il tessuto viene rimosso dal host tramite placcatura finale. Qui vi presentiamo i protocolli per l'isolamento diretto, isolamento laterale specifico, la cultura, e la verifica delle popolazioni pura VEC. Noi usiamo digestione enzimatica seguita da una tecnica delicata raschiatura tampone per staccare le cellule di superficie. Queste cellule vengono poi raccolti in un tubo e centrifugati in un pellet. Il pellet viene quindi risospeso e placcato in fiasche cultura pre-rivestito con collagene I matrice. Fenotipo VEC è confermata dal contatto inibito la crescita e l'espressione di marcatori endoteliali specifici come PECAM1 (CD31), fattore di von Willebrand (vWF), e l'espressione negativa di alfa-actina del muscolo liscio (α-SMA). Le caratteristiche funzionali di VEC sono associati con alti livelli di LDL acetilato. A differenza di cellule endoteliali vascolari, VEC hanno la capacità unica di trasformare in mesenchima, che normalmente si verifica durante la formazione embrionale valvola 1. Questo può verificarsi anche durante confluenti in modo significativo dopo prolungata coltura in vitro, per cui la cura dovrebbe essere fatto per il passaggio o in prossimità confluenza. Dopo l'isolamento VEC, popolazioni pure di VIC può quindi essere facilmente acquisita.
Protocollo
1. Preparazione
- Autoclave in uno strumento vassoio coperto i seguenti elementi:
- Forcipe del tessuto seghettato - Per la gestione del tessuto volantino
- Forbici dei tessuti (8 cm) - Per tagliare i tessuti depliant e cuspidi
- Tamponi di cotone - per isolare lo strato endoteliale dal volantino o cuspide
- Fai la soluzione sterile collagenasi
- Aggiungere 4,0 grammi di polvere DMEM a 250 ml di 18 MΩ acqua.
- Aggiungere 1,11 grammi di bicarbonato di sodio.
- Aggiungi (600 U / mL) 180.000 unità di collagenasi.
- Aggiungere 1% (3 ml) Penicillina / Streptomicina.
- Regolare il pH della soluzione a 7,2.
- Portare la soluzione fino a 270 ml.
- Sterilizzare la soluzione passa attraverso un filtro 0,2 micron.
- Aggiungere 10% (30 ml) di siero fetale bovino sterile.
- Rendere sterile medio delle cellule endoteliali
- Aggiungere 6,7 grammi di polvere DMEM a 400 ml di 18 MΩ acqua.
- Aggiungere 1,85 grammi di bicarbonato di sodio.
- Aggiungi (50 U / mL) 25.000 unità di eparina.
- Aggiungere 1% (5 ml) Penicillina / Streptomicina.
- Regolare il pH della soluzione a 7,2.
- Portare la soluzione fino a 450 ml.
- Sterilizzare la soluzione passa attraverso un filtro 0,2 micron.
- Aggiungere 10% (50 mL) di sterili siero fetale bovino.
- Rendere sterile medio delle cellule interstiziali
- Aggiungi 13,37 grammi di polvere DMEM a 800 ml di 18 MΩ acqua.
- Aggiungere 3,7 grammi di bicarbonato di sodio.
- Aggiungere 1% (10 ml) Penicillina / Streptomicina.
- Regolare il pH della soluzione a 7,2.
- Portare la soluzione fino a 900 ml.
- Sterilizzare la soluzione passa attraverso un filtro 0,2 micron.
- Aggiungere 10% (100 ml) di siero bovino sterile.
2. Isolamento dei lembi della valvola cardiaca
- Accise radice aortica immediatamente e in modo asettico dal cuore dopo sacrificio.
- Sciacquare la radice aortica di sangue freddo con DPBS sterile. E 'assolutamente necessario rimuovere tutti i componenti del sangue il più presto possibile per limitare la morte VEC e la contaminazione batterica. Antibiotici e antimicotici non è consigliabile in questa fase dal momento che sono potenzialmente dannose per l'VEC.
- Isolare i lembi della valvola (3 per ogni valvola) direttamente dalla radice e metterlo in un tubo sterile 15 ml conica riempita con 12 mL DPBS freddo. Agitare più volte per rimuovere i detriti e riempire con DPBS fresca.
- Trasporto al laboratorio in ghiaccio.
- Al suo arrivo in laboratorio, posto il contenitore con il tessuto sotto la cappa sterile.
3. Isolamento di strato endoteliale
- Riempire un piatto sterile da 35 mm con 3 ml di soluzione collagenasi freddo per valvola (3 volantini).
- Mettere tutti e tre i volantini dal tubo 15 ml nel piatto riempito con la soluzione di collagenasi.
- Incubare il tessuto per 5-10 minuti a 37 ° C.
- Rimuovere delicatamente lo strato endoteliale ruotando un tampone asciutto e sterile sulla superficie del foglio. Il senso di rotazione e la quantità di taglio applicata è fondamentale per la purezza del campione. La rotazione del tampone dovrebbe essere in una direzione opposta al movimento lineare della mano creando un taglio controllato. Questo taglio è ciò che solleva le cellule endoteliali dal tessuto. La quantità di forza applicata dovrebbe essere sufficiente per sentire la resistenza del tessuto, ma non penetrare la membrana basale.
- Occasionalmente, tamponare il tampone all'interno della soluzione collagenasi per staccare le cellule dalle fibre punta. Dopo tampone è completo, la trama dello strato endoteliale dovrebbe sentirsi un po 'più agevole rispetto a prima.
- Raccogliere la sospensione cellulare / collagenasi e trasferirli in un nuovo tubo sterile 15ml.
- Centrifugare le provette a 1000 giri per 5 minuti per far sedimentare le cellule isolate e aspirare il surnatante. Se isolare cellule interstiziali e, eseguire tale protocollo, mentre queste cellule vengono centrifugate.
- Aggiungere 3 ml di medium suina endoteliali ai 15 mL, centrifugare una seconda volta, e media aspirare. Questo aiuta a centrifugazione secondo filtro parte del materiale non desiderato come le fibre punta.
- Risospendere le cellule endoteliali centrifugati in 5 ml di terreno suina endoteliali e le cellule piastra in un pre-rivestito T-25 pallone con collagene (utilizzare 1 fiasco per provetta).
- Lasciate che le cellule crescono, almeno 2-3 giorni prima di cambiare il medium endoteliale. Questo aiuta le cellule recuperare e dividere in quanto il processo di isolamento è abbastanza dura e la resa delle cellule può essere bassa. E 'fondamentale per le cellule passaggio vicino confluenza quanto l'inibizione contatto potrebbe portare alla trasformazione cellulare.
4. Preparazione di 60 Dish Cultura mm per isolamento laterale specifico
- La linea 60 millimetri di vetro piastre di Petri con un foglio di alluminio (2 piatti di vetro per leaflet). Il foglio di alluminio aiuta a rimuovere la paraffina, in modo che il piatto di vetro di Petri possono essere riutilizzati per altri isolamenti.
- Luogo perline paraffina all'interno dei piatti, circa mezzo pieno, e la copertura per sterilizzazione in autoclave.
- Una volta che l'autoclave è completa e paraffina viene fuso, spostare il piatto insieme ad una superficie piana fredda. Come la paraffina si raffredda, si indurisce e creare uno strato che sosterrà punture d'ago.
- Dopo 30 minuti, il piatto sterilizzato può quindi essere utilizzato come una camera di isolamento per immobilizzare il tessuto foglio.
5. Isolamento di Side strato endoteliale specifico
- Rimuovere i volantini dai tubi 15ml e posto su piatto preparato cultura 60mm per lato isolamento specifico.
- Manipolare il foglio in modo che il lato ventricularis è a faccia in giù sulla superficie paraffina lasciando esposta la parte fibrosa. Pin i bordi del foglio per esporre lo strato endoteliale.
- Mettere qualche goccia di collagenasi fredda su ogni (rivolto verso l'alto) della superficie endoteliale e incubare il tessuto per 5-10 minuti a 37 ° C.
- Come prima, rimuovere delicatamente lo strato endoteliale ruotando un tampone asciutto e sterile sulla superficie del foglio. Il senso di rotazione e la quantità di taglio applicata è fondamentale per la purezza del campione. La rotazione del tampone dovrebbe essere in una direzione opposta al movimento lineare della mano creando un taglio controllato. Questo taglio è ciò che solleva le cellule endoteliali dal tessuto e nient'altro. La quantità di forza applicata dovrebbe essere sufficiente per sentire la resistenza del tessuto, ma non penetra all'interno del tessuto.
- Occasionalmente, tamponare il tampone all'interno della soluzione collagenasi per staccare le cellule dalle fibre punta. Dopo tampone è completo, la trama dello strato endoteliale dovrebbe sentirsi un po 'più agevole rispetto a prima.
- Raccogliere la sospensione cellulare / collagenasi e trasferirli in un nuovo tubo sterile 15ml. Indicare specificità lato sull'etichetta (volantini dalla valvola stessa può essere raggruppate).
- Trasferire i volantini per un piatto di nuova cultura in modo che il lato ventricularis è ora esposta e ripetere i passaggi (5,3-5,6).
- Una volta che tutti sospensione cellulare / collagenasi viene raccolto, centrifugare le provette a 1000 rpm per 5 minuti per far sedimentare le cellule isolate e aspirare il surnatante. Se isolare cellule interstiziali e, eseguire tale protocollo, mentre queste cellule vengono centrifugate.
- Aggiungere 3 ml di medium suina endoteliali ai tubi, centrifugare una seconda volta, ed aspirare media. Questo aiuta a centrifugazione secondo filtro parte del materiale non desiderato come le fibre punta.
- Risospendere le cellule endoteliali centrifugati in 5 ml di terreno suina endoteliali e le cellule piastra in un pre-rivestito T-25 pallone con collage (utilizzare 1 fiasco per provetta).
- Lasciate che le cellule crescono, almeno 2-3 giorni prima di cambiare il medium endoteliale. Questo aiuta le cellule recuperare e dividere in quanto il processo di isolamento è abbastanza dura. Se notate la resa sia molto bassa, in considerazione di passare a un fiasco più piccolo o pozzetti in quanto cellula-cellula adesione promuove la crescita cellulare. Ricordatevi di passaggio vicino confluenza quanto l'inibizione contatto potrebbe portare alla trasformazione cellulare.
6. Isolamento di cellule interstiziali
- Riempire una provetta sterile 15 ml con 10 ml di soluzione di collagenasi per valvola (3 volantini).
- Dopo strofinare i volantini delle cellule endoteliali, immediatamente posto nel tubo appropriato 15ml con la soluzione di collagenasi.
- Incubare per circa 12 a 18 ore (agitare gentilmente se desiderato).
- Mescolare il tessuto degradato delicatamente con una pipetta sierologica fino sospensione cellulare / collagenasi diventa omogeneizzato. Questa omogeneizzazione aiuta a rompere il tessuto e rilasciare le cellule interstiziali.
- Centrifugare il tessuto digerito per 5 minuti a 1000 rpm e aspirare il surnatante.
- Aggiungere 5 mL medio suina interstiziale ai tubi 15 ml, centrifugare una seconda volta, ed aspirare supernate.
- Risospendere le cellule endoteliali centrifugati in 5 ml di terreno suina interstiziale e la piastra le celle di una T-75 pallone (utilizzare 1 fiasco per provetta).
- Lasciate che le cellule crescono, almeno 1-2 giorni prima di cambiare il medium interstiziali delle cellule. Ci sarà detriti tessuto molto di più che con le cellule endoteliali, ma, che ci si aspetta. Le cellule dovrebbe aumentare anche la confluenza di più velocemente le cellule endoteliali a causa del rendimento delle cellule e la loro natura.
7. Immagini rappresentante

Figura 1. La morfologia delle cellule isolate a 2-3 giorni dopo l'isolamento. (A) VEC mostrano una morfologia tipica endoteliale e formare gruppi per promuovere la crescita. (B) VIC morfologia è simile a miofibroblasti che sono generalmente a forma di fuso e diffusa in modo uniforme in tutto il pallone.
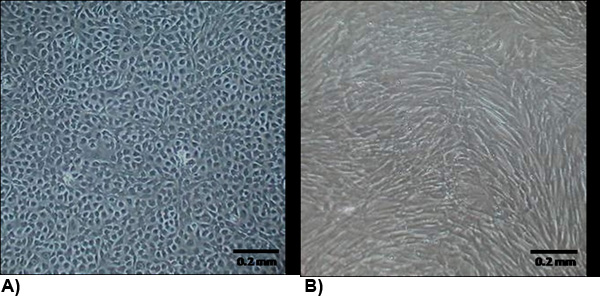
Figura 2. La morfologia delle cellule isolate a confluenza. (A) VEC mostrano una morfologia tipica endoteliali che sono generalmente di ciottoli e il contatto crescita inibita. (B) VIC morfologia è simile a miofibroblasti che sono generalmente a forma di fuso e di non contattare la crescita inibita.
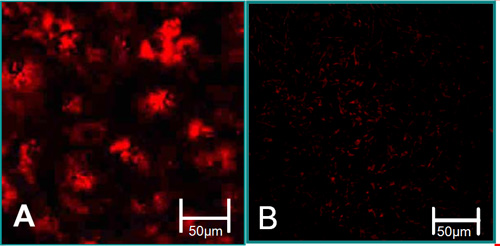
Figura 3. Le caratteristiche di funzione delle cellule isolate 6. (A) VEC sono associati con alti livelli di assorbimento acetilato LDL (rosso). (B) VIC sono associate a bassi livelli di LDL acetilato assorbimento.
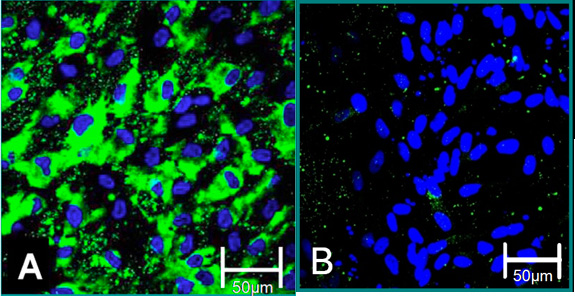
Figura 4. Marcatori cellulari di cellule isolate 6. (A) fenotipo VEC è contribuito alla colorazione positiva per il fattore di von Willebrand (verde), blu (nuclei). (B) fenotipo VIC è contribuito a colorazione negativa per il fattore di Von Willebrand.
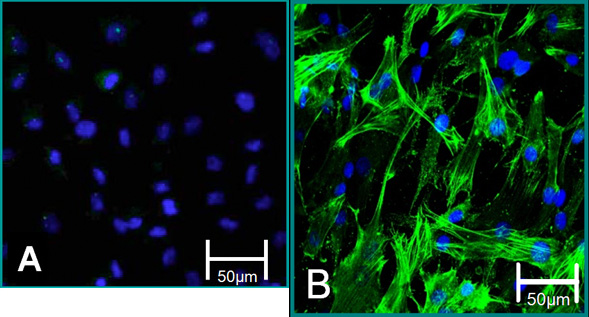
Figura 5. Marcatori cellulari di cellule isolate. (A) fenotipo VEC è contribuito a colorazione negativa per alpha SMA (verde), blu (nuclei). (B) fenotipo VIC è contribuito alla colorazione positiva per la SMA alfa.
| Dissociazione agente | Dissociazione Tecnica | Di raccolta delle cellule | Quantità di cellule | Cellula Purezza | Contaminazione |
| EDTA (3 mm) senza CaCl 2 | 5, 20, 60 min. Inoltre prima di CaCl 2 | 20, 60, 120 min. prima della raccolta | - | + / - | + + + |
| EDTA (6 mm) senza CaCl 2 | 5, 20, 60 min. Inoltre prima di CaCl 2 | 20, 60, 120 min. prima della raccolta | + / - | + | + + + |
| Tripsina-EDTA (0,5 g / L) | 5, 10, 15 min. prima di disattivazione | Media raccolti immediatamente | + | + | + + |
| Collagenasi II (300 U / mL) | 5, 10, 15 min. prima di disattivazione | Media raccolti immediatamente | -, +, + + | -, + +, + | + |
| Collagenasi II (600 U / mL) | 5, 10, 15 min. prima di disattivazione | Media raccolti immediatamente | +, + +, + + + | + +, + +, - | - |
Tabella 1. Risultati preliminari di protocolli delle cellule endoteliali valvolare isolamento.
Access restricted. Please log in or start a trial to view this content.
Discussione
La comprensione della biologia valvolare è stata compromessa da difficoltà tecniche di isolamento e la coltura popolazioni di puro valvolare cellule endoteliali. Tecniche di isolamento tipico coinvolgere digestione enzimatica della matrice sottostante basale o chimica di dissociazione dei legami adesivi endoteliale 2,3. Isolamento esperimenti preliminari sono stati valutati qualitativamente variando agenti dissociazione e periodi di incubazione. I risultati di questi esperimenti hanno dimostrato che l'E...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Riconoscimenti
Questa ricerca è sostenuta dal riconoscimento alla CARRIERA NSF, la Fondazione Hartwell, e l'American Heart Association (# 0830384N).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium | Mediatech, Inc. | 50-103-PB | |
| Fetal Bovine Serum | GIBCO, by Life Technologies | 26140 | |
| Penicillin Streptomycin | GIBCO, by Life Technologies | 15140-122 | |
| 0.25% Trypsin-EDTA | GIBCO, by Life Technologies | 25200 | |
| Heparin Sodium Salt | Sigma-Aldrich | H4784-1G | |
| Collagenase Type 2 | Worthington Biochemical | LS004176 | |
| DPBS | GIBCO, by Life Technologies | 21300-058 | |
| Rat Tail Collagen | BD Biosciences | 354236 | |
| Critical Swabs | VWR international | 89031-270 | |
| Sodium Bicarbonate | Sigma-Aldrich | 55761 | |
| T25 Flasks | BD Biosciences | 353018 | |
| T75 Flasks | BD Biosciences | 353136 | |
| 24 Well Plate | Falcon BD | 353047 | |
| 60x15 mm Dishes | VWR international | 25384-092 | |
| 60x15 Glass Dishes | VWR international | 89000-310 | |
| Paraffin Embedding Wax | Electron Microscopy Sciences | 19304-01 | |
| Precision Glide Needles | BD Biosciences | 305165 | |
| 500 mL Nalgene Filters | VWR international | 73520-985 | |
| 1L Nalgene Filters | VWR international | 73520-986 | |
| Tissue Forceps | Fine Science Tools | 11023-15 | |
| FSC Tweezers #5 | Fine Science Tools | 11295-00 |
Riferimenti
- Thompson, R. P., Fitzharris, T. P. Morphogenesis of the truncus arteriosus of the chick embryo heart: the formation and migration of mesenchymal tissue. Am J Anat. 154, 545-556 (1979).
- Johnson, C. M., Fass, D. N. Porcine cardiac valvular endothelial cells in culture: A relative deficiency of fibronectin synthesis in vitro. Lab Invest. 49 (5), 589-598 (1983).
- Manduteanu, I., Popov, D., Radu, A., Simionescu, M. Calf cardiac valvular endothelial cells in culture: production of glycosaminoglycans, prostacyclin and fibronectin. J Mol Cell Cardiol. 20 (2), 103-118 (1988).
- Cheunyg, W. Techniques for isolating and purifying porcine aortic valve endothelial cells. JHVD. 17 (6), 674-681 (2008).
- Paranya, G., Vineberg, S., Dvorin, E., Kaushal, S., Roth, S. J., Rabkin, E., Schoen, F. J., Bischoff, J. Aortic valve endothelial cells undergo transforming growth factor-beta-mediated and non-transforming growth factor-beta-mediated transdifferentiation in vitro. Am J Pathol. 159 (4), 1335-1343 (2001).
- Butcher, J. T., Penrod, A., Garcia, A. J. M., Nerem, R. M. Unique morphology and focal adhesion development of valvular endothelial cells in static and fluid flow environments. Arterioscler Thromb Vasc Bio. 24 (1), 1429-1434 (2004).
- Simmons, C. A., Grant, G. R., Manduchi, E., Davies, P. F. Spatial heterogeneity of endothelial phenotypes correlates with side-specific vulnerability to calcification in normal porcine aortic valves. Circ Res. 96, 792-799 (2005).
- Butcher, J. T., Tressel, S., Johnson, T., Turner, D., Sorescu, G., Jo, H., Nerem, R. M. Transcriptional Profiles of Valvular and Vascular Endothelial Cells Reveal Phenotypic Differences: Influence of Shear Stress. Arterioscler Thromb Vasc Biol. 26, 69-69 (2006).
- Parachuri, S., Yang, J. H., Aikawa, E., Melero-Martin, J. M., Khan, Z. A., Loukogeorgakis, S., Schoen, F. J., Bischoff, J. Human Pulmonary Valve Progenitor Cells Exhibit Endothelial/Mesenchymal Plasticity in Response to Vascular Endothelial Growth Factor-A and Transforming Growth Factor-β2. Circ Res. 99 (8), 861-869 (2006).
- Shi, Q. Evidence for circulating bone marrow-derived endothelial cells. Blood. 92, 362-367 (1998).
- Rehman, J., Li, J., Orschell, C. M., March, K. L. Peripheral blood endothelial progenitor cells are derived from monocyte/macrophages and secrete angiogenic growth factors. Circulation. 107, 1164-1169 (2003).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon