Method Article
الكشف عن مصفوفة Metalloproteinases الوظيفية التي Zymography
In This Article
Summary
يصف هذا البروتوكول مقايسة على أساس النشاط لاكتشاف metalloproteinases مصفوفة في supernatants الثقافة أو سوائل الجسم.
Abstract
metalloproteinases المصفوفة (MMPs) هي التي تحتوي على الزنك endopeptidases. انها تتحلل البروتينات التي تشطر سندات ببتيد. وقد تم تحديد أكثر من عشرين MMPs ويتم فصل إلى ست مجموعات على أساس بنيتها التحتية ونوعية (collagenases ، gelatinases ، نوع الغشاء [MT - MMP] ، stromelysins ، matrilysins ، وغيرها). MMPs تلعب دورا حاسما في غزو الخلية ، وتدهور الغضاريف ، إعادة تشكيل الأنسجة والتئام الجروح ، والتخلق. ولذلك كانت تشارك في كل العمليات الطبيعية والمرضية في كثير من الأمراض ، مثل التهاب المفاصل الروماتيزمي ، والسرطان ، أو مرض الانسداد الرئوي المزمن 1-6. هنا ، سوف نركز على MMP - 2 (جيلاتيناز A ، النوع الرابع كولاجيناز) ، وأعرب عن MMP على نطاق واسع. سوف نقوم شرح كيفية الكشف عن MMP - 2 في خلية ثقافة supernatants zymography ، وهي شائعة الاستخدام ، وتقنية بسيطة ، وحتى الآن حساسة للغاية لأول مرة في عام 1980 من قبل المجلس التنفيذي وHeussen جيم Dowdle 70-10. هذا الأسلوب هو نصف الكمية ، ويمكن بالتالي استخدامها لتحديد مستويات MMP في عينات الاختبار عندما يتم تحميل تركيزات المعروفة MMP المؤتلف على نفسه جل 11.
يتم تحميل محاليل تحتوي على MMPs (مثل supernatants خلية ثقافة والبول ، أو مصل) إلى مادة هلامية تحتوي على كبريتات الصوديوم بولي أكريلاميد دوديسيل (SDS ؛ ليصبح خطي البروتينات) ، والجيلاتين (الركيزة لMMP - 2). تم تصميم العينة عازلة لزيادة اللزوجة عينة (لتسهيل التحميل هلام) ، وتوفير صبغة التتبع (أزرق bromophenol ؛ لمراقبة الهجرة العينة) ، وتقديم الجزيئات تغيير طبيعة (ليصبح خطي البروتينات) ، والتحكم في درجة الحموضة في العينة. ويسمح للبروتينات ثم إلى الهجرة تحت تيار كهربائي في منطقة عازلة مصممة لتوفير تشغيل معدل الهجرة المستمرة. يرتبط ارتباطا عكسيا المسافة للهجرة مع الوزن الجزيئي للبروتين (بروتينات صغيرة تتحرك بشكل أسرع من خلال هلام من البروتينات ، وبالتالي لا كبيرة ترحيل مزيد من أسفل الجل). بعد الهجرة ، ويتم وضع الجل في renaturing عازلة للسماح للبروتينات لاستعادة بنيتها العالي ، واللازمة لنشاط الأنزيمي. ثم يتم وضع الجل في منطقة عازلة مصممة النامية للسماح للبروتياز لهضم ركيزة لها. المخزن يحتوي أيضا على تطوير ف aminophenylmercuric خلات (APMA) لتنشيط بروتين غير الموالية للMMPs في MMPs النشطة. الخطوة التالية يتكون من تلطيخ الركيزة (الجيلاتين في مثالنا). بعد غسل الصبغة قبالة هلام ، ومجالات الهضم البروتيني تظهر الفرق واضح. وأوضح الفرقة ، وأكثر تركيزا على البروتياز التي يحتوي عليها. ويمكن بعد ذلك الفرقة كثافة تلوين تحددها كثافة ، وذلك باستخدام برامج مثل ImageJ ، مما يسمح للمقارنة العينة.
Protocol
1. تحميل وتشغيل جل
- يجب أن يكون مستعدا على نحو كاف جميع العينات للحفاظ على وظيفة الأنزيمات واستخدامها على الفور بعد ان جمع أو تخزينها في المجمد -80 درجة مئوية. يجب أن العينات لا تحتوي على الحد من عوامل (مثل هذا β - المركابتويثانول) أو أن يغلى قبل تحميل هلام.
- فتح الحقيبة التي تحتوي على مادة هلامية داخل الكاسيت ، كاسيت شطف مع الماء منزوع الأيونات.
- إزالة الشريط الواقية من الجزء السفلي من الكاسيت والمشط من أعلى الجل.
- شطف ثلاث مرات مع العازلة تشغيل الآبار (مخفف ل1X في الماء منزوع الأيونات).
- وضع الجل في الخلوي البسيطة ، وضمان أن أصغر جانب الكاسيت تواجه الداخل. القفل في مكانه مع جل إسفين التوتر. ميني سيل يسمح لتشغيل واحد أو اثنين الهلام بشكل متواز.
- شغل أعلى (في الداخل) مع الغرفة العازلة 1X فوق مستوى تشغيل الآبار ، وتحقق من وجود أي تسرب. في حالة حدوث تسرب ، وإزالة المنطقة العازلة وإعادة الجل.
- ملء الغرفة السفلى مع 1X العازلة على التوالي.
- تحميل 10 ميكرولتر من علامة البروتين الجزيئي في واحدة أيضا.
- مزيج مبلغ مساو من هلام تحميل العازلة والعينة وتحميل في الآبار لاستخدام هلام هلام تحميل نصائح (تغيرت بين كل عينة). يمكن تحميل هذه الآبار مع ما يصل مجموعه إلى 20 ميكرولتر.
- وضع غطاء على خلية صغيرة وأسلاك توصيل كهربائي لتزويد الطاقة. التبديل إمدادات الطاقة على وضعه للتشغيل عند 125 V المستمر لمدة 90 دقيقة. تحقق من تشكيل فقاعات صغيرة على السلك من مجلس النواب ، مشيرا الى التداول الحالية.
- عند تشغيل هلام الأولى ، ورصد التقدم المحرز في الهجرة كل 15 دقيقة ، وذلك باستخدام اللون الأزرق bromophenol المدرجة في المنطقة العازلة تحميل كمؤشر. السماح للتشغيل حتى هلام الصبغة المؤشر يصل إلى الجزء السفلي من هلام.
2. Renaturing وتطوير جل
- لكل جيل ، وإعداد 100 مل من 1X renaturing العازلة و 200 مل من تغيير طبيعة العازلة ، سواء في الماء منزوع الأيونات.
- عندما تتبع bromophenol صبغة زرقاء تصل إلى الجزء السفلي من هلام ، والتبديل إمدادات الطاقة إيقاف ، افتح الخلية البسيطة ، وإزالة هلام. فصل الجانبين من الكاسيت باستخدام سكين هلام (أو ملعقة وزنها). قطع الزاوية للاحتفال في اتجاه الجل.
- إزالة بعناية الجل من الكاسيت ووضع في وعاء مع 100 مل renaturing العازلة. احتضان لمدة 30 دقيقة في درجة حرارة الغرفة مع الإثارة لطيف.
- إزالة العازلة renaturing وإضافة 100 مل من تطوير العازلة إلى هلام. احتضان لمدة 30 دقيقة في درجة حرارة الغرفة مع الإثارة لطيف.
- إزالة العازلة النامية وإضافة أكثر من 100 مل العازلة النامية إلى هلام. يحضن بين عشية وضحاها (16-18 ساعة) في 37 درجة مئوية.
- إزالة العازلة النامية وشطف ثلاث مرات (5 دقائق لكل منهما) مع الماء منزوع الأيونات في إطار التحريض لطيف في درجة حرارة الغرفة.
- مسح هلام لحفظ المواقع الدقيقة للفرق القياسية البروتين لأنها سوف تصبح أقل وضوحا أو لا بعد تلطيخ هلام.
- وصمة عار الجل وذلك بإضافة 20 مل من Safestain SimplyBlue إلى هلام. احتضان لمدة 1 ساعة في درجة حرارة الغرفة في إطار التحريض لطيف.
- إزالة SafeStain SimplyBlue وإزالة وصمة عار في جل 100 مل أو أكثر منزوع الأيونات الماء لمدة ساعة في درجة حرارة الغرفة في إطار التحريض لطيف.
- للحصول على أفضل النتائج ، مع استبدال الماء منزوع الأيونات الطازجة واحتضان لمدة ساعة أو أكثر في درجة حرارة الغرفة في إطار التحريض لطيف.
3. تحليل البيانات
- إزالة بعناية الجل من الماء ووضعه في حامية ورقة من البلاستيك.
- مسح هلام مع دقة 300 نقطة في البوصة أو أعلى. حفظ الصورة بتنسيق TIFF (الشكل 1A).
- قياس كثافة الموجات مع ImageJ (أو برامج أخرى مشابهة).
- فتح ملف TIFF في ImageJ (الشكل 1A).
- تصور بالأبيض والأسود عن طريق اختيار "> صورة نوع> 8 بت" (1B الشكل).
- استخدام أداة التحديد المستطيل لمخطط الفرقة الأولى ، رسم مستطيل على الأقل مرتين أعلى مما هو عليه واسعة (وهذا هو شرط البرمجيات).
- اضغط على "1" أو حدد "تحليل> الهلام> تحديد المسار الأول" سيتم تحديدها ، والفرقة.
- وسوف يظهر مستطيل جديدة ، نقله إلى الفرقة القادمة ، وحدد "تحليل> الهلام حارة تحديد> المقبلة". تكرار حتى يتم تحديد جميع نطاقات (1B الشكل).
- اضغط على "3" أو حدد "تحليل> الهلام مسارب الأرض>" لإنشاء ملف لكل مؤامرة فرقة (الشكل 1C).
- اختيار استخدام خط مستقيم (يجب أن يكون بالفعل تحديد تلقائيا) لرسم خطوط الأساس بحيث ذروة الفائدة هي منطقة مغلقة تماما.
- حدد أداة العصا فوق وداخل كل الذروة لتحديده.
- حدد "تحليل> الهلام قمم تسمية>" للحصول على طاولة المفاوضات مع كل منطقة لتحديد الذروة. يمكن رسم هذه البيانات على هذا النحو (Fويمكن تطبيع igure 1D) أو إلى قيمة الشريط الذي تم اختياره. هذا التطبيع مهم خصوصا عندما تجمع القيم من المواد الهلامية نسخ عديدة لتحديد الدلالة الإحصائية للنتائج.
4. ممثل النتائج
نظهر هلام مع 11 بئرا محملة supernatants ثقافة مختلفة الخلية التي تحتوي على كميات مختلفة من MMP - 2 (الشكل 1A). الملاحظة المباشرة لهذا الهلام يظهر اختلافات واضحة في MMP - 2 التركيزات بين بعض الآبار. على سبيل المثال ، فإنه من الواضح أن آبار # 4 و 5 تحتوي على أكثر بكثير من MMP - 2 جيدا أو جيدا # 11 حتى 10 #. الهدف من القياس الكمي للنطاقات استخدمنا قياس كثافة مع برنامج ImageJ (الشكل 1B - D) ، مؤكدا وجود فرق ما يقرب من 4 أضعاف في MMP - 2 كميات جيدة بين 11 و # # الآبار 4 و 5 و فرق ما يقرب من 2 أضعاف في MMP - 2 كميات جيدة بين # 10 # والآبار 4 و 5.

الشكل 1. الكشف عن MMP - 2 بواسطة zymography الجيلاتين. صورة ، الممسوحة ضوئيا من جل الجيلاتين. وأشارت الأرقام بشكل جيد في الجزء العلوي من هلام. ب ، الجل نفسه كما في هو موضح في بالأبيض والأسود لقياس كثافة. وقد تم اختيار كل الفرقة مع مستطيل في ImageJ. C ، وهناك مثالان لمحات عن كثافة الجل هو مبين في ألف وباء (العصابات # # 4 و 11). وقد رسم خط مستقيم عند قاعدة كل الذروة إلى إنشاء منطقة مغلقة. D قطعة من المناطق الذروة للهلام هو مبين في ألف وباء التطبيع (يمين) قبل (يسار) وبعد أن كثافة الفرقة رقم 1.
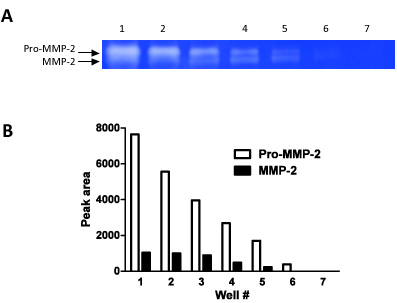
الشكل 2 ، وهذا الرقم يوضح كيف يمكن استخدام zymography كأسلوب نصف الكمية. وقد حملت لنا التخفيفات المتسلسلة (الخطوات من التخفيفات 01:01) في 7 آبار على التوالي ، وقياس كثافة الموجات على حد سواء المؤيدة - 2 - MMP و MMP - 2.
Discussion
وقد أثبتت لنا كيفية تنفيذ تحليل zymographic من MMP - 2 في supernatants ثقافة الخلية.
يجب تحديد كمية العينة ليتم تحميلها اعتمادا على هلام تجريبيا في الأصل وMMP من الفائدة. قد تحميل القليل جدا سوف يمنع الكشف أثناء تحميل الكثير يؤدي إلى تشبع وهناك ركيزة فقط بقدر ما هو البروتيني يمكن هضم في مجال الفرقة. يمكن إذا لزم الأمر ، يمكن أن تضعف العينة في الماء منزوع الأيونات قبل الاختلاط العازلة التحميل أو الوقت النامية من خفض دي بين عشية وضحاها إلى 4 ساعات. ومن الممكن أيضا أن تركز البروتينات في حل باستخدام مركزات (مثل ميليبور التسويقي UFC803024 #). إذا نطق تبقى مرئية بالكاد ، قد يكون من الضروري لتطوير المواد الهلامية لفترة أطول من الزمن ، حتى تصل إلى 48 ساعة. عند إعداد عينات من supernatants زراعة الأنسجة ، ينبغي الإشارة إلى أن مصل بقري جنيني (والأمصال الأخرى) يحتوي على MMPs التي يمكن أن تؤثر على النتائج. لهذا السبب ، نقوم بجمع كافة supernatants لدينا ثقافة في المصل بعد خالية من المتوسط.
ويغسل وصفها في الفقرتين 2.9 و 2.10 للبروتوكول ضرورية لإزالة الخلفية من تلطيخ العصابات هضمها. وسوف يعد مرات غسل إزالة أكثر الخلفية ، ولكن قاتمة أيضا تلون الركيزة في جميع أنحاء هلام. إذا غسل أوقات أطول ضرورية ، نوصي مسح هلام كل بضع ساعات لتحديد تفحص مع أفضل التباين.
ويمكن استخدام هذه التقنية لكشف MMPs الأخرى. على سبيل المثال ، يمكن الكشف عن MMP - 9 على الجيلاتين الهلام ، وأيضا إلى انخفاض مدى MMP - 1 ، MMP - 8 ، 13 - MMP والجيلاتين وليس الركيزة المفضل لديهم. تم الكشف عن أفضل MMP - 1 و MMP - 13 على zymography الكولاجين بينما الكازين هو الركيزة المفضل لMMP - 11 ويسمح أيضا للكشف عن MMP - 1 ، MMP - 3 ، MMP - 7 ، MMP - 12 ، و 13 - MMP 9. MMP - 7 (matrilysin) وcollagenases (MMP - 1 و MMP - 13) يصعب الكشف عندما تكون موجودة عند مستويات منخفضة في الكازين المواد الهلامية أو الجيلاتين. إضافة إلى نموذج الهيبارين في وقت التحميل جل تحسن كبير في الحد من الكشف عن MMP - 7. لMMP - 1 و 13 - MMP ، والهيبارين يحتاج إلى إضافته إلى هلام بعد تشغيل الكهربي جار بالفعل 12.
منذ zymography تدابير النشاط الأنزيمي بعد تمسخ واستعادة الطبيعة من الإنزيمات ، فإنه سيتم قياس نشاط كل MMPs موجودة في العينة. وتشمل هذه الانزيمات ، والانزيمات المؤيدة ، والانزيمات منضمة إلى مثبطات الذاتية (على سبيل المثال TIMP - 2). ومع ذلك فمن الممكن لتحديد مستوى التنشيط MMP في العينة من خلال مقارنة الكثافة عصابة من الإنزيم النشط وذلك لإنزيم للمحترفين ، والتي سوف يكون لها وزن جزيئي أعلى قليلا.
Zymography غالبا ما تكون غير كافية لتحديد هوية MMP. مقارنة بين مستوى الهجرة من MMP مع معايير معروفة الوزن الجزيئي لا يساعد في تحديد الهوية ولكن تجدر الإشارة إلى أن بعض هذه المعايير تتضمن خفض عامل ، وأنه عندما تستخدم في ظل عدم الحد من الظروف التي قد تشير إلى أوزان جزيئية مختلفة 9. الخيار هو لتحميل MMP المؤتلف للذوبان في هلام نفس عينات الاختبار. ولكن قد تكون مرتبطة MMPs مع بروتينات أخرى ، الأمر الذي أدى إلى تغيير في الوزن الجزيئي واضح. يمكن إضافة مثبطات انتقائية لMMP الجل (أو جزء من قطع هلام في نصف) خلال حضانة في المخزن النامية كأدوات الدوائية للهوية يوصى MMP تقنية interest.A الثاني (الغربية وصمة عار ، كيمياء سيتولوجية مناعية ، أو ELISA) ل المساعدة في تحديد هوية MMP من الفائدة. وتجدر الإشارة إلى أن حدود الكشف عن البقع الغربية غالبا ما تكون أقل بكثير من تلك المواد الهلامية zymographic ، مما قد يؤدي إلى نتائج سلبية كاذبة عند استخدام هذه التقنية.
Disclosures
Acknowledgements
نود أن نشكر الدكتور س. ريسلر (قسم علم الأحياء الجزيئية والخلوية ، وكلية بايلور للطب) ليشير الى ان استخدام مركزات البروتين لزيادة تركيز MMPs supernatants في ثقافة الخلية.
وقد أيد هذا المشروع من المنح المقدمة من الصندوق المسنين السيدة كليفورد غراهام الابيض بحوث وهبوا NIAMS المعاهد الوطنية للصحة / (AR059838) لبناء القدرات. المحتوى هو فقط من مسؤولية الكتاب ولا تمثل بالضرورة وجهة نظر رسمية من المعاهد الوطنية للصحة.
Materials
| Name | Company | Catalog Number | Comments |
| Xcell SureLock Mini-Cell CE mark electrophoresis apparatus | Invitrogen | EI0001 | |
| Power supply (model 302) | VWR international | 93000-744 | |
| Novex 10% gelatin zymogram gels, 1.0 mm, 12 wells | Invitrogen | EC61752BOX | |
| Blue Juice gel loading buffer | Invitrogen | 10816015 | |
| Gel loading tips | VWR international | 53509-015 | |
| Protein molecular weight standard | Invitrogen | LC5800 | |
| Novex Tris-Glycine-SDS running buffer | Invitrogen | LC2675 | |
| Novex zymogram renaturing buffer | Invitrogen | LC2670 | |
| Novex zymogram developing buffer | Invitrogen | LC2671 | |
| SimplyBlue SafeStain | Invitrogen | LC6060 | |
| Epson Perfection 4490 Photo Scanner | Amazon | n/a | |
| ImageJ software | http://rsbweb.nih.gov/ij/ | n/a | Authored by W. Rasband, NIH/NIMH |
References
- Luo, J. The role of matrix metalloproteinases in the morphogenesis of the cerebellar cortex. Cerebellum. 4, 239-245 (2005).
- Pasternak, B., Aspenberg, P. Metalloproteinases and their inhibitors - diagnostic and therapeutic opportunities in orthopedics. Acta Orthop. 80, 693-703 (2009).
- Kessenbrock, K., Plaks, V., Werb, Z. Matrix metalloproteinases: regulators of the tumor microenvironment. Cell. 141, 52-67 (2010).
- Lagente, V., Boichot, E. Role of matrix metallopreoteinases in the inflammatory process of respiratory diseases. J. Mol. Cell. Cardiol. 48, 440-444 (2010).
- Rodríguez, D., Morrison, C. J., Overall, C. M. Matrix metallopreoteinases: what do they not do? New substrates and biological roles identified by murine models and proteomics. Biochim. Biophys. Acta. 1803, 39-54 (2010).
- Bourboulia, D., Stetler-Stevenson, W. G. Matrix metalloproteinases (MMPs) and tissue inhibitors of metalloproteinases (TIMPs): positive and negative regulators in tumor cell adhesion. Semin. Cancer Biol. , (2010).
- Heussen, C., Dowdle, E. B. Electrophoretic analysis of plasminogen activators in polyacrylamide gels containing sodium dodecyl sulfate and copolymerized substrates. Analytical Biochem. , 102-196 (1980).
- Lombard, C., Saulnier, J., Wallach, J. Assays of matrix metalloproteinases (MMPs) activities: a review. Biochimie. 87, 265-272 (2005).
- Snoek-van Beurden, P. A., Von den Hoff, J. W. Zymographic techniques for the analysis of matrix metalloproteinases and their inhibitors. Biotechniques. 38, 73-83 (2005).
- Kupai, K., Szucs, G., Cseh, S., Hajdu, I., Csonka, C., Csont, T., Ferdinandy, P. Matrix metalloproteinase activity assays: importance of zymography. J. Pharmacol. Toxicol. Methods. 61, 205-209 (2010).
- Kleiner, D. E., Stetler-Stevenson, W. G. Quantitative zymography: detection of pictogram quantities of gelatinases. Anal. Biochem. 218, 325-329 (1994).
- Yu, W. H., Woessner, J. F. Heparin-enhanced zymographic detection of matrilysin and collagenases. Anal. Biochem. 293, 38-42 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved