Method Article
Выявление функциональных матриксных металлопротеиназ по Zymography
В этой статье
Резюме
Этот протокол описывает деятельность основе анализа для выявления матриксных металлопротеиназ в культуре супернатанты или другими биологическими жидкостями.
Аннотация
Матрица металлопротеиназ (ММП) в цинксодержащих endopeptidases. Они ухудшают белки при расщеплении пептидных связей. Более двадцати ММП были определены и разделены на шесть групп в зависимости от их структуры и субстратной специфичности (коллагеназы, желатиназы, мембранного типа [MT-ММП], стромелизины, matrilysins, и др.). ММП играют важную роль в клеточном вторжения, хрящей деградация ткани ремоделирования, заживление ран, и эмбриогенеза. Поэтому они участвуют в нормальных процессов и в патогенезе многих заболеваний, таких как ревматоидный артрит, рак, или хроническая обструктивная болезнь легких 1-6. Здесь мы сосредоточимся на MMP-2 (желатиназа, тип IV коллагеназы), широко выразил ММП. Мы продемонстрируем, как определить, MMP-2 в супернатантах клеточных культур по zymography, обычно используется, простой и вместе с тем очень чувствительный метод впервые описан в 1980 году С. Heussen и EB Даудл 7-10. Эта методика полуколичественного, поэтому может быть использована для определения уровня ММП в опытных образцах, когда известных концентраций рекомбинантного ММП загружаются в тот же гель 11.
Растворы, содержащие ММП (например, культура клеток супернатантов, моче или сыворотке) загружаются на полиакриламидном геле, содержащем додецилсульфата натрия (SDS; линеаризовать белков) и желатин (субстрат для MMP-2). Образец буфера, направленных на повышение вязкость образца (для облегчения загрузки гель), обеспечивают отслеживание красителя (бромфенола синий; следить образца миграция), обеспечить денатурации молекул (линеаризовать белков), а также контроль рН образца. Белки то разрешено мигрировать под действием электрического тока в буфере под управлением предназначен для обеспечения постоянной скорости миграции. Расстояния миграции обратно коррелирует с молекулярной массой белка (маленькие белки двигаться быстрее через гель, чем крупные белки и, следовательно, мигрировать дальше гель). После миграции геля помещается в буфер renaturing, чтобы белки, чтобы восстановить их третичной структуры, необходимые для ферментативной активности. Гель помещается в буфер развивающихся разработаны, чтобы позволить протеазы переварить ее субстратом. Развивающихся буфера также содержит р-aminophenylmercuric ацетат (APMA), чтобы активировать без протеолитических про-ММП в активные ММП. Следующий шаг заключается в окрашивании субстрата (желатин в нашем примере). После мытья избыток красителя с гелем, области протеазы пищеварения появляются как ясно полосы. Четкие группы, более концентрированный протеазы в нем содержится. Интенсивность окрашивания Группа может быть определена денситометрии, используя такие программы, как ImageJ, что позволяет для образца сравнения.
протокол
1. Загрузка и запуск Гель
- Все образцы должны быть готовы адекватно поддерживать функции ферментов и использовать сразу после сбора или хранят в замороженном виде при температуре -80 ° C. Образцы не должны содержать восстановителей (например, β-меркаптоэтанол) или вареным перед загрузкой геля.
- Откройте мешочек гель внутри кассеты, промыть кассету с деионизированной водой.
- Снимите защитную ленту с нижней части кассеты и гребень из верхней части геля.
- Промыть лунки три раза проточной буфера (разбавленным до 1 раза в деионизированной воде).
- Место гель в мини-Cell, гарантируя, что меньше стороне кассеты лица внутрь. Блокировка на место с Клин Напряженность лари. Мини-Cell позволяет запускать один или два гели параллельно.
- Заполните верхней (внутренней) камеры с 1X работает буфер над уровнем скважин, проверить на наличие течи. В случае утечки, удалять и перемещать буфера геля.
- Заполните нижнюю палату с 1X работает буфера.
- Нагрузка 10 мкл белка молекулярный маркер в одной скважине.
- Смешать равное количество геля загрузки буфера и образцов, а груз в лунки гель гель-погрузка советы (изменено между каждой выборки). Эти скважины может быть загружено до 20 мкл общего количества.
- Место крышкой Мини-Cell и подключения электродов провода к источнику питания. Переключатель питания и установите его работать на 125 В постоянного течение 90 минут. Проверьте образование мелких пузырьков на провод нижней палате, что указывает на текущий тираж.
- При запуске первого геля, контролировать ход миграции каждые 15 минут, используя бромфенола синий, включенных в загрузки буфера в качестве индикатора. Пусть гель работать, пока индикатор красителя достигает нижней части геля.
2. Renaturing и развитие Гель
- Для каждого гель, подготовить 100 мл 1X renaturing буфера и 200 мл денатурирующих буфера, как в деионизированной воде.
- Когда бромфенола синего красителя отслеживания достигает нижней части геля, переключатель питания выключен, открытые мини-Cell, и удалить гель. Отдельные две стороны кассеты использованием геля нож (или весом шпателем). Вырезать углу, чтобы отметить направление геля.
- Осторожно удалите гель из кассеты и поместить в контейнер с 100 мл renaturing буфера. Инкубировать 30 минут при комнатной температуре с нежным агитации.
- Удалить renaturing буфера и добавить 100 мл буфера для развивающихся геля. Инкубировать 30 минут при комнатной температуре с нежным агитации.
- Удалите развивающихся буфера и добавить 100 мл больше развивающихся буфера геля. Выдержите в течение ночи (16-18 часов) при 37 ° C.
- Удалить развивающихся буфера и промыть в три раза (5 минут) с деионизированной водой при легком помешивании при комнатной температуре.
- Сканирование гель для сохранения точного позиционирования белковых полос стандартных, поскольку они будут становиться все менее и не видны после гель-окрашивания.
- Пятно гель, добавив 20 мл SimplyBlue Safestain в гель. Инкубируйте в течение 1 часа при комнатной температуре в легком помешивании.
- Удалить SimplyBlue SafeStain и де-пятно геля в 100 мл или более деионизированной водой в течение одного часа при комнатной температуре в легком помешивании.
- Для лучших результатов, заменить свежей деионизированной водой и выдержать еще час или более при комнатной температуре в легком помешивании.
3. Анализ данных
- Осторожно удалите гель из воды и поместить в пластиковый протектор листа.
- Сканирование гель с разрешением 300 точек на дюйм и выше. Сохранить изображение в формате TIFF (рис. 1А).
- Мера интенсивности полос с ImageJ (или другого подобного программного обеспечения).
- Откройте файл формата TIFF в ImageJ (рис. 1А).
- Визуализируйте в черно-белом, выбрав "Image> Type> 8-битный" (рис. 1б).
- Используйте прямоугольное выделение в контур первой группе, рисование прямоугольника, по крайней мере в два раза выше, чем в ширину (это требование к программному обеспечению).
- Нажмите "1" или выберите "Анализ> Гели> Выбрать первую полосу", и группа будет сказано.
- Новый прямоугольник появится, перенести его на следующую группу и выберите "Анализ> Гели> Выбрать следующий переулок". Повторяйте, пока все полосы выбран (рис. 1В).
- Нажмите кнопку "3" или выберите "Анализ> Гели> Участок полосы" для создания профиля сюжет для каждой полосы (рис. 1в).
- Использование прямого выбора линии (уже должен быть выбран автоматически), чтобы привлечь базовой линии, таким образом, чтобы пик интереса полностью закрытом помещении.
- Выберите палочка инструмент и щелкните внутри каждого пика, чтобы выбрать его.
- Выберите "Анализ> Гели> Label пики», чтобы получить таблицу с площадью для каждого выбранного пика. Эти данные могут быть нанесены как таковой (Figure 1D) или может быть нормирована на значение выбранного диапазона. Такая нормализация что особенно важно при объединении значений из нескольких повторить гели для определения статистической значимости результатов.
4. Представитель Результаты
Мы показываем, гель с 11 скважин загружены различные культуры клеток супернатантов с различным содержанием ММП-2 (рис. 1А). Прямое наблюдение этого геля показывает очевидные различия в MMP-2 концентрации между некоторыми из скважин. Например, ясно, что скважины № 4 и 5 содержат намного больше MMP-2, чем скважины № 11 или даже скважины № 10. Для объективной количественной полос мы использовали денситометрии с помощью программного обеспечения ImageJ (рис. 1В-D), подтверждающие около 4-кратную разницу в MMP-2 сумму от скважины № 11 и скважины № 4 и 5, и около 2-кратную разницу в ММП-2 сумму от скважины № 10 и скважины № 4 и 5.

Рисунок 1. Обнаружение MMP-2 с помощью желатина zymography. , Отсканированное изображение желатин геля. Ну номера указаны в верхней части геля. B, тот же гель, как в показано в черно-белый для денситометрии. Каждая группа была выбрана с прямоугольником в ImageJ. С, Два примера денситометрии профили для геля показано в А и В (полосы № 4 и № 11). Прямая линия была нарисована в основе каждого пика создать замкнутую область. D, земельный площадей пиков для геля показано в А и В до (слева) и после (справа) нормализация к плотности группы № 1.
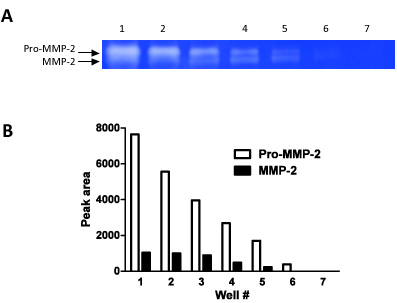
Рисунок 2. Эта цифра демонстрирует, как zymography может быть использован как полуколичественного техники. Мы загрузили серийные разведения (шаги 1:1, разведения) в 7 последовательных колодцев и измеряется группы плотности для обоих про-ММП-2 и MMP-2.
Обсуждение
Мы показали, как выполнять zymographic анализа ММП-2 в супернатантах клеточных культур.
Количество пробы, чтобы нагрузка на гель должен быть определен эмпирически в зависимости от происхождения и ММП интересов. Загрузка слишком мало будет препятствовать обнаружению при загрузке слишком много, может привести к насыщению, так как есть только в той субстрата протеазы может переварить в области полосы. При необходимости, образец можно развести в деионизированной воды до смешивания с загрузкой буфера или развивающиеся времени может де снижена с ночи до 4 часов. Кроме того, можно сосредоточиться белков в решение с использованием концентраторов (например, Millipore каталога # UFC803024). Если полосы остаются едва заметные, это может быть необходимо разработать гели для более длительного периода времени, вплоть до 48 часов. При подготовке проб из супернатантов культур тканей, следует отметить, что эмбриональной телячьей сыворотки (и других сывороток) содержит ММП, которые могут повлиять на результаты. По этой причине, мы собираем все наши супернатантов после культуру в свободной от сыворотки среде.
Моет, описанных в пунктах 2.9 и 2.10 протокола необходимо, чтобы удалить фон окрашивание переваривается полосы. Более мыть раз удалит больше фона, но и тусклый окрашивания подложки всей геля. Если более длительное время мытья необходимо, мы рекомендуем сканирования геля каждые несколько часов, чтобы выбрать сканирование с лучшей контрастностью.
Этот метод может быть использован для обнаружения других ММП. Например, MMP-9 могут быть обнаружены на желатин гелей, а также в меньшей степени MMP-1, MMP-8 и ММР-13 как желатин не является их предпочтительным субстратом. MMP-1 и ММР-13 лучше обнаружены на коллаген zymography в то время как казеин является предпочтительным субстратом для MMP-11, а также позволяет для обнаружения MMP-1, MMP-3, ММР-7, MMP-12 и ММР-13 9. MMP-7 (matrilysin) и коллагеназы (MMP-1 и MMP-13), трудно определить, когда присутствовал на низком уровне в казеин или желатин гели. Добавление гепарина к образцу во время загрузки гель значительно повышает предел обнаружения для MMP-7. Для MMP-1 и MMP-13, гепарина должна быть добавлена, чтобы гель после электрофоретического запустить уже идет 12.
С zymography меры ферментативную активность после денатурации и ренатурации ферментов, она будет измерять активность всех ММП присутствуют в образце. Они включают в себя ферменты, про-ферменты и ферменты, связанные с эндогенными ингибиторами (например, TIMP-2). Это, однако, можно определить уровень ММП активации в образец, сравнивая группы плотность активного фермента и, что про-фермента, который будет иметь немного более высоким молекулярным весом.
Zymography часто недостаточно для выявления ММП. Сравнение миграции уровня ММП с известным молекулярным весом стандарты действительно помогает в идентификации, но следует отметить, что некоторые из этих стандартов содержат восстановителем и что когда он используется в невосстанавливающих условиях они могут указывать на различные молекулярные массы 9. Опция для загрузки растворимых рекомбинантных ММП на том же геля в качестве тест-образцов. ММП, однако, может быть связан с другими белками, вызывая изменение молекулярной массы. Селективные ингибиторы MMP могут быть добавлены в гель (или его часть геля разрезать пополам) во время инкубации в развивающихся буфер фармакологических средств для личности ММП из interest.A Второй метод (Вестерн блот, иммуноцитохимия, или ИФА), рекомендуется помощь в идентификации ММП интересов. Следует отметить, что пределы обнаружения для Западной Блоты зачастую гораздо ниже, чем у zymographic гели, что может привести к ложно-отрицательных результатов при использовании этой техники.
Раскрытие информации
Благодарности
Мы хотели бы поблагодарить д-р С. Ресслер (Отдел молекулярной и клеточной биологии Медицинского колледжа Бэйлора), предложившего использовать белка концентраторы увеличить концентрацию ММП в супернатантах клеточных культур.
Этот проект был поддержан грантами от миссис Клиффорд старейшина Белый Грэм Наделенный Фонда исследований и NIH / NIAMS (AR059838) к ЦБ. Содержание несут их авторы и не обязательно отражает официальную точку зрения NIH.
Материалы
| Name | Company | Catalog Number | Comments |
| Xcell SureLock Mini-Cell CE mark electrophoresis apparatus | Invitrogen | EI0001 | |
| Power supply (model 302) | VWR international | 93000-744 | |
| Novex 10% gelatin zymogram gels, 1.0 mm, 12 wells | Invitrogen | EC61752BOX | |
| Blue Juice gel loading buffer | Invitrogen | 10816015 | |
| Gel loading tips | VWR international | 53509-015 | |
| Protein molecular weight standard | Invitrogen | LC5800 | |
| Novex Tris-Glycine-SDS running buffer | Invitrogen | LC2675 | |
| Novex zymogram renaturing buffer | Invitrogen | LC2670 | |
| Novex zymogram developing buffer | Invitrogen | LC2671 | |
| SimplyBlue SafeStain | Invitrogen | LC6060 | |
| Epson Perfection 4490 Photo Scanner | Amazon | n/a | |
| ImageJ software | http://rsbweb.nih.gov/ij/ | n/a | Authored by W. Rasband, NIH/NIMH |
Ссылки
- Luo, J. The role of matrix metalloproteinases in the morphogenesis of the cerebellar cortex. Cerebellum. 4, 239-245 (2005).
- Pasternak, B., Aspenberg, P. Metalloproteinases and their inhibitors - diagnostic and therapeutic opportunities in orthopedics. Acta Orthop. 80, 693-703 (2009).
- Kessenbrock, K., Plaks, V., Werb, Z. Matrix metalloproteinases: regulators of the tumor microenvironment. Cell. 141, 52-67 (2010).
- Lagente, V., Boichot, E. Role of matrix metallopreoteinases in the inflammatory process of respiratory diseases. J. Mol. Cell. Cardiol. 48, 440-444 (2010).
- Rodríguez, D., Morrison, C. J., Overall, C. M. Matrix metallopreoteinases: what do they not do? New substrates and biological roles identified by murine models and proteomics. Biochim. Biophys. Acta. 1803, 39-54 (2010).
- Bourboulia, D., Stetler-Stevenson, W. G. Matrix metalloproteinases (MMPs) and tissue inhibitors of metalloproteinases (TIMPs): positive and negative regulators in tumor cell adhesion. Semin. Cancer Biol. , (2010).
- Heussen, C., Dowdle, E. B. Electrophoretic analysis of plasminogen activators in polyacrylamide gels containing sodium dodecyl sulfate and copolymerized substrates. Analytical Biochem. , 102-196 (1980).
- Lombard, C., Saulnier, J., Wallach, J. Assays of matrix metalloproteinases (MMPs) activities: a review. Biochimie. 87, 265-272 (2005).
- Snoek-van Beurden, P. A., Von den Hoff, J. W. Zymographic techniques for the analysis of matrix metalloproteinases and their inhibitors. Biotechniques. 38, 73-83 (2005).
- Kupai, K., Szucs, G., Cseh, S., Hajdu, I., Csonka, C., Csont, T., Ferdinandy, P. Matrix metalloproteinase activity assays: importance of zymography. J. Pharmacol. Toxicol. Methods. 61, 205-209 (2010).
- Kleiner, D. E., Stetler-Stevenson, W. G. Quantitative zymography: detection of pictogram quantities of gelatinases. Anal. Biochem. 218, 325-329 (1994).
- Yu, W. H., Woessner, J. F. Heparin-enhanced zymographic detection of matrilysin and collagenases. Anal. Biochem. 293, 38-42 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены