Method Article
Detecção de Metaloproteinases da Matriz Funcional por zimografia
Neste Artigo
Resumo
Este protocolo descreve um ensaio baseado em atividades para a detecção de metaloproteinases de matriz em sobrenadante de cultura ou fluidos corporais.
Resumo
Metaloproteinases de matriz (MMPs) são endopeptidases contendo zinco. Eles degradam proteínas por clivagem de ligações peptídicas. Mais de vinte MMPs foram identificados e são separados em seis grupos com base em sua estrutura e especificidade de substrato (colagenases, gelatinases, tipo de membrana [MT-MMP], estromelisinas, matrilisinas, e outros). MMPs desempenham um papel crítico na invasão celular, a degradação da cartilagem, remodelação do tecido, cicatrização de feridas, e embriogênese. Eles, portanto, participar em ambos os processos normais e na patogênese de muitas doenças, como artrite reumatóide, câncer ou doença pulmonar obstrutiva crônica 1-6. Aqui, vamos nos concentrar em MMP-2 (gelatinase A, colagenase tipo IV), a MMP amplamente expressa. Vamos demonstrar como detectar MMP-2 em sobrenadante de cultura de células por zimografia, uma técnica comumente usada, simples, e ainda assim muito sensível descrita pela primeira vez em 1980 por C. Heussen e Dowdle EB 7-10. Esta técnica é semi-quantitativo, portanto pode ser usada para determinar os níveis de MMP em amostras de teste quando concentrações conhecidas de MMP recombinante são carregados no mesmo gel 11.
Soluções contendo MMPs (por exemplo, sobrenadantes de cultura de células, urina ou soro) são carregados em um gel de poliacrilamida contendo dodecil sulfato de sódio (SDS, para linearizar as proteínas) e gelatina (substrato para a MMP-2). O tampão de amostra é projetado para aumentar a viscosidade da amostra (para facilitar o carregamento gel), fornecem um corante de rastreamento (azul de bromofenol, para monitorar a migração da amostra), fornecem moléculas de desnaturação (para linearizar proteínas), e controlar o pH da amostra. Proteínas são, então, permissão para migrar sob uma corrente elétrica em um tampão de corrida projetado para fornecer uma taxa de migração constante. A distância de migração é inversamente correlacionada com o peso molecular da proteína (pequenas proteínas se movem mais rapidamente através do gel de proteínas e, portanto, fazer grandes migrar ainda mais para baixo do gel). Após a migração, o gel é colocado em um buffer renaturing para permitir que as proteínas para recuperar a sua estrutura terciária, necessárias para a atividade enzimática. O gel é então colocada em um buffer de desenvolvimento concebido para permitir a protease para digerir seu substrato. O buffer de desenvolvimento também contém p-aminophenylmercuric acetato (APMA) para ativar a não proteolíticos pró-MMPs em MMPs ativas. O próximo passo consiste em manchar o substrato (gelatina no nosso exemplo). Depois de lavar o excesso de corante fora do gel, as áreas de digestão protease aparecem como faixas claras. Quanto mais clara a banda, mais concentrada a protease que ele contém. Intensidade de coloração da banda pode ser determinada por densitometria, utilizando um software, como ImageJ, permitindo a comparação da amostra.
Protocolo
1. Carregando e executando o Gel
- Todas as amostras devem ser preparadas adequadamente para manter a função das enzimas e utilizado imediatamente após a coleta ou armazenado congelado a -80 ° C. As amostras não devem conter agentes redutores (como uma β-mercaptoetanol) ou ser fervida antes de carregá-gel.
- Abra a bolsa que contém um gel dentro de uma gaveta, lavar a cassete com água deionizada.
- Remover a fita protetora da parte inferior da cassete eo pente de cima do gel.
- Lave os poços três vezes com tampão de corrida (diluído em água deionizada 1X).
- Coloque o gel para o Mini-Cell, garantindo que o menor lado da cassete faces para dentro. Encaixado com o Wedge Tension Gel. O Mini-Cell permite executar um ou dois géis em paralelo.
- Encha a câmara (no interior) superior com 1X tampão de corrida acima do nível do poço, verificar se há vazamentos. Em caso de vazamentos, retire o tampão e reposicionar o gel.
- Encha a câmara baixa com 1X tampão de corrida.
- Carga de 10 L de marcador molecular de proteínas em um poço.
- Misture uma quantidade igual de gel de carregamento de buffer e de amostra e de carga nos poços do gel utilizando gel de carregamento de dicas (alterada entre cada amostra). Estes poços podem ser carregados com até 20 total mL.
- Coloque a tampa sobre a Célula Mini-e conecte os cabos eletrodo para o fornecimento de energia. Mudar a fonte de alimentação e configurá-lo para funcionar em 125 V constante por 90 minutos. Verificar a formação de pequenas bolhas no fio da câmara baixa, indicando a circulação atual.
- Ao executar o seu primeiro gel, monitorar o progresso da migração a cada 15 minutos, utilizando o azul de bromofenol incluído no tampão de carregamento como um indicador. Deixe a executar até que o gel corante indicador atinge o fundo do gel.
2. Renaturing e Desenvolvimento do Gel
- Para cada gel, preparar 100 ml de 1X tampão renaturing e 200 mL de tampão de desnaturação, tanto em água deionizada.
- Quando o corante azul de bromofenol rastreamento atinge o fundo do gel, mude a fonte de alimentação desligada, abrir o celular Mini-, e remover o gel. Separar os dois lados da cassete usando a faca gel (ou uma espátula de pesagem). Cortar um canto para marcar a direção do gel.
- Remova cuidadosamente o gel da gaveta e coloque em um recipiente com 100 mL de tampão renaturing. Incubar por 30 minutos em temperatura ambiente com agitação suave.
- Remova o tampão renaturing e adicionar 100 mL de buffer para o desenvolvimento de gel. Incubar por 30 minutos em temperatura ambiente com agitação suave.
- Remova o tampão desenvolvimento e adicionar mais 100 mL de tampão para o desenvolvimento de gel. Incubar overnight (16-18 horas) a 37 ° C.
- Remova o tampão desenvolvimento e lavar três vezes (5 minutos cada) com água deionizada sob agitação suave na temperatura ambiente.
- Digitalizar o gel para salvar o posicionamento exato das bandas padrão de proteínas como eles vão se tornar menos visíveis ou não após coloração do gel.
- Manchar o gel pela adição de 20 mL de SimplyBlue Safestain ao gel. Incubar durante uma hora à temperatura ambiente sob agitação suave.
- Remover o SafeStain SimplyBlue e de mancha o gel em 100 mL ou água deionizada por mais uma hora em temperatura ambiente sob agitação suave.
- Para melhores resultados, substitua com água deionizada fresco e incubar por mais uma hora ou mais à temperatura ambiente sob agitação suave.
3. Análise de Dados
- Remova cuidadosamente o gel da água e coloque em um protetor de plástico.
- Digitalizar o gel com uma resolução de 300 dpi ou superior. Salve a imagem no formato TIFF (Figura 1A).
- Medir intensidades banda com ImageJ (ou outro software similar).
- Abra o arquivo TIFF no ImageJ (Figura 1A).
- Visualize em preto e branco, selecionando "Image>> Tipo de 8 bits" (Figura 1B).
- Use a ferramenta de seleção retangular para delinear a primeira banda, desenhando um retângulo, pelo menos, duas vezes maior do que larga (este é um requisito de software).
- Pressione "1" ou selecione "Analisar> Géis> lane Selecione primeiro" ea banda serão delineadas.
- Um novo retângulo aparecerá, movê-lo para a banda e escolha a opção "Analisar> Géis> lane Select next". Repita até que todas as bandas são selecionados (Figura 1B).
- Pressione "3" ou selecione "Analisar> Géis pistas> Plot" para gerar o mapa do perfil de cada banda (Figura 1C).
- Use a seleção de linha reta (já deve estar selecionado automaticamente) para desenhar linhas de base para que o pico de interesse é uma área completamente fechado.
- Selecione a ferramenta varinha e clique dentro de cada pico para selecioná-lo.
- Selecione "Analisar> Géis picos> Label" para obter uma tabela com a área de cada pico selecionado. Estes dados podem ser plotados como tal (F1D IGURA) ou pode ser normalizada para o valor de uma banda escolhida. Esta normalização é especialmente importante quando o agrupamento de vários valores géis replicar para determinar a significância estatística dos resultados.
4. Resultados representante
Mostramos um gel com 11 poços carregado com sobrenadantes de células diferentes de cultura contendo diferentes quantidades de MMP-2 (Figura 1A). Observação direta deste gel mostra diferenças óbvias em MMP-2 concentrações entre alguns dos poços. Por exemplo, fica claro que os poços # 4 e 5 contêm muito mais MMP-2 do que bem # 11 ou até mesmo bem # 10. Para a quantificação objetivo de bandas que têm usado com o software de densitometria ImageJ (Figura 1B-D), confirmando uma diferença de cerca de 4 vezes na MMP-2 montantes entre bem # 11 e # poços 4 e 5 e uma diferença de aproximadamente 2 vezes na MMP-2 montantes entre bem # 10 e # poços 4 e 5.

Figura 1. Detecção de MMP-2 por zimografia gelatina. Uma imagem, digitalizada de um gel de gelatina. Números são bem indicado na parte superior do gel. B gel, mesmo que em um mostradas em preto e branco para a densitometria. Cada banda foi selecionada com um retângulo no ImageJ. C, dois exemplos de perfis de densitometria para o gel mostrado em A e B (bandas # 4 e # 11). Uma linha reta foi traçada na base de cada pico para criar uma área fechada. D, Lote das áreas de pico para o gel mostrado em A e B antes (esquerda) e após a normalização (direita) para a densidade da banda # 1.
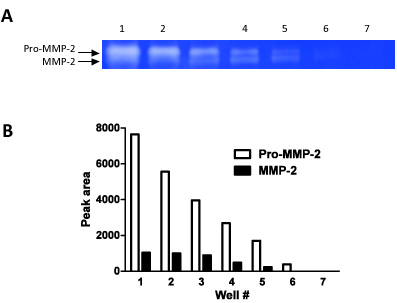
Figura 2. Esta figura demonstra como zimografia pode ser usado como uma técnica semi-quantitativa. Temos carregado diluições em série (passos de 1:1 diluições) em 7 poços consecutivos e mediram a densidade de banda para os dois pró-MMP-2 e MMP-2.
Discussão
Nós demonstramos como realizar análise zymographic de MMP-2 em sobrenadante de cultura de células.
A quantidade de amostra para carregar em um gel deve ser determinada empiricamente, dependendo da origem e MMP de interesse. Carregamento muito pouco vai impedir a detecção ao carregar demais pode levar à saturação como há substrato somente tanto uma protease pode digerir na área da banda. Se necessário, a amostra pode ser diluída em água deionizada antes da mistura com tampão de carregamento ou o tempo de desenvolvimento podem reduzido de overnight a 4 horas. Também é possível concentrar as proteínas em uma solução utilizando concentradores (por exemplo, catálogo Millipore # UFC803024). Se bandas permanecem pouco visíveis, pode ser necessário para desenvolver o gel por um longo período de tempo, até um máximo de 48 horas. Ao preparar as amostras de sobrenadantes de cultura de tecido, deve-se notar que o soro fetal bovino (e outros soros) contém MMPs que podem afetar os resultados. Por essa razão, coletamos todos os nossos sobrenadantes após cultura em meio livre de soro.
As lavagens descritos nos parágrafos 2.9 e 2.10 do protocolo são necessárias para remover o fundo de coloração de bandas digeridas. Vezes mais lavar irá remover mais fundo, mas também dim a coloração do substrato ao longo do gel. Se lavar mais vezes são necessárias, recomendamos a varredura do gel a cada poucas horas para selecionar o scan com o melhor contraste.
Esta técnica pode ser utilizada para detectar outras MMPs. Por exemplo, MMP-9 pode ser detectado em gel de gelatina, e também em menor escala MMP-1, MMP-8 e MMP-13 como a gelatina não é o seu substrato preferencial. MMP-1 e MMP-13 são melhor detectadas em zimografia colágeno, enquanto a caseína é o substrato preferido para a MMP-11 e também permite a detecção de MMP-1, MMP-3, MMP-7, MMP-12 e MMP-13 9. MMP-7 (matrilisina) e colagenases (MMP-1 e MMP-13) são difíceis de detectar quando presente em níveis baixos em caseína ou géis de gelatina. Adição de heparina ao exemplo em tempo de carregamento gel melhora significativamente o limite de detecção para MMP-7. Para MMP-1 e MMP-13, a heparina deve ser adicionado ao gel após a corrida eletroforética já está em andamento 12.
Desde zimografia medidas atividade enzimática após desnaturação e renaturação das enzimas, ele irá medir a atividade de todas as MMPs presentes na amostra. Isto inclui as enzimas, pró-enzimas, enzimas e obrigado a inibidores endógenos (por exemplo, TIMP-2). No entanto, é possível determinar o nível de ativação MMP na amostra, comparando a densidade da banda da enzima ativa e do da pró-enzima, que terá um peso molecular um pouco maior.
Zimografia muitas vezes não é suficiente para identificar uma MMP. Comparação do nível de migração de uma MMP com conhecidos padrões de peso molecular não ajuda na identificação, mas deve-se notar que algumas dessas normas contêm um agente redutor e que, quando usado sob condições não-redução que pode indicar diferentes pesos moleculares 9. Uma opção é carregar um MMP solúvel recombinante no mesmo gel que as amostras de teste. MMPs pode, contudo, ser associado com outras proteínas, induzindo uma mudança no peso molecular aparente. Inibidores seletivos MMP pode ser adicionado ao gel (ou parte de um corte pela metade gel) durante a incubação em tampão desenvolvimento como ferramentas farmacológicas para a identidade do MMP de interest.A segunda técnica (Western Blot, imunocitoquímica, ou ELISA) é recomendada para ajudar na identificação da MMP de interesse. Note-se que os limites de detecção para Western Blot são frequentemente muito inferiores aos dos géis zymographic, podendo levar a resultados falso-negativos quando se usa esta técnica.
Divulgações
Agradecimentos
Gostaríamos de agradecer ao Dr. S. Ressler (Departamento de Biologia Molecular e Celular, Baylor College of Medicine) para sugerir o uso de proteína concentradores para aumentar a concentração de MMPs em sobrenadante de cultura de células.
Este projeto foi suportado por concessões do Elder Clifford Sra. White Graham Fundo de Investigação Dotado eo NIAMS NIH / (AR059838) para CB. O conteúdo é da exclusiva responsabilidade dos autores e não representam, necessariamente, a posição oficial do NIH.
Materiais
| Name | Company | Catalog Number | Comments |
| Xcell SureLock Mini-Cell CE mark electrophoresis apparatus | Invitrogen | EI0001 | |
| Power supply (model 302) | VWR international | 93000-744 | |
| Novex 10% gelatin zymogram gels, 1.0 mm, 12 wells | Invitrogen | EC61752BOX | |
| Blue Juice gel loading buffer | Invitrogen | 10816015 | |
| Gel loading tips | VWR international | 53509-015 | |
| Protein molecular weight standard | Invitrogen | LC5800 | |
| Novex Tris-Glycine-SDS running buffer | Invitrogen | LC2675 | |
| Novex zymogram renaturing buffer | Invitrogen | LC2670 | |
| Novex zymogram developing buffer | Invitrogen | LC2671 | |
| SimplyBlue SafeStain | Invitrogen | LC6060 | |
| Epson Perfection 4490 Photo Scanner | Amazon | n/a | |
| ImageJ software | http://rsbweb.nih.gov/ij/ | n/a | Authored by W. Rasband, NIH/NIMH |
Referências
- Luo, J. The role of matrix metalloproteinases in the morphogenesis of the cerebellar cortex. Cerebellum. 4, 239-245 (2005).
- Pasternak, B., Aspenberg, P. Metalloproteinases and their inhibitors - diagnostic and therapeutic opportunities in orthopedics. Acta Orthop. 80, 693-703 (2009).
- Kessenbrock, K., Plaks, V., Werb, Z. Matrix metalloproteinases: regulators of the tumor microenvironment. Cell. 141, 52-67 (2010).
- Lagente, V., Boichot, E. Role of matrix metallopreoteinases in the inflammatory process of respiratory diseases. J. Mol. Cell. Cardiol. 48, 440-444 (2010).
- Rodríguez, D., Morrison, C. J., Overall, C. M. Matrix metallopreoteinases: what do they not do? New substrates and biological roles identified by murine models and proteomics. Biochim. Biophys. Acta. 1803, 39-54 (2010).
- Bourboulia, D., Stetler-Stevenson, W. G. Matrix metalloproteinases (MMPs) and tissue inhibitors of metalloproteinases (TIMPs): positive and negative regulators in tumor cell adhesion. Semin. Cancer Biol. , (2010).
- Heussen, C., Dowdle, E. B. Electrophoretic analysis of plasminogen activators in polyacrylamide gels containing sodium dodecyl sulfate and copolymerized substrates. Analytical Biochem. , 102-196 (1980).
- Lombard, C., Saulnier, J., Wallach, J. Assays of matrix metalloproteinases (MMPs) activities: a review. Biochimie. 87, 265-272 (2005).
- Snoek-van Beurden, P. A., Von den Hoff, J. W. Zymographic techniques for the analysis of matrix metalloproteinases and their inhibitors. Biotechniques. 38, 73-83 (2005).
- Kupai, K., Szucs, G., Cseh, S., Hajdu, I., Csonka, C., Csont, T., Ferdinandy, P. Matrix metalloproteinase activity assays: importance of zymography. J. Pharmacol. Toxicol. Methods. 61, 205-209 (2010).
- Kleiner, D. E., Stetler-Stevenson, W. G. Quantitative zymography: detection of pictogram quantities of gelatinases. Anal. Biochem. 218, 325-329 (1994).
- Yu, W. H., Woessner, J. F. Heparin-enhanced zymographic detection of matrilysin and collagenases. Anal. Biochem. 293, 38-42 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados